Xalatan 2.5ml Latanoprost Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
XALATAN® (latanoprost) Oftalmisk løsning
BESKRIVELSE
Latanoprost er en prostaglandin F2α-analog. Dets kjemiske navn er isopropyl-(Z)-7[(1R,2R,3R,5S)3,5dihydroksy-2-[(3R)-3-hydroksy-5-fenylpentyl]cyklopentyl]-5-heptenoat. Dens molekylformel er C26H40O5 og dens kjemiske struktur er:
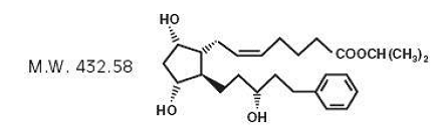
Latanoprost er en fargeløs til svakt gul olje som er svært løselig i acetonitril og fritt løselig i aceton, etanol, etylacetat, isopropanol, metanol og oktanol. Det er praktisk talt uløselig i vann.
XALATAN (latanoprost oftalmisk løsning) 0,005 % leveres som en steril, isotonisk, bufret vandig løsning av latanoprost med en pH på ca. 6,7 og en osmolalitet på ca. 267 mOsmol/kg. Hver ml XALATAN inneholder 50 mcg latanoprost. Benzalkoniumklorid, 0,02 % tilsettes som konserveringsmiddel. De inaktive ingrediensene er: natriumklorid, natriumdihydrogenfosfatmonohydrat, vannfri dinatriumhydrogenfosfat og vann til injeksjonsvæsker. En dråpe inneholder ca. 1,5 mcg latanoprost.
INDIKASJONER
XALATAN 2,5 ml er indisert for reduksjon av forhøyet intraokulært trykk hos pasienter med åpenvinklet glaukom eller okulær hypertensjon.
DOSERING OG ADMINISTRASJON
Anbefalt dosering er én dråpe i det/de berørte øyet en gang daglig om kvelden. Hvis en dose glemmes, bør behandlingen fortsette med neste dose som normalt.
Doseringen av XALATAN bør ikke overstige én gang daglig; kombinert bruk av to eller flere prostaglandiner, eller prostaglandinanaloger inkludert XALATAN 2,5 ml anbefales ikke. Det er vist at administrering av disse prostaglandinproduktene mer enn én gang daglig kan redusere den intraokulære trykksenkende effekten eller forårsake paradoksale økninger i IOP.
Reduksjon av IOP starter ca. 3 til 4 timer etter administrering og maksimal effekt oppnås etter 8 til 12 timer.
XALATAN kan brukes samtidig med andre topikale oftalmiske legemidler for å senke IOP. Hvis mer enn ett lokalt oftalmisk legemiddel brukes, bør legemidlene administreres med minst fem (5) minutters mellomrom. Kontaktlinser bør fjernes før administrering av XALATAN 2,5 ml, og kan settes inn igjen 15 minutter etter administrering
HVORDAN LEVERES
Doseringsformer og styrker
Steril oftalmisk oppløsning som inneholder 50 mcg/ml latanoprost.
Oppbevaring og håndtering
XALATAN er en klar, isotonisk, bufret, konservert fargeløs løsning av latanoprost 0,005 % (50 mcg/ml). Den leveres som en 2,5 mL løsning i en 5 mL klar polyetylenflaske med en klar dråpespiss av polyetylen, en turkis skrukork av polyetylen med høy tetthet og en manipulasjonssikker, gjennomsiktig lokk av polyetylen med lav tetthet.
2,5 mL fyll, 0,005 % (50 mcg/ml): Pakke med 1 flaske: NDC 0013-8303-04 2,5 mL fyll, 0,005 % (50 mcg/mL): Multipakning med 3 flasker: NDC 0013-8303-01
Oppbevaring
Beskytt mot lys. Oppbevar uåpnet(e) flaske(r) under kjøling ved 2° til 8°C (36° til 46°F). Under forsendelse til pasienten kan flasken holdes ved temperaturer opp til 40°C (104°F) i en periode på ikke over 8 dager. Når en flaske er åpnet for bruk, kan den oppbevares i romtemperatur opp til 25 °C (77 °F) i 6 uker.
Distribuert av: Pharmacia & Upjohn Co., Division of Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, Belgia. Revidert: n/a
BIVIRKNINGER
Følgende bivirkninger ble rapportert etter markedsføring og er omtalt mer detaljert i andre deler av etiketten:
- . Iris pigmentering endringer [se ADVARSLER OG FORHOLDSREGLER ] . Mørkere hud på øyelokket [se ADVARSLER OG FORHOLDSREGLER ] . Øyenvippeforandringer (økt lengde, tykkelse, pigmentering og antall vipper) [se ADVARSLER OG FORHOLDSREGLER ] . Intraokulær betennelse (iritt/uveitt) [se ADVARSLER OG FORHOLDSREGLER ] . Makulaødem, inkludert cystoid makulaødem [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsratene observert i de kliniske studiene av et legemiddel ikke sammenlignes direkte med ratene i kliniske studier av et annet legemiddel, og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
XALATAN 2,5 ml ble studert i tre multisenter, randomiserte, kontrollerte kliniske studier. Pasientene fikk 50 mcg/ml XALATAN én gang daglig eller 5 mg/ml aktiv komparator (timolol) to ganger daglig. Pasientpopulasjonen som ble studert hadde en gjennomsnittsalder på 65±10 år. Syv prosent av pasientene trakk seg før 6-måneders endepunkt.
Mindre enn 1 % av pasientene behandlet med XALATAN 2,5 ml krevde seponering av behandlingen på grunn av intoleranse mot konjunktival hyperemi.
Den okulære hendelsen/tegnene og symptomene på blefaritt har blitt identifisert som "vanlig observert" gjennom analyse av data fra kliniske studier.
Postmarketing-erfaring
Følgende reaksjoner er identifisert under bruk av XALATAN etter markedsføring i klinisk praksis. Fordi de rapporteres frivillig fra en populasjon av ukjent størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng til medikamenteksponering. Reaksjonene, som er valgt for inkludering enten på grunn av alvorlighetsgrad, rapporteringsfrekvens, mulig årsakssammenheng til XALATAN 2,5 ml, eller en kombinasjon av disse faktorene, inkluderer:
Forstyrrelser i nervesystemet: Svimmelhet; hodepine; giftig epidermal nekrolyse
Øyelidelser: Øyevippe- og vellushårendringer i øyelokket (økt lengde, tykkelse, pigmentering og antall øyevipper); keratitt; hornhinneødem og erosjoner; intraokulær betennelse (iritt/uveitt); makulaødem, inkludert cystoid makulaødem; trichiasis; periorbitale og lokkforandringer som resulterer i utdyping av øyelokkets sulcus; iriscyste; mørkere øyelokkshud; lokalisert hudreaksjon på øyelokkene; konjunktivitt; pseudopemfigoid av den okulære konjunktiva
Respiratoriske, thorax- og mediastinumsykdommer: Astma og forverring av astma; dyspné
Hud- og subkutane vevslidelser: Kløe
Infeksjoner og angrep: Herpes keratitt
Hjertelidelser: angina; hjertebank; angina ustabil
Generelle lidelser og administrasjonsbetingelser: Brystsmerter
NARKOTIKAHANDEL
In vitro-studier har vist at nedbør oppstår når øyedråper som inneholder timerosal blandes med XALATAN. Hvis slike legemidler brukes, bør de administreres med minst fem (5) minutters mellomrom.
Kombinert bruk av to eller flere prostaglandiner, eller prostaglandinanaloger inkludert XALATAN 2,5 ml anbefales ikke. Det har vist seg at administrering av disse prostaglandinproduktene mer enn én gang daglig kan redusere den IOP-senkende effekten eller forårsake paradoksale økninger i IOP.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Pigmentering
XALATAN er rapportert å forårsake endringer i pigmentert vev. De hyppigst rapporterte endringene har vært økt pigmentering av iris, periorbitalt vev (øyelokk) og øyevipper. Pigmentering forventes å øke så lenge latanoprost administreres.
Pigmenteringsendringen skyldes økt melanininnhold i melanocyttene snarere enn en økning i antall melanocytter. Etter seponering av latanoprost vil pigmentering av iris sannsynligvis være permanent, mens pigmentering av periorbitalvev og øyevippeforandringer er rapportert å være reversible hos noen pasienter. Pasienter som får behandling bør informeres om muligheten for økt pigmentering. Etter 5 år er effekten av økt pigmentering ikke kjent [se Kliniske studier ].
Irisfargeendring kan ikke være merkbar på flere måneder til år. Vanligvis sprer den brune pigmenteringen rundt pupillen seg konsentrisk mot periferien av iris og hele iris eller deler av iris blir mer brunaktig. Verken nevi eller fregner i iris ser ut til å være påvirket av behandlingen. Mens behandling med XALATAN 2,5 ml kan fortsettes hos pasienter som utvikler merkbart økt irispigmentering, bør disse pasientene undersøkes regelmessig [se PASIENTINFORMASJON ].
Øyevippeforandringer
XALATAN 2,5 ml kan gradvis endre øyevipper og vellushår i det behandlede øyet; disse endringene inkluderer økt lengde, tykkelse, pigmentering, antall vipper eller hår, og feilrettet vekst av øyevipper. Vippeforandringer er vanligvis reversible ved seponering av behandlingen [se PASIENTINFORMASJON ].
Intraokulær betennelse
XALATAN 2,5 ml bør brukes med forsiktighet hos pasienter med en historie med intraokulær betennelse (iritt/uveitt) og bør generelt ikke brukes til pasienter med aktiv intraokulær betennelse fordi betennelsen kan forverres.
Makulaødem
Makulaødem, inkludert cystoid makulaødem, er rapportert under behandling med XALATAN. XALATAN 2,5 ml bør brukes med forsiktighet hos afake pasienter, hos pseudofake pasienter med en avrevet bakre linsekapsel, eller hos pasienter med kjente risikofaktorer for makulaødem.
Herpetisk keratitt
Reaktivering av Herpes Simplex keratitt er rapportert under behandling med XALATAN. XALATAN 2,5 ml bør brukes med forsiktighet hos pasienter med en historie med herpetisk keratitt. XALATAN 2,5 ml bør unngås ved aktiv herpes simplex keratitt fordi betennelse kan forverres.
Bakteriell keratitt
Det har vært rapporter om bakteriell keratitt assosiert med bruk av flerdosebeholdere med aktuelle oftalmiske produkter. Disse beholderne var utilsiktet blitt kontaminert av pasienter som i de fleste tilfeller hadde en samtidig hornhinnesykdom eller en forstyrrelse av den okulære epiteloverflaten [se PASIENTINFORMASJON ].
Bruk med kontaktlinser
Kontaktlinser bør fjernes før administrering av XALATAN, og kan settes inn igjen 15 minutter etter administrering.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Latanoprost var ikke kreftfremkallende hos verken mus eller rotter når det ble administrert ved oral sonde i doser på opptil 170 mcg/kg/dag (omtrent 2800 ganger anbefalt maksimal dose til mennesker) i henholdsvis opptil 20 og 24 måneder.
Latanoprost var ikke mutagent i bakterier, i muselymfom eller i mikronukleustester hos mus. Kromosomavvik ble observert in vitro med humane lymfocytter. Ytterligere in vitro- og in vivo-studier på ikke-planlagt DNA-syntese hos rotter var negative.
Latanoprost har ikke vist seg å ha noen effekt på mannlig eller kvinnelig fertilitet i dyrestudier.
Bruk i spesifikke populasjoner
Svangerskap
Teratogene effekter
Graviditetskategori C.
Reproduksjonsstudier er utført på rotter og kaniner. Hos kaniner hadde en forekomst på 4 av 16 mor ingen levedyktige fostre ved en dose som var omtrent 80 ganger den maksimale humane dosen, og den høyeste ikke-embryocidale dosen hos kaniner var omtrent 15 ganger den maksimale humane dosen.
Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. XALATAN 2,5 ml skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Ammende mødre
Det er ikke kjent om dette legemidlet eller dets metabolitter skilles ut i morsmelk. Fordi mange legemidler skilles ut i morsmelk, bør det utvises forsiktighet når XALATAN 2,5 ml gis til en ammende kvinne.
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Ingen generelle forskjeller i sikkerhet eller effektivitet er observert mellom eldre og yngre pasienter.
OVERDOSE
Intravenøs infusjon på opptil 3 mcg/kg hos friske frivillige ga gjennomsnittlige plasmakonsentrasjoner 200 ganger høyere enn under klinisk behandling, og ingen bivirkninger ble observert. Intravenøse doser på 5,5 til 10 mcg/kg forårsaket magesmerter, svimmelhet, tretthet, hetetokter, kvalme og svette. Hvis overdosering med XALATAN oppstår, bør behandlingen være symptomatisk.
KONTRAINDIKASJONER
Kjent overfølsomhet overfor latanoprost, benzalkoniumklorid eller andre ingredienser i dette produktet.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Latanoprost er en prostanoid-selektiv FP-reseptoragonist som antas å redusere det intraokulære trykket (IOP) ved å øke utstrømningen av kammervann. Studier på dyr og mennesker tyder på at den viktigste virkningsmekanismen er økt uveoskleral utstrømning. Forhøyet IOP representerer en viktig risikofaktor for tap av glaukom. Jo høyere nivå av IOP, desto større er sannsynligheten for skade på synsnerven og tap av synsfelt.
Farmakodynamikk
Reduksjon av IOP hos mennesker starter ca. 3-4 timer etter administrering og maksimal effekt oppnås etter 8-12 timer. IOP-reduksjon er tilstede i minst 24 timer.
Farmakokinetikk
Absorpsjon
Latanoprost absorberes gjennom hornhinnen hvor isopropylesterprodrug hydrolyseres til syreform for å bli biologisk aktiv.
Fordeling
Distribusjonsvolumet hos mennesker er 0,16 ± 0,02 L/kg. Syren til latanoprost kan måles i kammervann i løpet av de første 4 timene, og i plasma kun i løpet av den første timen etter lokal administrering. Studier på mennesker indikerer at toppkonsentrasjonen i kammervæsken nås ca. to timer etter topisk administrering.
Metabolisme
Latanoprost, et isopropylester-prodrug, hydrolyseres av esteraser i hornhinnen til den biologisk aktive syren. Den aktive syren i latanoprost som når den systemiske sirkulasjonen, metaboliseres primært av leveren til 1,2-dinor- og 1,2,3,4-tetranor-metabolittene via fettsyre-β-oksidasjon.
Utskillelse
Eliminasjonen av syren i latanoprost fra humant plasma er rask (t½ = 17 min) etter både intravenøs og topisk administrering. Systemisk clearance er ca. 7 ml/min/kg. Etter hepatisk β-oksidasjon elimineres metabolittene hovedsakelig via nyrene. Omtrent 88 % og 98 % av den administrerte dosen gjenfinnes i urinen etter henholdsvis topikal og intravenøs dosering.
Kliniske studier
Forhøyet baseline IOP
Pasienter med gjennomsnittlig baseline IOP på 24 - 25 mmHg som ble behandlet i 6 måneder i multisenter, randomiserte, kontrollerte studier viste 6 - 8 mmHg reduksjoner i IOP. Denne IOP-reduksjonen med XALATAN 0,005 % dosert én gang daglig var ekvivalent med effekten av timolol 0,5 % dosert to ganger daglig.
Progresjon av økt irispigmentering
En 3-årig åpen, prospektiv sikkerhetsstudie med en 2-årig forlengelsesfase ble utført for å evaluere progresjonen av økt irispigmentering med kontinuerlig bruk av XALATAN én gang daglig som tilleggsbehandling hos 519 pasienter med åpenvinklet glaukom. Analysen var basert på observerte tilfeller av 380 pasienter som fortsatte i forlengelsesfasen.
Resultatene viste at utbruddet av merkbar økt irispigmentering skjedde i løpet av det første behandlingsåret for flertallet av pasientene som utviklet merkbart økt irispigmentering. Pasientene fortsatte å vise tegn på økende irispigmentering gjennom de fem årene studien varte. Observasjon av økt irispigmentering påvirket ikke forekomsten, arten eller alvorlighetsgraden av uønskede hendelser (annet enn økt irispigmentering) registrert i studien. IOP-reduksjonen var lik uavhengig av utviklingen av økt irispigmentering under studien.
PASIENTINFORMASJON
Potensial for pigmentering
Gi pasienter råd om potensialet for økt brun pigmentering av iris, som kan være permanent. Informer pasientene om muligheten for mørkere øyelokkshud, som kan være reversibel etter seponering av XALATAN [se ADVARSLER OG FORHOLDSREGLER ].
Potensial for øyevippeforandringer
Informer pasientene om muligheten for forandringer på øyevipper og vellushår i det behandlede øyet under behandling med XALATAN. Disse endringene kan resultere i ulikhet mellom øynene i lengde, tykkelse, pigmentering, antall øyevipper eller vellushår og/eller vekstretningen for øyenvippene. Vippeforandringer er vanligvis reversible ved seponering av behandlingen.
Håndtering av beholderen
Instruer pasienter om å unngå å la tuppen av dispenseringsbeholderen komme i kontakt med øyet eller omkringliggende strukturer fordi dette kan føre til at tuppen blir kontaminert av vanlige bakterier som er kjent for å forårsake øyeinfeksjoner. Alvorlig skade på øyet og påfølgende tap av synet kan oppstå ved bruk av kontaminerte løsninger [se ADVARSLER OG FORHOLDSREGLER ].
Når bør du søke legeråd
Informer pasienter om at hvis de utvikler en interkurrent øyelidelse (f.eks. traumer eller infeksjon) eller har okulær kirurgi, eller utvikler øyereaksjoner, spesielt konjunktivitt og øyelokkreaksjoner, bør de umiddelbart søke råd fra legen om fortsatt bruk av flerdosen. container.
Bruk med kontaktlinser
Informer pasienter om at XALATAN 2,5 ml inneholder benzalkoniumklorid, som kan absorberes av kontaktlinser. Kontaktlinser bør fjernes før administrering av løsningen. Linser kan settes inn igjen 15 minutter etter administrering av XALATAN.
Bruk sammen med andre oftalmologiske legemidler
Hvis mer enn ett lokalt oftalmisk legemiddel brukes, bør legemidlene administreres med minst fem (5) minutters mellomrom.
