Medisin mot hårtap: Avodart 0.5mg Dutasteride Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Avodart 0,5 mg og hvordan brukes det?
Avodart 0,5 mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på en forstørret prostata (godartet prostatahyperplasi). Avodart kan brukes alene eller sammen med andre medisiner.
Avodart 0,5 mg tilhører en klasse medikamenter som kalles 5-alfa-reduktasehemmere.
Det er ikke kjent om Avodart 0,5 mg er trygt og effektivt hos barn.
Hva er bivirkninger av Avodart?
Bivirkninger av Avodart 0,5 mg inkluderer:
- . utslett, . pustevansker, . hevelse i ansiktet eller halsen, . feber, . sår hals, . brennende øyne, . hudsmerter, og . rødt eller lilla hudutslett med blemmer og avskalling
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Avodart 0,5 mg inkluderer:
- . redusert libido (sexlyst), . redusert mengde sæd som frigjøres under sex, . impotens (problemer med å få eller beholde ereksjon), og . ømhet eller forstørrelse av brystene
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Avodart. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
AVODART 0,5 mg er en syntetisk 4-azasteroidforbindelse som er en selektiv hemmer av både type 1 og type 2 isoformene av steroid 5 alfa-reduktase, et intracellulært enzym som omdanner testosteron til DHT.
Dutasterid er kjemisk betegnet som (5α,17β)-N-{2,5 bis(trifluormetyl)fenyl}-3-okso-4-azaandrost-1-en-17-karboksamid. Den empiriske formelen til dutasterid er C27H30F6N2O2, som representerer en molekylvekt på 528,5 med følgende strukturformel:
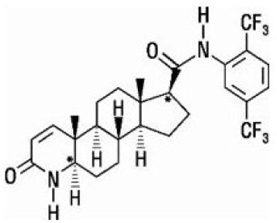
Dutasterid er et hvitt til blekgult pulver med et smeltepunkt på 242° til 250°C. Det er løselig i etanol (44 mg/ml), metanol (64 mg/ml) og polyetylenglykol 400 (3 mg/ml), men det er uløselig i vann.
Hver AVODART 0,5 mg myk gelatinkapsel, administrert oralt, inneholder 0,5 mg dutasterid oppløst i en blanding av mono-di-glyserider av kapryl/kaprinsyre og butylert hydroksytoluen. De inaktive hjelpestoffene i kapselskallet er jernoksid (gult), gelatin (fra sertifiserte BSE-frie storfekilder), glyserin og titandioksid. De myke gelatinkapslene er trykket med spiselig rødt blekk.
INDIKASJONER
Monoterapi
AVODART (dutasterid) myke gelatinkapsler er indisert for behandling av symptomatisk benign prostatahyperplasi (BPH) hos menn med forstørret prostata til:
- . forbedre symptomene, . redusere risikoen for akutt urinretensjon (AUR), og . redusere risikoen for behov for BPH-relatert kirurgi.
Kombinasjon med alfa-adrenerg antagonist
AVODART i kombinasjon med den alfa-adrenerge antagonisten, tamsulosin, er indisert for behandling av symptomatisk BPH hos menn med forstørret prostata.
Bruksbegrensninger
AVODART 0,5 mg er ikke godkjent for forebygging av prostatakreft.
DOSERING OG ADMINISTRASJON
Kapslene skal svelges hele og ikke tygges eller åpnes, da kontakt med kapselinnholdet kan føre til irritasjon av slimhinnen i munnhulen. AVODART kan administreres med eller uten mat.
Monoterapi
Den anbefalte dosen av AVODART er 1 kapsel (0,5 mg) tatt én gang daglig.
Kombinasjon med alfa-adrenerg antagonist
Den anbefalte dosen av AVODART 0,5 mg er 1 kapsel (0,5 mg) tatt én gang daglig og tamsulosin 0,4 mg én gang daglig.
HVORDAN LEVERES
Doseringsformer og styrker
0,5 mg, ugjennomsiktige, matt gule, gelatinkapsler merket med "GX CE2" i rødt blekk på den ene siden.
Oppbevaring og håndtering
AVODART myke gelatinkapsler 0,5 mg er avlange, ugjennomsiktige, matt gule, gelatinkapsler merket med "GX CE2" med rødt spiselig blekk på den ene siden, pakket i flasker med 30 stk. NDC 0173-0712-15) og 90 ( NDC 0173-0712-04) med barnesikre lukkinger.
Oppbevares ved 25°C (77°F); utflukter tillatt til 15° til 30°C (59° til 86°F) [se USP kontrollert romtemperatur ].
Dutasterid absorberes gjennom huden. AVODART 0,5 mg kapsler skal ikke håndteres av kvinner som er gravide eller som kan bli gravide på grunn av muligheten for absorpsjon av dutasterid og den påfølgende potensielle risikoen for et mannlig foster i utvikling [se ADVARSLER OG FORHOLDSREGLER ].
Produsert for: GlaxoSmithKline Research Triangle Park. Revidert: januar 2020
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Fra kliniske studier med AVODART 0,5 mg som monoterapi eller i kombinasjon med tamsulosin:
- . De vanligste bivirkningene rapportert hos personer som fikk AVODART 0,5 mg var impotens, redusert libido, brystsykdommer (inkludert brystforstørrelse og ømhet) og ejakulasjonsforstyrrelser. De vanligste bivirkningene rapportert hos personer som fikk kombinasjonsbehandling (AVODART 0,5 mg pluss tamsulosin) var impotens, nedsatt libido, brystsykdommer (inkludert brystforstørrelse og ømhet), ejakulasjonsforstyrrelser og svimmelhet. Ejakulasjonsforstyrrelser forekom signifikant mer hos personer som fikk kombinasjonsbehandling (11 %) sammenlignet med de som fikk AVODART (2 %) eller tamsulosin (4 %) som monoterapi. . Uttak av forsøk på grunn av bivirkninger forekom hos 4 % av pasientene som fikk AVODART 0,5 mg og 3 % av forsøkspersonene som fikk placebo i placebokontrollerte studier med AVODART. Den vanligste bivirkningen som førte til seponering av forsøk var impotens (1 %). . den kliniske studien som evaluerte kombinasjonsterapien, skjedde seponering på grunn av bivirkninger hos 6 % av pasientene som fikk kombinasjonsbehandling (AVODART pluss tamsulosin) og 4 % av pasientene som fikk AVODART 0,5 mg eller tamsulosin som monoterapi. Den vanligste bivirkningen i alle behandlingsarmer som førte til seponering av forsøk var erektil dysfunksjon (1 % til 1,5 %).
Monoterapi
Over 4 300 mannlige forsøkspersoner med BPH ble tilfeldig tildelt placebo eller 0,5 mg daglige doser av AVODART i 3 identiske 2-årige, placebokontrollerte, dobbeltblinde, fase 3-behandlingsstudier, hver etterfulgt av en 2-årig åpen etikett. Utvidelse. I løpet av den dobbeltblinde behandlingsperioden ble 2 167 mannlige forsøkspersoner eksponert for AVODART 0,5 mg, inkludert 1 772 eksponert i 1 år og 1 510 eksponert i 2 år. Når de åpne utvidelsene ble inkludert, ble 1 009 mannlige forsøkspersoner eksponert for AVODART 0,5 mg i 3 år og 812 ble eksponert i 4 år. Befolkningen var i alderen 47 til 94 år (gjennomsnittsalder: 66 år) og mer enn 90% var hvite. Tabell 1 oppsummerer kliniske bivirkninger rapportert hos minst 1 % av pasientene som fikk AVODART og med en høyere forekomst enn personer som fikk placebo.
Langtidsbehandling (opptil 4 år)
Høygradig prostatakreft
REDUCE-studien var en randomisert, dobbeltblind, placebokontrollert studie som inkluderte 8 231 menn i alderen 50 til 75 år med en serum-PSA på 2,5 ng/ml til 10 ng/ml og en negativ prostatabiopsi i løpet av de siste 6 månedene. Forsøkspersonene ble randomisert til å få placebo (n = 4 126) eller 0,5 mg daglige doser av AVODART (n = 4 105) i opptil 4 år. Gjennomsnittsalderen var 63 år og 91 % var hvite. Forsøkspersonene gjennomgikk protokollpålagte planlagte prostatabiopsier ved 2 og 4 års behandling eller hadde "for-årsak-biopsier" på ikke-planlagte tidspunkter hvis det var klinisk indisert. Det var en høyere forekomst av Gleason score 8-10 prostatakreft hos menn som fikk AVODART (1,0 %) sammenlignet med menn på placebo (0,5 %) [se INDIKASJONER OG BRUK , ADVARSLER OG FORHOLDSREGLER ]. I en 7-årig placebokontrollert klinisk studie med en annen 5 alfa-reduktasehemmer (finasterid 5 mg, PROSCAR), ble lignende resultater for Gleason score 8-10 observert prostatakreft (finasterid 1,8 % versus placebo 1,1 %).
Ingen klinisk fordel er vist hos pasienter med prostatakreft behandlet med AVODART.
Reproduktive og brystsykdommer
I de 3 pivotale placebokontrollerte BPH-studiene med AVODART 0,5 mg, hvert 4. år, var det ingen tegn på økte seksuelle bivirkninger (impotens, redusert libido og ejakulasjonsforstyrrelser) eller brystsykdommer med økt behandlingsvarighet. Blant disse 3 studiene var det 1 tilfelle av brystkreft i dutasteridgruppen og 1 tilfelle i placebogruppen. Ingen tilfeller av brystkreft ble rapportert i noen behandlingsgruppe i den 4-årige CombAT-studien eller den 4-årige REDUCE-studien.
Forholdet mellom langvarig bruk av dutasterid og mannlig brystneoplasi er foreløpig ukjent.
Kombinasjon med alfablokkerterapi (CombAT)
Over 4800 mannlige forsøkspersoner med BPH ble tilfeldig tildelt 0,5 mg AVODART 0,5 mg, 0,4 mg tamsulosin eller kombinasjonsbehandling (0,5 mg AVODART pluss 0,4 mg tamsulosin) administrert én gang daglig i en 4-årig dobbeltblind studie. Totalt fikk 1623 personer monoterapi med AVODART; 1 611 personer fikk monoterapi med tamsulosin; og 1610 personer fikk kombinasjonsbehandling. Befolkningen var i alderen 49 til 88 år (gjennomsnittsalder: 66 år) og 88% var hvite. Tabell 2 oppsummerer bivirkninger rapportert hos minst 1 % av pasientene i kombinasjonsgruppen og med en høyere forekomst enn pasienter som får monoterapi med AVODART 0,5 mg eller tamsulosin.
Hjertesvikt
CombAT, etter 4 års behandling, var forekomsten av den sammensatte termen hjertesvikt i kombinasjonsterapigruppen (12/1 610; 0,7 %) høyere enn i begge monoterapigruppene: AVODART 0,5 mg, 2/1 623 (0,1 %) og tamsulosin, 9/1611 (0,6%). Sammensatt hjertesvikt ble også undersøkt i en separat 4-årig placebokontrollert studie som evaluerte AVODART hos menn med risiko for utvikling av prostatakreft. Forekomsten av hjertesvikt hos personer som tok AVODART 0,5 mg var 0,6 % (26/4 105) sammenlignet med 0,4 % (15/4 126) hos personer på placebo. Et flertall av personer med hjertesvikt i begge studiene hadde komorbiditeter assosiert med økt risiko for hjertesvikt. Derfor er den kliniske betydningen av de numeriske ubalansene ved hjertesvikt ukjent. Det er ikke etablert noen årsakssammenheng mellom AVODART alene eller i kombinasjon med tamsulosin og hjertesvikt. Ingen ubalanse ble observert i forekomsten av generelle kardiovaskulære bivirkninger i noen av studiene.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av AVODART etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering. Disse reaksjonene er valgt for inkludering på grunn av en kombinasjon av alvorlighetsgrad, rapporteringsfrekvens eller potensiell årsakssammenheng til AVODART.
Forstyrrelser i immunsystemet
Overfølsomhetsreaksjoner, inkludert utslett, pruritus, urticaria, lokalisert ødem, alvorlige hudreaksjoner og angioødem.
Neoplasmer
Mannlig brystkreft.
Psykiatriske lidelser
Deprimert humør.
Reproduktive system og brystsykdommer
Testikkelsmerter og testikkelhevelse.
NARKOTIKAHANDEL
Cytokrom P450 3A-hemmere
Dutasterid metaboliseres i stor grad hos mennesker av isoenzymene cytokrom P450 (CYP)3A4 og CYP3A5. Effekten av potente CYP3A4-hemmere på dutasterid er ikke studert. På grunn av potensialet for legemiddelinteraksjoner, utvis forsiktighet når du forskriver AVODART til pasienter som tar potente, kroniske CYP3A4-enzymhemmere (f.eks. ritonavir) [se KLINISK FARMAKOLOGI ].
Alfa-adrenerge antagonister
Administrering av AVODART i kombinasjon med tamsulosin eller terazosin har ingen effekt på steady-state farmakokinetikken til noen av alfa-adrenerge antagonister. Effekten av administrering av tamsulosin eller terazosin på dutasterids farmakokinetiske parametere er ikke evaluert.
Kalsiumkanalantagonister
Samtidig administrering av verapamil eller diltiazem reduserer dutasteridclearance og fører til økt eksponering for dutasterid. Endringen i dutasterideksponering anses ikke å være klinisk signifikant. Ingen dosejustering anbefales [se KLINISK FARMAKOLOGI ].
Kolestyramin
Administrering av en enkelt dose på 5 mg AVODART 0,5 mg fulgt 1 time senere av 12 g kolestyramin påvirker ikke den relative biotilgjengeligheten av dutasterid [se KLINISK FARMAKOLOGI ].
Digoksin
AVODART 0,5 mg endrer ikke steady-state farmakokinetikken til digoksin når det administreres samtidig i en dose på 0,5 mg/dag i 3 uker [se KLINISK FARMAKOLOGI ].
Warfarin
Samtidig administrering av AVODART 0,5 mg/dag i 3 uker med warfarin endrer ikke steady-state farmakokinetikken til S- eller R-warfarin-isomerene eller endrer effekten av warfarin på protrombintid [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Effekter på prostata-spesifikt antigen (PSA) og bruken av PSA ved påvisning av prostatakreft
kliniske studier reduserte AVODART 0,5 mg serum-PSA-konsentrasjonen med ca. 50 % innen 3 til 6 måneder etter behandling. Denne nedgangen var forutsigbar over hele spekteret av PSA-verdier hos personer med symptomatisk BPH, selv om den kan variere hos individer. AVODART 0,5 mg kan også forårsake reduksjon i serum-PSA i nærvær av prostatakreft. For å tolke serielle PSA-er hos menn som tar AVODART 0,5 mg, bør en ny PSA-baselinje etableres minst 3 måneder etter behandlingsstart og PSA overvåkes periodisk deretter. Enhver bekreftet økning fra den laveste PSA-verdien mens du bruker AVODART kan signalisere tilstedeværelse av prostatakreft og bør evalueres, selv om PSA-nivåene fortsatt er innenfor normalområdet for menn som ikke tar en 5 alfareduktasehemmer. Manglende samsvar med AVODART kan også påvirke PSA-testresultatene.
For å tolke en isolert PSA-verdi hos en mann behandlet med AVODART 0,5 mg i 3 måneder eller mer, bør PSA-verdien dobles for sammenligning med normale verdier hos ubehandlede menn. Fri-total PSA-forholdet (prosent fri PSA) forblir konstant, selv under påvirkning av AVODART. Hvis klinikere velger å bruke prosent gratis PSA som et hjelpemiddel for å oppdage prostatakreft hos menn som får AVODART, ser det ikke ut til at det er nødvendig med justering av verdien.
Samtidig administrering av dutasterid og tamsulosin resulterte i lignende endringer i serum-PSA som dutasterid monoterapi.
Økt risiko for høygradig prostatakreft
Hos menn i alderen 50 til 75 år med en tidligere negativ biopsi for prostatakreft og en baseline PSA mellom 2,5 ng/ml og 10,0 ng/ml som tok AVODART i den 4-årige reduksjonen av dutasteride av prostatakrefthendelser (REDUCE)-studien, var det en økt forekomst av Gleason score 810 prostatakreft sammenlignet med menn som tok placebo (AVODART 1,0 % versus placebo 0,5 %) [se INDIKASJONER OG BRUK , BIVIRKNINGER ]. I en 7-årig placebokontrollert klinisk studie med en annen 5 alfa-reduktasehemmer (finasterid 5 mg, PROSCAR), ble lignende resultater for Gleason score 8-10 observert prostatakreft (finasterid 1,8 % versus placebo 1,1 %).
alfa-reduktasehemmere kan øke risikoen for utvikling av høygradig prostatakreft. Hvorvidt effekten av 5 alfa-reduktasehemmere for å redusere prostatavolum eller forsøksrelaterte faktorer påvirket resultatene av disse studiene, er ikke fastslått.
Evaluering for andre urologiske sykdommer
Før behandling med AVODART 0,5 mg startes, bør det tas hensyn til andre urologiske tilstander som kan forårsake lignende symptomer. I tillegg kan BPH og prostatakreft eksistere side om side.
Transdermal eksponering av AVODART 0,5 mg hos gravide kvinner – risiko for mannlig foster
AVODART kapsler skal ikke håndteres av kvinner som er gravide eller kan være gravide. Dutasterid kan absorberes gjennom huden og kan føre til utilsiktet føtal eksponering og potensiell risiko for et mannlig foster. Hvis en gravid kvinne kommer i kontakt med lekkende dutasteridkapsler, bør kontaktområdet vaskes umiddelbart med såpe og vann [se Bruk i spesifikke populasjoner ]. Dutasterid kan absorberes gjennom huden basert på dyrestudier [se Ikke-klinisk toksikologi ].
Bloddonasjon
Menn som behandles med AVODART bør ikke donere blod før det har gått minst 6 måneder etter siste dose. Hensikten med denne utsatte perioden er å forhindre administrering av dutasterid til en gravid kvinnelig transfusjonsmottaker.
Effekt på sædegenskaper
Effekten av dutasterid 0,5 mg/dag på sædegenskaper ble evaluert hos friske menn gjennom 52 ukers behandling og 24 ukers oppfølging etter behandling. Ved 52 uker, sammenlignet med placebo, resulterte dutasteridbehandling i gjennomsnittlig reduksjon i totalt antall sædceller, sædvolum og sædmotilitet; effektene på totalt antall sædceller var ikke reversible etter 24 ukers oppfølging. Sædkonsentrasjonen og sædmorfologien var upåvirket, og gjennomsnittsverdiene for alle sædparametre holdt seg innenfor normalområdet på alle tidspunkter. Den kliniske betydningen av effekten av dutasterid på sædegenskaper for en individuell pasients fertilitet er ikke kjent [se Bruk i spesifikke populasjoner ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
PSA-overvåking
Informer pasientene om at AVODART reduserer serum-PSA-nivåer med ca. 50 % innen 3 til 6 måneder etter behandling, selv om det kan variere for hvert individ. For pasienter som gjennomgår PSA-screening, kan økninger i PSA-nivåer under behandling med AVODART signalisere tilstedeværelse av prostatakreft og bør vurderes av en helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Økt risiko for høygradig prostatakreft
Informer pasientene om at det var en økning i høygradig prostatakreft hos menn behandlet med 5 alfa-reduktasehemmere (som er indisert for BPH-behandling), inkludert AVODART 0,5 mg, sammenlignet med de som ble behandlet med placebo i studier som ser på bruken av disse legemidler for å redusere risikoen for prostatakreft [se INDIKASJONER OG BRUK , ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
Transdermal eksponering av AVODART hos gravide eller potensielt gravide kvinner – risiko for mannlig foster
Informer pasienter om at AVODART 0,5 mg kapsler ikke skal håndteres av kvinner som er gravide eller potensielt kan være gravide på grunn av potensialet for absorpsjon av dutasterid og den påfølgende potensielle risikoen for et mannlig foster i utvikling. Dutasterid kan absorberes gjennom huden og kan føre til utilsiktet føtal eksponering. Hvis en gravid eller potensielt gravid kvinne kommer i kontakt med lekkende AVODART 0,5 mg kapsler, bør kontaktområdet vaskes umiddelbart med såpe og vann [se ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner ].
Effekter på sædparametere
Gi menn beskjed om at AVODART 0,5 mg kan påvirke sædcellenes egenskaper, men effekten på fertiliteten er ukjent [se ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner ].
Bloddonasjon
Informer menn behandlet med AVODART 0,5 mg at de ikke bør donere blod før minst 6 måneder etter siste dose for å forhindre at gravide kvinner får dutasterid gjennom blodoverføring [se ADVARSLER OG FORHOLDSREGLER ]. Serumnivåer av dutasterid kan påvises i 4 til 6 måneder etter avsluttet behandling [se KLINISK FARMAKOLOGI ].
AVODART er et varemerke som eies av eller er lisensiert til GSK-gruppen av selskaper.
De andre merkene som er oppført er varemerker som eies av eller er lisensiert til sine respektive eiere og er ikke eid av eller lisensiert til GSK-gruppen av selskaper. Produsentene av disse merkene er ikke tilknyttet og støtter ikke GSK-gruppen av selskaper eller dens produkter.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
En 2-årig karsinogenitetsstudie ble utført i B6C3F1-mus i doser på 3, 35, 250 og 500 mg/kg/dag for hanner og 3, 35 og 250 mg/kg/dag for hunner; en økt forekomst av benigne hepatocellulære adenomer ble observert ved 250 mg/kg/dag (290 ganger MRHD av en 0,5 mg daglig dose) kun hos hunnmus. To av de tre viktigste menneskelige metabolittene er påvist i mus. Eksponeringen for disse metabolittene hos mus er enten lavere enn hos mennesker eller er ikke kjent.
en 2-årig karsinogenitetsstudie på Han Wistar-rotter, ved doser på 1,5, 7,5 og 53 mg/kg/dag hos hanner og 0,8, 6,3 og 15 mg/kg/dag hos hunner, var det en økning i Leydig-celler adenomer i testiklene ved 135 ganger MRHD (53 mg/kg/dag og mer). En økt forekomst av Leydig-cellehyperplasi var til stede ved 52 ganger MRHD (hanrotter på 7,5 mg/kg/dag og mer). En positiv korrelasjon mellom proliferative endringer i Leydig-cellene og en økning i sirkulerende luteiniserende hormonnivåer er påvist med 5 alfa-reduktasehemmere og stemmer overens med en effekt på hypothalamus-hypofyse-testikkelen etter 5 alfa-reduktase-hemming. Ved tumorigene doser ble nivåene av luteiniserende hormon hos rotter økt med 167 %. I denne studien ble de viktigste humane metabolittene testet for karsinogenitet ved omtrent 1 til 3 ganger forventet klinisk eksponering.
Mutagenese
Dutasterid ble testet for genotoksisitet i en bakteriell mutageneseanalyse (Ames-test), en kromosomavviksanalyse i eggstokkceller fra kinesisk hamster og en mikronukleusanalyse hos rotter. Resultatene indikerte ikke noe gentoksisk potensiale til moderlegemidlet. To hovedmetabolitter hos mennesker var også negative i enten Ames-testen eller en forkortet Ames-test.
Nedsatt fruktbarhet
Behandling av kjønnsmodne hannrotter med dutasterid ved 0,1 ganger MRHD (dyredoser på 0,05 mg/kg/dag eller høyere i opptil 31 uker) basert på gjennomsnittlig serumkonsentrasjon resulterte i dose- og tidsavhengige reduksjoner i fertilitet ved alle doser ; redusert cauda epididymal (absolutt) spermatall, men ikke spermkonsentrasjon (ved 50 og 500 mg/kg/dag); redusert vekt av epididymis, prostata og sædblærer; og mikroskopiske endringer (cytoplasmatisk vakuolering av tubulært epitel i epididymidene og/eller redusert cytoplasmatisk innhold av epitel, forenlig med redusert sekretorisk aktivitet i prostata og sædblærer) i reproduksjonsorganene ved alle doser i fravær av paternal toksisitet. Fertilitetseffektene ble reversert ved restitusjonsuke 6 ved alle doser, og sædcellene var normale ved slutten av en 14-ukers restitusjonsperiode. De mikroskopiske endringene var ikke lenger til stede ved restitusjonsuke 14 ved 0,1 ganger MRHD og ble delvis gjenvunnet i de gjenværende behandlingsgruppene. Lave nivåer av dutasterid (0,6 til 17 ng/ml) ble påvist i serumet til ubehandlede hunnrotter paret med behandlede hanner (10 til 500 mg/kg/dag i 29 til 30 uker) som er 16 til 110 ganger MRHD basert på gjennomsnittlig serumkonsentrasjon. Ingen feminisering forekom hos hannavkom av ubehandlede hunnrotter paret med behandlede hannrotter selv om det ble observert påviselige blodnivåer av dutasterid hos hunnrottene.
en fertilitetsstudie på hunnrotter med dosering 4 uker før paring gjennom tidlig drektighet, resulterte oral administrering av dutasterid i doser på 0,05, 2,5, 12,5 og 30 mg/kg/dag i redusert kullstørrelse på grunn av økte resorpsjoner og feminisering av mannlige fostre (redusert anogenital avstand) ved 2 til 10 ganger MRHD (dyredoser på 2,5 mg/kg/dag eller mer) basert på gjennomsnittlig serumkonsentrasjon, i nærvær av maternell toksisitet (redusert kroppsvektøkning). Fosterets kroppsvekt ble også redusert med omtrent 0,02 ganger MRHD (rottedose på 0,05 mg/kg/dag eller mer) basert på gjennomsnittlig serumkonsentrasjon, uten nivå uten effekt, i fravær av maternell toksisitet.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
AVODART 0,5 mg er kontraindisert for bruk under graviditet fordi det kan forårsake skade på det mannlige fosteret [se KONTRAINDIKASJONER ]. AVODART er ikke indisert for bruk hos kvinner.
AVODART 0,5 mg er en 5 alfa-reduktasehemmer som forhindrer omdannelse av testosteron til dihydrotestosteron (DHT), et hormon som er nødvendig for normal utvikling av mannlige kjønnsorganer. Abnormiteter i kjønnsorganene til mannlige fostre er en forventet fysiologisk konsekvens av hemming av denne konverteringen. Disse resultatene ligner observasjoner hos mannlige spedbarn med genetisk 5 alfa-reduktase-mangel.
I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
reproduksjonsstudier på dyr hemmet dutasterid normal utvikling av ytre kjønnsorganer hos mannlige avkom når det ble gitt til rotter eller kaniner under organogenese ved mindre enn den maksimale anbefalte humane dosen (MRHD) på 0,5 mg daglig, i fravær av maternell toksisitet. Ved 15 ganger MRHD, forlenget graviditet, redusert vekt av reproduktive organer og forsinket pubertet hos mannlige avkom ble observert hos rotter, med ingen-effektnivåer mindre enn MRHD på 0,5 mg daglig. Økt placentavekt hos kaniner ble også observert, med ingen-effektnivåer mindre enn MRHD på 0,5 mg daglig (se Data ).
Selv om dutasterid skilles ut i menneskelig sæd, er legemiddelkonsentrasjonen i den menneskelige kvinnelige partneren omtrent 100 ganger mindre enn konsentrasjoner som gir unormale kjønnsorganer i dyreforsøk (se Data ). Hos aper som ble doseret under organogenese i blodkonsentrasjoner som er sammenlignbare med eller over nivåer som en kvinnelig partner anslås å bli eksponert for, ble ikke ytre kjønnsorganer av mannlige avkom påvirket. Ingen feminisering forekom hos hannavkom av ubehandlede hunnrotter paret med behandlede hannrotter selv om det ble observert påvisbare blodnivåer av dutasterid hos hunnrottene [se Ikke-klinisk toksikologi ].
Data
Menneskelige data
Den høyeste målte sædkonsentrasjonen av dutasterid hos behandlede menn var 14 ng/ml. Selv om dutasterid påvises i sæd, forutsatt eksponering av en kvinne på 50 kg for 5 ml sæd og 100 % absorpsjon, vil kvinnens forventede dutasterid-blodkonsentrasjon gjennom sæd være omtrent 0,0175 ng/ml. Denne konsentrasjonen er omtrent 100 ganger mindre enn blodkonsentrasjoner som gir unormale kjønnsorganer i dyreforsøk. Dutasterid er sterkt proteinbundet i menneskelig sæd (større enn 96 %), noe som kan redusere mengden dutasterid som er tilgjengelig for vaginal absorpsjon.
Dyredata
en embryo-føtal utviklingsstudie hos rotter, resulterte oral administrering av dutasterid ved 10 ganger mindre enn MRHD på 0,5 mg daglig (basert på gjennomsnittlige blodnivåer hos menn) i feminisering av mannlige kjønnsorganer i fosteret (redusert anogenital avstand ved 0,05 mg). /kg/dag, med mangel på et nivå uten effekt) i fravær av maternell toksisitet. I tillegg forekom brystvorteutvikling, hypospadi og utspilte preputialkjertler hos fostre av mødre behandlet med doser på 2,5 mg/kg/dag eller mer (omtrent 15 ganger MRHD). Redusert føtal kroppsvekt og tilhørende forsinket forbening i nærvær av maternell toksisitet (redusert kroppsvektøkning) ble observert ved mors eksponering omtrent 15 ganger MRHD (dose på 2,5 mg/kg/dag eller mer). En økning i dødfødte unger ble observert hos damer behandlet med 30 mg/kg/dag (ca. 111 ganger MRHD), med et nivå uten effekt på 12,5 mg/kg/dag.
en kaninembryo-føtal utviklingsstudie ble doser 28 ganger MRHD (doser på 30 mg/kg/dag eller mer), basert på gjennomsnittlige blodnivåer hos menn, administrert oralt på svangerskapsdagene 7 til 29 (under organogenese og sent. periode med utvikling av ytre kjønnsorganer). Histologisk evaluering av kjønnspapillen til fostre avslørte bevis på feminisering av det mannlige fosteret så vel som sammensmeltede hodeskallebein og økte placentavekter ved alle doser i fravær av maternell toksisitet. En andre embryo-føtal utviklingsstudie på kaniner doseret gjennom hele svangerskapet (organogenese og senere periode med utvikling av ytre kjønnsorganer [drektighetsdager 6 til 29]) med 0,3 ganger MRHD (doser på 0,05 mg/kg/dag eller mer, uten ingen- effektnivå), ga også bevis på feminisering av kjønnsorganene hos mannlige fostre og økte placentavekter ved alle doser i fravær av maternell toksisitet.
en embryo-føtal utviklingsstudie ble gravide rhesus-aper eksponert intravenøst under organogenese (drektighetsdager 20 til 100) for et dutasterid-blodnivå som var sammenlignbart med eller over den estimerte dutasterid-eksponeringen til en kvinnelig partner. Dutasterid ble administrert på drektighetsdager 20 til 100 (under organogenese) i doser på 400, 780, 1 325 eller 2 010 ng/dag (12 aper/gruppe). Ingen feminisering av mannlige ytre kjønnsorganer til apeavkom ble observert. Reduksjon av føtal binyrevekt, reduksjon i føtal prostatavekt og økning i føtal ovarie- og testisvekt ble observert ved den høyeste testede dosen. Basert på den høyeste målte sædkonsentrasjonen av dutasterid hos behandlede menn (14 ng/ml), representerer disse dosene hos apen opptil 16 ganger den potensielle maksimale eksponeringen av en 50 kg menneskelig hunn for 5 ml sæd daglig fra en dutasterid- behandlet hann, forutsatt 100 % absorpsjon. Dosenivåene (på ng/kg-basis) administrert til aper i denne studien er 32 til 186 ganger den nominelle (ng/kg) dosen som en hunn potensielt vil bli eksponert for via sæden. Det er ikke kjent om kaniner eller rhesus-aper produserer noen av de viktigste menneskelige metabolittene.
en oral pre- og postnatal utviklingsstudie på rotter ble feminisering av mannlige kjønnsorganer observert. Redusert anogenital avstand ble observert ved 0,05 ganger MRHD og høyere (0,05 mg/kg/dag og mer), med mangel på et nivå uten effekt, basert på gjennomsnittlige blodnivåer hos menn som en estimering av AUC. Hypospadi og brystvorteutvikling ble observert ved 2,5 mg/kg/dag eller mer (14 ganger MRHD eller høyere, med et nivå uten effekt ved 0,05 mg/kg/dag). Doser på 2,5 mg/kg/dag og mer resulterte også i forlenget svangerskap hos kvinnelige foreldre, en økning i tid til balano-preputial separasjon hos mannlige avkom, en reduksjon i tid til vaginal åpenhet for kvinnelige avkom, og en reduksjon i prostata og seminal vesikkelvekter hos mannlige avkom. Økt dødfødsel og redusert neonatal levedyktighet hos avkom ble notert ved 30 mg/kg/dag (102 ganger MRHD i nærvær av maternell toksisitet [redusert kroppsvekt]).
Amming
Risikosammendrag
AVODART er ikke indisert for bruk hos kvinner. Det er ingen tilgjengelig informasjon om tilstedeværelsen av dutasterid i morsmelk, effekten på barnet som ammes, eller effekten på melkeproduksjonen.
Kvinner og menn med reproduktivt potensial
Infertilitet
Hanner
Effekten av dutasterid 0,5 mg/dag på sædkarakteristika ble evaluert hos normale frivillige i alderen 18 til 52 år (n = 27 dutasterider, n = 23 placebo) gjennom 52 ukers behandling og 24 ukers oppfølging etter behandling. Ved 52 uker var den gjennomsnittlige prosentvise reduksjonen fra baseline i totalt spermantall, sædvolum og spermmotilitet henholdsvis 23 %, 26 % og 18 % i dutasteridgruppen når det ble justert for endringer fra baseline i placebogruppen. Spermkonsentrasjon og sædmorfologi var upåvirket. Etter 24 ukers oppfølging forble den gjennomsnittlige prosentvise endringen i totalt antall sædceller i dutasteridgruppen 23 % lavere enn baseline. Mens gjennomsnittsverdier for alle sædparametere på alle tidspunkter holdt seg innenfor de normale områdene og ikke oppfylte forhåndsdefinerte kriterier for en klinisk signifikant endring (30 %), hadde 2 personer i dutasteridgruppen reduksjoner i spermantall på mer enn 90 % fra baseline kl. 52 uker, med delvis bedring ved 24-ukers oppfølging. Den kliniske betydningen av dutasterids effekt på sædegenskaper for en individuell pasients fertilitet er ikke kjent [se ADVARSLER OG FORHOLDSREGLER ].
Pediatrisk bruk
AVODART 0,5 mg er ikke indisert for bruk hos pediatriske pasienter. Sikkerhet og effektivitet hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Av 2 167 mannlige forsøkspersoner behandlet med AVODART 0,5 mg i 3 kliniske studier, var 60 % i alderen 65 år og eldre og 15 % i alderen 75 år og eldre. Ingen generelle forskjeller i sikkerhet eller effekt ble observert mellom disse forsøkspersonene og yngre forsøkspersoner. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos noen eldre individer kan ikke utelukkes [se KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
Ingen dosejustering er nødvendig for AVODART 0,5 mg hos pasienter med nedsatt nyrefunksjon [se KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Effekten av nedsatt leverfunksjon på dutasterids farmakokinetikk er ikke studert. Fordi dutasterid metaboliseres i stor grad, kan eksponeringen være høyere hos pasienter med nedsatt leverfunksjon. I en klinisk studie der 60 forsøkspersoner fikk 5 mg (10 ganger den terapeutiske dosen) daglig i 24 uker, ble det imidlertid ikke observert ytterligere bivirkninger sammenlignet med de som ble observert ved den terapeutiske dosen på 0,5 mg [se KLINISK FARMAKOLOGI ].
OVERDOSE
I forsøk med frivillige har enkeltdoser av dutasterid opp til 40 mg (80 ganger den terapeutiske dosen) i 7 dager blitt administrert uten vesentlige sikkerhetsproblemer. I en klinisk studie ble daglige doser på 5 mg (10 ganger den terapeutiske dosen) administrert til 60 personer i 6 måneder uten ytterligere bivirkninger enn de som ble sett ved terapeutiske doser på 0,5 mg.
Det finnes ingen spesifikk motgift mot dutasterid. Ved mistanke om overdosering bør derfor symptomatisk og støttende behandling gis etter behov, med tanke på den lange halveringstiden til dutasterid.
KONTRAINDIKASJONER
AVODART 0,5 mg er kontraindisert for bruk i:

- . Svangerskap. Bruk av dutasterid er kontraindisert hos gravide kvinner. I reproduksjons- og utviklingstoksisitetsstudier på dyr, hemmet dutasterid utviklingen av mannlige fosterets ytre kjønnsorganer. Derfor kan AVODART 0,5 mg forårsake fosterskade når det gis til en gravid kvinne [se ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner ]. . Pasienter med tidligere påvist klinisk signifikant overfølsomhet (f.eks. alvorlige hudreaksjoner, angioødem) overfor AVODART eller andre 5 alfa-reduktasehemmere [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Dutasteride hemmer omdannelsen av testosteron til DHT. DHT er androgenet som er hovedansvarlig for den første utviklingen og den påfølgende forstørrelsen av prostatakjertelen. Testosteron omdannes til DHT av enzymet 5 alfa-reduktase, som eksisterer som 2 isoformer, type 1 og type 2. Type 2 isoenzymet er primært aktivt i reproduktive vev, mens type 1 isoenzymet også er ansvarlig for testosteronkonvertering i hud og lever.
Dutasteride er en konkurrerende og spesifikk hemmer av både type 1 og type 2 5 alfa-reduktase isoenzymer, som den danner et stabilt enzymkompleks med. Dissosiasjon fra dette komplekset har blitt evaluert under in vitro og in vivo forhold og er ekstremt langsom. Dutasterid binder seg ikke til den humane androgenreseptoren.
Farmakodynamikk
Effekt på 5 alfa-dihydrotestosteron og testosteron
Den maksimale effekten av daglige doser av dutasterid på reduksjonen av DHT er doseavhengig og observeres innen 1 til 2 uker. Etter 1 og 2 ukers daglig dosering med dutasterid 0,5 mg, ble median DHT-konsentrasjon i serum redusert med henholdsvis 85 % og 90 %. Hos pasienter med BPH behandlet med dutasterid 0,5 mg/dag i 4 år, var medianreduksjonen i serum-DHT 94 % etter 1 år, 93 % etter 2 år og 95 % etter både 3 og 4 år. Median økning i serumtestosteron var 19 % etter både 1 og 2 år, 26 % etter 3 år og 22 % etter 4 år, men gjennomsnitts- og mediannivåene holdt seg innenfor det fysiologiske området.
Hos pasienter med BPH behandlet med 5 mg/dag dutasterid eller placebo i opptil 12 uker før transurethral reseksjon av prostata, var gjennomsnittlige DHT-konsentrasjoner i prostatavev signifikant lavere i dutasteridgruppen sammenlignet med placebo (784 og 5793 pg/g) henholdsvis P
Voksne menn med genetisk arvelig type 2 5 alfa-reduktase-mangel har også reduserte DHT-nivåer. Disse 5 alfa-reduktase-mangelfulle mennene har en liten prostatakjertel gjennom hele livet og utvikler ikke BPH. Bortsett fra de assosierte urogenitale defektene som er tilstede ved fødselen, er ingen andre kliniske abnormiteter relatert til 5-alfa-reduktase-mangel observert hos disse personene.
Effekter på andre hormoner
Hos friske frivillige ga 52 ukers behandling med dutasterid 0,5 mg/dag (n = 26) ingen klinisk signifikant endring sammenlignet med placebo (n = 23) i kjønnshormonbindende globulin, østradiol, luteiniserende hormon, follikkelstimulerende hormon, tyroksin (fritt T4) og dehydroepiandrosteron. Statistisk signifikante, baseline-justerte gjennomsnittsøkninger sammenlignet med placebo ble observert for totalt testosteron etter 8 uker (97,1 ng/dL, P
Andre effekter
Plasmalipidpanel og beinmineraltetthet ble evaluert etter 52 uker med dutasterid 0,5 mg én gang daglig hos friske frivillige. Det var ingen endring i bentetthet målt ved dobbeltenergi røntgenabsorptiometri sammenlignet med verken placebo eller baseline. I tillegg var plasmalipidprofilen (dvs. totalt kolesterol, lipoproteiner med lav tetthet, lipoproteiner med høy tetthet, triglyserider) upåvirket av dutasterid. Ingen klinisk signifikante endringer i binyrehormonresponsen på stimulering av adrenokortikotropisk hormon (ACTH) ble observert i en undergruppepopulasjon (n = 13) av den 1-årige studien med friske frivillige.
Farmakokinetikk
Absorpsjon
Etter administrering av en enkelt dose på 0,5 mg av en myk gelatinkapsel, inntreffer tiden til maksimal serumkonsentrasjon (Tmax) av dutasterid innen 2 til 3 timer. Absolutt biotilgjengelighet hos 5 friske personer er omtrent 60 % (område: 40 % til 94 %). Når stoffet administreres sammen med mat, ble de maksimale serumkonsentrasjonene redusert med 10 % til 15 %. Denne reduksjonen er uten klinisk betydning.
Fordeling
Farmakokinetiske data etter enkelt- og gjentatte orale doser viser at dutasterid har et stort distribusjonsvolum (300 til 500 L). Dutasterid er sterkt bundet til plasmaalbumin (99,0 %) og alfa-1 surt glykoprotein (96,6 %).
I en studie med friske forsøkspersoner (n = 26) som fikk dutasterid 0,5 mg/dag i 12 måneder, var konsentrasjonen av sæddutasterid gjennomsnittlig 3,4 ng/ml (område: 0,4 til 14 ng/ml) etter 12 måneder og, i likhet med serum, oppnådd stabil - angi konsentrasjoner ved 6 måneder. I gjennomsnitt, etter 12 måneder, delte 11,5 % av serumdutasteridkonsentrasjonene seg i sæd.
Metabolisme og eliminering
Dutasterid metaboliseres i stor grad hos mennesker. In vitro-studier viste at dutasterid metaboliseres av isoenzymene CYP3A4 og CYP3A5. Begge disse isoenzymene produserte metabolittene 4'-hydroksydutasteride, 6-hydroksydutasteride og 6,4'-dihydroksydutasterid. I tillegg ble 15-hydroksydutasterid-metabolitten dannet av CYP3A4. Dutasterid metaboliseres ikke in vitro av humane cytokrom P450 isoenzymer CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 og CYP2E1. I humant serum etter dosering til steady state, uendret dutasterid, 3 hovedmetabolitter (4'-hydroksydutasterid, 1,2-dihydrodutasterid og 6-hydroksydutasterid), og 2 mindre metabolitter (6,4'-dihydroksydutasterid og 15 -hydroksydutasterid), som vurdert ved massespektrometrisk respons, er påvist. Den absolutte stereokjemien til hydroksyltilsetningene i 6 og 15 posisjonene er ikke kjent. In vitro er metabolittene 4'-hydroksydutasterid og 1,2-dihydrodutasterid mye mindre potente enn dutasterid mot begge isoformene av human 5-alfa-reduktase. Aktiviteten til 6β-hydroksydutasterid er sammenlignbar med aktiviteten til dutasterid.
Dutasterid og dets metabolitter ble hovedsakelig utskilt i feces. Som prosent av dosen var det omtrent 5 % uendret dutasterid (~1% til ~15%) og 40% som dutasterid-relaterte metabolitter (~2% til ~90%). Kun spormengder av uendret dutasterid ble funnet i urin (
Den terminale eliminasjonshalveringstiden for dutasterid er ca. 5 uker ved steady state. Gjennomsnittlig steady-state serum dutasteridkonsentrasjon var 40 ng/ml etter 0,5 mg/dag i 1 år. Etter daglig dosering oppnår serumkonsentrasjonen av dutasterid 65 % av steady-state-konsentrasjonen etter 1 måned og ca. 90 % etter 3 måneder. På grunn av den lange halveringstiden til dutasterid, forblir serumkonsentrasjoner påviselige (større enn 0,1 ng/ml) i opptil 4 til 6 måneder etter seponering av behandlingen.
Spesifikke populasjoner
Pediatriske pasienter
Dutasterids farmakokinetikk er ikke undersøkt hos personer yngre enn 18 år.
Geriatriske pasienter
Ingen dosejustering er nødvendig hos eldre. Farmakokinetikken og farmakodynamikken til dutasterid ble evaluert hos 36 friske mannlige forsøkspersoner i alderen 24 til 87 år etter administrering av en enkeltdose på 5 mg dutasterid. I denne enkeltdosestudien økte halveringstiden for dutasterid med alderen (ca. 170 timer hos menn i alderen 20 til 49 år, ca. 260 timer hos menn i alderen 50 til 69 år og ca. 300 timer hos menn eldre enn 70 år). Av 2 167 menn behandlet med dutasterid i de 3 pivotale studiene, var 60 % 65 år eller eldre og 15 % var 75 år eller eldre. Ingen generelle forskjeller i sikkerhet eller effekt ble observert mellom disse pasientene og yngre pasienter.
Mannlige og kvinnelige pasienter
AVODART er kontraindisert under graviditet og er ikke indisert for bruk hos kvinner [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER ]. Farmakokinetikken til dutasterid hos kvinner er ikke studert.
Rase- og etniske grupper
Effekten av rase på dutasterids farmakokinetikk er ikke studert.
Pasienter med nedsatt nyrefunksjon
Effekten av nedsatt nyrefunksjon på dutasterids farmakokinetikk er ikke studert. Imidlertid gjenfinnes mindre enn 0,1 % av en steady-state 0,5 mg dose av dutasterid i human urin, så det forventes ingen dosejustering for pasienter med nedsatt nyrefunksjon.
Pasienter med nedsatt leverfunksjon
Effekten av nedsatt leverfunksjon på dutasterids farmakokinetikk er ikke studert. Fordi dutasterid metaboliseres i stor grad, kan eksponeringen være høyere hos pasienter med nedsatt leverfunksjon.
Legemiddelinteraksjonsstudier
Cytokrom P450-hemmere
Ingen kliniske legemiddelinteraksjonsstudier har blitt utført for å evaluere effekten av CYP3A-enzymhemmere på dutasterids farmakokinetikk. Basert på in vitro-data kan imidlertid blodkonsentrasjoner av dutasterid øke ved tilstedeværelse av hemmere av CYP3A4/5 som ritonavir, ketokonazol, verapamil, diltiazem, cimetidin, troleandomycin og ciprofloksacin.
Dutasterid hemmer ikke in vitro-metabolismen av modellsubstrater for de viktigste humane cytokrom P450-isoenzymene (CYP1A2, CYP2C9, CYP2C19, CYP2D6 og CYP3A4) ved en konsentrasjon på 1000 ng/ml, 25 ganger høyere enn konsentrasjoner i humant serum. .
Alfa-adrenerge antagonister
I en enkeltsekvens, crossover-studie med friske frivillige, hadde administrering av tamsulosin eller terazosin i kombinasjon med AVODART ingen effekt på steady-state farmakokinetikken til noen av alfa-adrenerge antagonister. Selv om effekten av administrering av tamsulosin eller terazosin på dutasterid farmakokinetiske parametere ikke ble evaluert, var den prosentvise endringen i DHT-konsentrasjoner lik for AVODART 0,5 mg alene sammenlignet med kombinasjonsbehandlingen.
Kalsiumkanalantagonister
en populasjonsfarmakokinetikkanalyse ble det observert en reduksjon i clearance av dutasterid ved samtidig administrering med CYP3A4-hemmere verapamil (-37 %, n = 6) og diltiazem (-44 %, n = 5). Derimot ble ingen reduksjon i clearance sett når amlodipin, en annen kalsiumkanalantagonist som ikke er en CYP3A4-hemmer, ble administrert samtidig med dutasterid (+7 %, n = 4).
Reduksjonen i clearance og påfølgende økning i eksponering for dutasterid i nærvær av verapamil og diltiazem anses ikke å være klinisk signifikant. Ingen dosejustering anbefales.
Kolestyramin
Administrering av en enkeltdose på 5 mg AVODART 0,5 mg fulgt 1 time senere av 12 g kolestyramin påvirket ikke den relative biotilgjengeligheten av dutasterid hos 12 normale frivillige.
Digoksin
I en studie med 20 friske frivillige endret ikke AVODART 0,5 mg steady-state farmakokinetikken til digoksin når det ble administrert samtidig i en dose på 0,5 mg/dag i 3 uker.
Warfarin
en studie med 23 friske frivillige endret ikke 3 ukers behandling med AVODART 0,5 mg/dag steady-state farmakokinetikken til S- eller R-warfarin-isomerene eller endret effekten av warfarin på protrombintiden når det ble administrert med warfarin.
Annen samtidig terapi
Selv om spesifikke interaksjonsstudier ikke ble utført med andre forbindelser, tok omtrent 90 % av forsøkspersonene i de 3 randomiserte, dobbeltblinde, placebokontrollerte sikkerhets- og effektstudiene som fikk AVODART andre medisiner samtidig. Ingen klinisk signifikante uønskede interaksjoner kunne tilskrives kombinasjonen av AVODART og samtidig behandling når AVODART ble administrert sammen med antihyperlipidemier, angiotensin-konverterende enzym (ACE)-hemmere, beta-adrenerge blokkere, kalsiumkanalblokkere, kortikosteroider, diuretika, ikke-steroide antistoffer. -inflammatoriske legemidler (NSAIDs), fosfodiesterase Type V-hemmere og kinolonantibiotika.
Dyretoksikologi og/eller farmakologi
Toksikologiske studier i sentralnervesystemet
Hos rotter og hunder resulterte gjentatt oral administrering av dutasterid i at noen dyr viste tegn på ikke-spesifikk, reversibel, sentralt formidlet toksisitet uten assosierte histopatologiske endringer ved eksponeringer 425 ganger og 315 ganger forventet klinisk eksponering (av moderlegemidlet), hhv. .
Kanin dermal absorpsjon
I en dermal farmakokinetikkstudie på kanin, resulterte dermal absorpsjon av dutasterid i CAPMUL (glyceryloleat) hos kaniner i serumkonsentrasjoner på 2,7 til 40,5 mcg/time/ml for doser på henholdsvis 1 til 20 mg/ml, eller 56 % til 1000 %. av påført dutasterid som skal absorberes under okkluderte og langvarige forhold. AVODART myke gelatinkapsler administrert oralt inneholder 0,5 mg dutasterid oppløst i en blanding av mono-di-glyserider av kapryl/kaprinsyre og butylert hydroksytoluen. Dutasterid i vann ble minimalt absorbert hos kaniner (2000 mg/kg).
Kliniske studier
Monoterapi
AVODART 0,5 mg/dag (n = 2 167) eller placebo (n = 2 158) ble evaluert hos mannlige forsøkspersoner med BPH i tre 2-årige multisenter, placebokontrollerte, dobbeltblinde studier, hver med 2-års åpne utvidelser ( n = 2.340). Mer enn 90 % av prøvebefolkningen var hvite. Forsøkspersonene var i alderen minst 50 år med serum PSA ≥1,5 ng/ml og
Effekt på symptompoeng
Symptomer ble kvantifisert ved hjelp av AUA-SI, et spørreskjema som evaluerer urinsymptomer (ufullstendig tømming, hyppighet, intermittens, haster, svak strøm, anstrengelse og natturi) ved å rangere på en 0 til 5 skala for en total mulig poengsum på 35, med høyere numerisk total symptomscore som representerer større alvorlighetsgrad av symptomene. Baseline AUA-SI-score på tvers av de 3 studiene var omtrent 17 enheter i begge behandlingsgruppene.
Forsøkspersoner som fikk dutasterid oppnådde statistisk signifikant forbedring i symptomer sammenlignet med placebo innen måned 3 i 1 studie og innen måned 12 i de to andre pivotale studiene. Ved måned 12 var den gjennomsnittlige reduksjonen fra baseline i AUA-SI totale symptomscore på tvers av de tre sammenslåtte forsøkene -3,3 enheter for dutasterid og -2,0 enheter for placebo med en gjennomsnittlig forskjell mellom de 2 behandlingsgruppene på -1,3 (område: -1,1) til -1,5 enheter i hver av de 3 forsøkene, P
Disse studiene ble prospektivt designet for å evaluere effekter på symptomer basert på prostatastørrelse ved baseline. Hos menn med prostatavolum ≥40 cc var gjennomsnittlig reduksjon -3,8 enheter for dutasterid og -1,6 enheter for placebo, med en gjennomsnittlig forskjell mellom de 2 behandlingsgruppene på -2,2 ved måned 24. Hos menn med prostatavolum
Figur 1: AUA-SI scoreendring fra baseline (randomiserte, dobbeltblindede, placebokontrollerte forsøk samlet)
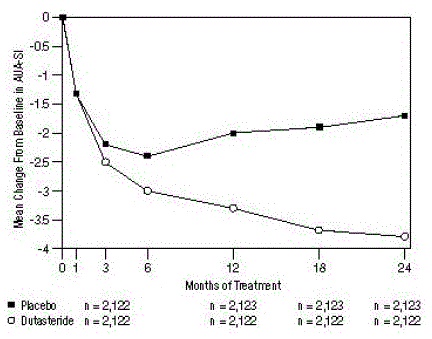
en AUA-SI-poengsum varierer fra 0 til 35.
Effekt på akutt urinretensjon og behovet for BPH-relatert kirurgi
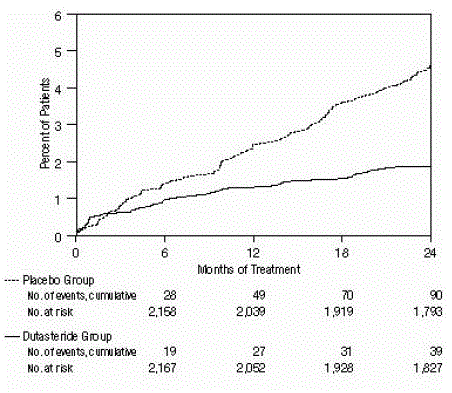
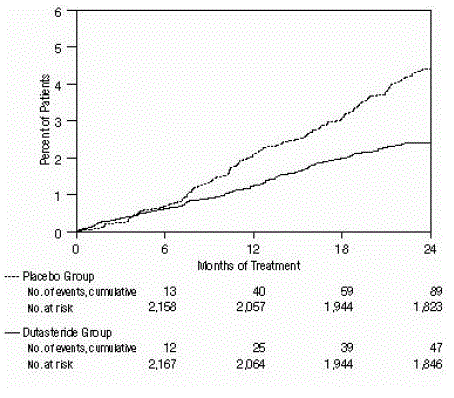
Effekten ble også vurdert etter 2 års behandling etter forekomsten av AUR som krever kateterisering og BPH-relatert urologisk kirurgisk intervensjon. Sammenlignet med placebo var AVODART assosiert med en statistisk signifikant lavere forekomst av AUR (1,8 % for AVODART versus 4,2 % for placebo, P
Figur 2: Prosent av forsøkspersoner som utvikler akutt urinretensjon over en 24-måneders periode (Randomiserte, dobbeltblinde, placebokontrollerte forsøk samlet)
Figur 3: Prosent av forsøkspersoner som har blitt operert for benign prostatahyperplasi over en 24-måneders periode (randomiserte, dobbeltblinde, placebokontrollerte studier samlet)
Effekt på prostatavolum
Et prostatavolum på minst 30 cc målt ved transrektal ultralyd var nødvendig for å gå inn i prøven. Gjennomsnittlig prostatavolum ved inngang til forsøket var omtrent 54 cc.
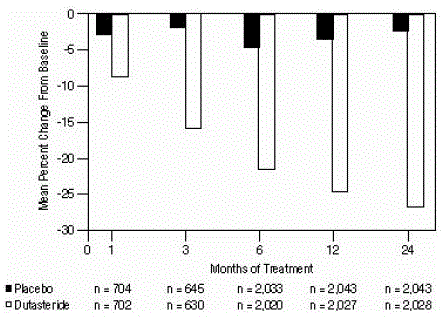
Statistisk signifikante forskjeller (AVODART 0,5 mg versus placebo) ble notert ved den tidligste prostatavolummålingen etter behandling i hver studie (måned 1, måned 3 eller måned 6) og fortsatte gjennom måned 24. Ved måned 12 var gjennomsnittlig prosentvis endring i prostatavolum i de tre sammenslåtte forsøkene var -24,7 % for dutasterid og -3,4 % for placebo; gjennomsnittlig forskjell (dutasterid minus placebo) var -21,3 % (område: -21,0 % til -21,6 % i hver av de 3 studiene, P
Figur 4: Prostatavolumendring fra baseline (randomiserte, dobbeltblindede, placebokontrollerte forsøk samlet)
Effekt på maksimal urinstrøm
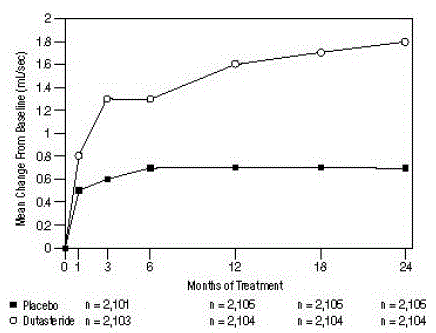
En gjennomsnittlig maksimal urinstrømningshastighet (Qmax) på ≤15 ml/sek var nødvendig for å gå i prøve. Qmax var omtrent 10 ml/sek ved baseline på tvers av de 3 pivotale studiene.
Forskjellene mellom de 2 gruppene var statistisk signifikante fra baseline ved måned 3 i alle 3 studiene og ble opprettholdt til og med måned 12. Ved måned 12 var gjennomsnittsøkningen i Qmax på tvers av de tre sammenslåtte forsøkene 1,6 ml/sek for AVODART 0,5 mg og 0,7 ml /sek for placebo; gjennomsnittlig forskjell (dutasterid minus placebo) var 0,8 ml/sek (område: 0,7 til 1,0 ml/sek i hver av de 3 studiene, P
Figur 5: Qmax-endring fra baseline (randomiserte, dobbeltblindede, placebokontrollerte forsøk samlet)
Sammendrag av kliniske studier
Data fra 3 store, godt kontrollerte effektstudier viser at behandling med AVODART (0,5 mg én gang daglig) reduserer risikoen for både AUR og BPH-relatert kirurgisk inngrep i forhold til placebo, forbedrer BPH-relaterte symptomer, reduserer prostatavolum og øker maksimalt urinstrømningshastigheter. Disse dataene tyder på at AVODART 0,5 mg stopper sykdomsprosessen til BPH hos menn med forstørret prostata.
Kombinasjon med alfablokkerterapi (CombAT)
Effekten av kombinasjonsbehandling (AVODART 0,5 mg/dag pluss tamsulosin 0,4 mg/dag, n = 1 610) ble sammenlignet med AVODART 0,5 mg alene (n = 1 623) eller tamsulosin alene (n = 1 611) i et 4-årig multisenter, randomisert , dobbeltblind forsøk. Kriteriene for studiestart var lik de dobbeltblinde, placebokontrollerte effektstudiene for monoterapi beskrevet i avsnitt 14.1. Åttiåtte prosent (88%) av den registrerte prøvepopulasjonen var hvite. Omtrent 52 % av forsøkspersonene hadde tidligere eksponering for behandling med 5 alfa-reduktase-hemmere eller alfa-adrenerge antagonister. Av de 4 844 forsøkspersonene som ble tilfeldig tildelt behandling, fullførte 69 % av pasientene i kombinasjonsgruppen, 67 % i gruppen som fikk AVODART 0,5 mg og 61 % i tamsulosingruppen 4 år med dobbeltblind behandling.
Effekt på symptomscore
Symptomene ble kvantifisert ved å bruke de første 7 spørsmålene i International Prostate Symptom Score (IPSS) (identisk med AUA-SI). Baseline-skåren var omtrent 16,4 enheter for hver behandlingsgruppe. Kombinasjonsterapi var statistisk overlegen hver av monoterapibehandlingene med synkende symptomscore ved måned 24, det primære tidspunktet for dette endepunktet. Ved måned 24 var gjennomsnittsendringene fra baseline (±SD) i IPSS totale symptomscore -6,2 (±7,14) for kombinasjon, -4,9 (±6,81) for AVODART og -4,3 (±7,01) for tamsulosin, med en gjennomsnittlig forskjell mellom kombinasjon og AVODART 0,5 mg av -1,3 enheter (P
Figur 6: Endring av internasjonal prostatasymptompoeng fra baseline over en 48 måneders periode (randomisert, dobbeltblind, parallellgruppeforsøk [CombAT Trial])
![International Prostate Symptom Score Change from Baseline over a 48Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/d183d813a5040a5e87c7813fa0da1369.jpg)
Effekt på akutt urinretensjon eller behovet for BPH-relatert kirurgi
Etter 4 års behandling ga kombinasjonsbehandling med AVODART 0,5 mg og tamsulosin ingen fordel i forhold til monoterapi med AVODART for å redusere forekomsten av AUR eller BPH-relatert kirurgi.
Effekt på maksimal urinstrøm
Baseline Qmax var ca. 10,7 ml/sek for hver behandlingsgruppe. Kombinasjonsterapi var statistisk overlegen hver av monoterapibehandlingene ved å øke Qmax ved måned 24, det primære tidspunktet for dette endepunktet. Ved måned 24 var gjennomsnittlig økning fra baseline (±SD) i Qmax 2,4 (±5,26) ml/sek for kombinasjon, 1,9 (±5,10) ml/sek for AVODART 0,5 mg og 0,9 (±4,57) ml/sek for tamsulosin, med en gjennomsnittlig forskjell mellom kombinasjon og AVODART på 0,5 mL/sek (P = 0,003; [95 % KI: 0,17, 0,84]), og mellom kombinasjon og tamsulosin på 1,5 mL/sek (P
Den ytterligere forbedringen i Qmax ved kombinasjonsbehandling i forhold til monoterapi med AVODART 0,5 mg var ikke lenger statistisk signifikant ved måned 48.
Figur 7: Qmax-endring fra baseline over en 24-måneders periode (randomisert, dobbeltblind, parallellgruppeprøve [CombAT-prøve])
![Qmax Change from Baseline over a 24-Month Period (Randomized, Double-blind, Parallel-Group Trial [CombAT Trial]) - Illustration](/pics/b92faa9635a82c67c54c9553ce1ec55c.jpg)
Effekt på prostatavolum
Gjennomsnittlig prostatavolum ved inngang til forsøk var ca. 55 cc. Ved måned 24, det primære tidspunktet for dette endepunktet, var gjennomsnittlig prosentvise endringer fra baseline (±SD) i prostatavolum -26,9 % (±22,57) for kombinasjonsbehandling, -28,0 % (±24,88) for AVODART 0,5 mg, og 0 % (±31,14) for tamsulosin, med en gjennomsnittlig forskjell mellom kombinasjon og AVODART 0,5 mg på 1,1 % (P = NS; [95 % KI: -0,6, 2,8]), og mellom kombinasjon og tamsulosin på -26,9 % (P
PASIENTINFORMASJON
AVODART (av o dart) (dutasterid) kapsler
AVODART 0,5 mg er kun til bruk av menn.
Les denne pasientinformasjonen før du begynner å ta AVODART 0,5 mg og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller din behandling.
Hva er AVODART 0,5 mg?
AVODART 0,5 mg er et reseptbelagt legemiddel som inneholder dutasterid. AVODART 0,5 mg brukes til å behandle symptomene på benign prostatahyperplasi (BPH) hos menn med forstørret prostata til:
- . forbedre symptomene, . redusere risikoen for akutt urinretensjon (en fullstendig blokkering av urinstrømmen), . redusere risikoen for behov for BPH-relatert kirurgi.
Hvem bør IKKE ta AVODART?
Ikke bruk AVODART hvis du er:
- . gravid eller kan bli gravid. AVODART 0,5 mg kan skade det ufødte barnet ditt. Gravide kvinner bør ikke røre AVODART kapsler. Hvis en kvinne som er gravid med en mannlig baby får nok AVODART 0,5 mg i kroppen ved å svelge eller ta på AVODART, kan den mannlige babyen bli født med kjønnsorganer som ikke er normale. Hvis en gravid kvinne eller kvinne i fertil alder kommer i kontakt med lekkende AVODART 0,5 mg kapsler, bør kontaktområdet vaskes umiddelbart med såpe og vann. . et barn eller en tenåring. . allergisk mot dutasterid eller noen av ingrediensene i AVODART. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i AVODART. . allergisk mot andre 5 alfa-reduktasehemmere, for eksempel PROSCAR (finasteride) ® tabletter.
Hva bør jeg fortelle helsepersonell før jeg tar AVODART 0,5 mg?
Før du tar AVODART 0,5 mg, fortell helsepersonell dersom du:
- . har leverproblemer
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. AVODART og andre legemidler kan påvirke hverandre og forårsake bivirkninger. AVODART 0,5 mg kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan AVODART 0,5 mg virker.
Kjenn til medisinene du tar. Hold en liste over dem for å vise helsepersonell og apotek når du får en ny medisin.
Hvordan skal jeg ta AVODART?
- . Ta 1 AVODART kapsel én gang daglig. . Svelg AVODART 0,5 mg kapsler hele. Ikke knus, tygg eller åpne AVODART 0,5 mg kapsler fordi innholdet i kapselen kan irritere leppene, munnen eller halsen. . Du kan ta AVODART 0,5 mg med eller uten mat. . Hvis du glemmer en dose, kan du ta den senere samme dag. Ikke ta igjen den glemte dosen ved å ta 2 doser neste dag.
Hva bør jeg unngå mens jeg tar AVODART 0,5 mg?
- . Du bør ikke donere blod mens du tar AVODART eller i 6 måneder etter at du har sluttet med AVODART. Dette er viktig for å forhindre at gravide får AVODART gjennom blodtransfusjoner.
Hva er de mulige bivirkningene av AVODART?
AVODART kan forårsake alvorlige bivirkninger, inkludert:
- . Sjeldne og alvorlige allergiske reaksjoner, inkludert:
- . hevelse i ansiktet, tungen eller halsen . alvorlige hudreaksjoner, slik som hudavskalling
Få medisinsk hjelp med en gang hvis du har disse alvorlige allergiske reaksjonene.
- . Høyere sjanse for en mer alvorlig form for prostatakreft.
De vanligste bivirkningene av AVODART inkluderer:
- . problemer med å få eller beholde ereksjon (impotens)* . en reduksjon i sexlyst (libido)* . ejakulasjonsproblemer* . forstørrede eller smertefulle bryster. Hvis du merker brystklumper eller utflod fra brystvorten, bør du snakke med legen din.
*Noen av disse hendelsene kan fortsette etter at du slutter å ta AVODART.
Deprimert humør er rapportert hos pasienter som får AVODART.
AVODART 0,5mg har vist seg å redusere spermantall, sædvolum og spermbevegelse. Effekten av AVODART 0,5 mg på mannlig fertilitet er imidlertid ikke kjent.
Prostata-spesifikk antigen (PSA) test: Din helsepersonell kan sjekke deg for andre prostataproblemer, inkludert prostatakreft før du starter og mens du tar AVODART. En blodprøve kalt PSA (prostata-spesifikt antigen) brukes noen ganger for å se om du kan ha prostatakreft. AVODART vil redusere mengden PSA målt i blodet ditt. Helsepersonell er klar over denne effekten og kan fortsatt bruke PSA for å se om du kan ha prostatakreft. Økninger i PSA-nivåene dine under behandling med AVODART (selv om PSA-nivåene er innenfor normalområdet) bør vurderes av helsepersonell.
Fortell helsepersonell dersom du har noen bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger med AVODART. For mer informasjon, spør helsepersonell eller apotek.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare AVODART 0,5 mg?
- . Oppbevar AVODART 0,5 mg kapsler ved romtemperatur (59 °F til 86 °F eller 15 °C til 30 °C). . AVODART 0,5 mg kapsler kan bli deformert og/eller misfarget hvis de oppbevares ved høye temperaturer. . Ikke bruk AVODART 0,5 mg hvis kapslene dine er deformert, misfarget eller lekker. . Kast trygt medisin som ikke lenger er nødvendig.
Oppbevar AVODART 0,5 mg og alle legemidler utilgjengelig for barn.
Medisiner er noen ganger foreskrevet til andre formål enn de som er oppført i et pasientvedlegg. Ikke bruk AVODART 0,5 mg for en tilstand det ikke er foreskrevet for. Ikke gi AVODART til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Dette pakningsvedlegget oppsummerer den viktigste informasjonen om AVODART. Hvis du vil ha mer informasjon, snakk med helsepersonell. Du kan spørre apoteket eller helsepersonell om informasjon om AVODART 0,5 mg som er skrevet for helsepersonell.
For mer informasjon, gå til www.AVODART.com eller ring 1-888-825-5249.
Hva er ingrediensene i AVODART 0,5 mg?
Aktiv ingrediens: dutasterid.
Inaktive ingredienser: butylert hydroksytoluen, jern(III)oksid (gult), gelatin (fra sertifiserte BSE-frie storfekilder), glyserin, mono-di-glyserider av kaprylsyre/kaprinsyre, titandioksid og spiselig rødt blekk.
Hvordan virker AVODART?
Prostatavekst er forårsaket av et hormon i blodet kalt dihydrotestosteron (DHT). AVODART senker DHT-produksjonen i kroppen, noe som fører til krymping av den forstørrede prostata hos de fleste menn. Mens noen menn har færre problemer og symptomer etter 3 måneders behandling med AVODART, er en behandlingsperiode på minst 6 måneder vanligvis nødvendig for å se om AVODART 0,5 mg vil fungere for deg.
Denne pasientinformasjonen er godkjent av US Food and Drug Administration.
