Proscar 5mg Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Proscar 5mg og hvordan brukes det?
Proscar er en reseptbelagt medisin som brukes til å behandle symptomene på benign prostatahyperplasi og androgen alopecia. Dette legemidlet er kun til bruk hos menn. Proscar 5mg kan brukes alene eller sammen med andre medisiner.
Proscar tilhører en klasse legemidler som kalles 5-alfa-reduktasehemmere.
Det er ikke kjent om Proscar 5mg er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Proscar 5mg?
Proscar kan forårsake alvorlige bivirkninger, inkludert:
- . alvorlig eller vedvarende kvalme, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . brystklumper, . brystsmerter eller ømhet, . brystvorte utflod, og . andre brystforandringer
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Proscar inkluderer:
- . tap av interesse for sex, . maktesløshet, . problemer med å få orgasme, og . unormal utløsning
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Proscar. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
PROSCAR (finasteride), en syntetisk 4-azasteroidforbindelse, er en spesifikk hemmer av steroid Type II 5α-reduktase, et intracellulært enzym som omdanner androgenet testosteron til 5α-dihydrotestosteron (DHT).
Finasterid er 4-azaandrost-1-en-17-karboksamid, N-(1,1-dimetyletyl)-3-okso-,(5α,17ß)-. Den empiriske formelen til finasterid er C23H36N2O2 og dens molekylvekt er 372,55. Dens strukturformel er:
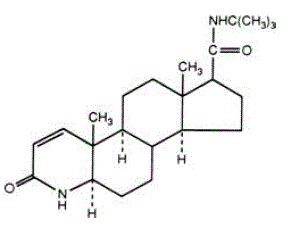
Finasteride er et hvitt krystallinsk pulver med et smeltepunkt nær 250°C. Det er fritt løselig i kloroform og i lavere alkohol løsemidler, men er praktisk talt uløselig i vann.
PROSCAR (finasterid) tabletter for oral administrering er filmdrasjerte tabletter som inneholder 5 mg finasterid og følgende inaktive ingredienser: vannholdig laktose, mikrokrystallinsk cellulose, pregelatinisert stivelse, natriumstivelsesglykolat, hydroksypropylcellulose LF, hydroksypropylmetylcellulose, titandioksid, magnesiumstearat , talkum, docusate natrium, FD&C Blue 2 aluminium lake og gult jernoksid.
INDIKASJONER
Monoterapi
PROSCAR® er indisert for behandling av symptomatisk benign prostatahyperplasi (BPH) hos menn med forstørret prostata til:
- . Forbedre symptomene . Reduser risikoen for akutt urinretensjon . Reduser risikoen for behov for kirurgi inkludert transuretral reseksjon av prostata (TURP) og prostatektomi.
Kombinasjon med Alpha-Blocker
PROSCAR 5mg administrert i kombinasjon med alfablokkeren doxazosin er indisert for å redusere risikoen for symptomatisk progresjon av BPH (en bekreftet ≥4 poeng økning i American Urological Association (AUA) symptomscore).
Bruksbegrensninger
PROSCAR er ikke godkjent for forebygging av prostatakreft.
DOSERING OG ADMINISTRASJON
PROSCAR kan administreres med eller uten måltider.
Monoterapi
Den anbefalte dosen av PROSCAR er én tablett (5 mg) tatt én gang daglig [se Kliniske studier ].
Kombinasjon med Alpha-Blocker
Den anbefalte dosen av PROSCAR er én tablett (5 mg) tatt en gang daglig i kombinasjon med alfablokkeren doxazosin [se Kliniske studier ].
HVORDAN LEVERES
Doseringsformer og styrker
5-mg blå, modifiserte epleformede, filmdrasjerte tabletter, med koden MSD 72 på den ene siden og PROSCAR 5mg på den andre.
Oppbevaring og håndtering
nr. 3094 - PROSCAR tabletter 5 mg er blå, modifiserte epleformede, filmdrasjerte tabletter, med koden MSD 72 på den ene siden og PROSCAR på den andre. De leveres som følger:
NDC 0006-0072-31 bruksenhetsflasker med 30 stk NDC 0006-0072-58 bruksenhetsflasker med 100 stk.
Oppbevaring og håndtering
Oppbevares ved romtemperatur under 30°C (86°F). Beskytt mot lys og hold beholderen tett lukket.
Kvinner bør ikke håndtere knuste eller ødelagte PROSCAR 5 mg tabletter når de er gravide eller potensielt kan være gravide på grunn av muligheten for absorpsjon av finasterid og den påfølgende potensielle risikoen for et mannlig foster [se ADVARSLER OG FORHOLDSREGLER  og Bruk i spesifikke populasjoner ].
Distribuert av: Merck Sharp & Dohme Corp., et datterselskap av MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revidert: juni 2021
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
4-års placebokontrollert studie (PLESS)
I PLESS ble 1524 pasienter behandlet med PROSCAR og 1516 pasienter behandlet med placebo evaluert for sikkerhet over en periode på 4 år. De hyppigst rapporterte bivirkningene var relatert til seksuell funksjon. 3,7 % (57 pasienter) behandlet med PROSCAR 5 mg og 2,1 % (32 pasienter) behandlet med placebo avbrøt behandlingen som følge av bivirkninger relatert til seksuell funksjon, som er de hyppigst rapporterte bivirkningene.
Tabell 1 viser de eneste kliniske bivirkningene som etterforskeren vurderer som mulig, sannsynligvis eller definitivt medikamentrelatert, og forekomsten av PROSCAR 5mg var ≥1 % og høyere enn placebo i løpet av de 4 årene av studien. I år 2-4 av studien var det ingen signifikant forskjell mellom behandlingsgruppene i forekomsten av impotens, nedsatt libido og ejakulasjonsforstyrrelser.
Fase III-studier og 5-års åpne utvidelser
Bivirkningsprofilen i de 1-årige, placebokontrollerte, fase III-studiene, de 5-årige åpne forlengelsene og PLESS var like.
Studie om medisinsk behandling av prostatasymptomer (MTOPS).
I MTOPS-studien ble 3047 menn med symptomatisk BPH randomisert til å få PROSCAR 5 mg/dag (n=768), doxazosin 4 eller 8 mg/dag (n=756), kombinasjonen av PROSCAR 5 mg/dag og doxazosin 4 eller 8 mg/dag (n=786), eller placebo (n=737) i 4 til 6 år. [Se en Kliniske studier .]
Forekomsten av legemiddelrelaterte bivirkninger rapportert av ≥2 % av pasientene i en hvilken som helst behandlingsgruppe i MTOPS-studien er oppført i tabell 2.
De individuelle bivirkningene som forekom hyppigere i kombinasjonsgruppen sammenlignet med begge legemidlene alene var: asteni, postural hypotensjon, perifert ødem, svimmelhet, redusert libido, rhinitt, unormal utløsning, impotens og unormal seksuell funksjon (se tabell 2). Av disse var forekomsten av unormal ejakulasjon hos pasienter som fikk kombinasjonsbehandling sammenlignbar med summen av forekomsten av denne uønskede erfaringen rapportert for de to monoterapiene.
Kombinasjonsbehandling med finasterid og doksazosin var assosiert med ingen ny klinisk bivirkningserfaring.
Fire pasienter i MTOPS rapporterte bivirkninger brystkreft. Tre av disse pasientene fikk kun finasterid og én fikk kombinasjonsbehandling. [Se en Langsiktige data .]
MTOPS-studien var ikke spesielt utviklet for å gjøre statistiske sammenligninger mellom grupper for rapporterte uønskede opplevelser. I tillegg kan direkte sammenligninger av sikkerhetsdata mellom MTOPS-studien og tidligere studier av enkeltmidlene ikke være hensiktsmessig basert på forskjeller i pasientpopulasjon, dosering eller doseregime og andre prosedyre- og studiedesignelementer.
Langsiktige data
Høygradig prostatakreft
PCPT-studien var en 7-årig randomisert, dobbeltblind, placebokontrollert studie som inkluderte 18 882 menn ≥55 år med en normal digital rektalundersøkelse og en PSA ≤3,0 ng/ml. Menn fikk enten PROSCAR (finasteride 5 mg) eller placebo daglig. Pasientene ble evaluert årlig med PSA og digitale rektale undersøkelser. Biopsier ble utført for forhøyet PSA, en unormal digital rektalundersøkelse eller slutten av studien. Forekomsten av Gleason score 8-10 prostatakreft var høyere hos menn behandlet med finasterid (1,8 %) enn hos de behandlet med placebo (1,1 %) [se INDIKASJONER  og ADVARSLER OG FORHOLDSREGLER ]. I en 4-årig placebokontrollert klinisk studie med en annen 5α-reduktasehemmer (dutasterid, AVODART), ble lignende resultater for Gleason score 8-10 prostatakreft observert (1 % dutasterid vs 0,5 % placebo).
Ingen klinisk fordel er vist hos pasienter med prostatakreft behandlet med PROSCAR.
Brystkreft
løpet av den 4-6-årige placebo- og komparatorkontrollerte MTOPS-studien som inkluderte 3047 menn, var det 4 tilfeller av brystkreft hos menn behandlet med finasterid, men ingen tilfeller hos menn som ikke ble behandlet med finasterid. I løpet av den 4-årige, placebokontrollerte PLESS-studien som inkluderte 3040 menn, var det 2 tilfeller av brystkreft hos placebobehandlede menn, men ingen tilfeller hos menn behandlet med finasterid. I løpet av den 7-årige placebokontrollerte prostatakreftforebyggingsstudien (PCPT) som inkluderte 18 882 menn, var det 1 tilfelle av brystkreft hos menn behandlet med finasterid, og 1 tilfelle av brystkreft hos menn behandlet med placebo. Forholdet mellom langvarig bruk av finasterid og mannlig brystneoplasi er foreløpig ukjent.
Seksuell funksjon
Det er ingen bevis for økte seksuelle bivirkninger med økt behandlingsvarighet med PROSCAR. Nye rapporter om legemiddelrelaterte seksuelle bivirkninger ble redusert med varigheten av behandlingen.
Postmarketing-erfaring
Følgende tilleggsbivirkninger er rapportert etter markedsføring med PROSCAR. Fordi disse hendelsene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering:
- . overfølsomhetsreaksjoner, som kløe, urticaria og angioødem (inkludert hevelser i lepper, tunge, svelg og ansikt) . testikkelsmerter . hematospermi . seksuell dysfunksjon som fortsatte etter seponering av behandlingen, inkludert erektil dysfunksjon, redusert libido og ejakulasjonsforstyrrelser (f.eks. redusert ejakulasjonsvolum). Disse hendelsene ble rapportert sjelden hos menn som tok PROSCAR for behandling av BPH. De fleste menn var eldre og tok samtidig medisiner og/eller hadde komorbide tilstander. Den uavhengige rollen til PROSCAR 5mg i disse hendelsene er ukjent. . mannlig infertilitet og/eller dårlig sædkvalitet ble rapportert sjelden hos menn som tok PROSCAR 5 mg for behandling av BPH. Normalisering eller forbedring av dårlig sædkvalitet er rapportert etter seponering av finasterid. Den uavhengige rollen til PROSCAR i disse hendelsene er ukjent. . depresjon . mannlig brystkreft.
Følgende tilleggsbivirkning relatert til seksuell dysfunksjon som fortsatte etter seponering av behandlingen er rapportert etter markedsføring med finasterid i lavere doser brukt til å behandle skallethet hos menn. Fordi hendelsen rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering:
- . orgasmeforstyrrelser
NARKOTIKAHANDEL
Cytochrome P450-Linked Drug Metabolizing Enzyme System
Ingen legemiddelinteraksjoner av klinisk betydning er identifisert. Finasterid ser ikke ut til å påvirke det cytokrom P450-koblede legemiddelmetaboliserende enzymsystemet. Forbindelser som har blitt testet på mennesker har inkludert antipyrin, digoksin, propranolol, teofyllin og warfarin, og ingen klinisk meningsfulle interaksjoner ble funnet.
Annen samtidig terapi
Selv om spesifikke interaksjonsstudier ikke ble utført, ble PROSCAR 5mg brukt samtidig i kliniske studier med paracetamol, acetylsalisylsyre, α-blokkere, angiotensin-konverterende enzym (ACE)-hemmere, analgetika, krampestillende midler, beta-adrenerge blokkere, diuretika, kalsium. kanalblokkere, hjertenitrater, HMG-CoA-reduktasehemmere, ikke-steroide antiinflammatoriske legemidler (NSAIDs), benzodiazepiner, H2Â-antagonister og kinolon-anti-infeksjonsmidler uten bevis for klinisk signifikante uønskede interaksjoner.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Effekter på prostataspesifikt antigen (PSA) og bruken av PSA ved påvisning av prostatakreft
kliniske studier reduserte PROSCAR serum-PSA-konsentrasjonen med ca. 50 % innen seks måneder etter behandling. Denne reduksjonen er forutsigbar over hele spekteret av PSA-verdier hos pasienter med symptomatisk BPH, selv om den kan variere fra individ til individ.
For tolkning av serielle PSA-er hos menn som tar PROSCAR, bør en ny PSA-baselinje etableres minst seks måneder etter behandlingsstart og PSA overvåkes med jevne mellomrom. Enhver bekreftet økning fra den laveste PSA-verdien mens du bruker PROSCAR 5mg kan signalisere tilstedeværelse av prostatakreft og bør evalueres, selv om PSA-nivåene fortsatt er innenfor normalområdet for menn som ikke tar en 5α-reduktasehemmer. Manglende overholdelse av PROSCAR-behandling kan også påvirke PSA-testresultatene. For å tolke en isolert PSA-verdi hos pasienter behandlet med PROSCAR 5mg i seks måneder eller mer, bør PSA-verdiene dobles for sammenligning med normalverdier hos ubehandlede menn. Disse justeringene bevarer nytten av PSA for å oppdage prostatakreft hos menn behandlet med PROSCAR.
PROSCAR kan også forårsake reduksjon i serum-PSA i nærvær av prostatakreft.
Forholdet mellom fri og total PSA (prosent fri PSA) forblir konstant selv under påvirkning av PROSCAR. Hvis klinikere velger å bruke prosent gratis PSA som et hjelpemiddel i påvisning av prostatakreft hos menn som gjennomgår finasteridbehandling, ser det ut til at det ikke er nødvendig med justering av verdien.
Økt risiko for høygradig prostatakreft
Menn på 55 år og over med normal digital rektalundersøkelse og PSA ≤3,0 ng/ml ved baseline som tok finasterid 5 mg/dag i den 7-årige prostatakreftforebyggingsstudien (PCPT) hadde en økt risiko for Gleason score 8-10 prostatakreft (finasterid 1,8 % vs placebo 1,1 %). [Se en INDIKASJONER  og BIVIRKNINGER .] Lignende resultater ble observert i en 4-årig placebokontrollert klinisk studie med en annen 5α-reduktasehemmer (dutasterid, AVODART) (1 % dutasterid vs. 0,5 % placebo). 5α-reduktasehemmere kan øke risikoen for utvikling av høygradig prostatakreft. Hvorvidt effekten av 5α-reduktasehemmere for å redusere prostatavolum, eller studierelaterte faktorer, påvirket resultatene av disse studiene har ikke blitt fastslått.
Eksponering av kvinner
Risiko for mannlig foster
PROSCAR er kontraindisert hos gravide kvinner og kvinner som potensielt kan være gravide og ikke indisert for bruk hos kvinner. Basert på dyrestudier og virkningsmekanismen, kan PROSCAR 5mg forårsake unormal utvikling av ytre kjønnsorganer hos et mannlig foster hvis det administreres til en gravid kvinne. Kvinner som er gravide eller potensielt kan være gravide, bør ikke håndtere knuste eller ødelagte PROSCAR 5mg tabletter. PROSCAR 5mg tabletter er belagt og vil forhindre kontakt med virkestoffet under normal håndtering, forutsatt at tablettene ikke er knust eller knust. Hvis en gravid kvinne kommer i kontakt med knuste eller ødelagte PROSCAR 5mg tabletter, bør kontaktområdet vaskes umiddelbart med såpe og vann. [Se en KONTRAINDIKASJONER ,EN Bruk i spesifikke populasjoner ,EN KLINISK FARMAKOLOGI , og HVORDAN LEVERES .]
Pediatriske pasienter og kvinner
PROSCAR er ikke indisert for bruk hos pediatriske pasienter [se Bruk i spesifikke populasjoner  og KLINISK FARMAKOLOGI ] eller kvinner [se også ADVARSLER OG FORHOLDSREGLER ,EN Bruk i spesifikke populasjoner ,EN KLINISK FARMAKOLOGI , og HVORDAN LEVERES ].
Effekt på sædegenskaper
Behandling med PROSCAR i 24 uker for å evaluere sædparametere hos friske mannlige frivillige viste ingen klinisk betydningsfulle effekter på spermkonsentrasjon, mobilitet, morfologi eller pH. En 0,6 ml (22,1 %) median reduksjon i ejakulatvolum med en samtidig reduksjon i total sperm per ejakulat ble observert. Disse parameterne holdt seg innenfor normalområdet og var reversible ved seponering av behandlingen med en gjennomsnittlig tid på 84 uker for å gå tilbake til baseline.
Betraktning av andre urologiske tilstander
Før behandling med PROSCAR 5mg startes, bør det tas hensyn til andre urologiske tilstander som kan forårsake lignende symptomer. I tillegg kan prostatakreft og BPH eksistere side om side.
Pasienter med stort gjenværende urinvolum og/eller sterkt redusert urinstrøm bør overvåkes nøye for obstruktiv uropati. Disse pasientene er kanskje ikke kandidater for finasteridbehandling.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Økt risiko for høygradig prostatakreft
Pasienter bør informeres om at det var en økning i høygradig prostatakreft hos menn behandlet med 5α-reduktasehemmere indisert for BPH-behandling, inkludert PROSCAR 5mg, sammenlignet med de som ble behandlet med placebo i studier som ser på bruken av disse legemidlene for å forebygge prostata. kreft [se INDIKASJONER ,EN ADVARSLER OG FORHOLDSREGLER , og BIVIRKNINGER ].
Eksponering av kvinner - risiko for mannlige foster
Leger bør informere pasienter om at kvinner som er gravide eller potensielt kan være gravide ikke bør håndtere knuste eller ødelagte PROSCAR-tabletter på grunn av muligheten for absorpsjon av finasterid og den påfølgende potensielle risikoen for det mannlige fosteret. PROSCAR tabletter er belagt og vil forhindre kontakt med virkestoffet under normal håndtering, forutsatt at tablettene ikke er knust eller knust. Hvis en kvinne som er gravid eller potensielt kan være gravid kommer i kontakt med knuste eller ødelagte PROSCAR-tabletter, bør kontaktområdet vaskes umiddelbart med såpe og vann [se KONTRAINDIKASJONER ,EN ADVARSLER OG FORHOLDSREGLER ,EN Bruk i spesifikke populasjoner  og HVORDAN LEVERES ].
Ytterligere instruksjoner
Leger bør informere pasienter om at volumet av ejakulat kan reduseres hos noen pasienter under behandling med PROSCAR. Denne reduksjonen ser ikke ut til å forstyrre normal seksuell funksjon. Imidlertid kan impotens og redusert libido forekomme hos pasienter behandlet med PROSCAR [se BIVIRKNINGER ].
Leger bør instruere sine pasienter om umiddelbart å rapportere eventuelle endringer i brystene som klumper, smerter eller utflod fra brystvorten. Brystforandringer inkludert brystforstørrelse, ømhet og neoplasmer er rapportert [se BIVIRKNINGER ].
Leger bør instruere pasientene sine om å lese pakningsvedlegget til pasienten før de starter behandling med PROSCAR 5mg og å lese det på nytt hver gang resepten fornyes, slik at de er klar over aktuell informasjon for pasienter angående PROSCAR.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Det ble ikke observert noen tegn på tumorigen effekt i en 24-måneders studie på Sprague-Dawley-rotter som fikk doser av finasterid på opptil 160 mg/kg/dag hos hanner og 320 mg/kg/dag hos hunner. Disse dosene ga respektive systemisk eksponering hos rotter på 111 og 274 ganger den som ble observert hos mennesker som fikk den anbefalte dosen til mennesker på 5 mg/dag. Alle eksponeringsberegninger var basert på beregnet AUC(0-24 timer) for dyr og gjennomsnittlig AUC(0-24 timer) for mennesker (0,4 μg•t/mL).
en 19-måneders karsinogenitetsstudie på CD-1-mus ble det observert en statistisk signifikant (p≤0,05) økning i forekomsten av testikkel-Leydig-celleadenomer ved 228 ganger eksponeringen hos mennesker (250 mg/kg/dag). Hos mus med 23 ganger den menneskelige eksponeringen, estimert (25 mg/kg/dag) og hos rotter ved 39 ganger den menneskelige eksponeringen (40 mg/kg/dag), ble det observert en økning i forekomsten av Leydig-cellehyperplasi. En positiv korrelasjon mellom de proliferative endringene i Leydig-cellene og en økning i serum-LH-nivåer (2 til 3 ganger over kontroll) er påvist hos begge gnagerartene behandlet med høye doser finasterid. Ingen legemiddelrelaterte Leydig-celleforandringer ble sett hos verken rotter eller hunder behandlet med finasterid i 1 år ved 30 og 350 ganger (henholdsvis 20 mg/kg/dag og 45 mg/kg/dag) eller hos mus behandlet i 19 måneder kl. 2,3 ganger den menneskelige eksponeringen, estimert (2,5 mg/kg/dag).
Mutagenese
Ingen tegn på mutagenisitet ble observert i en in vitro bakteriell mutageneseanalyse, en pattedyrcellemutageneseanalyse eller i en in vitro alkalisk elueringsanalyse. I en in vitro-kromosomavviksanalyse, ved bruk av eggstokkceller fra kinesisk hamster, var det en liten økning i kromosomavvik. Disse konsentrasjonene tilsvarer 4000-5000 ganger maksimale plasmanivåer hos mennesker gitt en total dose på 5 mg. I en in vivo-kromosomavviksanalyse hos mus ble det ikke observert noen behandlingsrelatert økning i kromosomavvik med finasterid ved den maksimalt tolererte dosen på 250 mg/kg/dag (228 ganger eksponeringen hos mennesker) som bestemt i karsinogenitetsstudiene.
Nedsatt fruktbarhet
Hos kjønnsmodne hannkaniner behandlet med finasterid ved 543 ganger den menneskelige eksponeringen (80 mg/kg/dag) i opptil 12 uker, ble det ikke sett noen effekt på fertilitet, spermantall eller ejakulatvolum. Hos kjønnsmodne hannrotter behandlet med 61 ganger human eksponering (80 mg/kg/dag), var det ingen signifikant effekt på fertiliteten etter 6 eller 12 ukers behandling; men når behandlingen ble fortsatt i opptil 24 eller 30 uker, var det en tilsynelatende reduksjon i fertilitet, fruktbarhet og en tilhørende signifikant reduksjon i vekten av sædblærene og prostata. Alle disse effektene var reversible innen 6 uker etter seponering av behandlingen. Ingen medikamentrelatert effekt på testikler eller på paringsytelse er sett hos rotter eller kaniner. Denne reduksjonen i fertilitet hos finasteridbehandlede rotter er sekundær til dens effekt på tilleggskjønnsorganer (prostata og sædblærer), noe som resulterer i manglende dannelse av sædpropp. Sædproppen er avgjørende for normal fertilitet hos rotter og er ikke relevant hos mennesker.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
PROSCAR er kontraindisert hos gravide kvinner og ikke indisert for bruk hos kvinner. Basert på dyrestudier og virkningsmekanismen, kan PROSCAR 5mg forårsake unormal utvikling av ytre kjønnsorganer hos et mannlig foster hvis det administreres til en gravid kvinne [se ADVARSLER OG FORHOLDSREGLER  og KLINISK FARMAKOLOGI ].
I en embryo-føtal utviklingsstudie på rotter, var det en doseavhengig økning i hypospadier som forekom hos 3,6 til 100 % av mannlige avkom av gravide rotter som ble administrert oralt finasterid i perioden med større organogenese i doser på omtrent 0,1 til 86 ganger maksimalt. anbefalt human dose (MRHD) på 5 mg/dag (basert på AUC ved dyredoser på 0,1 til 100 mg/kg/dag).
Redusert prostata- og sædvesikulære vekter, forsinket preputial separasjon og forbigående brystvorteutvikling ble også observert hos mannlige avkom ved orale maternelle doser omtrent 0,03 ganger MRHD (basert på AUC ved dyredose på 0,03 mg/kg/dag), sammen med redusert anogenital avstand. hos mannlige avkom ved orale maternelle doser omtrent 0,003 ganger MRHD (basert på AUC ved dyredose på 0,003 mg/kg/dag).
PROSCAR er en Type II 5α-reduktasehemmer som forhindrer omdannelse av testosteron til 5α-dihydrotestosteron (DHT), et hormon som er nødvendig for normal utvikling av mannlige kjønnsorganer. Hvis dette legemidlet brukes under graviditet, eller hvis pasienten blir gravid mens han tar dette legemidlet, bør pasienten informeres om den potensielle faren for det mannlige fosteret.
Unormal mannlig kjønnsutvikling er en forventet konsekvens når omdannelse av testosteron til 5α-dihydrotestosteron (DHT) hemmes av 5α-reduktasehemmere. Disse resultatene ligner de som er rapportert hos mannlige spedbarn med genetisk 5α-reduktasemangel. Kvinner kan bli utsatt for finasterid ved kontakt med knuste eller ødelagte PROSCAR-tabletter eller sæd fra en mannlig partner som tar PROSCAR. Når det gjelder finasterideksponering gjennom huden, er PROSCAR 5mg tabletter belagt og vil forhindre hudkontakt med finasterid under normal håndtering dersom tablettene ikke er knust eller ødelagt. Kvinner som er gravide eller potensielt kan være gravide bør ikke håndtere knuste eller ødelagte PROSCAR 5mg tabletter på grunn av mulig eksponering av et mannlig foster. Med hensyn til potensiell finasterideksponering gjennom sæd, er det utført tre studier som målte finasteridkonsentrasjoner i sæd hos menn som fikk PROSCAR 5 mg/dag. I disse studiene ble den høyeste mengden finasterid i sæd estimert til å være 50 til 100 ganger mindre enn dosen av finasterid (5 μg) som ikke hadde noen effekt på sirkulerende DHT-nivåer hos menn [se Data  og KLINISK FARMAKOLOGI ].
Data
Menneskelige data
2 studier av friske forsøkspersoner (n=69) som fikk PROSCAR 5 mg/dag i 6-24 uker, varierte finasteridkonsentrasjoner i sæd fra upåviselig ( KLINISK FARMAKOLOGI ].
Dyredata
en embryo-føtal utviklingsstudie fikk gravide rotter finasterid i perioden med større organogenese (drektighetsdager 6 til 17). Ved morsdoser av oralt finasterid ca. 0,1 til 86 ganger maksimal anbefalt human dose (MRHD) på 5 mg/dag (basert på AUC ved dyredoser på 0,1 til 100 mg/kg/dag) var det en doseavhengig økning i hypospadier som forekom hos 3,6 til 100 % av mannlige avkom. Eksponeringsmultipler ble estimert ved bruk av data fra ikke-gravide rotter. Dagene 16 til 17 av svangerskapet er en kritisk periode hos mannlige føtale rotter for differensiering av de ytre kjønnsorganene. Ved orale maternelle doser omtrent 0,03 ganger MRHD (basert på AUC ved dyredose på 0,03 mg/kg/dag), hadde mannlige avkom redusert prostata- og sædvesikulær vekt, forsinket preputial separasjon og forbigående brystvorteutvikling. Redusert anogenital avstand forekom hos hannavkom av drektige rotter som fikk omtrent 0,003 ganger MRHD (basert på AUC ved dyredose på 0,003 mg/kg/dag). Ingen abnormiteter ble observert hos kvinnelige avkom ved noen maternal dose av finasterid.
Ingen utviklingsavvik ble observert hos avkommet til ubehandlede hunner paret med finasteridbehandlede hannrotter som fikk omtrent 61 ganger MRHD (basert på AUC ved en dyredose på 80 mg/kg/dag). Noe redusert fertilitet ble observert hos hannavkom etter administrering av ca. 3 ganger MRHD (basert på AUC ved dyredose på 3 mg/kg/dag) til hunnrotter under sen drektighet og diegivning. Ingen effekter på fertilitet ble sett hos kvinnelige avkom under disse forholdene.
Ingen bevis på mannlige ytre genitale misdannelser eller andre abnormiteter ble observert hos kaninfostre eksponert for finasterid i perioden med større organogenese (drektighetsdager 6-18) ved orale doser opp til 100 mg/kg/dag hos mor, (finasterideksponeringsnivåer var ikke målt i kaniner). Imidlertid kan denne studien ikke ha inkludert den kritiske perioden for finasteride-effekter på utvikling av mannlige ytre kjønnsorganer hos kaninen.
Fostereffektene av maternal finasterideksponering i perioden med embryonal og fosterutvikling ble evaluert hos rhesusape (drektighetsdager 20-100), i en art og utviklingsperiode som er mer forutsigbar for spesifikke effekter hos mennesker enn studier på rotter og kaniner. Intravenøs administrering av finasterid til gravide aper i doser så høye som 800 ng/dag (estimert maksimal blodkonsentrasjon på 1,86 ng/mL eller omtrent 143 ganger den høyeste estimerte eksponeringen av gravide kvinner for finasterid fra sæd fra menn som tok 5 mg/dag) resulterte i ingen abnormiteter hos mannlige fostre. Som bekreftelse på relevansen av rhesus-modellen for utvikling av menneskelig foster, oral administrering av en dose finasterid (2 mg/kg/dag eller omtrent 18 000 ganger de høyeste estimerte blodnivåene av finasterid fra sæd fra menn som tar 5 mg/dag) til gravide aper resulterte i ytre genitale abnormiteter hos mannlige fostre. Ingen andre abnormiteter ble observert hos mannlige fostre og ingen finasterid-relaterte abnormiteter ble observert hos kvinnelige fostre ved noen dose.
Amming
Risikosammendrag
PROSCAR er ikke indisert for bruk hos kvinner.
Kvinner og menn med reproduktivt potensial
Infertilitet
Kvinner
PROSCAR er ikke indisert for bruk hos kvinner.
Hanner
Behandling med PROSCAR i 24 uker for å evaluere sædparametere hos friske mannlige frivillige viste ingen klinisk betydningsfulle effekter på spermkonsentrasjon, mobilitet, morfologi eller pH. En 0,6 ml (22,1 %) median reduksjon i ejakulatvolum med en samtidig reduksjon i total sperm per ejakulat ble observert. Disse parameterne holdt seg innenfor normalområdet og var reversible ved seponering av behandlingen med en gjennomsnittlig tid på 84 uker for å gå tilbake til baseline [se ADVARSLER OG FORHOLDSREGLER ].
Det har vært rapporter etter markedsføring om mannlig infertilitet og/eller dårlig sædkvalitet; normalisering eller forbedring av sædkvaliteten er rapportert etter seponering av finasterid [se BIVIRKNINGER ].
Pediatrisk bruk
PROSCAR 5mg er ikke indisert for bruk hos pediatriske pasienter.
Sikkerhet og effektivitet hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Av det totale antallet forsøkspersoner inkludert i PLESS, var 1480 og 105 forsøkspersoner henholdsvis 65 og over og 75 og over. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre pasienter, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Ingen dosejustering er nødvendig hos eldre [se KLINISK FARMAKOLOGI  og Kliniske studier ].
Nedsatt leverfunksjon
Forsiktighet bør utvises ved administrering av PROSCAR hos pasienter med leverfunksjonsavvik, da finasterid metaboliseres i stor grad i leveren [se KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
Ingen dosejustering er nødvendig hos pasienter med nedsatt nyrefunksjon [se KLINISK FARMAKOLOGI ].
OVERDOSE
Pasienter har fått enkeltdoser av PROSCAR 5 mg opptil 400 mg og flere doser PROSCAR 5 mg opptil 80 mg/dag i tre måneder uten bivirkninger. Inntil videre erfaring er oppnådd, kan ingen spesifikk behandling for en overdose med PROSCAR anbefales.
Signifikant dødelighet ble observert hos hann- og hunnmus ved orale enkeltdoser på 1500 mg/m2 (500 mg/kg) og hos hunn- og hannrotter ved orale enkeltdoser på 2360 mg/m2 (400 mg/kg) og 5900 mg/m2 (henholdsvis 1000 mg/kg).
KONTRAINDIKASJONER
PROSCAR er kontraindisert i følgende:
- . Overfølsomhet overfor noen komponent i denne medisinen. . Svangerskap. Bruk av Finasteride er kontraindisert hos kvinner når de er eller potensielt kan være gravide. På grunn av evnen til Type II 5α-reduktasehemmere til å hemme omdannelsen av testosteron til 5α-dihydrotestosteron (DHT), kan finasterid forårsake abnormiteter i de ytre kjønnsorganene til et mannlig foster til en gravid kvinne som får finasterid. Hvis dette legemidlet brukes under graviditet, eller hvis det oppstår graviditet mens du tar dette legemidlet, bør den gravide kvinnen informeres om den potensielle faren for det mannlige fosteret. [Se også ADVARSLER OG FORHOLDSREGLER ,EN Bruk i spesifikke populasjoner , og HVORDAN LEVERES .] Hos hunnrotter har lave doser finasterid administrert under svangerskapet gitt abnormiteter i de ytre kjønnsorganene hos mannlige avkom.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Utviklingen og forstørrelsen av prostatakjertelen er avhengig av det potente androgenet, 5α-dihydrotestosteron (DHT). Type II 5α-reduktase metaboliserer testosteron til DHT i prostatakjertelen, leveren og huden. DHT induserer androgene effekter ved å binde seg til androgenreseptorer i cellekjernene til disse organene.
Finasteride er en konkurrerende og spesifikk hemmer av Type II 5α-reduktase som det langsomt danner et stabilt enzymkompleks med. Omsetningen fra dette komplekset er ekstremt langsom (t½ ∼ 30 dager). Dette har blitt demonstrert både in vivo og in vitro. Finasteride har ingen affinitet for androgenreseptoren. Hos mennesker er de 5α-reduserte steroidmetabolittene i blod og urin redusert etter administrering av finasterid.
Farmakodynamikk
Hos mennesker gir en enkelt oral dose på 5 mg PROSCAR en rask reduksjon i serum-DHT-konsentrasjonen, med maksimal effekt observert 8 timer etter den første dosen. Undertrykkelsen av DHT opprettholdes gjennom hele 24-timers doseringsintervallet og med fortsatt behandling. Daglig dosering av PROSCAR med 5 mg/dag i opptil 4 år har vist seg å redusere serum-DHT-konsentrasjonen med ca. 70 %. Median sirkulasjonsnivå av testosteron økte med omtrent 10-20 %, men holdt seg innenfor det fysiologiske området. I en separat studie med friske menn behandlet med finasterid 1 mg per dag (n=82) eller placebo (n=69), økte gjennomsnittlige sirkulasjonsnivåer av testosteron og østradiol med omtrent 15 % sammenlignet med baseline, men disse holdt seg innenfor fysiologisk rekkevidde.
Hos pasienter som fikk PROSCAR 5 mg/dag, ble det observert økninger på ca. 10 % i luteiniserende hormon (LH) og follikkelstimulerende hormon (FSH), men nivåene holdt seg innenfor normalområdet. Hos friske frivillige endret ikke behandling med PROSCAR 5mg responsen til LH og FSH på gonadotropinfrigjørende hormon, noe som indikerer at hypothalamus-hypofyse-testikkelen ikke var påvirket.
Hos pasienter med BPH har PROSCAR ingen effekt på sirkulerende nivåer av kortisol, prolaktin, tyreoideastimulerende hormon eller tyroksin. Ingen klinisk betydningsfull effekt ble observert på plasmalipidprofilen (dvs. totalt kolesterol, lipoproteiner med lav tetthet, lipoproteiner med høy tetthet og triglyserider) eller benmineraltetthet.
Voksne menn med genetisk arvelig type II 5α-reduktase-mangel har også reduserte nivåer av DHT. Bortsett fra de assosierte urogenitale defektene som er tilstede ved fødselen, er ingen andre kliniske abnormiteter relatert til type II 5α-reduktase-mangel observert hos disse personene. Disse personene har en liten prostatakjertel gjennom hele livet og utvikler ikke BPH.
Hos pasienter med BPH behandlet med finasterid (1-100 mg/dag) i 7-10 dager før prostatektomi, ble det målt et omtrentlig 80 % lavere DHT-innhold i prostatavev fjernet ved operasjon, sammenlignet med placebo; Testosteronvevskonsentrasjonen ble økt opptil 10 ganger over nivåene før behandling, i forhold til placebo. Intraprostatisk innhold av PSA ble også redusert.
Hos friske mannlige frivillige behandlet med PROSCAR 5 mg i 14 dager, resulterte seponering av behandlingen i at DHT-nivåene gikk tilbake til nivåene før behandling i løpet av ca. 2 uker. Hos pasienter som ble behandlet i tre måneder, gikk prostatavolumet, som gikk ned med omtrent 20 %, tilbake til nær utgangsverdien etter omtrent tre måneders seponering av behandlingen.
Farmakokinetikk
Absorpsjon
I en studie av 15 friske unge forsøkspersoner var gjennomsnittlig biotilgjengelighet av finasterid 5 mg tabletter 63 % (område 34-108 %), basert på forholdet mellom arealet under kurven (AUC) i forhold til en intravenøs (IV) referansedose . Maksimal plasmakonsentrasjon av finasterid var i gjennomsnitt 37 ng/ml (område, 27-49 ng/ml) og ble nådd 1-2 timer etter dosering. Biotilgjengeligheten av finasterid ble ikke påvirket av mat.
Fordeling
Gjennomsnittlig steady-state distribusjonsvolum var 76 liter (område 44-96 liter). Omtrent 90 % av sirkulerende finasterid er bundet til plasmaproteiner. Det er en langsom akkumuleringsfase for finasterid etter gjentatt dosering. Etter dosering med 5 mg/dag finasterid i 17 dager var plasmakonsentrasjonen av finasterid 47 og 54 % høyere enn etter den første dosen hos menn 45-60 år (n=12) og ≥70 år (n=12) , henholdsvis. Gjennomsnittlig bunnkonsentrasjon etter 17 dagers dosering var henholdsvis 6,2 ng/ml (område 2,49,8 ng/ml) og 8,1 ng/ml (område 1,8-19,7 ng/ml), i de to aldersgruppene. Selv om steady state ikke ble nådd i denne studien, var gjennomsnittlig bunnplasmakonsentrasjon i en annen studie hos pasienter med BPH (gjennomsnittsalder 65 år) som fikk 5 mg/dag 9,4 ng/ml (område, 7,1-13,3 ng/ml; n= 22) etter over ett år med dosering.
Finasterid har vist seg å krysse blod-hjernebarrieren, men ser ikke ut til å fordele seg fortrinnsvis til CSF.
2 studier av friske forsøkspersoner (n=69) som fikk PROSCAR 5 mg/dag i 6-24 uker, varierte finasteridkonsentrasjoner i sæd fra upåviselig ( Bruk i spesifikke populasjoner ].
Metabolisme
Finasterid metaboliseres i stor grad i leveren, primært via cytokrom P450 3A4 enzymunderfamilien. To metabolitter, monohydroksylerte t-butylsidekjede- og monokarboksylsyremetabolitter, er identifisert som ikke har mer enn 20 % av den 5α-reduktasehemmende aktiviteten til finasterid.
Utskillelse
Hos friske unge forsøkspersoner (n=15) var gjennomsnittlig plasmaclearance av finasterid 165 ml/min (område, 70279 ml/min) og gjennomsnittlig eliminasjonshalveringstid i plasma var 6 timer (område, 3-16 timer). Etter en oral dose av 14C-finasterid hos mennesker (n=6), ble gjennomsnittlig 39 % (område 32-46 %) av dosen utskilt i urinen i form av metabolitter; 57 % (område, 51-64 %) ble skilt ut i avføringen.
Gjennomsnittlig terminal halveringstid for finasterid hos forsøkspersoner ≥70 år var omtrent 8 timer (område 6-15 timer; n=12), sammenlignet med 6 timer (område 4-12 timer; n=12) hos forsøkspersoner 45-60 år. Som et resultat var gjennomsnittlig AUC(0-24 timer) etter 17 dagers dosering 15 % høyere hos forsøkspersoner ≥70 år enn hos forsøkspersoner 45-60 år (p=0,02).
Pediatrisk
Finasterids farmakokinetikk er ikke undersøkt hos pasienter
Finasteride er ikke indisert for bruk hos pediatriske pasienter [se ADVARSLER OG FORHOLDSREGLER ,EN Bruk i spesifikke populasjoner ].
Kjønn
Finasteride er ikke indisert for bruk hos kvinner [se KONTRAINDIKASJONER ,EN ADVARSLER OG FORHOLDSREGLER ,EN Bruk i spesifikke populasjoner , og HVORDAN LEVERES ].
Geriatrisk
Ingen dosejustering er nødvendig hos eldre. Selv om eliminasjonshastigheten av finasterid er redusert hos eldre, er disse funnene uten klinisk betydning. [Se en Farmakokinetikk  og Bruk i spesifikke populasjoner .]
Løp
Effekten av rase på finasterids farmakokinetikk er ikke studert.
Nedsatt leverfunksjon
Effekten av nedsatt leverfunksjon på finasterids farmakokinetikk er ikke studert. Forsiktighet bør utvises ved administrering av PROSCAR 5mg hos pasienter med leverfunksjonsavvik, da finasterid metaboliseres i stor grad i leveren. Nedsatt nyrefunksjon
Ingen dosejustering er nødvendig hos pasienter med nedsatt nyrefunksjon. Hos pasienter med kronisk nedsatt nyrefunksjon, med kreatininclearance fra 9,0 til 55 ml/min, var AUC, maksimal plasmakonsentrasjon, halveringstid og proteinbinding etter en enkeltdose av 14C-finasterid lik verdiene oppnådd hos friske frivillige. Urinutskillelse av metabolitter ble redusert hos pasienter med nedsatt nyrefunksjon. Denne reduksjonen var assosiert med en økning i fekal utskillelse av metabolitter. Plasmakonsentrasjoner av metabolitter var signifikant høyere hos pasienter med nedsatt nyrefunksjon (basert på en 60 % økning i total radioaktivitet AUC). Finasterid har imidlertid blitt godt tolerert hos BPH-pasienter med normal nyrefunksjon som får opptil 80 mg/dag i 12 uker, hvor eksponeringen av disse pasientene for metabolitter antagelig vil være mye større.
Kliniske studier
Monoterapi
PROSCAR 5 mg/dag ble initialt evaluert hos pasienter med symptomer på BPH og forstørret prostata ved digital rektalundersøkelse i to 1-årige, placebokontrollerte, randomiserte, dobbeltblinde studier og deres 5-årige åpne forlengelser.
PROSCAR 5mg ble videre evaluert i PROSCAR Long-Term Efficacy and Safety Study (PLESS), en dobbeltblind, randomisert, placebokontrollert, 4-årig, multisenterstudie. 3040 pasienter mellom 45 og 78 år, med moderate til alvorlige symptomer på BPH og forstørret prostata ved digital rektalundersøkelse, ble randomisert til studien (1524 til finasterid, 1516 til placebo) og 3016 pasienter var evaluerbare for effekt. 1883 pasienter fullførte den 4-årige studien (1000 i finasteridgruppen, 883 i placebogruppen).
Effekt på symptomscore
Symptomene ble kvantifisert ved å bruke en skåre som ligner på American Urological Association Symptom Score, som evaluerte både obstruktive symptomer (forringelse av størrelse og kraft av strøm, følelse av ufullstendig blæretømming, forsinket eller avbrutt vannlating) og irritative symptomer (nokturi, dagtidsfrekvens, behov å belaste eller presse urinstrømmen) ved å rangere på en skala fra 0 til 5 for seks symptomer og en skala fra 0 til 4 for ett symptom, for en total mulig poengsum på 34.
Pasienter i PLESS hadde moderate til alvorlige symptomer ved baseline (gjennomsnitt på ca. 15 poeng på en 0-34 poengs skala). Pasienter randomisert til PROSCAR som forble på behandling i 4 år, hadde en gjennomsnittlig (± 1 SD) reduksjon i symptomscore på 3,3 (± 5,8) poeng sammenlignet med 1,3 (± 5,6) poeng i placebogruppen. (Se figur 1.) En statistisk signifikant forbedring i symptomscore var tydelig etter 1 år hos pasienter behandlet med PROSCAR vs. placebo (-2,3 vs. -1,6), og denne forbedringen fortsatte gjennom år 4.
Figur 1 Symptomscore i PLESS
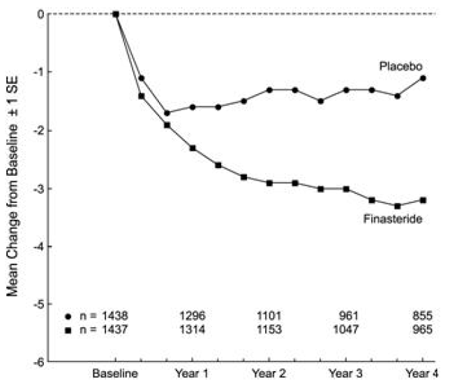
Resultatene sett i tidligere studier var sammenlignbare med de som ble sett i PLESS. Selv om det ble sett en tidlig bedring i urinsymptomer hos noen pasienter, var det vanligvis nødvendig med en terapeutisk utprøving på minst 6 måneder for å vurdere om en gunstig respons på symptomlindring var oppnådd. Forbedringen i BPH-symptomer ble sett i løpet av det første året og opprettholdt gjennom ytterligere 5 år med åpne forlengelsesstudier.
Effekt på akutt urinretensjon og behov for kirurgi
PLESS ble effekten også vurdert ved å evaluere behandlingssvikt. Behandlingssvikt ble prospektivt definert som BPH-relaterte urologiske hendelser eller klinisk forverring, mangel på bedring og/eller behov for alternativ behandling. BPH-relaterte urologiske hendelser ble definert som urologisk kirurgisk inngrep og akutt urinretensjon som krever kateterisering. Fullstendig hendelsesinformasjon var tilgjengelig for 92 % av pasientene. Følgende tabell (tabell 5) oppsummerer resultatene.
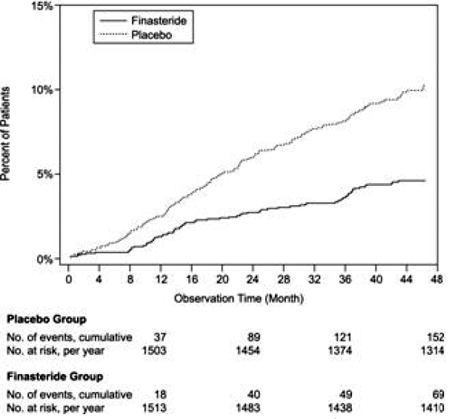
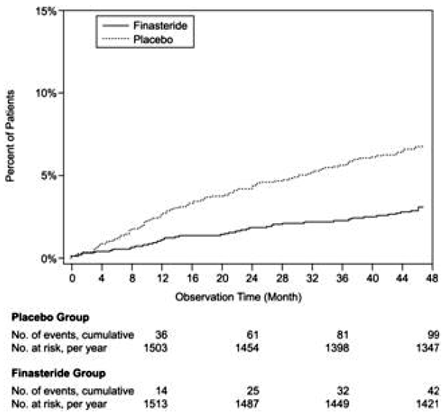
Sammenlignet med placebo var PROSCAR assosiert med en signifikant lavere risiko for akutt urinretensjon eller behov for BPH-relatert kirurgi [13,2 % for placebo vs 6,6 % for PROSCAR; 51 % reduksjon i risiko, 95 % KI: (34 til 63 %)]. Sammenlignet med placebo var PROSCAR 5 mg assosiert med en signifikant lavere risiko for kirurgi [10,1 % for placebo mot 4,6 % for PROSCAR; 55 % reduksjon i risiko, 95 % KI: (37 til 68 %)] og med en signifikant lavere risiko for akutt urinretensjon [6,6 % for placebo vs 2,8 % for PROSCAR; 57 % reduksjon i risiko, 95 % KI: (34 til 72 %)]; se figur 2 og 3.
Figur 2 Prosent av pasienter som har blitt operert for BPH, inkludert TURP
Figur 3 Prosent av pasienter som utvikler akutt urinretensjon (spontan og utfelt)
Effekt på maksimal urinstrøm
Hos pasientene i PLESS som forble på behandling under studiens varighet og hadde evaluerbare urinstrømsdata, økte PROSCAR 5 mg maksimal urinstrømshastighet med 1,9 mL/sek sammenlignet med 0,2 mL/sek i placebogruppen.
Det var en klar forskjell mellom behandlingsgruppene i maksimal urinstrømshastighet til fordel for PROSCAR 5 mg innen 4. måned (1,0 vs 0,3 ml/sek), som ble opprettholdt gjennom hele studien. I de tidligere 1-årsstudiene var økningen i maksimal urinstrømshastighet sammenlignbar med PLESS og ble opprettholdt gjennom det første året og gjennom ytterligere 5 år med åpne forlengelsesstudier.
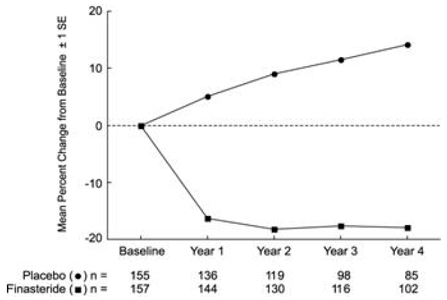
Effekt på prostatavolum
PLESS ble prostatavolum vurdert årlig ved magnetisk resonanstomografi (MRI) hos en undergruppe av pasienter. Hos pasienter behandlet med PROSCAR 5mg som forble på behandling, ble prostatavolumet redusert sammenlignet med både baseline og placebo gjennom den 4-årige studien. PROSCAR reduserte prostatavolumet med 17,9 % (fra 55,9 cc ved baseline til 45,8 cc ved 4 år) sammenlignet med en økning på 14,1 % (fra 51,3 cc til 58,5 cc) i placebogruppen (p
Resultatene sett i tidligere studier var sammenlignbare med de som ble sett i PLESS. Gjennomsnittlig prostatavolum ved baseline varierte mellom 40-50 cc. Reduksjonen i prostatavolum ble sett i løpet av det første året og opprettholdt gjennom ytterligere fem år med åpne forlengelsesstudier.
Figur 4 Prostatavolum i PLESS
Prostatavolum som en prediktor for terapeutisk respons
En metaanalyse som kombinerte 1-års data fra syv dobbeltblindede, placebokontrollerte studier av lignende design, inkludert 4491 pasienter med symptomatisk BPH, viste at hos pasienter behandlet med PROSCAR, størrelsen på symptomresponsen og graden av forbedring i maksimum urinstrømningshastigheten var høyere hos pasienter med forstørret prostata ved baseline.
Kombinasjon med alfablokkerterapi
The Medical Therapy of Prostatic Symptoms (MTOPS)-studien var en dobbeltblind, randomisert, placebokontrollert, multisenter, 4- til 6-årig studie (gjennomsnittlig 5 år) med 3047 menn med symptomatisk BPH, som ble randomisert til å motta PROSCAR 5 mg/dag (n=768), doxazosin 4 eller 8 mg/dag (n=756), kombinasjonen av PROSCAR 5 mg/dag og doxazosin 4 eller 8 mg/dag (n=786), eller placebo (n=737 ). Alle deltakerne gjennomgikk ukentlig titrering av doxazosin (eller placebo) fra 1 til 2 til 4 til 8 mg/dag. Bare de som tolererte dosenivået på 4 eller 8 mg ble holdt på doxazosin (eller dets placebo) i studien. Deltakerens endelige tolererte dose (enten 4 mg eller 8 mg) ble administrert fra slutten av uke 4. Den endelige doxazosin-dosen ble administrert én gang per dag, ved sengetid.
Gjennomsnittlig pasientalder ved randomisering var 62,6 år (±7,3 år). Pasientene var kaukasiske (82 %), afroamerikanske (9 %), latinamerikanske (7 %), asiatiske (1 %) eller indianere (
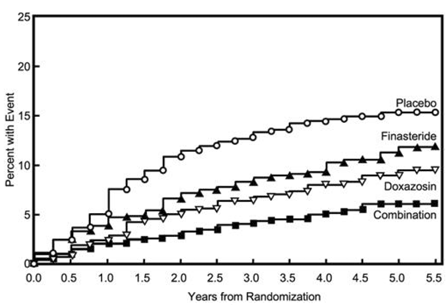
Det primære endepunktet var et sammensatt mål på den første forekomsten av noen av følgende fem utfall: en ≥4 poeng bekreftet økning fra baseline i symptomskåre, akutt urinretensjon, BPH-relatert nyreinsuffisiens (kreatininøkning), tilbakevendende urinveisinfeksjoner eller urosepsis eller inkontinens. Sammenlignet med placebo, resulterte behandling med PROSCAR 5mg, doxazosin eller kombinasjonsbehandling i en reduksjon i risikoen for å oppleve en av disse fem utfallshendelsene med 34 % (p=0,002), 39 % (p
Flertallet av hendelsene (274 av 351; 78 %) var en bekreftet ≥4 poeng økning i symptomscore, referert til som symptomscoreprogresjon. Risikoen for symptomskårprogresjon ble redusert med 30 % (p=0,016), 46 % (p
Figur 5 Kumulativ forekomst av en 4-punkts økning i AUA-symptompoeng etter behandlingsgruppe
Behandling med PROSCAR 5mg, doxazosin eller kombinasjonen av PROSCAR med doxazosin, reduserte gjennomsnittlig symptomskår fra baseline ved år 4. Tabell 7 viser gjennomsnittlig endring fra baseline for AUA symptomscore etter behandlingsgruppe for pasienter som forble på behandling i fire år.
Resultatene av MTOPS er i samsvar med funnene fra den 4-årige, placebokontrollerte studien PLESS [se Monoterapi ] ved at behandling med PROSCAR reduserer risikoen for akutt urinretensjon og behovet for BPH-relatert kirurgi. Ved MTOPS ble risikoen for å utvikle akutt urinretensjon redusert med 67 % hos pasienter behandlet med PROSCAR sammenlignet med pasienter behandlet med placebo (0,8 % for PROSCAR og 2,4 % for placebo). Risikoen for å kreve BPH-relatert invasiv terapi ble også redusert med 64 % hos pasienter behandlet med PROSCAR sammenlignet med pasienter behandlet med placebo (2,0 % for PROSCAR 5 mg og 5,4 % for placebo).
Sammendrag av kliniske studier
Dataene fra disse studiene, som viser bedring i BPH-relaterte symptomer, reduksjon i behandlingssvikt (BPH-relaterte urologiske hendelser), økte maksimale urinstrømningshastigheter og redusert prostatavolum, tyder på at PROSCAR stopper sykdomsprosessen til BPH hos menn med en forstørret prostata.
PASIENTINFORMASJON
Ingen informasjon gitt. Vennligst referer til ADVARSLER OG FORHOLDSREGLER seksjon.
