Zanaflex 2mg, 4mg Tizanidine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Zanaflex 2mg og hvordan brukes det?
Zanaflex 2mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på muskelstivhet (spastisitet) forbundet med tilstander som cerebral parese eller andre nevrologiske lidelser. Zanaflex 2mg kan brukes alene eller sammen med andre medisiner.
Zanaflex 2mg tilhører en klasse legemidler som kalles Central Alpha-2-Adrenerge agonister.
Det er ikke kjent om Zanaflex er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Zanaflex?
Zanaflex 2mg kan forårsake alvorlige bivirkninger inkludert:
- . lavt blodtrykk, . unormale leverfunksjonstester, . døsighet, . hallusinasjoner, . overdreven døsighet, . langsom hjerterytme, . tørr i munnen, . tretthet, og . svakhet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Zanaflex inkluderer:
- . tørr i munnen, . tretthet, . svakhet, . utmattelse, . tretthet, . svimmelhet, . urinveisinfeksjon, . forstoppelse, . unormale leverfunksjonstester, . oppkast, . taleforstyrrelse, . lat øye (amblyopi), . urinfrekvens, . influensasymptomer, . ukontrollerte muskelbevegelser, . nervøsitet, . sår hals, og . rennende nese
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Zanaflex. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
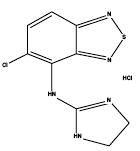
Zanaflex® (tizanidinhydroklorid) er en sentral alfa2-adrenerg agonist. Tizanidine HCl er et hvitt til off-white, fint krystallinsk pulver, som er luktfritt eller med en svak karakteristisk lukt. Tizanidin er lett løselig i vann og metanol; løseligheten i vann avtar når pH øker. Dets kjemiske navn er 5-klor-4-(2-imidazolin-2-ylamino)-2,1,3-benzotiadiazol monohydroklorid. Tizanidins molekylformel er C9H8ClN5S-HCl, dens molekylvekt er 290,2 og dens strukturformel er:
Zanaflex 4mg Capsules® leveres som 2, 4 og 6 mg kapsler for oral administrering. Zanaflex Capsules® inneholder den aktive ingrediensen, tizanidinhydroklorid (2,29 mg tilsvarende 2 mg tizanidinbase, 4,58 mg tilsvarende 4 mg tizanidinbase, og 6,87 mg tilsvarende 6 mg tizanidinbase), og de inaktive ingrediensene, hypromellose, silisiumdioksid sukkerkuler, titandioksid, gelatin og fargestoffer.
Zanaflex® tabletter leveres som 4 mg tabletter for oral administrering. Zanaflex® tabletter inneholder den aktive ingrediensen, tizanidinhydroklorid (4,58 mg tilsvarende 4 mg tizanidinbase), og de inaktive ingrediensene, kolloidalt silisiumdioksyd, stearinsyre, mikrokrystallinsk cellulose og vannfri laktose.
INDIKASJONER
Zanaflex er indisert for behandling av spastisitet. På grunn av den korte varigheten av terapeutisk effekt, bør behandling med Zanaflex reserveres til de daglige aktivitetene og tidspunktene da lindring av spastisitet er viktigst [se DOSERING OG ADMINISTRASJON ].
DOSERING OG ADMINISTRASJON
Doseringsinformasjon
Zanaflex 2mg Capsules® eller Zanaflex® tabletter kan forskrives med eller uten mat. Når formuleringen er valgt og beslutningen om å ta med eller uten mat er tatt, bør ikke dette regimet endres.
Mat har komplekse effekter på tizanidins farmakokinetikk, som varierer med de forskjellige formuleringene. Zanaflex kapsler og Zanaflex tabletter er bioekvivalente med hverandre under fastende forhold (mer enn 3 timer etter et måltid), men ikke under matforhold (innen 30 minutter etter et måltid). Disse farmakokinetiske forskjellene kan resultere i klinisk signifikante forskjeller når du bytter administrering av tabletter og kapsler og når du bytter administrering mellom matet eller fastende tilstand. Disse endringene kan resultere i økte uønskede hendelser, eller forsinket eller raskere aktivitetsstart, avhengig av byttets natur. Av denne grunn bør forskriveren være grundig kjent med endringene i kinetikk forbundet med disse forskjellige tilstandene [se KLINISK FARMAKOLOGI ].
Anbefalt startdose er 2 mg. Fordi effekten av Zanaflex topper seg ca. 1 til 2 timer etter dose og forsvinner mellom 3 til 6 timer etter dose, kan behandlingen gjentas med 6 til 8 timers intervaller etter behov, til maksimalt tre doser i løpet av 24 timer.
Doseringen kan økes gradvis med 2 mg til 4 mg ved hver dose, med 1 til 4 dager mellom doseøkningene, inntil en tilfredsstillende reduksjon av muskeltonus oppnås. Den totale daglige dosen bør ikke overstige 36 mg. Enkeltdoser større enn 16 mg er ikke undersøkt.
Dosering hos pasienter med nedsatt nyrefunksjon
Zanaflex bør brukes med forsiktighet hos pasienter med nyreinsuffisiens (kreatininclearance ADVARSLER OG FORHOLDSREGLER ].
Dosering hos pasienter med nedsatt leverfunksjon
Zanaflex 4mg bør brukes med forsiktighet hos pasienter med nedsatt leverfunksjon. Hos disse pasientene bør de individuelle dosene reduseres under titrering. Hvis høyere doser er nødvendig, bør individuelle doser økes i stedet for doseringsfrekvensen. Overvåking av aminotransferasenivåer anbefales for baseline og 1 måned etter at maksimal dose er oppnådd, eller hvis det er mistanke om leverskade [se Bruk i spesifikke populasjoner ].
Seponering av medikamenter
Hvis behandlingen må avbrytes, spesielt hos pasienter som har fått høye doser (20 mg til 36 mg daglig) i lange perioder (9 uker eller mer) eller som kan være på samtidig behandling med narkotika, bør dosen reduseres sakte ( 2 mg til 4 mg per dag) for å minimere risikoen for abstinens og rebound hypertensjon, takykardi og hypertoni [se Narkotikamisbruk og avhengighet ].
HVORDAN LEVERES
Doseringsformer og styrker
Kapsler
mg: Lyseblå ugjennomsiktig kropp med en lyseblå ugjennomsiktig hette med "2 MG" trykt på hetten 4 mg: Hvit ugjennomsiktig kropp med blå ugjennomsiktig hette med "4 MG" trykt på hetten 6 mg: Blå ugjennomsiktig kropp med en hvit stripe og blå ugjennomsiktig hette med "6 MG" trykt på hetten
Nettbrett
4 mg hvite, ikke-drasjerte tabletter med firkantede deler på den ene siden og merket med "A594" på den andre siden
Oppbevaring og håndtering
Zanaflex Capsules®
Zanaflex Capsules® (tizanidinhydroklorid) kapsler er tilgjengelig i tre styrker som todelte harde gelatinkapsler som inneholder tizanidinhydroklorid 2,29 mg, 4,58 mg og 6,87 mg, tilsvarende 2 mg, 4 mg og 6 mg tizanidinbase.
2 mg kapslene har en lyseblå ugjennomsiktig kropp med en lyseblå ugjennomsiktig hette med "2 MG" trykt på korken: flasker med 150 kapsler ( NDC 70515-602-15)
4 mg kapslene har en hvit ugjennomsiktig kropp med en blå ugjennomsiktig hette med "4 MG" trykt på korken: flasker med 150 kapsler ( NDC 70515-604-15)
mg kapslene har en blå ugjennomsiktig kropp med en hvit stripe og blå ugjennomsiktig hette med "6 MG" trykt på kapslene: flasker med 150 kapsler ( NDC 70515-606-15)
Oppbevares ved 25°C (77°F); utflukter tillatt til 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ]. Dispenser i beholdere med barnesikret lukking.
Zanaflex® tabletter
Zanaflex® (tizanidinhydroklorid) tabletter er tilgjengelige som 4 mg hvite, ikke-drasjerte tabletter som inneholder tizanidinhydroklorid 4,58 mg, tilsvarende 4 mg tizanidinbase. Tablettene har firkantede deler på den ene siden og er merket med "A594" på den andre siden. Tabletter leveres som følger: flasker med 150 tabletter (NDC 70515-594-15).
Oppbevares ved 25°C (77°F); utflukter tillatt til 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ].
Dispenser i beholdere med barnesikret lukking.
Produsert for: Covis Pharma Zug, 6300 Sveits. Revidert: desember 2020
BIVIRKNINGER
Følgende bivirkninger er beskrevet andre steder i andre deler av forskrivningsinformasjonen:
- . Hypotensjon [se ADVARSLER OG FORHOLDSREGLER ] . Leverskade [se ADVARSLER OG FORHOLDSREGLER ] . Sedasjon [se ADVARSLER OG FORHOLDSREGLER ] . Hallusinose/psykotisk-lignende symptomer [se ADVARSLER OG FORHOLDSREGLER ] . Overfølsomhetsreaksjoner [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier er utført under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
Tre dobbeltblinde, randomiserte, placebokontrollerte kliniske studier ble utført for å evaluere effekten av tizanidin på spastisitetskontroll. To studier ble utført på pasienter med multippel sklerose og en på pasienter med ryggmargsskade. Hver studie hadde en 13-ukers aktiv behandlingsperiode som inkluderte en 3-ukers titreringsfase til maksimal tolerert dose opp til 36 mg/dag i tre delte doser, en 9-ukers platåfase hvor dosen av tizanidin ble holdt konstant og en 1 ukes dosenedtrapping. I alt fikk 264 pasienter tizanidin og 261 pasienter fikk placebo. På tvers av de tre studiene varierte pasientalder fra 15-69 år og 51,4 prosent var kvinner. Mediandosen under platåfasen varierte fra 20-28 mg/dag.
De hyppigste bivirkningene rapportert i flerdose, placebokontrollerte kliniske studier med 264 pasienter med spastisitet var munntørrhet, søvnighet/sedasjon, asteni (svakhet, tretthet og/eller tretthet) og svimmelhet. Tre fjerdedeler av pasientene vurderte hendelsene som milde til moderate og en fjerdedel av pasientene vurderte hendelsene som alvorlige. Disse hendelsene så ut til å være doserelaterte.
Tabell 1 viser tegn og symptomer som ble rapportert hos mer enn 2 % av pasientene i tre flerdose, placebokontrollerte studier som fikk Zanaflex der frekvensen i Zanaflex-gruppen var høyere enn placebogruppen. For sammenligningsformål er den tilsvarende frekvensen av hendelsen (per 100 pasienter) blant placebobehandlede pasienter også oppgitt.
I en enkeltdose, placebokontrollert studie som involverte 142 pasienter med spastisitet på grunn av multippel sklerose (studie 1) [se Kliniske studier ], ble pasientene spesifikt spurt om de hadde opplevd noen av de fire vanligste bivirkningene: munntørrhet, somnolens (døsighet), asteni (svakhet, tretthet og/eller tretthet) og svimmelhet. I tillegg ble hypotensjon og bradykardi observert. Forekomsten av disse reaksjonene er oppsummert i tabell 2. Andre hendelser ble generelt rapportert med en hastighet på 2 % eller mindre.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av Zanaflex etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Visse hendelser, som somnolens, munntørrhet, hypotensjon, redusert blodtrykk, bradykardi, svimmelhet, svakhet eller asteni, muskelspasmer, hallusinasjoner, tretthet, unormale leverfunksjonsprøver og levertoksisitet, har blitt observert etter markedsføring og kliniske studier og er diskutert. i tidligere deler av dette dokumentet.
Følgende bivirkninger har blitt identifisert som forekommende etter markedsføring av Zanaflex. Basert på informasjonen som er gitt om disse reaksjonene, kan en årsakssammenheng med Zanaflex ikke helt utelukkes. Hendelsene er oppført i rekkefølge etter avtagende klinisk betydning; alvorlighetsgraden i postmarkedsføringsinnstillingen rapporteres ikke.
- . Stevens Johnson syndrom . Anafylaktisk reaksjon . Eksfoliativ dermatitt . Ventrikulær takykardi . Hepatitt . Kramper . Depresjon . Artralgi . Parestesi . Utslett . Tremor
NARKOTIKAHANDEL
Fluvoxamin
Samtidig bruk av fluvoksamin og Zanaflex 4mg er kontraindisert. Endringer i farmakokinetikken til tizanidin når det ble administrert sammen med fluvoksamin resulterte i signifikant redusert blodtrykk, økt døsighet og økt psykomotorisk svekkelse [se KONTRAINDIKASJONER og KLINISK FARMAKOLOGI ].
Ciprofloksacin
Samtidig bruk av ciprofloksacin og Zanaflex er kontraindisert. Endringer i farmakokinetikken til tizanidin når det ble administrert sammen med ciprofloksacin resulterte i signifikant redusert blodtrykk, økt døsighet og økt psykomotorisk svekkelse [se KONTRAINDIKASJONER og KLINISK FARMAKOLOGI ].
Andre CYP1A2-hemmere enn fluvoxamin og ciprofloksacin
På grunn av potensielle legemiddelinteraksjoner, samtidig bruk av Zanaflex med andre CYP1A2-hemmere, slik som zileuton, andre fluorokinoloner enn sterke CYP1A2-hemmere (som er kontraindisert), antiarytmika (amiodaron, mexiletin, propafenon og verapamil, prevensjonsmiddel, orale prevensjonsmidler) acyclovir og tiklopidin) bør unngås. Hvis bruken er klinisk nødvendig, bør behandlingen startes med 2 mg dose og økes i trinn på 2-4 mg daglig basert på pasientens respons på behandlingen. Hvis bivirkninger som hypotensjon, bradykardi eller overdreven døsighet oppstår, reduser eller avbryt Zanaflex-behandlingen [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Orale prevensjonsmidler
Samtidig bruk av Zanaflex 2mg og orale prevensjonsmidler anbefales ikke. Imidlertid, hvis samtidig bruk er klinisk nødvendig, initier Zanaflex 4 mg med en enkeltdose på 2 mg og øk i trinn på 2-4 mg daglig basert på pasientens respons på behandlingen. Hvis bivirkninger som hypotensjon, bradykardi eller overdreven døsighet oppstår, reduser eller avbryt Zanaflex-behandlingen [se KLINISK FARMAKOLOGI ].
Alkohol
Alkohol øker den totale mengden medikament i blodet etter en dose av Zanaflex. Dette var assosiert med en økning i bivirkninger av Zanaflex. De CNS-dempende effektene av Zanaflex og alkohol er additive [se KLINISK FARMAKOLOGI ].
Andre CNS-depressiva
De beroligende effektene av Zanaflex med CNS-depressiva (f.eks. benzodiazepiner, opioider, trisykliske antidepressiva) kan være additive. Overvåk pasienter som tar Zanaflex 2mg med et annet CNS-dempende middel for symptomer på overdreven sedasjon [se KLINISK FARMAKOLOGI ].
α2-adrenerge agonister
Fordi hypotensive effekter kan være kumulative, anbefales det ikke at Zanaflex 4mg brukes sammen med andre α2-adrenerge agonister [se ADVARSLER OG FORHOLDSREGLER ].
Narkotikamisbruk og avhengighet
Misbruke
Misbrukspotensialet ble ikke evaluert i studier på mennesker. Rotter var i stand til å skille tizanidin fra saltvann i et standard diskrimineringsparadigme, etter trening, men klarte ikke å generalisere effekten av morfin, kokain, diazepam eller fenobarbital til tizanidin.
Avhengighet
Tizanidin er nært beslektet med klonidin, som ofte misbrukes i kombinasjon med narkotika og er kjent for å forårsake symptomer på tilbakefall ved brå abstinenser. Tre tilfeller av rebound-symptomer ved plutselig seponering av tizanidin er rapportert. Saksrapportene tyder på at disse pasientene også misbrukte narkotika. Abstinenssymptomer inkluderte hypertensjon, takykardi, hypertoni, skjelving og angst. Det er mer sannsynlig at abstinenssymptomer oppstår i tilfeller der høye doser brukes, spesielt i lengre perioder, eller ved samtidig bruk av narkotika. Hvis behandlingen må avbrytes, bør dosen reduseres sakte for å minimere risikoen for abstinenssymptomer [se DOSERING OG ADMINISTRASJON ].
Aper ble vist å selv-administrere tizanidin på en doseavhengig måte, og brå seponering av tizanidin ga forbigående tegn på abstinens ved doser > 35 ganger maksimal anbefalt human dose på mg/m²-basis. Disse forbigående abstinenstegnene (økt bevegelse, rykninger i kroppen og aversiv oppførsel mot observatøren) ble ikke reversert ved administrering av nalokson.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Hypotensjon
Tizanidin er en α2-adrenerg agonist som kan gi hypotensjon. Synkope har blitt rapportert i postmarketing-innstillingen. Sjansen for betydelig hypotensjon kan muligens reduseres ved titrering av dosen og ved å fokusere oppmerksomheten på tegn og symptomer på hypotensjon før doseøkning. I tillegg kan pasienter som beveger seg fra liggende til fast oppreist stilling ha økt risiko for hypotensjon og ortostatiske effekter.
Overvåk for hypotensjon når Zanaflex brukes hos pasienter som samtidig får antihypertensiv behandling. Det anbefales ikke at Zanaflex 2mg brukes sammen med andre α2-adrenerge agonister. Klinisk signifikant hypotensjon (reduksjon i både systolisk og diastolisk trykk) er rapportert ved samtidig administrering av enten fluvoksamin eller ciprofloksacin og enkeltdoser på 4 mg Zanaflex. Derfor er samtidig bruk av Zanaflex og fluvoksamin eller med ciprofloksacin, potente hemmere av CYP1A2, kontraindisert [se KONTRAINDIKASJONER og NARKOTIKAHANDEL ].
Risiko for leverskade
Zanaflex kan forårsake hepatocellulær leverskade. Zanaflex 4mg bør brukes med forsiktighet hos pasienter med nedsatt leverfunksjon. Overvåking av aminotransferasenivåer anbefales for baseline og 1 måned etter at maksimal dose er oppnådd, eller hvis det er mistanke om leverskade [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Sedasjon
Zanaflex kan forårsake sedasjon, som kan forstyrre daglig aktivitet. I studiene med flere doser toppet forekomsten av pasienter med sedasjon seg etter den første uken med titrering og forble deretter stabil under vedlikeholdsfasen av studien. De CNS-dempende effektene av Zanaflex med alkohol og andre CNS-depressiva (f.eks. benzodiazepiner, opioider, trisykliske antidepressiva) kan være additive. Overvåk pasienter som tar Zanaflex 4mg med et annet CNS-dempende middel for symptomer på overdreven sedasjon [se NARKOTIKAHANDEL ].

Hallusinose/psykotisk-lignende symptomer
Zanaflex 4mg bruk har vært assosiert med hallusinasjoner. Dannede, visuelle hallusinasjoner eller vrangforestillinger er rapportert hos 5 av 170 pasienter (3 %) i to nordamerikanske kontrollerte kliniske studier. De fleste av pasientene var klar over at hendelsene var uvirkelige. En pasient utviklet psykose i forbindelse med hallusinasjonene. En pasient av disse 5 fortsatte å ha problemer i minst 2 uker etter seponering av tizanidin. Vurder å seponere Zanaflex hos pasienter som utvikler hallusinasjoner.
Interaksjon med CYP1A2-hemmere
På grunn av potensielle legemiddelinteraksjoner er Zanaflex 4mg kontraindisert hos pasienter som tar potente CYP1A2-hemmere, som fluvoksamin eller ciprofloksacin. Bivirkninger som hypotensjon, bradykardi eller overdreven døsighet kan oppstå når Zanaflex tas sammen med andre CYP1A2-hemmere, slik som zileuton, andre fluorokinoloner enn ciprofloksacin (som er kontraindisert), antiarytmika (amiodaron, mexiletin, peroral propafenidin, famotci, propafenidin, oralt). prevensjonsmidler, acyklovir og tiklopidin). Samtidig bruk bør unngås med mindre nødvendigheten av Zanaflex 2 mg-behandling er klinisk åpenbar. I slike tilfeller, bruk med forsiktighet [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
Overfølsomhetsreaksjoner
Zanaflex kan forårsake anafylaksi. Tegn og symptomer inkludert respiratorisk kompromittering, urticaria og angioødem i svelg og tunge er rapportert. Pasienter bør informeres om tegn og symptomer på alvorlige allergiske reaksjoner og instrueres om å seponere Zanaflex og søke øyeblikkelig medisinsk hjelp dersom disse tegnene og symptomene skulle oppstå [se KONTRAINDIKASJONER ].
Økt risiko for uønskede reaksjoner hos pasienter med nedsatt nyrefunksjon
Zanaflex bør brukes med forsiktighet hos pasienter med nyreinsuffisiens (kreatininclearance DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Uttaksbivirkninger
Abstinensbivirkninger inkluderer rebound hypertensjon, takykardi og hypertoni. For å minimere risikoen for disse reaksjonene, spesielt hos pasienter som har fått høye doser (20 til 28 mg daglig) i lange perioder (9 uker eller mer) eller som kan være på samtidig behandling med narkotika, bør dosen reduseres sakte (2 til 4 mg per dag) [se DOSERING OG ADMINISTRASJON ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Tizanidin ble administrert til mus i 78 uker i orale doser opptil 16 mg/kg/dag, som er 2 ganger den maksimale anbefalte humane dosen (MRHD) på 36 mg/dag på basis av kroppsoverflate (mg/m²). Tizanidin ble administrert til rotter i 104 uker i orale doser på opptil 9 mg/kg/dag, som er 2,5 ganger MRHD på mg/m²-basis. Det var ingen økning i svulster hos noen av artene.
Mutagenese
Tizanidin var negativt i in vitro (bakteriell omvendt mutasjon [Ames], pattedyrgenmutasjon og kromosomavvikstest i pattedyrceller) og in vivo (benmargsmikronukleus og cytogenetikk).
Nedsatt fruktbarhet
Oral administrering av tizanidin til rotter før og under paring og fortsatt tidlig i svangerskapet hos hunner resulterte i redusert fertilitet hos hann- og hunnrotter ved doser på henholdsvis 30 og 10 mg/kg/dag. Ingen effekt på fertilitet ble observert ved doser på 10 (mann) og 3 (kvinnelig) mg/kg/dag, som er henholdsvis omtrent 3 ganger og lik MRHD, på mg/m²-basis.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Det er ikke tilstrekkelige data om utviklingsrisiko forbundet med bruk av Zanaflex 2mg hos gravide kvinner. I dyrestudier resulterte administrering av tizanidin under graviditet i utviklingstoksisitet (embryofetal og postnatal avkomdødelighet og vekstmangel) ved doser lavere enn de som ble brukt klinisk, som ikke var assosiert med maternell toksisitet (se Dyredata ).
I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % - 4 % og 15 % - 20 %. Bakgrunnsrisikoen for store fødselsskader og spontanabort for den angitte befolkningen er ukjent.
Data
Dyredata
Oral administrering av tizanidin (0,3 til 100 mg/kg/dag) til drektige rotter i løpet av organogenesen resulterte i embryoføtal og postnatal avkomsdødelighet og reduksjon i kroppsvekt ved doser på 30 mg/kg/dag og over. Maternell toksisitet ble observert ved den høyeste dosen som ble testet. Ingen-effektdosen for embryoføtal utviklingstoksisitet hos rotter (3 mg/kg/dag) er lik maksimal anbefalt human dose (MRHD) på 36 mg/dag på kroppsoverflate (mg/m²).
Oral administrering av tizanidin (1 til 100 mg/kg/dag) til drektige kaniner i løpet av organogenesen resulterte i embryoføtal og postnatal avkomsdødelighet ved alle doser. Maternell toksisitet ble observert ved den høyeste dosen som ble testet. Oral administrering av tizanidin (10 og 30 mg/kg/dag) under den perinatale perioden av svangerskapet (2-6 dager før fødsel) resulterte i økt postnatal avkomsdødelighet ved begge doser. En dose uten effekt for embryoføtal utviklingstoksisitet hos kanin ble ikke identifisert. Den laveste dosen som ble testet (1 mg/kg/dag) er mindre enn MRHD på mg/m²-basis.
I en pre- og postnatal utviklingsstudie på rotter resulterte oral administrering av tizanidin (3 til 30 mg/kg/dag) i økt postnatal avkomsdødelighet. En dose uten effekt for pre- og postnatal utviklingstoksisitet ble ikke identifisert. Den laveste dosen som ble testet (3 mg/kg/dag) er lik MRHD på henholdsvis mg/m²-basis.
Amming
Risikosammendrag
Det er ingen data på tilstedeværelsen av tizanidin i morsmelk, effekten på spedbarnet som ammes, eller effekten på produksjonen av morsmelk. Dyrestudier har rapportert tilstedeværelsen av tizanidin i melken til diegivende dyr.
De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for Zanaflex 4mg og eventuelle skadelige effekter på det ammede spedbarnet fra Zanaflex eller fra den underliggende morstilstanden.
Kvinner og menn med reproduktivt potensial
Det er ingen adekvate og godt kontrollerte studier hos mennesker på effekten av Zanaflex 4 mg på kvinnelig eller mannlig reproduksjonsevne. Oral administrering av tizanidin til hann- og hunnrotter resulterte i uønskede effekter på fertilitet [se Ikke-klinisk toksikologi ].
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Zanaflex 2mg er kjent for å bli vesentlig utskilt av nyrene, og risikoen for bivirkninger av dette legemidlet kan være større hos pasienter med nedsatt nyrefunksjon. Fordi eldre pasienter har større sannsynlighet for å ha nedsatt nyrefunksjon, bør det utvises forsiktighet ved dosevalg, og det kan være nyttig å overvåke nyrefunksjonen.
Kliniske studier av Zanaflex 2mg inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Kryssstudiesammenlikning av farmakokinetiske data etter administrering av enkeltdoser på 6 mg Zanaflex 2 mg viste at yngre forsøkspersoner eliminerte stoffet fire ganger raskere enn de eldre. Hos eldre pasienter med nyreinsuffisiens (kreatininclearance
Nedsatt nyrefunksjon
Zanaflex er kjent for å utskilles i stor grad av nyrene, og risikoen for bivirkninger av dette legemidlet kan være større hos pasienter med nedsatt nyrefunksjon. Hos pasienter med nyreinsuffisiens (kreatininclearance DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Påvirkningen av nedsatt leverfunksjon på farmakokinetikken til tizanidin har ikke blitt evaluert. Fordi tizanidin i stor grad metaboliseres i leveren, vil nedsatt leverfunksjon forventes å ha betydelige effekter på farmakokinetikken til tizanidin [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ].
OVERDOSE
En gjennomgang av sikkerhetsovervåkingsdatabasen avdekket tilfeller av tilsiktet og utilsiktet overdose av Zanaflex. Noen av tilfellene resulterte i dødsfall, og mange av de tilsiktede overdosene var med flere medikamenter inkludert CNS-depressiva. De kliniske manifestasjonene av overdosering av tizanidin stemte overens med den kjente farmakologien. I de fleste tilfellene ble det observert en reduksjon i sensorium inkludert sløvhet, somnolens, forvirring og koma. Deprimert hjertefunksjon er også observert, inkludert oftest bradykardi og hypotensjon. Respirasjonsdepresjon er et annet vanlig trekk ved overdosering av tizanidin.
Dersom overdosering skulle oppstå, bør grunnleggende tiltak for å sikre tilstrekkelige luftveier og overvåking av kardiovaskulære og respiratoriske systemer utføres. Tizanidin er et lipidløselig legemiddel, som bare er lett løselig i vann og metanol. Derfor vil dialyse sannsynligvis ikke være en effektiv metode for å fjerne stoffet fra kroppen. Generelt forsvinner symptomene innen én til tre dager etter seponering av tizanidin og administrering av passende behandling. På grunn av den liknende virkningsmekanismen, er symptomer og behandling av overdosering av tizanidin lik den etter overdosering av klonidin. For den nyeste informasjonen om håndtering av overdose, kontakt et giftkontrollsenter.
KONTRAINDIKASJONER
Zanaflex er kontraindisert hos pasienter som tar potente hemmere av CYP1A2, som fluvoksamin eller ciprofloksacin [se NARKOTIKAHANDEL ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Tizanidin er en sentral alfa-2-adrenerg reseptoragonist og reduserer antagelig spastisitet ved å øke presynaptisk hemming av motoriske nevroner. Effekten av tizanidin er størst på polysynaptiske veier. Den samlede effekten av disse handlingene antas å redusere tilrettelegging av spinale motoriske nevroner.
Farmakokinetikk
Absorpsjon og distribusjon
Etter oral administrering absorberes tizanidin i hovedsak fullstendig. Den absolutte orale biotilgjengeligheten av tizanidin er ca. 40 % (CV = 24 %), på grunn av omfattende first-pass hepatisk metabolisme. Tizanidin distribueres omfattende i hele kroppen med et gjennomsnittlig steady state distribusjonsvolum på 2,4 l/kg (CV = 21 %) etter intravenøs administrering hos friske voksne frivillige. Tizanidin er omtrent 30 % bundet til plasmaproteiner.
Forskjeller mellom Zanaflex 4mg Capsules® og Zanaflex® tabletter
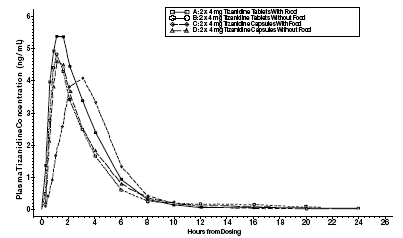
Zanaflex 2mg Capsules® og Zanaflex® tabletter er bioekvivalente med hverandre under fastende forhold, men ikke under matforhold. En enkeltdose på enten to 4 mg tabletter eller to 4 mg kapsler ble administrert under mating og fastende forhold i en åpen, fire-perioders randomisert crossover-studie med 96 frivillige, hvorav 81 var kvalifisert for den statistiske analysen. Etter oral administrering av enten tabletten eller kapselen (i fastende tilstand) oppsto maksimale plasmakonsentrasjoner av tizanidin 1,0 timer etter dosering med en halveringstid på ca. 2 timer. Når to 4 mg tabletter ble administrert sammen med mat, ble gjennomsnittlig maksimal plasmakonsentrasjon økt med ca. 30 %, og mediantiden til maksimal plasmakonsentrasjon økte med 25 minutter, til 1 time og 25 minutter. I motsetning til dette, når to 4 mg kapsler ble administrert sammen med mat, ble gjennomsnittlig maksimal plasmakonsentrasjon redusert med 20 %, mediantiden til maksimal plasmakonsentrasjon ble økt med 2 til 3 timer. Følgelig er gjennomsnittlig Cmax for kapselen når den administreres sammen med mat, ca. 66 % av Cmax for tabletten når den administreres sammen med mat. Mat økte også absorpsjonsgraden for både tabletter og kapsler. Økningen med tabletten (~30 %) var signifikant større enn med kapselen (~10 %). Følgelig, når hver ble administrert sammen med mat, var mengden absorbert fra kapselen omtrent 80 % av mengden absorbert fra tabletten. Administrering av kapselinnholdet drysset på eplemos var ikke bioekvivalent med administrering av en intakt kapsel under fastende forhold. Administrering av kapselinnholdet på eplemos resulterte i en 15 %–20 % økning i Cmax og AUC for tizanidin og en 15 minutters reduksjon i median forsinkelsestid og tid til toppkonsentrasjon sammenlignet med administrering av en intakt kapsel under fastende.
Figur 1: Gjennomsnittlig Tizanidin-konsentrasjon vs. tidsprofiler for Zanaflex-tabletter og -kapsler (2 × 4 mg) under faste- og matforhold
Metabolisme og utskillelse
Tizanidin har lineær farmakokinetikk over dosene studert i klinisk utvikling (1-20 mg). Tizanidin har en halveringstid på ca. 2,5 timer (CV=33%). Omtrent 95 % av en administrert dose metaboliseres. Det primære cytokrom P450 isoenzymet involvert i tizanidinmetabolismen er CYP1A2. Tizanidinmetabolitter er ikke kjent for å være aktive; halveringstiden deres varierer fra 20 til 40 timer.
Etter enkel og multippel oral dosering av 14C-tizanidin, ble gjennomsnittlig 60 % og 20 % av total radioaktivitet gjenfunnet i henholdsvis urin og feces.
Spesifikke populasjoner
Alderseffekter
Ingen spesifikk farmakokinetisk studie ble utført for å undersøke alderseffekter. Kryssstudiesammenlikning av farmakokinetiske data etter administrering av enkeltdoser på 6 mg Zanaflex 2 mg viste at yngre forsøkspersoner eliminerte stoffet fire ganger raskere enn de eldre. Zanaflex 4mg har ikke blitt evaluert hos barn [se Bruk i spesifikke populasjoner ].
Nedsatt leverfunksjon
Påvirkningen av nedsatt leverfunksjon på farmakokinetikken til tizanidin har ikke blitt evaluert. Fordi tizanidin i stor grad metaboliseres i leveren, vil nedsatt leverfunksjon forventes å ha betydelige effekter på tizanidins farmakokinetikk. Zanaflex anbefales ikke til denne pasientpopulasjonen [se Bruk i spesifikke populasjoner ].
Nedsatt nyrefunksjon
Tizanidinclearance er redusert med mer enn 50 % hos eldre pasienter med nyresvikt (kreatininclearance ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Kjønnseffekter
Ingen spesifikk farmakokinetisk studie ble utført for å undersøke kjønnseffekter. Retrospektiv analyse av farmakokinetiske data, etter enkelt- og flerdoseadministrasjon av 4 mg Zanaflex 2 mg, viste imidlertid at kjønn ikke hadde noen effekt på farmakokinetikken til tizanidin.
Raseeffekter
Farmakokinetiske forskjeller på grunn av rase er ikke studert.
Narkotikahandel
CYP1A2-hemmere
Interaksjonen mellom Zanaflex og enten fluvoksamin eller ciprofloksacin skyldes mest sannsynlig hemming av CYP1A2 av fluvoksamin eller ciprofloksacin. Effekten av fluvoksamin på farmakokinetikken til en enkeltdose på 4 mg Zanaflex ble studert hos 10 friske personer. Cmax, AUC og halveringstid for tizanidin økte med henholdsvis 12 ganger, 33 ganger og 3 ganger. Effekten av ciprofloksacin på farmakokinetikken til en enkeltdose på 4 mg Zanaflex 4 mg ble studert hos 10 friske personer. Cmax og AUC for tizanidin økte med henholdsvis 7 ganger og 10 ganger [se KONTRAINDIKASJONER ].
Selv om det ikke har vært noen kliniske studier som har evaluert effekten av andre CYP1A2-hemmere på tizanidin, andre CYP1A2-hemmere, slik som zileuton, andre fluorokinoloner, antiarytmika (amiodaron, mexiletin, propafenon og verapamil), cimetidin, cyklolopidin, oralt og antiseptivt kan også føre til betydelige økninger i tizanidin blodkonsentrasjoner [se ADVARSLER OG FORHOLDSREGLER ].
In vitro-studier av cytokrom P450 isoenzymer ved bruk av humane levermikrosomer indikerer at verken tizanidin eller hovedmetabolittene sannsynligvis vil påvirke metabolismen av andre legemidler metabolisert av cytokrom P450 isoenzymer.
Orale prevensjonsmidler
Ingen spesifikk farmakokinetisk studie ble utført for å undersøke interaksjon mellom orale prevensjonsmidler og Zanaflex. Retrospektiv analyse av populasjonsfarmakokinetiske data etter administrering av enkelt- og flerdoser av 4 mg Zanaflex viste imidlertid at kvinner som samtidig tok p-piller hadde 50 % lavere clearance av tizanidin sammenlignet med kvinner som ikke brukte p-piller [se ADVARSLER OG FORHOLDSREGLER ].
Paracetamol
Tizanidin forsinket Tmax for acetaminophen med 16 minutter. Paracetamol påvirket ikke farmakokinetikken til tizanidin.
Alkohol
Alkohol økte AUC for tizanidin med omtrent 20 %, samtidig som Cmax økte med omtrent 15 %. Dette var assosiert med en økning i bivirkninger av tizanidin. De CNS-dempende effektene av tizanidin og alkohol er additive.
Kliniske studier
Tizanidins evne til å redusere økt muskeltonus assosiert med spastisitet ble demonstrert i to adekvate og godt kontrollerte studier hos pasienter med multippel sklerose eller ryggmargsskade (studier 1 og 2).
Enkeltdosestudie hos pasienter med multippel sklerose med spastisitet
I studie 1 ble pasienter med multippel sklerose randomisert til å motta orale enkeltdoser av medikament eller placebo. Pasienter og bedømmere var blinde for behandlingsoppdrag, og det ble gjort forsøk på å redusere sannsynligheten for at bedømmere indirekte ville bli oppmerksomme på behandlingsoppdrag (f.eks. ga de ikke direkte omsorg til pasienter og fikk forbud mot å stille spørsmål om bivirkninger). I alt fikk 140 pasienter placebo, 8 mg eller 16 mg Zanaflex.
Responsen ble vurdert ved fysisk undersøkelse; muskeltonen ble vurdert på en 5-punkts skala (Ashworth-score), med en score på 0 brukt for å beskrive normal muskeltonus. En score på 1 indikerte en liten spastisk fangst, mens en score på 2 indikerte mer markert muskelmotstand. En score på 3 ble brukt for å beskrive betydelig økning i tonus, noe som gjorde passiv bevegelse vanskelig. En muskel immobilisert av spastisitet ble gitt en score på 4. Spasme-tellinger ble også samlet.
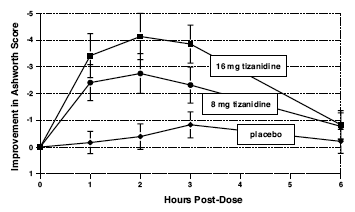
Vurderinger ble gjort 1, 2, 3 og 6 timer etter behandling. En statistisk signifikant reduksjon av Ashworth-skåren for Zanaflex 2 mg sammenlignet med placebo ble påvist 1, 2 og 3 timer etter behandling. Figur 2 nedenfor viser en sammenligning av gjennomsnittlig endring i muskeltonus fra baseline målt ved Ashworth-skalaen. Den største reduksjonen i muskeltonus var 1 til 2 timer etter behandling. Innen 6 timer etter behandling var muskeltonus i gruppene på 8 og 16 mg Zanaflex 2 mg umulig å skille fra muskeltonus hos pasienter som ble behandlet med placebo. Innenfor en gitt pasient var forbedring i muskeltonus korrelert med plasmakonsentrasjon. Plasmakonsentrasjoner var varierende fra pasient til pasient ved en gitt dose. Selv om 16 mg ga en større effekt, var bivirkninger inkludert hypotensjon mer vanlige og mer alvorlige enn i 8 mg-gruppen. Det var ingen forskjeller i antall spasmer som oppsto i hver gruppe.
Figur 2: Enkeltdosestudie - Gjennomsnittlig endring i muskeltonus fra baseline målt ved Ashworth-skalaen ± 95 % konfidensintervall (en negativ Ashworth-score betyr en forbedring i muskeltonus fra baseline)
Syvukers studie hos pasienter med ryggmargsskade med spastisitet
I en 7-ukers studie (studie 2) ble 118 pasienter med spastisitet sekundært til ryggmargsskade randomisert til enten placebo eller Zanaflex. Trinn som ligner på de som ble tatt i den første studien ble brukt for å sikre integriteten til blinding.
Pasientene ble titrert over 3 uker opp til en maksimal tolerert dose eller 36 mg daglig gitt i tre ulike doser (f.eks. 10 mg gitt om morgenen og ettermiddagen og 16 mg gitt om natten). Pasientene ble deretter opprettholdt på sin maksimalt tolererte dose i ytterligere 4 uker (dvs. vedlikeholdsfasen). Gjennom vedlikeholdsfasen ble muskeltonus vurdert på Ashworth-skalaen innen en periode på 2,5 timer etter enten morgen- eller ettermiddagsdosen. Antall spasmer på dagtid ble registrert daglig av pasienter.
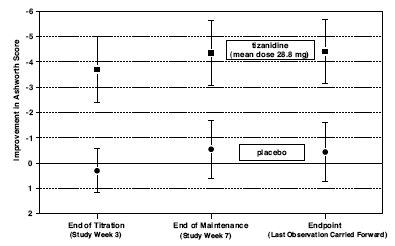
Ved endepunktet (det protokollspesifiserte tidspunktet for utfallsvurdering) var det en statistisk signifikant reduksjon i muskeltonus og frekvens av spasmer i gruppen behandlet med Zanaflex sammenlignet med placebo. Reduksjonen i muskeltonus var ikke assosiert med reduksjon i muskelstyrke (et ønskelig resultat), men førte heller ikke til noen konsekvent fordel av Zanaflex-behandlede pasienter med mål på dagliglivets aktiviteter. Figur 3 nedenfor viser en sammenligning av gjennomsnittlig endring i muskeltonus fra baseline målt ved Ashworth-skalaen.
Figur 3: Syvukersstudie – Gjennomsnittlig endring i muskeltonus 0,5 - 2,5 timer etter dosering målt ved Ashworth-skalaen ± 95 % konfidensintervall (en negativ Ashworth-score betyr en forbedring i muskeltonus fra baseline)
PASIENTINFORMASJON
Alvorlige legemiddelinteraksjoner
Informer pasienter om at de ikke bør ta Zanaflex hvis de tar fluvoksamin eller ciprofloksacin på grunn av økt risiko for alvorlige bivirkninger inkludert alvorlig blodtrykksreduksjon og sedasjon. Instruer pasienter om å informere sine leger eller farmasøyter når de begynner eller slutter å ta medisiner på grunn av risikoen forbundet med interaksjon mellom Zanaflex og andre legemidler.
Zanaflex Dosering
Fortell pasientene om å ta Zanaflex 2mg nøyaktig som foreskrevet (konsekvent enten med eller uten mat) og ikke bytte mellom tabletter og kapsler. Informer pasientene om at de ikke bør ta mer Zanaflex 2 mg enn foreskrevet på grunn av risikoen for bivirkninger ved enkeltdoser større enn 8 mg eller totale daglige doser større enn 36 mg. Fortell pasientene at de ikke plutselig bør seponere Zanaflex 4mg, fordi rebound hypertensjon og takykardi kan oppstå.
Effekter av Zanaflex
Advar pasienter om at de kan oppleve hypotensjon og å være forsiktig når de skifter fra liggende eller sittende til stående stilling. Fortell pasienter at Zanaflex kan føre til at de blir bedøvet eller somnolente, og de bør være forsiktige når de utfører aktiviteter som krever årvåkenhet, som å kjøre bil eller bruke maskiner. Fortell pasientene at sedasjonen kan være additiv når Zanaflex 4mg tas sammen med legemidler (baklofen, benzodiazepiner) eller stoffer (f.eks. alkohol) som virker som CNS-dempende midler. Minn pasienter på at hvis de er avhengige av sin spastisitet for å opprettholde holdning og balanse i bevegelse, eller når spastisitet brukes for å oppnå økt funksjon, at Zanaflex reduserer spastisitet og forsiktighet bør brukes.
