Brand Temovate 15g Clobetasol Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Temovate og hvordan brukes det?
Temovate er et reseptbelagt legemiddel som brukes til å behandle symptomene på plakk og psoriasis i hodebunnen og kortikosteroid-responsive dermatoser. Temovate kan brukes alene eller sammen med andre medisiner.
Temovate tilhører en klasse legemidler som kalles kortikosteroider, aktuell.
Det er ikke kjent om Temovate er trygt og effektivt hos barn under 12 år.
Hva er de mulige bivirkningene av Temovate?
Temovate kan forårsake alvorlige bivirkninger, inkludert:
- . forverring av hudtilstanden din, . rødhet, varme, hevelse, siver eller alvorlig irritasjon av behandlet hud, . tåkesyn, . tunnelsyn, . øyesmerter, . ser glorier rundt lys, . økt tørst, . tørr i munnen, . lukt av fruktig pust, . vektøkning i ansikt og skuldre, . sakte sårheling, . misfarging av huden, . tynn hud, . økt kroppsbehåring, . tretthet, . humørsvingninger, . menstruasjonsforandringer, og . seksuelle endringer
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Temovate inkluderer:
- . brenning, kløe, hevelse eller irritasjon av behandlet hud, . tørr eller sprukken hud, . rødhet eller skorpe rundt hårsekkene, . edderkoppårer, . strekkmerker, . tynn hud, . utslett eller elveblest, . akne, og . midlertidig hårtap
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Temovate. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
TEMOVATE® (klobetasolpropionatkrem og salve) Krem og salve, 0,05 % inneholder den aktive forbindelsen clobetasolpropionat, et syntetisk kortikosteroid, for lokal dermatologisk bruk. Clobetasol, en analog av prednisolon, har en høy grad av glukokortikoid aktivitet og en liten grad av mineralokortikoid aktivitet.
Kjemisk sett er klobetasolpropionat (11ß,16ß)-21-klor-9-fluor-11-hydroksy-16-metyl-17-(1-oksopropoksy)-pregna-1,4-dien-3,20-dion, og den har følgende strukturformel:
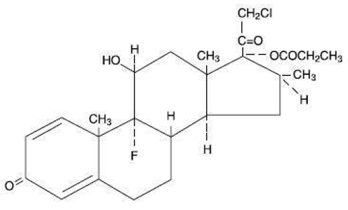
Klobetasolpropionat har molekylformelen C25H32CIFO5 og en molekylvekt på 467. Det er et hvitt til kremfarget krystallinsk pulver som er uløselig i vann.
TEMOVATE® Cream inneholder clobetasolpropionat 0,5 mg/g i en krembase av propylenglykol, glycerylmonostearat, cetostearylalkohol, glycerylstearat, PEG 100 stearat, hvit voks, klorokresol, natriumsitrat, sitronsyremonohydrat, og renset vann.
TEMOVATE® salve inneholder klobetasolpropionat 0,5 mg/g i en base av propylenglykol, sorbitan-sesquioleat og hvit vaselin.
INDIKASJONER
TEMOVATE® Cream and Ointment er kortikosteroidformuleringer med super høy styrke indisert for lindring av de inflammatoriske og kløende manifestasjonene av kortikosteroid-responsive dermatoser. Behandling utover 2 uker på rad anbefales ikke, og den totale dosen bør ikke overstige 50 g/uke på grunn av potensialet for at legemidlet kan undertrykke hypothalamus-hypofyse-binyrene (HPA). Bruk hos pediatriske pasienter under 12 år anbefales ikke.
Som med andre høyaktive kortikosteroider, bør behandlingen avbrytes når kontroll er oppnådd. Hvis ingen bedring sees innen 2 uker, kan det være nødvendig med revurdering av diagnosen.
DOSERING OG ADMINISTRASJON
Påfør et tynt lag TEMOVATE® krem eller salve på de berørte hudområdene to ganger daglig og gni inn forsiktig og fullstendig (se INDIKASJONER OG BRUK ).
TEMOVATE® Cream and Ointment er topikale kortikosteroider med super høy styrke; derfor, Behandlingen bør begrenses til 2 påfølgende uker og mengder større enn 50 g/uke bør ikke brukes.
Som med andre høyaktive kortikosteroider, bør behandlingen avbrytes når kontroll er oppnådd. Hvis ingen bedring sees innen 2 uker, kan det være nødvendig med revurdering av diagnosen.
TEMOVATE® Cream and Ointment skal ikke brukes med okklusive bandasjer.
Geriatrisk bruk
I studier der geriatriske pasienter (65 år eller eldre, se FORHOLDSREGLER har blitt behandlet med TEMOVATE® krem eller salve, var sikkerheten ikke forskjellig fra den hos yngre pasienter; derfor anbefales ingen dosejustering.
HVORDAN LEVERES
TEMOVATE® (clobetasol propionatkrem) krem, 0,05 % leveres i:
30 g rør ( NDC 10337-163-30), og 60-g rør ( NDC 10337-163-60).
TEMOVATE® (clobetasol propionat salve) salve, 0,05 % leveres i:
15 g rør ( NDC 10337-162-15), og 30-g rør ( NDC 10337-162-30).
Oppbevares mellom 15° og 30°C (59° og 86°F). TEMOVATE® Cream bør ikke oppbevares i kjøleskap. PharmaDerm
En avdeling av Fougera Pharmaceuticals Inc., Melville, NY 11747 USA. Revidert: januar 2012
BIVIRKNINGER
I kontrollerte kliniske studier var de hyppigste bivirkningene rapportert for TEMOVATE® Cream brennende og stikkende følelse hos 1 % av behandlede pasienter. Mindre hyppige bivirkninger var kløe, hudatrofi og sprekker og sprekker i huden.
kontrollerte kliniske studier var de hyppigste bivirkningene rapportert for TEMOVATE® salve brennende følelse, irritasjon og kløe hos 0,5 % av behandlede pasienter. Mindre hyppige bivirkninger var stikkende, sprekker, erytem, follikulitt, nummenhet i fingre, hudatrofi og telangiektasi.
Cushings syndrom er rapportert hos spedbarn og voksne som et resultat av langvarig bruk av aktuelle clobetasolpropionatformuleringer.
Følgende ytterligere lokale bivirkninger er rapportert med topikale kortikosteroider, og de kan forekomme hyppigere ved bruk av okklusive bandasjer og kortikosteroider med høyere styrke. Disse reaksjonene er oppført i en tilnærmet synkende rekkefølge: tørrhet, akneiforme utbrudd, hypopigmentering, perioral dermatitt, allergisk kontaktdermatitt, sekundær infeksjon, irritasjon, striae og miliaria.

NARKOTIKAHANDEL
Ingen informasjon gitt.
ADVARSLER
Ingen informasjon gitt. Vær snill å se FORHOLDSREGLER delen nedenfor.
FORHOLDSREGLER
Generell
TEMOVATE® Cream and Ointment skal ikke brukes i behandling av rosacea eller perioral dermatitt, og skal ikke brukes i ansikt, lyske eller aksiller.
Systemisk absorpsjon av topikale kortikosteroider kan gi reversibel HPA-aksesuppresjon med potensiale for glukokortikosteroidinsuffisiens etter seponering fra behandling. Manifestasjoner av Cushings syndrom, hyperglykemi og glukosuri kan også produseres hos noen pasienter ved systemisk absorpsjon av topikale kortikosteroider under behandling.
Pasienter som påfører et lokalt steroid på et stort overflateareal eller på områder under okklusjon, bør evalueres med jevne mellomrom for tegn på HPA-akseundertrykkelse. Dette kan gjøres ved å bruke ACTH-stimulering, AM plasmakortisol og urinfri kortisoltester. Pasienter som får superpotente kortikosteroider bør ikke behandles i mer enn 2 uker om gangen, og kun små områder bør behandles til enhver tid på grunn av økt risiko for HPA-suppresjon.
TEMOVATE® Cream and Ointment produserte HPA-akseundertrykkelse når det ble brukt i doser så lave som 2 g/dag i 1 uke hos pasienter med eksem.
Hvis HPA-aksen undertrykkes, bør det gjøres et forsøk på å trekke stoffet tilbake, redusere bruksfrekvensen eller erstatte et mindre potent kortikosteroid. Gjenoppretting av HPA-aksefunksjonen er vanligvis umiddelbar ved seponering av topikale kortikosteroider. I sjeldne tilfeller kan tegn og symptomer på glukokortikosteroidinsuffisiens oppstå som krever supplerende systemiske kortikosteroider. For informasjon om systemisk tilskudd, se forskrivningsinformasjon for disse produktene.
Pediatriske pasienter kan være mer utsatt for systemisk toksisitet fra ekvivalente doser på grunn av deres større forhold mellom hudoverflate og kroppsmasse (se FORHOLDSREGLER : Pediatrisk bruk ).
Hvis det oppstår irritasjon, bør TEMOVATE® Cream and Ointment seponeres og passende behandling settes i gang. Allergisk kontaktdermatitt med kortikosteroider diagnostiseres vanligvis ved å observere en svikt i å helbrede i stedet for å merke en klinisk forverring som med de fleste aktuelle produkter som ikke inneholder kortikosteroider. En slik observasjon bør bekreftes med passende diagnostisk lapptesting.
Hvis samtidige hudinfeksjoner er tilstede eller utvikles, bør et passende soppdrepende eller antibakterielt middel brukes. Hvis en gunstig respons ikke oppstår umiddelbart, bør bruken av TEMOVATE® krem og salve avbrytes til infeksjonen er tilstrekkelig kontrollert.
Laboratorietester
Følgende tester kan være nyttige for å evaluere pasienter for HPA-akseundertrykkelse:
ACTH-stimuleringstest AM plasmakortisoltest Urinfri kortisoltest
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Langtids dyrestudier er ikke utført for å evaluere det karsinogene potensialet til klobetasolpropionat.
Studier på rotter etter subkutan administrering ved dosenivåer på opptil 50 mcg/kg/dag viste at hunnene viste en økning i antall resorberte embryoer og en reduksjon i antall levende fostre ved høyeste dose.
Klobetasolpropionat var ikke-mutagent i 3 forskjellige testsystemer: Ames-testen, Saccharomyces cerevisiae-genkonverteringsanalysen og E. coli B WP2-fluktuasjonstesten.
Svangerskap
Teratogene effekter
Graviditetskategori C. Kortikosteroider har vist seg å være teratogene hos laboratoriedyr når de administreres systemisk i relativt lave dosenivåer. Noen kortikosteroider har vist seg å være teratogene etter dermal påføring på laboratoriedyr.
Klobetasolpropionat har ikke blitt testet for teratogenitet når det påføres lokalt; det absorberes imidlertid perkutant, og når det ble administrert subkutant var det et signifikant teratogent i både kanin og mus. Klobetasolpropionat har større teratogent potensial enn steroider som er mindre potente.
Teratogenisitetsstudier på mus som ble brukt subkutan, resulterte i føtotoksisitet ved den høyeste dosen som ble testet (1 mg/kg) og teratogenisitet ved alle dosenivåer testet ned til 0,03 mg/kg. Disse dosene er henholdsvis ca. 1,4 og 0,04 ganger den aktuelle dosen av TEMOVATE® Cream and Ointment for mennesker. Abnormiteter som ble sett inkluderte ganespalte og skjelettavvik.
Hos kaniner var clobetasolpropionat teratogent ved doser på 3 og 10 mcg/kg. Disse dosene er henholdsvis omtrent 0,02 og 0,05 ganger den lokale dosen av TEMOVATE® Cream and Ointment. Abnormiteter som ble sett inkluderer ganespalte, kranioschisis og andre skjelettavvik.
Det finnes ingen tilstrekkelige og godt kontrollerte studier av det teratogene potensialet til klobetasolpropionat hos gravide kvinner. TEMOVATE® Cream and Ointment skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Ammende mødre
Systemisk administrerte kortikosteroider vises i morsmelk og kan undertrykke vekst, forstyrre endogen kortikosteroidproduksjon eller forårsake andre uheldige effekter. Det er ikke kjent om lokal administrering av kortikosteroider kan resultere i tilstrekkelig systemisk absorpsjon til å produsere påvisbare mengder i morsmelk. Fordi mange legemidler skilles ut i morsmelk, bør det utvises forsiktighet når TEMOVATE® krem eller salve gis til en ammende kvinne.
Pediatrisk bruk
Sikkerhet og effektivitet av TEMOVATE® krem og salve hos pediatriske pasienter er ikke fastslått. Bruk hos pediatriske pasienter under 12 år anbefales ikke. På grunn av et høyere forhold mellom hudoverflate og kroppsmasse, har pediatriske pasienter en større risiko enn voksne for HPA-aksesuppresjon og Cushings syndrom når de behandles med topikale kortikosteroider. De har derfor også større risiko for binyrebarksvikt under eller etter seponering av behandlingen. Bivirkninger inkludert striae er rapportert ved upassende bruk av topikale kortikosteroider hos spedbarn og barn.
HPA-akseundertrykkelse, Cushings syndrom, lineær vekstretardasjon, forsinket vektøkning og intrakraniell hypertensjon er rapportert hos barn som får topikale kortikosteroider. Manifestasjoner av binyresuppresjon hos barn inkluderer lave plasmakortisolnivåer og fravær av respons på ACTH-stimulering. Manifestasjoner av intrakraniell hypertensjon inkluderer svulmende fontaneller, hodepine og bilateralt papilleødem.
Geriatrisk bruk
Et begrenset antall pasienter på eller over 65 år har blitt behandlet med TEMOVATE® Cream (n = 231) og med TEMOVATE® Ointment (n = 101) i amerikanske og ikke-amerikanske kliniske studier. Mens antallet pasienter er for lite til å tillate separat analyse av effekt og sikkerhet, var bivirkningene rapportert i denne populasjonen lik de som ble rapportert av yngre pasienter. Basert på tilgjengelige data er ingen justering av dosen av TEMOVATE® krem og salve til geriatriske pasienter berettiget.
OVERDOSE
Topisk påført TEMOVATE® krem og salve kan absorberes i tilstrekkelige mengder til å gi systemiske effekter (se FORHOLDSREGLER ).
KONTRAINDIKASJONER
TEMOVATE® (klobetasolpropionatkrem og salve) Krem og salve, 0,05 % er kontraindisert hos pasienter med en historie med overfølsomhet overfor noen av komponentene i preparatene.
KLINISK FARMAKOLOGI
Som andre aktuelle kortikosteroider har clobetasolpropionat antiinflammatoriske, kløestillende og vasokonstriktive egenskaper. Mekanismen for den antiinflammatoriske aktiviteten til topikale steroider er generelt uklar. Imidlertid antas kortikosteroider å virke ved induksjon av fosfolipase A2-hemmende proteiner, samlet kalt lipokortiner. Det er postulert at disse proteinene kontrollerer biosyntesen av potente mediatorer av betennelse som prostaglandiner og leukotriener ved å hemme frigjøringen av deres vanlige forløper, arakidonsyre. Arakidonsyre frigjøres fra membranfosfolipider av fosfolipase A2.
Farmakokinetikk
Omfanget av perkutan absorpsjon av topikale kortikosteroider bestemmes av mange faktorer, inkludert bæreren og integriteten til den epidermale barrieren. Okklusiv bandasje med hydrokortison i opptil 24 timer har ikke vist seg å øke penetrasjonen; okklusjon av hydrokortison i 96 timer øker imidlertid penetrasjonen markant. Aktuelle kortikosteroider kan absorberes fra normal intakt hud. Betennelse og/eller andre sykdomsprosesser i huden kan øke perkutan absorpsjon.
Studier utført med TEMOVATE® Cream and Ointment indikerer at de er i det superhøye styrkeområdet sammenlignet med andre topikale kortikosteroider.
PASIENTINFORMASJON
Pasienter som bruker aktuelle kortikosteroider bør motta følgende informasjon og instruksjoner:
. Denne medisinen skal brukes som anvist av legen. Den er kun til ekstern bruk. Unngå kontakt med øynene. . Denne medisinen bør ikke brukes til andre lidelser enn den den ble foreskrevet for. . Det behandlede hudområdet skal ikke bindes, på annen måte tildekkes eller pakkes inn for å være okklusive med mindre legen har instruert det. . Pasienter bør rapportere alle tegn på lokale bivirkninger til legen.