Elocon 5g Mometasone Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Elocon 5g og hvordan brukes det?
Elocon (mometasonfuroat) krem, 0,1 % er en kortikosteroid aktuell krem, lotion eller salve indisert for lindring av inflammatoriske og kløende manifestasjoner av kortikosteroid-responsive dermatoser hos pasienter 2 år eller eldre.
Hva er bivirkningene av Elocon 5g?
Vanlige bivirkninger av Elocon inkluderer:
- . hudutslett, . kløe, . brennende, . rødhet, . tørrhet, . tynning eller mykgjøring av huden din, . hudutslett eller irritasjon rundt munnen, . hovne hårsekker, . edderkoppårer, . nummenhet eller prikking, . endringer i fargen på behandlet hud, . blemmer, . kviser, . skorpedannelse av behandlet hud, eller . strekkmerker.
BESKRIVELSE
ELOCON (mometasonfuroat) krem, 0,1 % inneholder mometasonfuroat for lokal bruk. Mometasonfuroat er et syntetisk kortikosteroid med antiinflammatorisk aktivitet.
Kjemisk er mometasonfuroat 9α,21-diklor-11β,17-dihydroksy-16a-metylpregna-1,4-dien3,20-dion 17-(2-furoat), med den empiriske formelen C27 H30CI2O6, en molekylvekt på 521,4 og følgende strukturformel:
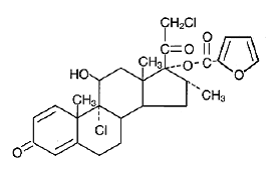
Mometasonfuroat er et hvitt til off-white pulver som er praktisk talt uløselig i vann, lett løselig i oktanol og moderat løselig i etylalkohol.
Hvert gram ELOCON 5g krem, 0,1 % inneholder 1 mg mometasonfuroat i en hvit til off-white krembase av aluminiumstivelse oktenylsuccinat (gamma bestrålt), heksylenglykol, hydrogenert soyabønnelecitin, fosforsyre, renset vann, mykt titandioksyd, hvitt. parafin og hvit voks.
INDIKASJONER
ELOCON® Cream er et kortikosteroid indisert for lindring av inflammatoriske og kløende manifestasjoner av kortikosteroid-responsive dermatoser hos pasienter 2 år eller eldre.
DOSERING OG ADMINISTRASJON
Påfør en tynn film ELOCON Cream på de berørte hudområdene én gang daglig. ELOCON Cream kan brukes til pediatriske pasienter 2 år eller eldre. Siden sikkerhet og effekt av ELOCON Cream ikke er fastslått hos pediatriske pasienter under 2 år; bruk i denne aldersgruppen anbefales ikke [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Behandlingen bør avbrytes når kontroll er oppnådd. Hvis ingen bedring sees innen 2 uker, kan det være nødvendig med revurdering av diagnosen. Sikkerhet og effekt av ELOCON Cream hos pediatriske pasienter i mer enn 3 ukers bruk er ikke fastslått.
ELOCON Cream skal ikke brukes med okklusive bandasjer med mindre det er instruert av en lege. ELOCON 5g Cream bør ikke påføres i bleieområdet hvis barnet fortsatt trenger bleier eller plastbukser, da disse plaggene kan utgjøre okklusive dressinger.
ELOCON Cream er kun til lokal bruk. Det er ikke for oral, oftalmisk eller intravaginal bruk.
Unngå bruk i ansikt, lyske eller aksiller.
HVORDAN LEVERES
Doseringsformer og styrker
Fløte, 0,1 %. Hvert gram ELOCON Cream inneholder 1 mg mometasonfuroat i en hvit til off-white glatt og homogen krembunn.
Oppbevaring og håndtering
ELOCON krem er hvit til off-white i fargen og leveres i 15 gram (NDC 0085-3149-01) og 50 gram ( NDC 0085-3149-03) rør.
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP kontrollert romtemperatur ]. Unngå overdreven varme.
Produsert for: Merck Sharp & Dohme Corp., et datterselskap av Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Produsert av: Schering-Plough Labo NV Heist-op-den-Berg, Belgia. Revidert: april 2013
BIVIRKNINGER
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
I kontrollerte kliniske studier som involverte 319 forsøkspersoner, var forekomsten av bivirkninger forbundet med bruk av ELOCON 5g krem 1,6 %. Rapporterte reaksjoner inkluderte svie, kløe og hudatrofi. Det er også mottatt rapporter om rosacea forbundet med bruk av ELOCON 5g Cream. I kontrollerte kliniske studier (n=74) som involverte pediatriske forsøkspersoner i alderen 2 til 12 år, var forekomsten av bivirkninger forbundet med bruk av ELOCON 5g krem ca. 7 %. Rapporterte reaksjoner inkluderte svie, kløe og furunkulose.
Følgende bivirkninger ble rapportert å være mulig eller sannsynligvis relatert til behandling med ELOCON 5g Cream under kliniske studier hos 4 % av 182 pediatriske personer i alderen 6 måneder til 2 år: reduserte glukokortikoidnivåer, 2; parestesi, 2; follikulitt, 1; moniliasis, 1; bakteriell infeksjon, 1; huddepigmentering, 1. Følgende tegn på hudatrofi ble også observert blant 97 personer behandlet med ELOCON Cream i en klinisk studie: glans, 4; telangiectasia, 1; tap av elastisitet, 4; tap av normale hudmerker, 4; tynnhet, 1; og blåmerker, 1.
Følgende ytterligere lokale bivirkninger er rapportert med topikale kortikosteroider, men kan forekomme hyppigere ved bruk av okklusive bandasjer. Disse reaksjonene er: irritasjon, tørrhet, follikulitt, hypertrikose, akneiforme utbrudd, hypopigmentering, perioral dermatitt, allergisk kontaktdermatitt, sekundær infeksjon, striae og miliaria.
NARKOTIKAHANDEL
Ingen legemiddelinteraksjonsstudier er utført med ELOCON Cream.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Effekter på det endokrine systemet
Systemisk absorpsjon av topikale kortikosteroider kan gi reversibel hypothalamus-hypofyse-binyre (HPA) aksesuppresjon med potensial for glukokortikosteroidinsuffisiens. Dette kan oppstå under behandling eller etter seponering av behandlingen. Manifestasjoner av Cushings syndrom, hyperglykemi og glukosuri kan også produseres hos noen pasienter ved systemisk absorpsjon av topikale kortikosteroider under behandling. Faktorer som disponerer en pasient som bruker et topisk kortikosteroid for HPA-akse-undertrykkelse inkluderer bruk av høypotente steroider, store behandlingsoverflater, langvarig bruk, bruk av okklusive bandasjer, endret hudbarriere, leversvikt og ung alder.
På grunn av potensialet for systemisk absorpsjon, kan bruk av topikale kortikosteroider kreve at pasienter med jevne mellomrom blir evaluert for HPA-aksesuppresjon. Dette kan gjøres ved å bruke stimuleringstesten for adrenokortikotropisk hormon (ACTH).
I en studie som evaluerte effekten av mometasonfuroatkrem på HPA-aksen, ble 15 gram påført to ganger daglig i 7 dager til seks voksne personer med psoriasis eller atopisk dermatitt. Resultatene viser at stoffet forårsaket en liten reduksjon av binyrekortikosteroidsekresjonen.
Hvis HPA-aksen undertrykkes, bør det gjøres et forsøk på å gradvis seponere medikamentet, redusere bruksfrekvensen eller erstatte et mindre potent kortikosteroid. Gjenoppretting av HPA-aksefunksjonen er vanligvis umiddelbar ved seponering av topikale kortikosteroider. I sjeldne tilfeller kan tegn og symptomer på glukokortikosteroidinsuffisiens forekomme, noe som krever supplerende systemiske kortikosteroider.
Pediatriske pasienter kan være mer utsatt for systemisk toksisitet fra ekvivalente doser på grunn av deres større forhold mellom hudoverflate og kroppsmasse [se Bruk i spesifikke populasjoner ].
Allergisk kontakteksem
Hvis irritasjon utvikles, bør ELOCON Cream seponeres og passende behandling igangsettes. Allergisk kontaktdermatitt med kortikosteroider diagnostiseres vanligvis ved å observere en svikt i å helbrede i stedet for å merke en klinisk forverring som med de fleste aktuelle produkter som ikke inneholder kortikosteroider. En slik observasjon bør bekreftes med passende diagnostisk lapptesting.
Samtidige hudinfeksjoner
Hvis samtidige hudinfeksjoner er tilstede eller utvikles, bør et passende soppdrepende eller antibakterielt middel brukes. Hvis en gunstig respons ikke oppstår umiddelbart, bør bruken av ELOCON 5g Cream avbrytes til infeksjonen er tilstrekkelig kontrollert.

Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Langtidsdyrestudier har ikke blitt utført for å evaluere det kreftfremkallende potensialet til ELOCON 5g Cream. Langsiktige karsinogenitetsstudier av mometasonfuroat ble utført ved inhalasjonsvei hos rotter og mus. I en 2-årig karsinogenitetsstudie på Sprague Dawley-rotter, viste mometasonfuroat ingen statistisk signifikant økning av svulster ved inhalasjonsdoser opp til 67 mcg/kg (omtrent 0,04 ganger den estimerte maksimale kliniske topiske dosen fra ELOCON 5g krem på en mcg/m²-basis ). I en 19-måneders karsinogenitetsstudie i sveitsiske CD-1-mus, viste mometasonfuroat ingen statistisk signifikant økning i forekomsten av svulster ved inhalasjonsdoser opp til 160 mcg/kg (omtrent 0,05 ganger den estimerte maksimale kliniske topiske dosen fra ELOCON Cream på en mcg/m² basis).
Mometasonfuroat økte kromosomavvik i en in vitro ovariecelleanalyse fra kinesisk hamster, men økte ikke kromosomavvik i en in vitro lungecelleanalyse av kinesisk hamster. Mometasonfuroat var ikke mutagent i Ames-testen eller muselymfomanalysen, og var ikke klastogent i en in vivo musemikronukleusanalyse, en kromosomavviksanalyse hos rottebenmarg eller en kromosomavviksanalyse hos hannkjønnsceller. Mometasonfuroat induserte heller ikke uplanlagt DNA-syntese in vivo i rottehepatocytter.
I reproduksjonsstudier på rotter ble det ikke forårsaket nedsatt fertilitet hos hann- eller hunnrotter ved subkutane doser opp til 15 mcg/kg (omtrent 0,01 ganger den estimerte maksimale kliniske topiske dosen fra ELOCON 5g krem, på mcg/m²-basis).
Bruk i spesifikke populasjoner
Svangerskap
Teratogene effekter - Graviditetskategori C
Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Derfor skal ELOCON 5g Cream kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Kortikosteroider har vist seg å være teratogene hos laboratoriedyr når de administreres systemisk i relativt lave dosenivåer. Noen kortikosteroider har vist seg å være teratogene etter dermal påføring hos laboratoriedyr.
Når mometasonfuroat ble gitt til gravide rotter, kaniner og mus, økte fostermisdannelser. Dosene som ga misdannelser reduserte også fosterveksten, målt ved lavere fostervekt og/eller forsinket ossifikasjon. Mometasonfuroat forårsaket også dystoki og relaterte komplikasjoner når det ble gitt til rotter under slutten av svangerskapet.
Hos mus forårsaket mometasonfuroat ganespalte ved subkutane doser på 60 mcg/kg og over. Fosterets overlevelse ble redusert med 180 mcg/kg. Ingen toksisitet ble observert ved 20 mcg/kg. (Doser på 20, 60 og 180 mcg/kg i mus er omtrent 0,01, 0,02 og 0,05 ganger den estimerte maksimale kliniske topiske dosen fra ELOCON Cream på en mcg/m²-basis.)
Hos rotter ga mometasonfuroat navlebrokk ved topiske doser på 600 mcg/kg og over. En dose på 300 mcg/kg ga forsinkelser i ossifikasjonen, men ingen misdannelser. (Doser på 300 og 600 mcg/kg hos rotter er omtrent 0,2 og 0,4 ganger den estimerte maksimale kliniske topiske dosen fra ELOCON 5g Cream på en mcg/m²-basis.)
Hos kaniner forårsaket mometasonfuroat flere misdannelser (f.eks. bøyde forpoter, galleblærenes, navlebrokk, hydrocefali) ved topiske doser på 150 mcg/kg og over (omtrent 0,2 ganger den estimerte maksimale kliniske topiske dosen fra ELOCON Cream på en mcg/mcg) m² basis). I en oral studie økte mometasonfuroat resorpsjoner og forårsaket ganespalte og/eller hodemisdannelser (hydrocefali og kuppelformet hode) ved 700 mcg/kg. Ved 2800 mcg/kg ble de fleste kullene abortert eller resorbert. Ingen toksisitet ble observert ved 140 mcg/kg. (Doser på 140, 700 og 2800 mcg/kg hos kaninen er omtrent 0,2, 0,9 og 3,6 ganger den estimerte maksimale kliniske topiske dosen fra ELOCON 5g Cream på en mcg/m²-basis.)
Når rotter fikk subkutane doser av mometasonfuroat gjennom hele svangerskapet eller i de senere stadier av svangerskapet, forårsaket 15 mcg/kg langvarig og vanskelig fødsel og reduserte antall levendefødte, fødselsvekt og tidlig overlevelse av valpen. Lignende effekter ble ikke observert ved 7,5 mcg/kg. (Doser på 7,5 og 15 mcg/kg hos rotter er omtrent 0,005 og 0,01 ganger den estimerte maksimale kliniske topiske dosen fra ELOCON Cream på en mcg/m²-basis.)
Ammende mødre
Systemisk administrerte kortikosteroider vises i morsmelk og kan undertrykke vekst, forstyrre endogen kortikosteroidproduksjon eller forårsake andre uheldige effekter. Det er ikke kjent om lokal administrering av kortikosteroider kan resultere i tilstrekkelig systemisk absorpsjon til å produsere påvisbare mengder i morsmelk. Fordi mange legemidler skilles ut i morsmelk, bør det utvises forsiktighet når ELOCON 5g krem gis til en ammende kvinne.
Pediatrisk bruk
ELOCON Cream kan brukes med forsiktighet hos pediatriske pasienter 2 år eller eldre, selv om sikkerheten og effekten av legemiddelbruk i mer enn 3 uker ikke er fastslått. Siden sikkerhet og effekt av ELOCON 5g Cream ikke er fastslått hos pediatriske pasienter under 2 år, anbefales ikke bruk i denne aldersgruppen.
en pediatrisk studie ble 24 personer med atopisk dermatitt, hvorav 19 personer i alderen 2 til 12 år, behandlet med ELOCON Cream én gang daglig. Flertallet av forsøkspersonene forsvant innen 3 uker.ELOCON 5g krem forårsaket HPA-akseundertrykkelse hos ca. 16 % av pediatriske forsøkspersoner i alderen 6 til 23 måneder, som viste normal binyrefunksjon ved Cortrosyn-test før behandlingsstart, og ble behandlet i ca. 3 uker over en gjennomsnittlig kroppsoverflateareal på 41 % (område 15 %-94 %). Kriteriene for suppresjon var: basalt kortisolnivå på ≤ 5 mcg/dL, 30-minutters poststimuleringsnivå på ≤ 18 mcg/dL, eller en økning på KLINISK FARMAKOLOGI ].
På grunn av et høyere forhold mellom hudoverflate og kroppsmasse, har pediatriske pasienter en større risiko enn voksne for HPA-aksesuppresjon og Cushings syndrom når de behandles med topikale kortikosteroider. De har derfor også større risiko for binyrebarksvikt under og/eller etter seponering av behandlingen. Pediatriske pasienter kan være mer utsatt enn voksne for hudatrofi, inkludert striae, når de behandles med topikale kortikosteroider. Pediatriske pasienter som bruker topikale kortikosteroider på mer enn 20 % av kroppsoverflaten har høyere risiko for HPA-akseundertrykkelse.
HPA-akseundertrykkelse, Cushings syndrom, lineær vekstretardasjon, forsinket vektøkning og intrakraniell hypertensjon er rapportert hos pediatriske pasienter som får topikale kortikosteroider. Manifestasjoner av binyresuppresjon hos barn inkluderer lave plasmakortisolnivåer og fravær av respons på ACTH-stimulering. Manifestasjoner av intrakraniell hypertensjon inkluderer svulmende fontaneller, hodepine og bilateralt papilleødem.
ELOCON Cream skal ikke brukes til behandling av bleieeksem.
Geriatrisk bruk
Kliniske studier av ELOCON 5g Cream inkluderte 190 forsøkspersoner som var 65 år eller eldre og 39 forsøkspersoner som var 75 år eller eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre pasienter, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Større sensitivitet hos enkelte eldre individer kan imidlertid ikke utelukkes.
OVERDOSE
Lokalt påført ELOCON Cream kan absorberes i tilstrekkelige mengder til å gi systemiske effekter [se ADVARSLER OG FORHOLDSREGLER ].
KONTRAINDIKASJONER
Ingen.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Som andre aktuelle kortikosteroider har mometasonfuroat antiinflammatoriske, kløestillende og vasokonstriktive egenskaper. Mekanismen for den antiinflammatoriske aktiviteten til topikale steroider er generelt uklar. Imidlertid antas kortikosteroider å virke ved induksjon av fosfolipase A2-hemmende proteiner, samlet kalt lipokortiner. Det er postulert at disse proteinene kontrollerer biosyntesen av potente mediatorer av betennelse som prostaglandiner og leukotriener ved å hemme frigjøringen av deres vanlige forløper arakidonsyre. Arakidonsyre frigjøres fra membranfosfolipider av fosfolipase A2.
Farmakodynamikk
Studier utført med ELOCON 5g Cream indikerer at den er i middels styrke sammenlignet med andre aktuelle kortikosteroider.
en studie som evaluerte effekten av mometasonfuroatkrem på HPA-aksen, ble 15 gram påført to ganger daglig i 7 dager til seks voksne personer med psoriasis eller atopisk dermatitt. Kremen ble påført uten okklusjon på minst 30 % av kroppsoverflaten. Resultatene viste at stoffet forårsaket en liten reduksjon av binyrekortikosteroidsekresjonen [se ADVARSLER OG FORHOLDSREGLER ].
97 pediatriske forsøkspersoner i alderen 6 til 23 måneder med atopisk dermatitt ble registrert i en åpen sikkerhetsstudie på HPA-aksen. ELOCON Cream ble påført én gang daglig i ca. 3 uker over et gjennomsnittlig kroppsoverflateareal på 41 % (område 15 %-94 %). Hos omtrent 16 % av forsøkspersonene som viste normal binyrefunksjon ved Cortrosyn-test før behandlingsstart, ble binyresuppresjon observert ved slutten av behandlingen med ELOCON 5g Cream. Kriteriene for suppresjon var: basalt kortisolnivå på ≤ 5 mcg/dL, 30-minutters poststimuleringsnivå på ≤ 18 mcg/dL, eller en økning på Bruk i spesifikke populasjoner ].
Farmakokinetikk
Omfanget av perkutan absorpsjon av topikale kortikosteroider bestemmes av mange faktorer, inkludert bæreren og integriteten til den epidermale barrieren. Studier på mennesker indikerer at omtrent 0,4 % av den påførte dosen av ELOCON 5g Cream kommer inn i sirkulasjonen etter 8 timers kontakt på normal hud uten okklusjon. Betennelse og/eller andre sykdomsprosesser i huden kan øke perkutan absorpsjon.
Kliniske studier
Sikkerheten og effekten av ELOCON 5g krem for behandling av kortikosteroid-responsive dermatoser ble evaluert i to randomiserte, dobbeltblindede, vehikelkontrollerte kliniske studier, en i psoriasis og en i atopisk dermatitt. Totalt 366 forsøkspersoner (12-81 år), hvorav 177 mottok ELOCON Cream og 181 personer mottok kjøretøykrem, ble evaluert i disse forsøkene. ELOCON Cream eller kjøretøykremen ble påført én gang daglig i 21 dager.
De to forsøkene viste at ELOCON 5g Cream er effektiv i behandlingen av psoriasis og atopisk dermatitt.
PASIENTINFORMASJON
Informer pasienter om følgende:
- . Bruk ELOCON 5g krem som anvist av legen. Den er kun til ekstern bruk. . Unngå kontakt med øynene. . Ikke bruk ELOCON Cream på ansikt, armhuler eller lyskeområder med mindre legen har instruert det. . Ikke bruk ELOCON 5g Cream for andre lidelser enn den den er foreskrevet for. . Det behandlede hudområdet skal ikke bindes eller på annen måte dekkes eller pakkes inn for å være okklusive, med mindre legen har instruert det. . Rapporter eventuelle tegn på lokale bivirkninger til legen. . Råd pasienter om ikke å bruke ELOCON 5g Cream i behandlingen av bleieeksem. Ikke bruk ELOCON Cream i bleieområdet, da bleier eller plastbukser kan utgjøre okklusive bandasjer. . Avbryt behandlingen når kontroll er oppnådd. Hvis ingen bedring sees innen 2 uker, kontakt legen. . Ikke bruk andre kortikosteroidholdige produkter med ELOCON Cream uten først å konsultere legen.
