Crestor 10mg, 20mg, 5mg Rosuvastatin Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Crestor og hvordan brukes det?
Crestor er en reseptbelagt medisin som brukes til å senke LDL-kolesterol (lipoprotein med lav tetthet) og triglyserider i blodet, bremse utviklingen av plakk i blodårene, redusere risikoen for hjerneslag og hjerteinfarkt. Crestor 20mg kan brukes alene eller sammen med andre medisiner.
Crestor er et lipidsenkende middel, statiner, HMG-CoA-reduktasehemmere.
Det er ikke kjent om Crestor er trygt og effektivt hos barn under 8 år.
Hva er de mulige bivirkningene av Crestor?
Crestor kan forårsake alvorlige bivirkninger, inkludert:
- . uforklarlige muskelsmerter . muskelømhet . muskel svakhet . forvirring . hukommelsesproblemer . smerter i øvre mage . tretthet . tap av Appetit . mørk urin . gulfarging av hud eller øyne (gulsott)
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Crestor inkluderer:
- . hodepine . svakhet . muskelsmerter . kvalme . magesmerter
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Crestor. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
CRESTOR (rosuvastatin kalsium) er et syntetisk lipidsenkende middel for oral administrering.
Det kjemiske navnet på rosuvastatinkalsium er bis[(E)-7-[4-(4-fluorfenyl)-6-isopropyl-2-[metyl(metylsulfonyl)amino]pyrimidin-5-yl](3R,5S)-3 ,5-dihydroksyhept-6-ensyre] kalsiumsalt med følgende strukturformel:
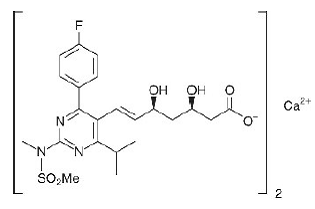
Den empiriske formelen for rosuvastatinkalsium er (C22H27FN3O6S)2Ca og molekylvekten er 1001,14. Rosuvastatin kalsium er et hvitt amorft pulver som er lite løselig i vann og metanol, og lett løselig i etanol. Rosuvastatin kalsium er en hydrofil forbindelse med en fordelingskoeffisient (oktanol/vann) på 0,13 ved pH på 7,0.
CRESTOR tabletter for oral administrering inneholder 5, 10, 20 eller 40 mg rosuvastatin og følgende inaktive ingredienser: Hver tablett inneholder: mikrokrystallinsk cellulose NF, laktosemonohydrat NF, tribasisk kalsiumfosfat NF, krospovidon NF, magnesiumstearat NF, hypromellose triacetin NF, titandioksid USP, gult jernoksid og rødt jernoksid NF.
INDIKASJONER
Hyperlipidemi og blandet dyslipidemi
CRESTOR er indisert som tilleggsbehandling til diett for å redusere forhøyet total-C, LDL-C, ApoB, non-HDL-C og triglyserider og for å øke HDL-C hos voksne pasienter med primær hyperlipidemi eller blandet dyslipidemi. Lipidforandrende midler bør brukes i tillegg til en diett begrenset i mettet fett og kolesterol når respons på diett og ikke-farmakologiske intervensjoner alene har vært utilstrekkelig.
Pediatriske pasienter med familiær hyperkolesterolemi
CRESTOR 10mg er indisert som et tillegg til diett for:
- . redusere total-C, LDL-C og ApoB-nivåer hos barn og ungdom 8 til 17 år med heterozygot familiær hyperkolesterolemi hvis følgende funn er tilstede etter en adekvat utprøving av diettbehandling: LDL-C >190 mg/dL, eller >160 mg/dL sammen med en positiv familiehistorie med prematur kardiovaskulær sykdom (CVD) eller to eller flere andre CVD-risikofaktorer. . redusere LDL-C, Total-C, non-HDL-C og ApoB hos barn og ungdom 7 til 17 år med homozygot familiær hyperkolesterolemi, enten alene eller sammen med andre lipidsenkende behandlinger (f.eks. LDL-aferese).
Hypertriglyseridemi
CRESTOR er indisert som tilleggsbehandling til diett for behandling av voksne pasienter med hypertriglyseridemi.
Primær dysbetalipoproteinemi (type III hyperlipoproteinemi)
CRESTOR er indisert som et tillegg til diett for behandling av voksne pasienter med primær dysbetalipoproteinemi (type III hyperlipoproteinemi).
Voksne pasienter med homozygot familiær hyperkolesterolemi
CRESTOR er indisert som tilleggsbehandling til andre lipidsenkende behandlinger (f.eks. LDL-aferese) eller alene hvis slike behandlinger ikke er tilgjengelige for å redusere LDL-C, Total-C og ApoB hos voksne pasienter med homozygot familiær hyperkolesterolemi.
Bremsing av progresjonen av aterosklerose
CRESTOR 5mg er indisert som tilleggsbehandling til diett for å bremse progresjonen av aterosklerose hos voksne pasienter som en del av en behandlingsstrategi for å senke Total-C og LDL-C til målnivåene.
Primær forebygging av kardiovaskulær sykdom
Hos individer uten klinisk tydelig koronar hjertesykdom, men med økt risiko for hjerte- og karsykdom basert på alder ≥50 år hos menn og ≥60 år hos kvinner, hsCRP ≥2 mg/L, og tilstedeværelsen av minst én ekstra kardiovaskulær sykdom risikofaktor som hypertensjon, lavt HDL-C, røyking eller en familiehistorie med prematur koronar hjertesykdom, CRESTOR er indisert for å:
- . redusere risikoen for hjerneslag . redusere risikoen for hjerteinfarkt . redusere risikoen for arterielle revaskulariseringsprosedyrer
Bruksbegrensninger
CRESTOR er ikke studert ved Fredrickson Type I og V dyslipidemier.
DOSERING OG ADMINISTRASJON
Generell doseringsinformasjon
Doseområdet for CRESTOR 5 mg hos voksne er 5 til 40 mg oralt én gang daglig. Vanlig startdose er 10 til 20 mg én gang daglig. Vanlig startdose hos voksne pasienter med homozygot familiær hyperkolesterolemi er 20 mg én gang daglig.
Den maksimale CRESTOR-dosen på 20 mg på 40 mg skal kun brukes til de pasientene som ikke har oppnådd LDL-C-målet ved å bruke 20 mg-dosen [se ADVARSLER OG FORHOLDSREGLER ].
CRESTOR 5mg kan administreres som en enkeltdose når som helst på dagen, med eller uten mat. Tabletten skal svelges hel.
Ved oppstart av CRESTOR-behandling eller bytting fra annen behandling med HMG-CoA-reduktasehemmer, bør den passende CRESTOR 10 mg startdosen først brukes, og først deretter titreres i henhold til pasientens respons og individuelle mål med behandlingen.
Etter oppstart eller ved titrering av CRESTOR, bør lipidnivåene analyseres innen 2 til 4 uker og dosen justeres deretter.
Pediatrisk dosering
Ved heterozygot familiær hyperkolesterolemi er anbefalt doseområde 5 til 10 mg oralt én gang daglig hos pasienter 8 til under 10 år, og 5 til 20 mg oralt én gang daglig hos pasienter i alderen 10 til 17 år.
Ved homozygot familiær hyperkolesterolemi er den anbefalte dosen 20 mg oralt én gang daglig hos pasienter i alderen 7 til 17 år.
Dosering hos asiatiske pasienter
Hos asiatiske pasienter bør du vurdere å starte CRESTOR 20 mg-behandling med 5 mg én gang daglig på grunn av økte plasmakonsentrasjoner av rosuvastatin. Den økte systemiske eksponeringen bør tas i betraktning ved behandling av asiatiske pasienter som ikke er tilstrekkelig kontrollert ved doser opptil 20 mg/dag [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
Bruk sammen med samtidig terapi
Pasienter som tar cyklosporin
Dosen av CRESTOR 20 mg bør ikke overstige 5 mg én gang daglig [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
Pasienter som tar Gemfibrozil
Unngå samtidig bruk av CRESTOR og gemfibrozil. Hvis samtidig bruk ikke kan unngås, start CRESTOR med 5 mg én gang daglig. Dosen av CRESTOR bør ikke overstige 10 mg én gang daglig [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
Pasienter som tar atazanavir og ritonavir, lopinavir og ritonavir eller simeprevir
Start CRESTOR 10 mg-behandling med 5 mg én gang daglig. Dosen av CRESTOR bør ikke overstige 10 mg én gang daglig [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
Dosering hos pasienter med alvorlig nedsatt nyrefunksjon
For pasienter med alvorlig nedsatt nyrefunksjon (CLcr Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
5 mg: Gule, runde, bikonvekse, drasjerte tabletter. Preget "CRESTOR" og "5" på den ene siden av tabletten.
10 mg: Rosa, runde, bikonvekse, belagte tabletter. Preget "CRESTOR" og "10" på den ene siden av tabletten.
20 mg: Rosa, runde, bikonvekse, belagte tabletter. Preget "CRESTOR" og "20" på den ene siden av tabletten.
40 mg: Rosa, ovale, bikonvekse, belagte tabletter. Preget "CRESTOR" på den ene siden og "40" på den andre siden av tabletten.
Oppbevaring og håndtering
CRESTOR® (rosuvastatin kalsium) tabletter leveres som:
NDC 0310-0755-90: 5 mg. Gule, runde, bikonvekse, belagte tabletter. Preget "CRESTOR" og "5" på den ene siden; flaske med 90 tabletter
NDC 0310-0751-90: 10 mg. Rosa, runde, bikonvekse, belagte tabletter. Preget "CRESTOR" og "10" på den ene siden; flaske med 90 tabletter
NDC 0310-0751-39: 10 mg. Rosa, runde, bikonvekse, belagte tabletter. Preget "CRESTOR" og "10" på den ene siden; enhetsdosepakninger på 100 stk
NDC 0310-0752-90: 20 mg. Rosa, runde, bikonvekse, belagte tabletter. Preget "CRESTOR" og "20" på den ene siden; flasker à 90 stk
NDC 0310-0752-39: 20 mg. Rosa, runde, bikonvekse, belagte tabletter. Preget "CRESTOR" og "20" på den ene siden; enhetsdosepakninger på 100 stk
NDC 0310-0754-30: 40 mg. Rosa, ovale, bikonvekse, belagte tabletter. Preget "CRESTOR" på den ene siden og "40" på den andre siden; flasker med 30 stk
Oppbevaring
Oppbevares ved kontrollert romtemperatur, 20-25°C (68-77°F) [se USP kontrollert romtemperatur ]. Beskytt mot fuktighet.
Distribuert av: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revidert: sep 2018
BIVIRKNINGER
Følgende alvorlige bivirkninger er omtalt mer detaljert i andre deler av etiketten:
- . Rabdomyolyse med myoglobinuri og akutt nyresvikt og myopati (inkludert myositt) [se ADVARSLER OG FORHOLDSREGLER ] . Leverenzymavvik [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske studier
Fordi kliniske studier er utført under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
I CRESTOR-databasen for kontrollerte kliniske studier (placebo eller aktiv-kontrollert) med 5394 pasienter med en gjennomsnittlig behandlingsvarighet på 15 uker, avbrøt 1,4 % av pasientene på grunn av bivirkninger. De vanligste bivirkningene som førte til seponering av behandlingen var:
- . myalgi . magesmerter . kvalme
De vanligst rapporterte bivirkningene (insidens ≥2%) i CRESTOR 5 mg kontrollerte kliniske studiedatabase med 5394 pasienter var:
- . hodepine . myalgi . magesmerter . asteni . kvalme
Bivirkninger rapportert hos ≥2 % av pasientene i placebokontrollerte kliniske studier og med en høyere rate enn placebo er vist i tabell 1. Disse studiene hadde en behandlingsvarighet på opptil 12 uker.
Andre bivirkninger rapportert i kliniske studier var magesmerter, svimmelhet, overfølsomhet (inkludert utslett, pruritus, urticaria og angioødem) og pankreatitt. Følgende laboratorieavvik er også rapportert: peilepinnepositiv proteinuri og mikroskopisk hematuri [se ADVARSLER OG FORHOLDSREGLER ]; forhøyet kreatinfosfokinase, transaminaser, glukose, glutamyltranspeptidase, alkalisk fosfatase og bilirubin; og uregelmessigheter i skjoldbruskkjertelen.
METEOR-studien, som involverte 981 deltakere behandlet med rosuvastatin 40 mg (n=700) eller placebo (n=281) med en gjennomsnittlig behandlingsvarighet på 1,7 år, 5,6 % av pasientene behandlet med CRESTOR 5 mg versus 2,8 % av placebobehandlede personer. seponert på grunn av bivirkninger. De vanligste bivirkningene som førte til seponering av behandlingen var: myalgi, økt leverenzym, hodepine og kvalme [se Kliniske studier ].
Bivirkninger rapportert hos ≥2 % av pasientene og med en høyere rate enn placebo er vist i tabell 2.
I JUPITER-studien ble 17 802 deltakere behandlet med rosuvastatin 20 mg (n=8901) eller placebo (n=8901) i en gjennomsnittlig varighet på 2 år. En høyere prosentandel av rosuvastatin-behandlede pasienter versus placebo-behandlede pasienter, henholdsvis 6,6 % og 6,2 %, avbrøt studiemedisinen på grunn av en bivirkning, uavhengig av behandlingsårsakssammenheng. Myalgi var den vanligste bivirkningen som førte til seponering av behandlingen.
JUPITER var det en signifikant høyere frekvens av diabetes mellitus rapportert hos pasienter som tok rosuvastatin (2,8 %) sammenlignet med pasienter som tok placebo (2,3 %). Gjennomsnittlig HbA1c var signifikant økt med 0,1 % hos rosuvastatin-behandlede pasienter sammenlignet med placebo-behandlede pasienter. Antall pasienter med HbA1c >6,5 % ved slutten av studien var signifikant høyere hos rosuvastatin-behandlede versus placebo-behandlede pasienter [se ADVARSLER OG FORHOLDSREGLER og Kliniske studier ].
Bivirkninger rapportert hos ≥2 % av pasientene og med en høyere rate enn placebo er vist i tabell 3.
Pediatriske pasienter med heterozygot familiær hyperkolesterolemi
I en 12-ukers kontrollert studie på gutter og postmenarkeale jenter i alderen 10 til 17 år med heterozygot familiær hyperkolesterolemi med CRESTOR 5 til 20 mg daglig [se Bruk i spesifikke populasjoner og Kliniske studier ], økte serumkreatinfosfokinase (CK) >10 x ULN ble observert hyppigere hos rosuvastatin sammenlignet med placebobehandlede barn. Fire av 130 (3 %) barn behandlet med rosuvastatin (2 behandlet med 10 mg og 2 behandlet med 20 mg) hadde økt CK >10 x ULN, sammenlignet med 0 av 46 barn på placebo.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av CRESTOR etter godkjenning: artralgi, fatal og ikke-fatal leversvikt, hepatitt, gulsott, trombocytopeni, depresjon, søvnforstyrrelser (inkludert søvnløshet og mareritt), perifer nevropati, interstitiell lungesykdom og gynekomasti. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Det har vært sjeldne rapporter om immun-mediert nekrotiserende myopati assosiert med statinbruk [se ADVARSLER OG FORHOLDSREGLER ].
Det har vært sjeldne rapporter etter markedsføring om kognitiv svekkelse (f.eks. hukommelsestap, glemsomhet, hukommelsestap, hukommelsessvikt og forvirring) assosiert med statinbruk. Disse kognitive problemene er rapportert for alle statiner. Rapportene er generelt ikke-seriøse og reversible ved seponering av statin, med varierende tid til symptomdebut (1 dag til år) og symptomoppløsning (median på 3 uker).
NARKOTIKAHANDEL
Syklosporin
Cyklosporin økte eksponeringen for rosuvastatin og kan føre til økt risiko for myopati. Hos pasienter som tar ciklosporin, bør dosen av CRESTOR 10 mg derfor ikke overstige 5 mg én gang daglig [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Gemfibrozil
Gemfibrozil økte eksponeringen for rosuvastatin signifikant. På grunn av en observert økt risiko for myopati/rabdomyolyse, bør kombinasjonsbehandling med CRESTOR og gemfibrozil unngås. Hvis den brukes sammen, bør dosen av CRESTOR 10 mg ikke overstige 10 mg én gang daglig [se KLINISK FARMAKOLOGI ].
Proteasehemmere
Samtidig administrering av rosuvastatin med visse proteasehemmere har ulike effekter på rosuvastatineksponering og kan øke risikoen for myopati. Simeprevir, som er en hepatitt C-virus (HCV) proteasehemmer, eller kombinasjoner av atazanavir/ritonavir eller lopinavir/ritonavir, som er HIV-1 proteasehemmere, øker eksponeringen for rosuvastatin [se tabell 4 - KLINISK FARMAKOLOGI ]. For disse proteasehemmere bør dosen av CRESTOR 5 mg ikke overstige 10 mg én gang daglig. Kombinasjonene av fosamprenavir/ritonavir eller tipranavir/ritonavir, som er HIV-1-proteasehemmere, gir liten eller ingen endring i eksponeringen for rosuvastatin. Forsiktighet bør utvises når rosuvastatin gis samtidig med proteasehemmere [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Kumarin antikoagulantia
CRESTOR 20 mg økte INR signifikant hos pasienter som fikk kumarinantikoagulantia. Det bør derfor utvises forsiktighet når kumarinantikoagulantia gis sammen med CRESTOR. Hos pasienter som tar kumarinantikoagulantia og CRESTOR samtidig, bør INR bestemmes før oppstart av CRESTOR og ofte nok under tidlig behandling for å sikre at ingen signifikant endring av INR oppstår [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Niacin
Risikoen for skjelettmuskeleffekter kan økes når CRESTOR 5 mg brukes i kombinasjon med lipidmodifiserende doser (≥1 g/dag) av niacin; forsiktighet bør utvises ved forskrivning med CRESTOR [se ADVARSLER OG FORHOLDSREGLER ].
Fenofibrat
Når CRESTOR 20 mg ble administrert samtidig med fenofibrat, ble det ikke observert noen klinisk signifikant økning i AUC for rosuvastatin eller fenofibrat. Fordi det er kjent at risikoen for myopati under behandling med HMG-CoA-reduktasehemmere øker ved samtidig bruk av fenofibrater, bør det utvises forsiktighet ved forskrivning av fenofibrater med CRESTOR [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Kolkisin
Tilfeller av myopati, inkludert rabdomyolyse, er rapportert med HMG-CoA-reduktasehemmere, inkludert rosuvastatin, administrert samtidig med kolkisin, og forsiktighet bør utvises ved forskrivning av CRESTOR med kolkisin [se ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Skjelettmuskeleffekter
Tilfeller av myopati og rabdomyolyse med akutt nyresvikt sekundært til myoglobinuri er rapportert med HMG-CoA-reduktasehemmere, inkludert CRESTOR. Disse risikoene kan oppstå ved alle dosenivåer, men økes ved høyeste dose (40 mg).
CRESTOR 5 mg bør forskrives med forsiktighet til pasienter med predisponerende faktorer for myopati (f.eks. alder ≥65 år, utilstrekkelig behandlet hypotyreose, nedsatt nyrefunksjon). Risikoen for myopati under behandling med CRESTOR 5mg kan øke ved samtidig administrering av noen andre lipidsenkende terapier (fibrater eller niacin), gemfibrozil, ciklosporin, atazanavir/ritonavir, lopinavir/ritonavir eller simeprevir [se DOSERING OG ADMINISTRASJON og NARKOTIKAHANDEL ]. Tilfeller av myopati, inkludert rabdomyolyse, er rapportert med HMG-CoA-reduktasehemmere, inkludert rosuvastatin, administrert samtidig med kolkisin, og forsiktighet bør utvises ved forskrivning av CRESTOR med kolkisiner [se NARKOTIKAHANDEL ].
CRESTOR-behandlingen bør seponeres hvis det oppstår markert forhøyede kreatinkinasenivåer eller myopati er diagnostisert eller mistenkt. CRESTOR 5 mg-behandling bør også midlertidig avbrytes hos enhver pasient med en akutt, alvorlig tilstand som tyder på myopati eller disponerer for utvikling av nyresvikt sekundært til rabdomyolyse (f.eks. sepsis, hypotensjon, dehydrering, større operasjoner, traumer, alvorlig metabolsk, endokrin, og elektrolyttforstyrrelser, eller ukontrollerte anfall).
Det har vært sjeldne rapporter om immunmediert nekrotiserende myopati (IMNM), en autoimmun myopati, assosiert med statinbruk. IMNM er karakterisert ved: proksimal muskelsvakhet og forhøyet serumkreatinkinase, som vedvarer til tross for seponering av statinbehandling; muskelbiopsi som viser nekrotiserende myopati uten signifikant betennelse; forbedring med immunsuppressive midler.
Alle pasienter bør rådes til umiddelbart å rapportere uforklarlig muskelsmerte, ømhet eller svakhet til legen, spesielt hvis de er ledsaget av ubehag eller feber eller hvis muskeltegn og symptomer vedvarer etter seponering av CRESTOR.
Leverenzymavvik
Det anbefales at leverenzymtester utføres før initiering av CRESTOR 10 mg, og hvis det oppstår tegn eller symptomer på leverskade.
Økning i serumtransaminaser [AST (SGOT) eller ALAT (SGPT)] er rapportert med HMG-CoA-reduktasehemmere, inkludert CRESTOR. I de fleste tilfeller var forhøyelsene forbigående og forsvant eller forbedret ved fortsatt behandling eller etter et kort avbrudd i behandlingen. Det var to tilfeller av gulsott, hvor det ikke kunne fastslås en sammenheng med CRESTOR-behandling, som forsvant etter seponering av behandlingen. Det var ingen tilfeller av leversvikt eller irreversibel leversykdom i disse forsøkene. I en samlet analyse av placebokontrollerte studier forekom økninger i serumtransaminaser til >3 ganger øvre normalgrense hos 1,1 % av pasientene som tok CRESTOR 5 mg versus 0,5 % av pasientene behandlet med placebo.
Det har vært sjeldne rapporter etter markedsføring om fatal og ikke-fatal leversvikt hos pasienter som tar statiner, inkludert rosuvastatin. Hvis det oppstår alvorlig leverskade med kliniske symptomer og/eller hyperbilirubinemi eller gulsott under behandling med CRESTOR 20 mg, avbryt behandlingen umiddelbart. Hvis en alternativ etiologi ikke finnes, må du ikke starte CRESTOR på nytt.
CRESTOR 5mg bør brukes med forsiktighet hos pasienter som inntar betydelige mengder alkohol og/eller har en historie med kronisk leversykdom [se KLINISK FARMAKOLOGI ]. Aktiv leversykdom, som kan inkludere uforklarlige vedvarende transaminaseøkninger, er en kontraindikasjon for bruk av CRESTOR [se KONTRAINDIKASJONER ].
Samtidig kumarinantikoagulanter
Forsiktighet bør utvises når antikoagulantia gis sammen med CRESTOR på grunn av dets potensering av effekten av kumarin-type antikoagulantia for å forlenge protrombintiden/INR. Hos pasienter som tar kumarinantikoagulantia og CRESTOR samtidig, bør INR bestemmes før start med CRESTOR 10 mg og ofte nok under tidlig behandling for å sikre at ingen signifikant endring av INR oppstår [se NARKOTIKAHANDEL ].
Proteinuri og hematuri
CRESTORs kliniske studieprogram ble peilepinnepositiv proteinuri og mikroskopisk hematuri observert blant CRESTOR-behandlede pasienter. Disse funnene var hyppigere hos pasienter som tok CRESTOR 40 mg, sammenlignet med lavere doser av CRESTOR 20 mg eller komparator HMG-CoA-reduktasehemmere, selv om det generelt var forbigående og ikke var assosiert med forverret nyrefunksjon. Selv om den kliniske betydningen av dette funnet er ukjent, bør en dosereduksjon vurderes for pasienter på CRESTOR-behandling med uforklarlig vedvarende proteinuri og/eller hematuri under rutinemessig urinanalyse.
Endokrine effekter
Økning i HbA1c og fastende serumglukosenivåer er rapportert med HMG-CoA-reduktasehemmere, inkludert CRESTOR. Basert på data fra kliniske studier med CRESTOR, kan disse økningene i noen tilfeller overstige terskelen for diagnostisering av diabetes mellitus [se BIVIRKNINGER ].
Selv om kliniske studier har vist at CRESTOR 10 mg alene ikke reduserer basal plasmakortisolkonsentrasjon eller svekker binyrereserven, bør det utvises forsiktighet hvis CRESTOR administreres samtidig med legemidler som kan redusere nivåene eller aktiviteten til endogene steroidhormoner som ketokonazol, spironolakton og cimetidin.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Pasienter bør instrueres om ikke å ta 2 doser CRESTOR innen 12 timer etter hverandre.
Skjelettmuskeleffekter
Pasienter bør rådes til å rapportere omgående uforklarlige muskelsmerter, ømhet eller svakhet, spesielt hvis de er ledsaget av ubehag eller feber eller hvis disse muskeltegnene eller symptomene vedvarer etter seponering av CRESTOR.
Samtidig bruk av antacida
Når du tar CRESTOR 5 mg med et kombinasjonssyrebindende middel av aluminium og magnesiumhydroksid, bør antacida tas minst 2 timer etter administrering av CRESTOR 10 mg.
Embryofetal toksisitet
Informer kvinner om reproduksjonspotensialet om risikoen for et foster, om å bruke effektiv prevensjon under behandlingen, og å informere helsepersonell om kjent eller mistenkt graviditet. [se KONTRAINDIKASJONER og Bruk i spesifikke populasjoner ].
Amming
Råd kvinner til ikke å amme under behandling med CRESTOR [se KONTRAINDIKASJONER og Bruk i spesifikke populasjoner ].
Leverenzymer
Det anbefales at leverenzymtester utføres før oppstart av CRESTOR og hvis det oppstår tegn eller symptomer på leverskade. Alle pasienter som behandles med CRESTOR bør rådes til umiddelbart å rapportere alle symptomer som kan indikere leverskade, inkludert tretthet, anoreksi, ubehag i øvre høyre del av magen, mørk urin eller gulsott.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
I en 104-ukers karsinogenitetsstudie på rotter ved dosenivåer på 2, 20, 60 eller 80 mg/kg/dag ved oral sonde, var forekomsten av uterine stromale polypper signifikant økt hos hunner ved 80 mg/kg/dag ved systemisk eksponering 20 ganger human eksponering ved 40 mg/dag basert på AUC. Økt forekomst av polypper ble ikke sett ved lavere doser.
en 107-ukers karsinogenitetsstudie på mus som ble gitt 10, 60 eller 200 mg/kg/dag ved oral sonde, ble en økt forekomst av hepatocellulært adenom/karsinom observert ved 200 mg/kg/dag ved systemisk eksponering 20 ganger human eksponering. ved 40 mg/dag basert på AUC. Økt forekomst av hepatocellulære svulster ble ikke sett ved lavere doser.
Rosuvastatin var ikke mutagent eller klastogent med eller uten metabolsk aktivering i Ames-testen med Salmonella typhimurium og Escherichia coli, muselymfomanalysen og kromosomavviksanalysen i lungeceller fra kinesisk hamster. Rosuvastatin var negativt i mikronukleustesten in vivo hos mus.
fertilitetsstudier med rotter med orale sondedoser på 5, 15, 50 mg/kg/dag, ble hannene behandlet i 9 uker før og gjennom paring, og hunnene ble behandlet 2 uker før paring og gjennom hele paringen frem til 7. svangerskapsdag. effekt på fertilitet ble observert ved 50 mg/kg/dag (systemisk eksponering opptil 10 ganger human eksponering ved 40 mg/dag basert på AUC). I testiklene til hunder behandlet med rosuvastatin ved 30 mg/kg/dag i en måned, ble det sett spermatidiske kjempeceller. Spermatidiske kjempeceller ble observert hos aper etter 6 måneders behandling med 30 mg/kg/dag i tillegg til vakuolering av seminiferøst tubulært epitel. Eksponeringen hos hunden var 20 ganger og hos apen 10 ganger den menneskelige eksponeringen ved 40 mg/dag basert på kroppsoverflate. Lignende funn er sett med andre legemidler i denne klassen.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
CRESTOR 5mg er kontraindisert for bruk hos gravide kvinner siden sikkerheten hos gravide kvinner ikke er fastslått og det ikke er noen åpenbar fordel med behandling med CRESTOR 20mg under graviditet. Fordi HMG-CoA-reduktasehemmere reduserer kolesterolsyntesen og muligens syntesen av andre biologisk aktive stoffer avledet fra kolesterol, kan CRESTOR forårsake fosterskader når det administreres til gravide kvinner. CRESTOR 5mg bør seponeres så snart graviditet oppdages [se KONTRAINDIKASJONER ]. Begrensede publiserte data om bruk av rosuvastatin er utilstrekkelige til å fastslå en legemiddelassosiert risiko for alvorlige medfødte misdannelser eller spontanabort. I reproduksjonsstudier på dyr var det ingen uønskede utviklingseffekter ved oral administrering av rosuvastatin under organogenese ved systemisk eksponering tilsvarende en maksimal anbefalt human dose (MRHD) på 40 mg/dag hos rotter eller kaniner (basert på henholdsvis AUC og kroppsoverflate). ). Hos rotter og kaniner forekom redusert overlevelse av valp/foster ved henholdsvis 12 ganger og tilsvarende MRHD på 40 mg/dag [se Data ].
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2-4 % og 15-20 %.
Data
Menneskelige data
Begrensede publiserte data om rosuvastatin har ikke vist økt risiko for alvorlige medfødte misdannelser eller spontanabort. Sjeldne rapporter om medfødte anomalier har blitt mottatt etter intrauterin eksponering for andre statiner. I en gjennomgang av omtrent 100 prospektivt fulgte graviditeter hos kvinner eksponert for simvastatin eller lovastatin, oversteg ikke forekomsten av medfødte anomalier, spontane aborter og fosterdødsfall/dødfødsler det som kunne forventes i den generelle befolkningen. Antall tilfeller er tilstrekkelig til å utelukke en ≥3 til 4 ganger økning i medfødte anomalier i forhold til bakgrunnsforekomsten. I 89 % av de prospektivt fulgte svangerskapene ble medikamentell behandling igangsatt før svangerskapet og ble avbrutt på et tidspunkt i første trimester da graviditet ble identifisert.
Dyredata
Rosuvastatin krysser placenta hos rotter og kaniner og finnes i fostervev og fostervann ved henholdsvis 3 % og 20 % av mors plasmakonsentrasjon etter en enkelt 25 mg/kg oral sondeernæring hos rotter på drektighetsdag 16. En høyere distribusjon av fostervev (25 % maternal plasmakonsentrasjon) ble observert hos kaniner etter en enkelt oral sondedose på 1 mg/kg på drektighetsdag 18.
Administrering av rosuvastatin indikerte ingen teratogene effekt hos rotter ved ≤25 mg/kg/dag eller hos kaniner ≤3 mg/kg/dag (doser tilsvarende MRHD på 40 mg/dag basert på henholdsvis AUC og kroppsoverflate).
Hos hunnrotter som ble gitt 5, 15 og 50 mg/kg/dag før paring og fortsatte til drektighetsdag 7, resulterte det i redusert kroppsvekt hos fosteret (hunnunger) og forsinket ossifikasjon ved 50 mg/kg/dag (10 ganger eksponeringen hos mennesker kl. MRHD-dosen på 40 mg/dag basert på AUC).
Hos drektige rotter som ble gitt 2, 10 og 50 mg/kg/dag med rosuvastatin fra drektighetsdag 7 til og med ammedag 21 (avvenning), oppsto redusert overlevelse av valpen ved 50 mg/kg/dag (dose tilsvarende 12 ganger MRHD på 40 mg /dag basert kroppsoverflate).
Hos drektige kaniner som ble gitt 0,3, 1 og 3 mg/kg/dag rosuvastatin fra drektighetsdag 6 til dag 18, ble det observert redusert føtal levedyktighet og mødredødelighet ved 3 mg/kg/dag (dose tilsvarende MRHD på 40 mg/ dag basert på kroppsoverflate).
Amming
Risikosammendrag
Bruk av rosuvastatin er kontraindisert under amming [se KONTRAINDIKASJONER ]. Begrensede data indikerer at CRESTOR finnes i morsmelk. Det er ingen tilgjengelig informasjon om effekten av stoffet på det ammede spedbarnet eller effekten av stoffet på melkeproduksjonen. På grunn av potensialet for alvorlige bivirkninger hos et spedbarn som ammes, informer pasienter om at amming ikke anbefales under behandling med CRESTOR.
Kvinner og menn med reproduktivt potensial
Prevensjon
CRESTOR kan forårsake fosterskader når det administreres til en gravid kvinne [se Bruk i spesifikke populasjoner ]. Informer kvinner med reproduksjonsevne til å bruke effektiv prevensjon under behandling med CRESTOR.
Pediatrisk bruk
Hos barn og ungdom i alderen 8 til 17 år med heterozygot familiær hyperkolesterolemi, sikkerheten og effektiviteten av CRESTOR 10 mg som et supplement til dietten for å redusere totalkolesterol, LDL-C og ApoB-nivåer når, etter en adekvat utprøving av diettbehandling, LDL -C overstiger 190 mg/dL eller når LDL-C overstiger 160 mg/dL og det er en positiv familiehistorie med prematur CVD eller to eller flere andre CVD risikofaktorer, ble etablert i en kontrollert studie og i en åpen, ukontrollert rettssak [se Kliniske studier ]. Den langsiktige effekten av CRESTOR-behandling initiert i barndommen for å redusere sykelighet og dødelighet i voksen alder er ikke fastslått.

Sikkerheten og effektiviteten til CRESTOR 5 mg hos barn og ungdom 10 til 17 år med heterozygot familiær hyperkolesterolemi ble evaluert i en kontrollert klinisk studie med 12 ukers varighet etterfulgt av 40 ukers åpen eksponering. Pasienter behandlet med 5 mg, 10 mg og 20 mg daglig CRESTOR 10 mg hadde en bivirkningsprofil som generelt var lik den for pasienter behandlet med placebo. Det var ingen påvisbar effekt av CRESTOR på vekst, vekt, BMI (kroppsmasseindeks) eller seksuell modning [se Kliniske studier ] hos barn og ungdom (10 til 17 år).
CRESTOR har ikke blitt studert i kontrollerte kliniske studier med prepubertale pasienter eller pasienter yngre enn 10 år med heterozygot familiær hyperkolesterolemi. Imidlertid ble sikkerheten og effektiviteten til CRESTOR evaluert i en toårig åpen ukontrollert studie som inkluderte barn og ungdom i alderen 8 til 17 år med heterozygot familiær hyperkolesterolemi [se Kliniske studier ]. Sikkerheten og effekten av CRESTOR 5 mg for å senke LDL-C så generelt ut i samsvar med det som ble observert for voksne pasienter, til tross for begrensninger i den ukontrollerte studiedesignen.
Barn og ungdom i alderen 7 til 15 år med homozygot familiær hyperkolesterolemi ble studert i en 6-ukers randomisert, placebokontrollert, cross-over-studie med CRESTOR 20 mg én gang daglig etterfulgt av 12 ukers åpen behandling [se Kliniske studier ]. Generelt var sikkerhetsprofilen i denne studien i samsvar med den tidligere etablerte sikkerhetsprofilen hos voksne.
Selv om ikke alle bivirkninger identifisert i den voksne populasjonen har blitt observert i kliniske studier med barn og ungdom, bør de samme advarslene og forsiktighetsregler for voksne vurderes for barn og ungdom. Ungdomskvinner bør veiledes om passende prevensjonsmetoder mens de er i behandling med CRESTOR 5 mg [se Bruk i spesifikke populasjoner ].
Geriatrisk bruk
Av de 10 275 pasientene i kliniske studier med CRESTOR, var 3159 (31 %) 65 år og eldre, og 698 (6,8 %) var 75 år og eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre personer, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes.
Eldre pasienter har høyere risiko for myopati og CRESTOR bør forskrives med forsiktighet til eldre [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
Rosuvastatineksponering påvirkes ikke av mild til moderat nedsatt nyrefunksjon (CLcr ≥30 ml/min/1,73 m²). Eksponering for rosuvastatin øker i klinisk signifikant grad hos pasienter med alvorlig nedsatt nyrefunksjon (CLcr DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
CRESTOR er kontraindisert hos pasienter med aktiv leversykdom, som kan inkludere uforklarlige vedvarende økninger i levertransaminasenivåer. Kronisk alkoholleversykdom er kjent for å øke eksponeringen for rosuvastatin; CRESTOR 20 mg bør brukes med forsiktighet hos disse pasientene [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Asiatiske pasienter
Farmakokinetiske studier har vist en omtrentlig 2 ganger økning i median eksponering for rosuvastatin hos asiatiske personer sammenlignet med kaukasiske kontroller. CRESTOR-dosen bør justeres hos asiatiske pasienter [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
OVERDOSE
Det finnes ingen spesifikk behandling ved overdosering. Ved overdosering bør pasienten behandles symptomatisk og støttende tiltak iverksettes etter behov. Hemodialyse øker ikke clearance av rosuvastatin signifikant.
KONTRAINDIKASJONER
CRESTOR 20 mg er kontraindisert under følgende forhold:
- . Pasienter med kjent overfølsomhet overfor noen komponent i dette produktet. Overfølsomhetsreaksjoner inkludert utslett, pruritus, urticaria og angioødem er rapportert med CRESTOR [se BIVIRKNINGER ]. . Pasienter med aktiv leversykdom, som kan inkludere uforklarlige vedvarende økninger i levertransaminasenivåer [se ADVARSLER OG FORHOLDSREGLER ]. . Graviditet [se Bruk i spesifikke populasjoner ]. . Amming. Begrensede data indikerer at CRESTOR 20 mg finnes i morsmelk. Fordi statiner har potensial for alvorlige bivirkninger hos ammende spedbarn, bør kvinner som trenger CRESTOR-behandling ikke amme sine spedbarn [se Bruk i spesifikke populasjoner ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
CRESTOR 10mg er en selektiv og konkurrerende hemmer av HMG-CoA-reduktase, det hastighetsbegrensende enzymet som omdanner 3-hydroksy-3-metylglutarylkoenzym A til mevalonat, en forløper for kolesterol. In vivo-studier på dyr og in vitro-studier på dyrkede dyre- og menneskeceller har vist at rosuvastatin har et høyt opptak i og selektivitet for virkning i leveren, målorganet for kolesterolsenkende. I in vivo- og in vitro-studier produserer rosuvastatin sin lipidmodifiserende effekt på to måter. For det første øker det antallet hepatiske LDL-reseptorer på celleoverflaten for å øke opptak og katabolisme av LDL. For det andre hemmer rosuvastatin hepatisk syntese av VLDL, noe som reduserer det totale antallet VLDL- og LDL-partikler.
Farmakodynamikk
CRESTOR 5mg doseavhengig reduserer forhøyet LDL-kolesterol og reduserer totalkolesterol og triglyserider og øker HDL-kolesterol [se Kliniske studier ]. En terapeutisk respons på CRESTOR 5 mg er tydelig innen 1 uke etter behandlingsstart og 90 % av maksimal respons oppnås vanligvis innen 2 uker. Maksimal respons oppnås vanligvis innen 4 uker og opprettholdes etter det. Individualisering av legemiddeldosering bør være basert på den terapeutiske responsen [se DOSERING OG ADMINISTRASJON ].
Farmakokinetikk
Absorpsjon
I kliniske farmakologiske studier hos mennesker ble maksimale plasmakonsentrasjoner av rosuvastatin nådd 3 til 5 timer etter oral dosering. Både Cmax og AUC økte omtrentlig proporsjonalt med CRESTOR 10 mg dose. Den absolutte biotilgjengeligheten av rosuvastatin er omtrent 20 %.
Administrering av CRESTOR sammen med mat påvirket ikke AUC for rosuvastatin.
AUC for rosuvastatin avviker ikke etter administrasjon av legemiddel om kvelden eller morgenen.
Fordeling
Gjennomsnittlig distribusjonsvolum ved steady-state av rosuvastatin er ca. 134 liter. Rosuvastatin er 88 % bundet til plasmaproteiner, hovedsakelig albumin. Denne bindingen er reversibel og uavhengig av plasmakonsentrasjoner.
Eliminering
Rosuvastatin elimineres primært ved utskillelse i avføringen. Eliminasjonshalveringstiden for rosuvastatin er omtrent 19 timer.
Metabolisme
Rosuvastatin metaboliseres ikke i stor grad; ca. 10 % av en radiomerket dose gjenvinnes som metabolitt. Hovedmetabolitten er N-desmetyl rosuvastatin, som hovedsakelig dannes av cytokrom P450 \ 2C9, og in vitro-studier har vist at N-desmetyl rosuvastatin har omtrent en sjettedel til halvparten av den HMG-CoA-reduktasehemmende aktiviteten til moderforbindelsen. . Totalt sett er mer enn 90 % av aktiv plasma-HMG-CoA-reduktase-hemmende aktivitet regnskapsført av moderforbindelsen.
Utskillelse
Etter oral administrering utskilles rosuvastatin og dets metabolitter primært i feces (90 %). Etter en intravenøs dose var omtrent 28 % av total kroppsclearance via nyrene og 72 % via leverveien.
Spesifikke populasjoner
Rase- eller etniske grupper
En populasjonsfarmakokinetisk analyse avdekket ingen klinisk relevante forskjeller i farmakokinetikk blant kaukasiske, latinamerikanske og svarte eller afro-karibiske grupper. Imidlertid har farmakokinetiske studier, inkludert en utført i USA, vist en omtrentlig 2 ganger økning i median eksponering (AUC og Cmax) hos asiatiske personer sammenlignet med en kaukasisk kontrollgruppe.
Mannlige og kvinnelige pasienter
Det var ingen forskjeller i plasmakonsentrasjoner av rosuvastatin mellom menn og kvinner.
Pediatriske pasienter
I en populasjonsfarmakokinetisk analyse av to pediatriske studier som involverte pasienter med heterozygot familiær hyperkolesterolemi henholdsvis 10 til 17 år og 8 til 17 år, så rosuvastatineksponeringen ut til å være sammenlignbar med eller lavere enn eksponeringen for rosuvastatin hos voksne pasienter.
Geriatriske pasienter
Det var ingen forskjeller i plasmakonsentrasjoner av rosuvastatin mellom ikke-eldre og eldre populasjoner (alder ≥65 år).
Pasienter med nedsatt nyrefunksjon
Lett til moderat nedsatt nyrefunksjon (CLcr ≥30 ml/min/1,73 m²) hadde ingen påvirkning på plasmakonsentrasjonen av rosuvastatin. Imidlertid økte plasmakonsentrasjoner av rosuvastatin til en klinisk signifikant grad (ca. 3 ganger) hos pasienter med alvorlig nedsatt nyrefunksjon (CLcr 80 ml/min/ 1,73 m²).
Hemodialyse
Steady-state plasmakonsentrasjoner av rosuvastatin hos pasienter i kronisk hemodialyse var omtrent 50 % høyere sammenlignet med friske frivillige personer med normal nyrefunksjon.
Pasienter med nedsatt leverfunksjon
Hos pasienter med kronisk alkoholleversykdom var plasmakonsentrasjonen av rosuvastatin moderat økt.
Hos pasienter med Child-Pugh A-sykdom økte Cmax og AUC med henholdsvis 60 % og 5 % sammenlignet med pasienter med normal leverfunksjon. Hos pasienter med Child-Pugh B-sykdom økte Cmax og AUC med henholdsvis 100 % og 21 % sammenlignet med pasienter med normal leverfunksjon.
Studier av legemiddelinteraksjoner
Rosuvastatinclearance er ikke avhengig av metabolisme av cytokrom P450 3A4 i en klinisk signifikant grad.
Rosuvastatin er et substrat for visse transportørproteiner, inkludert hepatisk opptakstransportør organisk aniontransporterende polyprotein 1B1 (OATP1B1) og efflux transporter brystkreftresistensprotein (BCRP). Samtidig administrering av CRESTOR 10 mg med medisiner som hemmer disse transportproteinene (f.eks. ciklosporin, visse HIV-proteasehemmere) kan føre til økte plasmakonsentrasjoner av rosuvastatin [se DOSERING OG ADMINISTRASJON og NARKOTIKAHANDEL ].
Farmakogenomikk
Disponering av HMG-CoA-reduktasehemmere, inkludert rosuvastatin, involverer OATP1B1 og andre transportproteiner. Høyere plasmakonsentrasjoner av rosuvastatin er rapportert hos svært små pasientgrupper (n=3 til 5) som har to alleler med redusert funksjon av genet som koder for OATP1B1 (SLCO1B1 521T > C). Frekvensen av denne genotypen (dvs. SLCO1B1 521 C/C) er generelt lavere enn 5 % i de fleste rase/etniske grupper. Effekten av denne polymorfismen på effekten og/eller sikkerheten til rosuvastatin er ikke klart fastslått.
Dyretoksikologi og/eller farmakologi
Toksisitet i sentralnervesystemet
CNS-vaskulære lesjoner, karakterisert ved perivaskulær blødning, ødem og mononukleær celleinfiltrasjon av perivaskulære rom, har blitt observert hos hunder behandlet med flere andre medlemmer av denne medikamentklassen. Et kjemisk likt medikament i denne klassen ga doseavhengig degenerasjon av synsnerven (Wallerian degenerasjon av retinogene fibre) hos hunder, i en dose som ga plasmanivåer av medikamenter omtrent 30 ganger høyere enn gjennomsnittlig legemiddelnivå hos mennesker som tok den høyeste anbefalte dosen. Ødem, blødning og delvis nekrose i interstitium av choroid plexus ble observert hos en hunnhund som ble ofret døende på dag 24 ved 90 mg/kg/dag ved oral sonde (systemisk eksponering 100 ganger menneskelig eksponering ved 40 mg/dag basert på AUC). Korneal opasitet ble sett hos hunder behandlet i 52 uker med 6 mg/kg/dag ved oral sonde (systemisk eksponering 20 ganger human eksponering ved 40 mg/dag basert på AUC). Katarakt ble sett hos hunder behandlet i 12 uker med oral sonde med 30 mg/kg/dag (systemisk eksponering 60 ganger human eksponering ved 40 mg/dag basert på AUC). Retinal dysplasi og retinaltap ble sett hos hunder behandlet i 4 uker med oral sonde med 90 mg/kg/dag (systemisk eksponering 100 ganger human eksponering ved 40 mg/dag basert på AUC). Doser ≤30 mg/kg/dag (systemisk eksponering ≤60 ganger human eksponering ved 40 mg/dag basert på AUC) avslørte ikke retinale funn under behandling i opptil ett år.
Juvenile Toxicology Study
I en juvenil studie ble rotter dosert ved oral sonde med 10 eller 50 mg/kg/dag fra avvenning i 9 uker før paring, gjennom paring og frem til dagen før obduksjon for hanner eller opp til drektighetsdag 7 for hunner. Ingen effekter på seksuell utvikling, testikkel- og epididymalt utseende eller fertilitet ble observert ved noen av dosenivåene (2 ganger eller opptil 24 ganger human eksponering (AUC) ved maksimal pediatrisk dose på 20 mg/dag).
Kliniske studier
Hyperlipidemi og blandet dyslipidemi
CRESTOR 5mg reduserer Total-C, LDL-C, ApoB, nonHDL-C og TG, og øker HDL-C, hos voksne pasienter med hyperlipidemi og blandet dyslipidemi.
Dosevarierende studie
I en multisenter, dobbeltblind, placebokontrollert, dosevarierende studie hos pasienter med hyperlipidemi CRESTOR gitt som en enkelt daglig dose i 6 uker reduserte total-C, LDL-C, non-HDL-C og ApoB signifikant over hele dosen rekkevidde (tabell 6).
Aktiv-kontrollert studie
CRESTOR 5mg ble sammenlignet med HMG-CoA-reduktasehemmere atorvastatin, simvastatin og pravastatin i en multisenter, åpen, dosevarierende studie av 2240 pasienter med hyperlipidemi eller blandet dyslipidemi. Etter randomisering ble pasientene behandlet i 6 uker med en enkelt daglig dose av enten CRESTOR 20 mg, atorvastatin, simvastatin eller pravastatin (figur 1 og tabell 7).
Figur 1: Prosentvis LDL-C-endring etter dose av CRESTOR 20 mg, Atorvastatin, Simvastatin og Pravastatin ved uke 6 hos pasienter med hyperlipidemi eller blandet dyslipidemi 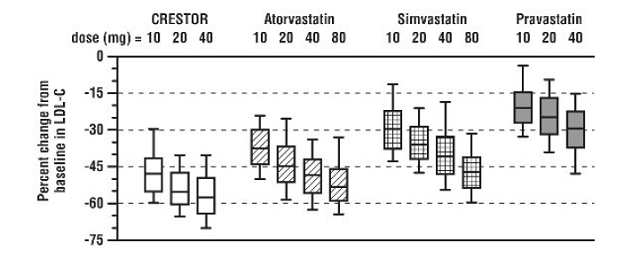
Boksplott er en representasjon av 25., 50. og 75. persentilverdier, med værhår som representerer 10. og 90. persentilverdiene. Gjennomsnittlig baseline LDL-C: 189 mg/Dl
Heterozygot familiær hyperkolesterolemi
Aktiv-kontrollert studie
en studie av pasienter med heterozygot FH (baseline gjennomsnittlig LDL på 291), ble pasientene randomisert til CRESTOR 20 mg eller atorvastatin 20 mg. Dosen ble økt med 6 ukers intervaller. Signifikante LDL-C-reduksjoner fra baseline ble sett ved hver dose i begge behandlingsgruppene (tabell 8).
Hypertriglyseridemi
Dose-respons-studie
I en dobbeltblind, placebokontrollert dose-respons-studie hos pasienter med baseline TG-nivåer fra 273 til 817 mg/dL, reduserte CRESTOR 10 mg gitt som en enkelt daglig dose (5 til 40 mg) over 6 uker signifikant serum TG-nivåer ( Tabell 9).
Primær dysbetalipoproteinemi (type III hyperlipoproteinemi)
en randomisert, multisenter, dobbeltblind crossover-studie gikk 32 pasienter (27 med ε2/ε2 og 4 med apo E-mutasjon [Arg145Cys] med primær dysbetalipoproteinemi (Type III Hyperlipoproteinemia) inn i en 6-ukers kosttilskuddsperiode på NCEP Terapeutisk livsstilsendring (TLC) diett. Etter diettinnføring ble pasientene randomisert til en sekvens av behandlinger i forbindelse med TLC-dietten i 6 uker hver: rosuvastatin 10 mg etterfulgt av rosuvastatin 20 mg eller rosuvastatin 20 mg etterfulgt av rosuvastatin 10 mg CRESTOR reduserte nivåer av ikke-HDL-C (primært endepunkt) og sirkulerende lipoproteinrester Resultatene er vist i tabellen nedenfor.
Homozygot familiær hyperkolesterolemi
Dose-titreringsstudie
en åpen, tvungen titreringsstudie ble homozygote FH-pasienter (n=40, 8-63 år) evaluert for deres respons på CRESTOR 20 til 40 mg titrert med et 6-ukers intervall. I den totale befolkningen var gjennomsnittlig LDL-C-reduksjon fra baseline 22 %. Omtrent en tredjedel av pasientene hadde fordel av å øke dosen fra 20 mg til 40 mg med ytterligere LDL-reduksjon på mer enn 6 %. Hos de 27 pasientene med minst 15 % reduksjon i LDL-C, var gjennomsnittlig LDL-C-reduksjon 30 % (median 28 % reduksjon). Blant 13 pasienter med en LDL-C-reduksjon på
Pediatriske pasienter med homozygot familiær hyperkolesterolemi
CRESTOR ble studert i en randomisert, dobbeltblind, placebokontrollert, multisenter, crossover-studie på 14 barn og ungdom med homozygot familiær hyperkolesterolemi. Studien inkluderte en 4-ukers kosttilskuddsfase der pasientene fikk CRESTOR 10 mg daglig, en cross-over-fase som inkluderte to 6-ukers behandlingsperioder med enten CRESTOR 20 mg eller placebo i tilfeldig rekkefølge, etterfulgt av en 12-ukers behandlingsperiode. uke åpen fase der alle pasienter fikk CRESTOR 20 mg. Pasienter varierte i alder fra 7 til 15 år (median 11 år), 50 % var menn, 71 % var kaukasiske, 21 % var asiatiske, 7 % var svarte, og ingen pasienter var av latinamerikansk etnisitet. Femti prosent var på aferesebehandling og 57 prosent tok ezetimibe. Pasienter som gikk inn i studien med afereseterapi eller ezetimibe fortsatte behandlingen gjennom hele studien. Gjennomsnittlig LDL-C ved baseline var 416 mg/dL (område 152 til 716 mg/dL). Totalt 13 pasienter fullførte begge behandlingsperiodene i den randomiserte cross-over-fasen; en pasient trakk tilbake samtykket på grunn av manglende evne til å få tatt blod under overkrysningsfasen.
CRESTOR 20 mg reduserte LDL-C, totalkolesterol, ApoB og ikke-HDL-C signifikant sammenlignet med placebo (tabell 11).
Pediatriske pasienter med heterozygot familiær hyperkolesterolemi
I en dobbeltblind, randomisert, multisenter, placebokontrollert, 12-ukers studie ble 176 (97 menn og 79 kvinner) barn og ungdom med heterozygot familiær hyperkolesterolemi randomisert til rosuvastatin 5, 10 eller 20 mg eller placebo daglig. Pasientene varierte i alder fra 10 til 17 år (median alder på 14 år) med omtrent 30 % av pasientene 10 til 13 år og omtrent 17 %, 18 %, 40 % og 25 % i Tanner-stadier II, III, IV, og V, henholdsvis. Kvinnene var minst 1 år postmenarche. Gjennomsnittlig LDL-C ved baseline var 233 mg/dL (område 129 til 399). Den 12-ukers dobbeltblinde fasen ble fulgt av en 40 ukers åpen dosetitreringsfase, hvor alle pasienter (n=173) fikk 5 mg, 10 mg eller 20 mg rosuvastatin daglig.
Rosuvastatin reduserte signifikant LDL-C (primært endepunkt), totalkolesterol og ApoB-nivåer ved hver dose sammenlignet med placebo. Resultatene er vist i tabell 12 nedenfor.
Ved slutten av den 12 uker lange, dobbeltblinde behandlingsperioden var prosentandelen av pasienter som oppnådde LDL-C-målet på mindre enn 110 mg/dL (2,8 mmol/L) 0 % for placebo, 12 % for rosuvastatin 5 mg , 41 % for rosuvastatin 10 mg og 41 % for rosuvastatin 20 mg. For den 40 uker lange, åpne fasen ble 71 % av pasientene titrert til maksimal dose på 20 mg og 41 % av pasientene oppnådde LDL-C-målet på 110 mg/dL.
Rosuvastatin ble også studert i en toårig åpen, ukontrollert, titrering til målforsøk som inkluderte 175 barn og ungdom med heterozygot familiær hyperkolesterolemi som var 8 til 17 år gamle (79 gutter og 96 jenter). Alle pasientene hadde en dokumentert genetisk defekt i LDL-reseptoren eller i ApoB. Omtrent 89 % var kaukasiske, 7 % var asiatiske, 1 % var svarte, og færre enn 1 % var latinamerikanske. Gjennomsnittlig LDL-C ved baseline var 236 mg/dL. Femtiåtte (33 %) pasienter var prepubertale ved baseline. Startdosen av rosuvastatin for alle barn og ungdom var 5 mg én gang daglig. Barn 8 til under 10 år (n=41 ved baseline) kunne titrere til en maksimal dose på 10 mg én gang daglig, og barn og ungdom i alderen 10 til 17 år kunne titrere til en maksimal dose på 20 mg én gang daglig.
Reduksjonene i LDL-C fra baseline var generelt konsistente på tvers av aldersgrupper i studien, så vel som med tidligere erfaring i kontrollerte studier for både voksne og pediatrisk.
Langtidseffekten av rosuvastatinbehandling initiert i barndommen for å redusere sykelighet og dødelighet i voksen alder er ikke fastslått.
Bremsing av progresjonen av aterosklerose
Measuring Effects on Intima Media Thickness: an Evaluation Of Rosuvastatin 40 mg (METEOR) studien ble effekten av behandling med CRESTOR på carotis aterosclerosis vurdert ved B-modus ultrasonografi hos pasienter med forhøyet LDL-C, med lav risiko (Framingham-risiko)
Den årlige endringsraten fra baseline for placebogruppen var +0,0131 mm/år (p
På individuelt pasientnivå i gruppen behandlet med CRESTOR, viste 52,1 % av pasientene fravær av sykdomsprogresjon (definert som en negativ årlig endringsrate), sammenlignet med 37,7 % av pasientene i placebogruppen.
Primær forebygging av kardiovaskulær sykdom
Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin (JUPITER) studie, ble effekten av CRESTOR (rosuvastatin kalsium) på forekomsten av alvorlige kardiovaskulære (CV) sykdomstilfeller vurdert hos 17 802 menn (≥50 år) ) og kvinner (≥ 60 år) som ikke hadde noen klinisk tydelig kardiovaskulær sykdom, LDL-C-nivåer
Det primære endepunktet var et sammensatt endepunkt som bestod av tid til første forekomst av noen av følgende store CV-hendelser: CV-død, ikke-fatalt hjerteinfarkt, ikke-dødelig hjerneslag, sykehusinnleggelse for ustabil angina eller en arteriell revaskulariseringsprosedyre.
Rosuvastatin reduserte risikoen for alvorlige CV-hendelser signifikant (252 hendelser i placebogruppen vs. 142 hendelser i rosuvastatingruppen) med en statistisk signifikant (p
Figur 2: Tid til første forekomst av store kardiovaskulære hendelser i JUPITER 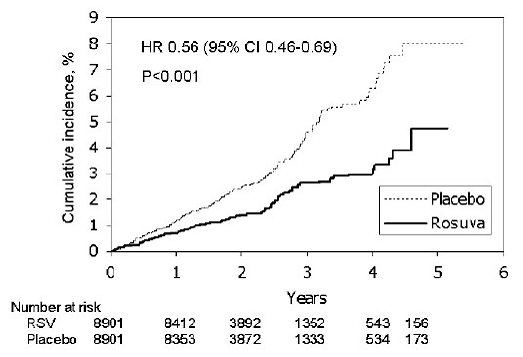
De individuelle komponentene til det primære endepunktet er presentert i figur 3. Rosuvastatin reduserte risikoen for ikke-fatalt hjerteinfarkt, ikke-fatalt hjerneslag og arterielle revaskulariseringsprosedyrer betydelig. Det var ingen signifikante behandlingsforskjeller mellom rosuvastatin- og placebogruppene for død på grunn av kardiovaskulære årsaker eller sykehusinnleggelser for ustabil angina.
Rosuvastatin reduserte signifikant risikoen for hjerteinfarkt (6 fatale hendelser og 62 ikke-dødelige hendelser hos placebo-behandlede personer vs. 9 fatale hendelser og 22 ikke-dødelige hendelser hos rosuvastatin-behandlede personer) og risikoen for hjerneslag (6 fatale hendelser og 58 ikke-dødelige hendelser i placebo-behandlede personer vs. 3 fatale hendelser og 30 ikke-dødelige hendelser hos rosuvastatin-behandlede personer).
en post-hoc undergruppeanalyse av JUPITER-personer (n=1405; rosuvastatin=725, placebo=680) med hsCRP ≥2 mg/L og ingen andre tradisjonelle risikofaktorer (røyking, BP ≥140/90 eller tar antihypertensiva, lav HDL-C) bortsett fra alder, etter justering for høy HDL-C, var det ingen signifikant behandlingsfordel med rosuvastatinbehandling.
Figur 3: Store CV-hendelser etter behandlingsgruppe i JUPITER 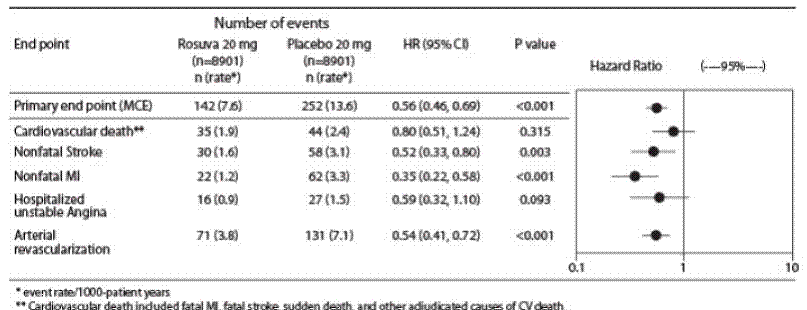
Etter ett år økte rosuvastatin HDL-C og reduserte LDL-C, hsCRP, totalt kolesterol og serum triglyseridnivåer (p
PASIENTINFORMASJON
CRESTOR® (Kres-tor) rosuvastatin kalsiumtabletter
Les denne pasientinformasjonen nøye før du begynner å ta CRESTOR 20 mg og hver gang du får påfyll. Spør legen din hvis du har spørsmål om CRESTOR. Bare legen din kan avgjøre om CRESTOR er riktig for deg.
Hva er CRESTOR?
CRESTOR 20mg er et reseptbelagt legemiddel som inneholder et kolesterolsenkende legemiddel kalt rosuvastatin kalsium. Det meste av kolesterolet i blodet ditt lages i leveren. CRESTOR 20mg virker ved å redusere kolesterolet på to måter: CRESTOR 5mg blokkerer et enzym i leveren som får leveren til å lage mindre kolesterol, og CRESTOR 20mg øker leverens opptak og nedbrytning av kolesterol som allerede er i blodet.
- . CRESTOR brukes sammen med diett for å:
- . senke nivået av ditt "dårlige" kolesterol (LDL) . øke nivået av ditt "gode" kolesterol (HDL) . senke nivået av fett i blodet ditt (triglyserider) . bremse oppbyggingen av fettavleiringer (plakk) i veggene i blodårene
- . voksne som ikke kan kontrollere kolesterolnivået med kosthold og trening alene . barn i alderen 8 til 17 år med heterozygot familiær hyperkolesterolemi (en arvelig tilstand som forårsaker høye nivåer av LDL) . barn i alderen 7 til 17 år med homozygot familiær hyperkolesterolemi (en arvelig tilstand som forårsaker høye nivåer av LDL).
CRESTOR 20mg er ikke godkjent for bruk hos barn med heterozygot familiær hyperkolesterolemi yngre enn 8 år eller for bruk hos barn med homozygot familiær hyperkolesterolemi yngre enn 7 år.
CRESTOR 5mg brukes til å redusere risikoen for hjerteinfarkt og hjerneslag hos menn 50 år og eldre og kvinner 60 år og eldre som ikke har kjent hjertesykdom, men som har visse tilleggsrisikofaktorer.
Det er ikke kjent om CRESTOR 10mg er trygt og effektivt hos personer som har Fredrickson Type I og V dyslipidemier.
Hvem bør ikke ta CRESTOR?
Ikke ta CRESTOR hvis du:
- . er allergisk mot rosuvastatinkalsium eller noen av innholdsstoffene i CRESTOR. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i CRESTOR. . har leverproblemer. . er gravid eller tror du kan være gravid, eller planlegger å bli gravid. CRESTOR 20mg kan skade det ufødte barnet ditt. Hvis du blir gravid, slutt å ta CRESTOR og ring legen din umiddelbart. Hvis du ikke planlegger å bli gravid, bør du bruke effektiv prevensjon (prevensjon) mens du tar CRESTOR. . ammer. Medisiner som CRESTOR 5mg kan gå over i morsmelk og kan skade babyen din.
Hva bør jeg fortelle legen min før og mens jeg tar CRESTOR?
Fortell legen din dersom du:
- . har uforklarlige muskelsmerter eller svakhet . har eller har hatt nyreproblemer . har eller har hatt leverproblemer . drikk mer enn 2 glass alkohol daglig . har problemer med skjoldbruskkjertelen . er 65 år eller eldre . er av asiatisk avstamning . er gravid eller tror du kan være gravid, eller planlegger å bli gravid . ammer
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
Snakk med legen din før du begynner å ta nye medisiner.
Å ta CRESTOR 20 mg sammen med visse andre legemidler kan påvirke hverandre og forårsake bivirkninger. CRESTOR kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan CRESTOR virker.
Fortell legen din spesielt hvis du tar:
- . ciklosporin (et legemiddel for immunsystemet ditt) . gemfibrozil (et fibrinsyremedisin for å senke kolesterol) . antivirale medisiner inkludert HIV eller hepatitt C proteasehemmere (som lopinavir, ritonavir, fosamprenavir, tipranavir, atazanavir eller simeprevir) . visse anti-soppmedisiner (som itrakonazol, ketokonazol og flukonazol) . kumarinantikoagulanter (legemidler som forhindrer blodpropp, som warfarin) . niacin eller nikotinsyre . fibrinsyrederivater (som fenofibrat) . kolkisin (et legemiddel som brukes til å behandle gikt)
Spør legen din eller apoteket om en liste over disse legemidlene hvis du er usikker.
Kjenn til alle medisinene du tar. Hold en liste over dem for å vise legen din og apoteket når du får ny medisin.
Hvordan skal jeg ta CRESTOR 10mg?
- . Ta CRESTOR nøyaktig slik legen din sier at du skal ta det. . Ta CRESTOR, gjennom munnen, 1 gang hver dag. Svelg tabletten hel. . CRESTOR kan tas når som helst på dagen, med eller uten mat. . Ikke endre dosen eller slutte med CRESTOR 10 mg uten å snakke med legen din, selv om du føler deg bra. . Legen din kan ta blodprøver for å kontrollere kolesterolnivået ditt før og under behandlingen med CRESTOR. Legen din kan endre dosen din av CRESTOR 10 mg om nødvendig. . Legen din kan starte deg på en kolesterolsenkende diett før du gir deg CRESTOR. Hold deg på denne dietten når du tar CRESTOR. . Vent minst 2 timer etter å ha tatt CRESTOR med å ta et syrenøytraliserende middel som inneholder en kombinasjon av aluminium og magnesiumhydroksid. . Hvis du glemmer en dose CRESTOR 10 mg, ta den så snart du husker det. Men, ikke ta 2 doser CRESTOR 10 mg innen 12 timer etter hverandre. . Hvis du tar for mye CRESTOR 20 mg eller overdose, ring legen din eller gå til nærmeste legevakt umiddelbart.
Hva er de mulige bivirkningene av CRESTOR 20mg?
CRESTOR 10mg kan forårsake alvorlige bivirkninger, inkludert:
- . Muskelsmerter, ømhet og svakhet (myopati). Muskelproblemer, inkludert muskelnedbrytning, kan være alvorlig hos noen mennesker og forårsaker sjelden nyreskade som kan føre til døden. Fortell legen din umiddelbart hvis:
- . du har uforklarlige muskelsmerter, ømhet eller svakhet, spesielt hvis du har feber eller føler deg mer trøtt enn vanlig mens du tar CRESTOR. . du har muskelproblemer som ikke forsvinner selv etter at legen din har bedt deg om å slutte å ta CRESTOR. Legen din kan gjøre ytterligere tester for å diagnostisere årsaken til muskelproblemene dine.
Sjansene for å få muskelproblemer er høyere hvis du:
- . tar visse andre legemidler mens du tar CRESTOR . er 65 år eller eldre . har skjoldbruskkjertelproblemer (hypotyreose) som ikke er kontrollert . har nyreproblemer . tar høyere doser CRESTOR
- . føler seg uvanlig trøtt eller svak . tap av Appetit . smerter i øvre del av magen . mørk urin . gulfarging av huden eller det hvite i øynene
De vanligste bivirkningene kan omfatte: hodepine, muskelsmerter, magesmerter, svakhet og kvalme.
Ytterligere bivirkninger som er rapportert med CRESTOR inkluderer hukommelsestap og forvirring.
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av CRESTOR. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare CRESTOR 20mg?
- . Oppbevar CRESTOR 10 mg ved romtemperatur, mellom 20 °C til 25 °C (68 °F til 77 °F) og på et tørt sted. . Kast medisin som er utdatert eller ikke lenger er nødvendig.
Oppbevar CRESTOR 10mg og alle legemidler utilgjengelig for barn.
Hva er ingrediensene i CRESTOR?
Aktiv ingrediens: rosuvastatin som rosuvastatin kalsium
Inaktive ingredienser: mikrokrystallinsk cellulose NF, laktosemonohydrat NF, tribasisk kalsiumfosfat NF, krospovidon NF, magnesiumstearat NF, hypromellose NF, triacetin NF, titandioksid USP, gult jernoksid og rødt jernoksid NF.
Generell informasjon om sikker og effektiv bruk av CRESTOR
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i et pasientinformasjonshefte. Ikke bruk CRESTOR 10 mg for en tilstand det ikke er foreskrevet for. Ikke gi CRESTOR 20 mg til andre mennesker, selv om de har samme medisinske tilstand som du har. Det kan skade dem.
Du kan spørre apoteket eller legen om informasjon om CRESTOR 5mg som er skrevet for helsepersonell.
Denne pasientinformasjonen er godkjent av US Food and Drug Administration Revidert 9/2018
