Tricor 160mg, 200mg Fenofibrate Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Tricor og hvordan brukes det?
Tricor er en reseptbelagt medisin som brukes til å behandle redusere symptomer på kolesterol og triglyserider (fettsyrer) i blodet. Tricor kan brukes alene eller sammen med andre medisiner.
- . Tricor tilhører en klasse legemidler som kalles Fibric Acid Agents. . Det er ikke kjent om Tricor 200mg er trygt og effektivt hos barn
Hva er de mulige bivirkningene av Tricor?
Tricor 200mg kan forårsake alvorlige bivirkninger, inkludert:
- . skarpe magesmerter som sprer seg til ryggen eller skulderbladet, . tap av Appetit, . magesmerter etter bare å ha spist, . gulfarging av hud eller øyne (gulsott), . feber, . frysninger, . svakhet, . sår hals, . munnsår, . uvanlige blåmerker eller blødninger, . brystsmerter, . plutselig hoste, . hvesing, . rask pust, . hoste opp blod, og . hevelse, varme eller rødhet i en arm eller et ben
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Tricor inkluderer:
- . rennende nese, . nysing, og . unormale laboratorietester
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Tricor. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
TRICOR (fenofibrat tabletter), er et lipidregulerende middel tilgjengelig som tabletter for oral administrering. Hver tablett inneholder 54 mg eller 160 mg fenofibrat. Det kjemiske navnet på fenofibrat er 2-[4-(4-klorbenzoyl)fenoksy]-2-metyl-propansyre, 1-metyletylester med følgende strukturformel:
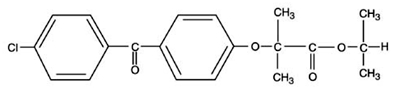
Den empiriske formelen er C20H21O4Cl og molekylvekten er 360,83; fenofibrat er uløselig i vann. Smeltepunktet er 79-82°C. Fenofibrat er et hvitt fast stoff som er stabilt under vanlige forhold.
Inaktive ingredienser
Hver tablett inneholder kolloidalt silisiumdioksid, krospovidon, laktosemonohydrat, lecitin, mikrokrystallinsk cellulose, polyvinylalkohol, povidon, natriumlaurylsulfat, natriumstearylfumarat, talkum, titandioksid og xantangummi. I tillegg inneholder 54 mg individuelle tabletter D&C Yellow No. 10, FD&C Yellow No. 6, FD&C Blue No. 2.
INDIKASJONER
Primær hyperkolesterolemi eller blandet dyslipidemi
TRICOR er indisert som tilleggsbehandling til diett for å redusere forhøyet lavdensitetslipoproteinkolesterol (LDL-C), totalkolesterol (Total-C), triglyserider og apolipoprotein B (Apo B), og for å øke høydensitetslipoproteinkolesterol (HDL- C) hos voksne pasienter med primær hyperkolesterolemi eller blandet dyslipidemi.
Alvorlig hypertriglyseridemi
TRICOR 200mg er også indisert som tilleggsbehandling til diett for behandling av voksne pasienter med alvorlig hypertriglyseridemi. Forbedring av glykemisk kontroll hos diabetespasienter som viser fastende kylomikronemi vil vanligvis unngå behovet for farmakologisk intervensjon.
Markert forhøyede nivåer av serumtriglyserider (f.eks. > 2000 mg/dL) kan øke risikoen for å utvikle pankreatitt. Effekten av fenofibratbehandling på å redusere denne risikoen er ikke tilstrekkelig studert.
Viktige bruksbegrensninger
Fenofibrat i en dose tilsvarende 145 mg TRICOR ble ikke vist å redusere koronar hjertesykdom morbiditet og dødelighet i en stor, randomisert kontrollert studie med pasienter med type 2 diabetes mellitus [se ADVARSLER OG FORHOLDSREGLER ].
DOSERING OG ADMINISTRASJON
Generelle betraktninger
Pasienter bør settes på en passende lipidsenkende diett før de får TRICOR 160 mg, og bør fortsette denne dietten under behandling med TRICOR. TRICOR tabletter kan gis uten hensyn til måltider.
Den første behandlingen for dyslipidemi er diettbehandling spesifikk for typen lipoproteinavvik. Overdreven kroppsvekt og overdreven alkoholinntak kan være viktige faktorer ved hypertriglyseridemi og bør behandles før enhver medikamentell behandling. Fysisk trening kan være et viktig hjelpetiltak. Sykdommer som bidrar til hyperlipidemi, slik som hypotyreose eller diabetes mellitus, bør letes etter og behandles adekvat. Østrogenbehandling, tiaziddiuretika og betablokkere er noen ganger assosiert med massiv økning i plasmatriglyserider, spesielt hos personer med familiær hypertriglyseridemi. I slike tilfeller kan seponering av det spesifikke etiologiske middelet eliminere behovet for spesifikk medikamentell behandling av hypertriglyseridemi.
Lipidnivåer bør overvåkes med jevne mellomrom, og det bør vurderes å redusere dosen av TRICOR dersom lipidnivåene faller betydelig under målområdet.
Behandlingen bør seponeres hos pasienter som ikke har tilstrekkelig respons etter to måneders behandling med maksimal anbefalt dose på 145 mg én gang daglig.
Primær hyperkolesterolemi eller blandet dyslipidemi
Startdosen av TRICOR 200 mg er 145 mg én gang daglig.
Alvorlig hypertriglyseridemi
Startdosen er 48 til 145 mg per dag. Doseringen bør individualiseres i henhold til pasientens respons, og bør justeres om nødvendig etter gjentatte lipidbestemmelser med 4 til 8 ukers intervaller. Maksimal dose er 145 mg én gang daglig.
Nedsatt nyrefunksjon
Behandling med TRICOR 200 mg bør startes med en dose på 48 mg per dag hos pasienter med mild til moderat nedsatt nyrefunksjon, og økes først etter evaluering av effekten på nyrefunksjonen og lipidnivåene ved denne dosen. Bruk av TRICOR bør unngås hos pasienter med alvorlig nedsatt nyrefunksjon [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
Geriatriske pasienter
Dosevalg for eldre bør gjøres på grunnlag av nyrefunksjonen [se Bruk i spesifikke populasjoner ].
HVORDAN LEVERES
Doseringsformer og styrker
- . 48 mg gule tabletter, merket med kodeidentifikasjonsbokstavene "FI". . 48 mg gule tabletter, merket med "a"-logoen og kodeidentifikasjonsbokstavene "FI". . 145 mg hvite tabletter, merket med kodeidentifikasjonsbokstavene "FO". . 145 mg hvite tabletter, merket med "a"-logoen og kodeidentifikasjonsbokstavene "FO".
Oppbevaring og håndtering
TRICOR® (fenofibrat tabletter) er tilgjengelig i to styrker:
48 mg
Gule tabletter, merket med kodeidentifikasjonsbokstavene "FI", tilgjengelig i flasker på 90 ( NDC 0074-3173-90).
Gule tabletter, merket med "a"-logoen og kodeidentifikasjonsbokstavene "FI", tilgjengelig i flasker på 90 ( NDC 0074-6122-90).
145 mg
Hvite tabletter, merket med kodeidentifikasjonsbokstavene "FO", tilgjengelig i flasker på 90 ( NDC 0074-3189-90).
Hvite tabletter, merket med "a"-logoen og kodeidentifikasjonsbokstavene "FO", tilgjengelig i flasker på 90 ( NDC 0074-6123-90).
Oppbevaring
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F).
[Se USP-kontrollert romtemperatur]. Oppbevares utilgjengelig for barn. Beskytt mot fuktighet.
Produsert for AbbVie Inc., North Chicago, IL 60064, USA av Fournier Laboratories Ireland Limited, Anngrove, Carrigtwohill Co. Cork, Irland. Revidert: mars 2021
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i merkingen:
- . Mortalitet og koronar hjertesykdom sykelighet [se ADVARSLER OG FORHOLDSREGLER ] . Levertoksisitet [se ADVARSLER OG FORHOLDSREGLER ] . Pankreatitt [se ADVARSLER OG FORHOLDSREGLER ] . Overfølsomhetsreaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Venotromboembolisk sykdom [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
Bivirkninger rapportert av 2 % eller flere av pasientene behandlet med fenofibrat (og flere enn placebo) under de dobbeltblindede, placebokontrollerte studiene, uavhengig av årsakssammenheng, er oppført i tabell 1 nedenfor. Bivirkninger førte til seponering av behandlingen hos 5,0 % av pasientene behandlet med fenofibrat og hos 3,0 % behandlet med placebo. Økning i leverfunksjonstester var de hyppigste hendelsene, noe som førte til seponering av fenofibratbehandling hos 1,6 % av pasientene i dobbeltblinde studier.
Urticaria ble sett hos 1,1 % vs. 0 %, og utslett hos 1,4 % vs. 0,8 % av henholdsvis fenofibrat- og placebopasienter i kontrollerte studier.
Økning i leverenzymer
I en samlet analyse av 10 placebokontrollerte studier forekom økninger til > 3 ganger den øvre normalgrensen i ALAT hos 5,3 % av pasientene som tok fenofibrat i doser tilsvarende 96 mg til 145 mg TRICOR daglig versus 1,1 % av pasientene behandlet med placebo [se ADVARSLER OG FORHOLDSREGLER ]. I en 8-ukers studie var forekomsten av ALAT- eller ASAT-økninger ≥ 3 ganger øvre normalgrense 13 % hos pasienter som fikk doser tilsvarende 96 mg til 145 mg TRICOR daglig, og var 0 % hos de som fikk doser tilsvarende 48 mg. eller mindre TRICOR daglig eller placebo.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av fenofibrat etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng til legemiddeleksponering: myalgi, rabdomyolyse, pankreatitt, akutt nyresvikt, muskelspasmer, hepatitt, skrumplever, økt total bilirubin, anemi, artralgi, reduksjon i hemoglobin, reduksjon i hematokrit, reduksjon av hvite blodlegemer, asteni, alvorlig deprimerte HDL-kolesterolnivåer og interstitiell lungesykdom. Fotosensitivitetsreaksjoner har oppstått dager til måneder etter oppstart; i noen av disse tilfellene rapporterte pasienter en tidligere fotosensitivitetsreaksjon på ketoprofen.
NARKOTIKAHANDEL
Kumarin antikoagulantia
Potensering av antikoagulerende effekter av kumarin-type er observert ved forlengelse av PT/INR.
Forsiktighet bør utvises når kumarinantikoagulantia gis sammen med TRICOR. Doseringen av antikoagulantene bør reduseres for å opprettholde PT/INR på ønsket nivå for å forhindre blødningskomplikasjoner. Hyppige PT/INR-bestemmelser er tilrådelig inntil det er definitivt fastslått at PT/INR har stabilisert seg [se ADVARSLER OG FORHOLDSREGLER ].
Immundempende midler
Immunsuppressiva som ciklosporin og takrolimus kan gi nefrotoksisitet med redusert kreatininclearance og økning i serumkreatinin, og fordi nyreutskillelse er den primære eliminasjonsveien for fibratmedisiner inkludert TRICOR, er det en risiko for at en interaksjon vil føre til forverring av nyrefunksjonen. Fordelene og risikoene ved bruk av TRICOR (fenofibrattabletter) sammen med immunsuppressiva og andre potensielt nefrotoksiske midler bør vurderes nøye, og laveste effektive dose som brukes og nyrefunksjon overvåkes.
Gallesyrebindende harpikser
Siden gallesyrebindende harpikser kan binde andre legemidler gitt samtidig, bør pasienter ta TRICOR 200 mg minst 1 time før eller 4 til 6 timer etter en gallesyrebindende harpiks for å unngå å hemme absorpsjonen.
Kolkisin
Tilfeller av myopati, inkludert rabdomyolyse, er rapportert med fenofibrat administrert samtidig med kolkisin, og forsiktighet bør utvises ved forskrivning av fenofibrat med kolkisin.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Mortalitet og koronar hjertesykdom Sykelighet
Effekten av TRICOR 160 mg på koronar hjertesykdom morbiditet og dødelighet og ikke-kardiovaskulær dødelighet er ikke fastslått.
The Action to Control Cardiovascular Risk in Diabetes Lipid (ACCORD Lipid) studie var en randomisert placebokontrollert studie av 5518 pasienter med type 2 diabetes mellitus på bakgrunnsbehandling med statin behandlet med fenofibrat. Gjennomsnittlig varighet av oppfølgingen var 4,7 år. Kombinasjonsbehandling med fenofibrat pluss statin viste en ikke-signifikant 8 % relativ risikoreduksjon i det primære resultatet av alvorlige kardiovaskulære hendelser (MACE), en sammensetning av ikke-dødelig hjerteinfarkt, ikke-dødelig hjerneslag og død av hjerte- og karsykdommer (hazard ratio [hazard ratio] HR] 0,92, 95 % KI 0,79-1,08) (p=0,32) sammenlignet med statin monoterapi. I en kjønnsundergruppeanalyse var hazard ratio for MACE hos menn som fikk kombinasjonsbehandling versus statin monoterapi 0,82 (95 % KI 0,69–0,99), og hazard ratio for MACE hos kvinner som fikk kombinasjonsbehandling versus statin monoterapi var 1,38 (95 % KI) 0,98-1,94) (interaksjon p=0,01). Den kliniske betydningen av dette undergruppefunnet er uklart.
Fenofibrat-intervensjons- og hendelsessenking ved diabetes (FIELD)-studien var en 5-årig randomisert, placebokontrollert studie av 9795 pasienter med type 2 diabetes mellitus behandlet med fenofibrat. Fenofibrat viste en ikke-signifikant 11 % relativ reduksjon i det primære utfallet av koronar hjertesykdom (hazard ratio [HR] 0,89, 95 % KI 0,75-1,05, p=0,16) og en signifikant 11 % reduksjon i det sekundære resultatet av totalt kardiovaskulære sykdommer (HR 0,89 [0,80-0,99], p=0,04). Det var en ikke-signifikant økning på 11 % (HR 1,11 [0,95, 1,29], p=0,18) og 19 % (HR 1,19 [0,90, 1,57], p=0,22) i henholdsvis total og koronar hjertesykdomsdødelighet med fenofibrat sammenlignet med placebo.
På grunn av kjemiske, farmakologiske og kliniske likheter mellom TRICOR (fenofibrattabletter), klofibrat og gemfibrozil, kan de uønskede funnene i 4 store randomiserte, placebokontrollerte kliniske studier med disse andre fibratmedikamentene også gjelde for TRICOR.
Coronary Drug Project, en stor studie av post myokardinfarkt hos pasienter behandlet i 5 år med klofibrat, var det ingen forskjell i dødelighet sett mellom klofibratgruppen og placebogruppen. Det var imidlertid en forskjell i frekvensen av kolelitiasis og kolecystitt som krever kirurgi mellom de to gruppene (3,0 % vs. 1,8 %).
en studie utført av Verdens helseorganisasjon (WHO) ble 5000 personer uten kjent koronarsykdom behandlet med placebo eller klofibrat i 5 år og fulgt i ytterligere ett år. Det var en statistisk signifikant, høyere aldersjustert dødelighet av alle årsaker i klofibratgruppen sammenlignet med placebogruppen (5,70 % vs. 3,96 %, p =
Helsinki Heart Study var en stor (n=4081) studie av middelaldrende menn uten en historie med koronarsykdom. Forsøkspersonene fikk enten placebo eller gemfibrozil i 5 år, med 3,5 års åpen forlengelse etterpå. Total dødelighet var numerisk høyere i randomiseringsgruppen for gemfibrozil, men oppnådde ikke statistisk signifikans (p = 0,19, 95 % konfidensintervall for relativ risiko G:P = ,91-1,64). Selv om kreftdødsfall hadde en høyere trend i gemfibrozil-gruppen (p = 0,11), ble kreft (unntatt basalcellekarsinom) diagnostisert med lik frekvens i begge studiegruppene. På grunn av den begrensede størrelsen på studien, ble den relative risikoen for død uansett årsak ikke vist å være annerledes enn det som ble sett i 9 års oppfølgingsdata fra Verdens helseorganisasjons studie (RR=1,29).
En sekundær forebyggingskomponent i Helsinki Heart Study registrerte middelaldrende menn som ble ekskludert fra den primære forebyggingsstudien på grunn av kjent eller mistenkt koronar hjertesykdom. Forsøkspersonene fikk gemfibrozil eller placebo i 5 år. Selv om hjertedødsfall hadde en høyere trend i gemfibrozil-gruppen, var dette ikke statistisk signifikant (hazard ratio 2,2, 95 % konfidensintervall: 0,94-5,05). Frekvensen av galleblærekirurgi var ikke statistisk signifikant mellom studiegruppene, men hadde en høyere trend i gemfibrozil-gruppen (1,9 % vs. 0,3 %, p = 0,07).
Hepatotoksisitet
Alvorlig legemiddelindusert leverskade (DILI), inkludert levertransplantasjon og død, er rapportert etter markedsføring med TRICOR. DILI har blitt rapportert i løpet av de første ukene av behandlingen eller etter flere måneders behandling og har i noen tilfeller reversert med seponering av TRICOR 200 mg-behandling. Pasienter med DILI har opplevd tegn og symptomer inkludert mørk urin, unormal avføring, gulsott, ubehag, magesmerter, myalgi, vekttap, kløe og kvalme. Mange pasienter hadde samtidige økninger av total bilirubin, serumalanintransaminase (ALT) og aspartattransaminase (AST). DILI har blitt karakterisert som hepatocellulær, kronisk aktiv og kolestatisk hepatitt, og cirrhose har oppstått i forbindelse med kronisk aktiv hepatitt.
I kliniske studier har fenofibrat i doser tilsvarende 96 mg til 145 mg TRICOR 160 mg daglig blitt assosiert med økning i serum ASAT eller ALAT. Forekomsten av økninger i transaminaser kan være doserelatert [se BIVIRKNINGER ].
TRICOR 160mg er kontraindisert hos pasienter med aktiv leversykdom, inkludert de med primær biliær cirrhose og uforklarlige vedvarende leverfunksjonsavvik [se KONTRAINDIKASJONER ]. Overvåk pasientens leverfunksjon, inkludert serum ALT, ASAT og total bilirubin, ved baseline og med jevne mellomrom i løpet av behandlingen med TRICOR. Seponer TRICOR 200 mg hvis tegn eller symptomer på leverskade utvikles eller hvis forhøyede enzymnivåer vedvarer (ALT eller AST > 3 ganger øvre normalgrense, eller hvis det er ledsaget av forhøyet bilirubin). Ikke start TRICOR 160mg på nytt hos disse pasientene hvis det ikke er noen alternativ forklaring på leverskaden.
Myopati og rabdomyolyse
Fibrater øker risikoen for myopati og har vært assosiert med rabdomyolyse. Risikoen for alvorlig muskeltoksisitet ser ut til å være økt hos eldre pasienter og hos pasienter med diabetes, nyresvikt eller hypotyreose.
Myopati bør vurderes hos alle pasienter med diffuse myalgier, muskelømhet eller -svakhet og/eller markerte forhøyede nivåer av kreatinfosfokinase (CPK).
Pasienter bør rådes til å rapportere omgående uforklarlige muskelsmerter, ømhet eller svakhet, spesielt hvis de er ledsaget av ubehag eller feber. CPK-nivåer bør vurderes hos pasienter som rapporterer disse symptomene, og behandling med TRICOR 200 mg bør seponeres hvis det oppstår markert forhøyede CPK-nivåer eller mistenkes eller diagnostiseres myopati/myositt.
Data fra observasjonsstudier indikerer at risikoen for rabdomyolyse øker når fibrater, spesielt gemfibrozil, administreres samtidig med et statin. Kombinasjonen bør unngås med mindre fordelen med ytterligere endringer i lipidnivåer sannsynligvis vil oppveie den økte risikoen for denne medikamentkombinasjonen [se KLINISK FARMAKOLOGI ].
Tilfeller av myopati, inkludert rabdomyolyse, har blitt rapportert med fenofibrater administrert samtidig med kolkisin, og forsiktighet bør utvises ved forskrivning av fenofibrat med kolkisin [se NARKOTIKAHANDEL ].
Serum kreatinin
Økning i serumkreatinin er rapportert hos pasienter på fenofibrat. Disse økningene har en tendens til å gå tilbake til baseline etter seponering av fenofibrat. Den kliniske betydningen av disse observasjonene er ukjent. Overvåk nyrefunksjonen hos pasienter med nedsatt nyrefunksjon som tar TRICOR. Nyreovervåking bør også vurderes for pasienter som tar TRICOR med risiko for nyreinsuffisiens, slik som eldre og pasienter med diabetes.
Kolelithiasis
Fenofibrat, som klofibrat og gemfibrozil, kan øke kolesterolutskillelsen i gallen, og føre til kolelitiasis. Ved mistanke om kolelitiasis, er galleblærenstudier indisert. Behandling med TRICOR 160 mg bør avbrytes hvis det oppdages gallestein.

Kumarin antikoagulantia
Forsiktighet bør utvises når kumarinantikoagulantia gis sammen med TRICOR 160 mg på grunn av potensering av kumarin-type antikoagulasjonseffekter ved å forlenge protrombintid/internasjonalt normalisert forhold (PT/INR). For å forhindre blødningskomplikasjoner anbefales hyppig overvåking av PT/INR og dosejustering av antikoagulanten inntil PT/INR har stabilisert seg [se NARKOTIKAHANDEL ].
Pankreatitt
Pankreatitt er rapportert hos pasienter som tar fenofibrat, gemfibrozil og klofibrat. Denne forekomsten kan representere en svikt i effekt hos pasienter med alvorlig hypertriglyseridemi, en direkte medikamenteffekt eller et sekundært fenomen mediert gjennom galleveisstein eller slamdannelse med obstruksjon av den vanlige gallegangen.
Hematologiske endringer
Mild til moderat reduksjon av hemoglobin, hematokrit og hvite blodlegemer er observert hos pasienter etter oppstart av fenofibratbehandling. Imidlertid stabiliseres disse nivåene under langtidsadministrasjon. Trombocytopeni og agranulocytose er rapportert hos personer behandlet med fenofibrat. Periodisk overvåking av røde og hvite blodlegemer anbefales i løpet av de første 12 månedene av TRICOR-administrasjon.
Overfølsomhetsreaksjoner
Akutt overfølsomhet
Anafylaksi og angioødem er rapportert etter markedsføring med fenofibrat. I noen tilfeller var reaksjonene livstruende og krevde akuttbehandling. Hvis en pasient utvikler tegn eller symptomer på en akutt overfølsomhetsreaksjon, råd dem til å søke øyeblikkelig legehjelp og seponere fenofibrat.
Forsinket overfølsomhet
Alvorlige kutane bivirkninger (SCAR), inkludert Stevens-Johnsons syndrom, toksisk epidermal nekrolyse og legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS), har blitt rapportert etter markedsføring, som forekommer dager til uker etter oppstart av fenofibrat. Tilfellene av DRESS var assosiert med kutane reaksjoner (som utslett eller eksfoliativ dermatitt) og en kombinasjon av eosinofili, feber, systemisk organpåvirkning (nyre, lever eller luftveier). Seponer fenofibrat og behandle pasienter på riktig måte hvis det er mistanke om SCAR.
Venotromboembolisk sykdom
FIELD-studien ble lungeemboli (PE) og dyp venetrombose (DVT) observert med høyere forekomster i fenofibrat-enn den placebobehandlede gruppen. Av 9 795 pasienter som ble registrert i FIELD, var det 4 900 i placebogruppen og 4 895 i fenofibratgruppen. For DVT var det 48 hendelser (1 %) i placebogruppen og 67 (1 %) i fenofibratgruppen (p = 0,074); og for PE var det 32 (0,7 %) hendelser i placebogruppen og 53 (1 %) i fenofibratgruppen (p = 0,022).
I Coronary Drug Project opplevde en høyere andel av klofibratgruppen sikker eller mistenkt fatal eller ikke-dødelig lungeemboli eller tromboflebitt enn placebogruppen (5,2 % vs. 3,3 % etter fem år; p
Paradoksale reduksjoner i HDL-kolesterolnivåer
Det har vært rapporter etter markedsføring og kliniske studier om alvorlige reduksjoner i HDL-kolesterolnivåer (så lave som 2 mg/dL) hos diabetikere og ikke-diabetikere som er startet på fibratbehandling. Nedgangen i HDL-C gjenspeiles av en nedgang i apolipoprotein A1. Denne reduksjonen er rapportert å skje innen 2 uker til år etter oppstart av fibratbehandling. HDL-C-nivåene forblir deprimerte inntil fibratbehandlingen er trukket tilbake; responsen på seponering av fibratbehandling er rask og vedvarende. Den kliniske betydningen av denne reduksjonen i HDL-C er ukjent. Det anbefales at HDL-C-nivåer kontrolleres innen de første månedene etter oppstart av fibratbehandling. Hvis det oppdages et alvorlig deprimert HDL-C-nivå, bør fibratbehandlingen seponeres, og HDL-C-nivået overvåkes til det har returnert til baseline, og fibratbehandlingen bør ikke startes på nytt.
Ikke-klinisk toksikologi
Karsinogenese og mutagenese og svekkelse av fruktbarhet
To karsinogenitetsstudier i kosten er utført på rotter med fenofibrat. I den første 24-måneders studien ble Wistar-rotter dosert med fenofibrat med 10, 45 og 200 mg/kg/dag, omtrent 0,3, 1 og 6 ganger den maksimale anbefalte humane dosen (MRHD) på 300 mg fenofibrat daglig, tilsvarende 145 mg TRICOR 160 mg daglig, basert på sammenligninger av kroppsoverflate. Ved en dose på 200 mg/kg/dag (ved 6 ganger MRHD) var forekomsten av leverkarsinomer signifikant økt hos begge kjønn. En statistisk signifikant økning i pankreaskarsinomer ble observert hos menn med 1 og 6 ganger MRHD; en økning i bukspyttkjerteladenomer og godartede testikkel-interstitielle svulster ble observert med 6 ganger MRHD hos menn. I en andre 24-måneders karsinogenitetsstudie hos rotter i en annen rottesamme (Sprague-Dawley), ga doser på 10 og 60 mg/kg/dag (0,3 og 2 ganger MRHD) signifikant økning i forekomsten av acinare adenom i bukspyttkjertelen i begge kjønn og økning i testikkelinterstitielle celletumorer hos menn med 2 ganger MRHD.
En 117-ukers karsinogenitetsstudie ble utført på rotter som sammenlignet tre legemidler: fenofibrat 10 og 60 mg/kg/dag (0,3 og 2 ganger MRHD, basert på sammenligninger av kroppsoverflate), klofibrat (400 mg/kg/dag; 2 ganger human dose), og gemfibrozil (250 mg/kg/dag; 2 ganger human dose, basert på mg/m² overflate). Fenofibrat økte pankreas acinare adenomer hos begge kjønn. Klofibrat økte hepatocellulært karsinom og pankreas acinare adenomer hos menn og hepatiske neoplastiske knuter hos kvinner. Gemfibrozil økte hepatiske neoplastiske knuter hos menn og kvinner, mens alle tre legemidlene økte testikkelinterstitielle celletumorer hos menn.
en 21-måneders studie på CF-1-mus økte fenofibrat 10, 45 og 200 mg/kg/dag (omtrent 0,2, 1 og 3 ganger MRHD, basert på sammenligninger av kroppsoverflate) signifikant leverkarsinomer i begge kjønn på 3 ganger MRHD. I en andre 18-måneders studie med 10, 60 og 200 mg/kg/dag, økte fenofibrat signifikant leverkarsinomer hos hannmus og leveradenomer hos hunnmus med 3 ganger MRHD.
Elektronmikroskopistudier har vist peroksisomal proliferasjon etter administrering av fenofibrat til rotte. En tilstrekkelig studie for å teste for peroksisomproliferasjon hos mennesker er ikke gjort, men endringer i peroksisommorfologi og -antall er observert hos mennesker etter behandling med andre medlemmer av fibratklassen når leverbiopsier ble sammenlignet før og etter behandling hos samme individ.
Fenofibrat har vist seg å være uten mutagent potensial i følgende tester: Ames, muselymfom, kromosomavvik og ikke-planlagt DNA-syntese i primære rottehepatocytter.
I fertilitetsstudier fikk rotter orale diettdoser av fenofibrat, hanner fikk 61 dager før paring og hunner 15 dager før paring gjennom avvenning, noe som ikke resulterte i noen negativ effekt på fertiliteten ved doser opp til 300 mg/kg/dag (10 ganger MRHD, basert på sammenligninger av kroppsoverflate).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Begrensede tilgjengelige data for bruk av fenofibrat hos gravide kvinner er utilstrekkelige til å fastslå en medikamentassosiert risiko for alvorlige fødselsskader, spontanabort eller ugunstige utfall hos mor eller foster. I reproduksjonsstudier på dyr ble det ikke observert tegn på embryo-føtal toksisitet ved oral administrering av fenofibrat til rotter og kaniner under organogenese ved doser mindre enn eller tilsvarende maksimal anbefalt klinisk dose på 145 mg daglig, basert på kroppsoverflate (mg/ m²). Uønskede reproduksjonsutfall oppstod ved høyere doser i nærvær av maternell toksisitet (se Data ). TRICOR 200 mg skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2-4 % og 15-20 %.
Data
Dyredata
Hos drektige rotter som ble gitt orale diettdoser på 14, 127 og 361 mg/kg/dag fra drektighetsdag 6-15 i løpet av organogeneseperioden, ble ingen uønskede utviklingsfunn observert ved 14 mg/kg/dag (mindre enn den kliniske eksponeringen) ved maksimal anbefalt human dose [MRHD] på 300 mg fenofibrat daglig, tilsvarende 145 mg TRICOR daglig, basert på sammenligninger av kroppsoverflate). Økte føtale skjelettmisdannelser ble observert ved maternal toksiske doser (361 mg/kg/dag, tilsvarende 12 ganger den kliniske eksponeringen ved MRHD) som signifikant undertrykte mors kroppsvektøkning.
Hos drektige kaniner som ble gitt orale sondedoser på 15, 150 og 300 mg/kg/dag fra drektighetsdag 618 i løpet av organogeneseperioden og fikk føde, ble det ikke observert uønskede utviklingsfunn ved 15 mg/kg/dag (en dose som tilnærmer den kliniske eksponeringen ved MRHD, basert på sammenligninger av kroppsoverflate). Aborterte kull ble observert ved maternal toksiske doser (≥ 150 mg/kg/dag, tilsvarende ≥ 10 ganger den kliniske eksponeringen ved MRHD) som undertrykte mors kroppsvektsøkning.
Hos drektige rotter som fikk orale diettdoser på 15, 75 og 300 mg/kg/dag fra drektighetsdag 15 til og med ammedag 21 (avvenning), ble det ikke observert uønskede utviklingseffekter ved 15 mg/kg/dag (mindre enn den kliniske eksponeringen) ved MRHD, basert på sammenligninger av kroppsoverflate), til tross for maternell toksisitet (redusert vektøkning). Post-implantasjonstap ble observert ved ≥ 75 mg/kg/dag (≥ 2 ganger den kliniske eksponeringen ved MRHD) i nærvær av maternell toksisitet (redusert vektøkning). Redusert valpeoverlevelse ble notert ved 300 mg/kg/dag (10 ganger den kliniske eksponeringen ved MRHD), noe som var assosiert med redusert maternell kroppsvektøkning/morsom omsorgssvikt.
Amming
Risikosammendrag
Det er ingen tilgjengelig informasjon om tilstedeværelsen av fenofibrat i morsmelk, effekter av stoffet på spedbarn som ammes, eller effekten på melkeproduksjonen. Fenofibrat finnes i melken til rotter, og er derfor sannsynligvis tilstede i morsmelk. På grunn av potensialet for alvorlige bivirkninger hos spedbarn som ammes, slik som forstyrrelse av spedbarns lipidmetabolisme, bør kvinner ikke amme under behandling med TRICOR 200 mg og i 5 dager etter siste dose [se KONTRAINDIKASJONER ].
Pediatrisk bruk
Sikkerhet og effektivitet er ikke fastslått hos pediatriske pasienter.
Geriatrisk bruk
Fenofibrinsyre er kjent for å utskilles vesentlig av nyrene, og risikoen for bivirkninger av dette legemidlet kan være større hos pasienter med nedsatt nyrefunksjon. Fenofibrinsyreeksponering påvirkes ikke av alder. Siden eldre pasienter har høyere forekomst av nedsatt nyrefunksjon, bør dosevalg for eldre gjøres på grunnlag av nyrefunksjonen [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ]. Eldre pasienter med normal nyrefunksjon bør ikke kreve doseendringer. Vurder å overvåke nyrefunksjonen hos eldre pasienter som tar TRICOR.
Nedsatt nyrefunksjon
Bruk av TRICOR 160 mg bør unngås hos pasienter som har alvorlig nedsatt nyrefunksjon [se KONTRAINDIKASJONER ]. Dosereduksjon er nødvendig hos pasienter med mild til moderat nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ]. Overvåking av nyrefunksjonen hos pasienter med nedsatt nyrefunksjon anbefales.
Nedsatt leverfunksjon
Bruken av TRICOR 200 mg har ikke blitt evaluert hos personer med nedsatt leverfunksjon [se KONTRAINDIKASJONER og KLINISK FARMAKOLOGI ].
OVERDOSE
Det finnes ingen spesifikk behandling for overdosering med TRICOR. Generell støttebehandling av pasienten er indisert, inkludert overvåking av vitale tegn og observasjon av klinisk status, dersom en overdose skulle oppstå. Hvis det er indisert, bør eliminering av uabsorbert legemiddel oppnås ved brekninger eller mageskylling; vanlige forholdsregler bør tas for å opprettholde luftveiene. Fordi fenofibrinsyre er sterkt bundet til plasmaproteiner, bør hemodialyse ikke vurderes.
KONTRAINDIKASJONER
TRICOR 200mg er kontraindisert ved:
- . pasienter med alvorlig nedsatt nyrefunksjon, inkludert de som får dialyse [se KLINISK FARMAKOLOGI ]. . pasienter med aktiv leversykdom, inkludert de med primær biliær cirrhose og uforklarlige vedvarende leverfunksjonsavvik [se ADVARSLER OG FORHOLDSREGLER ]. . pasienter med eksisterende galleblæresykdom [se ADVARSLER OG FORHOLDSREGLER ]. . ammende mødre [se Bruk i spesifikke populasjoner ]. . pasienter med kjent overfølsomhet overfor fenofibrat eller fenofibrinsyre [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Den aktive delen av TRICOR er fenofibrinsyre. De farmakologiske effektene av fenofibrinsyre hos både dyr og mennesker har blitt grundig studert gjennom oral administrering av fenofibrat.
De lipidmodifiserende effektene av fenofibrinsyre sett i klinisk praksis har blitt forklart in vivo i transgene mus og in vitro i humane hepatocyttkulturer ved aktivering av peroxisomproliferatoraktivert reseptor α (PPARα). Gjennom denne mekanismen øker fenofibrat lipolyse og eliminering av triglyseridrike partikler fra plasma ved å aktivere lipoproteinlipase og redusere produksjonen av apoprotein C-III (en hemmer av lipoproteinlipaseaktivitet).
Den resulterende reduksjonen i TG gir en endring i størrelsen og sammensetningen av LDL fra små, tette partikler (som antas å være aterogene på grunn av deres mottakelighet for oksidasjon), til store flytende partikler. Disse større partiklene har en større affinitet for kolesterolreseptorer og kataboliseres raskt. Aktivering av PPARα induserer også en økning i syntesen av apolipoproteinene AI, A-II og HDL-kolesterol.
Fenofibrat reduserer også serumurinsyrenivået hos hyperurikemiske og normale individer ved å øke urinutskillelsen av urinsyre.
Farmakodynamikk
En rekke kliniske studier har vist at forhøyede nivåer av total-C, LDL-C og apo B, et LDL-membrankompleks, er assosiert med human aterosklerose. Tilsvarende er reduserte nivåer av HDL-C og dets transportkompleks, apolipoprotein A (apo AI og apo AII) assosiert med utviklingen av aterosklerose. Epidemiologiske undersøkelser har fastslått at kardiovaskulær morbiditet og dødelighet varierer direkte med nivået av total-C, LDL-C og TG, og omvendt med nivået av HDL-C. Den uavhengige effekten av å øke HDL-C eller senke triglyserider (TG) på risikoen for kardiovaskulær sykelighet og dødelighet er ikke fastslått.
Fenofibrinsyre, den aktive metabolitten av fenofibrat, produserer reduksjoner i totalkolesterol, LDL-kolesterol, apolipoprotein B, totale triglyserider og triglyseridrikt lipoprotein (VLDL) hos behandlede pasienter. I tillegg resulterer behandling med fenofibrat i økninger i høydensitetslipoprotein (HDL) og apolipoproteiner apoAI og apoAII.
Farmakokinetikk
Plasmakonsentrasjoner av fenofibrinsyre etter administrering av tre 48 mg eller én 145 mg tabletter tilsvarer under matingsforhold en 200 mg mikronisert fenofibratkapsel.
Fenofibrat er en pro-drug av den aktive kjemiske delen fenofibric acid. Fenofibrat omdannes ved esterhydrolyse i kroppen til fenofibrinsyre som er den aktive bestanddel som kan måles i sirkulasjonen.
Absorpsjon
Den absolutte biotilgjengeligheten til fenofibrat kan ikke bestemmes da forbindelsen er praktisk talt uløselig i vandige medier egnet for injeksjon. Imidlertid absorberes fenofibrat godt fra mage-tarmkanalen. Etter oral administrering hos friske frivillige forekom ca. 60 % av en enkeltdose radiomerket fenofibrat i urinen, primært som fenofibrinsyre og dets glukuronatkonjugat, og 25 % ble utskilt i feces. Maksimal plasmanivå av fenofibrinsyre oppstår innen 6 til 8 timer etter administrering.
Eksponering for fenofibrinsyre i plasma, målt ved Cmax og AUC, er ikke signifikant forskjellig når en enkeltdose på 145 mg fenofibrat administreres under fastende eller ikke-fastende forhold.
Fordeling
Ved gjentatt dosering av fenofibrat oppnås fenofibsyre-steady state innen 9 dager. Plasmakonsentrasjoner av fenofibrinsyre ved steady state er omtrent det dobbelte av de etter en enkeltdose. Serumproteinbindingen var omtrent 99 % hos normale og hyperlipidemiske personer.
Metabolisme
Etter oral administrering hydrolyseres fenofibrat raskt av esteraser til den aktive metabolitten fenofibrinsyre; ikke uendret fenofibrat påvises i plasma.
Fenofibrinsyre konjugeres primært med glukuronsyre og skilles deretter ut i urinen. En liten mengde fenofibrinsyre reduseres ved karbonyldelen til en benzhydrolmetabolitt som i sin tur konjugeres med glukuronsyre og skilles ut i urinen.
In vivo metabolismedata indikerer at verken fenofibrat eller fenofibrinsyre gjennomgår oksidativ metabolisme (f.eks. cytokrom P450) i betydelig grad.
Eliminering
Etter absorpsjon utskilles fenofibrat hovedsakelig i urinen i form av metabolitter, primært fenofibrinsyre og fenofibrinsyreglukuronid. Etter administrering av radiomerket fenofibrat kom ca. 60 % av dosen til syne i urinen og 25 % ble skilt ut i feces.
Fenofibrinsyre elimineres med en halveringstid på 20 timer, noe som tillater dosering én gang daglig.
Spesielle populasjoner
Geriatri
Hos eldre frivillige i alderen 77 til 87 år var den orale clearance av fenofibrinsyre etter en enkelt oral dose fenofibrat 1,2 l/time, som sammenlignes med 1,1 l/time hos unge voksne. Dette indikerer at et lignende doseringsregime kan brukes hos eldre med normal nyrefunksjon, uten å øke akkumuleringen av legemidlet eller metabolitter [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Pediatri
Farmakokinetikken til TRICOR 160 mg er ikke studert i pediatriske populasjoner.
Kjønn
Ingen farmakokinetisk forskjell mellom menn og kvinner er observert for fenofibrat.
Løp
Påvirkning av rase på farmakokinetikken til fenofibrat er ikke studert, men fenofibrat metaboliseres ikke av enzymer som er kjent for å utvise interetnisk variasjon.
Nedsatt nyrefunksjon
Farmakokinetikken til fenofibrinsyre ble undersøkt hos pasienter med mild, moderat og alvorlig nedsatt nyrefunksjon. Pasienter med alvorlig nedsatt nyrefunksjon (estimert glomerulær filtrasjonshastighet [eGFR] DOSERING OG ADMINISTRASJON ].
Nedsatt leverfunksjon
Ingen farmakokinetiske studier er utført hos pasienter med nedsatt leverfunksjon.
Legemiddel-legemiddelinteraksjoner
In vitro-studier med humane levermikrosomer indikerer at fenofibrat og fenofibrinsyre ikke er hemmere av cytokrom (CYP) P450 isoformene CYP3A4, CYP2D6, CYP2E1 eller CYP1A2. De er svake hemmere av CYP2C8, CYP2C19 og CYP2A6, og milde til moderate hemmere av CYP2C9 ved terapeutiske konsentrasjoner.
Tabell 2 beskriver effekten av samtidig administrerte legemidler på systemisk eksponering av fenofibrinsyre. Tabell 3 beskriver effekten av samtidig administrert fenofibrat eller fenofibrinsyre på andre legemidler.
Kliniske studier
Primær hyperkolesterolemi (heterozygot familiær og ikke-familiær) og blandet dyslipidemi
Effekten av fenofibrat ved en dose tilsvarende 145 mg TRICOR (fenofibrattabletter) per dag ble vurdert fra fire randomiserte, placebokontrollerte, dobbeltblinde, parallellgruppestudier inkludert pasienter med følgende gjennomsnittlige baseline lipidverdier: total-C 306,9 mg/dL; LDL-C 213,8 mg/dL; HDL-C 52,3 mg/dL; og triglyserider 191,0 mg/dL. TRICOR 200 mg-behandling senket LDL-C, Total-C og LDL-C/HDL-C-forholdet. TRICOR-behandling senket også triglyserider og økte HDL-C (se tabell 4).
I en undergruppe av forsøkspersonene ble målinger av apo B utført. TRICOR 200 mg-behandling reduserte apo B signifikant fra baseline til endepunkt sammenlignet med placebo (henholdsvis -25,1 % vs. 2,4 %, p
Alvorlig hypertriglyseridemi
Effekten av fenofibrat på serumtriglyserider ble studert i to randomiserte, dobbeltblindede, placebokontrollerte kliniske studier med 147 hypertriglyseridemiske pasienter. Pasientene ble behandlet i åtte uker etter protokoller som bare skilte seg ved at den ene kom inn i pasienter med baseline TG-nivåer på 500 til 1500 mg/dL, og den andre TG-nivåer på 350 til 500 mg/dL. Hos pasienter med hypertriglyseridemi og normal kolesterolemi med eller uten hyperkylomikronemi, reduserte behandling med fenofibrat i doser tilsvarende TRICOR 145 mg per dag primært triglyserider med svært lav tetthet lipoprotein (VLDL) og VLDL-kolesterol. Behandling av pasienter med forhøyede triglyserider resulterer ofte i en økning av LDL-C (se tabell 5).
Effekten av TRICOR 160 mg på kardiovaskulær morbiditet og dødelighet er ikke fastslått.
PASIENTINFORMASJON
Pasienter bør informeres om:
- . av de potensielle fordelene og risikoene ved TRICOR. . ikke bruke TRICOR hvis det er kjent overfølsomhet overfor fenofibrat eller fenofibrinsyre. . av medisiner som ikke bør tas i kombinasjon med TRICOR. . at hvis de tar kumarinantikoagulanter, kan TRICOR 160mg øke deres antikoagulerende effekt, og økt overvåking kan være nødvendig. . å fortsette å følge en passende lipidmodifiserende diett mens du tar TRICOR. . å ta TRICOR 160 mg én gang daglig, uten hensyn til mat, i den foreskrevne dosen, og svelge hver tablett hel. . å gå tilbake til legekontoret for rutinemessig overvåking. . å informere legen om alle medisiner, kosttilskudd og urtepreparater de tar og eventuelle endringer i deres medisinske tilstand. Pasienter bør også rådes til å informere legen sin som forskriver en ny medisin om at de tar TRICOR. . å informere legen om symptomer på leverskade (f.eks. gulsott, magesmerter, kvalme, ubehag, mørk urin, unormal avføring, kløe); muskelsmerter, ømhet eller svakhet; eller andre nye symptomer. . ikke å amme under behandling med TRICOR og i 5 dager etter siste dose.
