Zetia 10mg Ezetimibe Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Zetia og hvordan brukes det?
Zetia er en reseptbelagt medisin som brukes til å behandle symptomene på høyt kolesterol og redusere kolesterolet. Zetia kan brukes alene eller sammen med andre medisiner.
Zetia tilhører en klasse legemidler som kalles lipidsenkende midler, 2-azetidinoner.
Det er ikke kjent om Zetia 10mg er trygt og effektivt hos barn under 10 år.
Hva er de mulige bivirkningene av Zetia?
Zetia kan forårsake alvorlige bivirkninger, inkludert:
- . Muskelsmerte, . muskelømhet eller svakhet, . feber, . uvanlig tretthet, og . mørk farget urin
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Zetia 10mg inkluderer:
- . muskel- eller leddsmerter, . tett nese, . bihulesmerter, . sår hals, . diaré, og . smerter i en arm eller et ben
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Zetia. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
ZETIA (ezetimib) er i en klasse av lipidsenkende forbindelser som selektivt hemmer intestinal absorpsjon av kolesterol og relaterte fytosteroler. Det kjemiske navnet på ezetimib er 1-(4-fluorfenyl)-3(R)-[3-(4-fluorfenyl)-3(S)-hydroksypropyl]-4(S)-(4-hydroksyfenyl)-2-azetidinon . Den empiriske formelen er C24H21F2NO3. Dens molekylvekt er 409,4 og dens strukturformel er:
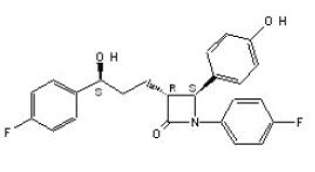
Ezetimibe er et hvitt, krystallinsk pulver som er fritt til svært løselig i etanol, metanol og aceton og praktisk talt uløselig i vann. Ezetimib har et smeltepunkt på ca. 163°C og er stabilt ved omgivelsestemperatur. ZETIA 10mg er tilgjengelig som en tablett for oral administrering som inneholder 10 mg ezetimib og følgende inaktive ingredienser: kroskarmellosenatrium NF, laktosemonohydrat NF, magnesiumstearat NF, mikrokrystallinsk cellulose NF, povidon USP og natriumlaurylsulfat NF.
INDIKASJONER
Terapi med lipidforandrende midler bør kun være én komponent i intervensjon med flere risikofaktorer hos individer med betydelig økt risiko for aterosklerotisk vaskulær sykdom på grunn av hyperkolesterolemi. Medikamentell behandling er indisert som et tillegg til dietten når responsen på en diett begrenset i mettet fett og kolesterol og andre ikke-farmakologiske tiltak alene har vært utilstrekkelig.
Primær hyperlipidemi
Monoterapi
ZETIA®, administrert alene, er indisert som tilleggsterapi til diett for reduksjon av forhøyet totalkolesterol (total-C), lavdensitetslipoproteinkolesterol (LDL-C), apolipoprotein B (Apo B) og ikke-høydensitetslipoproteinkolesterol (ikke-HDL-C) hos pasienter med primær (heterozygot familiær og ikke-familiær) hyperlipidemi.
Kombinasjonsterapi med HMG-CoA-reduktasehemmere (statiner)
ZETIA 10 mg, administrert i kombinasjon med en 3-hydroksy-3-metylglutaryl-koenzym A (HMG-CoA) reduktasehemmer (statin), er indisert som tilleggsbehandling til diett for reduksjon av forhøyet total-C, LDL-C, Apo B, og ikke-HDL-C hos pasienter med primær (heterozygot familiær og ikke-familiær) hyperlipidemi.
Kombinasjonsterapi med fenofibrat
ZETIA 10 mg, administrert i kombinasjon med fenofibrat, er indisert som tilleggsbehandling til diett for reduksjon av forhøyet total-C, LDL-C, Apo B og ikke-HDL-C hos voksne pasienter med blandet hyperlipidemi.
Homozygot familiær hyperkolesterolemi (HoFH)
Kombinasjonen av ZETIA 10 mg og atorvastatin eller simvastatin er indisert for reduksjon av forhøyede total-C- og LDL-C-nivåer hos pasienter med HoFH, som et tillegg til andre lipidsenkende behandlinger (f.eks. LDL-aferese) eller hvis slike behandlinger ikke er tilgjengelige. .
Homozygot sitosterolemi
ZETIA 10mg er indisert som tilleggsbehandling til diett for reduksjon av forhøyede sitosterol- og campesterolnivåer hos pasienter med homozygot familiær sitosterolemi.
Bruksbegrensninger
Effekten av ZETIA på kardiovaskulær morbiditet og dødelighet er ikke fastslått.
ZETIA har ikke blitt studert ved Fredrickson Type I, III, IV og V dyslipidemier.
DOSERING OG ADMINISTRASJON
Generell doseringsinformasjon
Den anbefalte dosen av ZETIA er 10 mg én gang daglig.
ZETIA 10 mg kan administreres med eller uten mat.
Samtidig lipidsenkende terapi
ZETIA 10 mg kan administreres sammen med et statin (hos pasienter med primær hyperlipidemi) eller med fenofibrat (hos pasienter med blandet hyperlipidemi) for inkrementell effekt. For enkelhets skyld kan den daglige dosen av ZETIA tas samtidig med statin eller fenofibrat, i henhold til doseringsanbefalingene for de respektive medisinene.
Coadminis med gallesyrebindere
Dosering av ZETIA bør skje enten ≥2 timer før eller ≥4 timer etter administrering av en gallesyrebinder [se NARKOTIKAHANDEL ].
Pasienter med nedsatt leverfunksjon
Ingen dosejustering er nødvendig hos pasienter med lett nedsatt leverfunksjon [se ADVARSLER OG FORHOLDSREGLER ].
Pasienter med nedsatt nyrefunksjon
Ingen dosejustering er nødvendig hos pasienter med nedsatt nyrefunksjon [se KLINISK FARMAKOLOGI ]. Når det gis sammen med simvastatin til pasienter med moderat til alvorlig nedsatt nyrefunksjon (estimert glomerulær filtrasjonshastighet Bruk i spesifikke populasjoner ].
Geriatriske pasienter
Ingen dosejustering er nødvendig hos geriatriske pasienter [se KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
10 mg tabletter er hvite til off-white, kapselformede tabletter merket med "414" på den ene siden.
Oppbevaring og håndtering
nr. 3861 - Tabletter ZETIA, 10 mg , er hvite til off-white, kapselformede tabletter merket med "414" på den ene siden. De leveres som følger:
NDC 66582-414-31 flasker à 30 stk NDC 66582-414-54 flasker à 90 stk NDC 66582-414-74 flasker à 500 NDC 66582-414-76 flasker à 5000 NDC 66582-414-28 enhetsdosepakker med 100 stk.
Oppbevaring
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F). [Se USP kontrollert romtemperatur .] Beskytt mot fuktighet.
Merck Sharp & Dohme Corp., et datterselskap av MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revidert: august 2013
BIVIRKNINGER
Følgende alvorlige bivirkninger er omtalt mer detaljert i andre deler av etiketten:
- . Leverenzymavvik [se ADVARSLER OG FORHOLDSREGLER ] . Rabdomyolyse og myopati [se ADVARSLER OG FORHOLDSREGLER ]
Monoterapistudier
ZETIA 10 mg-databasen med kontrollerte kliniske studier (placebokontrollert) av 2396 pasienter med en median behandlingsvarighet på 12 uker (fra 0 til 39 uker), avbrøt 3,3 % av pasientene på ZETIA 10 mg og 2,9 % av pasientene på placebo på grunn av bivirkninger reaksjoner. De vanligste bivirkningene i gruppen pasienter som ble behandlet med ZETIA 10 mg som førte til seponering av behandlingen og som oppsto i en høyere hastighet enn placebo, var:
- . Artralgi (0,3 %) . Svimmelhet (0,2 %) . Gamma-glutamyltransferase økt (0,2 %)
De vanligst rapporterte bivirkningene (insidens ≥2 % og høyere enn placebo) i ZETIA monoterapi-kontrollerte kliniske studiedatabase med 2396 pasienter var: øvre luftveisinfeksjon (4,3 %), diaré (4,1 %), artralgi (3,0 %), bihulebetennelse (2,8 %) og smerter i ekstremiteter (2,7 %).
Studier av samtidig administrering av statiner
databasen for ZETIA + statinkontrollerte kliniske studier med 11 308 pasienter med en median behandlingsvarighet på 8 uker (område 0 til 112 uker), avbrøt 4,0 % av pasientene på ZETIA + statin og 3,3 % av pasientene på statin alene på grunn av bivirkninger. De vanligste bivirkningene i gruppen av pasienter behandlet med ZETIA + statin som førte til seponering av behandlingen og forekom med en høyere hastighet enn statin alene, var:
- . Alaninaminotransferase økte (0,6 %) . Myalgi (0,5 %) . Tretthet, økt aspartataminotransferase, hodepine og smerter i ekstremiteter (hver på 0,2 %)
De vanligst rapporterte bivirkningene (insidens ≥2 % og høyere enn statin alene) i ZETIA + statinkontrollerte kliniske studiedatabase med 11 308 pasienter var: nasofaryngitt (3,7 %), myalgi (3,2 %), øvre luftveisinfeksjon (2,9 % ), artralgi (2,6 %) og diaré (2,5 %).
Erfaring fra kliniske forsøk
Fordi kliniske studier er utført under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
Monoterapi
I 10 dobbeltblindede, placebokontrollerte kliniske studier, 2396 pasienter med primær hyperlipidemi (aldersgruppe 9-86 år, 50 % kvinner, 90 % kaukasiere, 5 % svarte, 3 % latinamerikanere, 2 % asiater) og forhøyet LDL-C ble behandlet med ZETIA 10 mg/dag i en median behandlingsvarighet på 12 uker (fra 0 til 39 uker).
Bivirkninger rapportert hos ≥2 % av pasientene behandlet med ZETIA og med en insidens høyere enn placebo i placebokontrollerte studier av ZETIA 10 mg, uavhengig av årsaksvurdering, er vist i tabell 1.
TABELL 1: Kliniske bivirkninger som oppstår hos ≥2 % av pasientene behandlet med ZETIA 10 mg og med en forekomst større enn placebo, uavhengig av årsakssammenheng
Frekvensen av mindre vanlige bivirkninger var sammenlignbar mellom ZETIA 10 mg og placebo.
Kombinasjon med statin
I 28 dobbeltblinde, kontrollerte (placebo eller aktiv-kontrollerte) kliniske studier, 11 308 pasienter med primær hyperlipidemi (aldersspenn 10-93 år, 48 % kvinner, 85 % kaukasiere, 7 % svarte, 4 % latinamerikanere, 3 % asiater) og forhøyet LDL-C ble behandlet med ZETIA 10 mg/dag samtidig med eller lagt til pågående statinbehandling i en median behandlingsvarighet på 8 uker (område 0 til 112 uker).
Forekomsten av påfølgende økte transaminaser (≥3 × ULN) var høyere hos pasienter som fikk ZETIA 10 mg administrert med statiner (1,3 %) enn hos pasienter behandlet med statiner alene (0,4 %). [Se ADVARSLER OG FORHOLDSREGLER ]
Kliniske bivirkninger rapportert hos ≥2 % av pasientene behandlet med ZETIA + statin og med en forekomst høyere enn statin, uavhengig av årsaksvurdering, er vist i tabell 2.
TABELL 2: Kliniske bivirkninger som oppstår hos ≥2 % av pasientene behandlet med ZETIA 10 mg samtidig administrert med et statin og med en forekomst som er høyere enn statin, uavhengig av årsakssammenheng
Kombinasjon med fenofibrat
Denne kliniske studien som involverte 625 pasienter med blandet dyslipidemi (aldersområde 20-76 år, 44 % kvinner, 79 % kaukasiere, 0,1 % svarte, 11 % latinamerikanere, 5 % asiater) behandlet i opptil 12 uker og 576 pasienter behandlet i opptil 12 uker. ytterligere 48 uker evaluert samtidig administrering av ZETIA og fenofibrat. Denne studien ble ikke designet for å sammenligne behandlingsgrupper for sjeldne hendelser. Insidensrater (95 % KI) for klinisk viktige økninger (≥3 — ULN, fortløpende) i levertransaminasenivåer var 4,5 % (1,9, 8,8) og 2,7 % (1,2, 5,4) for fenofibrat monoterapi (n=188) og ZETIA administrert samtidig. med henholdsvis fenofibrat (n=183), justert for behandlingseksponering. Tilsvarende insidensrater for kolecystektomi var henholdsvis 0,6 % (95 % KI: 0,0 %, 3,1 %) og 1,7 % (95 % KI: 0,6 %, 4,0 %) for fenofibrat monoterapi og ZETIA 10 mg samtidig administrert med fenofibrat [se NARKOTIKAHANDEL ]. Antallet pasienter som ble utsatt for samtidig administreringsbehandling samt fenofibrat og ezetimib monoterapi var utilstrekkelig til å vurdere risikoen for galleblæresykdom. Det var ingen CPK-økninger > 10 — ULN i noen av behandlingsgruppene.
Erfaring etter markedsføring
Fordi reaksjonene nedenfor er rapportert frivillig fra en populasjon av usikker størrelse, er det vanligvis ikke mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering.
Følgende tilleggsbivirkninger er identifisert under bruk av ZETIA etter godkjenning:
Overfølsomhetsreaksjoner, inkludert anafylaksi, angioødem, utslett og urticaria; erythema multiforme; artralgi; myalgi; forhøyet kreatinfosfokinase; myopati/rabdomyolyse [se ADVARSLER OG FORHOLDSREGLER ]; økning i levertransaminaser; hepatitt; magesmerter; trombocytopeni; pankreatitt; kvalme; svimmelhet; parestesi; depresjon; hodepine; kolelithiasis; kolecystitt.
NARKOTIKAHANDEL
[Se KLINISK FARMAKOLOGI ]
Syklosporin
Forsiktighet bør utvises ved samtidig bruk av ZETIA 10 mg og ciklosporin på grunn av økt eksponering for både ezetimib og ciklosporin. Syklosporinkonsentrasjoner bør overvåkes hos pasienter som får ZETIA og ciklosporin.
Graden av økning i eksponering for ezetimib kan være større hos pasienter med alvorlig nyresvikt. Hos pasienter som behandles med ciklosporin, bør de potensielle effektene av økt eksponering for ezetimib ved samtidig bruk veies nøye opp mot fordelene ved endringer i lipidnivåer gitt av ezetimib.
Fibrater
Effekten og sikkerheten ved samtidig administrering av ezetimib med andre fibrater enn fenofibrat er ikke studert.
Fibrater kan øke kolesterolutskillelsen i gallen, og føre til kolelitiasis. I en preklinisk studie på hunder økte ezetimib kolesterol i galleblæren [se Ikke-klinisk toksikologi ]. Samtidig administrering av ZETIA med andre fibrater enn fenofibrat anbefales ikke før bruk hos pasienter er tilstrekkelig studert.
Fenofibrat
Hvis det er mistanke om kolelitiasis hos en pasient som får ZETIA 10 mg og fenofibrat, er galleblærenstudier indisert og alternativ lipidsenkende behandling bør vurderes [se BIVIRKNINGER og produktmerkingen for fenofibrat].
Kolestyramin
Samtidig administrering av kolestyramin reduserte gjennomsnittlig arealet under kurven (AUC) for total ezetimib med omtrent 55 %. Den inkrementelle LDL-C-reduksjonen på grunn av tilsetning av ezetimib til kolestyramin kan reduseres ved denne interaksjonen.
Kumarin antikoagulantia
Hvis ezetimib legges til warfarin, et kumarinantikoagulant, bør International Normalized Ratio (INR) overvåkes på passende måte.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Bruk sammen med statiner eller fenofibrat
Samtidig administrering av ZETIA med et spesifikt statin eller fenofibrat bør være i samsvar med produktmerkingen for den medisinen.
Leverenzymer
kontrollerte kliniske monoterapistudier var forekomsten av påfølgende økninger (≥3 x øvre normalgrense [ULN]) i levertransaminasenivåer lik mellom ZETIA (0,5 %) og placebo (0,3 %).
I kontrollerte kliniske kombinasjonsstudier av ZETIA 10 mg initiert samtidig med et statin, var forekomsten av påfølgende økninger (≥3 x ULN) i levertransaminasenivåer 1,3 % for pasienter behandlet med ZETIA administrert med statiner og 0,4 % for pasienter behandlet med statiner alene. Disse økningene i transaminaser var generelt asymptomatiske, ikke assosiert med kolestase, og returnerte til baseline etter seponering av behandlingen eller med fortsatt behandling. Når ZETIA gis samtidig med et statin, bør leverprøver utføres ved oppstart av behandlingen og i henhold til anbefalingene fra statinet. Dersom en økning i ALAT eller ASAT ≥3 x ULN vedvarer, bør du vurdere seponering av ZETIA 10 mg og/eller statinet.
Myopati/Rabdomyolyse
kliniske studier var det ingen overskytende myopati eller rabdomyolyse assosiert med ZETIA 10 mg sammenlignet med den relevante kontrollarmen (placebo eller statin alene). Imidlertid er myopati og rabdomyolyse kjente bivirkninger på statiner og andre lipidsenkende legemidler. I kliniske studier var forekomsten av kreatinfosfokinase (CPK) > 10 x ULN 0,2 % for ZETIA vs. 0,1 % for placebo, og 0,1 % for ZETIA samtidig administrert med et statin vs. 0,4 % for statiner alene. Risikoen for skjelettmuskeltoksisitet øker med høyere doser statin, høy alder (> 65), hypotyreose, nedsatt nyrefunksjon, og avhengig av statin som brukes, samtidig bruk av andre legemidler.
Etter markedsføring av ZETIA er tilfeller av myopati og rabdomyolyse rapportert. De fleste pasienter som utviklet rabdomyolyse tok et statin før oppstart av ZETIA. Imidlertid er rabdomyolyse rapportert med ZETIA 10 mg monoterapi og med tillegg av ZETIA 10 mg til midler som er kjent for å være forbundet med økt risiko for rabdomyolyse, som fibrater. ZETIA og eventuelle statiner eller fibrater som pasienten tar samtidig, bør seponeres umiddelbart hvis myopati er diagnostisert eller mistenkt. Tilstedeværelsen av muskelsymptomer og et CPK-nivå > 10 x ULN indikerer myopati.
Nedsatt leverfunksjon
På grunn av de ukjente effektene av økt eksponering for ezetimib hos pasienter med moderat til alvorlig nedsatt leverfunksjon, anbefales ikke ZETIA til disse pasientene. [Se KLINISK FARMAKOLOGI ]
Informasjon om pasientveiledning
Se FDA-godkjent pasientmerking (PASIENTINFORMASJON).
Pasienter bør rådes til å følge deres nasjonale kolesterolopplæringsprogram (NCEP) - anbefalt diett, et regelmessig treningsprogram og periodisk testing av et fastende lipidpanel.
Muskelsmerte
Alle pasienter som starter behandling med ezetimibe bør informeres om risikoen for myopati og fortelles om umiddelbart å rapportere enhver uforklarlig muskelsmerte, ømhet eller svakhet. Risikoen for dette er økt når du tar visse typer medisiner. Pasienter bør diskutere all medisin, både reseptbelagte og reseptfrie, med legen sin.
Leverenzymer
Levertester bør utføres når ZETIA 10 mg legges til statinbehandling og i henhold til statinanbefalingene.
Svangerskap
Kvinner i fertil alder bør rådes til å bruke en effektiv prevensjonsmetode for å forhindre graviditet mens de bruker ZETIA i tillegg til statinbehandling. Diskuter fremtidige graviditetsplaner med pasientene dine, og diskuter når de skal stoppe kombinasjonen ZETIA 10 mg og statinbehandling hvis de prøver å bli gravide. Pasienter bør informeres om at hvis de blir gravide, bør de slutte å ta kombinasjonen ZETIA 10 mg og statinbehandling og ringe helsepersonell.
Amming
Kvinner som ammer bør rådes til ikke å bruke ZETIA i tillegg til statinbehandling. Pasienter som har en lipidforstyrrelse og ammer bør rådes til å diskutere alternativene med helsepersonell.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
En 104-ukers diettkarsinogenitetsstudie med ezetimib ble utført på rotter i doser opp til 1500 mg/kg/dag (hanner) og 500 mg/kg/dag (hunn) (~20 x human eksponering ved 10 mg daglig basert på AUC0 -24 timer for total ezetimib). En 104-ukers diettkarsinogenitetsstudie med ezetimib ble også utført på mus i doser på opptil 500 mg/kg/dag (> 150 ganger human eksponering ved 10 mg daglig basert på AUC0-24 timer for total ezetimib). Det var ingen statistisk signifikant økning i tumorforekomst hos medikamentbehandlede rotter eller mus.
Ingen tegn på mutagenitet ble observert in vitro i en mikrobiell mutagenitetstest (Ames) med Salmonella typhimurium og Escherichia coli med eller uten metabolsk aktivering. Ingen tegn på klastogenisitet ble observert in vitro i en kromosomavviksanalyse i humane perifere blodlymfocytter med eller uten metabolsk aktivering. I tillegg var det ingen tegn på genotoksisitet i in vivo musemikronukleustesten.
orale (gavage) fertilitetsstudier av ezetimib utført på rotter, var det ingen tegn på reproduksjonstoksisitet ved doser opp til 1000 mg/kg/dag hos hann- eller hunnrotter (~7 x den menneskelige eksponeringen ved 10 mg daglig basert på AUC0- 24 timer for total ezetimib).
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori C
Det er ingen tilstrekkelige og godt kontrollerte studier av ezetimib hos gravide kvinner. Ezetimib bør kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør risikoen for fosteret.
orale (gavage) embryo-føtale utviklingsstudier av ezetimib utført på rotter og kaniner under organogenese, var det ingen tegn på embryoletale effekter ved de testede dosene (250, 500, 1000 mg/kg/dag). Hos rotter ble det observert økt forekomst av vanlige føtale skjelettfunn (ekstra par thoraxribb, uskadet cervical vertebral centra, forkortede ribben) ved 1000 mg/kg/dag (~10 x den menneskelige eksponeringen ved 10 mg daglig basert på AUC0-24 timer for total ezetimib). Hos kaniner behandlet med ezetimibe ble det observert en økt forekomst av ekstra thorax ribben ved 1000 mg/kg/dag (150 x den menneskelige eksponeringen ved 10 mg daglig basert på AUC0-24 timer for total ezetimib). Ezetimib krysset placenta når gravide rotter og kaniner ble gitt flere orale doser.
Flerdosestudier av ezetimib gitt i kombinasjon med statiner hos rotter og kaniner under organogenese resulterer i høyere eksponering for ezetimib og statiner. Reproduktive funn forekommer ved lavere doser i kombinasjonsterapi sammenlignet med monoterapi.
Alle statiner er kontraindisert hos gravide og ammende kvinner. Når ZETIA 10 mg administreres med et statin til en kvinne i fertil alder, se graviditetskategorien og produktmerkingen for statinet. [Se KONTRAINDIKASJONER]
Ammende mødre
Det er ikke kjent om ezetimib utskilles i morsmelk hos mennesker. I rottestudier var eksponering for total ezetimibe hos ammende unger opptil halvparten av det som ble observert i mors plasma. Fordi mange legemidler skilles ut i morsmelk, bør det utvises forsiktighet når ZETIA 10 mg gis til en ammende kvinne. ZETIA skal ikke brukes til ammende mødre med mindre den potensielle fordelen rettferdiggjør den potensielle risikoen for spedbarnet.
Pediatrisk bruk
Effekten av ZETIA samtidig administrert med simvastatin (n=126) sammenlignet med simvastatin monoterapi (n=122) har blitt evaluert hos unge gutter og jenter med heterozygot familiær hyperkolesterolemi (HeFH). I en multisenter, dobbeltblind, kontrollert studie fulgt av en åpen fase, 142 gutter og 106 postmenarkale jenter, 10 til 17 år (gjennomsnittsalder 14,2 år, 43 % kvinner, 82 % kaukasiere, 4 % asiatiske, 2 % svarte , 13 % multi-rase) med HeFH ble randomisert til å motta enten ZETIA 10 mg samtidig administrert med simvastatin eller simvastatin monoterapi. Inkludering i studien krevde 1) et baseline LDL-C-nivå mellom 160 og 400 mg/dL og 2) en medisinsk historie og klinisk presentasjon i samsvar med HeFH. Gjennomsnittlig baseline LDL-C-verdi var 225 mg/dL (område: 161-351 mg/dL) i ZETIA 10 mg samtidig administrert med simvastatin-gruppen sammenlignet med 219 mg/dL (område: 149-336 mg/dL) i simvastatin monoterapi gruppe. Pasientene fikk samtidig ZETIA og simvastatin (10 mg, 20 mg eller 40 mg) eller simvastatin monoterapi (10 mg, 20 mg eller 40 mg) i 6 uker, samtidig administrert ZETIA og 40 mg simvastatin eller 40 mg simvastatin monoterapi for de neste 27 ukene, og åpen samtidig administrert ZETIA og simvastatin (10 mg, 20 mg eller 40 mg) i 20 uker deretter.
Resultatene av studien ved uke 6 er oppsummert i tabell 3. Resultatene ved uke 33 var konsistente med de ved uke 6.
TABELL 3: Gjennomsnittlig prosentforskjell ved uke 6 mellom den samlede ZETIA 10 mg administrert sammen med Simvastatin-gruppen og den sammenslåtte Simvastatin-monoterapigruppen hos ungdomspasienter med heterozygot familiær hyperkolesterolemi
Fra starten av studien til slutten av uke 33 forekom seponeringer på grunn av en bivirkning hos 7 (6 %) pasienter i ZETIA-gruppen som ble administrert samtidig med simvastatin-gruppen og hos 2 (2 %) pasienter i monoterapigruppen med simvastatin.
Under studien forekom hepatiske transaminaseforhøyelser (to påfølgende målinger for ALAT og/eller ASAT ≥3 x ULN) hos fire (3 %) individer i ZETIA 10 mg administrert samtidig med simvastatin-gruppen og hos to (2 %) individer i simvastatin monoterapi gruppe. Forhøyelser av CPK (≥10 x ULN) forekom hos to (2 %) individer i ZETIA-gruppen som ble administrert samtidig med simvastatin-gruppen og hos null individer i simvastatin-monoterapigruppen.
I denne begrensede kontrollerte studien var det ingen signifikant effekt på vekst eller kjønnsmodning hos unge gutter eller jenter, eller på menstruasjonssykluslengden hos jenter.
Samtidig administrering av ZETIA 10 mg og simvastatin i doser større enn 40 mg/dag er ikke studert hos ungdom. ZETIA 10mg har heller ikke blitt studert hos pasienter yngre enn 10 år eller hos premenarkalske jenter.
Basert på total ezetimib (ezetimib + ezetimib-glukuronid), er det ingen farmakokinetiske forskjeller mellom ungdom og voksne. Farmakokinetiske data for pediatrisk populasjon
Geriatrisk bruk
Monoterapistudier
Av de 2396 pasientene som fikk ZETIA 10 mg i kliniske studier, var 669 (28 %) 65 år og eldre, og 111 (5 %) var 75 år eller eldre.
Studier av samtidig administrering av statiner
Av de 11 308 pasientene som fikk ZETIA + statin i kliniske studier, var 3587 (32 %) 65 år og eldre, og 924 (8 %) var 75 år eller eldre.
Ingen generelle forskjeller i sikkerhet og effektivitet ble observert mellom disse pasientene og yngre pasienter, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos noen eldre individer kan ikke utelukkes [se KLINISK FARMAKOLOGI ].

Nedsatt nyrefunksjon
Når det brukes som monoterapi, er det ikke nødvendig med dosejustering av ZETIA 10 mg.
studien av hjerte- og nyrebeskyttelse (SHARP)-studien med 9270 pasienter med moderat til alvorlig nedsatt nyrefunksjon (6247 pasienter uten dialyse med median serumkreatinin 2,5 mg/dL og median estimert glomerulær filtrasjonshastighet 25,6 ml/min/1,73 m², og 3023 dialysepasienter), forekomsten av alvorlige bivirkninger, bivirkninger som førte til seponering av studiebehandlingen eller bivirkninger av spesiell interesse (muskuloskeletale bivirkninger, leverenzymavvik, krefttilfelle) var lik mellom pasienter som noen gang ble tildelt ezetimib 10 mg pluss simvastatin 20 mg (n=4650) eller placebo (n=4620) under en median oppfølging på 4,9 år. Men fordi nedsatt nyrefunksjon er en risikofaktor for statinassosiert myopati, bør doser av simvastatin over 20 mg brukes med forsiktighet og nøye overvåking når det administreres samtidig med ZETIA hos pasienter med moderat til alvorlig nedsatt nyrefunksjon.
Nedsatt leverfunksjon
ZETIA anbefales ikke til pasienter med moderat til alvorlig nedsatt leverfunksjon [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
ZETIA 10 mg gitt samtidig med et statin er kontraindisert hos pasienter med aktiv leversykdom eller uforklarlige vedvarende økninger i levertransaminasenivåer [se KONTRAINDIKASJONER ; ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
OVERDOSE
I kliniske studier, administrering av ezetimibe, 50 mg/dag til 15 friske personer i opptil 14 dager, 40 mg/dag til 18 pasienter med primær hyperlipidemi i opptil 56 dager, og 40 mg/dag til 27 pasienter med homozygot sitosterolemi for 26 uker ble generelt godt tolerert. En kvinnelig pasient med homozygot sitosterolemi tok en utilsiktet overdose av ezetimib 120 mg/dag i 28 dager uten rapporterte kliniske eller laboratoriemessige bivirkninger.
Ved overdose bør symptomatiske og støttende tiltak brukes.
KONTRAINDIKASJONER
ZETIA er kontraindisert under følgende forhold:
- . Kombinasjonen av ZETIA 10 mg med et statin er kontraindisert hos pasienter med aktiv leversykdom eller uforklarlige vedvarende økninger i hepatiske transaminasenivåer. . Kvinner som er gravide eller kan bli gravide. Fordi statiner reduserer kolesterolsyntesen og muligens syntesen av andre biologisk aktive stoffer avledet fra kolesterol, kan ZETIA i kombinasjon med et statin forårsake fosterskader når det administreres til gravide kvinner. I tillegg er det ingen åpenbar fordel med terapi under graviditet, og sikkerheten hos gravide kvinner er ikke fastslått. Hvis pasienten blir gravid mens han tar dette legemidlet, bør pasienten informeres om den potensielle faren for fosteret og mangelen på kjent klinisk fordel ved fortsatt bruk under graviditet. [Se Bruk i spesifikke populasjoner ] . Ammende mødre. Fordi statiner kan gå over i morsmelk, og fordi statiner har potensial til å forårsake alvorlige bivirkninger hos ammende spedbarn, bør kvinner som trenger ZETIA-behandling i kombinasjon med et statin rådes til ikke å amme sine spedbarn [se Bruk i spesifikke populasjoner ]. . Pasienter med kjent overfølsomhet overfor noen komponent i dette produktet. Overfølsomhetsreaksjoner inkludert anafylaksi, angioødem, utslett og urticaria er rapportert med ZETIA [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Ezetimib reduserer kolesterol i blodet ved å hemme absorpsjonen av kolesterol i tynntarmen. I en 2-ukers klinisk studie med 18 hyperkolesterolemiske pasienter, hemmet ZETIA 10 mg intestinal kolesterolabsorpsjon med 54 % sammenlignet med placebo. ZETIA hadde ingen klinisk betydningsfull effekt på plasmakonsentrasjonene av de fettløselige vitaminene A, D og E (i en studie med 113 pasienter), og svekket ikke produksjonen av binyrebarksteroidhormon (i en studie med 118 pasienter).
Kolesterolinnholdet i leveren kommer hovedsakelig fra tre kilder. Leveren kan syntetisere kolesterol, ta opp kolesterol fra blodet fra sirkulerende lipoproteiner, eller ta opp kolesterol absorbert av tynntarmen. Intestinalt kolesterol er avledet primært fra kolesterol som skilles ut i gallen og fra diettkolesterol.
Ezetimib har en virkningsmekanisme som skiller seg fra andre klasser av kolesterolsenkende forbindelser (statiner, gallesyrebindere [harpikser], fibrinsyrederivater og plantestanoler). Det molekylære målet for ezetimib har vist seg å være steroltransportøren, Niemann-Pick C1-Like 1 (NPC1L1), som er involvert i tarmens opptak av kolesterol og fytosteroler.
Ezetimib hemmer ikke kolesterolsyntesen i leveren eller øker utskillelsen av gallesyre. I stedet lokaliserer ezetimib seg ved børstekanten av tynntarmen og hemmer absorpsjonen av kolesterol, noe som fører til en reduksjon i tilførselen av intestinalt kolesterol til leveren. Dette forårsaker en reduksjon av hepatiske kolesterollagre og en økning i clearance av kolesterol fra blodet; denne distinkte mekanismen er komplementær til den til statiner og fenofibrat [se Kliniske studier ].
Farmakodynamikk
Kliniske studier har vist at forhøyede nivåer av total-C, LDL-C og Apo B, hovedproteinbestanddelen i LDL, fremmer aterosklerose hos mennesker. I tillegg er reduserte nivåer av HDL-C assosiert med utvikling av aterosklerose. Epidemiologiske studier har fastslått at kardiovaskulær morbiditet og dødelighet varierer direkte med nivået av total-C og LDL-C og omvendt med nivået av HDL-C. I likhet med LDL kan kolesterolanrikede triglyseridrike lipoproteiner, inkludert lipoproteiner med svært lav tetthet (VLDL), lipoproteiner med middels tetthet (IDL) og rester, også fremme åreforkalkning. Den uavhengige effekten av å øke HDL-C eller senke TG på risikoen for koronar og kardiovaskulær morbiditet og dødelighet er ikke fastslått.
ZETIA reduserer total-C, LDL-C, Apo B, non-HDL-C og TG, og øker HDL-C hos pasienter med hyperlipidemi. Administrering av ZETIA 10 mg med et statin er effektivt for å forbedre serum total-C, LDL-C, Apo B, non-HDL-C, TG og HDL-C utover hver behandling alene. Administrering av ZETIA 10 mg med fenofibrat er effektiv for å forbedre serum total-C, LDL-C, Apo B og ikke-HDL-C hos pasienter med blandet hyperlipidemi sammenlignet med begge behandlingene alene. Effekten av ezetimib gitt enten alene eller i tillegg til et statin eller fenofibrat på kardiovaskulær morbiditet og mortalitet er ikke fastslått.
Farmakokinetikk
Absorpsjon
Etter oral administrering absorberes ezetimib og konjugeres i stor grad til et farmakologisk aktivt fenolisk glukuronid (ezetimib-glukuronid). Etter en enkelt dose på 10 mg ZETIA 10 mg til fastende voksne, ble gjennomsnittlig maksimal plasmakonsentrasjon av ezetimib (Cmax) på 3,4 til 5,5 ng/ml oppnådd innen 4 til 12 timer (Tmax ). Gjennomsnittlige Cmax-verdier for ezetimib-glukuronid på 45 til 71 ng/ml ble oppnådd mellom 1 og 2 timer (Tmax). Det var ingen vesentlig avvik fra doseproporsjonalitet mellom 5 og 20 mg. Den absolutte biotilgjengeligheten av ezetimib kan ikke bestemmes, da forbindelsen er praktisk talt uløselig i vandige medier egnet for injeksjon.
Effekt av mat på oral absorpsjon
Samtidig administrasjon av mat (fettrike eller fettfrie måltider) hadde ingen effekt på graden av absorpsjon av ezetimib når det ble administrert som ZETIA 10 mg tabletter. C-verdien av ezetimib ble økt med 38 % ved inntak av fettrike måltider. ZETIA kan administreres med eller uten mat.
Fordeling
Ezetimib og ezetimib-glukuronid er sterkt bundet (> 90 %) til humane plasmaproteiner.
Metabolisme og utskillelse
Ezetimib metaboliseres primært i tynntarmen og leveren via glukuronidkonjugering (en fase II-reaksjon) med påfølgende galle- og nyreutskillelse. Minimal oksidativ metabolisme (en fase I-reaksjon) er observert hos alle evaluerte arter.
Hos mennesker metaboliseres ezetimib raskt til ezetimib-glukuronid. Ezetimib og ezetimibeglukuronid er de viktigste legemiddelavledede forbindelsene som påvises i plasma, og utgjør henholdsvis ca. 10 til 20 % og 80 til 90 % av det totale legemidlet i plasma. Både ezetimib og ezetimibeglukuronid elimineres fra plasma med en halveringstid på ca. 22 timer for både ezetimib og ezetimibeglukuronid. Plasmakonsentrasjon-tidsprofiler viser flere topper, noe som tyder på enterohepatisk resirkulering.
Etter oral administrering av 14C-ezetimib (20 mg) til mennesker, utgjorde total ezetimib (ezetimib + ezetimib-glukuronid) omtrent 93 % av den totale radioaktiviteten i plasma. Etter 48 timer var det ingen påvisbare nivåer av radioaktivitet i plasmaet.
Omtrent 78 % og 11 % av den administrerte radioaktiviteten ble gjenfunnet i henholdsvis avføring og urin over en 10-dagers oppsamlingsperiode. Ezetimib var hovedkomponenten i feces og utgjorde 69 % av den administrerte dosen, mens ezetimib-glukuronid var hovedkomponenten i urinen og utgjorde 9 % av den administrerte dosen.
Spesifikke populasjoner
Geriatriske pasienter: I en flerdosestudie med ezetimib gitt 10 mg én gang daglig i 10 dager, var plasmakonsentrasjonen for total ezetimib omtrent 2 ganger høyere hos eldre (≥65 år) friske forsøkspersoner sammenlignet med yngre forsøkspersoner.
Pediatriske pasienter: [Se Bruk i spesifikke populasjoner ]
Kjønn: en flerdosestudie med ezetimib gitt 10 mg én gang daglig i 10 dager, var plasmakonsentrasjonen for total ezetimib litt høyere (
Løp: Basert på en metaanalyse av farmakokinetiske studier med flere doser, var det ingen farmakokinetiske forskjeller mellom svarte og kaukasiske personer. Studier på asiatiske personer indikerte at farmakokinetikken til ezetimib var lik den som ble sett hos kaukasiske personer.
Nedsatt leverfunksjon: Etter en enkeltdose på 10 mg ezetimib ble gjennomsnittlig AUC for total ezetimib økt med ca. 1,7 ganger hos pasienter med lett nedsatt leverfunksjon (Child-Pugh score 5 til 6), sammenlignet med friske personer. Gjennomsnittlige AUC-verdier for total ezetimib og ezetimib ble økt henholdsvis ca. 3-4 ganger og 5-6 ganger hos pasienter med moderat (Child-Pugh-skåre 7 til 9) eller alvorlig nedsatt leverfunksjon (Child-Pugh-score 10 til 15). I en 14-dagers flerdosestudie (10 mg daglig) hos pasienter med moderat nedsatt leverfunksjon, ble gjennomsnittlige AUC-verdier for total ezetimib og ezetimibe økt ca. 4 ganger på dag 1 og dag 14 sammenlignet med friske personer. På grunn av de ukjente effektene av økt eksponering for ezetimib hos pasienter med moderat eller alvorlig nedsatt leverfunksjon, anbefales ikke ZETIA til disse pasientene [se ADVARSLER OG FORHOLDSREGLER ].
Nedsatt nyrefunksjon: Etter en enkeltdose på 10 mg ezetimib hos pasienter med alvorlig nyresykdom (n=8; gjennomsnittlig CrCl ≥ 30 ml/min/1,73 m²), ble gjennomsnittlige AUC-verdier for total ezetimib, ezetimib-glukuronid og ezetimib økt med ca. 1,5 -fold, sammenlignet med friske forsøkspersoner (n=9).
Narkotikahandel
[Se også NARKOTIKAHANDEL ]
ZETIA 10 mg hadde ingen signifikant effekt på en serie probemedisiner (koffein, dekstrometorfan, tolbutamid og IV midazolam) kjent for å bli metabolisert av cytokrom P450 (1A2, 2D6, 2C8/9 og 3A4) i en "cocktail"-studie av tolv friske voksne menn. Dette indikerer at ezetimib verken er en hemmer eller induktor av disse cytokrom P450 isozymene, og det er usannsynlig at ezetimib vil påvirke metabolismen av legemidler som metaboliseres av disse enzymene.
TABELL 4: Effekt av samtidig administrerte legemidler på totalt ezetimibe
TABELL 5: Effekt av samtidig administrering av ezetimib på systemisk eksponering for andre legemidler
Dyretoksikologi og/eller farmakologi
Den hypokolesterolemiske effekten av ezetimib ble evaluert i kolesterolfôrede Rhesus-aper, hunder, rotter og musemodeller av human kolesterolmetabolisme. Ezetimib ble funnet å ha en ED50-verdi på 0,5 μg/kg/dag for å hemme økningen i plasmakolesterolnivåer hos aper. ED50-verdiene hos hunder, rotter og mus var henholdsvis 7, 30 og 700 μg/kg/dag. Disse resultatene stemmer overens med at ZETIA er en potent kolesterolabsorpsjonshemmer.
I en rottemodell, hvor glukuronidmetabolitten til ezetimib (SCH 60663) ble administrert intraduodenalt, var metabolitten like potent som moderforbindelsen (SCH 58235) når det gjaldt å hemme absorpsjonen av kolesterol, noe som tyder på at glukuronidmetabolitten hadde en aktivitet som ligner på den opprinnelige. legemiddel.
1-måneders studier på hunder som ble gitt ezetimib (0,03 til 300 mg/kg/dag), økte konsentrasjonen av kolesterol i galleblæren ~2- til 4 ganger. En dose på 300 mg/kg/dag administrert til hunder i ett år resulterte imidlertid ikke i dannelse av gallestein eller andre uønskede lever- og galleeffekter. I en 14-dagers studie på mus som ble gitt ezetimib (0,3 til 5 mg/kg/dag) og matet med et fettfattig eller kolesterolrikt kosthold, var konsentrasjonen av kolesterol i galleblærens galle enten upåvirket eller redusert til normale nivåer.
En serie akutte prekliniske studier ble utført for å bestemme selektiviteten til ZETIA for å hemme kolesterolabsorpsjon. Ezetimib hemmet absorpsjonen av 14C-kolesterol uten effekt på absorpsjonen av triglyserider, fettsyrer, gallesyrer, progesteron, etinyløstradiol eller de fettløselige vitaminene A og D.
4- til 12-ukers toksisitetsstudier på mus induserte ikke ezetimib cytokrom P450 legemiddelmetaboliserende enzymer. I toksisitetsstudier ble det sett en farmakokinetisk interaksjon mellom ezetimib og statiner (foreldre eller deres aktive hydroksysyremetabolitter) hos rotter, hunder og kaniner.
Kliniske studier
Primær hyperlipidemi
ZETIA 10mg reduserer total-C, LDL-C, Apo B, non-HDL-C og TG, og øker HDL-C hos pasienter med hyperlipidemi. Maksimal til nesten maksimal respons oppnås vanligvis innen 2 uker og opprettholdes under kronisk behandling.
Monoterapi
I to multisenter, dobbeltblinde, placebokontrollerte, 12-ukers studier på 1719 pasienter med primær hyperlipidemi, reduserte ZETIA total-C, LDL-C, Apo B, ikke-HDL-C og TG signifikant, og økte HDL- C sammenlignet med placebo (se tabell 6). Reduksjon i LDL-C var konsistent på tvers av alder, kjønn og baseline LDL-C.
TABELL 6: Respons på ZETIA 10 mg hos pasienter med primær hyperlipidemi (gjennomsnittlig % endring fra ubehandlet baseline†)
Kombinasjon med statiner
ZETIA 10mg lagt til pågående statinterapi
I en multisenter, dobbeltblind, placebokontrollert, 8-ukers studie, 769 pasienter med primær hyperlipidemi, kjent koronar hjertesykdom eller flere kardiovaskulære risikofaktorer som allerede fikk statin monoterapi, men som ikke hadde nådd sitt NCEP ATP II-mål LDL -C-målet ble randomisert til å motta enten ZETIA 10 mg eller placebo i tillegg til det pågående statinet.
ZETIA 10 mg, lagt til pågående statinbehandling, reduserte total-C, LDL-C, Apo B, ikke-HDL-C og TG signifikant, og økte HDL-C sammenlignet med et statin administrert alene (se tabell 7). LDL-C-reduksjoner indusert av ZETIA 10 mg var generelt konsistente på tvers av alle statiner.
TABELL 7: Respons på tillegg av ZETIA 10 mg til pågående statinterapi hos pasienter med hyperlipidemi (gjennomsnittlig % endring fra behandlet baseline‡)
ZETIA initiert samtidig med et statin
fire multisenter, dobbeltblinde, placebokontrollerte, 12-ukers studier, hos 2382 hyperlipidemiske pasienter, ble ZETIA eller placebo administrert alene eller med ulike doser av atorvastatin, simvastatin, pravastatin eller lovastatin.
Når alle pasienter som fikk ZETIA med et statin ble sammenlignet med alle de som fikk det tilsvarende statinet alene, reduserte ZETIA 10 mg total-C, LDL-C, Apo B, ikke-HDL-C og TG, og med unntak av pravastatin , økt HDL-C sammenlignet med statin administrert alene. LDL-C-reduksjoner indusert av ZETIA 10 mg var generelt konsistente på tvers av alle statiner. (Se fotnote, tabell 8 til 11.)
TABELL 8: Respons på ZETIA 10 mg og Atorvastatin initiert samtidig hos pasienter med primær hyperlipidemi (gjennomsnittlig % endring fra ubehandlet baseline†)
TABELL 9: Respons på ZETIA 10 mg og simvastatin initiert samtidig hos pasienter med primær hyperlipidemi (gjennomsnittlig % endring fra ubehandlet baseline†)
TABELL 10: Respons på ZETIA og Pravastatin initiert samtidig hos pasienter med primær hyperlipidemi (gjennomsnittlig % endring fra ubehandlet baseline†)
TABELL 11: Respons på ZETIA og Lovastatin initiert samtidig hos pasienter med primær hyperlipidemi (gjennomsnittlig % endring fra ubehandlet baseline†)
Kombinasjon med fenofibrat
I en multisenter, dobbeltblind, placebokontrollert, klinisk studie med pasienter med blandet hyperlipidemi ble 625 pasienter behandlet i opptil 12 uker og 576 i opptil 48 uker i tillegg. Pasientene ble randomisert til å få placebo, ZETIA alene, 160 mg fenofibrat alene eller ZETIA 10 mg og 160 mg fenofibrat i den 12-ukers studien. Etter å ha fullført den 12-ukers studien, ble kvalifiserte pasienter tildelt ZETIA samtidig administrert med fenofibrat eller fenofibrat monoterapi i ytterligere 48 uker.
ZETIA 10 mg samtidig administrert med fenofibrat reduserte total-C, LDL-C, Apo B og ikke-HDL-C signifikant sammenlignet med fenofibrat administrert alene. Den prosentvise reduksjonen i TG og den prosentvise økningen i HDLC for ZETIA samtidig administrert med fenofibrat var sammenlignbare med de for fenofibrat administrert alene (se tabell 12).
TABELL 12: Respons på ZETIA 10 mg og fenofibrat initiert samtidig hos pasienter med blandet hyperlipidemi (gjennomsnittlig % endring fra ubehandlet baseline† ved 12 uker†)
Endringene i lipid-endepunktene etter ytterligere 48 ukers behandling med ZETIA samtidig administrert med fenofibrat eller med fenofibrat alene var i samsvar med 12-ukers dataene vist ovenfor.
Homozygot familiær hyperkolesterolemi (HoFH)
En studie ble utført for å vurdere effekten av ZETIA i behandlingen av HoFH. Denne dobbeltblinde, randomiserte, 12-ukers studien inkluderte 50 pasienter med en klinisk og/eller genotypisk diagnose av HoFH, med eller uten samtidig LDL-aferese, som allerede fikk atorvastatin eller simvastatin (40 mg). Pasientene ble randomisert til en av tre behandlingsgrupper, atorvastatin eller simvastatin (80 mg), ZETIA 10 mg administrert med atorvastatin eller simvastatin (40 mg), eller ZETIA administrert med atorvastatin eller simvastatin (80 mg). På grunn av redusert biotilgjengelighet av ezetimib hos pasienter som samtidig får kolestyramin [se NARKOTIKAHANDEL ], ble ezetimib dosert minst 4 timer før eller etter administrering av harpiks. Gjennomsnittlig baseline LDL-C var 341 mg/dL hos de pasientene som ble randomisert til atorvastatin 80 mg eller simvastatin 80 mg alene og 316 mg/dL i gruppen randomisert til ZETIA 10 mg pluss atorvastatin 40 eller 80 mg eller simvastatin 40 eller 80 mg. ZETIA 10 mg, administrert med atorvastatin eller simvastatin (40- og 80-mg statingrupper, samlet), reduserte LDL-C signifikant (21 %) sammenlignet med å øke dosen av simvastatin eller atorvastatin monoterapi fra 40 til 80 mg (7 %). Hos de som ble behandlet med ZETIA 10 mg pluss 80 mg atorvastatin eller med ZETIA 10 mg pluss 80 mg simvastatin, ble LDL-C redusert med 27 %.
Homozygot sitosterolemi (fytosterolemi)
En studie ble utført for å vurdere effekten av ZETIA ved behandling av homozygot sitosterolemi. I denne multisenter, dobbeltblinde, placebokontrollerte, 8-ukers studien, 37 pasienter med homozygot sitosterolemi med forhøyede plasma sitosterolnivåer (> 5 mg/dL) på sitt nåværende terapeutiske regime (diett, gallesyrebindende harpikser, statiner, ileal bypass-operasjon og/eller LDL-aferese), ble randomisert til å motta ZETIA (n=30) eller placebo (n=7). På grunn av redusert biotilgjengelighet av ezetimib hos pasienter som samtidig får kolestyramin [se NARKOTIKAHANDEL ], ble ezetimib dosert minst 2 timer før eller 4 timer etter at harpikser ble administrert. Med unntak av den ene personen som fikk LDL-aferese, reduserte ZETIA signifikant plasmasitosterol og campesterol med henholdsvis 21 % og 24 % fra baseline. Derimot hadde pasienter som fikk placebo økninger i sitosterol og campesterol på henholdsvis 4 % og 3 % fra baseline. For pasienter behandlet med ZETIA 10 mg ble gjennomsnittlige plasmanivåer av plantesteroler redusert gradvis i løpet av studien. Effekten av å redusere plasma sitosterol og campesterol på å redusere risikoen for kardiovaskulær morbiditet og dødelighet er ikke fastslått.
Reduksjoner i sitosterol og campesterol var konsistente mellom pasienter som tok ZETIA 10 mg samtidig med gallesyrebindende midler (n=8) og pasienter som ikke fikk samtidig behandling med gallesyrebindende midler (n=21).
Bruksbegrensninger
Effekten av ZETIA 10 mg på kardiovaskulær morbiditet og dødelighet er ikke fastslått.
PASIENTINFORMASJON
ZETIA® (ezetimib) Tabletter
Pasientinformasjon om ZETIA (zet´-ea)
Generisk navn: ezetimibe (e-zet´-e-mib)
Les denne informasjonen nøye før du begynner å ta ZETIA® og hver gang du får i deg mer ZETIA. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med legen din om din medisinske tilstand eller din behandling. Spør legen din hvis du har spørsmål om ZETIA. Bare legen din kan avgjøre om ZETIA er riktig for deg.
Hva er ZETIA?
ZETIA er et legemiddel som brukes til å senke nivåene av totalkolesterol og LDL (dårlig) kolesterol i blodet. ZETIA er for pasienter som ikke kan kontrollere kolesterolnivået ved diett og trening alene. Det kan brukes alene eller sammen med andre medisiner for å behandle høyt kolesterol. Du bør holde deg på en kolesterolsenkende diett mens du tar denne medisinen.
ZETIA arbeider for å redusere mengden kolesterol som kroppen din absorberer. ZETIA 10mg hjelper deg ikke å gå ned i vekt. ZETIA 10mg har ikke vist seg å forhindre hjertesykdom eller hjerteinfarkt.
For mer informasjon om kolesterol, se "Hva bør jeg vite om høyt kolesterol?" avsnittet som følger.
Hvem bør ikke ta ZETIA 10mg?
- . Ikke ta ZETIA 10 mg hvis du er allergisk mot ezetimib, den aktive ingrediensen i ZETIA, eller mot de inaktive ingrediensene. For en liste over inaktive ingredienser, se delen "Inaktive ingredienser" som følger. . Hvis du har aktiv leversykdom, ikke ta ZETIA 10 mg mens du tar kolesterolsenkende medisiner kalt statiner. . Hvis du er gravid eller ammer, ikke ta ZETIA mens du tar et statin. . Hvis du er en kvinne i fertil alder, bør du bruke en effektiv prevensjonsmetode for å forhindre graviditet mens du bruker ZETIA i tillegg til statinbehandling.
ZETIA har ikke blitt undersøkt hos barn under 10 år.
Hva bør jeg fortelle legen min før og mens jeg tar ZETIA 10mg?
Fortell legen din om eventuelle reseptbelagte og reseptfrie medisiner du tar eller planlegger å ta, inkludert naturlige eller urtemedisiner.
Fortell legen din om alle dine medisinske tilstander, inkludert allergier.
Fortell legen din dersom du:
- . noen gang hatt leverproblemer. ZETIA 10mg er kanskje ikke riktig for deg. . er gravid eller planlegger å bli gravid. Legen din vil diskutere med deg om ZETIA 10mg er riktig for deg. . ammer. Vi vet ikke om ZETIA 10 mg kan overføres til babyen din gjennom melken din. Legen din vil diskutere med deg om ZETIA 10mg er riktig for deg. . oppleve uforklarlige muskelsmerter, ømhet eller svakhet.
Hvordan skal jeg ta ZETIA 10mg?
- . Ta ZETIA én gang daglig, med eller uten mat. Det kan være lettere å huske å ta dosen hvis du gjør den til samme tid hver dag, for eksempel med frokost, middag eller ved sengetid. Hvis du også tar et annet legemiddel for å redusere kolesterolet ditt, spør legen din om du kan ta dem samtidig. . Hvis du glemmer å ta ZETIA, ta det så snart du husker det. Ta imidlertid ikke mer enn én dose ZETIA om dagen. . Fortsett å følge en kolesterolsenkende diett mens du tar ZETIA. Spør legen din hvis du trenger diettinformasjon. . Fortsett å ta ZETIA 10 mg med mindre legen din ber deg slutte. Det er viktig at du fortsetter å ta ZETIA 10 mg selv om du ikke føler deg kvalm. . Se legen din regelmessig for å sjekke kolesterolnivået ditt og for å se etter bivirkninger. Legen din kan ta blodprøver for å sjekke leveren din før du begynner å ta ZETIA med et statin og under behandlingen.
Hva er de mulige bivirkningene av ZETIA?
kliniske studier rapporterte pasienter få bivirkninger mens de tok ZETIA. Disse inkluderte diaré, leddsmerter og trøtthetsfølelse.
Pasienter har opplevd alvorlige muskelproblemer mens de tok ZETIA 10 mg, vanligvis når ZETIA 10 mg ble lagt til et statinlegemiddel. Hvis du opplever uforklarlige muskelsmerter, ømhet eller svakhet mens du tar ZETIA, kontakt legen din umiddelbart. Du må gjøre dette umiddelbart, for i sjeldne tilfeller kan disse muskelproblemene være alvorlige, med muskelnedbrytning som resulterer i nyreskade.
tillegg er følgende bivirkninger rapportert ved generell bruk: allergiske reaksjoner (som kan kreve behandling med en gang) inkludert hevelse i ansikt, lepper, tunge og/eller svelg som kan forårsake problemer med å puste eller svelge, utslett og elveblest ; hevet rødt utslett, noen ganger med målformede lesjoner; leddsmerter; muskelsmerter; endringer i noen laboratorieblodprøver; leverproblemer; magesmerter; betennelse i bukspyttkjertelen; kvalme; svimmelhet; kriblende følelse; depresjon; hodepine; gallestein; betennelse i galleblæren.
Fortell legen din dersom du har disse eller andre medisinske problemer mens du bruker ZETIA. Spør legen din eller apoteket for en fullstendig liste over bivirkninger.
Hva bør jeg vite om høyt kolesterol?
Kolesterol er en type fett som finnes i blodet ditt. Totalkolesterolet ditt består av LDL- og HDL-kolesterol.
LDL-kolesterol kalles "dårlig" kolesterol fordi det kan bygge seg opp i veggen av arteriene dine og danne plakk. Over tid kan plakkoppbygging forårsake en innsnevring av arteriene. Denne innsnevringen kan bremse eller blokkere blodstrømmen til hjertet, hjernen og andre organer. Høyt LDL-kolesterol er en viktig årsak til hjertesykdom og en av årsakene til hjerneslag.
HDL-kolesterol kalles "godt" kolesterol fordi det hindrer det dårlige kolesterolet i å bygge seg opp i arteriene.
Triglyserider er også fett som finnes i blodet ditt.
Generell informasjon om ZETIA
Medisiner er noen ganger foreskrevet for tilstander som ikke er nevnt i pasientopplysninger. Ikke bruk ZETIA 10 mg for en tilstand det ikke er foreskrevet for. Ikke gi ZETIA til andre mennesker, selv om de har samme tilstand som du har. Det kan skade dem.
Dette oppsummerer den viktigste informasjonen om ZETIA. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre apoteket eller legen om informasjon om ZETIA 10mg som er skrevet for helsepersonell.
Inaktive ingredienser:
Kroskarmellosenatrium, laktosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose, povidon og natriumlaurylsulfat.
