Lopid 300mg Gemfibrozil Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Lopid 300mg og hvordan brukes det?
Lopid (gemfibrozil) er et lipidregulerende middel som brukes til å behandle svært høye kolesterol- og triglyseridnivåer hos personer med pankreatitt, og brukes også til å redusere risikoen for hjerneslag, hjerteinfarkt eller andre hjertekomplikasjoner hos personer med høyt kolesterol og triglyserider som har ikke blitt hjulpet av andre behandlinger. Lopid er tilgjengelig i generisk form.
Hva er bivirkningene av Lopid 300mg?
Vanlige bivirkninger av Lopid 300mg inkluderer:
- . urolig mage, . mage/magesmerter, . kvalme, . oppkast, . diaré, . hodepine, . svimmelhet, . døsighet, . ledd- eller muskelsmerter, . tap av interesse for sex, . maktesløshet, . problemer med å få orgasme, . nummenhet eller prikkende følelse, . uvanlig smak, eller . forkjølelsessymptomer som tett nese, nysing, sår hals.
Lopid 300mg kan sjelden forårsake gallestein og leverproblemer.
Fortell legen din dersom du merker noen av følgende usannsynlige, men alvorlige bivirkninger av Lopid 300mg, inkludert:
- . sterke mage/magesmerter, . vedvarende kvalme eller oppkast, . gulne øyne eller hud, og . mørk urin.
BESKRIVELSE
LOPID® (gemfibrozil tabletter, USP) er et lipidregulerende middel. Det er tilgjengelig som tabletter for oral administrering. Hver tablett inneholder 600 mg gemfibrozil. Hver tablett inneholder også kalsiumstearat, NF; candelilla voks, FCC; mikrokrystallinsk cellulose, NF; hydroksypropylcellulose, NF; hypromellose, USP; metylparaben, NF; Opaspray hvit; polyetylenglykol, NF; polysorbat 80, NF; propylparaben, NF; kolloidalt silisiumdioksid, NF; pregelatinisert stivelse, NF. Det kjemiske navnet er 5-(2,5-dimetylfenoksy)-2,2-dimetylpentansyre, med følgende strukturformel:
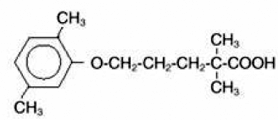
Den empiriske formelen er C15H22O3 og molekylvekten er 250,35; løseligheten i vann og syre er 0,0019 % og i fortynnet base er den større enn 1 %. Smeltepunktet er 58° –61°C. Gemfibrozil er et hvitt fast stoff som er stabilt under vanlige forhold.
INDIKASJONER
LOPID (gemfibrozil tabletter, USP) er indisert som tilleggsterapi til diett for:
. Behandling av voksne pasienter med svært høye forhøyede triglyseridnivåer i serum (hyperlipidemi av type IV og V) som utgjør en risiko for pankreatitt og som ikke reagerer tilstrekkelig på en bestemt diettforsøk for å kontrollere dem. Pasienter som utgjør en slik risiko har vanligvis serumtriglyserider over 2000 mg/dL og har forhøyede VLDL-kolesterol samt fastende chylomikroner (type V hyperlipidemi). Pasienter som konsekvent har totalt serum- eller plasmatriglyserider under 1000 mg/dL er usannsynlig å ha en risiko for pankreatitt. LOPID-behandling kan vurderes for de personer med triglyseridøkninger mellom 1000 og 2000 mg/dL som har en historie med pankreatitt eller tilbakevendende magesmerter som er typiske for pankreatitt. Det er anerkjent at noen type IV-pasienter med triglyserider under 1000 mg/dL, gjennom diett eller alkoholisk indiskresjon, kan konvertere til et type V-mønster med massive triglyseridøkninger som følger med fastende kylomikronemi, men påvirkningen av LOPID 300 mg-behandling på risikoen for pankreatitt i slike situasjoner er ikke tilstrekkelig studert. Medikamentell behandling er ikke indisert for pasienter med type I hyperlipoproteinemi, som har forhøyede chylomikroner og plasmatriglyserider, men som har normale nivåer av svært lav tetthet lipoprotein (VLDL). Inspeksjon av plasma nedkjølt i 14 timer er nyttig for å skille mellom type I, IV og V hyperlipoproteinemi. . Redusere risikoen for å utvikle koronar hjertesykdom bare hos pasienter av type IIb uten historie med eller symptomer på eksisterende koronar hjertesykdom som har hatt en utilstrekkelig respons på vekttap, kostholdsterapi, trening og andre farmakologiske midler (som gallesyrebindere og nikotinsyre, kjent for å redusere LDL-og øke HDL-kolesterol) og som har følgende triade av lipidavvik: lave HDL-kolesterolnivåer i tillegg til forhøyet LDL-kolesterol og forhøyede triglyserider (se ADVARSLER , FORHOLDSREGLER , og KLINISK FARMAKOLOGI ). National Cholesterol Education Program har definert en serum HDL-kolesterolverdi som konsekvent er under 35 mg/dL som en uavhengig risikofaktor for koronar hjertesykdom. Pasienter med signifikant forhøyede triglyserider bør observeres nøye når de behandles med gemfibrozil. Hos noen pasienter med høye triglyseridnivåer er behandling med gemfibrozil assosiert med en signifikant økning i LDL-kolesterol. PÅ GRUNN AV POTENSIAL TOKSISITET SOM Malignitet, GALLEBLÆRESYKDOM, MAGESMERTER SOM FØRER TIL APPENDEKTOMI OG ANDRE bukkirurgi, ØKT FOREkomst I IKKE-KORONAR DØDELIGHET OG DEN TREVELIGE ØKELSEN I ELLER 44% RIADUSIELT DET KJEMISK OG FARMAKOLOGISK RELATERTE GENERELT, KLOFIBRAT, DEN POTENSIELLE FORDELEN MED GEMFIBROZIL VED BEHANDLING AV TYPE IIA-PASIENTER MED BARE FORHØJELSE AV LDL-KOLESTROL, ER IKKE SANNSYNLIG Å VEI OPP RISIKOEN. LOPID 300mg ER OGSÅ IKKE INDISERT FOR BEHANDLING AV PASIENTER MED LAVT HDL-KOLESTEROL SOM DERES ENESTE LIPIDABNORMALITET.en undergruppeanalyse av pasienter i Helsinki Heart Study med over median HDL-kolesterolverdier ved baseline (større enn 46,4 mg/dL), var forekomsten av alvorlige koronare hendelser lik for gemfibrozil og placebo undergrupper (se tabell I).
Den første behandlingen for dyslipidemi er diettbehandling spesifikk for typen lipoproteinavvik. Overdreven kroppsvekt og overdreven alkoholinntak kan være viktige faktorer ved hypertriglyseridemi og bør behandles før enhver medikamentell behandling. Fysisk trening kan være et viktig hjelpetiltak, og har vært assosiert med økninger i HDL-kolesterol. Sykdommer som bidrar til hyperlipidemi som hypotyreose eller diabetes mellitus bør ses etter og behandles adekvat. Østrogenbehandling er noen ganger assosiert med massiv økning i plasmatriglyserider, spesielt hos personer med familiær hypertriglyseridemi. I slike tilfeller kan seponering av østrogenbehandling eliminere behovet for spesifikk medikamentell behandling av hypertriglyseridemi. Bruk av legemidler bør kun vurderes når det er gjort rimelige forsøk på å oppnå tilfredsstillende resultater med ikke-medikamentelle metoder. Dersom det tas beslutning om å bruke legemidler, bør pasienten instrueres om at dette ikke reduserer betydningen av å følge kostholdet.
DOSERING OG ADMINISTRASJON
Den anbefalte dosen for voksne er 1200 mg gitt i to oppdelte doser 30 minutter før morgen- og kveldsmåltider (se KLINISK FARMAKOLOGI ).
HVORDAN LEVERES
LOPID (Tablett 737), hvite, elliptiske, filmdrasjerte tabletter med delestrek, som hver inneholder 600 mg gemfibrozil, er tilgjengelig som følger:
NDC 0071-0737-20: Flasker med 60 stk NDC 0071-0737-30: Flasker på 500
Oppbevares ved kontrollert romtemperatur 20° – 25°C (68° – 77°F) [se USP]. Beskytt mot lys og fuktighet.
Distribuert av Parke-Davis Division of Pfizer Inc, NY, NY 10017. Revidert: Des 2020
BIVIRKNINGER
I den dobbeltblinde kontrollerte fasen av den primære forebyggingskomponenten i Helsinki Heart Study, fikk 2046 pasienter LOPID i opptil fem år. I den studien var følgende bivirkninger statistisk hyppigere hos personer i LOPID-gruppen:
Galleblæren kirurgi ble utført hos 0,9 % av LOPID 300 mg og 0,5 % av placebo-personene i den primære forebyggingskomponenten, et overskudd på 64 %, som ikke er statistisk forskjellig fra overskuddet av galleblærekirurgi observert i klofibratgruppen sammenlignet med placebogruppen i WHO-studien . Galleblærekirurgi ble også utført hyppigere i LOPID-gruppen sammenlignet med placebogruppen (1,9 % versus 0,3 %, p=0,07) i den sekundære forebyggende komponenten. En statistisk signifikant økning i appendektomi i gemfibrozil-gruppen ble også sett i den sekundære forebyggingskomponenten (6 på gemfibrozil versus 0 på placebo, p=0,014).
Bivirkninger på nervesystemet og spesielle sanser var mer vanlige i LOPID 300 mg-gruppen. Disse inkluderte hypestesi, parestesier og smaksperversjon. Andre bivirkninger som var mer vanlige blant pasienter med LOPID 300 mg behandlingsgruppe, men hvor en årsakssammenheng ikke ble etablert inkluderer grå stær, perifer vaskulær sykdom og intracerebral blødning.
Fra andre studier virker det sannsynlig at LOPID 300mg er årsakssammenheng med forekomsten av MUSKULOSKELETALE SYMPTOMER (se ADVARSLER ), og til ABNORMALE LEVERFUNKSJONSTESTER og HEMATOLOGISKE ENDRINGER (se FORHOLDSREGLER ).
Rapporter om virale og bakterielle infeksjoner (forkjølelse, hoste, urinveisinfeksjoner) var mer vanlig hos gemfibrozil-behandlede pasienter i andre kontrollerte kliniske studier med 805 pasienter. Ytterligere bivirkninger som er rapportert for gemfibrozil er listet opp nedenfor etter system. Disse er kategorisert etter om en årsakssammenheng til behandling med LOPID er sannsynlig eller ikke etablert:
Ytterligere bivirkninger som er rapportert inkluderer kolecystitt og kolelitiasis (se ADVARSLER ).
NARKOTIKAHANDEL
HMG-CoA-reduktasehemmere
Samtidig administrering av LOPID 300 mg og simvastatin er kontraindisert (se KONTRAINDIKASJONER og ADVARSLER ). Unngå samtidig bruk av LOPID og rosuvastatin. Hvis samtidig bruk ikke kan unngås, initier rosuvastatin med 5 mg én gang daglig. Dosen av rosuvastatin bør ikke overstige 10 mg én gang daglig. Risikoen for myopati og rabdomyolyse øker ved kombinert behandling med gemfibrozil og HMG-CoA-reduktasehemmer. Myopati eller rabdomyolyse med eller uten akutt nyresvikt er rapportert så tidlig som tre uker etter oppstart av kombinasjonsbehandling eller etter flere måneder (se ADVARSLER ). Det er ingen garanti for at periodisk overvåking av kreatinkinase vil forhindre forekomsten av alvorlig myopati og nyreskade.
Antikoagulanter
FORSIKTIG BØR UTFØRES NÅR WARFARIN GIVES I SAMMENSETNING MED LOPID. DOSERINGEN AV WARFARIN BØR REDUSERES FOR Å OPPHOLDE PROTHROMBINTIDEN PÅ ØNSKET NIVÅ FOR Å FORHINDRE BlØDINGSKOMPLIKASJONER. HYPPIGE PROTHROMBINBESTEMMELSER ER ANBEFALEDE INNTIL DET ER DEFINITIVT BLEVET BESTEMT AT PROTHROMBINNIVÅET HAR STABILISERT.
CYP2C8 substrater
Gemfibrozil er en sterk hemmer av CYP2C8 og kan øke eksponeringen av legemidler som hovedsakelig metaboliseres av CYP2C8 (f.eks. dabrafenib, enzalutamid, loperamid, montelukast, paklitaksel, pioglitazon, rosiglitazon). Derfor kan dosereduksjon av legemidler som hovedsakelig metaboliseres av CYP2C8-enzymet være nødvendig når gemfibrozil brukes samtidig (se ADVARSLER ).
Repaglinid
Hos friske frivillige resulterte samtidig administrering med gemfibrozil (600 mg to ganger daglig i 3 dager) i en 8,1 ganger (område 5,5 til 15,0 ganger) høyere repaglinid AUC og en 28,6 ganger (område 18,5 til 80,1 ganger) høyere plasmakonsentrasjon av repaglinid 7 timer etter dosen. I samme studie resulterte gemfibrozil (600 mg to ganger daglig i 3 dager) + itrakonazol (200 mg om morgenen og 100 mg om kvelden på dag 1, deretter 100 mg to ganger daglig på dag 2-3) i en 19,4-( område 12,9 til 24,7 ganger høyere repaglinid AUC og en 70,4 ganger (område 42,9 til 119,2 ganger) høyere plasmakonsentrasjon av repaglinid 7 timer etter dosen. I tillegg forlenget gemfibrozil alene eller gemfibrozil + itrakonazol den hypoglykemiske effekten av repaglinid. Samtidig administrering av gemfibrozil og repaglinid øker risikoen for alvorlig hypoglykemi og er kontraindisert (se KONTRAINDIKASJONER ).
Dasabuvir
Samtidig administrering av gemfibrozil og dasabuvir økte dasabuvir AUC og Cmax (forhold: henholdsvis 11,3 og 2,01) på grunn av CYP2C8-hemming. Økt eksponering for dasabuvir kan øke risikoen for QT-forlengelse, derfor er samtidig administrering av gemfibrozil og dasabuvir kontraindisert (se KONTRAINDIKASJONER ).
Selexipag
Samtidig administrering av gemfibrozil og selexipag doblet eksponeringen for selexipag og økte eksponeringen for den aktive metabolitten med omtrent 11 ganger. Samtidig administrering av gemfibrozil og selexipag er kontraindisert (se KONTRAINDIKASJONER ).
Enzalutamid
Hos friske frivillige som fikk en enkeltdose på 160 mg enzalutamid etter gemfibrozil 600 mg to ganger daglig, ble AUC for enzalutamid pluss aktiv metabolitt (N-desmetylenzalutamid) økt med 2,2 ganger og tilsvarende Cmax ble redusert med 16 %. Økt eksponering for enzalutamid kan øke risikoen for anfall. Hvis samtidig administrering anses nødvendig, bør dosen av enzalutamid reduseres (se ADVARSLER ).
OATP1B1 substrater
Gemfibrozil er en hemmer av OATP1B1-transportør og kan øke eksponeringen av medikamenter som er substrater for OATP1B1 (f.eks. atrasentan, atorvastatin, bosentan, ezetimibe, fluvastatin, glyburid, SN-38 [aktiv metabolitt av irinotecan], rosuvastatin, rifinavastatin, pravinastatin, . , valsartan, olmesartan). Derfor kan dosereduksjoner av legemidler som er substrater for OATP1B1 være nødvendig når gemfibrozil brukes samtidig (se ADVARSLER ). Kombinasjonsbehandling av gemfibrozil med simvastatin eller med repaglinid, som er OATP1B1-substrater, er kontraindisert (se KONTRAINDIKASJONER ).
In vitro-studier av CYP-enzymer, UGTA-enzymer og OATP1B1-transporter
In vitro-studier har vist at gemfibrozil er en hemmer av CYP1A2, CYP2C8, CYP2C9, CYP2C19, OATP1B1 og UDP-glukuronosyltransferase (UGT) 1A1 og 1A3 (se ADVARSLER ).
Gallesyrebindende harpikser
Gemfibrozil AUC ble redusert med 30 % når gemfibrozil ble gitt (600 mg) samtidig med harpiksgranulatmedisiner som kolestipol (5 g). Administrering av legemidlene med to timers mellomrom eller mer anbefales fordi eksponeringen av gemfibrozil ikke ble signifikant påvirket når den ble administrert med to timers mellomrom fra kolestipol.
Kolkisin
Myopati, inkludert rabdomyolyse, er rapportert ved kronisk administrering av kolkisin i terapeutiske doser. Samtidig bruk av LOPID kan potensere utviklingen av myopati. Pasienter med nedsatt nyrefunksjon og eldre pasienter har økt risiko. Forsiktighet bør utvises ved forskrivning av LOPID med kolkisin, spesielt hos eldre pasienter eller pasienter med nedsatt nyrefunksjon.
ADVARSLER
På grunn av den mer begrensede størrelsen på Helsinki Heart Study, er den observerte forskjellen i dødelighet uansett årsak mellom LOPID 300 mg og placebogruppene ikke statistisk signifikant forskjellig fra 29 % overdødelighet rapportert i klofibratgruppen i den separate WHO-studien ved ni års oppfølging (se KLINISK FARMAKOLOGI ). Ikke-koronar hjertesykdomsrelatert dødelighet viste et overskudd i gruppen som opprinnelig ble randomisert til LOPID, primært på grunn av kreftdødsfall observert under den åpne utvidelsen.
løpet av den femårige primærforebyggende komponenten av Helsinki Heart Study var dødeligheten uansett årsak 44 (2,2 %) i LOPID 300 mg-gruppen og 43 (2,1 %) i placebogruppen; inkludert 3,5 års oppfølgingsperiode siden studien ble fullført, var kumulativ dødelighet uansett årsak 101 (4,9 %) i LOPID-gruppen og 83 (4,1 %) i gruppen som opprinnelig ble randomisert til placebo (fareforhold 1:20 i favør) av placebo). På grunn av den mer begrensede størrelsen på Helsinki Heart Study, er den observerte forskjellen i dødelighet uansett årsak mellom LOPID 300 mg og placebogruppene ved år-5 eller ved år-8,5 ikke statistisk signifikant forskjellig fra 29 % overdødelighet rapportert i klofibratgruppen i den separate WHO-studien ved niårsoppfølgingen. Ikke-koronar hjertesykdomsrelatert dødelighet viste et overskudd i gruppen som opprinnelig ble randomisert til LOPID 300mg ved 8,5 års oppfølging (65 LOPID 300mg versus 45 placebo ikke-koronare dødsfall).
Forekomsten av kreft (unntatt basalcellekarsinom) oppdaget under forsøket og i løpet av de 3,5 årene etter at forsøket ble fullført var 51 (2,5 %) i begge de opprinnelig randomiserte gruppene. I tillegg var det 16 basalcellekarsinomer i gruppen som opprinnelig ble randomisert til LOPID 300 mg og 9 i gruppen som opprinnelig ble randomisert til placebo (p=0,22). Det var 30 (1,5 %) dødsfall som ble tilskrevet kreft i gruppen som opprinnelig ble randomisert til LOPID 300 mg og 18 (0,9 %) i gruppen som opprinnelig ble randomisert til placebo (p=0,11). Uønskede utfall, inkludert koronarhendelser, var høyere hos gemfibrozilpasienter i en tilsvarende studie på menn med en historie med kjent eller mistenkt koronar hjertesykdom i den sekundære forebyggende komponenten av Helsinki Heart Study (se KLINISK FARMAKOLOGI ).
En sammenlignende karsinogenitetsstudie ble også utført på rotter som sammenlignet tre legemidler i denne klassen: fenofibrat (10 og 60 mg/kg; henholdsvis 0,3 og 1,6 ganger human dose), klofibrat (400 mg/kg; 1,6 ganger human dose), og gemfibrozil (250 mg/kg; 1,7 ganger human dose). Pankreas acinare adenomer ble økt hos menn og kvinner på fenofibrat; hepatocellulært karsinom og bukspyttkjertelacinære adenomer ble økt hos menn og hepatiske neoplastiske knuter hos kvinner behandlet med klofibrat; hepatiske neoplastiske knuter ble økt hos menn og kvinner behandlet med klofibrat; hepatiske neoplastiske knuter ble økt hos menn og kvinner behandlet med gemfibrozil, mens testikulære interstitielle celle (Leydig-celle) svulster ble økt hos menn på alle tre legemidlene.

FORHOLDSREGLER
Innledende terapi
Laboratoriestudier bør gjøres for å fastslå at lipidnivåene er konsekvent unormale. Før LOPID-behandling iverksettes, bør alle forsøk gjøres for å kontrollere serumlipider med passende diett, trening, vekttap hos overvektige pasienter og kontroll av eventuelle medisinske problemer som diabetes mellitus og hypotyreose som bidrar til lipidavvikene.
Fortsatt terapi
Periodisk bestemmelse av serumlipider bør oppnås, og stoffet må trekkes tilbake hvis lipidresponsen er utilstrekkelig etter tre måneders behandling.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Langtidsstudier er utført på rotter med 0,2 og 1,3 ganger eksponeringen hos mennesker (basert på AUC). Forekomsten av benigne leverknuter og leverkarsinomer var signifikant økt hos høydose hannrotter. Forekomsten av leverkarsinomer økte også hos menn med lav dose, men denne økningen var ikke statistisk signifikant (p=0,1). Hannrotter hadde en doserelatert og statistisk signifikant økning av benigne Leydig-celletumorer. Hunnrottene med høyere dose hadde en signifikant økning i den kombinerte forekomsten av benigne og ondartede leverneoplasmer.
Langtidsstudier er utført på mus med 0,1 og 0,7 ganger human eksponering (basert på AUC). Det var ingen statistisk signifikante forskjeller fra kontrollene i forekomsten av levertumorer, men dosene som ble testet var lavere enn de som ble vist å være kreftfremkallende med andre fibrater.
Elektronmikroskopistudier har vist en florid hepatisk peroksisomproliferasjon etter administrering av LOPID til hannrotten. En tilstrekkelig studie for å teste for peroksisomproliferasjon er ikke gjort hos mennesker, men endringer i peroksisommorfologi er observert. Peroksisomproliferasjon har vist seg å forekomme hos mennesker med ett av to andre legemidler av fibratklassen når leverbiopsier ble sammenlignet før og etter behandling hos samme individ.
Administrering av ca. 2 ganger human dose (basert på overflateareal) til hannrotter i 10 uker resulterte i en doserelatert reduksjon i fertilitet. Etterfølgende studier viste at denne effekten ble reversert etter en medikamentfri periode på rundt åtte uker, og den ble ikke overført til avkommet.
Svangerskap
LOPID 300mg har vist seg å gi uønskede effekter hos rotter og kaniner ved doser mellom 0,5 og 3 ganger human dose (basert på overflateareal). Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. LOPID 300mg skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Administrering av LOPID 300 mg til hunnrotter ved 2 ganger den humane dosen (basert på overflateareal) før og gjennom svangerskapet forårsaket en doserelatert reduksjon i unnfangelsesraten, en økning i dødfødte og en svak reduksjon i ungvekten under diegivning. Det var også doserelaterte økte skjelettvariasjoner. Anoftalmi oppstod, men sjelden.
Administrering av 0,6 og 2 ganger human dose (basert på overflateareal) av LOPID til hunnrotter fra drektighetsdag 15 til avvenning forårsaket doserelaterte reduksjoner i fødselsvekt og undertrykkelse av vekst av valpen under diegivning.
Administrering av 1 og 3 ganger human dose (basert på overflateareal) av LOPID 300 mg til hunnkaniner under organogenese forårsaket en doserelatert reduksjon i kullstørrelse og, ved høy dose, økt forekomst av parietale beinvariasjoner.
Ammende mødre
Det er ikke kjent om dette legemidlet skilles ut i morsmelk. Fordi mange legemidler skilles ut i morsmelk og på grunn av potensialet for tumorgenisitet vist for LOPID i dyrestudier, bør det tas en beslutning om å avbryte amming eller å avbryte medikamentet, tatt i betraktning stoffets betydning for moren.
Hematologiske endringer
Mild reduksjon av hemoglobin, hematokrit og hvite blodlegemer er observert hos enkelte pasienter etter oppstart av LOPID-behandling. Imidlertid stabiliseres disse nivåene under langtidsadministrasjon. I sjeldne tilfeller er alvorlig anemi, leukopeni, trombocytopeni og benmargshypoplasi rapportert.
Derfor anbefales periodiske blodtellinger i løpet av de første 12 månedene av LOPID 300 mg administrering.
Leverfunksjon
Unormale leverfunksjonstester er av og til observert under administrering av LOPID, inkludert forhøyelser av ASAT, ALAT, LDH, bilirubin og alkalisk fosfatase. Disse er vanligvis reversible når LOPID 300mg seponeres. Derfor anbefales periodiske leverfunksjonsstudier, og behandling med LOPID 300 mg bør avsluttes hvis unormaliteten vedvarer.
Nyrefunksjon
Det har vært rapporter om forverret nyresvikt ved tillegg av LOPID-behandling hos personer med baseline plasmakreatinin >2,0 mg/dL. Hos slike pasienter bør bruk av alternativ behandling vurderes opp mot risikoen og fordelene ved en lavere dose LOPID.
Pediatrisk bruk
Sikkerhet og effekt hos pediatriske pasienter er ikke fastslått.
OVERDOSE
Det har vært rapportert tilfeller av overdosering med LOPID. I ett tilfelle ble et 7 år gammelt barn frisk etter å ha inntatt opptil 9 gram LOPID. Symptomer rapportert ved overdosering var magekramper, unormale leverfunksjonstester, diaré, økt CPK, ledd- og muskelsmerter, kvalme og oppkast. Symptomatiske støttetiltak bør tas dersom en overdose skulle oppstå.
KONTRAINDIKASJONER
. Lever eller alvorlig nedsatt nyrefunksjon, inkludert primær biliær cirrhose. . Eksisterende galleblæresykdom (se ADVARSLER ). . Overfølsomhet overfor gemfibrozil. . Kombinasjonsbehandling av gemfibrozil og simvastatin (se ADVARSLER og FORHOLDSREGLER ). . Kombinasjonsbehandling av gemfibrozil og repaglinid (se FORHOLDSREGLER ). . Kombinasjonsbehandling av gemfibrozil og dasabuvir (se FORHOLDSREGLER ). . Kombinasjonsbehandling av gemfibrozil og selexipag (se FORHOLDSREGLER ).KLINISK FARMAKOLOGI
LOPID er et lipidregulerende middel som reduserer serumtriglyserider og veldig lavdensitetslipoprotein (VLDL) kolesterol, og øker høydensitetslipoprotein (HDL) kolesterol. Mens beskjedne reduksjoner i total- og lavdensitetslipoprotein (LDL)-kolesterol kan observeres med LOPID 300 mg-behandling, resulterer behandling av pasienter med forhøyede triglyserider på grunn av type IV hyperlipoproteinemi ofte i en økning i LDL-kolesterol. LDL-kolesterolnivåer hos type IIb-pasienter med forhøyelser av både serum-LDL-kolesterol og triglyserider påvirkes generelt minimalt av behandling med LOPID 300 mg; LOPID 300mg øker imidlertid vanligvis HDL-kolesterol betydelig i denne gruppen. LOPID 300mg øker nivåene av HDL-subfraksjonene HDL2 og HDL3, samt apolipoproteinene AI og AII. Epidemiologiske studier har vist at både lavt HDL-kolesterol og høyt LDL-kolesterol er uavhengige risikofaktorer for koronar hjertesykdom.
den primære forebyggingskomponenten av Helsinki Heart Study, der 4081 mannlige pasienter mellom 40 og 55 år ble studert på en randomisert, dobbeltblind, placebokontrollert måte, var LOPID 300 mg-behandling assosiert med signifikante reduksjoner i totale plasmatriglyserider. og en betydelig økning i høydensitetslipoproteinkolesterol. Moderat reduksjon i totalt plasmakolesterol og lavdensitetslipoproteinkolesterol ble observert for LOPID-behandlingsgruppen som helhet, men lipidresponsen var heterogen, spesielt blant ulike Fredrickson-typer. Studien involverte personer med ikke-HDL-kolesterol i serum på over 200 mg/dL og ingen tidligere historie med koronar hjertesykdom. I løpet av den femårige studieperioden opplevde LOPID 300 mg-gruppen en 1,4 % absolutt (34 % relativ) reduksjon i frekvensen av alvorlige koronare hendelser (plutselige hjertedødsfall pluss dødelige og ikke-dødelige hjerteinfarkter) sammenlignet med placebo, p=0,04 (se Tabell I). Det var en 37 % relativ reduksjon i frekvensen av ikke-dødelig hjerteinfarkt sammenlignet med placebo, tilsvarende en behandlingsrelatert forskjell på 13,1 hendelser per tusen personer. Dødsfall uansett årsak under den dobbeltblinde delen av studien var totalt 44 (2,2 %) i LOPID 300 mg randomiseringsgruppen og 43 (2,1 %) i placebogruppen.
Blant Fredrickson-typer, under den 5-årige dobbeltblinde delen av den primære forebyggingskomponenten i Helsinki Heart Study, skjedde den største reduksjonen i forekomsten av alvorlige koronare hendelser hos type IIb-pasienter som hadde forhøyelser av både LDL-kolesterol og totalt plasma. triglyserider. Denne undergruppen av type IIb gemfibrozil-gruppepasienter hadde et lavere gjennomsnittlig HDL-kolesterolnivå ved baseline enn type IIa-undergruppen som hadde forhøyninger av LDL-kolesterol og normale plasmatriglyserider. Gjennomsnittlig økning i HDL-kolesterol blant type IIb-pasientene i denne studien var 12,6 % sammenlignet med placebo. Gjennomsnittlig endring i LDL-kolesterol blant type IIb-pasienter var –4,1 % med LOPID sammenlignet med en økning på 3,9 % i placebo-undergruppen. Type IIb-personene i Helsinki Heart Study hadde 26 færre koronare hendelser per tusen personer over fem år i gemfibrozil-gruppen sammenlignet med placebo. Forskjellen i koronare hendelser var vesentlig større mellom LOPID 300 mg og placebo for den undergruppen av pasienter med triaden LDL-kolesterol >175 mg/dL (>4,5 mmol), triglyserider >200 mg/dL (>2,2 mmol) og HDL -kolesterol
Ytterligere informasjon er tilgjengelig fra en 3,5 års (8,5 år kumulativ) oppfølging av alle forsøkspersoner som hadde deltatt i Helsinki Heart Study. Ved fullføringen av Helsinki Heart Study kunne forsøkspersoner velge å starte, stoppe eller fortsette å motta LOPID; uten kunnskap om egne lipidverdier eller dobbeltblind behandling, begynte 60 % av pasientene som opprinnelig ble randomisert til placebo behandling med LOPID 300 mg og 60 % av pasientene som opprinnelig ble randomisert til LOPID fortsatte medisinering. Etter ca. 6,5 år etter randomisering ble alle pasienter informert om sin opprinnelige behandlingsgruppe og lipidverdier i løpet av de fem årene av den dobbeltblinde behandlingen. Etter ytterligere elektive endringer i LOPID-behandlingsstatus, tok 61 % av pasientene i gruppen som opprinnelig ble randomisert til LOPID medikament; i gruppen som opprinnelig ble randomisert til placebo, tok 65 % LOPID. Hendelsesraten per 1000 som oppstår i løpet av den åpne oppfølgingsperioden er beskrevet i tabell II.
Kumulativ dødelighet gjennom 8,5 år viste et 20 % relativt overskudd av dødsfall i gruppen opprinnelig randomisert til LOPID 300 mg versus den opprinnelig randomiserte placebogruppen og en 20 % relativ reduksjon i hjertehendelser i gruppen som opprinnelig ble randomisert til LOPID 300 mg versus den opprinnelig randomiserte placebogruppen (se tabell III). Denne analysen av den opprinnelig randomiserte "intent-to-treat"-populasjonen neglisjerer de mulige kompliserende effektene av behandlingsbytte under den åpne fasen. Justering av fareforhold, som tar hensyn til åpen behandlingsstatus fra år 6,5 til 8,5, kan endre de rapporterte fareforholdene for dødelighet mot enhet.
Det er ikke klart i hvilken grad funnene av den primære forebyggingskomponenten i Helsinki Heart Study kan ekstrapoleres til andre segmenter av den dyslipidemiske populasjonen som ikke er studert (som kvinner, yngre eller eldre menn, eller de med lipidavvik som er begrenset utelukkende til HDL -kolesterol) eller til andre lipid-endrende legemidler.
Den sekundære forebyggingskomponenten i Helsinki Heart Study ble utført over fem år parallelt og ved de samme sentrene i Finland i 628 middelaldrende menn ekskludert fra den primære forebyggingskomponenten i Helsinki Heart Study på grunn av en historie med angina, hjerteinfarkt, eller uforklarlige EKG-forandringer. Det primære effektendepunktet for studien var hjertehendelser (summen av fatale og ikke-dødelige hjerteinfarkter og plutselige hjertedødsfall). Hazard ratio (LOPID:placebo) for hjertehendelser var 1,47 (95 % konfidensgrenser 0,88–2,48, p=0,14). Av de 35 pasientene i LOPID 300 mg-gruppen som opplevde hjertehendelser, led 12 pasienter hendelser etter seponering fra studien. Av de 24 pasientene i placebogruppen med hjertehendelser, fikk 4 pasienter hendelser etter seponering fra studien. Det var 17 hjertedødsfall i LOPID-gruppen og 8 i placebogruppen (hazard ratio 2,18; 95 % konfidensgrenser 0,94–5,05, p=0,06). Ti av disse dødsfallene i LOPID-gruppen og 3 i placebogruppen skjedde etter seponering av behandlingen. I denne studien av pasienter med kjent eller mistenkt koronar hjertesykdom ble det ikke observert noen fordel ved LOPID 300 mg-behandling for å redusere hjertehendelser eller hjertedødsfall. Således har LOPID 300mg vist fordel kun hos utvalgte dyslipidemiske pasienter uten mistenkt eller etablert koronar hjertesykdom. Selv hos pasienter med koronar hjertesykdom og triaden av forhøyet LDL-kolesterol, forhøyede triglyserider pluss lavt HDL-kolesterol, er den mulige effekten av LOPID på koronare hendelser ikke tilstrekkelig studert.
Ingen effekt hos pasienter med etablert koronar hjertesykdom ble observert under Coronary Drug Project med det kjemisk og farmakologisk relaterte stoffet, clofibrate. Coronary Drug Project var en 6-årig randomisert, dobbeltblind studie som involverte 1000 klofibrater, 1000 nikotinsyre og 3000 placebopasienter med kjent koronar hjertesykdom. En klinisk og statistisk signifikant reduksjon i hjerteinfarkt ble sett i den samtidige nikotinsyregruppen sammenlignet med placebo; ingen reduksjon ble sett med klofibrat.
Virkningsmekanismen til gemfibrozil er ikke definitivt fastslått. Hos mennesker har LOPID 300mg vist seg å hemme perifer lipolyse og redusere leverekstraksjonen av frie fettsyrer, og dermed redusere levertriglyseridproduksjonen. LOPID 300mg hemmer syntesen og øker clearance av VLDL-bærer-apolipoprotein B, noe som fører til en reduksjon i VLDL-produksjonen.
Dyrestudier tyder på at gemfibrozil, i tillegg til å heve HDL-kolesterol, kan redusere inkorporering av langkjedede fettsyrer i nydannede triglyserider, akselerere omsetning og fjerning av kolesterol fra leveren, og øke utskillelsen av kolesterol i avføringen. LOPID 300mg absorberes godt fra mage-tarmkanalen etter oral administrering. Maksimal plasmanivå inntreffer etter 1 til 2 timer med en plasmahalveringstid på 1,5 timer etter gjentatte doser.
Gemfibrozil absorberes fullstendig etter oral administrering av LOPID 300 mg tabletter, og når maksimal plasmakonsentrasjon 1 til 2 timer etter dosering. Gemfibrozils farmakokinetikk påvirkes av tidspunktet for måltider i forhold til tidspunktet for dosering. I en studie (ref. 4) ble både hastigheten og omfanget av absorpsjon av medikamentet signifikant økt når det ble administrert 0,5 time før måltider. Gjennomsnittlig AUC ble redusert med 14–44 % når LOPID ble administrert etter måltider sammenlignet med 0,5 time før måltider. I en påfølgende studie var absorpsjonshastigheten av LOPID 300 mg maksimal når det ble administrert 0,5 time før måltider med Cmax 50–60 % høyere enn når det ble gitt enten med måltider eller faste. I denne studien var det ingen signifikant effekt på AUC for tidspunktet for dosen i forhold til måltider (se DOSERING OG ADMINISTRASJON ).
LOPID gjennomgår hovedsakelig oksidasjon av en ringmetylgruppe for suksessivt å danne en hydroksymetyl- og en karboksylmetabolitt. Omtrent sytti prosent av den administrerte humane dosen utskilles i urinen, hovedsakelig som glukuronidkonjugatet, med mindre enn 2 % utskilt som uendret gemfibrozil. Seks prosent av dosen står i avføringen. Gemfibrozil er sterkt bundet til plasmaproteiner og det er potensial for fortrengningsinteraksjoner med andre legemidler (se FORHOLDSREGLER ).
PASIENTINFORMASJON
Ingen informasjon gitt. Vennligst referer til ADVARSLER og FORHOLDSREGLER seksjoner.
