Zocor 5mg, 10mg, 20mg, 40mg Simvastatin Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Zocor og hvordan brukes det?
Zocor (simvastatin) er et reseptbelagt legemiddel som brukes til å senke nivåer av "dårlig" kolesterol (lavdensitetslipoprotein eller LDL) og for å øke nivåene av "gode" kolesterol (high-density lipoprotein eller HDL) og senke triglyserin samt å redusere risikoen for hjerneslag og hjerteinfarkt. Zocor kan brukes alene eller sammen med andre medisiner.
Zocor tilhører en klasse legemidler som kalles lipidsenkende midler, statiner, HMG-CoA-reduktasehemmere.
Det er ikke kjent om Zocor er trygt og effektivt hos barn under 10 år.
Hva er mulige bivirkninger av Zocor?
Zocor 20mg kan forårsake alvorlige bivirkninger inkludert:
- . tap av Appetit, . magesmerter øverst til høyre, . tretthet, . kløe, . mørk urin, . leirefarget krakk, og . gulfarging av hud eller øyne
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Zocor inkluderer:
- . hodepine, . kvalme, . magesmerter, . forstoppelse, og . forkjølelsessymptomer (tett nese, nysing eller sår hals)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Zocor. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
ZOCOR (simvastatin) er et lipidsenkende middel som er avledet syntetisk fra et fermenteringsprodukt av Aspergillus terreus. Etter oralt inntak hydrolyseres simvastatin, som er et inaktivt lakton, til den tilsvarende β-hydroksysyreformen. Dette er en hemmer av 3-hydroksy-3-metylglutaryl-koenzym A (HMG-CoA) reduktase. Dette enzymet katalyserer omdannelsen av HMG-CoA til mevalonat, som er et tidlig og hastighetsbegrensende trinn i biosyntesen av kolesterol.
Simvastatin er butansyre, 2,2-dimetyl-,1,2,3,7,8,8a-heksahydro-3,7-dimetyl-8-[2-(tetrahydro-4hydroksy-6-okso-2H-pyran- 2-yl)-etyl]-1-naftalenylester, [1S-[la,3a,7ß,8ß(2S*,4S*),-8aß]]. Den empiriske formelen til simvastatin er C25H38O5 og dens molekylvekt er 418,57. Dens strukturformel er:
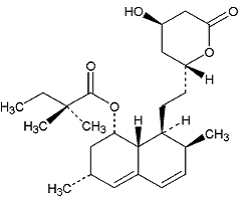
Simvastatin er et hvitt til off-white, ikke-hygroskopisk, krystallinsk pulver som er praktisk talt uløselig i vann, og fritt løselig i kloroform, metanol og etanol.
Tabletter ZOCOR for oral administrering inneholder enten 5 mg, 10 mg, 20 mg, 40 mg eller 80 mg simvastatin og følgende inaktive ingredienser: askorbinsyre, sitronsyre, hydroksypropylcellulose, hypromellose, jernoksider, laktose, magnesiumstearat, mikrokrystallinsk cellulose stivelse, talkum og titandioksid. Butylert hydroksyanisol tilsettes som konserveringsmiddel.
INDIKASJONER
Terapi med lipidforandrende midler bør kun være én komponent i intervensjon med flere risikofaktorer hos individer med betydelig økt risiko for aterosklerotisk vaskulær sykdom på grunn av hyperkolesterolemi. Medikamentell behandling er indisert som et tillegg til dietten når responsen på en diett begrenset i mettet fett og kolesterol og andre ikke-farmakologiske tiltak alene har vært utilstrekkelig. Hos pasienter med koronar hjertesykdom (CHD) eller med høy risiko for CHD, kan ZOCOR® startes samtidig med diett.
Reduksjoner i risiko for CHD-dødelighet og kardiovaskulære hendelser
Hos pasienter med høy risiko for koronar hendelser på grunn av eksisterende koronar hjertesykdom, diabetes, perifer karsykdom, historie med hjerneslag eller annen cerebrovaskulær sykdom, er ZOCOR 5mg indisert for:
- . Reduser risikoen for total dødelighet ved å redusere CHD-dødsfall. . Reduser risikoen for ikke-dødelig hjerteinfarkt og hjerneslag. . Reduser behovet for koronare og ikke-koronare revaskulariseringsprosedyrer.
Høyt kolesterol
ZOCOR er indikert til:
- . Reduser forhøyet totalkolesterol (total-C), low-density lipoprotein-kolesterol (LDL-C), apolipoprotein B (Apo B) og triglyserider (TG), og for å øke high-density lipoprotein-kolesterol (HDL-C) hos pasienter med primær hyperlipidemi (Fredrickson type IIa, heterozygot familiær og ikke-familiær) eller blandet dyslipidemi (Fredrickson type IIb). . Reduser forhøyet TG hos pasienter med hypertriglyseridemi (Fredrickson type lV hyperlipidemi). . Reduser forhøyet TG og VLDL-C hos pasienter med primær dysbetalipoproteinemi (Fredrickson type lll hyperlipidemi). . Reduser total-C og LDL-C hos pasienter med homozygot familiær hyperkolesterolemi (HoFH) som et tillegg til andre lipidsenkende behandlinger (f.eks. LDL-aferese) eller hvis slike behandlinger ikke er tilgjengelige.
Ungdomspasienter med heterozygot familiær hyperkolesterolemi (HeFH)
ZOCOR er indisert som et tillegg til diett for å redusere total-C, LDL-C og Apo B-nivåer hos unge gutter og jenter som er minst ett år etter menarche, 10-17 år gamle, med HeFH, hvis etter en tilstrekkelig utprøving av diettbehandling følgende funn er til stede:
. LDL-kolesterol forblir ≥190 mg/dL; eller . LDL-kolesterol forblir ≥160 mg/dL og- . Det er en positiv familiehistorie med prematur kardiovaskulær sykdom (CVD) eller . To eller flere andre CVD-risikofaktorer er tilstede hos den unge pasienten.
Minimumsmålet for behandling hos pediatriske og ungdomspasienter er å oppnå en gjennomsnittlig LDL-C
Bruksbegrensninger
ZOCOR 20mg har ikke blitt studert under tilstander der den største abnormiteten er forhøyelse av chylomikroner (dvs. hyperlipidemi Fredrickson type I og V).
DOSERING OG ADMINISTRASJON
Anbefalt dosering
Det vanlige doseringsområdet er 5 til 40 mg/dag. Hos pasienter med CHD eller med høy risiko for CHD, kan ZOCOR startes samtidig med diett. Den anbefalte vanlige startdosen er 10 eller 20 mg en gang daglig om kvelden. For pasienter med høy risiko for en CHD-hendelse på grunn av eksisterende CHD, diabetes, perifer karsykdom, historie med hjerneslag eller annen cerebrovaskulær sykdom, er den anbefalte startdosen 40 mg/dag. Lipidbestemmelser bør utføres etter 4 ukers behandling og periodisk deretter.
Begrenset dosering for 80 mg
På grunn av økt risiko for myopati, inkludert rabdomyolyse, spesielt i løpet av det første behandlingsåret, bør bruken av 80 mg dosen ZOCOR begrenses til pasienter som har tatt simvastatin 80 mg kronisk (f.eks. i 12 måneder eller mer) uten bevis på muskeltoksisitet [se ADVARSLER OG FORHOLDSREGLER ].
Pasienter som for tiden tolererer 80 mg dosen av ZOCOR som må startes med et interagerende legemiddel som er kontraindisert eller assosiert med en dosetak for simvastatin, bør byttes til et alternativt statin med mindre potensiale for legemiddelinteraksjonen.
På grunn av den økte risikoen for myopati, inkludert rabdomyolyse, assosiert med dosen på 80 mg ZOCOR 40 mg, bør pasienter som ikke er i stand til å nå LDL-C-målet ved å bruke 40 mg dosen ZOCOR 5 mg, ikke titreres til dosen på 80 mg. , men bør settes på alternativ(e) LDL-C-senkende behandling(er) som gir større LDL-C-senkende.
Samtidig administrering med andre legemidler
Pasienter som tar Verapamil, Diltiazem eller Dronedarone
- . Dosen av ZOCOR bør ikke overstige 10 mg/dag [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL , og KLINISK FARMAKOLOGI ].
Pasienter som tar Amiodaron, Amlodipin eller Ranolazin
- . Dosen av ZOCOR 10 mg bør ikke overstige 20 mg/dag [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL , og KLINISK FARMAKOLOGI ].
Pasienter med homozygot familiær hyperkolesterolemi
Den anbefalte dosen er 40 mg/dag om kvelden [Se DOSERING OG ADMINISTRASJON , Begrenset dosering for 80 mg ]. ZOCOR 5mg skal brukes som et tillegg til andre lipidsenkende behandlinger (f.eks. LDL-aferese) hos disse pasientene eller hvis slike behandlinger ikke er tilgjengelige.
Simvastatineksponering er omtrent doblet ved samtidig bruk av lomitapid; derfor bør dosen av ZOCOR reduseres med 50 % ved oppstart av lomitapid. ZOCOR 5 mg-dose bør ikke overstige 20 mg/dag (eller 40 mg/dag for pasienter som tidligere har tatt ZOCOR 80 mg/dag kronisk, f.eks. i 12 måneder eller mer, uten tegn på muskeltoksisitet) mens de tar lomitapid.
Ungdom (10–17 år) med heterozygot familiær hyperkolesterolemi
Den anbefalte vanlige startdosen er 10 mg en gang daglig om kvelden. Det anbefalte doseringsområdet er 10 til 40 mg/dag; maksimal anbefalt dose er 40 mg/dag. Doser bør individualiseres i henhold til det anbefalte målet for behandlingen [se Retningslinjer for NCEP Pediatric Panel1 og Kliniske studier ]. Justeringer bør gjøres med intervaller på 4 uker eller mer.
Pasienter med nedsatt nyrefunksjon
Fordi ZOCOR 5mg ikke utskilles betydelig i nyrene, bør dosejustering ikke være nødvendig hos pasienter med mild til moderat nedsatt nyrefunksjon. Imidlertid bør det utvises forsiktighet når ZOCOR 20 mg gis til pasienter med alvorlig nedsatt nyrefunksjon; slike pasienter bør startes med 5 mg/dag og overvåkes nøye [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
- . Tabletter ZOCOR 5 mg er buff, ovale, filmdrasjerte tabletter, kodet MSD 726 på den ene siden og ZOCOR 5 på den andre. . Tabletter ZOCOR 10 mg er ferskenfargede, ovale, filmdrasjerte tabletter, kodet MSD 735 på den ene siden og vanlige på den andre. . Tabletter ZOCOR 20 mg er brune, ovale, filmdrasjerte tabletter, kodet MSD 740 på den ene siden og ensfarget på den andre. . Tabletter ZOCOR 40 mg er mursteinsrøde, ovale, filmdrasjerte tabletter, kodet MSD 749 på den ene siden og ensfarget på den andre. . Tabletter ZOCOR 80 mg er mursteinsrøde, kapselformede, filmdrasjerte tabletter, kodet 543 på den ene siden og 80 på den andre.
Oppbevaring og håndtering
nr. 8146 - Tabletter ZOCOR 10 mg er ferskenfargede, ovale, filmdrasjerte tabletter, kodet MSD 735 på den ene siden og vanlige på den andre. De leveres som følger:
NDC 0006-0735-31 bruksenhet flasker med 30 stk NDC 0006-0735-54 bruksenhetsflasker med 90 stk.
nr. 8147 - Tabletter ZOCOR 20 mg er brune, ovale, filmdrasjerte tabletter, kodet MSD 740 på den ene siden og ensfarget på den andre. De leveres som følger:
NDC 0006-0740-31 bruksenhet flasker med 30 stk NDC 0006-0740-54 bruksenhet flasker på 90.
nr. 8148 - Tabletter ZOCOR 40 mg er mursteinsrøde, ovale, filmdrasjerte tabletter, kodet MSD 749 på den ene siden og vanlig på den andre. De leveres som følger:
NDC 0006-0749-31 bruksenhet flasker med 30 stk NDC 0006-0749-54 bruksenhetsflasker med 90 stk.
nr. 6577 - Tabletter ZOCOR 80 mg er mursteinsrøde, kapselformede, filmdrasjerte tabletter, kodet 543 på den ene siden og 80 på den andre. De leveres som følger:
NDC 0006-0543-31 bruksenhet flasker med 30 stk NDC 0006-0543-54 bruksenhetsflasker med 90 stk.
Oppbevaring
Oppbevares mellom 5-30°C (41-86°F).
1National Cholesterol Education Program (NCEP): Høydepunkter i rapporten fra ekspertpanelet om blodkolesterolnivåer hos barn og unge. Pediatri. 89(3):495-501. 1992.
Produsert av: Merck Sharp & Dohme Ltd. Cramlington, Northumberland, Storbritannia NE23 3JU. Revidert: september 2020
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
de kontrollerte kliniske studiene før markedsføring og deres åpne utvidelser (2 423 pasienter med median oppfølgingsvarighet på ca. 18 måneder), ble 1,4 % av pasientene seponert på grunn av bivirkninger. De vanligste bivirkningene som førte til seponering av behandlingen var: gastrointestinale lidelser (0,5 %), myalgi (0,1 %) og artralgi (0,1 %). De hyppigst rapporterte bivirkningene (insidens ≥5 %) i simvastatinkontrollerte kliniske studier var: øvre luftveisinfeksjoner (9,0 %), hodepine (7,4 %), magesmerter (7,3 %), forstoppelse (6,6 %) og kvalme (5,4 %). %).
Skandinavisk Simvastatin Survival Study
I 4S som involverer 4444 (aldersspenn 35-71 år, 19% kvinner, 100% kaukasiere) behandlet med 20-40 mg/dag ZOCOR (n=2221) eller placebo (n=2223) over en median på 5,4 år, uønsket Reaksjoner rapportert hos ≥2 % av pasientene og med en høyere rate enn placebo er vist i tabell 2.
Hjertevernstudie
Heart Protection Study (HPS), som involverte 20 536 pasienter (aldersgruppe 40-80 år, 25 % kvinner, 97 % kaukasiere, 3 % andre raser) behandlet med ZOCOR 40 mg/dag (n=10,269) eller placebo (n= 10 267) over gjennomsnittlig 5 år ble det kun registrert alvorlige bivirkninger og seponeringer på grunn av eventuelle bivirkninger. Seponeringsfrekvensen på grunn av bivirkninger var 4,8 % hos pasienter behandlet med ZOCOR 10 mg sammenlignet med 5,1 % hos pasienter behandlet med placebo. Forekomsten av myopati/rabdomyolyse var
Andre kliniske studier
en klinisk studie der 12 064 pasienter med hjerteinfarkt i anamnesen ble behandlet med ZOCOR (gjennomsnittlig oppfølging 6,7 år), var forekomsten av myopati (definert som uforklarlig muskelsvakhet eller smerte med en serumkreatinkinase [CK] >10 ganger) øvre normalgrense [ULN]) hos pasienter på 80 mg/dag var omtrent 0,9 % sammenlignet med 0,02 % for pasienter på 20 mg/dag. Forekomsten av rabdomyolyse (definert som myopati med en CK >40 ganger ULN) hos pasienter på 80 mg/dag var omtrent 0,4 % sammenlignet med 0 % for pasienter på 20 mg/dag. Forekomsten av myopati, inkludert rabdomyolyse, var høyest i løpet av det første året og reduserte deretter spesielt i løpet av de påfølgende årene med behandling. I denne studien ble pasientene nøye overvåket og noen interagerende legemidler ble ekskludert.
Andre bivirkninger rapportert i kliniske studier var: diaré, utslett, dyspepsi, flatulens og asteni.
Laboratorietester
Markerte vedvarende økninger av levertransaminaser er observert [se ADVARSLER OG FORHOLDSREGLER ]. Forhøyet alkalisk fosfatase og y-glutamyl transpeptidase er også rapportert. Omtrent 5 % av pasientene hadde forhøyede CK-nivåer på 3 eller flere ganger normalverdien ved en eller flere anledninger. Dette skyldtes den ikke-hjerte-fraksjonen av CK. [se ADVARSLER OG FORHOLDSREGLER ]
Ungdomspasienter (alder 10–17 år)
I en 48-ukers kontrollert studie med unge gutter og jenter som var minst 1 år etter menarche, 10-17 år (43,4 % kvinner, 97,7 % kaukasiere, 1,7 % latinamerikanere, 0,6 % multirase) med heterozygot familiær hyperkolesterolemi (n=175), behandlet med placebo eller ZOCOR (10-40 mg daglig), de vanligste bivirkningene observert i begge gruppene var øvre luftveisinfeksjon, hodepine, magesmerter og kvalme [se Bruk i spesifikke populasjoner og Kliniske studier ].
Postmarketing-erfaring
Fordi reaksjonene nedenfor rapporteres frivillig fra en populasjon av usikker størrelse, er det generelt ikke mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering. Følgende tilleggsbivirkninger er identifisert under bruk av simvastatin etter godkjenning: kløe, alopecia, en rekke hudforandringer (f.eks. knuter, misfarging, tørr hud/slimhinner, endringer i hår/negler), svimmelhet, muskelkramper, myalgi , pankreatitt, parestesi, perifer nevropati, oppkast, anemi, erektil dysfunksjon, interstitiell lungesykdom, rabdomyolyse, hepatitt/gulsott, fatal og ikke-dødelig leversvikt og depresjon.
Det har vært sjeldne rapporter om immun-mediert nekrotiserende myopati assosiert med statinbruk [se ADVARSLER OG FORHOLDSREGLER ].
Et tilsynelatende overfølsomhetssyndrom er sjelden rapportert som har inkludert noen av følgende trekk: anafylaksi, angioødem, lupus erytematøst-lignende syndrom, polymyalgia rheumatica, dermatomyositis, vaskulitt, purpura, trombocytopeni, leukopeni, hemolytisk anemi, ESR-økning, ANA-filemi, positiv ANA-fil. , leddgikt, artralgi, urticaria, asteni, lysfølsomhet, feber, frysninger, rødme, ubehag, dyspné, toksisk epidermal nekrolyse, erythema multiforme, inkludert Stevens-Johnsons syndrom.
Det har vært sjeldne rapporter etter markedsføring om kognitiv svikt (f.eks. hukommelsestap, glemsomhet, hukommelsestap, hukommelsessvikt, forvirring) assosiert med statinbruk. Disse kognitive problemene er rapportert for alle statiner. Rapportene er generelt ikke-seriøse og reversible ved seponering av statin, med varierende tid til symptomdebut (1 dag til år) og symptomoppløsning (median på 3 uker).
NARKOTIKAHANDEL
Sterke CYP3A4-hemmere, cyklosporin eller danazol
Sterke CYP3A4-hemmere: Simvastatin er, som flere andre hemmere av HMG-CoA-reduktase, et substrat for CYP3A4. Simvastatin metaboliseres av CYP3A4, men har ingen CYP3A4-hemmende aktivitet; derfor forventes det ikke å påvirke plasmakonsentrasjonen av andre legemidler som metaboliseres av CYP3A4.
Forhøyede plasmanivåer av HMG-CoA-reduktasehemmende aktivitet øker risikoen for myopati og rabdomyolyse, spesielt ved høyere doser simvastatin. [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ] Samtidig bruk av legemidler merket som å ha en sterk hemmende effekt på CYP3A4 er kontraindisert [se KONTRAINDIKASJONER ]. Hvis behandling med itrakonazol, ketokonazol, posakonazol, vorikonazol, erytromycin, klaritromycin eller telitromycin er uunngåelig, må behandlingen med simvastatin avbrytes i løpet av behandlingen.
Cyklosporin eller Danazol: Risikoen for myopati, inkludert rabdomyolyse, økes ved samtidig administrering av ciklosporin eller danazol. Derfor er samtidig bruk av disse legemidlene kontraindisert [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Lipidsenkende legemidler som kan forårsake myopati når de gis alene
Gemfibrozil
Kontraindisert med simvastatin [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Andre fibrater
Forsiktighet bør utvises ved forskrivning med simvastatin [se ADVARSLER OG FORHOLDSREGLER ].
Amiodaron, Dronedaron, Ranolazin eller Kalsiumkanalblokkere
Risikoen for myopati, inkludert rabdomyolyse, økes ved samtidig administrering av amiodaron, dronedaron, ranolazin eller kalsiumkanalblokkere som verapamil, diltiazem eller amlodipin [Se DOSERING OG ADMINISTRASJON og ADVARSLER OG FORHOLDSREGLER , og tabell 3 in KLINISK FARMAKOLOGI ].
Niacin
Tilfeller av myopati/rabdomyolyse har blitt observert med simvastatin administrert samtidig med lipidmodifiserende doser (≥1 g/dag niacin) av niacinholdige produkter. Risikoen for myopati er større hos kinesiske pasienter. I en klinisk studie (median oppfølging 3,9 år) som involverte pasienter med høy risiko for kardiovaskulær sykdom og med godt kontrollerte LDL-C-nivåer på simvastatin 40 mg/dag med eller uten ezetimib 10 mg/dag, var det ingen inkrementell fordel på kardiovaskulære utfall med tillegg av lipidmodifiserende doser (≥1 g/dag) av niacin. Samtidig administrering av ZOCOR med lipidmodifiserende doser (≥1 g/dag) av niacin anbefales ikke hos kinesiske pasienter. Det er ukjent om denne risikoen gjelder andre asiatiske pasienter [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Digoksin
I en studie resulterte samtidig administrering av digoksin og simvastatin i en liten økning i digoksinkonsentrasjonen i plasma. Pasienter som tar digoksin bør overvåkes riktig når simvastatin initieres [se KLINISK FARMAKOLOGI ].
Kumarin antikoagulantia
to kliniske studier, en på normale frivillige og den andre hos hyperkolesterolemiske pasienter, forsterket simvastatin 20-40 mg/dag beskjedent effekten av kumarinantikoagulanter: protrombintiden, rapportert som International Normalized Ratio (INR), økte fra en baseline på 1,7 til 1,8 og fra 2,6 til 3,4 i henholdsvis frivillig- og pasientstudiene. Med andre statiner er det rapportert klinisk tydelig blødning og/eller økt protrombintid hos noen få pasienter som tar kumarinantikoagulantia samtidig. Hos slike pasienter bør protrombintiden bestemmes før oppstart av simvastatin og ofte nok under tidlig behandling for å sikre at ingen signifikant endring av protrombintiden oppstår. Når en stabil protrombintid er dokumentert, kan protrombintiden overvåkes med de intervallene som vanligvis anbefales for pasienter på kumarinantikoagulantia. Hvis dosen av simvastatin endres eller seponeres, bør samme prosedyre gjentas. Simvastatinbehandling har ikke vært assosiert med blødning eller med endringer i protrombintid hos pasienter som ikke tar antikoagulantia.
Kolkisin
Tilfeller av myopati, inkludert rabdomyolyse, er rapportert med simvastatin administrert samtidig med kolkisin, og forsiktighet bør utvises ved forskrivning av simvastatin med kolkisin.
Daptomycin
Tilfeller av rabdomyolyse er rapportert med simvastatin administrert med daptomycin. Både simvastatin og daptomycin kan forårsake myopati og rabdomyolyse når de gis alene, og risikoen for myopati og rabdomyolyse kan øke ved samtidig administrering. Utsett ZOCOR midlertidig hos pasienter som tar daptomycin [se ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Myopati/Rabdomyolyse
Simvastatin forårsaker av og til myopati manifestert som muskelsmerter, ømhet eller svakhet med kreatinkinase (CK) over ti ganger øvre normalgrense (ULN). Myopati tar noen ganger form av rabdomyolyse med eller uten akutt nyresvikt sekundært til myoglobinuri, og sjeldne dødsfall har forekommet. Risikoen for myopati øker ved forhøyede plasmanivåer av simvastatin og simvastatinsyre. Predisponerende faktorer for myopati inkluderer høy alder (≥65 år), kvinnelig kjønn, ukontrollert hypotyreose og nedsatt nyrefunksjon. Kinesiske pasienter kan ha økt risiko for myopati [se Bruk i spesifikke populasjoner ].
Risikoen for myopati, inkludert rabdomyolyse, er doserelatert. en database med kliniske studier der 41 413 pasienter ble behandlet med ZOCOR 10 mg, hvorav 24 747 (omtrent 60 %) ble inkludert i studier med en median oppfølging på minst 4 år, var forekomsten av myopati omtrent 0,03 % og 0,08 % ved henholdsvis 20 og 40 mg/dag. Forekomsten av myopati med 80 mg (0,61 %) var uforholdsmessig høyere enn det som ble observert ved de lavere dosene. I disse studiene ble pasientene nøye overvåket og noen interagerende legemidler ble ekskludert.
en klinisk studie der 12 064 pasienter med hjerteinfarkt i anamnesen ble behandlet med ZOCOR (gjennomsnittlig oppfølging 6,7 år), var forekomsten av myopati (definert som uforklarlig muskelsvakhet eller smerte med en serumkreatinkinase [CK] >10 ganger) øvre normalgrense [ULN]) hos pasienter på 80 mg/dag var omtrent 0,9 % sammenlignet med 0,02 % for pasienter på 20 mg/dag. Forekomsten av rabdomyolyse (definert som myopati med en CK >40 ganger ULN) hos pasienter på 80 mg/dag var omtrent 0,4 % sammenlignet med 0 % for pasienter på 20 mg/dag. Forekomsten av myopati, inkludert rabdomyolyse, var høyest i løpet av det første året og reduserte deretter spesielt i løpet av de påfølgende årene med behandling. I denne studien ble pasientene nøye overvåket og noen interagerende legemidler ble ekskludert.
Risikoen for myopati, inkludert rabdomyolyse, er større hos pasienter på simvastatin 80 mg sammenlignet med andre statinbehandlinger med lignende eller større LDL-C-senkende effekt og sammenlignet med lavere doser simvastatin. Derfor bør dosen på 80 mg ZOCOR kun brukes på innlagte pasienter som har tatt simvastatin 80 mg kronisk (f.eks. i 12 måneder eller mer) uten bevis for muskeltoksisitet [Se DOSERING OG ADMINISTRASJON , Begrenset dosering for 80 mg ]. Hvis imidlertid en pasient som for øyeblikket tolererer 80 mg dosen av ZOCOR må startes med et legemiddel som virker kontraindisert eller assosiert med en dosetak for simvastatin, bør denne pasienten byttes til et alternativt statin med mindre potensiale for medikament-legemiddel interaksjon. Pasienter bør informeres om den økte risikoen for myopati, inkludert rabdomyolyse, og omgående rapportere enhver uforklarlig muskelsmerte, ømhet eller svakhet. Hvis symptomer oppstår, bør behandlingen avbrytes umiddelbart. [se Immun-mediert nekrotiserende myopati ]
Alle pasienter som starter behandling med ZOCOR 20 mg, eller hvis dose av ZOCOR økes, bør informeres om risikoen for myopati, inkludert rabdomyolyse, og informeres om umiddelbart å rapportere uforklarlige muskelsmerter, ømhet eller svakhet, spesielt hvis de er ledsaget av ubehag eller feber hvis muskeltegn. og symptomene vedvarer etter seponering av ZOCOR. ZOCOR-behandling bør avbrytes umiddelbart hvis myopati er diagnostisert eller mistenkt. de fleste tilfeller forsvant muskelsymptomer og CK-økninger når behandlingen ble stoppet umiddelbart. Periodiske CK-bestemmelser kan vurderes hos pasienter som starter behandling med ZOCOR 5 mg eller hvis dose økes, men det er ingen sikkerhet for at slik overvåking vil forhindre myopati.
Mange av pasientene som har utviklet rabdomyolyse under behandling med simvastatin har hatt kompliserte sykehistorier, inkludert nyresvikt, vanligvis som følge av langvarig diabetes mellitus. Slike pasienter fortjener tettere overvåking. ZOCOR-behandling bør seponeres hvis det oppstår markert forhøyede CPK-nivåer eller myopati er diagnostisert eller mistenkt. ZOCOR-behandling bør også midlertidig avbrytes hos enhver pasient som opplever en akutt eller alvorlig tilstand som disponerer for utvikling av nyresvikt sekundært til rabdomyolyse, f.eks. sepsis; hypotensjon; stor operasjon; traume; alvorlige metabolske, endokrine eller elektrolyttforstyrrelser; eller ukontrollert epilepsi.
Narkotikahandel
Risikoen for myopati og rabdomyolyse øker ved forhøyede plasmanivåer av simvastatin og simvastatinsyre. Simvastatin metaboliseres av cytokrom P450 isoform 3A4. Visse legemidler som hemmer denne metabolske veien kan øke plasmanivåene av simvastatin og kan øke risikoen for myopati. Disse inkluderer itrakonazol, ketokonazol, posakonazol, voriconazol, makrolidantibiotika erytromycin og klaritromycin, og ketolidantibiotikum telitromycin, HIV-proteasehemmere, boceprevir, telaprevir, antidepressiva nefazodon, cobicistat-inneholdende juice-produkter, [se produkter som inneholder grapefrukt, KLINISK FARMAKOLOGI ]. Kombinasjon av disse legemidlene med simvastatin er kontraindisert. Hvis korttidsbehandling med sterke CYP3A4-hemmere er uunngåelig, må behandlingen med simvastatin avbrytes i løpet av behandlingen [se KONTRAINDIKASJONER og NARKOTIKAHANDEL ].
Kombinert bruk av simvastatin med gemfibrozil, ciklosporin eller danazol er kontraindisert [se KONTRAINDIKASJONER og NARKOTIKAHANDEL ].
Forsiktighet bør utvises ved forskrivning av andre fibrater med simvastatin, da disse midlene kan forårsake myopati når de gis alene og risikoen øker når de administreres samtidig [se NARKOTIKAHANDEL ].
Tilfeller av myopati, inkludert rabdomyolyse, er rapportert med simvastatin administrert sammen med kolkisin, og forsiktighet bør utvises ved forskrivning av simvastatin med kolkisin [se NARKOTIKAHANDEL ].
Fordelene ved kombinert bruk av simvastatin med følgende legemidler bør veies nøye opp mot den potensielle risikoen ved kombinasjoner: andre lipidsenkende legemidler (fibrater eller, for pasienter med HoFH, lomitapide), amiodaron, dronedaron, verapamil, diltiazem, amlodipin, eller ranolazin [Se DOSERING OG ADMINISTRASJON , NARKOTIKAHANDEL ].
Tilfeller av myopati, inkludert rabdomyolyse, har blitt observert med simvastatin administrert samtidig med lipidmodifiserende doser (≥1 g/dag niacin) av niacinholdige produkter [se NARKOTIKAHANDEL ].
Tilfeller av rabdomyolyse er rapportert med simvastatin administrert med daptomycin. Utsett ZOCOR midlertidig hos pasienter som tar daptomycin [se NARKOTIKAHANDEL ].
Forskrivningsanbefalinger for interagerende midler er oppsummert i tabell 1 [se også DOSERING OG ADMINISTRASJON , NARKOTIKAHANDEL , KLINISK FARMAKOLOGI ].

Immun-mediert nekrotiserende myopati
Det har vært sjeldne rapporter om immunmediert nekrotiserende myopati (IMNM), en autoimmun myopati, assosiert med statinbruk. IMNM er karakterisert ved: proksimal muskelsvakhet og forhøyet serumkreatinkinase, som vedvarer til tross for seponering av statinbehandling; positivt anti-HMG CoA reduktase antistoff; muskelbiopsi som viser nekrotiserende myopati; og forbedring med immunsuppressive midler. Ytterligere nevromuskulær og serologisk testing kan være nødvendig. Behandling med immunsuppressive midler kan være nødvendig. Vurder risikoen for IMNM nøye før oppstart av et annet statin. Hvis behandlingen startes med et annet statin, overvåk for tegn og symptomer på IMNM.
Leverdysfunksjon
Vedvarende økninger (til mer enn 3X ULN) i serumtransaminaser har forekommet ca. 1 % av pasientene som fikk simvastatin i kliniske studier. Når medikamentell behandling ble avbrutt eller avbrutt hos disse pasientene, falt transaminasenivåene vanligvis sakte til nivåer før behandling. Økningene var ikke assosiert med gulsott eller andre kliniske tegn eller symptomer. Det var ingen tegn på overfølsomhet.
I Scandinavian Simvastatin Survival Study (4S) [se Kliniske studier ], antall pasienter med mer enn én transaminaseøkning til >3X ULN, i løpet av studien, var ikke signifikant forskjellig mellom simvastatin- og placebogruppene (14 [0,7 %] vs. 12 [0,6 %]). Forhøyede transaminaser resulterte i seponering av 8 pasienter fra behandling i simvastatingruppen (n=2221) og 5 i placebogruppen (n=2223). Av de 1 986 simvastatinbehandlede pasientene i 4S med normale leverfunksjonstester (LFT) ved baseline, utviklet 8 (0,4 %) påfølgende LFT-økninger til >3X ULN og/eller ble avbrutt på grunn av transaminaseøkninger i løpet av de 5,4 årene (median oppfølging) ) av studien. Blant disse 8 pasientene utviklet 5 i utgangspunktet disse abnormitetene i løpet av det første året. Alle pasientene i denne studien fikk en startdose på 20 mg simvastatin; 37 % ble titrert til 40 mg.
2 kontrollerte kliniske studier med 1 105 pasienter var 12-måneders forekomst av vedvarende hepatisk transaminaseøkning uten hensyn til medikamentforhold 0,9 % og 2,1 % ved henholdsvis 40 og 80 mg doser. Ingen pasienter utviklet vedvarende leverfunksjonsavvik etter de første 6 månedene med behandling med en gitt dose.
Det anbefales at leverfunksjonstester utføres før behandlingsstart, og deretter når det er klinisk indisert. Det har vært sjeldne rapporter etter markedsføring om fatal og ikke-dødelig leversvikt hos pasienter som tar statiner, inkludert simvastatin. Hvis alvorlig leverskade med kliniske symptomer og/eller hyperbilirubinemi eller gulsott oppstår under behandling med ZOCOR 5 mg, avbryt behandlingen umiddelbart. Hvis en alternativ etiologi ikke finnes, må du ikke starte ZOCOR på nytt. Merk at ALT kan komme fra muskler, derfor kan ALT som stiger med CK indikere myopati [se Myopati/Rabdomyolyse ].
Legemidlet bør brukes med forsiktighet hos pasienter som inntar betydelige mengder alkohol og/eller har tidligere hatt leversykdom. Aktive leversykdommer eller uforklarlige transaminaseøkninger er kontraindikasjoner for bruk av simvastatin.
Moderat (mindre enn 3X ULN) økning av serumtransaminaser er rapportert etter behandling med simvastatin. Disse endringene dukket opp kort tid etter oppstart av behandling med simvastatin, var ofte forbigående, ble ikke ledsaget av noen symptomer og krevde ikke avbrudd i behandlingen.
Endokrin funksjon
Økning i HbA1c og fastende serumglukosenivåer er rapportert med HMG-CoA-reduktasehemmere, inkludert ZOCOR.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
en 72-ukers karsinogenitetsstudie ble mus administrert daglige doser av simvastatin på 25, 100 og 400 mg/kg kroppsvekt, noe som resulterte i gjennomsnittlige plasma-legemiddelnivåer ca. 1, 4 og 8 ganger høyere enn gjennomsnittlig humant plasma-legemiddel. nivå, henholdsvis (som total hemmende aktivitet basert på AUC) etter en 80 mg oral dose. Leverkarsinomer var signifikant økt hos høydose kvinner og mellom- og høydose menn med en maksimal forekomst på 90 % hos menn. Forekomsten av adenomer i leveren var signifikant økt hos kvinner med middels og høye doser. Medikamentell behandling økte også forekomsten av lungeadenomer betydelig hos menn og kvinner med middels og høye doser. Adenomer i Harderian-kjertelen (en kjertel i øyet til gnagere) var signifikant høyere hos høydosemus enn hos kontroller. Det ble ikke observert noen tegn på tumorogen effekt ved 25 mg/kg/dag.
en separat 92-ukers karsinogenitetsstudie på mus i doser opp til 25 mg/kg/dag, ble det ikke observert noen tegn på tumorigen effekt (gjennomsnittlige plasmanivåer av legemiddel var 1 ganger høyere enn mennesker gitt 80 mg simvastatin målt ved AUC).
I en toårig studie på rotter med 25 mg/kg/dag, var det en statistisk signifikant økning i forekomsten av follikulære adenomer i skjoldbruskkjertelen hos hunnrotter eksponert for omtrent 11 ganger høyere nivåer av simvastatin enn hos mennesker som fikk 80 mg simvastatin (som målt ved AUC).
En andre toårig karsinogenitetsstudie med rotter med doser på 50 og 100 mg/kg/dag ga hepatocellulære adenomer og karsinomer (i hunnrotter ved begge doser og hos hanner ved 100 mg/kg/dag). Skjoldbruskkjertelfollikulære celleadenomer ble økt hos menn og kvinner ved begge doser; skjoldbruskkjertelfollikulære cellekarsinomer ble økt hos kvinner med 100 mg/kg/dag. Den økte forekomsten av neoplasmer i skjoldbruskkjertelen ser ut til å være i samsvar med funn fra andre statiner. Disse behandlingsnivåene representerte plasmalegemiddelnivåer (AUC) på omtrent 7 og 15 ganger (menn) og 22 og 25 ganger (kvinner) gjennomsnittlig human plasmamedisineksponering etter en daglig dose på 80 milligram.
Ingen tegn på mutagenitet ble observert i en mikrobiell mutagenisitetstest (Ames) med eller uten metabolsk aktivering av rotte- eller muselever. I tillegg ble det ikke observert bevis på skade på genetisk materiale i en in vitro alkalisk elueringsanalyse med rottehepatocytter, en V-79 pattedyrcelle videre mutasjonsstudie, en in vitro kromosomavviksstudie i CHO-celler eller en in vivo kromosomavviksanalyse i benmarg hos mus.
Det var redusert fertilitet hos hannrotter behandlet med simvastatin i 34 uker ved 25 mg/kg kroppsvekt (4 ganger maksimalt humant eksponeringsnivå, basert på AUC, hos pasienter som fikk 80 mg/dag); denne effekten ble imidlertid ikke observert under en påfølgende fertilitetsstudie der simvastatin ble administrert med samme dosenivå til hannrotter i 11 uker (hele spermatogenesesyklusen inkludert epididymal modning). Ingen mikroskopiske endringer ble observert i testiklene til rotter fra noen av studiene. Ved 180 mg/kg/dag, (som gir eksponeringsnivåer 22 ganger høyere enn hos mennesker som tar 80 mg/dag basert på overflateareal, mg/m2), ble degenerasjon av sædrøre (nekrose og tap av spermatogent epitel) observert. Hos hunder var det medikamentrelatert testikkelatrofi, redusert spermatogenese, spermatocytisk degenerasjon og dannelse av gigantiske celler ved 10 mg/kg/dag (omtrent 2 ganger human eksponering, basert på AUC, ved 80 mg/dag). Den kliniske betydningen av disse funnene er uklar.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori X [Se KONTRAINDIKASJONER ]
ZOCOR er kontraindisert hos kvinner som er eller kan bli gravide. Lipidsenkende legemidler gir ingen fordel under graviditet, fordi kolesterol og kolesterolderivater er nødvendige for normal fosterutvikling. Aterosklerose er en kronisk prosess, og seponering av lipidsenkende legemidler under graviditet bør ha liten innvirkning på langsiktige resultater av primær hyperkolesterolemibehandling. Det er ingen tilstrekkelige og godt kontrollerte studier av bruk med ZOCOR under graviditet; Det er imidlertid sjeldne rapporter om medfødte anomalier hos spedbarn som er eksponert for statiner in utero. Dyreproduksjonsstudier av simvastatin hos rotter og kaniner viste ingen tegn på teratogenitet. Serumkolesterol og triglyserider øker under normal graviditet, og kolesterol eller kolesterolderivater er avgjørende for fosterutviklingen. Fordi statiner reduserer kolesterolsyntesen og muligens syntesen av andre biologisk aktive stoffer avledet fra kolesterol, kan ZOCOR forårsake fosterskader når det administreres til en gravid kvinne. Hvis ZOCOR 5mg brukes under graviditet eller hvis pasienten blir gravid mens du tar dette legemidlet, bør pasienten informeres om den potensielle faren for fosteret.
Det er sjeldne rapporter om medfødte anomalier etter intrauterin eksponering for statiner. I en gjennomgang2 av omtrent 100 prospektivt fulgte graviditeter hos kvinner eksponert for simvastatin eller et annet strukturelt beslektet statin, oversteg ikke forekomsten av medfødte anomalier, spontane aborter og fosterdødsfall/dødfødsler det som forventes i den generelle befolkningen. Studien var imidlertid bare i stand til å utelukke en 3- til 4 ganger økt risiko for medfødte anomalier i forhold til bakgrunnsfrekvensen. I 89 % av disse tilfellene ble medikamentell behandling igangsatt før graviditet og ble avbrutt i løpet av første trimester da graviditet ble identifisert.
Simvastatin var ikke teratogent hos rotter eller kaniner ved doser (henholdsvis 25, 10 mg/kg/dag) som resulterte i 3 ganger human eksponering basert på mg/m2 overflateareal. I studier med et annet strukturelt beslektet statin ble det imidlertid observert skjelettmisdannelser hos rotter og mus.
Manson, JM, Freyssinges, C., Ducrocq, MB, Stephenson, WP, Postmarketing Surveillance of Lovastatin and Simvastatin Exposure Under Pregnancy, Reproductive Toxicology, 10(6):439-446, 1996.
Kvinner i fertil alder, som trenger behandling med ZOCOR 5 mg for en lipidforstyrrelse, bør rådes til å bruke effektiv prevensjon. For kvinner som prøver å bli gravide, bør seponering av ZOCOR vurderes. Hvis graviditet oppstår, bør ZOCOR seponeres umiddelbart.
Ammende mødre
Det er ikke kjent om simvastatin skilles ut i morsmelk. Fordi en liten mengde av et annet legemiddel i denne klassen skilles ut i morsmelk og på grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn, bør ikke kvinner som tar simvastatin amme sine spedbarn. Det bør tas en beslutning om å avbryte amming eller avbryte medikamentet, tatt i betraktning stoffets betydning for moren [se KONTRAINDIKASJONER ].
Pediatrisk bruk
Sikkerhet og effektivitet av simvastatin hos pasienter 10-17 år med heterozygot familiær hyperkolesterolemi har blitt evaluert i en kontrollert klinisk studie hos unge gutter og jenter som var minst 1 år etter menarken. Pasienter behandlet med simvastatin hadde en bivirkningsprofil som ligner på pasienter behandlet med placebo. Doser større enn 40 mg er ikke studert i denne populasjonen. I denne begrensede kontrollerte studien var det ingen signifikant effekt på vekst eller kjønnsmodning hos unge gutter eller jenter, eller på menstruasjonssykluslengden hos jenter. [Se DOSERING OG ADMINISTRASJON , BIVIRKNINGER , Kliniske studier ] Kvinner i ungdom bør rådes til passende prevensjonsmetoder mens de er i behandling med simvastatin [se KONTRAINDIKASJONER og Svangerskap ]. Simvastatin er ikke studert hos pasienter yngre enn 10 år, og heller ikke hos premenarkalske jenter.
Geriatrisk bruk
Av de 2 423 pasientene som fikk ZOCOR 5 mg i kliniske fase III-studier og de 10 269 pasientene i hjertebeskyttelsesstudien som fikk ZOCOR 40 mg, var henholdsvis 363 (15 %) og 5 366 (52 %) ≥65 år gamle. I HPS var 615 (6%) ≥75 år. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre personer, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes. Siden høy alder (≥65 år) er en disponerende faktor for myopati, bør ZOCOR forskrives med forsiktighet til eldre. [Se KLINISK FARMAKOLOGI ]
En farmakokinetisk studie med simvastatin viste at gjennomsnittlig plasmanivå av statinaktivitet var ca. 45 % høyere hos eldre pasienter mellom 70-78 år sammenlignet med pasienter mellom 18-30 år. I 4S var 1021 (23%) av 4444 pasienter 65 år eller eldre. Lipidsenkende effekt var minst like stor hos eldre pasienter sammenlignet med yngre pasienter, og ZOCOR reduserte signifikant total dødelighet og CHD-dødelighet hos eldre pasienter med en historie med CHD. I HPS var 52 % av pasientene eldre (4 891 pasienter 65-69 år og 5 806 pasienter 70 år eller eldre). Den relative risikoreduksjonen av CHD-død, ikke-dødelig hjerteinfarkt, koronar og ikke-koronar revaskulariseringsprosedyrer og hjerneslag var lik hos eldre og yngre pasienter [se Kliniske studier ]. I HPS, blant 32 145 pasienter som gikk inn i den aktive innkjøringsperioden, var det 2 tilfeller av myopati/rabdomyolyse; disse pasientene var i alderen 67 og 73. Av de 7 tilfellene av myopati/rabdomyolyse blant 10 269 pasienter tildelt simvastatin, var 4 i alderen 65 år eller eldre (ved baseline), hvorav en var over 75. Det var ingen generelle forskjeller i sikkerhet mellom eldre og yngre pasienter i enten 4S eller HPS.
Fordi høy alder (≥65 år) er en disponerende faktor for myopati, inkludert rabdomyolyse, bør ZOCOR 40 mg forskrives med forsiktighet til eldre. I en klinisk studie med pasienter behandlet med simvastatin 80 mg/dag, hadde pasienter ≥65 år en økt risiko for myopati, inkludert rabdomyolyse, sammenlignet med pasienter ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ]
Nedsatt nyrefunksjon
Forsiktighet bør utvises når ZOCOR 20 mg gis til pasienter med alvorlig nedsatt nyrefunksjon.[Se DOSERING OG ADMINISTRASJON ]
Nedsatt leverfunksjon
ZOCOR 10mg er kontraindisert hos pasienter med aktiv leversykdom som kan inkludere uforklarlige vedvarende økninger i levertransaminasenivåer [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
kinesiske pasienter
I en klinisk studie der pasienter med høy risiko for kardiovaskulær sykdom ble behandlet med simvastatin 40 mg/dag (median oppfølging 3,9 år), var forekomsten av myopati ca. 0,05 % for ikke-kinesiske pasienter (n=7367) sammenlignet med 0,24 % for kinesiske pasienter (n=5468). Forekomsten av myopati for kinesiske pasienter på simvastatin 40 mg/dag eller ezetimib/simvastatin 10/40 mg/dag samtidig administrert med niacin med forlenget frigivelse 2 g/dag var 1,24 %.
Kinesiske pasienter kan ha høyere risiko for myopati, overvåk pasienter på riktig måte. Samtidig administrering av ZOCOR 10mg med lipidmodifiserende doser (≥1 g/dag niacin) av niacinholdige produkter anbefales ikke til kinesiske pasienter [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL ].
OVERDOSE
Signifikant dødelighet ble observert hos mus etter en enkelt oral dose på 9 g/m2. Ingen tegn på dødelighet ble observert hos rotter eller hunder behandlet med doser på henholdsvis 30 og 100 g/m2. Ingen spesifikke diagnostiske tegn ble observert hos gnagere. Ved disse dosene var de eneste tegnene som ble sett hos hunder brekninger og slimete avføring.
Noen få tilfeller av overdosering med ZOCOR er rapportert; den maksimale dosen som ble tatt var 3,6 g. Alle pasientene ble friske uten følgetilstander. Støttende tiltak bør tas i tilfelle overdose. Dialyserbarheten til simvastatin og dets metabolitter hos mennesker er foreløpig ikke kjent.
KONTRAINDIKASJONER
ZOCOR 40 mg er kontraindisert under følgende forhold:
- . Samtidig administrering av sterke CYP3A4-hemmere (f.eks. itrakonazol, ketokonazol, posakonazol, voriconazol, HIV-proteasehemmere, boceprevir, telaprevir, erytromycin, klaritromycin, telitromycin, nefazodon og kobicistatholdige produkter) ADVARSLER OG FORHOLDSREGLER ]. . Samtidig administrering av gemfibrozil, ciklosporin eller danazol [se ADVARSLER OG FORHOLDSREGLER ]. . Overfølsomhet overfor noen komponent i denne medisinen [se BIVIRKNINGER ]. . Aktiv leversykdom, som kan inkludere uforklarlige vedvarende økninger i hepatiske transaminasenivåer [se ADVARSLER OG FORHOLDSREGLER ]. . Kvinner som er gravide eller kan bli gravide. Serumkolesterol og triglyserider øker under normal graviditet, og kolesterol eller kolesterolderivater er avgjørende for fosterutviklingen. Fordi HMG-CoA-reduktasehemmere (statiner) reduserer kolesterolsyntesen og muligens syntesen av andre biologisk aktive stoffer avledet fra kolesterol, kan ZOCOR 40mg forårsake fosterskader når det administreres til en gravid kvinne. Aterosklerose er en kronisk prosess og seponering av lipidsenkende legemidler under graviditet bør ha liten innvirkning på resultatet av langtidsbehandling av primær hyperkolesterolemi. Det er ingen tilstrekkelige og godt kontrollerte studier av bruk med ZOCOR under graviditet; Imidlertid ble det i sjeldne rapporter observert medfødte anomalier etter intrauterin eksponering for statiner. I reproduksjonsstudier på rotter og kaniner avslørte simvastatin ingen tegn på teratogenitet. ZOCOR skal kun gis til kvinner i fertil alder når det er svært lite sannsynlig at slike pasienter blir gravide. Hvis pasienten blir gravid mens du tar dette legemidlet, bør ZOCOR seponeres umiddelbart og pasienten skal informeres om den potensielle faren for fosteret [se Bruk i spesifikke populasjoner ]. . Ammende mødre. Det er ikke kjent om simvastatin skilles ut i morsmelk; imidlertid går en liten mengde av et annet legemiddel i denne klassen over i morsmelk. Fordi statiner har potensial for alvorlige bivirkninger hos ammende spedbarn, bør kvinner som trenger behandling med ZOCOR ikke amme sine spedbarn [se Bruk i spesifikke populasjoner ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Simvastatin er et prodrug og hydrolyseres til sin aktive β-hydroksysyreform, simvastatinsyre, etter administrering. Simvastatin er en spesifikk hemmer av 3-hydroksy-3-metylglutaryl-koenzym A (HMG-CoA) reduktase, enzymet som katalyserer omdannelsen av HMG-CoA til mevalonat, et tidlig og hastighetsbegrensende trinn i biosynteseveien for kolesterol. I tillegg reduserer simvastatin VLDL og TG og øker HDL-C.
Farmakodynamikk
Epidemiologiske studier har vist at forhøyede nivåer av total-C, LDL-C, samt reduserte nivåer av HDL-C er assosiert med utvikling av aterosklerose og økt kardiovaskulær risiko. Senking av LDL-C reduserer denne risikoen. Den uavhengige effekten av å øke HDL-C eller senke TG på risikoen for koronar og kardiovaskulær sykelighet og dødelighet er imidlertid ikke bestemt.
Farmakokinetikk
Simvastatin er et lakton som lett hydrolyseres in vivo til den tilsvarende β-hydroksysyren, en potent hemmer av HMG-CoA-reduktase. Hemming av HMG-CoA-reduktase er grunnlaget for en analyse i farmakokinetiske studier av β-hydroksysyremetabolitter (aktive hemmere) og, etter basehydrolyse, aktive pluss latente inhibitorer (totale hemmere) i plasma etter administrering av simvastatin.
Etter en oral dose av 14C-merket simvastatin til mennesker ble 13 % av dosen utskilt i urin og 60 % i feces. Plasmakonsentrasjoner av total radioaktivitet (simvastatin pluss 14C-metabolitter) nådde en topp etter 4 timer og sank raskt til ca. 10 % av topp 12 timer etter dosering. Siden simvastatin gjennomgår omfattende førstegangsekstraksjon i leveren, er tilgjengeligheten av legemidlet til den generelle sirkulasjonen lav (
Både simvastatin og dets β-hydroksysyremetabolitt er sterkt bundet (omtrent 95 %) til humane plasmaproteiner. Rottestudier indikerer at når radiomerket simvastatin ble administrert, krysset simvastatinderivert radioaktivitet blod-hjerne-barrieren.
De viktigste aktive metabolittene av simvastatin som finnes i humant plasma er β-hydroksysyren til simvastatin og dets 6'-hydroksy-, 6'-hydroksymetyl- og 6'-eksometylenderivater. Maksimal plasmakonsentrasjon av både aktive og totale hemmere ble oppnådd innen 1,3 til 2,4 timer etter dosering. Mens det anbefalte terapeutiske doseområdet er 5 til 40 mg/dag, var det ingen vesentlig avvik fra lineariteten til AUC for inhibitorer i den generelle sirkulasjonen med en doseøkning til så høy som 120 mg. I forhold til fastetilstanden ble plasmaprofilen til inhibitorer ikke påvirket når simvastatin ble administrert rett før en American Heart Association anbefalte fettfattig måltid.
en studie inkludert 16 eldre pasienter mellom 70 og 78 år som fikk ZOCOR 40 mg/dag, ble gjennomsnittlig plasmanivå av HMG-CoA-reduktasehemmende aktivitet økt med ca. 45 % sammenlignet med 18 pasienter mellom 18-30 år. Erfaring fra kliniske studier hos eldre (n=1522) tyder på at det ikke var noen generelle forskjeller i sikkerhet mellom eldre og yngre pasienter [se Bruk i spesifikke populasjoner ].
Kinetiske studier med et annet statin, som har en lignende hovedvei for eliminering, har antydet at for et gitt dosenivå kan høyere systemisk eksponering oppnås hos pasienter med alvorlig nyreinsuffisiens (målt ved kreatininclearance).
Simvastatinsyre er et substrat for transportproteinet OATP1B1. Samtidig administrering av legemidler som er hemmere av transportproteinet OATP1B1 kan føre til økte plasmakonsentrasjoner av simvastatinsyre og økt risiko for myopati. For eksempel har ciklosporin vist seg å øke AUC for statiner; Selv om mekanismen ikke er fullt ut forstått, er økningen i AUC for simvastatinsyre antagelig delvis på grunn av hemming av CYP3A4 og/eller OATP1B1.
Risikoen for myopati øker ved høye nivåer av HMG-CoA-reduktasehemmende aktivitet i plasma. Hemmere av CYP3A4 kan øke plasmanivåene av HMG-CoA-reduktasehemmende aktivitet og øke risikoen for myopati [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ].
en studie med 12 friske frivillige hadde simvastatin i 80 mg dose ingen effekt på metabolismen av probe cytokrom P450 isoform 3A4 (CYP3A4) substratene midazolam og erytromycin. Dette indikerer at simvastatin ikke er en hemmer av CYP3A4, og derfor forventes det ikke å påvirke plasmanivåene av andre legemidler som metaboliseres av CYP3A4.
Samtidig administrering av simvastatin (40 mg daglig i 10 dager) resulterte i en økning i de maksimale gjennomsnittlige nivåene av kardioaktivt digoksin (gitt som en enkeltdose på 0,4 mg på dag 10) med ca. 0,3 ng/ml.
Dyretoksikologi og/eller farmakologi
CNS toksisitet
Synsnervedegenerasjon ble sett hos klinisk normale hunder behandlet med simvastatin i 14 uker ved 180 mg/kg/dag, en dose som ga gjennomsnittlige plasmanivåer av medikamenter om lag 12 ganger høyere enn gjennomsnittlig plasmalegemiddelnivå hos mennesker som tok 80 mg/dag.
Et kjemisk likt medikament i denne klassen produserte også degenerasjon av synsnerven (Wallerian degenerasjon av retinogene fibre) hos klinisk normale hunder på en doseavhengig måte som startet ved 60 mg/kg/dag, en dose som ga gjennomsnittlige plasmanivåer av medikamenter omtrent 30 ganger høyere. enn det gjennomsnittlige plasmamedikamentnivået hos mennesker som tar den høyeste anbefalte dosen (målt ved total enzymhemmende aktivitet). Det samme medikamentet produserte også vestibulocochleær Wallerian-lignende degenerasjon og retinal ganglioncellekromatolyse hos hunder behandlet i 14 uker med 180 mg/kg/dag, en dose som resulterte i et gjennomsnittlig plasmamedikamentnivå tilsvarende det som ble sett med 60 mg/kg/ dagsdose.
CNS vaskulære lesjoner, karakterisert ved perivaskulær blødning og ødem, mononukleær celleinfiltrasjon av perivaskulær rom, perivaskulær fibrinavleiring og nekrose av små kar ble sett hos hunder behandlet med simvastatin i en dose på 360 mg/kg/dag, en dose som ga gjennomsnittlig plasma medikamentnivåer som var omtrent 14 ganger høyere enn gjennomsnittlige plasmanivåer av legemiddel hos mennesker som tok 80 mg/dag. Lignende CNS vaskulære lesjoner er observert med flere andre legemidler av denne klassen.
Det var grå stær hos hunnrotter etter to års behandling med 50 og 100 mg/kg/dag (henholdsvis 22 og 25 ganger human AUC ved 80 mg/dag) og hos hunder etter tre måneder ved 90 mg/kg/dag ( 19 ganger) og etter to år ved 50 mg/kg/dag (5 ganger).
Kliniske studier
Kliniske studier hos voksne
Reduksjoner i risiko for CHD-dødelighet og kardiovaskulære hendelser
4S ble effekten av behandling med ZOCOR 20 mg på total dødelighet vurdert hos 4444 pasienter med CHD og totalkolesterol ved baseline 212-309 mg/dL (5,5-8,0 mmol/L). I denne multisenter, randomiserte, dobbeltblinde, placebokontrollerte studien ble pasientene behandlet med standardbehandling, inkludert diett, og enten ZOCOR 20-40 mg/dag (n=2221) eller placebo (n=2223) i median varighet på 5,4 år. I løpet av studien førte behandling med ZOCOR til gjennomsnittlige reduksjoner i total-C, LDL-C og TG på henholdsvis 25 %, 35 % og 10 %, og en gjennomsnittlig økning i HDL-C på 8 %. ZOCOR reduserte risikoen for dødelighet signifikant med 30 % (p=0,0003, 182 dødsfall i ZOCOR 40 mg-gruppen mot 256 dødsfall i placebogruppen). Risikoen for CHD-dødelighet ble signifikant redusert med 42 % (p=0,00001, 111 vs. 189 dødsfall). Det var ingen statistisk signifikant forskjell mellom gruppene i ikke-kardiovaskulær dødelighet. ZOCOR reduserte risikoen for å ha alvorlige koronare hendelser (CHD-dødelighet pluss sykehusverifisert og stille ikke-dødelig hjerteinfarkt [MI]) med 34 % (p
Hjertebeskyttelsesstudien (HPS) var en stor, multisenter, placebokontrollert, dobbeltblind studie med en gjennomsnittlig varighet på 5 år utført på 20 536 pasienter (10 269 på ZOCOR 40 mg og 10 267 på placebo). Pasienter ble allokert til behandling ved bruk av en kovariat adaptiv metode3 som tok hensyn til fordelingen av 10 viktige grunnlinjekarakteristikker for pasienter som allerede var registrert og minimerte ubalansen mellom disse egenskapene på tvers av gruppene. Pasientene hadde en gjennomsnittsalder på 64 år (spredning 40-80 år), var 97 % kaukasiske og hadde høy risiko for å utvikle en alvorlig koronarhendelse på grunn av eksisterende CHD (65 %), diabetes (type 2, 26 %; Type 1 , 3 %), historie med hjerneslag eller annen cerebrovaskulær sykdom (16 %), perifer karsykdom (33 %) eller hypertensjon hos menn ≥65 år (6 %). Ved baseline hadde 3 421 pasienter (17 %) LDL-C-nivåer under 100 mg/dL, hvorav 953 (5 %) hadde LDL-C-nivåer under 80 mg/dL; 7 068 pasienter (34 %) hadde nivåer mellom 100 og 130 mg/dL; og 10 047 pasienter (49 %) hadde nivåer høyere enn 130 mg/dL.
DR Taves, Minimization: en ny metode for å tilordne pasienter til behandlings- og kontrollgrupper. Clin. Pharmacol. Ther. 15 (1974), s. 443-453
HPS-resultatene viste at ZOCOR 40 mg/dag signifikant reduserte: total- og CHD-dødelighet; ikke-dødelige hjerteinfarkt, hjerneslag og revaskulariseringsprosedyrer (koronar og ikke-koronar) (se tabell 4).
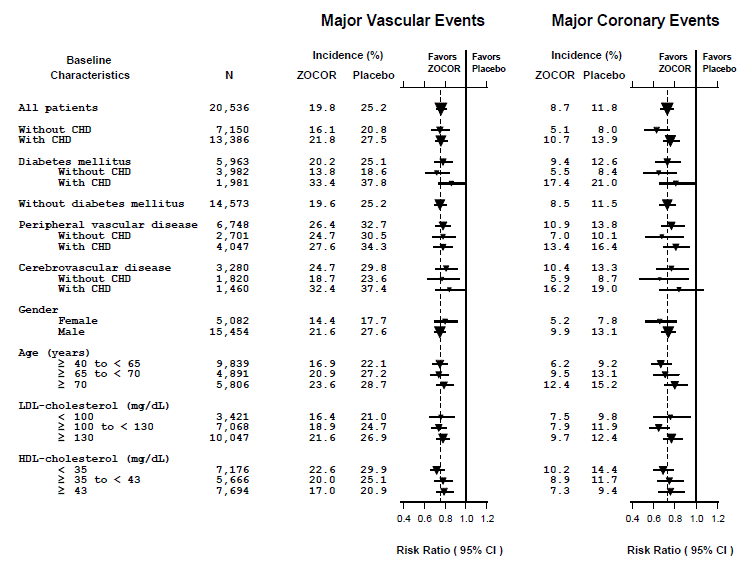
To sammensatte endepunkter ble definert for å ha tilstrekkelige hendelser til å vurdere relativ risikoreduksjon på tvers av en rekke grunnlinjekarakteristikker (se figur 1). En sammensetning av store koronare hendelser (MCE) besto av CHD-dødelighet og ikke-dødelig MI (analysert etter tid til første hendelse; 898 pasienter behandlet med ZOCOR 5 mg hadde hendelser og 1 212 pasienter på placebo hadde hendelser). En sammensetning av store vaskulære hendelser (MVE) besto av MCE, slag og revaskulariseringsprosedyrer inkludert koronare, perifere og andre ikke-koronare prosedyrer (analysert etter tid til første hendelse; 2 033 pasienter behandlet med ZOCOR 10 mg hadde hendelser og 2 585 pasienter på placebo hadde hendelser). Signifikante relative risikoreduksjoner ble observert for begge sammensatte endepunktene (27 % for MCE og 24 % for MVE, p
Figur 1 Effektene av behandling med ZOCOR 5mg på store vaskulære hendelser og store koronare hendelser i HPS
Angiografiske studier
I Multicenter Anti-Atheroma Study ble effekten av simvastatin på aterosklerose vurdert ved kvantitativ koronar angiografi hos hyperkolesterolemiske pasienter med CHD. I denne randomiserte, dobbeltblinde, kontrollerte studien ble pasientene behandlet med simvastatin 20 mg/dag eller placebo. Angiogrammer ble evaluert ved baseline, to og fire år. De co-primære studienes endepunkt var gjennomsnittlig endring per pasient i minimums- og gjennomsnittlig lumendiameter, noe som indikerer henholdsvis fokal og diffus sykdom. ZOCOR bremset signifikant progresjon av lesjoner målt i år 4-angiogrammet ved begge parametere, så vel som ved endring i prosentvis diameterstenose. I tillegg reduserte simvastatin andelen pasienter med nye lesjoner og med nye totale okklusjoner signifikant.
Modifikasjoner av lipidprofiler
Primær hyperlipidemi (Fredrickson type lla og llb)
ZOCOR har vist seg å være effektiv for å redusere total-C og LDL-C i heterozygote familiære og ikke-familiære former for hyperlipidemi og ved blandet hyperlipidemi. Maksimal til nesten maksimal respons oppnås vanligvis innen 4-6 uker og opprettholdes under kronisk behandling. ZOCOR reduserte total-C, LDL-C, total-C/HDL-C ratio og LDL-C/HDL-C ratio betydelig; ZOCOR reduserte også TG og økte HDL-C (se tabell 5).
Hypertriglyseridemi (Fredrickson Type lV)
Resultatene av en undergruppeanalyse hos 74 pasienter med type lV hyperlipidemi fra en 130 pasienter, dobbeltblind, placebokontrollert, 3-perioders crossover-studie er presentert i tabell 6.
Dysbetalipoproteinemi (Fredrickson Type III)
Resultatene av en undergruppeanalyse hos 7 pasienter med type lll hyperlipidemi (dysbetalipoproteinemi) (apo E2/2) (VLDL-C/TG>0,25) fra en 130 pasienter, dobbeltblind, placebokontrollert, 3-perioders crossover-studie er presentert i tabell 7.
Homozygot familiær hyperkolesterolemi
I en kontrollert klinisk studie fikk 12 pasienter i alderen 15-39 år med homozygot familiær hyperkolesterolemi simvastatin 40 mg/dag i en enkeltdose eller i 3 oppdelte doser, eller 80 mg/dag i 3 oppdelte doser. Hos 11 pasienter med reduksjoner i LDL-C var gjennomsnittlige LDL-C-endringer for 40 og 80 mg doser 14 % (område 8 % til 23 %, median 12 %) og 30 % (område 14 % til 46 % , henholdsvis median 29 %). En pasient hadde en økning på 15 % i LDL-C. En annen pasient med manglende LDL-C-reseptorfunksjon hadde en LDL-C-reduksjon på 41 % med dosen på 80 mg.
Endokrin funksjon
kliniske studier svekket ikke simvastatin binyrereserven eller reduserte den basale plasmakortisolkonsentrasjonen signifikant. Små reduksjoner fra baseline i basalt plasmatestosteron hos menn ble observert i kliniske studier med simvastatin, en effekt som også ble observert med andre statiner og gallesyrebinderen kolestyramin. Det var ingen effekt på plasmagonadotropinnivåer. I en placebokontrollert, 12-ukers studie var det ingen signifikant effekt av simvastatin 80 mg på plasmatestosteronresponsen på humant koriongonadotropin. I en annen 24-ukers studie hadde simvastatin 20-40 mg ingen påvisbar effekt på spermatogenesen. I 4S, der 4444 pasienter ble randomisert til simvastatin 20-40 mg/dag eller placebo i en median varighet på 5,4 år, var forekomsten av seksuelle bivirkninger hos menn i de to behandlingsgruppene ikke signifikant forskjellig. På grunn av disse faktorene er det usannsynlig at de små endringene i plasmatestosteron er klinisk signifikante. Eventuelle effekter på hypofyse-gonadeaksen hos pre-menopausale kvinner er ukjent.
Kliniske studier hos ungdom
I en dobbeltblind, placebokontrollert studie ble 175 pasienter (99 ungdomsgutter og 76 postmenarkale jenter) 10-17 år (gjennomsnittsalder 14,1 år) med heterozygot familiær hyperkolesterolemi (HeFH) randomisert til simvastatin (n= 106) eller placebo (n=67) i 24 uker (basisstudie). Inkludering i studien krevde et baseline LDL-C-nivå mellom 160 og 400 mg/dL og minst én forelder med et LDL-C-nivå >189 mg/dL. Doseringen av simvastatin (en gang daglig om kvelden) var 10 mg de første 8 ukene, 20 mg de andre 8 ukene og 40 mg deretter. I en 24-ukers forlengelse valgte 144 pasienter å fortsette behandlingen med simvastatin 40 mg eller placebo.
ZOCOR 20 mg reduserte plasmanivåene av total-C, LDL-C og Apo B signifikant (se tabell 8). Resultatene fra utvidelsen etter 48 uker var sammenlignbare med de som ble observert i basisstudien.
Etter 24 ukers behandling var gjennomsnittlig oppnådd LDL-C-verdi 124,9 mg/dL (område: 64,0289,0 mg/dL) i ZOCOR 40 mg-gruppen sammenlignet med 207,8 mg/dL (område: 128,0-334,0 mg/dL) i placebogruppen.
Sikkerhet og effekt av doser over 40 mg daglig er ikke studert hos barn med HeFH. Den langsiktige effekten av simvastatinbehandling i barndommen for å redusere sykelighet og dødelighet i voksen alder er ikke fastslått.
PASIENTINFORMASJON
Pasienter bør rådes til å følge deres anbefalte kosthold for kolesterolutdanningsprogram (NCEP), et regelmessig treningsprogram og periodisk testing av et fastende lipidpanel.
Pasienter bør informeres om stoffer de ikke bør ta samtidig med simvastatin [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ]. Pasienter bør også rådes til å informere annet helsepersonell som forskriver en ny medisin eller øker dosen av en eksisterende medisin om at de tar ZOCOR.
Muskelsmerte
Alle pasienter som starter behandling med ZOCOR bør informeres om risikoen for myopati, inkludert rabdomyolyse, og fortelles om umiddelbart å rapportere enhver uforklarlig muskelsmerte, ømhet eller svakhet, spesielt hvis de er ledsaget av ubehag eller feber eller hvis disse muskeltegnene eller symptomene vedvarer etter seponering av ZOCOR. Pasienter som bruker 80 mg dosen bør informeres om at risikoen for myopati, inkludert rabdomyolyse, øker ved bruk av 80 mg dosen. Risikoen for myopati, inkludert rabdomyolyse, som oppstår ved bruk av ZOCOR 40 mg øker når du tar visse typer medisiner eller inntar grapefruktjuice. Pasienter bør diskutere all medisin, både reseptbelagt og reseptfri, med helsepersonell.
Leverenzymer
Det anbefales at leverfunksjonstester utføres før initiering av ZOCOR 20 mg, og deretter når det er klinisk indisert. Alle pasienter som behandles med ZOCOR bør rådes til å rapportere omgående alle symptomer som kan indikere leverskade, inkludert tretthet, anoreksi, ubehag i øvre høyre del av magen, mørk urin eller gulsott.
Svangerskap
Kvinner i fertil alder bør rådes til å bruke en effektiv prevensjonsmetode for å forhindre graviditet mens de bruker ZOCOR. Diskuter fremtidige graviditetsplaner med pasientene dine, og diskuter når de skal slutte å ta ZOCOR 40 mg hvis de prøver å bli gravide. Pasienter bør informeres om at hvis de blir gravide, bør de slutte å ta ZOCOR og ringe helsepersonell.
Amming
Kvinner som ammer bør ikke bruke ZOCOR. Pasienter som har en lipidforstyrrelse og ammer bør rådes til å diskutere alternativene med helsepersonell.
