Antibakterielle legemidler: Bactrim 400/80mg, 800/160mg Trimethoprim Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Merkenavn: Bactrim
Generisk navn: sulfametoksazol og trimetoprim injeksjon for intravenøs infusjon
Hva er Bactrim 800mg?
Bactrim (sulfametoksazol og trimetoprim) DS er en kombinasjon av to antibiotika som brukes til å behandle urinveisinfeksjoner, akutt mellomørebetennelse, bronkitt, Shigellose, Pneumocystis lungebetennelse, reisediaré, meticillin-resistente Staphylococcus aureus og andre bakterier (MRSA), infeksjoner som er mottakelige for dette antibiotikumet.
Hva er bivirkninger av Bactrim?
Vanlige bivirkninger av Bactrim inkluderer:
- . tap av Appetit, . kvalme, . oppkast, . smertefull eller hoven tunge, . svimmelhet, . spinnende følelse, . ringer i ørene dine, . tretthet, eller . søvnproblemer (søvnløshet).
Fortell legen din dersom du opplever alvorlige bivirkninger av Bactrim 800mg, inkludert:
- . blåmerker eller blødninger, . aplastisk anemi, . gulsott, . levernekrose, . munnsår, . leddsmerter, . alvorlig hudutslett, . kløe, og . sår hals.
BESKRIVELSE
BACTRIM™ (trimetoprim og sulfametoksazol) injeksjon, en steril løsning kun for intravenøs infusjon, er en kombinasjon av sulfametoksazol, et sulfonamid antimikrobielt middel, og trimetoprim, en antibakteriell dihydrofolatreduktasehemmer. Hver 5 ml inneholder 80 mg trimetoprim (16 mg/ml) og 400 mg sulfametoksazol (80 mg/ml) sammensatt med 40 % propylenglykol, 10 % etylalkohol og 0,3 % dietanolamin; 1 % benzylalkohol og 0,1 % natriummetabisulfitt tilsatt som konserveringsmidler, vann til injeksjon og pH justert til ca. 10 med natriumhydroksid.
Trimetoprim er 2,4-diamino-5-(3,4,5-trimetoksybenzyl)pyrimidin. Det er en hvit til lys gul, luktfri, bitter forbindelse med en molekylvekt på 290,3 og følgende strukturformel:
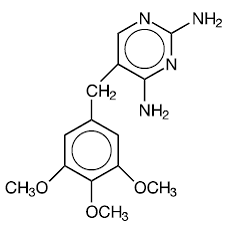
C14H18N4O3 MW 290,3
Sulfametoksazol er N1-(5-metyl-3-isoksazolyl)sulfanilamid. Det er en nesten hvit, luktfri, smakløs forbindelse med en molekylvekt på 253,28 og følgende strukturformel:
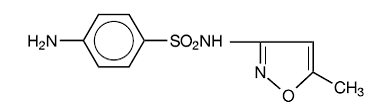
C10H11N3O3S MW 253,28
INDIKASJONER
Pneumocystis jirovecii Lungebetennelse
BACTRIM er indisert for behandling av Pneumocystis jirovecii lungebetennelse hos voksne og pediatriske pasienter to måneder og eldre.
Shigellose
BACTRIM 400 mg er indisert for behandling av enteritt forårsaket av følsomme stammer av Shigella flexneri og Shigella sonnei hos voksne og pediatriske pasienter to måneder og eldre.
Urinveisinfeksjon
BACTRIM er indisert for behandling av alvorlige eller kompliserte urinveisinfeksjoner hos voksne og pediatriske pasienter to måneder og eldre på grunn av følsomme stammer av Escherichia coli, Klebsiella-arter, Enterobacter-arter, Morganella morganii, Proteus mirabilis og Proteus vulgaris ved oral administrering av BACTRIM er ikke mulig og når organismen ikke er mottakelig for antibakterielle midler som er effektive i urinveiene.
Bruk
For å redusere utviklingen av legemiddelresistente bakterier og opprettholde effektiviteten til BACTRIM og andre antibakterielle legemidler, skal BACTRIM kun brukes til å behandle eller forebygge infeksjoner som er bevist eller sterkt mistenkt å være forårsaket av følsomme bakterier. Når kultur- og mottakelighetsinformasjon er tilgjengelig, bør de vurderes ved valg eller modifisering av antibakteriell terapi. I mangel av slike data kan lokal epidemiologi og mottakelighetsmønstre bidra til empirisk valg av terapi.
Selv om passende kultur- og mottakelighetsstudier bør utføres, kan behandlingen startes mens man venter på resultatene fra disse studiene.
DOSERING OG ADMINISTRASJON
Dosering hos voksne og pediatriske pasienter (to måneder og eldre)
Maksimal anbefalt daglig dose er 60 ml (960 mg trimetoprim) per dag.
Doseendringer hos pasienter med nedsatt nyrefunksjon
Når nyrefunksjonen er nedsatt, bør en redusert dose brukes, som vist i tabell 2.
Viktige administrasjonsinstruksjoner
Administrer oppløsningen ved intravenøs infusjon over en periode på 60 til 90 minutter. Unngå administrering ved rask infusjon eller bolusinjeksjon. IKKE administrer BACTRIM 400mg intramuskulært.
Inspiser parenterale legemidler visuelt for partikler og misfarging før administrering, når løsningen og beholderen tillater det.
Fremgangsmåte
Fortynning av enkelt- og flerdoseglass
BACTRIM må fortynnes. Hver 5 mL skal tilsettes 125 mL 5 % dekstrose i vann. Etter fortynning med 5 % dekstrose i vann, bør løsningen ikke oppbevares i kjøleskap og brukes innen 6 timer.
Hvis en fortynning på 5 mL per 100 mL 5 % dekstrose i vann er ønskelig, bør den brukes innen 4 timer. I de tilfellene hvor væskerestriksjon er ønskelig, kan hver 5 ml tilsettes til 75 ml 5 % dekstrose i vann. Under disse omstendighetene bør løsningen blandes rett før bruk og bør administreres innen 2 timer.
Hvis det ved visuell inspeksjon er uklarhet eller tegn på krystallisering etter blanding, bør løsningen kasseres og en fersk løsning tilberedes.
Gjøre IKKE bland Bactrim i 5 % dekstrose i vann med legemidler eller løsninger i samme beholder.
Multiple-dose hetteglass (håndtering)
Etter første innføring i hetteglasset, må det gjenværende innholdet brukes innen 48 timer.
Infusjonssystemer for intravenøs administrasjon
Følgende infusjonssystemer er testet og funnet tilfredsstillende: enhetsdose glassbeholdere; enhetsdosebeholdere av polyvinylklorid og polyolefin. Ingen andre systemer er testet og derfor kan ingen andre anbefales.
HVORDAN LEVERES
Doseringsformer og styrker
BACTRIM er tilgjengelig som en injeksjon som inneholder 80 mg/ml sulfametoksazol og 16 mg/ml trimetoprim i 10 ml enkeltdose- og 30 ml flerdose-hetteglass.
Oppbevaring og håndtering
BACTRIM™ (sulfametoksazol og trimetoprim) injeksjon leveres som følger:
10 ml hetteglass som inneholder 160 mg trimetoprim (16 mg/ml) og 800 mg sulfametoksazol (80 mg/ml) til infusjon med 5 % dekstrose i vann.
10 mL hetteglass: NDC 49708-001-4210 mL hetteglass (eske med 10): NDC 49708-001-45
30-ml hetteglass med flere doser , hver 5 ml inneholder 80 mg trimetoprim (16 mg/ml) og 400 mg sulfametoksazol (80 mg/ml) til infusjon med 5 % dekstrose i vann.
30 mL hetteglass (eske med 1): NDC 49708-002-47
Oppbevares ved romtemperatur (15°C – 30°C eller 59°F – 86°F). IKKE KJØLE.
REFERANSER
1. Winston DJ, Lau WK, Gale RP, Young LS. Trimetoprim-sulfametoksazol for behandling av Pneumocystis carinii lungebetennelse. Ann Intern Med. juni 1980;92:762-769.
Distribuert av: Sun Pharmaceutical Industries, Inc. Cranbury, NJ 08512. Revidert: juli 2020
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet andre steder i merkingen:
- . Embryo-føtal toksisitet [se ADVARSLER OG FORHOLDSREGLER ] . Overfølsomhet og andre dødelige reaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Trombocytopeni [se ADVARSLER OG FORHOLDSREGLER ] . Clostridioides difficile-assosiert diaré [se ADVARSLER OG FORHOLDSREGLER ] . Sulfittfølsomhet [se ADVARSLER OG FORHOLDSREGLER ] . Risiko forbundet med samtidig bruk av Leucovorin for Pneumocystis jirovecii lungebetennelse [se ADVARSLER OG FORHOLDSREGLER ] . Propylenglykol toksisitet [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ] . Infusjonsreaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Hypoglykemi [se ADVARSLER OG FORHOLDSREGLER ] . Elektrolyttavvik [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
De vanligste bivirkningene er gastrointestinale forstyrrelser (kvalme, oppkast og anoreksi) og allergiske hudreaksjoner (som utslett og urticaria).
Lokal reaksjon, smerte og lett irritasjon ved intravenøs (IV) administrering er sjeldne. Tromboflebitt er observert.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av BACTRIM etter godkjenning. Fordi disse reaksjonene ble rapportert frivillig fra en populasjon av usikker størrelse, er det ikke mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering:
- . Trombotisk trombocytopeni purpura . Idiopatisk trombocytopenisk purpura . QT-forlengelse som resulterer i ventrikulær takykardi og torsade de pointes . Metabolsk acidose
NARKOTIKAHANDEL
Potensial for BACTRIM 400mg å påvirke andre legemidler
Trimetoprim er en hemmer av CYP2C8 så vel som OCT2 transportør. Sulfametoksazol er en hemmer av CYP2C9. Unngå samtidig administrering av BACTRIM 80 mg med legemidler som er substrater for CYP2C8 og 2C9 eller OCT2.
Interaksjoner med laboratorie- eller diagnostiske tester
BACTRIM, spesifikt trimetoprim-komponenten, kan interferere med en serummetotreksatanalyse som bestemt av den konkurrerende bindingsproteinteknikken (CBPA) når en bakteriell dihydrofolatreduktase brukes som bindingsprotein. Ingen interferens oppstår imidlertid hvis metotreksat måles med en radioimmunoassay (RIA).
Tilstedeværelsen av BACTRIM kan også forstyrre Jaffes alkaliske piratreaksjonsanalyse for kreatinin, noe som resulterer i overestimeringer på omtrent 10 % i området for normale verdier.
REFERANSER
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Hva klinikere bør vite om QT-intervallet. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Gjennomgang: Dofetilides farmakologi og toksikologi. Int J Med Toxicol. 2001;4(2):16.
5. London NJ, Garg SJ, Moorthy RS, Cunningham ET. Legemiddelindusert uveitt. J Oftalmic Inflamm Infect. 2013;3:43.
6. Marinella MA. Trimetoprim-indusert hyperkalemi: En analyse av rapporterte tilfeller. Gerontol. 1999;45:209-212.
7. Margassery S, Bastani B. Livstruende hyperkalemi og acidose sekundært til behandling med trimetoprimsulfametoksazol. J. Nephrol. 2001;14(5):410-414.
8. Moh R, et al. Hematologiske endringer hos voksne som får et zidovudinholdig HAART-regime i kombinasjon med cotrimoxazol i Elfenbenskysten. Antivir Ther. 2005;10(5):615-24.
9. Kosoglou T, Rocci ML Jr, Vlasses PH. Trimetoprim endrer disposisjonen av prokainamid og nacetylprokainamid. Clin Pharmacol Ther. oktober 1988;44(4):467-77.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Embryo-føtal toksisitet
Noen epidemiologiske studier tyder på at eksponering for BACTRIM under graviditet kan være assosiert med økt risiko for medfødte misdannelser, spesielt nevralrørsdefekter, kardiovaskulære misdannelser, urinveisdefekter, munnspalter og klumpfot. Hvis BACTRIM 400mg brukes under graviditet, eller hvis pasienten blir gravid mens du tar dette legemidlet, bør pasienten informeres om potensielle farer for fosteret [se Bruk i spesifikke populasjoner ].
Overfølsomhet og andre dødelige reaksjoner
Dødsfall forbundet med administrering av sulfonamider har oppstått på grunn av alvorlige reaksjoner, inkludert Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, fulminant levernekrose, agranulocytose, aplastisk anemi og andre bloddyskrasier.
Sulfonamider, inkludert sulfonamidholdige produkter som BACTRIM, bør seponeres ved første opptreden av hudutslett eller tegn på bivirkning. Kliniske tegn, som utslett, sår hals, feber, artralgi, hoste, kortpustethet, blekhet, purpura eller gulsott kan være tidlige indikasjoner på alvorlige reaksjoner. Et hudutslett kan bli fulgt av mer alvorlige reaksjoner, som Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, levernekrose eller alvorlig blodsykdom. Fullstendig blodtelling bør gjøres ofte hos pasienter som får sulfonamider. Hoste, kortpustethet og lungeinfiltrater er overfølsomhetsreaksjoner i luftveiene som er rapportert i forbindelse med sulfonamidbehandling.
Trombocytopeni
BACTRIM-indusert trombocytopeni kan være en immun-mediert lidelse. Alvorlige tilfeller av trombocytopeni som er dødelige eller livstruende er rapportert. Overvåk pasienter for hematologisk toksisitet. Trombocytopeni går vanligvis over innen en uke etter seponering av BACTRIM.
Streptokokkinfeksjoner og revmatisk feber
Unngå bruk av BACTRIM i behandlingen av streptokokkfaryngitt. Kliniske studier har dokumentert at pasienter med gruppe A β-hemolytisk streptokokk tonsillofaryngitt har en større forekomst av bakteriologisk svikt når de behandles med BACTRIM 800 mg enn de pasientene som behandles med penicillin, noe som fremgår av manglende utryddelse av denne organismen fra tonsillopharyngeal området. Derfor vil ikke BACTRIM forhindre følgetilstander som revmatisk feber.
Clostridioides Difficile-assosiert diaré
Clostridioides difficile-assosiert diaré (CDAD) er rapportert ved bruk av nesten alle antibakterielle midler, inkludert BACTRIM 80 mg, og kan variere i alvorlighetsgrad fra mild diaré til fatal kolitt. Behandling med antibakterielle midler endrer normalfloraen i tykktarmen som fører til overvekst av C. difficile.
C. difficile produserer giftstoffer A og B som bidrar til utviklingen av CDAD. Hypertoksinproduserende stammer av C. difficile forårsaker økt sykelighet og dødelighet, da disse infeksjonene kan være motstandsdyktige mot antimikrobiell behandling og kan kreve kolektomi. CDAD må vurderes hos alle pasienter som får diaré etter antibakteriell bruk. Nøye sykehistorie er nødvendig siden CDAD har blitt rapportert å oppstå over to måneder etter administrering av antibakterielle midler.
Hvis CDAD mistenkes eller bekreftes, kan pågående antibakteriell bruk som ikke er rettet mot C. difficile må avbrytes. Hensiktsmessig væske- og elektrolytthåndtering, proteintilskudd, antibakteriell behandling av
C. difficile, og kirurgisk evaluering bør iverksettes som klinisk indisert.
Sulfittfølsomhet
BACTRIM 400mg inneholder natriummetabisulfitt, en sulfitt som kan forårsake allergiske reaksjoner, inkludert anafylaktiske symptomer og livstruende eller mindre alvorlige astmatiske episoder hos visse mottakelige personer. Den generelle prevalensen av sulfittfølsomhet i den generelle befolkningen er ukjent. Sulfittfølsomhet ses oftere hos astmatiske enn hos ikke-astmatiske personer.
Benzylalkoholtoksisitet hos pediatriske pasienter ("Gispesyndrom")
BACTRIM 160mg inneholder benzylalkohol som konserveringsmiddel. Alvorlige og dødelige bivirkninger inkludert "gispende syndrom" kan forekomme hos nyfødte og spedbarn med lav fødselsvekt som behandles med benzylalkoholkonserverte formuleringer i infusjonsløsninger, inkludert BACTRIM. "Gispesyndromet" er preget av depresjon i sentralnervesystemet, metabolsk acidose og gispende respirasjoner. BACTRIM 160mg er kontraindisert hos pediatriske pasienter under to måneder gamle [se KONTRAINDIKASJONER ].
Når du foreskriver BACTRIM 400 mg til pediatriske pasienter (to måneder gamle og eldre), bør du vurdere den kombinerte daglige metabolske belastningen av benzylalkohol fra alle kilder, inkludert BACTRIM (inneholder 10 mg benzylalkohol per ml) og andre legemidler som inneholder benzylalkohol. Minimumsmengden benzylalkohol som kan oppstå alvorlige bivirkninger er ikke kjent [se Bruk i spesifikke populasjoner ].
Risiko forbundet med samtidig bruk av Leucovorin for Pneumocystis jirovecii lungebetennelse
Behandlingssvikt og overdødelighet ble observert når BACTRIM ble brukt samtidig med leucovorin for behandling av HIV-positive pasienter med Pneumocystis jirovecii pneumoni i en randomisert placebokontrollert studie.4 Unngå samtidig administrering av BACTRIM og leucovorin under behandling av Pneumocystis pneumrovecii.
Propylenglykol toksisitet
BACTRIM inneholder propylenglykol som løsemiddel (40 % v/v). Når det administreres i høye doser som for behandling av P. jirovecii pneumoni og samtidig med andre produkter som inneholder propylenglykol, kan hyperosmolaritet med aniongap metabolsk acidose, inkludert laktacidose, forekomme. Propylenglykol-toksisitet kan føre til akutt nyreskade, CNS-toksisitet og multiorgansvikt. Overvåk det totale daglige inntaket av propylenglykol fra alle kilder og for syre-base-forstyrrelser. Seponer BACTRIM 400 mg hvis det er mistanke om toksisitet for propylenglykol [se BIVIRKNINGER ].
Folatmangel
Unngå bruk av BACTRIM 160mg hos pasienter med nedsatt nyre- eller leverfunksjon, hos de med mulig folatmangel (f.eks. eldre, kroniske alkoholikere, pasienter som får krampestillende terapi, pasienter med malabsorpsjonssyndrom og pasienter i underernæringstilstander) og hos de med alvorlige allergier eller bronkial astma.
Hematologiske endringer som indikerer folsyremangel kan forekomme hos eldre pasienter eller hos pasienter med eksisterende folsyremangel eller nyresvikt. Disse effektene er reversible ved folinsyrebehandling [se Bruk i spesifikke populasjoner ].
Hemolyse
Hos personer med mangel på glukose-6-fosfatdehydrogenase kan hemolyse forekomme. Denne reaksjonen er ofte doserelatert.
Infusjonsreaksjoner
Lokal irritasjon og betennelse på grunn av ekstravaskulær infiltrasjon av infusjonen har blitt observert med BACTRIM. Hvis disse skjer, bør infusjonen avbrytes og startes på nytt på et annet sted.
Hypoglykemi
Tilfeller av hypoglykemi hos ikke-diabetespasienter behandlet med BACTRIM 400 mg har blitt sett, vanligvis etter noen dagers behandling. Pasienter med nedsatt nyrefunksjon, leversykdom, underernæring eller de som får høye doser BACTRIM 800 mg er spesielt utsatt.
Nedsatt fenylalaninmetabolisme
Trimetoprim, en komponent i BACTRIM, har vist seg å svekke fenylalaninmetabolismen, men dette har ingen betydning hos fenylketonuriske pasienter med passende diettbegrensninger.
Porfyri og hypotyreose
Som andre legemidler som inneholder sulfonamider, kan BACTRIM utløse porfyriskrise og hypotyreose. Unngå bruk av BACTRIM hos pasienter med porfyri eller skjoldbruskdysfunksjon.
Potensiell risiko ved behandling av Pneumocystis jirovecii lungebetennelse hos pasienter med ervervet immunsviktsyndrom (AIDS)
AIDS-pasienter kan ikke tolerere eller reagere på BACTRIM på samme måte som ikke-AIDS-pasienter. Forekomsten av bivirkninger, spesielt utslett, feber, leukopeni og forhøyede aminotransferase (transaminase) verdier, med BACTRIM-behandling hos AIDS-pasienter som behandles for Pneumocystis jirovecii lungebetennelse er rapportert å være sterkt økt sammenlignet med forekomsten som normalt er forbundet med bruk av BACTRIM 800mg hos ikke-AIDS-pasienter. Hvis en pasient utvikler hudutslett eller tegn på en bivirkning, revurder behandlingen med BACTRIM [se ADVARSLER OG FORHOLDSREGLER ].
Unngå samtidig administrering av BACTRIM 80 mg og leukovorin under behandling av Pneumocystis jirovecii pneumoni [se ADVARSLER OG FORHOLDSREGLER ].
Elektrolyttavvik
Høye doser trimetoprim, som brukt hos pasienter med P. jirovecii pneumoni, induserer en progressiv, men reversibel økning av serumkaliumkonsentrasjoner hos et betydelig antall pasienter. Selv behandling med anbefalte doser kan forårsake hyperkalemi når trimetoprim administreres til pasienter med underliggende forstyrrelser i kaliummetabolismen, med nyreinsuffisiens, eller hvis legemidler som er kjent for å indusere hyperkalemi gis samtidig. Tett overvåking av serumkalium er nødvendig hos disse pasientene.
Alvorlig og symptomatisk hyponatremi kan forekomme hos pasienter som får BACTRIM 800 mg, spesielt for behandling av P. jirovecii pneumoni. Evaluering for hyponatremi og passende korreksjon er nødvendig hos symptomatiske pasienter for å forhindre livstruende komplikasjoner.
Sørg for tilstrekkelig væskeinntak og urinutgang under behandlingen for å forhindre krystalluri. Pasienter som er "langsomme acetylatorer" kan være mer utsatt for idiosynkratiske reaksjoner på sulfonamider.
Overvåking av laboratorietester
Fullstendig blodtelling bør gjøres ofte hos pasienter som får BACTRIM. Seponer BACTRIM 800 mg hvis det observeres en betydelig reduksjon i antallet av dannet blodelement. Utfør urinanalyse med nøye mikroskopisk undersøkelse og nyrefunksjonstester under behandlingen, spesielt for pasienter med nedsatt nyrefunksjon.
Utvikling av medikamentresistente bakterier
Forskrivning av BACTRIM i fravær av en påvist eller sterkt mistenkt bakteriell infeksjon eller en profylaktisk indikasjon vil neppe gi fordeler for pasienten og øker risikoen for utvikling av legemiddelresistente bakterier.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Sulfametoksazol var ikke kreftfremkallende ved vurdering i en 26-ukers tumorogen mus (Tg-rasH2) studie ved doser opp til 400 mg/kg/dag sulfametoksazol; tilsvarende 2 ganger den humane systemiske eksponeringen (ved en daglig dose på 800 mg sulfametoksazol to ganger daglig (to ganger daglig).
Mutagenese
In vitro reversmutasjonsbakterietester i henhold til standardprotokollen er ikke utført med sulfametoksazol og trimetoprim i kombinasjon. En in vitro kromosomavvikstest i humane lymfocytter med sulfametoksazol/trimetoprim var negativ. I in vitro og in vivo tester på dyrearter skadet ikke sulfametoksazol/trimetoprim kromosomene. In vivo mikronukleusanalyser var positive etter oral administrering av sulfametoksazol/trimetoprim. Observasjoner av leukocytter oppnådd fra pasienter behandlet med sulfametoksazol og trimetoprim avslørte ingen kromosomavvik.
Sulfametoksazol alene var positivt i en in vitro revers mutasjonsbakterieanalyse og i in vitro mikronukleusanalyser ved bruk av dyrkede humane lymfocytter.
Trimetoprim alene var negativt i in vitro reversmutasjonsbakterieanalyser og i in vitro kromosomavviksanalyser med eggstokk- eller lungeceller fra kinesisk hamster med eller uten S9-aktivering. In vitro Comet-, mikronukleus- og kromosomskadeanalyser ved bruk av dyrkede humane lymfocytter, var trimetoprim positivt. Hos mus etter oral administrering av trimetoprim ble det ikke registrert DNA-skade i Comet-analyser av lever, nyre, lunge, milt eller benmarg.
Nedsatt fruktbarhet
Ingen uønskede effekter på fertilitet eller generell reproduksjonsevne ble observert hos rotter som fikk orale doser så høye som 350 mg/kg/dag sulfametoksazol pluss 70 mg/kg/dag trimetoprim, doser omtrent to ganger den anbefalte daglige dosen for mennesker på basis av kroppsoverflate. .
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
BACTRIM kan forårsake fosterskader hvis det administreres til en gravid kvinne. Noen epidemiologiske studier tyder på at eksponering for BACTRIM 400 mg under graviditet kan være assosiert med økt risiko for medfødte misdannelser, spesielt nevralrørsdefekter, kardiovaskulære abnormiteter, urinveisdefekter, munnspalter og klumpfot (se Menneskelige data ).
En av 3 rottestudier viste ganespalte ved doser omtrent 5 ganger anbefalt human dose på basis av kroppsoverflate; de andre 2 studiene viste ikke teratogenisitet ved lignende doser. Studier på drektige kaniner viste økt fostertap ved omtrent 6 ganger human dose på basis av kroppsoverflate (se Dyredata ).
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanaborter for den angitte befolkningen er ukjent. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %. Informer gravide kvinner om potensiell skade av BACTRIM 400 mg på fosteret (se Kliniske betraktninger ).
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-/fosterrisiko
Urinveisinfeksjon i svangerskapet er assosiert med uønskede perinatale utfall som for tidlig fødsel, lav fødselsvekt og svangerskapsforgiftning og økt dødelighet hos den gravide kvinnen. P. jirovecii pneumoni i svangerskapet er assosiert med prematur fødsel og økt sykelighet og dødelighet for den gravide. BACTRIM skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Data
Menneskelige data
Selv om det ikke er store, prospektive, godt kontrollerte studier på gravide kvinner og deres babyer, tyder noen retrospektive epidemiologiske studier på en sammenheng mellom første trimester eksponering for BACTRIM 80 mg med økt risiko for medfødte misdannelser, spesielt nevralrørsdefekter, kardiovaskulære abnormiteter, urinveier. luftveisdefekter, munnspalter og klumpfot. Disse studiene var imidlertid begrenset av det lille antallet eksponerte tilfeller og mangelen på justering for flere statistiske sammenligninger og konfoundere. Disse studiene er ytterligere begrenset av tilbakekalling, seleksjon og informasjonsskjevheter, og av begrenset generaliserbarhet av funnene deres. Til slutt varierte utfallsmålene mellom studiene, noe som begrenser sammenligninger på tvers av studier. Alternativt oppdaget ikke andre epidemiologiske studier statistisk signifikante assosiasjoner mellom BACTRIM 160 mg eksponering og spesifikke misdannelser. Brumfitt og Pursell10 rapporterte i en retrospektiv studie utfallet av 186 graviditeter der moren fikk enten placebo eller oral trimetoprim og sulfametoksazol. Forekomsten av medfødte abnormiteter var 4,5 % (3 av 66) hos de som fikk placebo og 3,3 % (4 av 120) hos de som fikk trimetoprim og sulfametoksazol. Det var ingen abnormiteter hos de 10 barna hvis mødre fikk stoffet i løpet av første trimester. I en egen undersøkelse fant Brumfitt og Pursell heller ingen medfødte abnormiteter hos 35 barn hvis mødre hadde fått oral trimetoprim og sulfametoksazol ved unnfangelsen eller kort tid etter.
Dyredata
Hos rotter ga orale doser av enten 533 mg/kg sulfametoksazol eller 200 mg/kg trimetoprim teratologiske effekter som hovedsakelig manifesterte seg som ganespalte. Disse dosene er omtrent 5 og 6 ganger den anbefalte totale daglige dosen for mennesker på basis av kroppsoverflate. I to studier på rotter ble det ikke observert teratologi når 512 mg/kg sulfametoksazol ble brukt i kombinasjon med 128 mg/kg trimetoprim. I noen kaninstudier var en generell økning i fostertap (døde og resorberte konsepter) assosiert med doser av trimetoprim 6 ganger den humane terapeutiske dosen basert på kroppsoverflate.
Amming
Risikosammendrag
Nivåer av BACTRIM i morsmelk er omtrent 2 til 5 % av anbefalt daglig dose for pediatriske pasienter over to måneder. Det er ingen informasjon om effekten av BACTRIM på spedbarn som ammes eller effekten på melkeproduksjonen. På grunn av den potensielle risikoen for bilirubinforskyvning og kernicterus på det ammede barnet [se KONTRAINDIKASJONER ], anbefaler kvinner å unngå amming under behandling med BACTRIM.
Pediatrisk bruk
BACTRIM er kontraindisert hos pediatriske pasienter yngre enn to måneder på grunn av den potensielle risikoen for bilirubinforskyvning og kernicterus [se KONTRAINDIKASJONER ].
Alvorlige bivirkninger inkludert fatale reaksjoner og "gipesyndromet" oppstod hos premature nyfødte og spedbarn med lav fødselsvekt på intensivavdelingen for nyfødte som fikk benzylalkohol som konserveringsmiddel i infusjonsløsninger. I disse tilfellene ga benzylalkoholdoser på 99 til 234 mg/kg/dag høye nivåer av benzylalkohol og dets metabolitter i blod og urin (blodnivåer av benzylalkohol var 0,61 til 1,378 mmol/L). Ytterligere bivirkninger inkluderte gradvis nevrologisk forverring, anfall, intrakraniell blødning, hematologiske abnormiteter, hudnedbrytning, lever- og nyresvikt, hypotensjon, bradykardi og kardiovaskulær kollaps. Premature spedbarn med lav fødselsvekt kan ha større sannsynlighet for å utvikle disse reaksjonene fordi de kan være mindre i stand til å metabolisere benzylalkohol.
Når du foreskriver BACTRIM 800 mg til pediatriske pasienter, bør du vurdere den kombinerte daglige metabolske belastningen av benzylalkohol fra alle kilder, inkludert BACTRIM (BACTRIM 160 mg inneholder 10 mg benzylalkohol per ml) og andre legemidler som inneholder benzylalkohol. Minimumsmengden benzylalkohol som kan oppstå alvorlige bivirkninger er ikke kjent [se ADVARSLER OG FORHOLDSREGLER ].
Geriatrisk bruk
Kliniske studier av BACTRIM inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner.
Det kan være økt risiko for alvorlige bivirkninger hos eldre pasienter, spesielt når det eksisterer kompliserende tilstander, f.eks. nedsatt nyre- og/eller leverfunksjon, eller samtidig bruk av andre legemidler. Alvorlige hudreaksjoner, generalisert benmargssuppresjon [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ], en spesifikk reduksjon i blodplater (med eller uten purpura), og hyperkalemi er de hyppigst rapporterte alvorlige bivirkningene hos eldre pasienter.
Hos de som samtidig får visse diuretika, primært tiazider, er det rapportert en økt forekomst av trombocytopeni med purpura. Økte digoksinnivåer i blodet kan forekomme ved samtidig behandling med BACTRIM 80 mg, spesielt hos eldre pasienter. Serumdigoksinnivåer bør overvåkes [se NARKOTIKAHANDEL ].
Hematologiske endringer som indikerer folsyremangel kan forekomme hos eldre pasienter. Disse effektene er reversible ved behandling med folinsyre. Passende dosejusteringer bør gjøres for pasienter med nedsatt nyrefunksjon, og bruksvarigheten bør være så kort som mulig for å minimere risikoen for uønskede reaksjoner [se DOSERING OG ADMINISTRASJON ].
Trimetoprim-komponenten i BACTRIM kan forårsake hyperkalemi når den administreres til pasienter med underliggende forstyrrelser i kaliummetabolismen, med nyreinsuffisiens eller når det gis samtidig med legemidler som er kjent for å indusere hyperkalemi, slik som angiotensinkonverterende enzymhemmere. Tett overvåking av serumkalium er nødvendig hos disse pasientene. Seponering av BACTRIM 160 mg-behandling anbefales for å redusere serumnivået av kalium.
Farmakokinetiske parametere for sulfametoksazol var like for geriatriske og yngre voksne. Den gjennomsnittlige maksimale serumtrimetoprimkonsentrasjonen var høyere og gjennomsnittlig renal clearance av trimetoprim var lavere hos geriatriske personer sammenlignet med yngre personer [se KLINISK FARMAKOLOGI ].
REFERANSER
4. Safrin S, Lee BL, Sande MA. Tillegg av folinsyre med trimetoprim-sulfametoksazol for Pneumocystis carinii pneumoni hos AIDS-pasienter er assosiert med økt risiko for terapeutisk svikt og død. J Infect Dis. oktober 1994;170(4):912-7.
10. Brumfitt W, Pursell R. Trimethoprim/Sulfamethoxazole in the Treatment of Bacteriuria in Women. J Infect Dis. Nov 1973;128 (Suppl): S657-S663.
OVERDOSE
Akutt
Siden det ikke har vært omfattende erfaring hos mennesker med enkeltdoser av BACTRIM 160 mg over 25 ml (400 mg trimetoprim og 2000 mg sulfametoksazol), er den maksimale tolererte dosen hos mennesker ukjent.
Tegn og symptomer på overdosering rapportert med sulfonamider inkluderer anoreksi, kolikk, kvalme, oppkast, svimmelhet, hodepine, døsighet og bevisstløshet. Pyreksi, hematuri og krystalluri kan observeres. Bloddyskrasier og gulsott er potensielle sene manifestasjoner av overdosering.
Tegn på akutt overdosering med trimetoprim inkluderer kvalme, oppkast, svimmelhet, hodepine, mental depresjon, forvirring og benmargsdepresjon.
Generelle prinsipper for behandling inkluderer administrering av intravenøs væske hvis urinproduksjonen er lav og nyrefunksjonen er normal. Forsuring av urinen vil øke renal eliminering av trimetoprim. Pasienten bør overvåkes med blodtelling og passende blodkjemi, inkludert elektrolytter. Hvis en betydelig bloddyskrasi eller gulsott oppstår, bør spesifikk behandling settes i gang for disse komplikasjonene. Peritonealdialyse er ikke effektiv og hemodialyse er bare moderat effektiv for å eliminere trimetoprim og sulfametoksazol.
Kronisk
Bruk av BACTRIM 800 mg i høye doser og/eller over lengre perioder kan forårsake benmargsdepresjon, manifestert som trombocytopeni, leukopeni og/eller megaloblastisk anemi. Hvis tegn på benmargsdepresjon oppstår, bør pasienten gis leukovorin 5 til 15 mg daglig inntil normal hematopoiesis er gjenopprettet.
KONTRAINDIKASJONER
BACTRIM er kontraindisert i følgende:
- . Kjent overfølsomhet overfor trimetoprim eller sulfonamider [se ADVARSLER OG FORHOLDSREGLER ] . Anamnese med legemiddelindusert immuntrombocytopeni ved bruk av trimetoprim og/eller sulfonamider [se ADVARSLER OG FORHOLDSREGLER ] . Pasienter med dokumentert megaloblastisk anemi på grunn av folatmangel [se ADVARSLER OG FORHOLDSREGLER ] . Pediatriske pasienter under to måneder gamle [se Bruk i spesifikke populasjoner ] . Markert leverskade [se ADVARSLER OG FORHOLDSREGLER ] . Alvorlig nyresvikt når nyrefunksjonsstatus ikke kan overvåkes [se ADVARSLER OG FORHOLDSREGLER ] . Samtidig administrering med dofetilid2,3 [se NARKOTIKAHANDEL ]
REFERANSER
2. Al-Khatib SM, LaPointe N, Kramer JM, Califf RM. Hva klinikere bør vite om QT-intervallet. JAMA. 2003;289(16):2120-2127.
3. Boyer EW, Stork C, Wang RY. Gjennomgang: Dofetilides farmakologi og toksikologi. Int J Med Toxicol. 2001;4(2):16.
KLINISK FARMAKOLOGI
Virkningsmekanismen
BACTRIM er et antimikrobielt legemiddel [se Mikrobiologi ].
Farmakokinetikk
Etter en 1-times intravenøs infusjon av en enkeltdose på 160 mg trimetoprim og 800 mg sulfametoksazol til 11 pasienter hvis vekt varierte fra 105 lbs til 165 lbs (gjennomsnittlig 143 lbs), var de maksimale plasmakonsentrasjonene av trimetoprim og sulfametoksazol ± 0 334. henholdsvis μg/mL og 46,3 ± 2,7 μg/mL. Etter gjentatt intravenøs administrering av samme dose med 8-timers intervaller, var gjennomsnittlig plasmakonsentrasjon like før og umiddelbart etter hver infusjon ved steady state 5,6 ± 0,6 μg/ml og 8,8 ± 0,9 μg/ml for trimetoprim og 70,6 ± 7,3 μg /mL og 105,6 ± 10,9 μg/mL for sulfametoksazol. Gjennomsnittlig plasmahalveringstid var 11,3 ± 0,7 timer for trimetoprim og 12,8 ± 1,8 timer for sulfametoksazol. Alle disse 11 pasientene hadde normal nyrefunksjon, og alderen deres varierte fra 17 til 78 år (median, 60 år).11
Farmakokinetiske studier hos barn og voksne antyder en aldersavhengig halveringstid for trimetoprim, som indikert i tabell 5.12
Pasienter med alvorlig nedsatt nyrefunksjon viser en økning i halveringstiden for begge komponentene, noe som krever justering av doseringsregimet [se DOSERING OG ADMINISTRASJON ].
Fordeling
Både trimetoprim og sulfametoksazol finnes i blodet som ubundne, proteinbundne og metaboliserte former; sulfametoksazol eksisterer også som den konjugerte formen.
Omtrent 44 % av trimetoprim og 70 % av sulfametoksazol er bundet til plasmaproteiner. Tilstedeværelsen av 10 mg prosent sulfametoksazol i plasma reduserer proteinbindingen av trimetoprim i en ubetydelig grad; trimetoprim påvirker ikke proteinbindingen til sulfametoksazol.
Både trimetoprim og sulfametoksazol distribueres til sputum og vaginalvæske; trimetoprim distribueres også til bronkial sekret, og begge passerer placentabarrieren og skilles ut i morsmelk.
Eliminering
Metabolisme
Sulfametoksazol metaboliseres hos mennesker til minst 5 metabolitter: N4-acetyl-, N4-hydroksy-, 5-metylhydroksy-, N4-acetyl-5-metylhydroksy-sulfametoksazol-metabolitter og et N-glukuronidkonjugat. Dannelsen av N4-hydroksymetabolitt medieres via CYP2C9.
Trimetoprim metaboliseres in vitro til 11 forskjellige metabolitter, hvorav fem er glutationaddukter og seks er oksidative metabolitter, inkludert hovedmetabolittene 1- og 3-oksider og 3- og 4-hydroksyderivatene.
De frie formene av trimetoprim og sulfametoksazol anses å være de terapeutisk aktive formene. In vitro-studier tyder på at trimetoprim er et substrat for P-glykoprotein, OCT1 og OCT2, og at sulfametoksazol ikke er et substrat for P-glykoprotein.
Utskillelse
Utskillelse av trimetoprim og sulfametoksazol skjer primært av nyrene gjennom både glomerulær filtrasjon og tubulær sekresjon. Urinkonsentrasjoner av både trimetoprim og sulfametoksazol er betydelig høyere enn konsentrasjonene i blodet. Prosentandelen av dose som ble utskilt i urin over en 12-timers periode etter intravenøs administrering av den første dosen på 240 mg trimetoprim og 1200 mg sulfametoksazol på dag 1 varierte fra 17 % til 42,4 % som fri trimetoprim; 7 % til 12,7 % som fri sulfametoksazol; og 36,7 % til 56 % totalt (fri pluss den N4-acetylerte metabolitten) sulfametoksazol. Når det administreres sammen som BACTRIM 400 mg, påvirker verken trimetoprim eller sulfametoksazol utskillelsesmønsteret i urin hos den andre.
Spesifikke populasjoner
Geriatriske pasienter
Farmakokinetikken til sulfametoksazol 800 mg og trimetoprim 160 mg ble studert hos seks geriatriske personer (gjennomsnittsalder: 78,6 år) og seks unge friske personer (gjennomsnittsalder: 29,3 år) ved bruk av en ikke-amerikansk godkjent formulering. Farmakokinetiske verdier for sulfametoksazol hos geriatriske personer var lik de som ble observert hos unge voksne. Gjennomsnittlig renal clearance av trimetoprim var signifikant lavere hos geriatriske personer sammenlignet med unge voksne personer (19 ml/time/kg vs. 55 ml/time/kg). Etter normalisering etter kroppsvekt var imidlertid den tilsynelatende totale kroppsclearance av trimetoprim i gjennomsnitt 19 % lavere hos geriatriske personer sammenlignet med unge voksne.
Mikrobiologi
Virkningsmekanismen
Sulfametoksazol hemmer bakteriell syntese av dihydrofolsyre ved å konkurrere med para-aminobenzosyre (PABA). Trimetoprim blokkerer produksjonen av tetrahydrofolsyre fra dihydrofolsyre ved å binde seg til og reversibelt hemme det nødvendige enzymet, dihydrofolatreduktase. Således blokkerer sulfametoksazol og trimetoprim to påfølgende trinn i biosyntesen av nukleinsyrer og proteiner som er essensielle for mange bakterier.
Motstand
In vitro-studier har vist at bakteriell resistens utvikler seg langsommere med både sulfametoksazol og trimetoprim i kombinasjon enn med enten sulfametoksazol eller trimetoprim alene.
Antimikrobiell aktivitet
BACTRIM har vist seg å være aktiv mot de fleste isolater av følgende mikroorganismer, både in vitro og ved kliniske infeksjoner [se INDIKASJONER OG BRUK ].
Aerobe gramnegative bakterier
Escherichia coliKlebsiella-arterEnterobacter-arterMorganella morganiiProteus mirabilisProteus vulgarisShigella flexneriShigella sonnei
Andre mikroorganismer
Pneumocystis jirovecii
Følgende in vitro-data er tilgjengelige, men deres kliniske betydning er ukjent. Minst 90 prosent av de følgende bakteriene viser en in vitro minimum hemmende konsentrasjon (MIC) mindre enn eller lik det følsomme bruddpunktet for BACTRIM 160 mg mot isolater av lignende slekt eller organismegruppe. Effekten av BACTRIM 400 mg ved behandling av kliniske infeksjoner forårsaket av disse bakteriene har imidlertid ikke blitt fastslått i tilstrekkelige og godt kontrollerte kliniske studier.
Aerobe grampositive bakterier
Streptococcus pneumoniae
Aerobe gramnegative bakterier
influensa
Resistenstesting
For spesifikk informasjon angående tolkningskriterier for mottakelighetstester, og tilhørende testmetoder og kvalitetskontrollstandarder anerkjent av FDA for dette legemidlet, se https://www.fda.gov/STIC.
REFERANSER
11. Grose WE, Bodey GP, Loo TL. Klinisk farmakologi av intravenøst administrert trimetoprim-sulfametoksazol. Antimikrobielle midler Chemother. Mar 1979;15:447-451.
12. Siber GR, Gorham C, Durbin W, Lesko L, Levin MJ. Farmakologi av intravenøs trimetoprim-sulfametoksazol hos barn og voksne. Nåværende kjemoterapi og infeksjonssykdommer. American Society for Microbiology, Washington, DC 1980; Vol. 1, s. 691-692.
PASIENTINFORMASJON
Embryo føtal toksisitet
Informer kvinnelige pasienter med reproduksjonspotensial om at BACTRIM kan forårsake fosterskader og informere helsepersonell om kjent eller mistenkt graviditet [se Bruk i spesifikke populasjoner ].
Amming
Råd ammende kvinner til å unngå amming under behandling med BACTRIM.
Antibakteriell motstand
Gi pasienter beskjed om at antibakterielle legemidler inkludert BACTRIM kun skal brukes til å behandle bakterielle infeksjoner. Det behandler ikke virusinfeksjoner (f.eks. forkjølelse).
Instruer pasientene om å opprettholde et tilstrekkelig væskeinntak for å forhindre krystalluri og steindannelse.
Diaré
Gi pasienter beskjed om at diaré er et vanlig problem forårsaket av antibiotika som vanligvis slutter når antibiotikaen seponeres. Noen ganger kan pasienter etter oppstart av behandling med antibiotika utvikle vassen og blodig avføring (med eller uten magekramper og feber) selv så sent som to eller flere måneder etter å ha tatt den siste dosen av antibiotika. Hvis dette skjer, bør pasienter kontakte legen sin så snart som mulig.
