Furadantin 100mg Nitrofurantoin Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Furadantin 100mg og hvordan brukes det?
Furadantin (nitrofurantoin oral suspensjon) er et antibiotikum som brukes til å behandle urinveisinfeksjoner. Furadantin er tilgjengelig i generisk form.
Hva er bivirkningene av Furadantin?
Vanlige bivirkninger av Furadantin inkluderer:
- . kvalme, . oppkast, . tap av Appetit, . urolig mage, . diaré, . hodepine, . svimmelhet, . døsighet, . rustfarget eller brunaktig urin, eller . vaginal kløe eller utflod.
Fortell legen din dersom du har sjeldne, men svært alvorlige bivirkninger av Furadantin, inkludert:
- . øyesmerter, . synsforandringer, . mentale/stemningsforandringer, . vedvarende eller alvorlig hodepine, . nye tegn på infeksjon (f.eks. feber, vedvarende sår hals), eller . lett blåmerker eller blødninger.
BESKRIVELSE
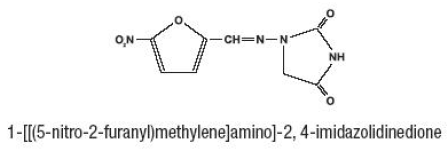
Furadantin (nitrofurantoin), et syntetisk kjemikalie, er en stabil, gul, krystallinsk forbindelse. Furadantin er et antibakterielt middel for spesifikke urinveisinfeksjoner. Furadantin er tilgjengelig i 25 mg/5 ml flytende suspensjon for oral administrering.
Inaktive ingredienser
Furadantin Oral Suspension inneholder karboksymetylcellulosenatrium, sitronsyre, smaksstoffer, glyserin, magnesiumaluminiumsilikat, metylparaben, propylparaben, renset vann, natriumsitrat og sorbitol.
INDIKASJONER
Furadantin er spesifikt indisert for behandling av urinveisinfeksjoner på grunn av følsomme stammer av Escherichia coli, enterokokker, Staphylococcus aureus og visse følsomme stammer av Klebsiella- og Enterobacter-arter.
Nitrofurantoin er ikke indisert for behandling av pyelonefritt eller perinefrie abscesser.
Nitrofurantoiner mangler den bredere vevsdistribusjonen til andre terapeutiske midler godkjent for urinveisinfeksjoner. Følgelig mange pasienter som behandles med Furadantin er disponert for vedvarende eller gjenopptreden av bakteriuri. Urinprøver for dyrking og mottakelighetstesting bør tas før og etter fullført behandling. Hvis vedvarende eller gjenopptreden av bakteriuri oppstår etter behandling med Furadantin , bør andre terapeutiske midler med bredere vevsfordeling velges. Ved å vurdere bruken av Furadantin , bør lavere utryddelseshastigheter balanseres mot det økte potensialet for systemisk toksisitet og for utvikling av antimikrobiell resistens når midler med bredere vevsfordeling brukes.
DOSERING OG ADMINISTRASJON
Furadantin bør gis sammen med mat for å forbedre legemiddelabsorpsjonen og, hos noen pasienter, toleransen.
Voksne
50-100 mg fire ganger daglig -- det lavere dosenivået anbefales ved ukompliserte urinveisinfeksjoner.
Pediatriske pasienter
5-7 mg/kg kroppsvekt per 24 timer, gitt i fire oppdelte doser (kontraindisert under en måneds alder).
Følgende tabell er basert på en gjennomsnittsvekt i hvert område som mottar 5 til 6 mg/kg kroppsvekt per 24 timer, gitt i fire oppdelte doser. Den kan brukes til å beregne en gjennomsnittlig dose på Furadantin Oral suspensjon (25 mg/5 ml) for pediatriske pasienter.
Behandlingen bør fortsette i én uke eller i minst 3 dager etter at urinen er sterilisert. Fortsatt infeksjon indikerer behov for revurdering.
For langvarig suppressiv behandling hos voksne kan en reduksjon av dosen til 50-100 mg ved sengetid være tilstrekkelig. For langvarig suppressiv behandling hos pediatriske pasienter kan doser så lave som 1 mg/kg per 24 timer, gitt i en enkelt dose eller i to oppdelte doser, være tilstrekkelig. SE ADVARSLER ANGÅENDE RISIKO KNYTTET TIL LANGSIKTIG TERAPI .
HVORDAN LEVERES
Furadantin Oral suspensjon er tilgjengelig i:
NDC 70199-006-32 PET-ravgul flaske på 230 ml
Unngå eksponering for sterkt lys som kan gjøre stoffet mørkere. Den er stabil når den oppbevares mellom 20°-25°C (68°-77°F); utflukter tillatt til 15°-30°C (59°-86°F) [Se USP kontrollert romtemperatur ]. Beskytt mot frysing. Riste kraftig. Dispenser i tett, lysbestandig, plast (PET) eller glassbeholder.
Bruk innen 30 dager.
Oppbevares utilgjengelig for barn.
Produsert for: Casper Pharma LLC, East Brunswick NJ 08816. Revidert: Des 2020
BIVIRKNINGER
Luftveiene
KRONISKE, SUBAKUTE ELLER AKUTTE LUNGE HIPERSENSITIVITETSREAKSJONER KAN OPPKOMME.
KRONISKE LUNNEREAKSJONER KAN GENERELT OPPKOMME HOS PASIENTER SOM HAR FÅTT KONTINUERLIG BEHANDLING I SEX MÅNEDER ELLER LENGER. ULAGSMÅL, DYSPNØ VED ANMODNING, HOSTE OG ENDRET LUNGEFUNKSJON ER VANLIGE MANIFESTASJONER SOM KAN OPPKOMME SMIDIG. RADIOLOGISKE OG HISTOLOGISKE FUNN AV DIFFUSE INTERSTITIELL PNEUMONITT ELLER FIBROSIS, ELLER BEGGE, ER OGSÅ VANLIGE MANIFESTASJONER AV DEN KRONISKE LUNGEREAKSJONEN. FEBER ER SJELDEN PROMINENT.
Alvorlighetsgraden av kroniske lungereaksjoner og deres oppløsningsgrad ser ut til å være relatert til VARIGHETEN AV TERAPIEN ETTER DE FØRSTE KLINISKE TEGNENE VISES. LUNGEFUNKSJONEN KAN VÆRE PERMANENT SVEKKET, SELV ETTER AVSLUTNING AV TERAPIEN. RISIKOEN ER STØRRE NÅR KRONISKE LUNNEREAKSJONER IKKE OPPMERKSES TIDLIG.
Ved subakutte lungereaksjoner forekommer feber og eosinofili sjeldnere enn ved akutt form. Ved avslutning av behandlingen kan restitusjonen ta flere måneder. Hvis symptomene ikke anerkjennes som medikamentrelaterte og nitrofurantoinbehandlingen ikke stoppes, kan symptomene bli mer alvorlige.
Akutte lungereaksjoner er ofte manifestert ved feber, frysninger, hoste, brystsmerter, dyspné, lungeinfiltrasjon med konsolidering av pleural effusjon på røntgen og eosinofili.
Akutte reaksjoner oppstår vanligvis innen den første uken av behandlingen og er reversible ved seponering av behandlingen. Oppløsningen er ofte dramatisk. (se ADVARSLER )
Endringer i EKG (f.eks. uspesifikke ST/T-bølgeforandringer, grenblokk) er rapportert i forbindelse med lungereaksjoner.
Cyanose er rapportert sjelden.
Hepatisk
Leverreaksjoner, inkludert hepatitt, kolestatisk gulsott, kronisk aktiv hepatitt og hepatisk nevrose, forekommer sjelden. (se ADVARSLER )
Nevrologisk
Perifer nevropati, som kan bli alvorlig eller irreversibel, har oppstått. Det er rapportert om omkomne. Tilstander som nedsatt nyrefunksjon (kreatininclearance under 60 ml per minutt eller klinisk signifikant forhøyet serumkreatinin), anemi, diabetes mellitus, elektrolyttforstyrrelse, vitamin B-mangel og svekkende sykdommer kan øke muligheten for perifer nevropati (se ADVARSLER )
Asteni, vertigo, nystagmus, svimmelhet, hodepine og døsighet er også rapportert ved bruk av nitrofurantoin.
Benign intrakraniell hypertensjon (pseudotumor cerebri), forvirring, depresjon, optikusnevritt og psykotiske reaksjoner er sjelden rapportert. Svulmende fontaneller, som et tegn på godartet intrakraniell hypertensjon hos spedbarn, har blitt rapportert i sjeldne tilfeller.
Dermatologisk
Eksfoliativ dermatitt og erythema multiforme (inkludert Stevens-Johnsons syndrom) er rapportert i sjeldne tilfeller. Forbigående alopecia er også rapportert.
Allergisk
Et lupuslignende syndrom assosiert med pulmonale reaksjoner på nitrofurantoin er rapportert. Også angioødem; makulopapulære, erytematøse eller eksematiske utbrudd; kløe; urticaria; anafylaksi; artralgi; myalgi; narkotika feber; og vaskulitt (noen ganger assosiert med lungereaksjoner) er rapportert. Overfølsomhetsreaksjoner er de hyppigste spontant rapporterte bivirkningene i verdensomspennende erfaring etter markedsføring med nitrofurantoinformuleringer.
Gastrointestinale
Kvalme, brekninger og anoreksi forekommer oftest. Magesmerter og diaré er mindre vanlige gastrointestinale reaksjoner. Disse doserelaterte reaksjonene kan minimeres ved å redusere dosen. Sialadenitt og pankreatitt er rapportert. Det har vært sporadiske rapporter om pseudomembranøs kolitt ved bruk av nitrofurantoin. Utbruddet av pseudomembranøs kolitt-symptomer kan oppstå under eller etter antimikrobiell behandling. (se ADVARSLER )
Hematologisk
Cyanose sekundært til methemoglobinemi er rapportert i sjeldne tilfeller.
Diverse
Som med andre antimikrobielle midler, kan superinfeksjoner forårsaket av resistente organismer, f.eks. Pseudomonas-arter eller Candida-arter, forekomme. Det er sporadiske rapporter om Clostridium difficile-superinfeksjoner, eller pseudomembranøs kolitt, ved bruk av nitrofurantoin.
Uønskede hendelser i laboratoriet
Følgende laboratoriebivirkninger er rapportert ved bruk av nitrofurantoin; økt ASAT (SGOT), økt ALAT (SGPT), redusert hemoglobin, økt serumfosfor, eosinofili, glukose-6-fosfatdehydrogenase-mangelanemi (se ADVARSLER ), agranulocytose, leukopeni, granulocytopeni, hemolytisk anemi, trombocytopeni, megaloblastisk anemi. I de fleste tilfeller forsvant disse hematologiske abnormitetene etter avsluttet behandling. Aplastisk anemi er sjelden rapportert.
For å rapportere MISTENTE BIVIRKNINGER, kontakt Casper Pharma LLC. på 1-844-5-CASPER (1-844-522-7737) eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
NARKOTIKAHANDEL
Antacida som inneholder magnesiumtrisilikat, når det administreres samtidig med nitrofurantoin, reduserer både hastigheten og omfanget av absorpsjon. Mekanismen for denne interaksjonen er sannsynligvis adsorpsjon av nitrofurantoin på overflaten av magnesiumtrisilikat.
Urikosuriske legemidler, som probenecid og sulfinpyrazon, kan hemme renal tubulær sekresjon av nitrofurantoin. Den resulterende økningen i nitrofurantoinserumnivåer kan øke toksisiteten, og de reduserte urinnivåene kan redusere dens effektivitet som antibakteriell urinveismiddel.
Interaksjoner med legemiddel/laboratorietest
Som et resultat av tilstedeværelsen av nitrofurantoin kan det oppstå en falsk positiv reaksjon for glukose i urinen. Dette har blitt observert med Benedicts og Fehlings løsninger, men ikke med den enzymatiske glukosetesten.
ADVARSLER
Lungereaksjoner
AKUTTE, SUBAKUTE ELLER KRONISKE LUNGEREAKSJONER HAR BLITT OBSERVERT HOS PASIENTER BHANDLET MED NITROFURANTOIN. HVIS DISSE REAKSJONENE OPPTÅR, BØR FURADANTIN 100mg AVSLUTTES OG PASSENDE TILTAK TAKKES. RAPPORTER HAR SITERT LUNGEREAKSJONER SOM EN MEDIDRAGENDE DØDSÅRSAK.
KRONISKE LUNNEREAKSJONER (DIFFUSE INTERSTITIELL PNEUMONITT ELLER LUNGEFIBROSIS, ELLER BEGGE) KAN UTVIKLE SMIDIG. DISSE REAKSJONENE OPPKOMMER SJELDEN OG GENERELT HOS PASIENTER SOM MOTTER BEHANDLING I 6 MÅNEDER ELLER LENGER. NØT OVERVÅKING AV LUNGETIDEN TIL PASIENTER SOM MOTTER LANGTIDSBEHANDLING ER GARANTERT OG KREVER AT FORDELENE VED BEHANDLING VEIES OPP POTENSIAL RISIKO. (se RESPIRATORISKE REAKSJONER.)
Hepatotoksisitet
Leverreaksjoner, inkludert hepatitt, kolestatisk gulsott, kronisk aktiv hepatitt og levernekrose, forekommer sjelden. Det er rapportert om omkomne. Utbruddet av kronisk aktiv hepatitt kan være snikende, og pasienter bør overvåkes med jevne mellomrom for endringer i biokjemiske tester som kan indikere leverskade. Hvis hepatitt oppstår, bør legemidlet seponeres umiddelbart og passende tiltak bør iverksettes.
Nevropati
Perifer nevropati, som kan bli alvorlig eller irreversibel, har oppstått. Det er rapportert om omkomne. Tilstander som nedsatt nyrefunksjon (kreatininclearance under 60 ml per minutt eller klinisk signifikant forhøyet serumkreatinin), anemi, diabetes mellitus, elektrolyttubalanse, vitamin B-mangel og svekkende sykdom kan øke forekomsten av perifer nevropati. Pasienter som får langtidsbehandling bør overvåkes med jevne mellomrom for endringer i nyrefunksjonen.
Optikusnevritt er rapportert i sjeldne tilfeller etter markedsføring med nitrofurantoinformuleringer.
Hemolytisk anemi
Tilfeller av hemolytisk anemi av typen primakin-sensitivitet har blitt indusert av nitrofurantoin. Hemolyse ser ut til å være knyttet til en glukose-6-fosfatdehydrogenase-mangel i de røde blodcellene til de berørte pasientene. Denne mangelen finnes hos 10 prosent av svarte og en liten prosentandel av etniske grupper av Middelhavet og nær-østlig opprinnelse. Hemolyse er en indikasjon for seponering Furadantin hemolyse opphører når stoffet trekkes tilbake.
Clostridium Difficile-assosiert diaré
Clostridium difficile assosiert diaré (CDAD) er rapportert ved bruk av nesten alle antibakterielle midler, inkludert Furadantin Oral suspensjon, og kan variere i alvorlighetsgrad fra mild diaré til fatal kolitt. Behandling med antibakterielle midler endrer normalfloraen i tykktarmen som fører til overvekst av C. difficile.
C. difficile produserer giftstoffer A og B som bidrar til utviklingen av CDAD. Hypertoksinproduserende stammer av C. difficile forårsaker økt sykelighet og dødelighet, da disse infeksjonene kan være motstandsdyktige mot antimikrobiell behandling og kan kreve kolektomi. CDAD må vurderes hos alle pasienter som får diaré etter antibiotikabruk. Nøye sykehistorie er nødvendig siden CDAD har blitt rapportert å oppstå over to måneder etter administrering av antibakterielle midler.
Hvis CDAD mistenkes eller bekreftes, kan pågående antibiotikabruk som ikke er rettet mot C. difficile må avbrytes. Hensiktsmessig væske- og elektrolyttbehandling, proteintilskudd, antibiotikabehandling av C. difficile og kirurgisk evaluering bør iverksettes som klinisk indisert.
FORHOLDSREGLER
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Nitrofurantoin var ikke kreftfremkallende når det ble fôret til Holtzman-hunnrotter i 44,5 uker eller til Sprague-Dawley-hunnrotter i 75 uker. To kroniske gnagerbioassays med bruk av Sprague-Dawley-hann- og hunnrotter og to kroniske bioassays i sveitsiske mus og BDF1-mus avslørte ingen bevis for kreftfremkallende egenskaper.
Nitrofurantoin presenterte bevis på kreftfremkallende aktivitet hos B6C3F1 hunnmus som vist ved økt forekomst av tubulære adenomer, godartede blandede svulster og granulosacelletumorer i eggstokken. Hos F344/N-hannrotter var det økt forekomst av uvanlige nyretubulære celle-neoplasmer, osteosarkomer i beinet og neoplasmer i subkutan vev. I en studie som involverte subkutan administrering av 75 mg/kg nitrofurantoin til gravide hunnmus, ble lungepapillære adenomer av ukjent betydning observert i F1-generasjonen.
Nitrofurantoin har vist seg å indusere punktmutasjoner i visse stammer av Salmonella typhimurium og forovermutasjoner på L5178Y muselymfomceller. Nitrofurantoin induserte økt antall søsterkromatidutvekslinger og kromosomavvik i eggstokkceller fra kinesisk hamster, men ikke i humane celler i kultur. Resultatene av den kjønnsbundne recessive letale analysen i Drosophila var negative etter administrering av nitrofurantoin ved fôring eller ved injeksjon. Nitrofurantoin induserte ikke arvelig mutasjon i de undersøkte gnagermodellene.
Betydningen av funn av karsinogenitet og mutagenitet i forhold til terapeutisk bruk av nitrofurantoin hos mennesker er ukjent.
Administrering av høye doser nitrofurantoin til rotter forårsaker midlertidig spermatogen arrestasjon; dette er reversibelt ved seponering av stoffet. Doser på 10 mg/kg/dag eller mer hos friske menn kan, i visse uforutsigbare tilfeller, gi en lett til moderat spermatogen arrestasjon med en reduksjon i spermantall.
Svangerskap
Teratogene effekter
Flere reproduksjonsstudier er utført på kaniner og rotter i doser opptil seks ganger human dose, og har ikke avdekket bevis på nedsatt fertilitet eller skade på fosteret på grunn av nitrofurantoin. I en enkelt publisert studie utført på mus med 68 ganger den humane dosen (basert på mg/kg administrert til mor), ble vekstretardasjon og lav forekomst av mindre og vanlige misdannelser observert. Ved 25 ganger human dose ble det imidlertid ikke observert fostermisdannelser; relevansen av disse funnene for mennesker er usikker. Det finnes imidlertid ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for menneskelig respons, bør dette legemidlet kun brukes under graviditet hvis det er klart nødvendig.
Ikke-teratogene effekter
Nitrofurantoin har blitt vist i en publisert transplacental karsinogenitetsstudie for å indusere lungepapillære adenomer i F1-generasjonsmusene ved doser 19 ganger human dose på mg/kg basis. Forholdet mellom dette funnet og potensiell karsinogenese hos mennesker er foreløpig ukjent. På grunn av usikkerheten angående de menneskelige implikasjonene av disse dyredataene, bør dette legemidlet kun brukes under graviditet hvis det er klart nødvendig.
Arbeid og levering
Se KONTRAINDIKASJONER .
Ammende mødre
Nitrofurantoin er påvist i human morsmelk i spormengder. På grunn av potensialet for alvorlige bivirkninger fra nitrofurantoin hos ammende spedbarn under en måneds alder, bør det tas en beslutning om å avbryte ammingen eller å avbryte medikamentet, tatt i betraktning stoffets betydning for moren. (se KONTRAINDIKASJONER )
Pediatrisk bruk
Sikkerhet og effektivitet av Furadantin hos nyfødte under en måned er ikke påvist. (se KONTRAINDIKASJONER )
OVERDOSE
Sporadiske hendelser med akutt overdosering av Furadantin har ikke resultert i andre spesifikke symptomer enn oppkast. Induksjon av brekninger anbefales. Det finnes ingen spesifikk motgift, men et høyt væskeinntak bør opprettholdes for å fremme urinutskillelse av stoffet. Den er dialyserbar.
KONTRAINDIKASJONER
Anuri, oliguri eller betydelig nedsatt nyrefunksjon (kreatininclearance under 60 ml per minutt eller klinisk signifikant forhøyet serumkreatinin) er kontraindikasjoner. Behandling av denne typen pasienter medfører økt risiko for toksisitet på grunn av nedsatt utskillelse av legemidlet.
På grunn av muligheten for hemolytisk anemi på grunn av umodne erytrocyttenzymsystemer (glutation-ustabilitet), er stoffet kontraindisert hos gravide pasienter ved termin (38-42 ukers svangerskap), under fødsel og fødsel, eller når fødselen er nært forestående. Av samme grunn er stoffet kontraindisert hos nyfødte under en måneds alder.
Furadantin er kontraindisert hos pasienter med tidligere kolestatisk gulsott/hepatisk dysfunksjon assosiert med nitrofurantoin. Furadantin er også kontraindisert hos pasienter med kjent overfølsomhet overfor nitrofurantoin.
KLINISK FARMAKOLOGI
Oralt administrert Furadantin absorberes lett og skilles raskt ut i urinen. Blodkonsentrasjoner ved terapeutisk dosering er vanligvis lave. Det er svært løselig i urin, som det kan gi en brun farge.
Etter et doseregime på 100 mg qid i 7 dager, var gjennomsnittlig gjenoppretting av legemidler i urin (0-24 timer) på dag 1 og dag 7 42,7 % og 43,6 %.
I motsetning til mange medikamenter, kan tilstedeværelsen av mat eller midler som forsinker magetømming øke biotilgjengeligheten av Furadantin , antagelig ved å tillate bedre oppløsning i magesaft.
Mikrobiologi
Handlingsmåte
Nitrofurantoin reduseres av et bredt spekter av enzymer inkludert bakterielle flavoproteiner til reaktive mellomprodukter som er skadelige for makromolekyler som DNA og proteiner.
Kryssmotstand
Selv om kryssresistens med andre antimikrobielle midler kan forekomme, er kryssresistens med sulfonamider ikke observert.
Interaksjon med andre antimikrobielle midler
Antagonisme er påvist in vitro mellom nitrofurantoin og kinolonantimikrobielle midler. Nitrofurantoin, i form av nitrofurantoin oral suspensjon, har vist seg å være aktiv mot de fleste av følgende bakterier både in vitro og ved kliniske infeksjoner: (Se INDIKASJONER OG BRUK ).
Gram-positive aerober
Staphylococcus aureusEnterococcus arter
Gram-negative aerober
Escherichia coli
MERK: Noen stammer av Enterobacter-arter og Klebsiella-arter er resistente mot nitrofurantoin.
Følgende in vitro-data er tilgjengelige, men deres kliniske betydning er ukjent. Nitrofurantoin viser in vitro aktivitet mot følgende bakterier; Imidlertid er sikkerheten og effektiviteten til nitrofurantoin ved behandling av kliniske infeksjoner på grunn av disse bakteriene ikke blitt fastslått i tilstrekkelige og godt kontrollerte kliniske studier.
Gram-positive aerober
Koagulase-negative stafylokokker (inkludert Staphylococcus epidermidis og Staphylococcus saprophyticus) Streptococcus agalactiaeViridans gruppestreptokokker
Gram-negative aerober
Citrobacter koseriCitrobacter freundiiKlebsiella oxytoca
Nitrofurantoin er ikke aktivt mot de fleste stammer av Proteus-arter eller Serratia-arter. Den har ingen aktivitet mot Pseudomonas-arter.
Resistenstesting
For spesifikk informasjon om tolkningskriterier for mottakelighetstest, og tilhørende testmetoder og kvalitetskontrollstandarder anerkjent av FDA for dette legemidlet, se: http://www.fda.gov/STIC.
PASIENTINFORMASJON
Pasienter bør rådes til å ta Furadantin med mat for ytterligere å øke toleransen og forbedre medikamentabsorpsjonen. Pasienter bør instrueres til å fullføre hele behandlingsforløpet; de bør imidlertid rådes til å kontakte legen dersom det skulle oppstå uvanlige symptomer under behandlingen.
Diaré er et vanlig problem forårsaket av antibiotika som vanligvis slutter når antibiotikaen seponeres. Noen ganger kan pasienter etter oppstart av behandling med antibiotika utvikle vassen og blodig avføring (med eller uten magekramper og feber) selv så sent som to eller flere måneder etter å ha tatt den siste dosen av antibiotika. Hvis dette skjer, bør pasienter kontakte legen sin så snart som mulig.
Pasienter bør rådes til ikke å bruke syrenøytraliserende preparater som inneholder magnesiumtrisilikat mens de tar Furadantin .
