Suprax 100mg, 200mg Cefixime Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Suprax 200mg og hvordan brukes det?
Suprax (cefixim) for oral suspensjon er et cefalosporinantibiotikum som brukes til å behandle mange forskjellige typer infeksjoner forårsaket av bakterier.
Hva er bivirkningene av Suprax?
Vanlige bivirkninger av Suprax 100mg inkluderer:
- . magesyke/smerter, . diaré, . kvalme, . forstoppelse, . tap av Appetit, . gass, . hodepine, . svimmelhet, . angst, . døsighet, . økt vannlating om natten, . rennende nese, . sår hals, . hoste, eller . vaginal kløe eller utflod.
Fortell legen din dersom du opplever sjeldne, men svært alvorlige bivirkninger av Suprax 200mg, inkludert:
- . sterke mage- eller magesmerter, . vedvarende kvalme eller oppkast, . gulne øyne eller hud, . mørk urin, . uvanlig tretthet, . nye tegn på infeksjon (f.eks. vedvarende sår hals, feber), . lett blåmerker eller blødninger, . endring i mengde urin, eller . mentale/stemningsforandringer (som forvirring).
BESKRIVELSE
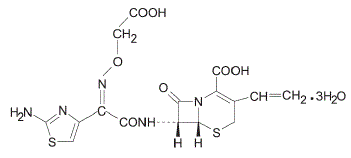
Cefixime er en semisyntetisk cefalosporin-antibakteriell for oral administrering. Kjemisk er det (6R,7R)-7-[2-(2-amino-4-tiazolyl)glyoksylamido]-8-okso-3-vinyl-5-tia-1-azabicyklo [4.2.0] okt-2 -en-2-karboksylsyre, 72-(Z)-[O-(karboksymetyl)oksim]trihydrat.
Molekylvekt = 507,50 som trihydrat. Kjemisk formel er C16H15N5O7S2.3H2O
Strukturformelen for cefixim er:
- . Inaktive ingredienser i SUPRAX® (cefixim) 400 mg tabletter USP er: dibasisk kalsiumfosfat, hypromellose, laktosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose, polyetylenglykol, pregelatinisert stivelse, titandioksid og triacetin. . Inaktive ingredienser i SUPRAX® (cefixime) 400 mg kapsler er: kolloidalt silisiumdioksid, krospovidon, lavsubstituert hydroksypropylcellulose, magnesiumstearat og mannitol. Kapselskallet inneholder følgende inaktive ingredienser: svart jernoksid, rødt jernoksid, gelatin, kaliumhydroksid, propylenglykol, skjellakk, natriumlaurylsulfat og titandioksid. . Inaktive ingredienser i SUPRAX® (cefixime) 100 mg eller 150 mg eller 200 mg tyggetabletter er: aspartam, kolloidalt silisiumdioksid, krospovidon, FD&C Red # 40 Aluminium Lake, lavsubstituert hydroksypropylcellulose, magnesiumstearat, permaseal cellulose, mannitol og tutti frutti smak. . Inaktive ingredienser i SUPRAX® (cefixime) pulver til oral suspensjon USP er: kolloidalt silisiumdioksid, natriumbenzoat, jordbærsmak, sukralose (kun i 500 mg/5 ml styrke), sukrose og xantangummi.
INDIKASJONER
Ukompliserte urinveisinfeksjoner
SUPRAX er indisert for behandling av voksne og pediatriske pasienter seks måneder eller eldre med ukompliserte urinveisinfeksjoner forårsaket av følsomme isolater av Escherichia coli og Proteus mirabilis.
Mellomørebetennelse
SUPRAX er indisert for behandling av voksne og pediatriske pasienter seks måneder eller eldre med mellomørebetennelse forårsaket av følsomme isolater av Haemophilus influenzae, Moraxella catarrhalis og Streptococcus pyogenes. (Effektiviteten for Streptococcus pyogenes i dette organsystemet ble studert i færre enn 10 infeksjoner.)
Merk
For pasienter med mellomørebetennelse forårsaket av Streptococcus pneumoniae, var den totale responsen omtrent 10 % lavere for cefixim enn for komparatoren [se Kliniske studier ].
Faryngitt og tonsillitt
SUPRAX er indisert for behandling av voksne og pediatriske pasienter seks måneder eller eldremed faryngitt og betennelse i mandlene forårsaket av følsomme isolater av Streptococcus pyogenes. (Merk: Penicillin er det vanlige medikamentet ved behandling av Streptococcus pyogenes-infeksjoner. SUPRAX er generelt effektivt for å utrydde Streptococcus pyogenes fra nasofarynx, men data som fastslår effekten av SUPRAX 100mg i den påfølgende forebyggingen av revmatisk feber er ikke tilgjengelig.)
Akutte forverringer av kronisk bronkitt
SUPRAX 200mg er indisert for behandling av voksne og pediatriske pasienter seks måneder eller eldre med akutte forverringer av kronisk bronkitt forårsaket av følsomme isolater av Streptococcus pneumoniae og Haemophilus influenzae.
Ukomplisert gonoré (cervikal/urethral)
SUPRAX 100mg er indisert for behandling av voksne og pediatriske pasienter seks måneder eller eldre med ukomplisert gonoré (cervikal/urethral) forårsaket av følsomme isolater av Neisseria gonorrhoeae (penicillinase- og ikke-penicillinaseproduserende isolater).
Bruk
For å redusere utviklingen av medikamentresistente bakterier og opprettholde effektiviteten til SUPRAX 100mg og andre antibakterielle legemidler, bør SUPRAX 100mg kun brukes til å behandle infeksjoner som er bevist eller sterkt mistenkt å være forårsaket av følsomme bakterier. Når kultur- og mottakelighetsinformasjon er tilgjengelig, bør de vurderes ved valg eller modifisering av antimikrobiell behandling. I mangel av slike data kan lokal epidemiologi og mottakelighetsmønstre bidra til empirisk valg av terapi.
DOSERING OG ADMINISTRASJON
Voksne
Den anbefalte dosen av cefixim er 400 mg daglig. Dette kan gis som en 400 mg tablett eller kapsel daglig, eller 400 mg tabletten kan deles og gis som en halv tablett hver 12. time. For behandling av ukompliserte cervikale/urethrale gonokokkinfeksjoner anbefales en enkelt oral dose på 400 mg. Kapselen og tabletten kan administreres uten hensyn til mat.
Ved behandling av infeksjoner på grunn av Streptococcus pyogenes bør en terapeutisk dose av cefixim administreres i minst 10 dager.
Pediatriske pasienter (6 måneder eller eldre)
Den anbefalte dosen er 8 mg/kg/dag av suspensjonen. Dette kan gis som en enkelt daglig dose eller kan gis i to oppdelte doser, som 4 mg/kg hver 12. time.
Merk
En foreslått dose er bestemt for hvert pediatrisk vektområde. Se tabell 1. Sørg for at alle bestillinger som spesifiserer en dose i milliliter inkluderer en konsentrasjon, fordi SUPRAX for oral suspensjon er tilgjengelig i tre forskjellige konsentrasjoner (100 mg/5 mL, 200 mg/5 mL og 500 mg/5 mL).
Barn som veier mer enn 45 kg eller eldre enn 12 år bør behandles med anbefalt voksendose. SUPRAX (cefixim) tyggetabletter må tygges eller knuses før de svelges.
Mellomørebetennelse bør behandles med tyggetabletter eller suspensjon. Kliniske studier av mellomørebetennelse ble utført med tyggetablettene eller suspensjonen, og tyggetablettene eller suspensjonen resulterer i høyere toppnivåer i blodet enn tabletten når de administreres i samme dose.
Derfor bør tabletten eller kapselen ikke erstattes med tyggetablettene eller suspensjonen ved behandling av mellomørebetennelse [se KLINISK FARMAKOLOGI ].
Ved behandling av infeksjoner på grunn av Streptococcus pyogenes bør en terapeutisk dose av cefixim administreres i minst 10 dager.
Nedsatt nyrefunksjon
SUPRAX 200 mg kan administreres ved nedsatt nyrefunksjon. Normal dose og tidsplan kan brukes hos pasienter med kreatininclearance på 60 ml/min eller mer. Se tabell 2 for dosejusteringer for voksne med nedsatt nyrefunksjon. Verken hemodialyse eller peritonealdialyse fjerner betydelige mengder medikament fra kroppen.
Rekonstitueringsveiledning for oral suspensjon
Etter rekonstituering kan suspensjonen oppbevares i 14 dager enten ved romtemperatur eller i kjøling, uten betydelig tap av styrke. Hold tett lukket. Rist godt før bruk. Kast ubrukt porsjon etter 14 dager.
HVORDAN LEVERES
Doseringsformer og styrker
SUPRAX er tilgjengelig for oral administrering i følgende doseringsformer og styrker:
- . Filmdrasjerte tabletter gir 400 mg cefixim som trihydrat. Disse er hvite til off-white, filmdrasjerte, kapselformede tabletter med skrå kanter og en delt delestrek på hver side. Tabletten er merket med "SUPRAX" på den ene siden og "LUPIN" på den andre siden. . Kapsler gir 400 mg cefixim som trihydrat. Dette er kapsler i størrelse “00EL” med rosa ugjennomsiktig hette og rosa ugjennomsiktig kropp med “LU” på hetten og “U43” på hoveddelen i svart blekk. Kapsler inneholder hvitt til gulaktig hvitt granulært pulver. . Tyggetabletter gir enten 100 mg eller 150 mg eller 200 mg cefixim som trihydrat. 100 mg tabletten er rosa, rund tablett, preget med "SUPRAX 100" på den ene siden og "LUPIN" på den andre siden. 150 mg tabletten er rosa, rund tablett, preget med "SUPRAX 150" på den ene siden og "LUPIN" på den andre siden. 200 mg tabletten er rosa, rund tablett, preget med "SUPRAX 200" på den ene siden og "LUPIN" på den andre siden. . Pulver til oral suspensjon, når det er rekonstituert, gir enten 100 mg/5 ml eller 200 mg/5 ml eller 500 mg/5 ml cefixim som trihydrat. For 100 mg/5 mL og 200 mg/5 mL har pulveret en off-white til blekgul farge og er jordbærsmak. For 500 mg/5 ml har pulveret en off-white til kremfarge og er jordbærsmak.
Oppbevaring og håndtering
SUPRAX® er tilgjengelig for oral administrering i følgende doseringsformer, styrker og pakker oppført i tabellen nedenfor:
Produsert av: Lupine Limited Mandideep 462 046 India. Revidert: mars 2018.
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
De vanligste bivirkningene i amerikanske studier av tablettformuleringen var gastrointestinale hendelser, som ble rapportert hos 30 % av voksne pasienter på enten regimet to ganger daglig eller én gang daglig. Fem prosent (5%) av pasientene i de amerikanske kliniske studiene avbrøt behandlingen på grunn av legemiddelrelaterte bivirkninger. Individuelle bivirkninger inkluderte diaré 16 %, løs eller hyppig avføring 6 %, magesmerter 3 %, kvalme 7 %, dyspepsi 3 % og flatulens 4 %. Forekomsten av gastrointestinale bivirkninger, inkludert diaré og løs avføring, hos pediatriske pasienter som fikk suspensjonen var sammenlignbar med forekomsten sett hos voksne pasienter som fikk tabletter.
Erfaring etter markedsføring
Følgende bivirkninger er rapportert etter bruk av cefixim etter godkjenning. Forekomsten var mindre enn 1 av 50 (mindre enn 2 %).
Gastrointestinale
Flere tilfeller av dokumentert pseudomembranøs kolitt ble identifisert i kliniske studier. Utbruddet av pseudomembranøs kolitt-symptomer kan oppstå under eller etter behandlingen.
Overfølsomhetsreaksjoner
Anafylaktiske/anafylaktoide reaksjoner (inkludert sjokk og dødsfall), hudutslett, urticaria, medikamentfeber, kløe, angioødem og ansiktsødem. Erythema multiforme, Stevens-Johnsons syndrom og serumsykdomslignende reaksjoner er rapportert.
Hepatisk
forbigående økninger i SGPT, SGOT, alkalisk fosfatase, hepatitt, gulsott.
Nyre
Forbigående økninger i BUN eller kreatinin, akutt nyresvikt.
Sentralnervesystemet
Hodepine, svimmelhet, anfall.
Hemisk og lymfatisk system
Forbigående trombocytopeni, leukopeni, nøytropeni, forlengelse av protrombintid, forhøyet LDH, pancytopeni, agranulocytose og eosinofili.
Unormale laboratorietester
Hyperbilirubinemi.
Andre uønskede reaksjoner
Genital kløe, vaginitt, candidiasis, giftig epidermal nekrolyse.
Bivirkninger rapportert for legemidler i cefalosporinklassen
Allergiske reaksjoner, superinfeksjon, nyredysfunksjon, toksisk nefropati, leverdysfunksjon inkludert kolestase, aplastisk anemi, hemolytisk anemi, blødning og kolitt.
Flere cefalosporiner har vært involvert i å utløse anfall, spesielt hos pasienter med nedsatt nyrefunksjon når dosen ikke ble redusert [se DOSERING OG ADMINISTRASJON se OVERDOSE ]. Hvis anfall forbundet med medikamentell behandling oppstår, bør legemidlet seponeres. Antikonvulsiv behandling kan gis hvis det er klinisk indisert.
NARKOTIKAHANDEL
Karbamazepin
Forhøyede karbamazepinnivåer er rapportert etter markedsføring når cefixim administreres samtidig. Legemiddelovervåking kan være til hjelp for å oppdage endringer i plasmakonsentrasjoner av karbamazepin.
Warfarin og antikoagulantia
Økt protrombintid, med eller uten klinisk blødning, er rapportert når cefixim administreres samtidig.
Interaksjoner med legemiddel/laboratorietest
En falsk positiv reaksjon for ketoner i urinen kan oppstå med tester som bruker nitroprussid, men ikke med de som bruker nitroferricyanid.
Administrering av cefixim kan resultere i en falsk positiv reaksjon for glukose i urinen ved bruk av Clinitest®, Benedicts oppløsning eller Fehlings oppløsning. Det anbefales at glukosetester basert på enzymatiske glukoseoksidasereaksjoner (som Clinistix® eller TesTape®) brukes. En falsk positiv direkte Coombs-test er rapportert under behandling med andre cefalosporiner; derfor bør det erkjennes at en positiv Coombs-test kan skyldes stoffet.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Overfølsomhetsreaksjoner
Anafylaktiske/anafylaktoide reaksjoner (inkludert sjokk og dødsfall) er rapportert ved bruk av cefixim.
Før behandling med SUPRAX settes i gang, bør det foretas nøye undersøkelser for å avgjøre om pasienten tidligere har hatt overfølsomhetsreaksjoner overfor cefalosporiner, penicilliner eller andre legemidler. Hvis dette produktet skal gis til penicillinfølsomme pasienter, bør det utvises forsiktighet fordi kryssoverfølsomhet blant beta-laktam antibakterielle legemidler er klart dokumentert og kan forekomme hos opptil 10 % av pasientene med en historie med penicillinallergi. Hvis det oppstår en allergisk reaksjon på SUPRAX 100mg, seponer stoffet.
Clostridium Difficile-assosiert diaré
Clostridium difficile assosiert diaré (CDAD) er rapportert ved bruk av nesten alle antibakterielle midler, inkludert SUPRAX 200mg, og kan variere i alvorlighetsgrad fra mild diaré til fatal kolitt. Behandling med antibakterielle midler endrer normalfloraen i tykktarmen som fører til overvekst av C. difficile.
C. difficile produserer giftstoffer A og B som bidrar til utviklingen av CDAD. Hypertoksinproduserende isolater av C. difficile forårsaker økt sykelighet og dødelighet, da disse infeksjonene kan være motstandsdyktige mot antimikrobiell behandling og kan kreve kolektomi. CDAD må vurderes hos alle pasienter som får diaré etter bruk av antibakterielle legemidler. Nøye sykehistorie er nødvendig siden CDAD har blitt rapportert å oppstå over to måneder etter administrering av antibakterielle midler.
Hvis CDAD mistenkes eller bekreftes, kan pågående bruk av antibakterielle legemidler som ikke er rettet mot C. difficile må avbrytes. Hensiktsmessig væske- og elektrolyttbehandling, proteintilskudd, antibakteriell medikamentbehandling av C. difficile og kirurgisk evaluering bør iverksettes som klinisk indisert.
Dosejustering ved nedsatt nyrefunksjon
Dosen av SUPRAX 100 mg bør justeres hos pasienter med nedsatt nyrefunksjon, så vel som hos pasienter som gjennomgår kontinuerlig ambulatorisk peritonealdialyse (CAPD) og hemodialyse (HD). Pasienter i dialyse bør overvåkes nøye [se DOSERING OG ADMINISTRASJON ].
Koagulasjonseffekter
Cefalosporiner, inkludert SUPRAX 200 mg, kan være assosiert med et fall i protrombinaktivitet. De i risikogruppen inkluderer pasienter med nedsatt nyre- eller leverfunksjon, eller dårlig ernæringstilstand, samt pasienter som får en langvarig antimikrobiell behandling, og pasienter som tidligere har stabilisert seg på antikoagulantbehandling. Protrombintiden bør overvåkes hos pasienter med risiko og eksogent vitamin K administreres som angitt.
Utvikling av medikamentresistente bakterier
Forskrivning av SUPRAX (cefixim) i fravær av en påvist eller sterkt mistenkt bakteriell infeksjon vil neppe gi fordel for pasienten og øker risikoen for utvikling av medikamentresistente bakterier.
Risiko hos pasienter med fenylketonuri
Fenylalanin kan være skadelig for pasienter med fenylketonuri (PKU). SUPRAX 200 mg tyggetabletter inneholder aspartam, en kilde til fenylalanin. Hver 100 mg, 150 mg og 200 mg styrke inneholder henholdsvis 3,3 mg, 5 mg og 6,7 mg fenylalanin. Før du foreskriver SUPRAX tyggetabletter til en pasient med PKU, bør du vurdere den kombinerte daglige mengden fenylalanin fra alle kilder, inkludert SUPRAX 200 mg tyggetabletter.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Livstidsstudier på dyr for å evaluere kreftfremkallende potensiale er ikke utført. Cefixim forårsaket ikke punktmutasjoner i bakterier eller pattedyrceller, DNA-skade eller kromosomskade in vitro og viste ikke klastogent potensiale in vivo i mikronukleustesten hos mus. Hos rotter ble ikke fertilitet og reproduksjonsevne påvirket av cefixim ved doser opptil 25 ganger den terapeutiske dosen for voksne.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori B
Reproduksjonsstudier er utført på mus og rotter i doser opp til 40 ganger human dose og har ikke avdekket bevis for skade på fosteret på grunn av cefixim. Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for menneskelig respons, bør dette legemidlet kun brukes under graviditet hvis det er klart nødvendig.
Arbeid og levering
Cefixime har ikke blitt undersøkt for bruk under fødsel og fødsel. Behandling bør kun gis hvis det er klart nødvendig.
Ammende mødre
Det er ikke kjent om cefixim utskilles i morsmelk. Det bør vurderes å avslutte ammingen midlertidig under behandling med dette legemidlet.
Pediatrisk bruk
Sikkerhet og effektivitet av cefixim hos barn under seks måneder har ikke blitt fastslått. Forekomsten av gastrointestinale bivirkninger, inkludert diaré og løs avføring, hos pediatriske pasienter som fikk suspensjonen, var sammenlignbar med forekomsten sett hos voksne pasienter som fikk tabletter.
Geriatrisk bruk
Kliniske studier inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og eldre til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. En farmakokinetisk studie hos eldre oppdaget forskjeller i farmakokinetiske parametere [se KLINISK FARMAKOLOGI ]. Disse forskjellene var små og indikerer ikke behov for dosejustering av legemidlet hos eldre.
Nedsatt nyrefunksjon
Dosen av cefixim bør justeres hos pasienter med nedsatt nyrefunksjon samt de som gjennomgår kontinuerlig ambulatorisk peritonealdialyse (CAPD) og hemodialyse (HD). Pasienter i dialyse bør overvåkes nøye [se DOSERING OG ADMINISTRASJON ].
OVERDOSE
Mageskylling kan være indisert; ellers finnes det ingen spesifikk motgift. Cefixim fjernes ikke i betydelige mengder fra sirkulasjonen ved hemodialyse eller peritonealdialyse. Bivirkninger hos et lite antall friske voksne frivillige som fikk enkeltdoser på opptil 2 g cefixim skilte seg ikke fra profilen sett hos pasienter behandlet med anbefalte doser.
KONTRAINDIKASJONER
Suprax (cefixim) er kontraindisert hos pasienter med kjent allergi mot cefixim eller andre cefalosporiner.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Cefixime er et semisyntetisk cefalosporin antibakterielt medikament [se Mikrobiologi ].
Farmakokinetikk
SUPRAX 200 mg tyggetabletter er bioekvivalente med oral suspensjon.
SUPRAX 200 mg tabletter og suspensjon, gitt oralt, absorberes ca. 40 % til 50 % enten de administreres med eller uten mat; men tiden til maksimal absorpsjon økes med ca. 0,8 timer når det administreres sammen med mat. En enkelt 200 mg tablett med cefixim gir en gjennomsnittlig topp serumkonsentrasjon på ca. 2 mcg/ml (område 1 til 4 mcg/ml); en enkelt 400 mg tablett gir en gjennomsnittlig toppkonsentrasjon på ca. 3,7 mcg/ml (område 1,3 til 7,7 mcg/ml). Den orale suspensjonen produserer gjennomsnittlig toppkonsentrasjoner som er ca. 25 % til 50 % høyere enn tablettene, når testet hos normale voksne frivillige. To hundre og 400 mg doser oral suspensjon gir gjennomsnittlig toppkonsentrasjoner på henholdsvis 3 mcg/ml (område 1 til 4,5 mcg/ml) og 4,6 mcg/ml (område 1,9 til 7,7 mcg/ml), når de testes hos normale voksne frivillige. . Arealet under kurven for tid versus konsentrasjon (AUC) er ca. 10 % til 25 % større med mikstur enn med tabletten etter doser på 100 til 400 mg, ved testing hos normale voksne frivillige. Denne økte absorpsjonen bør tas i betraktning dersom den orale suspensjonen skal erstatte tabletten. På grunn av mangel på bioekvivalens, bør tabletter ikke erstatte mikstur suspensjon ved behandling av mellomørebetennelse [se DOSERING OG ADMINISTRASJON ]. Cross-over-studier av tablett versus suspensjon er ikke utført hos barn.
400 mg kapsel er bioekvivalent med 400 mg tablett under fastende forhold. Mat reduserer imidlertid absorpsjonen etter administrering av kapselen med ca. 15 % basert på AUC og 25 % basert på Cmax.
Maksimal serumkonsentrasjon oppstår mellom 2 og 6 timer etter oral administrering av en enkelt 200 mg tablett, en enkelt 400 mg tablett eller 400 mg cefiximsuspensjon. Maksimal serumkonsentrasjon oppstår mellom 2 og 5 timer etter en enkelt administrering av 200 mg suspensjon. Maksimal serumkonsentrasjon oppstår mellom 3 og 8 timer etter oral administrering av en enkelt 400 mg kapsel.
Fordeling
Serumproteinbinding er konsentrasjonsuavhengig med en bundet fraksjon på omtrent 65 %. I en flerdosestudie utført med en forskningsformulering som er mindre biotilgjengelig enn tabletten eller suspensjonen, var det liten akkumulering av legemiddel i serum eller urin etter dosering i 14 dager. Tilstrekkelige data om CSF-nivåer av cefixim er ikke tilgjengelig.
Metabolisme og utskillelse
Det er ingen bevis for metabolisme av cefixim in vivo. Omtrent 50 % av den absorberte dosen skilles ut uendret i urinen i løpet av 24 timer. I dyrestudier ble det bemerket at cefixim også skilles ut i gallen i overkant av 10 % av den administrerte dosen. Serumhalveringstiden for cefixim hos friske personer er uavhengig av doseringsform og er gjennomsnittlig 3 til 4 timer, men kan variere opptil 9 timer hos noen normale frivillige.
Spesielle populasjoner
Geriatri
Gjennomsnittlig AUC ved steady state hos eldre pasienter er omtrent 40 % høyere enn gjennomsnittlig AUC hos andre friske voksne. Forskjeller i farmakokinetiske parametere mellom 12 unge og 12 eldre forsøkspersoner som fikk 400 mg cefixim en gang daglig i 5 dager er oppsummert som følger:
Disse økningene var imidlertid ikke klinisk signifikante [se DOSERING OG ADMINISTRASJON ].
Nedsatt nyrefunksjon
Hos personer med moderat nedsatt nyrefunksjon (20 til 40 ml/min kreatininclearance), er gjennomsnittlig serumhalveringstid for cefixim forlenget til 6,4 timer. Ved alvorlig nedsatt nyrefunksjon (5 til 20 ml/min kreatininclearance) økte halveringstiden til gjennomsnittlig 11,5 timer. Legemidlet fjernes ikke signifikant fra blodet ved hemodialyse eller peritonealdialyse. En studie indikerte imidlertid at med doser på 400 mg, har pasienter som gjennomgår hemodialyse lignende blodprofiler som personer med kreatininclearance på 21 til 60 ml/min.
Mikrobiologi
Virkningsmekanismen
Som med andre cefalosporiner, er den bakteriedrepende virkningen av cefixim et resultat av hemming av celleveggsyntese. Cefixime er stabilt i nærvær av visse beta-laktamase-enzymer. Som et resultat kan visse organismer som er resistente mot penicilliner og noen cefalosporiner på grunn av tilstedeværelsen av betalaktamaser, være mottakelige for cefixim.
Motstand
Resistens mot cefixim i isolater av Haemophilus influenzae og Neisseria gonorrhoeae er oftest assosiert med endringer i penicillinbindende proteiner (PBP). Cefixime kan ha begrenset aktivitet mot Enterobacteriaceae som produserer utvidede spektrum beta-laktamaser (ESBL). Pseudomonas-arter, Enterococcus-arter, stammer av gruppe D-streptokokker, Listeria monocytogenes, de fleste stammer av stafylokokker (inkludert meticillin-resistente stammer), de fleste stammer av Enterobacter-arter, de fleste stammer av Bacteroides fragilis, og de fleste stammer av Clotostridium-arter er resistanser av Clotostridium.
Antimikrobiell aktivitet
Cefixim har vist seg å være aktivt mot de fleste isolater av følgende mikroorganismer, både in vitro og ved kliniske infeksjoner [se INDIKASJONER ].
Gram-positive bakterier
Streptococcus pneumoniae Streptococcus pyogenes
Gram-negative bakterier
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Følgende in vitro-data er tilgjengelige, men deres kliniske betydning er ukjent. Minst 90 prosent av de følgende bakteriene viser en in vitro minimum hemmende konsentrasjon (MIC) mindre enn eller lik det følsomme bruddpunktet for cefixim mot isolater av lignende slekt eller organismegruppe. Effekten av cefixim ved behandling av kliniske infeksjoner forårsaket av disse bakteriene har imidlertid ikke blitt fastslått i tilstrekkelige og godt kontrollerte kliniske studier.
Gram-positive bakterier
Streptococcus agalactiae
Gram-negative bakterier
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Providencia arter Salmonella arter Serratia marcescens Shigella arter
Resistenstesting
For spesifikk informasjon om tolkningskriterier for mottakelighetstest og tilhørende testmetoder og kvalitetskontrollstandarder anerkjent av FDA for dette legemidlet, se: https://www.fda.gov/STIC.
Kliniske studier
Sammenlignende kliniske studier av mellomørebetennelse ble utført på nesten 400 barn i alderen 6 måneder til 10 år. Streptococcus pneumoniae ble isolert fra 47 % av pasientene, Haemophilus influenzae fra 34 %, Moraxella catarrhalis fra 15 % og S. pyogenes fra 4 %.
Den totale responsraten for Streptococcus pneumoniae på cefixime var omtrent 10 % lavere og den for Haemophilus influenzae eller Moraxella catarrhalis omtrent 7 % høyere (12 % når beta-laktamase positive isolater av H. influenzae er inkludert) enn responsratene til disse organismene på de aktive kontrollmedisinene.
disse studiene ble pasientene randomisert og behandlet med enten cefixim ved doseregimer på 4 mg/kg to ganger daglig eller 8 mg/kg én gang daglig, eller med en komparator. 69 til 70 % av pasientene i hver gruppe hadde opphør av tegn og symptomer på mellomørebetennelse når de ble evaluert 2 til 4 uker etter behandling, men vedvarende effusjon ble funnet hos 15 % av pasientene. Når de ble evaluert ved avsluttet terapi, ble 17 % av pasientene som fikk cefixim og 14 % av pasientene som fikk effektive sammenlignende legemidler (18 % inkludert de pasientene som hadde Haemophilus influenzae som var resistente mot kontrollmedisinen og som fikk det antibakterielle kontrollmiddelet) ansett for å være behandlingssvikt. Ved 2 til 4 ukers oppfølging hadde totalt 30 %-31 % av pasientene tegn på enten behandlingssvikt eller tilbakevendende sykdom.
Bakteriologisk utfall av otitis media to til fire uker etter terapi basert på gjentatt mellomøre
PASIENTINFORMASJON
Råd pasientene om at antibakterielle legemidler, inkludert cefixim, kun skal brukes til å behandle bakterielle infeksjoner. De behandler ikke virusinfeksjoner (f.eks. forkjølelse). Når cefixim er foreskrevet for å behandle en bakteriell infeksjon, bør pasienter fortelles at selv om det er vanlig å føle seg bedre tidlig i behandlingsforløpet, bør medisinen tas nøyaktig som anvist. Å hoppe over doser eller ikke fullføre hele behandlingsforløpet kan: (1) redusere effektiviteten av den umiddelbare behandlingen og (2) øke sannsynligheten for at bakterier vil utvikle resistens og ikke vil kunne behandles med cefixim for oral suspensjon eller cefixim tyggetabletter eller andre antibakterielle medisiner i fremtiden.
Rådfør pasienter med fenylketonuri om at SUPRAX 200 mg tyggetabletter inneholder aspartam, en kilde til fenylalanin som følger: Hver SUPRAX tyggetablett inneholder henholdsvis 3,3 mg, 5 mg og 6,7 mg fenylalanin per 100 mg og 200 mg styrke.
Gi pasienter beskjed om at diaré er et vanlig problem forårsaket av antibakterielle legemidler som vanligvis slutter når det antibakterielle legemidlet seponeres. Noen ganger kan pasienter etter oppstart av behandling med antibakterielle legemidler utvikle vassen og blodig avføring (med eller uten magekramper og feber) selv så sent som to eller flere måneder etter å ha tatt den siste dosen av det antibakterielle legemidlet. Hvis dette skjer, bør pasienter kontakte legen sin så snart som mulig.
