Ceftin 250mg, 500mg, 125mg Cefuroxime Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Ceftin 500mg og hvordan brukes det?
Ceftin 500mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på bakterielle infeksjoner. Ceftin kan brukes alene eller sammen med andre medisiner.
Ceftin 250mg er et cefalosporinantibiotikum.
Det er ikke kjent om Ceftin er trygt og effektivt hos barn yngre enn 3 måneder.
Hva er de mulige bivirkningene av Ceftin?
Ceftin 250mg kan forårsake alvorlige bivirkninger inkludert:
- . sterke magesmerter, . diaré (med eller uten blod), . gulfarging av hud eller øyne, . hudutslett, . blåmerker, . alvorlig prikking eller nummenhet, . anfall (kramper), . vanskelig eller smertefull vannlating, . hevelse i føttene, anklene, ansiktet eller tungen, . tretthet, . kortpustethet, . feber, . sår hals, . brenner i øynene dine, . hudsmerter med rødt eller lilla utslett, . hudblemmer og peeling
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Ceftin inkluderer:
- . diaré, . kvalme, . oppkast, . uvanlig eller ubehagelig smak i munnen, . bleieutslett hos et spedbarn,
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Ceftin. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
CEFTIN 500mg tabletter og CEFTIN for oral suspensjon inneholder cefuroksim som cefuroksimaksetil. CEFTIN er et semisyntetisk, cefalosporin antibakterielt legemiddel for oral administrering.
Det kjemiske navnet på cefuroksim aksetil (1-(acetyloksy) etylester av cefuroksim) er (RS)-1-hydroksyetyl (6R,7R)-7-[2-(2-furyl)glyoksyl-amido]-3-(hydroksymetyl) )-8-okso-5-tia-1-azabicyklo[4.2.0]-okt-2-en-2-karboksylat, 72-(Z)-(O-metyl-oksim), 1-acetat 3-karbamat. Molekylformelen er C20H22N4O10S, og den har en molekylvekt på 510,48.
Cefuroksimaksetil er i amorf form og har følgende strukturformel:
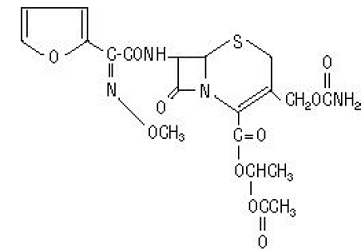
Tabletter er filmdrasjerte og inneholder tilsvarende 250 eller 500 mg cefuroksim som cefuroksimaksetil. Tabletter inneholder de inaktive ingrediensene kolloidalt silisiumdioksid, kroskarmellosenatrium, hydrogenert vegetabilsk olje, hypromellose, metylparaben, mikrokrystallinsk cellulose, propylenglykol, propylparaben, natriumbenzoat, natriumlaurylsulfat og titandioksid.
Oral suspensjon, når rekonstituert med vann, gir tilsvarende 125 mg eller 250 mg cefuroksim (som cefuroksimaksetil) per 5 ml. Oral suspensjon inneholder de inaktive ingrediensene acesulfamkalium, aspartam, povidon K30, stearinsyre, sukrose, tutti-frutti-aroma og xantangummi.
INDIKASJONER
Faryngitt/mandelbetennelse
CEFTIN 125 mg tabletter er indisert for behandling av voksne pasienter og pediatriske pasienter (13 år og eldre) med mild til moderat faryngitt/tonsillitt forårsaket av følsomme stammer av Streptococcus pyogenes.
CEFTIN 500 mg til mikstur, suspensjon er indisert for behandling av pediatriske pasienter i alderen 3 måneder til 12 år med mild til moderat faryngitt/tonsillitt forårsaket av følsomme stammer av Streptococcus pyogenes.
Bruksbegrensninger
- . Effekten av CEFTIN i forebygging av revmatisk feber ble ikke fastslått i kliniske studier. . Effekten av CEFTIN 125 mg i behandlingen av penicillinresistente stammer av Streptococcus pyogenes er ikke påvist i kliniske studier.
Akutt bakteriell mellomørebetennelse
CEFTIN 125mg tabletter er indisert for behandling av pediatriske pasienter (som kan svelge tabletter hele) med akutt bakteriell otitis media forårsaket av følsomme stammer av Streptococcus pneumoniae, Haemophilus influenzae (inkludert β-lactamase-produserende stammer) -produserende stammer), eller Streptococcus pyogenes.
CEFTIN for oral suspensjon er indisert for behandling av pediatriske pasienter i alderen 3 måneder til 12 år med akutt bakteriell mellomørebetennelse forårsaket av følsomme stammer av Streptococcus pneumoniae, Haemophilus influenzae (inkludert β-laktamaseproduserende stammer), Moraxella catarrudtais -produserende stammer), eller Streptococcus pyogenes.
Akutt bakteriell maksillær bihulebetennelse
CEFTIN-tabletter er indisert for behandling av voksne og pediatriske pasienter (13 år og eldre) med mild til moderat akutt bakteriell maksillær bihulebetennelse forårsaket av følsomme stammer av Streptococcus pneumoniae eller Haemophilus influenzae (kun ikke-β-laktamaseproduserende stammer).
CEFTIN 250 mg til mikstur, suspensjon er indisert for behandling av pediatriske pasienter i alderen 3 måneder til 12 år med mild til moderat akutt bakteriell maksillær bihulebetennelse forårsaket av følsomme stammer av Streptococcus pneumoniae eller Haemophilus influenzae (bare ikke-β-produserende laktamasestammer) .
Bruksbegrensninger
Effektiviteten av CEFTIN for bihuleinfeksjoner forårsaket av β-laktamase-produserende Haemophilus influenzae eller Moraxella catarrhalis hos pasienter med akutt bakteriell maksillær bihulebetennelse ble ikke fastslått på grunn av utilstrekkelig antall av disse isolatene i de kliniske studiene [se Kliniske studier ].
Akutte bakterielle eksaserbasjoner av kronisk bronkitt
CEFTIN-tabletter er indisert for behandling av voksne pasienter og pediatriske pasienter (13 år og eldre) med mild til moderat akutt bakteriell forverring av kronisk bronkitt forårsaket av følsomme stammer av Streptococcus pneumoniae, Haemophilus influenzae (β-negative stammer), eller Haemophilus para influenzae (β-laktamase-negative stammer).
Ukompliserte hud- og hudstrukturinfeksjoner
CEFTIN 250 mg tabletter er indisert for behandling av voksne pasienter og pediatriske pasienter (13 år og eldre) med ukompliserte hud- og hudstrukturinfeksjoner forårsaket av følsomme stammer av Staphylococcus aureus (inkludert β-laktamaseproduserende stammer) eller Streptococcus pyogenes.
Ukompliserte urinveisinfeksjoner
CEFTIN 500 mg tabletter er indisert for behandling av voksne pasienter og pediatriske pasienter (13 år og eldre) med ukompliserte urinveisinfeksjoner forårsaket av følsomme stammer av Escherichia coli eller Klebsiella pneumoniae.
Ukomplisert gonoré
CEFTIN-tabletter er indisert for behandling av voksne pasienter og pediatriske pasienter (13 år og eldre) med ukomplisert gonoré, urethral og endocervikal, forårsaket av penicillinaseproduserende og ikke-penicillinaseproduserende følsomme stammer av Neisseria gonorrhoeae hos kvinner i recirkulasjons-, og ukomplicerte kvinner. , forårsaket av ikke-penicillinase-produserende følsomme stammer av Neisseria gonorrhoeae.
Tidlig Lyme-sykdom (erythema migrans)
CEFTIN-tabletter er indisert for behandling av voksne pasienter og pediatriske pasienter (13 år og eldre) med tidlig borreliose (erythema migrans) forårsaket av følsomme stammer av Borrelia burgdorferi.
Impetigo
CEFTIN 250 mg til oral suspensjon er indisert for behandling av pediatriske pasienter i alderen 3 måneder til 12 år med impetigo forårsaket av følsomme stammer av Staphylococcus aureus (inkludert Plactamase-produserende stammer) eller Streptococcus pyogenes.
Bruk
For å redusere utviklingen av medikamentresistente bakterier og opprettholde effektiviteten til CEFTIN og andre antibakterielle legemidler, skal CEFTIN 500mg kun brukes til å behandle eller forebygge infeksjoner som er bevist eller sterkt mistenkt å være forårsaket av følsomme bakterier. Når kultur- og mottakelighetsinformasjon er tilgjengelig, bør de vurderes ved valg eller modifisering av antibakteriell terapi. I mangel av slike data kan lokal epidemiologi og mottakelighetsmønstre bidra til empirisk valg av terapi.
DOSERING OG ADMINISTRASJON
Viktige administrasjonsinstruksjoner
- . CEFTIN-tabletter og CEFTIN for mikstur, suspensjon er ikke bioekvivalente og kan derfor ikke erstattes på milligram-per-milligram-basis [se KLINISK FARMAKOLOGI ]. . Administrer CEFTIN tabletter eller mikstur som beskrevet i de aktuelle doseringsretningslinjene [se Dosering for CEFTIN 500mg tabletter, Dosering for CEFTIN 250mg for oral suspensjon og Tilberedning og administrering av CEFTIN 125mg for oral suspensjon ]. . Administrer CEFTIN 500 mg tabletter med eller uten mat. . Administrer CEFTIN 500mg til mikstur, suspensjon sammen med mat. . Pediatriske pasienter (i alderen 13 år og eldre) som ikke kan svelge CEFTIN 125 mg tabletter hele bør få CEFTIN som mikstur, fordi tabletten har en sterk, vedvarende bitter smak når den knuses [se Dosering for CEFTIN tabletter ].
Dosering for CEFTIN 500mg tabletter
Administrer CEFTIN 250 mg tabletter som beskrevet i doseringstabellen nedenfor med eller uten mat.
Dosering for CEFTIN For oral suspensjon
Administrer CEFTIN til mikstur som beskrevet i doseringstabellen nedenfor med mat.
Klargjøring og administrering av CEFTIN for oral suspensjon
Forbered en suspensjon ved utleveringstidspunktet som følger:
. Rist flasken for å løsne pulveret. . Fjern lokket. . Tilsett den totale mengden kaldt vann for rekonstituering (tabell 3) og sett på lokket. . Snu flasken og vipp flasken kraftig fra side til side slik at vannet stiger gjennom pulveret. . Når lyden av pulveret mot flasken forsvinner, snu flasken oppreist og rist den kraftig i diagonal retning i minst ett minutt. . Etter rekonstituering, vent en time før du administrerer suspensjon til en pasient.
- . Rist miksturen godt før hver bruk. . Sett lokket godt på plass etter hver åpning. . Oppbevar den rekonstituerte suspensjonen i kjøleskap mellom 2° og 8°C (36° og 46°F). . Kast den rekonstituerte suspensjonen etter 10 dager.
Dosering hos pasienter med nedsatt nyrefunksjon
En doseintervalljustering er nødvendig for pasienter hvis kreatininclearance er mindre enn 30 ml/min, som oppført i tabell 4 nedenfor, fordi cefuroksim elimineres primært av nyrene [se KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
CEFTIN tabletter er hvite, kapselformede, filmdrasjerte tabletter tilgjengelig i følgende styrker:
- . 250 mg cefuroksim (som cefuroksimaksetil) med "GX ES7" inngravert på den ene siden og blank på den andre siden. . 500 mg cefuroksim (som cefuroksimaksetil) med "GX EG2" inngravert på den ene siden og blank på den andre siden.
CEFTIN til mikstur, suspensjon leveres som tørt, hvitt til off-white, tutti-frutti-smakspulver. Når rekonstituert som anvist, gir suspensjonen tilsvarende 125 mg eller 250 mg cefuroksim (som cefuroksimaksetil) per 5 ml.
Oppbevaring og håndtering
CEFTIN tabletter, 250 mg cefuroksim (som cefuroksim aksetil), er hvite, kapselformede, filmdrasjerte tabletter merket med "GX ES7" på den ene siden og blanke på den andre siden som følger: 20 tabletter/flaske NDC 0173-0387-00
CEFTIN tabletter, 500 mg cefuroksim (som cefuroksim aksetil), er hvite, kapselformede, filmdrasjerte tabletter merket med "GX EG2" på den ene siden og blanke på den andre siden som følger: 20 tabletter/flaske NDC 0173-0394-00
Oppbevar tablettene mellom 15° og 30°C (59° og 86°F). Sett lokket godt på plass etter hver åpning.
CEFTIN 500 mg til mikstur, suspensjon leveres som tørt, hvitt til off-white pulver med tutti-frutti-smak. Når rekonstituert som anvist, gir suspensjonen tilsvarende 125 mg eller 250 mg cefuroksim (som cefuroksimaksetil) per 5 ml. Den leveres i gule glassflasker som følger:
125 mg/5 ml
100 ml suspensjon NDC 0173-0740-00
250 mg/5 ml
50 ml suspensjon NDC 0173-0741-10 100-mL Suspensjon NDC 0173-0741-00
Før rekonstituering, oppbevar tørt pulver mellom 2° og 30°C (36° og 86°F).
Etter rekonstituering, oppbevar suspensjonen umiddelbart i kjøleskap mellom 2° og 8°C (36° og 46°F). KASTE ETTER 10 DAGER.
GlaxoSmithKline, Research Triangle Park, NC 27709. Revidert: okt 2017
BIVIRKNINGER
Følgende alvorlige og ellers viktige bivirkning er beskrevet mer detaljert i avsnittet Advarsler og forholdsregler på etiketten:
Anafylaktiske reaksjoner [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
Nettbrett
Doseringsregimer med flere doser med 7 til 10 dagers varighet
kliniske studier med flere doser ble 912 personer behandlet med CEFTIN (125 til 500 mg to ganger daglig). Det bemerkes at 125 mg to ganger daglig ikke er en godkjent dosering. Tjue (2,2 %) forsøkspersoner avbrøt medisinering på grunn av bivirkninger. Sytten (85 %) av de 20 pasientene som avbrøt behandlingen gjorde det på grunn av gastrointestinale forstyrrelser, inkludert diaré, kvalme, oppkast og magesmerter. Prosentandelen av personer behandlet med CEFTIN som avbrøt studiemedisinen på grunn av bivirkninger var lik ved daglige doser på 1000, 500 og 250 mg (henholdsvis 2,3 %, 2,1 % og 2,2 %). Imidlertid økte forekomsten av gastrointestinale bivirkninger med de høyere anbefalte dosene.
Bivirkningene i tabell 5 er for forsøkspersoner (n = 912) behandlet med CEFTIN 250 mg i kliniske studier med flere doser.
Følgende bivirkninger forekom hos mindre enn 1 %, men mer enn 0,1 % av pasientene (n = 912) behandlet med CEFTIN i kliniske studier med flere doser.
Forstyrrelser i immunsystemet Elveblest, hoven tunge.
Metabolisme og ernæringsforstyrrelser : Anoreksi.
Forstyrrelser i nervesystemet : Hodepine.
Hjertelidelser : Brystsmerter.
Respiratoriske lidelser : Kortpustethet.
Gastrointestinale lidelser : Magesmerter, magekramper, flatulens, fordøyelsesbesvær, munnsår.
Hud- og subkutane vevslidelser : Utslett, kløe.
Nyre- og urinveislidelser : Dysuri.
Reproduktive system og brystsykdommer : Vaginitt, vulva kløe.
Generelle lidelser og administrasjonsbetingelser : Frysninger, søvnighet, tørste.
Undersøkelser : Positiv Coombs' test.
Tidlig Lyme-sykdom med 20-dagers regime
To multisenterstudier vurderte CEFTIN 500 mg to ganger daglig i 20 dager. De vanligste legemiddelrelaterte bivirkningene var diaré (10,6 %), Jarisch-Herxheimer-reaksjon (5,6 %) og vaginitt (5,4 %). Andre uønskede opplevelser forekom med frekvenser sammenlignbare med de som ble rapportert ved 7 til 10 dagers dosering.
Enkeltdoseregime for ukomplisert gonoré
I kliniske studier med en enkeltdose på 1 000 mg CEFTIN 250 mg, ble 1 061 personer behandlet for ukomplisert gonoré. Bivirkningene i tabell 6 var for personer behandlet med en enkeltdose på 1000 mg CEFTIN i amerikanske kliniske studier.
Følgende bivirkninger forekom hos mindre enn 1 %, men mer enn 0,1 % av pasientene (n = 1061) behandlet med en enkeltdose CEFTIN 1000 mg for ukomplisert gonoré i amerikanske kliniske studier.
Infeksjoner og angrep : Vaginal candidiasis.
Forstyrrelser i nervesystemet : Hodepine, svimmelhet, somnolens.
Hjertelidelser : Stramhet/smerter i brystet, takykardi.
Gastrointestinale lidelser : Magesmerter, dyspepsi.
Hud- og subkutane vevslidelser : Erytem, utslett, kløe.
Muskuloskeletale og bindevevslidelser : Muskelkramper, muskelstivhet, muskelspasmer i nakken, reaksjon på kjevetypen.
Nyre- og urinveislidelser : Blødning/smerter i urinrøret, nyresmerter.
Reproduktive system og brystsykdommer : Vaginal kløe, utflod fra skjeden.
Oral suspensjon
I kliniske studier med multiple doser av CEFTIN 250 mg, ble pediatriske forsøkspersoner (96,7 % var yngre enn 12 år) behandlet med CEFTIN (20 til 30 mg/kg/dag fordelt to ganger daglig opp til en maksimal dose på 500 eller 1000 mg/dag, henholdsvis). Elleve (1,2 %) amerikanske forsøkspersoner avsluttet medisinering på grunn av bivirkninger. Seponeringene var primært for gastrointestinale forstyrrelser, vanligvis diaré eller oppkast. Tretten (1,4 %) amerikanske pediatriske forsøkspersoner avbrøt behandlingen på grunn av smak og/eller problemer med legemiddeladministrering.
Bivirkningene i tabell 7 er for amerikanske personer (n = 931) behandlet med CEFTIN i kliniske studier med flere doser.
Følgende bivirkninger forekom hos mindre enn 1 %, men mer enn 0,1 % av amerikanske forsøkspersoner (n = 931) behandlet med CEFTIN for oral suspensjon i kliniske studier med flere doser.
Infeksjoner og angrep : Gastrointestinal infeksjon, candidiasis, virussykdom, øvre luftveisinfeksjon, bihulebetennelse, urinveisinfeksjon.
Blod- og lymfesystemlidelser : Eosinofili.
Psykiatriske lidelser : Hyperaktivitet, irritabel oppførsel.
Gastrointestinale lidelser : Magesmerter, flatulens, ptyalisme.
Hud- og subkutane vevslidelser : Utslett.
Muskuloskeletale og bindevevslidelser : Leddhevelse, artralgi.
Reproduktive system og brystsykdommer : Vaginal irritasjon.
Generelle lidelser og administrasjonsbetingelser : Hoste, feber.
Undersøkelser : Forhøyede leverenzymer, positiv Coombs' test.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av CEFTIN etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Blod- og lymfesystemlidelser
Hemolytisk anemi, leukopeni, pancytopeni, trombocytopeni.
Gastrointestinale lidelser
Pseudomembranøs kolitt [se ADVARSLER OG FORHOLDSREGLER ].
Lever og gallesykdommer
Nedsatt leverfunksjon inkludert hepatitt og kolestase, gulsott.
Forstyrrelser i immunsystemet
Anafylaksi, serumsykdomslignende reaksjon.
Undersøkelser
Økt protrombintid.
Forstyrrelser i nervesystemet
Anfall, encefalopati.
Nyre- og urinveislidelser
Nyredysfunksjon.
Hud- og subkutane vevslidelser
Angioødem, erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, urticaria.
NARKOTIKAHANDEL
Orale prevensjonsmidler
Cefuroksimaksetil kan påvirke tarmfloraen, noe som fører til lavere østrogenreabsorpsjon og redusert effekt av kombinerte orale østrogen/progesteron-prevensjonsmidler. Råd pasientene til å vurdere alternative supplerende (ikke-hormonelle) prevensjonstiltak under behandlingen.
Legemidler som reduserer surheten i magen
Legemidler som reduserer surheten i magen kan føre til lavere biotilgjengelighet av CEFTIN sammenlignet med administrering i fastende tilstand. Administrering av legemidler som reduserer surheten i magen kan oppheve mateffekten av økt absorpsjon av CEFTIN 250mg når det administreres i postprandial tilstand. Administrer CEFTIN minst 1 time før eller 2 timer etter administrering av korttidsvirkende antacida. Histamin-2 (H2)-antagonister og protonpumpehemmere bør unngås.
Probenecid
Samtidig administrering av probenecid og cefuroksimaksetil-tabletter øker serumkonsentrasjonen av cefuroksim [se KLINISK FARMAKOLOGI ]. Samtidig administrering av probenecid med cefuroksimaksetil anbefales ikke.
Interaksjoner med legemiddel/laboratorietest
En falsk positiv reaksjon for glukose i urinen kan oppstå med kobberreduksjonstester (f.eks. Benedicts eller Fehlings løsning), men ikke med enzymbaserte tester for glykosuri. Siden et falsk-negativt resultat kan forekomme i ferricyanid-testen, anbefales det at enten glukoseoksidase- eller heksokinasemetoden brukes for å bestemme blod-/plasmaglukosenivåer hos pasienter som får cefuroksimaksetil. Tilstedeværelsen av cefuroksim forstyrrer ikke analysen av serum- og urinkreatinin ved den alkaliske pikratmetoden.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Anafylaktiske reaksjoner
Alvorlige og til tider dødelige overfølsomhetsreaksjoner (anafylaktiske) er rapportert hos pasienter på β-laktam antibakterielle midler. Disse reaksjonene er mer sannsynlig å oppstå hos personer med en historie med β-laktam-overfølsomhet og/eller en historie med følsomhet for flere allergener. Det har vært rapporter om personer med penicillinoverfølsomhet i anamnesen som har opplevd alvorlige reaksjoner ved behandling med cefalosporiner. CEFTIN 500mg er kontraindisert hos pasienter med kjent overfølsomhet overfor CEFTIN eller andre β-laktam antibakterielle legemidler [se KONTRAINDIKASJONER ]. Før du starter behandling med CEFTIN, må du spørre om tidligere overfølsomhetsreaksjoner mot penicilliner, cefalosporiner eller andre allergener. Hvis en allergisk reaksjon oppstår, seponer CEFTIN og sett i gang passende behandling.
Clostridium Difficile-assosiert diaré
Clostridium difficile-assosiert diaré (CDAD) er rapportert ved bruk av nesten alle antibakterielle midler, inkludert CEFTIN, og kan variere i alvorlighetsgrad fra mild diaré til fatal kolitt. Behandling med antibakterielle midler endrer normalfloraen i tykktarmen som fører til overvekst av C. difficile.
C. difficile produserer giftstoffer A og B som bidrar til utviklingen av CDAD. Hypertoksinproduserende stammer av C. difficile forårsaker økt sykelighet og dødelighet, da disse infeksjonene kan være motstandsdyktige mot antimikrobiell behandling og kan kreve kolektomi. CDAD må vurderes hos alle pasienter som får diaré etter antibiotikabruk. Nøye sykehistorie er nødvendig siden CDAD har blitt rapportert å oppstå over 2 måneder etter administrering av antibakterielle midler.
Hvis CDAD mistenkes eller bekreftes, kan pågående antibiotikabruk som ikke er rettet mot C. difficile må avbrytes. Hensiktsmessig væske- og elektrolyttbehandling, proteintilskudd, antibiotikabehandling av C. difficile og kirurgisk evaluering bør iverksettes som klinisk indisert.
Potensial for mikrobiell overvekst
Muligheten for superinfeksjoner med sopp- eller bakteriepatogener bør vurderes under behandlingen.
Utvikling av medikamentresistente bakterier
Forskrivning av CEFTIN enten i fravær av en påvist eller sterkt mistenkt bakteriell infeksjon eller en profylaktisk indikasjon vil neppe gi fordel for pasienten og øker risikoen for utvikling av medikamentresistente bakterier.
Fenylketonuri
CEFTIN 125mg for mikstur suspensjon 125 mg/5 ml inneholder fenylalanin 11,8 mg per 5 ml (1 teskje) rekonstituert suspensjon. CEFTIN 250 mg til mikstur suspensjon 250 mg/5 ml inneholder fenylalanin 25,2 mg per 5 ml (1 teskje) rekonstituert suspensjon.
Interferens med glukosetester
Et falskt positivt resultat for glukose i urinen kan oppstå med kobberreduksjonstester, og et falskt negativt resultat for blod/plasmaglukose kan oppstå med ferricyanidprøver hos personer som får CEFTIN [se NARKOTIKAHANDEL ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Selv om livstidsstudier på dyr ikke er utført for å evaluere karsinogent potensial, ble det ikke funnet noen mutagen aktivitet for cefuroksimaksetil i en rekke bakterielle mutasjonstester. Positive resultater ble oppnådd i en in vitro kromosomavviksanalyse; negative resultater ble imidlertid funnet i en in vivo mikronukleustest ved doser opp til 1,5 g/kg. Reproduksjonsstudier på rotter ved doser opp til 1000 mg/kg/dag (9 ganger anbefalt maksimal dose for mennesker basert på kroppsoverflate) har ikke vist noen svekkelse av fertilitet.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori B. Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for menneskelig respons, bør CEFTIN kun brukes under graviditet hvis det er klart nødvendig.
Reproduksjonsstudier er utført på mus i doser på opptil 3200 mg/kg/dag (14 ganger anbefalt maksimal dose for mennesker basert på kroppsoverflate) og på rotter i doser opptil 1000 mg/kg/dag (9 ganger anbefalt maksimum) human dose basert på kroppsoverflate) og har ikke avslørt tegn på nedsatt fertilitet eller skade på fosteret på grunn av cefuroksimaksetil.
Ammende mødre
Siden cefuroksim skilles ut i morsmelk, bør det utvises forsiktighet når CEFTIN 500 mg gis til en ammende kvinne.
Pediatrisk bruk
Sikkerheten og effektiviteten til CEFTIN 250 mg er fastslått for pediatriske pasienter i alderen 3 måneder til 12 år for akutt bakteriell maksillær bihulebetennelse basert på godkjenning hos voksne. Bruk av CEFTIN hos pediatriske pasienter støttes av farmakokinetiske og sikkerhetsdata hos voksne og pediatriske pasienter, og av kliniske og mikrobiologiske data fra adekvate og velkontrollerte studier av behandling av akutt bakteriell maksillær bihulebetennelse hos voksne og av akutt otitis media med effusjon i pediatriske pasienter. Det støttes også av bivirkningsovervåking etter markedsføring. [Se INDIKASJONER OG BRUK , DOSERING OG ADMINISTRASJON , BIVIRKNINGER , KLINISK FARMAKOLOGI ]
Geriatrisk bruk
Av det totale antallet forsøkspersoner som fikk CEFTIN 250 mg i 20 kliniske studier, var 375 i alderen 65 år og eldre, mens 151 var 75 år eller eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre voksne. Rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre voksne pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes.
Cefuroksim skilles hovedsakelig ut av nyrene, og risikoen for bivirkninger kan være større hos pasienter med nedsatt nyrefunksjon. Fordi eldre pasienter har større sannsynlighet for å ha nedsatt nyrefunksjon, bør det utvises forsiktighet ved dosevalg, og det kan være nyttig å overvåke nyrefunksjonen.
Nedsatt nyrefunksjon
Redusering av dosen av CEFTIN 125mg anbefales for voksne pasienter med alvorlig nedsatt nyrefunksjon (kreatininclearance DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ].
OVERDOSE
Overdosering av cefalosporiner kan forårsake cerebral irritasjon som kan føre til kramper eller encefalopati. Serumnivåer av cefuroksim kan reduseres ved hemodialyse og peritonealdialyse.
KONTRAINDIKASJONER
CEFTIN er kontraindisert hos pasienter med kjent overfølsomhet (f.eks. anafylaksi) overfor CEFTIN eller andre β-laktam antibakterielle legemidler (f.eks. penicilliner og cefalosporiner).
KLINISK FARMAKOLOGI
Virkningsmekanismen
CEFTIN 250mg er et antibakterielt medikament [se Mikrobiologi ].
Farmakokinetikk
Absorpsjon
Etter oral administrering absorberes cefuroksimaksetil fra mage-tarmkanalen og hydrolyseres raskt av uspesifikke esteraser i tarmslimhinnen og blodet til cefuroksim. Serumfarmakokinetiske parametere for cefuroksim etter administrering av CEFTIN 250 mg tabletter til voksne er vist i tabell 8.
Mateffekt
Absorpsjonen av tabletten er større når den tas etter mat (absolutt biotilgjengelighet øker fra 37 % til 52 %). Til tross for denne forskjellen i absorpsjon, var den kliniske og bakteriologiske responsen til forsøkspersonene uavhengig av matinntak på tidspunktet for tablettadministrasjon i 2 studier hvor dette ble vurdert.
Alle farmakokinetiske og kliniske effektivitets- og sikkerhetsstudier hos pediatriske personer som brukte suspensjonsformuleringen ble utført i matet tilstand. Ingen data er tilgjengelig på absorpsjonskinetikken til suspensjonsformuleringen når den administreres til fastende pediatriske personer.
Mangel på bioekvivalens
Oral suspensjon var ikke bioekvivalent med tabletter ved testing hos friske voksne. Tablett- og orale suspensjonsformuleringene er IKKE substituerbare på milligram-permilligram-basis. Arealet under kurven for suspensjonen var i gjennomsnitt 91 % av det for tabletten, og toppplasmakonsentrasjonen for suspensjonen var i gjennomsnitt 71 % av toppplasmakonsentrasjonen til tablettene. Derfor ble sikkerheten og effektiviteten til både tablettene og orale suspensjonsformuleringene fastslått i separate kliniske studier.
Fordeling
Cefuroksim er fordelt gjennom de ekstracellulære væskene. Omtrent 50 % av serumcefuroksim er bundet til protein.
Metabolisme
Aksetildelen metaboliseres til acetaldehyd og eddiksyre.
Utskillelse
Cefuroksim utskilles uendret i urinen; hos voksne gjenfinnes omtrent 50 % av den administrerte dosen i urinen innen 12 timer. Farmakokinetikken til cefuroksim hos pediatriske personer er ikke studert. Inntil ytterligere data er tilgjengelig, bør den renale eliminasjonen av cefuroksimaksetil etablert hos voksne ikke ekstrapoleres til pediatriske personer.
Spesifikke populasjoner
Nedsatt nyrefunksjon
I en studie med 28 voksne med normal nyrefunksjon eller alvorlig nedsatt nyrefunksjon (kreatininclearance DOSERING OG ADMINISTRASJON ].
Pediatriske pasienter
Serumfarmakokinetiske parametere for cefuroksim hos pediatriske personer som får CEFTIN som mikstur, er vist i tabell 9.
Geriatriske pasienter
en studie med 20 eldre forsøkspersoner (gjennomsnittsalder = 83,9 år) med en gjennomsnittlig kreatininclearance på 34,9 ml/min, ble gjennomsnittlig serumeliminasjonshalveringstid forlenget til 3,5 timer; til tross for lavere eliminering av cefuroksim hos geriatriske pasienter, er dosejustering basert på alder ikke nødvendig [se Bruk i spesifikke populasjoner ].
Narkotikahandel
Samtidig administrering av probenecid og cefuroksim-aksetil-tabletter øker cefuroksimområdet under serumkonsentrasjonen versus tidskurven og maksimal serumkonsentrasjon med henholdsvis 50 % og 21 %.
Mikrobiologi
Virkningsmekanismen
Cefuroksimaksetil er et bakteriedrepende middel som virker ved å hemme bakteriell celleveggsyntese. Cefuroksimaksetil har aktivitet i nærvær av noen β-laktamaser, både penicillinaser og cefalosporinaser, av gram-negative og gram-positive bakterier.
Motstandsmekanisme
Resistens mot cefuroksimaksetil er primært gjennom hydrolyse av β-laktamase, endring av penicillinbindende proteiner (PBP), redusert permeabilitet og tilstedeværelse av bakterielle utstrømningspumper.
Mottakelighet for cefuroksimaksetil vil variere med geografi og tid; lokale følsomhetsdata bør konsulteres, hvis tilgjengelig. Beta-laktamase-negative, ampicillin-resistente (BLNAR) isolater av H. influenzae bør vurderes som resistente mot cefuroksimaksetil.
Cefuroksimaksetil har vist seg å være aktiv mot de fleste isolater av følgende bakterier, både in vitro og ved kliniske infeksjoner [se INDIKASJONER OG BRUK ]:
Gram-positive bakterier
Staphylococcus aureus (bare meticillin-følsomme isolater) Streptococcus pneumoniae Streptococcus pyogenes
Gram-negative bakterier
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a Mest utvidet spektrum β-laktamase (ESBL)-produserende og karbapenemase-produserende isolater er resistente mot cefuroksim. Spirochetes Borrelia Burgdorferi
Følgende in vitro-data er tilgjengelige, men deres kliniske betydning er ukjent. Minst 90 prosent av følgende mikroorganismer viser en in vitro minimum hemmende konsentrasjon (MIC) mindre enn eller lik det følsomme bruddpunktet for cefuroksimaksetil på 1 mcg/ml. Effekten av cefuroksimaksetil ved behandling av kliniske infeksjoner på grunn av disse mikroorganismene har imidlertid ikke blitt fastslått i tilstrekkelige og godt kontrollerte kliniske studier.
Gram-positive bakterier
Staphylococcus epidermidis (bare meticillinfølsomme isolater) Staphylococcus saprophyticus (bare meticillinfølsomme isolater) Streptococcus agalactiae
Gram-negative bakterier
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Anaerobe bakterier Peptococcus niger
Testmetoder for mottakelighet
Når det er tilgjengelig, bør det kliniske mikrobiologiske laboratoriet gi resultatene av in vitro-følsomhetstester for antimikrobielle legemidler brukt i lokale sykehus og praksisområder til legen som periodiske rapporter som beskriver mottakelighetsprofilen til nosokomiale og lokalsamfunnservervede patogener. Disse rapportene skal hjelpe legen med å velge et antibakterielt legemiddel for behandling.
Fortynningsteknikker
Kvantitative metoder brukes for å bestemme antimikrobielle MIC-er. Disse MIC-ene gir reproduserbare estimater av følsomheten til bakterier for antimikrobielle forbindelser. MIC-verdiene bør bestemmes ved hjelp av en standardisert testmetode (buljong eller agar).1, 2 MIC-verdiene bør tolkes i henhold til kriteriene gitt i tabell 10.2,3
Diffusjonsteknikker
Kvantitative metoder som krever måling av sonediametre gir også reproduserbare estimater av bakteriers mottakelighet for antimikrobielle forbindelser. Sonestørrelsen gir et estimat av bakteriers mottakelighet for antimikrobielle forbindelser. Sonestørrelsen bør bestemmes ved hjelp av en standardisert testmetode.4 Denne prosedyren bruker papirskiver impregnert med 30 mcg cefuroksimaksetil for å teste mikroorganismers mottakelighet for cefuroksimaksetil. Fortolkningskriteriene for diskdiffusjon er gitt i tabell 10.3
Stafylokokkers mottakelighet for cefuroksim kan utledes fra testing av kun penicillin og enten cefoxitin eller oksacillin.
Mottakelighet for Streptococcus pyogenes kan utledes fra testing av penicillin.3
En rapport om "Følelig" indikerer at det antimikrobielle stoffet sannsynligvis vil hemme veksten av patogenet hvis det antimikrobielle stoffet når den konsentrasjonen som vanligvis er oppnåelig på infeksjonsstedet. En rapport med "Intermediate" indikerer at resultatet bør betraktes som tvetydig, og hvis mikroorganismen ikke er fullt mottakelig for alternative, klinisk mulige legemidler, bør testen gjentas. Denne kategorien antyder mulig klinisk anvendbarhet på kroppssteder der legemidlet er fysiologisk konsentrert eller i situasjoner der høye doser medikament kan brukes. Denne kategorien gir også en buffersone som forhindrer at små ukontrollerte tekniske faktorer forårsaker store tolkningsavvik. En rapport om "Resistent" indikerer at det antimikrobielle stoffet sannsynligvis ikke vil hemme veksten av patogenet hvis det antimikrobielle stoffet når konsentrasjonene som vanligvis kan oppnås på infeksjonsstedet; annen terapi bør velges.
Kvalitetskontroll
Standardiserte følsomhetstestprosedyrer krever bruk av laboratoriekontroller for å overvåke og sikre nøyaktigheten og presisjonen til forsyninger og reagenser som brukes i analysen, og teknikkene til individet som utfører testen.1,2,4 QC-områdene for MIC og diskdiffusjon testing med 30-mcg-disken er gitt i tabell 11.3
Kliniske studier
Akutt bakteriell maksillær bihulebetennelse
En adekvat og godt kontrollert studie ble utført med personer med akutt bakteriell maxillær bihulebetennelse. I denne studien hadde hvert individ et maxillar sinus-aspirat samlet ved sinuspunktur før behandling ble startet for presumptiv akutt bakteriell bihulebetennelse. Alle forsøkspersonene hadde radiografiske og kliniske tegn på akutt maksillær bihulebetennelse. I studien var den kliniske effekten av CEFTIN ved behandling av akutt maksillær bihulebetennelse sammenlignbar med et oralt antimikrobielt middel som inneholder en spesifikk β-laktamasehemmer. Mikrobiologiske data viste imidlertid at CEFTIN er effektivt i behandling av akutt bakteriell maksillær bihulebetennelse kun på grunn av Streptococcus pneumoniae eller ikke-β-laktamaseproduserende Haemophilus influenzae. Utilstrekkelig antall β-laktamase-produserende Haemophilus influenzae og Moraxella catarrhalis isolater ble oppnådd i denne studien for å kunne evaluere effektiviteten av CEFTIN ved behandling av akutt bakteriell maksillær bihulebetennelse på grunn av disse 2 organismene.
Denne studien randomiserte 317 voksne personer, 132 personer i USA og 185 personer i Sør-Amerika. Tabell 12 viser resultatene av intent-to-treat-analysen.
I denne studien og i en støttende maksillær punkteringsstudie hadde 15 evaluerbare forsøkspersoner ikke-β-laktamaseproduserende Haemophilus influenzae som identifisert patogen. Av disse fikk 67 % (10/15) dette patogenet utryddet. Atten (18) evaluerbare forsøkspersoner hadde Streptococcus pneumoniae som identifisert patogen. Av disse fikk 83 % (15/18) dette patogenet utryddet.
Tidlig Lyme-sykdom
To adekvate og godt kontrollerte studier ble utført på personer med tidlig borreliose. Alle forsøkspersoner presentert med legedokumentert erythema migrans, med eller uten systemiske manifestasjoner av infeksjon. Forsøkspersonene ble vurdert 1 måned etter behandling for suksess med behandling av tidlig borreliose (del I) og 1 år etter behandling for suksess med å forhindre progresjon til følgene av sen borreliose (del II).
Totalt 355 voksne forsøkspersoner (181 behandlet med cefuroksimaksetil og 174 behandlet med doksycyklin) ble randomisert i de 2 studiene, med diagnose av tidlig borreliose bekreftet hos 79 % (281/355). Den kliniske diagnosen tidlig Lyme-sykdom hos disse forsøkspersonene ble validert ved 1) blindet ekspertavlesning av fotografier, når tilgjengelig, av hudlesjonen erythema migrans før behandling, og 2) serologisk bekreftelse (ved bruk av enzymkoblet immunosorbentanalyse [ELISA] og immunoblotanalyse [“Western” blot]) av tilstedeværelsen av antistoffer spesifikke for Borrelia burgdorferi, det etiologiske middelet til Lyme-sykdom. Effektdataene i Tabell 13 er spesifikke for denne "validerte" pasientundergruppen, mens sikkerhetsdataene nedenfor gjenspeiler hele pasientpopulasjonen for de 2 studiene. Kliniske data for evaluerbare forsøkspersoner i den "validerte" pasientundergruppen er vist i tabell 13.
CEFTIN og doksycyklin var effektive i forebygging av utviklingen av følgetilstander etter sen borreliose.
Mens forekomsten av legemiddelrelaterte gastrointestinale bivirkninger var lik i de 2 behandlingsgruppene (cefuroksimaksetil - 13 %; doksycyklin - 11 %), var forekomsten av legemiddelrelatert diaré høyere i cefuroksimaksetil-armen sammenlignet med doksycyklin-armen (11). % mot 3 %, henholdsvis).
REFERANSER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder for fortynning Antimikrobielle mottakelighetstester for bakterier som vokser aerobt; Godkjent standard - tiende utgave. 2015. CLSI-dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Clinical and Laboratory Standards Institute (CLSI). Metoder for antimikrobiell fortynning og diskfølsomhetstesting for sjelden isolerte eller kresne bakterier: Godkjente retningslinjer - andre utgave. 2010. CLSI-dokument M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Ytelsesstandarder for antimikrobiell mottakelighetstesting; Tjuefemte informasjonstillegg. 2015. CLSI-dokument M100- S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Clinical and Laboratory Standards Institute (CLSI). Ytelsesstandarder for antimikrobielle diskdiffusjonsfølsomhetstester; Godkjent standard – tolvte utgave. 2015. CLSI-dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
PASIENTINFORMASJON
Allergiske reaksjoner
Informer pasienter om at CEFTIN er et cefalosporin som kan forårsake allergiske reaksjoner hos enkelte individer [se ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-assosiert diaré
Informer pasienter om at diaré er et vanlig problem forårsaket av antibakterielle midler, og det slutter vanligvis når det antibakterielle stoffet seponeres. Noen ganger kan pasienter etter oppstart av behandling med antibakterielle midler utvikle vassen og blodig avføring (med eller uten magekramper og feber) selv så sent som 2 eller flere måneder etter å ha tatt sin siste dose av antibakterielt middel. Hvis dette skjer, råd pasientene til å kontakte legen sin så snart som mulig.
Fenylketonuri
Informer pasienter og omsorgspersoner om at CEFTIN 125mg til mikstur, suspensjon inneholder fenylalanin (en komponent av aspartam) [se ADVARSLER OG FORHOLDSREGLER ].
Knusende tabletter
Instruer pasienter om å svelge tabletten hel uten å knuse tabletten. Pasienter som ikke kan svelge tabletten hel bør få oral suspensjon.
Oral suspensjon
Instruer pasientene om å riste miksturen godt før hver bruk, oppbevares i kjøleskap og kastes etter 10 dager. Den orale suspensjonen bør tas sammen med mat.
Medikamentresistens
Informer pasienter om at antibakterielle legemidler, inkludert CEFTIN, kun skal brukes til å behandle bakterielle infeksjoner. De behandler ikke virusinfeksjoner (f.eks. forkjølelse). Når CEFTIN 250mg er foreskrevet for å behandle en bakteriell infeksjon, informer pasientene om at selv om det er vanlig å føle seg bedre tidlig i behandlingsforløpet, bør medisinen tas nøyaktig som anvist. Å hoppe over doser eller ikke fullføre hele behandlingsforløpet kan: (1) redusere effektiviteten av den umiddelbare behandlingen, og (2) øke sannsynligheten for at bakterier vil utvikle resistens og ikke vil kunne behandles med CEFTIN 500mg eller andre antibakterielle legemidler i fremtiden .
