Casodex 50mg Bicalutamide Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Casodex og hvordan brukes det?
Casodex er et reseptbelagt legemiddel som brukes til å behandle symptomene på prostatakreft. Casodex 50mg kan brukes alene eller sammen med andre medisiner.
Casodex 50mg tilhører en klasse legemidler som heter Antineoplastics, Antiandrogen; CYP3A4-hemmer, moderat.
Det er ikke kjent om Casodex er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Casodex?
Casodex kan forårsake alvorlige bivirkninger, inkludert:
- . brystsmerter eller hevelse, . blod i urinen, . feber, . frysninger, . plutselige brystsmerter eller ubehag, . hvesing, . tørrhoste, . kortpustethet, . blek hud, . svimmelhet, . rask hjertefrekvens, . problemer med å konsentrere seg, . kvalme, . smerter i øvre mage, . føler meg sliten, . tap av Appetit, . mørk urin, . leirefarget avføring, . gulfarging av hud eller øyne (gulsott), . økt tørst, . økt vannlating, . sult, . tørr i munnen, . lukt av fruktig pust, . døsighet, . tørr hud, . tåkesyn, og . vekttap
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Casodex 50mg inkluderer:
- . hetetokter, . smerter i ryggen, . bekkensmerter, . magesmerter, . hevelse i hender, ankler eller føtter, . økt vannlating om natten, . svakhet, . svimmelhet, . kvalme, . diaré, og . forstoppelse
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Casodex. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
CASODEX® (bicalutamid) tabletter inneholder 50 mg bicalutamid, en ikke-steroid androgenreseptorhemmer uten annen kjent endokrin aktivitet. Det kjemiske navnet er propanamid, N [4-cyano-3-(trifluormetyl)fenyl]-3-[(4-fluorfenyl)sulfonyl]-2-hydroksy-2-metyl-,(+-). De strukturelle og empiriske formlene er:
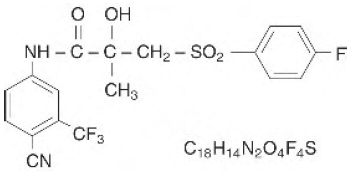
Bicalutamid har en molekylvekt på 430,37. pKa' er omtrent 12. Bicalutamid er et fint hvitt til off-white pulver som er praktisk talt uløselig i vann ved 37°C (5 mg per 1000 ml), lett løselig i kloroform og absolutt etanol, tungt løselig i metanol og løselig i aceton og tetrahydrofuran.
CASODEX er et racemat hvor dets antiandrogene aktivitet nesten utelukkende vises av R-enantiomeren av bicalutamid; S-enantiomeren er i det vesentlige inaktiv.
De inaktive ingrediensene i CASODEX 50 mg tabletter er laktose, magnesiumstearat, hypromellose, polyetylenglykol, polyvidon, natriumstivelsesglykolat og titandioksid.
INDIKASJONER
CASODEX 50 mg daglig er indisert for bruk i kombinasjonsterapi med en luteiniserende hormonfrigjørende hormon (LHRH)-analog for behandling av stadium D2 metastatisk karsinom i prostata.
CASODEX 150 mg daglig er ikke godkjent for bruk alene eller sammen med andre behandlinger [se Kliniske studier ].
DOSERING OG ADMINISTRASJON
Anbefalt dose og tidsplan
Den anbefalte dosen for CASODEX 50 mg-behandling i kombinasjon med en LHRH-analog er én 50 mg tablett én gang daglig (morgen eller kveld), med eller uten mat. Det anbefales at CASODEX 50 mg tas til samme tid hver dag. Behandling med CASODEX bør startes samtidig med behandling med en LHRH-analog. Hvis en dose av CASODEX 50 mg glemmes, ta neste dose til planlagt tid. Ikke ta den glemte dosen og ikke doble neste dose.
Dosejustering ved nedsatt nyrefunksjon
Ingen dosejustering er nødvendig for pasienter med nedsatt nyrefunksjon [se Bruk i spesifikke populasjoner ].
Dosejustering ved nedsatt leverfunksjon
Ingen dosejustering er nødvendig for pasienter med mild til moderat nedsatt leverfunksjon. Hos pasienter med alvorlig nedsatt leverfunksjon (n=4), selv om det var en 76 % økning i halveringstiden (henholdsvis 5,9 og 10,4 dager for normale og nedsatte pasienter) for den aktive enantiomeren av bicalutamid, er det ikke nødvendig med dosejustering [ se Bruk i spesifikke populasjoner ].
HVORDAN LEVERES
Doseringsformer og styrke
CASODEX® (bicalutamid) 50 mg tabletter for oral administrering.
Hvite, filmdrasjerte tabletter (identifisert på den ene siden med "CDX50" og på baksiden med "CASODEX-logoen") leveres i enhetsdoseflasker med 30 tabletter (0310-0705-30).
Oppbevaring og håndtering
Oppbevares ved kontrollert romtemperatur, 20°-25°C (68°-77°F).
Produsert for: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Revidert: mars 2017.
BIVIRKNINGER
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Erfaring fra kliniske forsøk
Hos pasienter med avansert prostatakreft behandlet med CASODEX 50 mg i kombinasjon med en LHRH-analog, var den hyppigste bivirkningen hetetokter (53 %).
I den multisenter, dobbeltblinde, kontrollerte kliniske studien som sammenlignet CASODEX 50 mg én gang daglig med flutamid 250 mg tre ganger daglig, hver i kombinasjon med en LHRH-analog, følgende bivirkninger med en forekomst på 5 % eller mer, uansett av årsakssammenheng, er rapportert.
Andre bivirkninger (større enn eller lik 2 %, men mindre enn 5 %) rapportert i CASODEX-LHRH-analogbehandlingsgruppen er oppført nedenfor etter kroppssystem og er i rekkefølge etter avtagende frekvens innenfor hvert kroppssystem uavhengig av årsakssammenheng.
Kroppen som helhet: Neoplasma; Nakkesmerter; Feber; Frysninger; Sepsis; Brokk; Cyste
Kardiovaskulær: Angina pectoris; Kongestiv hjertesvikt; Myokardinfarkt; hjertestans; Koronararterielidelse; Synkope
Fordøyelsessystemet: Melena; rektal blødning; Tørr i munnen; Dysfagi; Gastrointestinal lidelse; periodontal abscess; Gastrointestinalt karsinom
Metabolsk og ernæringsmessig: Ødem; BUN Økt; Kreatinin økt; Dehydrering; gikt; Hyperkolesteremi
Muskuloskeletal: Myalgi; Kramper i benet
Nervøs: hypertoni; Forvirring; Søvnighet; Libido redusert; Nevropati; Nervøsitet
Luftveiene: Lungelidelse; Astma; Epistaxis; Bihulebetennelse
Hud og vedheng: Tørr hud; Alopecia; Kløe; Herpes Zoster; Hudkarsinom; Hudlidelse
Spesielle sanser: Katarakt spesifisert
Urogenital: Dysuri; Urinary Urgency; Hydronefrose; Urinveislidelse
Unormale laboratorietestverdier:
Laboratorieavvik inkludert: forhøyet AST, ALAT, bilirubin, BUN og kreatinin; og redusert hemoglobin- og hvite blodlegemer, er rapportert hos både CASODEX-LHRH-analogbehandlede og flutamid-LHRH-analogbehandlede pasienter.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av CASODEX etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Luftveislidelser: Interstitiell lungesykdom (noen dødelig) inkludert interstitiell pneumonitt og lungefibrose, oftest ved doser større enn 50 mg.
Hud- og subkutane vevssykdommer: Fotosensitivitet
NARKOTIKAHANDEL
Kliniske studier har ikke vist noen legemiddelinteraksjoner mellom bicalutamid og LHRH-analoger (goserelin eller leuprolid). Det er ingen bevis for at bicalutamid induserer leverenzymer.
In vitro-studier har vist at R-bicalutamid er en hemmer av CYP 3A4 med mindre hemmende effekt på CYP 2C9, 2C19 og 2D6 aktivitet. Kliniske studier har vist at ved samtidig administrering av CASODEX kan gjennomsnittlig midazolam (et CYP 3A4-substrat) økes 1,5 ganger (for Cmax) og 1,9 ganger (for AUC). Derfor bør det utvises forsiktighet når CASODEX 50 mg administreres samtidig med CYP 3A4-substrater.
In vitro proteinbindingsstudier har vist at bicalutamid kan fortrenge kumarinantikoagulanter fra bindingssteder. Protrombintiden bør overvåkes nøye hos pasienter som allerede får kumarinantikoagulantia og som starter med CASODEX 50 mg, og justering av antikoagulantdosen kan være nødvendig.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Hepatitt
Tilfeller av død eller sykehusinnleggelse på grunn av alvorlig leverskade (leversvikt) er rapportert etter markedsføring i forbindelse med bruk av CASODEX. Levertoksisitet i disse rapportene oppsto vanligvis i løpet av de første tre til fire månedene av behandlingen. Hepatitt eller markert økning i leverenzymer som førte til seponering av medikamentet forekom hos ca. 1 % av CASODEX-pasientene i kontrollerte kliniske studier.
Serumtransaminasenivåer bør måles før oppstart av behandling med CASODEX, med jevne mellomrom de første fire månedene av behandlingen, og periodisk deretter. Hvis det oppstår kliniske symptomer eller tegn som tyder på leverdysfunksjon (f.eks. kvalme, oppkast, magesmerter, tretthet, anoreksi, "influensalignende" symptomer, mørk urin, gulsott eller ømhet i øvre øvre kvadrant), serumtransaminaser, spesielt serum ALT, bør måles umiddelbart. Hvis en pasient på noe tidspunkt har gulsott, eller deres ALAT stiger over to ganger øvre normalgrense, bør CASODEX seponeres umiddelbart med tett oppfølging av leverfunksjonen.
Gynekomasti og brystsmerter
I kliniske studier med CASODEX 150 mg som enkeltmiddel for prostatakreft er gynekomasti og brystsmerter rapportert hos henholdsvis opptil 38 % og 39 % av pasientene.
Glukosetoleranse
En reduksjon i glukosetoleranse er observert hos menn som får LHRH-agonister. Dette kan manifestere seg som diabetes eller tap av glykemisk kontroll hos de med eksisterende diabetes. Det bør derfor vurderes å overvåke blodsukker hos pasienter som får CASODEX 50 mg i kombinasjon med LHRH-agonister.
Laboratorietester
Regelmessige vurderinger av serum prostataspesifikt antigen (PSA) kan være nyttig for å overvåke pasientens respons. Hvis PSA-nivåene øker under CASODEX 50 mg-behandling, bør pasienten evalueres for klinisk progresjon. For pasienter som har objektiv sykdomsprogresjon sammen med forhøyet PSA, kan en behandlingsfri periode med antiandrogen, mens man fortsetter med LHRH-analogen, vurderes.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Dose og tidsplan
Informer pasientene om at behandling med CASODEX 50 mg og LHRH-analogen bør startes samtidig og at de ikke bør avbryte eller slutte å ta disse medisinene uten å konsultere helsepersonell [se DOSERING OG ADMINISTRASJON ].
Hepatitt
Informer pasienter om at CASODEX kan forårsake hepatitt, som kan føre til leversvikt og død. Informer pasienter om at leverfunksjonstester bør overvåkes regelmessig under behandlingen og rapportere tegn og symptomer på hepatitt [se ADVARSLER OG FORHOLDSREGLER ].
Glukosetoleranse
Informer pasienter om at diabetes eller tap av glykemisk kontroll hos pasienter med allerede eksisterende diabetes er rapportert under behandling med LHRH-agonister. Det bør derfor vurderes å overvåke blodsukker hos pasienter som får CASODEX i kombinasjon med LHRH-agonister [se ADVARSLER OG FORHOLDSREGLER ].
Søvnighet
Under behandling med CASODEX har søvnighet blitt rapportert. Råd pasienter som opplever dette symptomet om å utvise forsiktighet når de kjører bil eller bruker maskiner [se BIVIRKNINGER ].
Fotosensitivitet
Informer pasienter om at tilfeller av lysfølsomhet er rapportert under behandling med CASODEX og at de bør unngå direkte eksponering for mye sollys eller UV-lys. Det bør tas hensyn til bruk av solkrem [se BIVIRKNINGER ].
Prevensjon og fruktbarhet
Rådfør mannlige pasienter med kvinnelige partnere med reproduksjonspotensial om å bruke effektiv prevensjon under behandlingen og i 130 dager etter siste dose med CASODEX 50 mg behandling. Informer mannlige pasienter om at CASODEX kan svekke fertiliteten [se Bruk i spesifikke populasjoner ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Toårige orale karsinogenitetsstudier ble utført på både hann- og hunnrotter og -mus i doser på 5, 15 eller 75 mg/kg/dag av bicalutamid. En rekke tumormålorganeffekter ble identifisert og ble tilskrevet antiandrogenisiteten til bicalutamid, nemlig testikulære benigne interstitielle (Leydig) celletumorer hos hannrotter ved alle dosenivåer (steady-state plasmakonsentrasjonen med 5 mg/kg/dag dosen er omtrent 0,7 ganger human eksponering ved anbefalt dose) og uterint adenokarsinom hos hunnrotter ved 75 mg/kg/dag (ca. 1,5 ganger human eksponering ved anbefalt dose). Det er ingen tegn på Leydig-cellehyperplasi hos pasienter; livmorsvulster er ikke relevante for den angitte pasientpopulasjonen.
En liten økning i forekomsten av hepatocellulært karsinom hos hannmus som ble gitt 75 mg/kg/dag av bicalutamid (ca. 4 ganger human eksponering ved anbefalt dose) og en økt forekomst av benigne follikulære celleadenomer i skjoldbruskkjertelen hos rotter gitt 5 mg/kg /dag (omtrent 0,7 ganger human eksponering ved anbefalt dose) og høyere ble registrert. Disse neoplastiske endringene var progresjoner av ikke-neoplastiske endringer relatert til leverenzyminduksjon observert i toksisitetsstudier på dyr. Enzyminduksjon er ikke observert etter administrering av bicalutamid hos mennesker. Det var ingen tumorigene effekter som tyder på genotoksisk karsinogenese.
Et omfattende batteri av både in vitro og in vivo genotoksisitetstester (gjærgenkonvertering, Ames, E. coli, CHO/HGPRT, cytogenetiske cytogenetiske lymfocytter, mus mikronukleus og rottebenmarg cytogenetiske tester) har vist at bicalutamid ikke har genotoksisk aktivitet .
toksikologiske studier med gjentatte doser er atrofi av sædrør i testiklene observert for alle undersøkte arter, som er en forutsagt klasseeffekt med antiandrogener. I den 6- og 12-måneders rottestudien ble testikkelatrofi sett ved omtrent 2 ganger eksponeringen hos mennesker ved anbefalt dose. I den 12 måneder lange hundestudien ble forekomsten av testikkelatrofi sett ved omtrent 7 ganger eksponeringen hos mennesker ved anbefalt dose. Hos hannrotter som ble administrert 250 mg/kg/dag (ca. 2 ganger human eksponering ved anbefalt dose), ble det prekoitale intervallet og tiden til vellykket paring økt i den første paringen, men ingen effekter på fertiliteten etter vellykket paring ble sett. Disse effektene ble reversert 7 uker etter slutten av en 11-ukers doseringsperiode.
Hunnrotter dosert med 1, 10 og 250 mg/kg/dag (mindre enn 2 ganger human eksponering ved anbefalt dose) hadde økt uregelmessighet i brunstsyklusen, men det var ingen effekt på fertiliteten.
en peri- og postnatal utviklingsstudie hadde kvinnelige avkom av rotter som fikk doser på 10 mg/kg/dag (omtrent 0,7 ganger human eksponering ved anbefalt klinisk dose) og over reduserte graviditetsrater. Administrering av bicalutamid til gravide kvinner resulterte i feminisering av det mannlige avkommet som førte til hypospadi ved doser på 10 mg/kg/dag (omtrent 0,7 ganger human eksponering ved anbefalt dose) og over. Berørte mannlige avkom var også impotente.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
CASODEX er kontraindisert for bruk hos gravide kvinner fordi det kan forårsake fosterskader. CASODEX 50mg er ikke indisert for bruk hos kvinner. Det finnes ingen humane data om bruk av CASODEX 50 mg hos gravide kvinner. I reproduksjonsstudier på dyr forårsaket oral administrering av bicalutamid til drektige rotter under organogenese unormal utvikling av reproduksjonsorganer hos hannfostre ved eksponeringer på omtrent 0,7 til 2 ganger eksponeringen for mennesker ved anbefalt dose (se Data ).
Data
Dyredata
en embryo-føtal utviklingsstudie på drektige rotter dosert i løpet av organogeneseperioden fra svangerskapsdagene 6-15, hadde hannfostre redusert anogenital avstand ved doser på 10 mg/kg/dag og over (omtrent 0,7 til 2 ganger eksponeringen hos mennesker kl. anbefalt dose).
I en pre- og postnatal utviklingsstudie ble hunnrotter dosert fra drektighetsdag 7-16 og tillatt å forsøple og oppdra avkommet til avvenning . Hannavkom av rotter som fikk doser på 10 mg/kg/dag (omtrent 0,7 ganger human eksponering ved anbefalt dose) og over, ble observert å ha redusert anogenital avstand.
en peri- og postnatal utviklingsstudie ble hunnrotter doseret fra drektighetsdag 16 til ammingsdag 22 og tillatt å forsøple og oppdra avkommet til avvenning. Overlevelse og vekt av avkom under amming ble redusert for kull fra morsrotter som fikk doser på 250 mg/kg/dag (ca. 2 ganger eksponeringen hos mennesker ved anbefalt dose). Mannlige avkom av rotter som fikk doser på 10 mg/kg/dag (omtrent 0,7 ganger den menneskelige eksponeringen ved anbefalt dose) og over, ble observert å ha redusert anogenital avstand, mindre sekundære kjønnsorganer, kryptorkisme og hypospadi som resulterte i manglende evne til å pare seg. og impregnere deres kvinnelige partnere. Kvinnelige avkom av rotter som fikk doser på 10 mg/kg/dag (omtrent 0,7 ganger human eksponering ved anbefalt dose) og over hadde reduserte graviditetsrater.
Amming
Risikosammendrag
CASODEX 50mg er ikke indisert for bruk hos gravide kvinner. Det er ingen tilgjengelig informasjon om tilstedeværelsen av bicalutamid i morsmelk, eller om effekten på spedbarn som ammes eller på melkeproduksjonen. Bicalutamid er påvist i rottemelk.
Kvinner og menn med reproduktivt potensial
Prevensjon
Hanner
Antiandrogenbehandling kan forårsake morfologiske endringer i sædceller [se Ikke-klinisk toksikologi ]. Basert på funn i reproduksjonsstudier på dyr og dens virkningsmekanisme, råd mannlige pasienter med kvinnelige partnere med reproduksjonspotensial til å bruke effektiv prevensjon under behandlingen og i 130 dager etter den siste dosen av CASODEX [se Svangerskap og KLINISK FARMAKOLOGI ].
Infertilitet
Hanner

Basert på dyrestudier kan CASODEX 50 mg føre til hemming av spermatogenese og kan svekke fertiliteten hos menn med reproduksjonspotensial. Langtidseffektene av CASODEX 50 mg på mannlig fertilitet er ikke studert [se Ikke-klinisk toksikologi ].
Pediatrisk bruk
Sikkerheten og effekten av CASODEX 50 mg hos pediatriske pasienter er ikke fastslått.
CASODEX (bicalutamid) smeltetablett ble studert i kombinasjon med ARIMIDEX (anastrozol) smeltetablett i en åpen, ikke-sammenlignende, multisenterstudie som vurderte effektiviteten og sikkerheten til dette kombinasjonsregimet over 12 måneder i behandlingen av gonadotropin-uavhengig. tidlig pubertet hos gutter med familiær mannlig begrenset tidlig pubertet, også kjent som testotoksikose. Pasienter ble inkludert i studien hvis de hadde en baselinealder ≥2 år og en diagnose av testotoksikose basert på kliniske trekk ved progressiv tidlig pubertet, symmetrisk testikkelforstørrelse, avansert benalder, pubertale nivåer av serumtestosteron, prepubertalt mønster av gonadotropinsekresjon etter en GnRH-stimuleringstest, og fravær av andre kliniske og biokjemiske årsaker til testosteronoverskudd. Tretten av de 14 pasientene som ble registrert fullførte 12 måneders kombinasjonsbehandling (en pasient gikk tapt for oppfølging). Hvis sentral tidlig pubertet (CPP) utviklet seg, skulle en LHRH-analog legges til. Fire pasienter ble diagnostisert med CPP i løpet av den 12-måneders studien og mottok LHRH-analogbehandling og 2 ekstra pasienter ble diagnostisert ved slutten av de 12 månedene og fikk deretter behandling. Gjennomsnittlig ± SD-karakteristikker ved baseline var som følger: kronologisk alder: 3,9±1,9 år; beinalder 8,8±2,5; benalder/kronologisk aldersforhold: 2,06±0,51; vekstrate (cm/år): 10,81±4,22; vekstrate standardavviksscore (SDS): 0,41±1,36.
Startdosen CASODEX var 12,5 mg. CASODEX ble titrert hos hver pasient inntil steady-state R-bicalutamid (den aktive isomeren av bicalutamid) bunnplasmakonsentrasjon nådde 5-15 mcg/ml, som er rekkevidden av terapeutiske konsentrasjoner oppnådd hos voksne med prostatakreft etter administrering av den nåværende godkjent CASODEX dose på 50 mg. Den daglige startdosen av anastrozol var 0,5 mg. Anastrozol ble titrert uavhengig hos hver pasient inntil det ved steady-state nådde en serum østradiolkonsentrasjon på
Den primære effektivitetsanalysen av studien var å vurdere endringen i veksthastighet etter 12 måneders behandling, i forhold til veksthastigheten i løpet av ≥ 6 måneder før innføring i studien. Pre-studie vekstrater ble oppnådd retrospektivt. Det var ingen statistiske bevis for at veksthastigheten ble redusert under behandlingen. Under CASODEX/ARIMIDEX-behandlingen sank gjennomsnittlig veksthastighet (cm/år) med 1,6 cm/år, 95 % KI (-4,7 til 1,5) p=0,28; gjennomsnittlig veksthastighet SDS sank med 0,1 SD, 95 % KI (–1,2 til 1,0) p=0,88. Tabell 2 viser beskrivende data for veksthastigheter for den totale populasjonen og for undergrupper definert etter tidligere behandling for testotoksikose med ketokonazol, spironolakton, anastrozol eller andre aromatasehemmere.
Total testosteronkonsentrasjon økte med gjennomsnittlig 5 mmol/L i løpet av de 12 månedene med behandling fra et baseline-gjennomsnitt på 10 mmol/L. Østradiolkonsentrasjoner var på eller under kvantifiseringsnivået (9,81 pmol/L) for 11 av 12 pasienter etter 12 måneders behandling. Seks av de 12 pasientene startet behandling med en østradiolkonsentrasjon under kvantifiseringsnivået.
Det var ingen dødsfall, alvorlige bivirkninger eller seponeringer på grunn av uønskede hendelser under studien. Av de 14 pasientene som ble utsatt for studiebehandling, opplevde 13 (92,9 %) minst én bivirkning. De hyppigst rapporterte (>3 pasienter) bivirkningene var gynekomasti (7/14, 50 %), sentral tidlig pubertet (6/14, 43 %), oppkast (5/14, 36 %), hodepine (3/14, 21 %), pyreksi (3/14, 21 %) og øvre luftveisinfeksjon (3/14, 21 %). Bivirkninger ansett som mulig relatert til bicalutamid av etterforskere inkluderte gynekomasti (6/14, 43 %), sentral tidlig pubertet (2/14, 14 %), ømhet i brystene (2/14, 14 %), brystsmerter (1/14, 7 %), asteni (1/14, 7 %), økt alaninaminotransferase [ALT] (1/14, 7 %), økt aspartataminotransferase [AST] (1/14, 7 %) og muskel- og skjelettsmerter i brystet (1 /14, 7 %). Hodepine var den eneste bivirkningen som ble ansett som mulig relatert til anastrozol av etterforskere. For pasienten som utviklet forhøyet ALAT og ASAT, var forhøyningen
Geriatrisk bruk
to studier med pasienter som ble gitt 50 eller 150 mg daglig, er det ikke vist noen signifikant sammenheng mellom alder og steady-state nivåer av totalt bicalutamid eller den aktive R-enantiomeren.
Nedsatt leverfunksjon
CASODEX bør brukes med forsiktighet hos pasienter med moderat til alvorlig nedsatt leverfunksjon. CASODEX metaboliseres i stor grad av leveren. Begrensede data fra personer med alvorlig nedsatt leverfunksjon tyder på at utskillelse av CASODEX kan bli forsinket og kan føre til ytterligere akkumulering. Periodiske leverfunksjonstester bør vurderes for pasienter med nedsatt leverfunksjon på langtidsbehandling [se ADVARSLER OG FORHOLDSREGLER ].
Ingen klinisk signifikant forskjell i farmakokinetikken til noen av enantiomeren av bicalutamid ble observert hos pasienter med mild til moderat leversykdom sammenlignet med friske kontroller. Halveringstiden til R-enantiomeren ble imidlertid økt med ca. 76 % (5,9 og 10,4 dager for henholdsvis normale og svekkede pasienter) hos pasienter med alvorlig leversykdom (n=4).
Nedsatt nyrefunksjon
Nedsatt nyrefunksjon (målt ved kreatininclearance) hadde ingen signifikant effekt på eliminasjonen av totalt bicalutamid eller den aktive R-enantiomeren.
OVERDOSE
Langsiktige kliniske studier har blitt utført med doser på opptil 200 mg CASODEX 50 mg daglig, og disse dosene har blitt godt tolerert. En enkeltdose CASODEX 50 mg som resulterer i symptomer på en overdose som anses å være livstruende er ikke fastslått.
Det er ingen spesifikk motgift; behandling av en overdose bør være symptomatisk.
Ved behandling av en overdose med CASODEX 50 mg, kan brekninger fremkalles dersom pasienten er våken. Det bør huskes at i denne pasientpopulasjonen kan flere legemidler ha blitt tatt. Dialyse vil sannsynligvis ikke være nyttig siden CASODEX er sterkt proteinbundet og metaboliseres i stor grad. Generell støttebehandling, inkludert hyppig overvåking av vitale tegn og nøye observasjon av pasienten, er indisert.
KONTRAINDIKASJONER
Casodex er kontraindisert i:
Overfølsomhet
CASODEX 50mg er kontraindisert hos enhver pasient som har vist en overfølsomhetsreaksjon på legemidlet eller noen av tablettens komponenter. Overfølsomhetsreaksjoner inkludert angioneurotisk ødem og urticaria er rapportert.
Kvinner
CASODEX 50mg har ingen indikasjon for kvinner, og bør ikke brukes i denne populasjonen.
Svangerskap
CASODEX 50mg kan forårsake fosterskader når det administreres til en gravid kvinne [se Bruk i spesifikke populasjoner ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
CASODEX 50mg er en ikke-steroid androgenreseptorhemmer. Det hemmer konkurransedyktig virkningen av androgener ved å binde seg til cytosol androgenreseptorer i målvevet. Prostatakarsinom er kjent for å være androgensensitivt og reagerer på behandling som motvirker effekten av androgen og/eller fjerner kilden til androgen.
Når CASODEX 50mg kombineres med LHRH-analogterapi, påvirkes ikke undertrykkelsen av serumtestosteron indusert av LHRH-analogen. I kliniske studier med CASODEX som enkeltmiddel for prostatakreft er det imidlertid observert økninger i serumtestosteron og østradiol.
Hos en undergruppe av pasienter som har blitt behandlet med CASODEX og en LHRH-agonist, og som avbryter behandlingen med CASODEX 50 mg på grunn av progressiv avansert prostatakreft, kan en reduksjon i prostataspesifikt antigen (PSA) og/eller klinisk bedring (fenomenet med antiandrogenabstinens) være observert.
Farmakokinetikk
Absorpsjon
Bicalutamid absorberes godt etter oral administrering, selv om den absolutte biotilgjengeligheten er ukjent. Samtidig administrering av bicalutamid med mat har ingen klinisk signifikant effekt på absorpsjonshastighet eller -grad.
Fordeling
Bicalutamid er sterkt proteinbundet (96 %) [se NARKOTIKAHANDEL ].
Metabolisme/Eliminering
Bicalutamid gjennomgår stereospesifikk metabolisme. Den S (inaktive) isomeren metaboliseres primært ved glukuronidering. R (aktiv) isomeren gjennomgår også glukuronidering, men oksideres hovedsakelig til en inaktiv metabolitt etterfulgt av glukuronidering. Både moder- og metabolitten glukuronider elimineres i urin og avføring. S-enantiomeren fjernes raskt i forhold til R-enantiomeren, med R-enantiomeren som står for omtrent 99 % av totale steady-state plasmanivåer.
Farmakokinetikken til den aktive enantiomeren av CASODEX 50 mg hos normale menn og pasienter med prostatakreft er presentert i tabell 3.
Kliniske studier
CASODEX 50 mg daglig i kombinasjon med en LHRH-A
en multisenter, dobbeltblind, kontrollert klinisk studie ble 813 pasienter med tidligere ubehandlet avansert prostatakreft randomisert til å motta CASODEX 50 mg én gang daglig (404 pasienter) eller flutamid 250 mg (409 pasienter) tre ganger daglig, hver i kombinasjon med LHRH-analoger (enten goserelinacetatimplantat eller leuprolidacetatdepot).
I en analyse utført etter at en median oppfølging på 160 uker var nådd, var 213 (52,7 %) pasienter behandlet med CASODEX-LHRH analog terapi og 235 (57,5 %) pasienter behandlet med flutamid-LHRH analog terapi døde. Det var ingen signifikant forskjell i overlevelse mellom behandlingsgruppene (se figur 1). Hazard ratio for tid til død (overlevelse) var 0,87 (95 % konfidensintervall 0,72 til 1,05).
Figur 1 - Kaplan-Meier-sannsynligheten for død for begge antiandrogenbehandlingsgruppene. 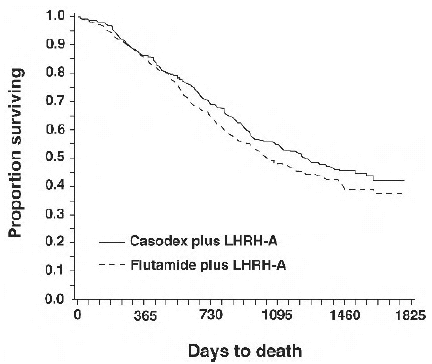
Det var ingen signifikant forskjell i tid til objektiv tumorprogresjon mellom behandlingsgruppene (se figur 2). Objektiv tumorprogresjon ble definert som utseendet av eventuelle benmetastaser eller forverring av eksisterende benmetastaser på benskanning som kan tilskrives metastatisk sykdom, eller en økning med 25 % eller mer av eksisterende målbare ekstraskjelettmetastaser. Fareforholdet for tid til progresjon av CASODEX pluss LHRH-analog til det for flutamid pluss LHRH-analog var 0,93 (95 % konfidensintervall, 0,79 til 1,10).
Figur 2 - Kaplan-Meier-kurve for tid til progresjon for begge antiandrogenbehandlingsgruppene. 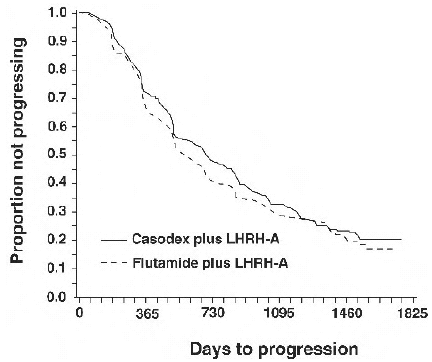
Livskvalitet ble vurdert med selvadministrerte pasientspørreskjemaer om smerte, sosial funksjon, emosjonelt velvære, vitalitet, aktivitetsbegrensning, sengehemming, generell helse, fysisk kapasitet, generelle symptomer og behandlingsrelaterte symptomer. Vurdering av livskvalitetsspørreskjemaene indikerte ikke konsistente signifikante forskjeller mellom de to behandlingsgruppene.
Sikkerhetsdata fra kliniske studier med CASODEX 150 mg
CASODEX 150 mg er ikke godkjent for bruk verken alene eller sammen med andre behandlinger.
To identiske multisenter, randomiserte, åpne studier som sammenlignet CASODEX 150 mg daglig monoterapi med kastrering ble utført hos pasienter som hadde lokalt avansert (T3-4, NX, M0) eller metastatisk (M1) prostatakreft.
Monoterapi – M1 Gruppe
CASODEX 150 mg daglig er ikke godkjent for bruk hos pasienter med M1-kreft i prostata. Basert på en foreløpig analyse av de to studiene for overlevelse, anbefalte Data Safety Monitoring Board at CASODEX-behandlingen skulle seponeres hos M1-pasientene fordi risikoen for død var 25 % (HR 1,25, 95 % KI 0,87 til 1,81) og 31 % ( HR 1,31, 95 % KI 0,97 til 1,77) høyere i henholdsvis den CASODEX 50 mg-behandlede gruppen sammenlignet med den i den kastrerte gruppen.
Lokalt avansert (T3-4, NX, M0) gruppe
CASODEX 150 mg daglig er ikke godkjent for bruk hos pasienter med lokalt avansert (T3-4, NX, M0) kreft i prostata. Etter seponering av alle M1-pasienter, fortsatte forsøkene med T3-4, NX, M0-pasienter inntil studien var fullført. I den større studien (N=352) var risikoen for død 25 % (HR 1,25, 95 % KI 0,92 til 1,71) høyere i CASODEX-gruppen og i den mindre studien (N=140) var risikoen for død 36 % (HR 0,64, 95 % KI, 0,39 til 1,03) lavere i CASODEX 50 mg-gruppen.
tillegg til de to ovennevnte studiene er det tre andre pågående kliniske studier som gir ytterligere sikkerhetsinformasjon for CASODEX 150 mg, en dose som ikke er godkjent for bruk. Dette er tre multisenter, randomiserte, dobbeltblinde, parallelle gruppestudier som sammenligner CASODEX 150 mg daglig monoterapi (adjuvans til tidligere behandling eller under vaktsom venting) med placebo, for død eller tid til sykdomsprogresjon, i en populasjon på 8113 pasienter med lokalisert eller lokalt avansert prostatakreft.
CASODEX 150 mg daglig er ikke godkjent for bruk som terapi for pasienter med lokalisert prostatakreft som er kandidater for vaktsom venting. Data fra en planlagt undergruppeanalyse av to av disse studiene med 1627 pasienter med lokalisert prostatakreft som var under vaktsom venting, avslørte en trend mot redusert overlevelse i CASODEX-armen etter en median oppfølging på 7,4 år. Det var 294 (37,7 %) dødsfall hos CASODEX-behandlede pasienter mot 279 (32,9 %) dødsfall i placebo-behandlede pasienter (lokalisert vaktsom ventegruppe) for en fareforhold på 1,16 (95 % KI 0,99 til 1,37).
PASIENTINFORMASJON
CASODEX® [cas–o–dex] (bicalutamid) Tablett
Les denne pasientinformasjonen før du begynner å ta CASODEX 50mg og hver gang du får påfyll. Det kan komme ny informasjon. Dette pakningsvedlegget erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller din behandling.
Hva er CASODEX 50mg?
CASODEX er et reseptbelagt legemiddel kalt en androgenreseptorhemmer, brukt i kombinasjon med luteiniserende hormonfrigjørende hormon (LHRH) medisiner for å behandle stadium D2 metastatisk prostatakreft.
CASODEX er ikke til bruk hos kvinner.
Det er ikke kjent om CASODEX er trygt og effektivt hos barn.
Hvem bør ikke ta CASODEX 50mg?
Ikke ta CASODEX 50 mg hvis du:
- . er en kvinne. . er gravid eller kan bli gravid. CASODEX kan skade det ufødte barnet ditt. . er allergisk mot noen av ingrediensene i CASODEX. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i CASODEX. Få medisinsk hjelp umiddelbart hvis du får noen av følgende symptomer på en allergisk reaksjon: kløe, elveblest (hevede nupper), hevelse i ansikt, lepper eller tunge, problemer med å puste eller svelge.
Hva bør jeg fortelle helsepersonell før jeg tar CASODEX?
Før du tar CASODEX 50mg, fortell helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
- . har leverproblemer. . ta en medisin for å tynne blodet ditt. Spør helsepersonell eller apotek hvis du ikke er sikker på om medisinen din er blodfortynnende. . har diabetes (dårlig blodsukkerkontroll er rapportert hos personer som tar CASODEX i kombinasjon med LHRH-medisiner). . har en partner som er gravid eller kan bli gravid. Du bør bruke effektive prevensjonsmetoder mens du tar CASODEX 50 mg og i 130 dager etter avsluttet CASODEX. Snakk med legen din hvis du har spørsmål om prevensjon.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. CASODEX 50mg og andre legemidler kan påvirke hverandre og forårsake bivirkninger. CASODEX kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan CASODEX 50mg virker.
Kjenn til medisinene du tar. Ha en liste over medisinene dine med deg for å vise helsepersonell når du får en ny medisin.
Hvordan skal jeg ta CASODEX 50mg?
- . Ta CASODEX nøyaktig slik helsepersonell ber deg ta det. . Ta CASODEX til samme tid hver dag. . Behandlingen med CASODEX 50 mg bør starte samtidig med behandlingen med LHRH-medisinen. . Hvis du glemmer en dose, ikke ta en ekstra dose, ta neste dose til vanlig tid. Ikke ta 2 doser samtidig. . CASODEX 50 mg kan tas med eller uten mat. . Hvis du tar for mye CASODEX, ring helsepersonell eller giftkontrollsenteret eller gå til nærmeste legevakt umiddelbart. . Ikke slutt å ta CASODEX med mindre helsepersonell forteller deg det. . Helsepersonell kan ta blodprøver mens du tar CASODEX. . Prostatakreften din kan bli verre mens du tar CASODEX i kombinasjon med LHRH-medisiner.
Regelmessig overvåking av prostatakreften din med helsepersonell er viktig for å avgjøre om sykdommen din er verre.
Hva bør jeg unngå mens jeg tar CASODEX 50mg?
Ikke kjør bil, bruk maskiner eller gjør andre farlige aktiviteter før du vet hvordan CASODEX påvirker deg.
Noen mennesker har hatt hudfølsomhet for sollys mens de tok CASODEX. Du bør unngå sollys eller sollamper og solarier og vurdere å bruke solkrem mens du behandles med CASODEX.
Hva er de mulige bivirkningene av CASODEX 50mg?
CASODEX kan forårsake alvorlige bivirkninger, inkludert:
- . Leverproblemer, inkludert leversvikt som kanskje må behandles på sykehus eller som kan føre til døden. Helsepersonell bør ta blodprøver for å sjekke leverfunksjonen din før og under behandling med CASODEX. Fortell helsepersonell med en gang hvis du får noen av disse symptomene på et leverproblem under behandlingen:
- . gulfarging av hud og øyne (gulsott) . mørk urin . høyre øvre magesmerter . kvalme . oppkast . tretthet . tap av Appetit . frysninger . feber
De vanligste bivirkningene av CASODEX 50mg inkluderer:
- . hetetokter, eller korte perioder med varmefølelse og svette . smerter i hele kroppen i ryggen, bekkenet, magen . føler seg svak . forstoppelse . infeksjon . kvalme . hevelse i ankler, ben eller føtter . diaré . blod i urinen . våkne fra søvn for å tisse om natten . en reduksjon i røde blodlegemer (anemi) . føler meg svimmel
Fortell helsepersonell dersom du har noen bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av CASODEX. For mer informasjon, spør helsepersonell eller apotek.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare CASODEX?
Oppbevar CASODEX ved romtemperatur mellom 68 °F til 77 °F (20 °C til 25 °C).
Oppbevar CASODEX 50mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av CASODEX.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i et pasientvedlegg. Ikke bruk CASODEX for en tilstand det ikke er foreskrevet for. Ikke gi CASODEX 50 mg til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Dette Pasientinformasjonsheftet oppsummerer den viktigste informasjonen om CASODEX. Hvis du vil ha mer informasjon om CASODEX, snakk med helsepersonell. Du kan spørre helsepersonell eller apotek om informasjon om CASODEX som er skrevet for helsepersonell. For mer informasjon gå til www.CASODEX.com eller ring 1-800-236-9933.
Hva er ingrediensene i CASODEX 50mg?
Aktiv ingrediens: bikalutamid.
Inaktive ingredienser: laktose, magnesiumstearat, hypromellose, polyetylenglykol, polyvidon, natriumstivelsesglykolat, titandioksid.
Denne pasientinformasjonen er godkjent av US Food and Drug Administration.
