Hydrea 500mg Hydroxyurea Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Hydrea 500mg og hvordan brukes det?
Hydrea (hydroksyurea) er et antineoplastisk (anti-kreft) middel som brukes til å behandle melanom, resistent kronisk myelocytisk leukemi og tilbakevendende, metastatisk eller inoperabel karsinom i eggstokkene og primære plateepitelkarsinomer (epidermoid) i hode og nakke. Hydrea er tilgjengelig i generisk form.
Hva er bivirkningene av Hydrea?
Vanlige bivirkninger av Hydrea inkluderer:
- . kvalme, . oppkast, . urolig mage, . diaré, . forstoppelse, . hudforandringer som avskalling eller misfarging, . influensalignende symptomer, . hårtap, . utslett, . hodepine, . svimmelhet, . døsighet, eller . vektøkning.
Alvorlige bivirkninger av Hydrea inkluderer:
- . anemi, . myelosuppresjon, og . leukemi.
BESKRIVELSE
HYDREA (hydroksyureakapsler, USP) er en antimetabolitt tilgjengelig for oral bruk som kapsler som inneholder 500 mg hydroksyurea. Inaktive ingredienser inkluderer sitronsyre, fargestoffer (D&C Yellow No. 10, FD&C Blue No. 1, FD&C Red No. 40 og D&C Red No. 28), gelatin, laktose, magnesiumstearat, natriumfosfat og titandioksid.
Hydroxyurea er et hvitt til off-white krystallinsk pulver. Det er hygroskopisk og fritt løselig i vann, men praktisk talt uløselig i alkohol. Den empiriske formelen er CH4N2O2 og den har en molekylvekt på 76,05. Dens strukturformel er:
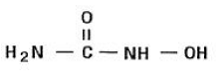
INDIKASJONER
HYDREA 500mg er indisert for behandling av:
- . Resistent kronisk myeloid leukemi. . Lokalt avanserte plateepitelkarsinomer i hode og nakke (unntatt leppen) i kombinasjon med kjemoradiasjon.
DOSERING OG ADMINISTRASJON
Doseringsinformasjon
HYDREA brukes alene eller sammen med andre antitumormidler eller strålebehandling for å behandle neoplastiske sykdommer. Tilpass behandling basert på tumortype, sykdomstilstand, respons på behandling, pasientrisikofaktorer og gjeldende kliniske praksisstandarder.
Baser all dosering på pasientens faktiske eller ideelle vekt, avhengig av hva som er minst.
HYDREA er et cellegift. Følg gjeldende spesielle håndterings- og avhendingsprosedyrer [se REFERANSER ].
Svelg HYDREA kapsler hele. IKKE åpne, knekk eller tygg kapsler fordi HYDREA er et cellegift.
Profylaktisk administrering av folsyre anbefales [se ADVARSLER OG FORHOLDSREGLER ].
Overvåk blodtellingen minst en gang i uken under behandling med HYDREA 500 mg. Alvorlig anemi må korrigeres før behandling med HYDREA startes.
Doseendringer for toksisitet
Overvåk følgende og reduser dosen eller seponer HYDREA 500mg tilsvarende:
- . Myelosuppresjon [se ADVARSLER OG FORHOLDSREGLER ] . Kutan vaskulitt [se ADVARSLER OG FORHOLDSREGLER ]
Vurder doseendringer for andre toksisiteter.
Doseendringer for nedsatt nyrefunksjon
Reduser dosen av HYDREA med 50 % hos pasienter med målt kreatininclearance på mindre enn 60 ml/min eller med sluttstadium nyresykdom (ESRD) [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
Nøye overvåking av hematologiske parametere anbefales hos disse pasientene.
HVORDAN LEVERES
Doseringsformer og styrker
Kapsler
500 mg ugjennomsiktig grønn hette og ugjennomsiktig rosa kropp merket med "HYDREA" og "830".
Oppbevaring og håndtering
HYDREA® (hydroksyureakapsler, USP) leveres som 500 mg kapsler i HDPE-flasker med sikkerhetsskrukork av plast. Hver flaske inneholder 100 kapsler.
Hetten er ugjennomsiktig grønn og kroppen er ugjennomsiktig rosa. Kapslene er trykt på begge seksjoner med "HYDREA" og "830" i svart blekk ( NDC 0003-0830-50).
Oppbevaring
Oppbevares ved 20-25°C (68-77°F); utflukter tillatt til 15°C-30°C (59°F-86°F) [se USP kontrollert romtemperatur]. Hold tett lukket.
Håndtering og avhending
HYDREA 500mg er et cellegift. Følg gjeldende spesielle håndterings- og avhendingsprosedyrer [se REFERANSER ].
For å redusere risikoen for kontakt, råd omsorgspersoner til å bruke engangshansker når de håndterer HYDREA eller flasker som inneholder HYDREA. Vask hendene med såpe og vann før og etter kontakt med flasken eller kapslene når du håndterer HYDREA. Ikke åpne HYDREA 500mg kapsler. Unngå eksponering for knuste eller åpnede kapsler. Hvis det oppstår kontakt med knuste eller åpnede kapsler på huden, vask det berørte området umiddelbart og grundig med såpe og vann. Hvis det oppstår kontakt med knuste eller åpnede kapsler på øyet(e), skal det berørte området skylles grundig med vann eller isotonisk øyeskyll som er beregnet for dette formålet i minst 15 minutter. Hvis pulveret fra kapselen søles, tørk det umiddelbart opp med et fuktig engangshåndkle og kast det i en lukket beholder, for eksempel en plastpose; det samme skal de tomme kapslene. Sølområdene bør deretter rengjøres tre ganger med en vaskemiddelløsning etterfulgt av rent vann. Hold medisinen unna barn og kjæledyr. Kontakt legen din for instruksjoner om hvordan du kaster utdaterte kapsler.
REFERANSER
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Produsert for: Bristol-Myers Squibb Company Princeton, New Jersey 08543 USA. Revidert: desember 2020
BIVIRKNINGER
Følgende klinisk signifikante bivirkninger er beskrevet i detalj i andre merkingsavsnitt:
- . Myelosuppresjon [se ADVARSLER OG FORHOLDSREGLER ] . Maligniteter [se ADVARSLER OG FORHOLDSREGLER ] . Vaskulittiske toksisiteter [se ADVARSLER OG FORHOLDSREGLER ] . Risikoer ved samtidig bruk av antiretrovirale legemidler [se ADVARSLER OG FORHOLDSREGLER ] . Tilbakekalling av stråling [se ADVARSLER OG FORHOLDSREGLER ] . Makrocytose [se ADVARSLER OG FORHOLDSREGLER ] . Pulmonal toksisitet [se ADVARSLER OG FORHOLDSREGLER ]
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av HYDREA etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen.
- . Reproduktive system og brystsykdommer: azoospermi og oligospermi . Gastrointestinale lidelser: stomatitt, kvalme, oppkast, diaré og forstoppelse . Metabolisme og ernæringsforstyrrelser: anoreksi, tumorlysis syndrom . Hud- og subkutane vevssykdommer: makulopapulært utslett, sårdannelse i huden, kutan lupus erythematosus, dermatomyositt-lignende hudforandringer, perifert og ansiktserytem, hyperpigmentering, hyperpigmentering av negler, atrofi av hud og negler, avskalling, fiolette papler og alopecia . Nyre- og urinveislidelser: dysuri, forhøyede nivåer av serumursyre, ureanitrogen i blodet (BUN) og kreatinin . Forstyrrelser i nervesystemet: hodepine, svimmelhet, døsighet, desorientering, hallusinasjoner og kramper . Generelle lidelser: feber, frysninger, ubehag, ødem og asteni . Lever og galleveier: forhøyelse av leverenzymer, kolestase og hepatitt . Luftveislidelser: diffuse lungeinfiltrater, dyspné og lungefibrose, interstitiell lungesykdom, pneumonitt, alveolitt, allergisk alveolitt og hoste . Immunforstyrrelser: systemisk lupus erythematosus . Overfølsomhet: Legemiddelindusert feber (pyreksi) (>39°C, >102°F) som krever sykehusinnleggelse er rapportert samtidig med gastrointestinale, pulmonale, muskel- og skjelett-, hepatobiliære, dermatologiske eller kardiovaskulære manifestasjoner. Begynnelsen skjedde vanligvis innen 6 uker etter oppstart og forsvant ved seponering av hydroksyurea. Ved re-administrering gjenoppsto feber vanligvis innen 24 timer.
Bivirkninger observert med kombinert hydroksyurea og strålebehandling er lik de som er rapportert ved bruk av hydroksyurea eller strålebehandling alene. Disse effektene inkluderer primært benmargsdepresjon (anemi og leukopeni), mageirritasjon og mukositt. Nesten alle pasienter som får en adekvat kur med kombinert hydroksyurea og strålebehandling vil vise samtidig leukopeni. Blodplatedepresjon (
NARKOTIKAHANDEL
Økt toksisitet ved samtidig bruk av antiretrovirale legemidler
Pankreatitt
Hos pasienter med HIV-infeksjon under behandling med hydroksyurea og didanosin, med eller uten stavudin, har fatal og ikke-fatal pankreatitt forekommet. Hydroxyurea er ikke indisert for behandling av HIV-infeksjon; Hvis pasienter med HIV-infeksjon behandles med hydroksyurea, og spesielt i kombinasjon med didanosin og/eller stavudin, anbefales det imidlertid nøye overvåking for tegn og symptomer på pankreatitt. Avbryt behandling med hydroksyurea permanent hos pasienter som utvikler tegn og symptomer på pankreatitt.
Hepatotoksisitet
Levertoksisitet og leversvikt som resulterer i død er rapportert under overvåking etter markedsføring hos pasienter med HIV-infeksjon behandlet med hydroksyurea og andre antiretrovirale legemidler. Fatale leverhendelser ble oftest rapportert hos pasienter behandlet med kombinasjonen av hydroksyurea, didanosin og stavudin. Unngå denne kombinasjonen.
Perifer nevropati
Perifer nevropati, som i noen tilfeller var alvorlig, er rapportert hos pasienter med HIV-infeksjon som får hydroksyurea i kombinasjon med antiretrovirale legemidler, inkludert didanosin, med eller uten stavudin.
Laboratorietest interferens
Interferens med urinsyre-, urea- eller melkesyreanalyser
Studier har vist at det er en analytisk interferens av hydroksyurea med enzymene (urease, urikase og laktatdehydrogenase) som brukes ved bestemmelse av urea, urinsyre og melkesyre, noe som gir falskt forhøyede resultater av disse hos pasienter behandlet med hydroksyurea.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Myelosuppresjon
Hydroxyurea forårsaker alvorlig myelosuppresjon. Behandling med hydroksyurea bør ikke startes hvis benmargsfunksjonen er markert redusert. Benmargssuppresjon kan forekomme, og leukopeni er generelt den første og vanligste manifestasjonen. Trombocytopeni og anemi forekommer sjeldnere og ses sjelden uten en forutgående leukopeni. Benmargsdepresjon er mer sannsynlig hos pasienter som tidligere har fått strålebehandling eller cytotoksiske kreftkjemoterapeutiske midler; bruk hydroksyurea forsiktig hos slike pasienter.
Evaluer hematologisk status før og under behandling med HYDREA. Gi støttende behandling og endre dosen eller seponer HYDREA etter behov. Gjenoppretting etter myelosuppresjon er vanligvis rask når behandlingen avbrytes.
Maligniteter
Hydroxyurea er et kreftfremkallende menneske. Hos pasienter som får langvarig hydroksyurea for myeloproliferative lidelser, er sekundær leukemi rapportert. Hudkreft er også rapportert hos pasienter som får langvarig hydroksyurea. Gi råd til beskyttelse mot soleksponering og overvåk utviklingen av sekundære maligniteter.
Embryo-føtal toksisitet
Basert på virkningsmekanismen og funn hos dyr, kan HYDREA 500 mg forårsake fosterskader når det administreres til en gravid kvinne. Hydroxyurea var embryotoksisk og teratogent hos rotter og kaniner ved doser på henholdsvis 0,8 ganger og 0,3 ganger den maksimale anbefalte daglige dosen til mennesker på mg/m2-basis. Informer gravide kvinner om den potensielle risikoen for et foster [se Bruk i spesifikke populasjoner ].
Informer kvinner med reproduksjonsevne til å bruke effektiv prevensjon under og etter behandling med HYDREA 500 mg i minst 6 måneder etter behandling. Rådfør menn med reproduksjonspotensial til å bruke effektiv prevensjon under og etter behandling med HYDREA 500 mg i minst 1 år etter behandling [se Bruk i spesifikke populasjoner ].
Vaskulittiske toksisiteter
Kutan vaskulittisk toksisitet, inkludert vaskulittiske ulcerasjoner og koldbrann, har forekommet hos pasienter med myeloproliferative lidelser under behandling med hydroksyurea. Disse vaskulittiske toksisitetene ble oftest rapportert hos pasienter med en historie med, eller som for tiden mottar, interferonbehandling. Hvis det oppstår kutane vaskulittsår, sett i gang behandling og seponer HYDREA.
Levende vaksinasjoner
Unngå bruk av levende vaksine hos pasienter som tar HYDREA. Samtidig bruk av HYDREA og en levende virusvaksine kan potensere replikasjonen av viruset og/eller kan øke bivirkningen av vaksinen fordi normale forsvarsmekanismer kan undertrykkes av HYDREA. Vaksinasjon med levende vaksiner hos en pasient som får HYDREA 500 mg kan føre til alvorlig infeksjon. Pasientens antistoffrespons på vaksiner kan være redusert. Vurder konsultasjon med en spesialist.
Risikoer ved samtidig bruk av antiretrovirale legemidler
Pankreatitt, hepatotoksisitet og perifer nevropati har oppstått når hydroksyurea ble administrert samtidig med antiretrovirale legemidler, inkludert didanosin og stavudin [se NARKOTIKAHANDEL ].
Tilbakekalling av stråling
Pasienter som har fått strålebehandling tidligere kan ha en forverring av erytem etter bestråling. Overvåk for huderytem hos pasienter som tidligere har mottatt stråling og behandler symptomatisk.
Makrocytose
HYDREA 500mg kan forårsake makrocytose, som er selvbegrensende, og ses ofte tidlig i behandlingsforløpet. Den morfologiske endringen ligner pernisiøs anemi, men er ikke relatert til vitamin B12 eller folsyremangel. Dette kan maskere diagnosen pernisiøs anemi. Profylaktisk administrering av folsyre anbefales.
Lungetoksisitet
Interstitiell lungesykdom inkludert lungefibrose, lungeinfiltrasjon, pneumonitt og alveolitt/allergisk alveolitt (inkludert fatale tilfeller) er rapportert hos pasienter behandlet for myeloproliferativ neoplasma. Overvåk pasienter som utvikler pyreksi, hoste, dyspné eller andre luftveissymptomer ofte, undersøk og behandle umiddelbart. Seponer HYDREA 500mg og administrer med kortikosteroider [se BIVIRKNINGER ].
Laboratorietest interferens
Interferens med urinsyre-, urea- eller melkesyreanalyser er mulig, noe som gir falskt forhøyede resultater av disse hos pasienter behandlet med hydroksyurea [se NARKOTIKAHANDEL ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Konvensjonelle langtidsstudier for å evaluere det karsinogene potensialet til hydroksyurea er ikke utført. Imidlertid økte intraperitoneal administrering av 125 til 250 mg/kg hydroksyurea (omtrent 0,6-1,2 ganger den maksimale anbefalte orale daglige dosen for mennesker på mg/m2-basis) tre ganger ukentlig i 6 måneder til hunnrotter forekomsten av brystsvulster hos rotter som overlever til 18 år. måneder sammenlignet med kontroll. Hydroxyurea er mutagent in vitro for bakterier, sopp, protozoer og pattedyrceller. Hydroxyurea er klastogent in vitro (hamsterceller, humane lymfoblaster) og in vivo (SCE-analyse i gnagere, mus mikronukleus-analyse). Hydroxyurea forårsaker transformasjon av gnagerembryoceller til en tumorigen fenotype.
Hydroxyurea administrert til hannrotter med 60 mg/kg/dag (omtrent 0,3 ganger den maksimale anbefalte daglige dosen for mennesker på mg/m2-basis) ga testikkelatrofi, reduserte spermatogenese og reduserte deres evne til å impregnere hunner betydelig.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
HYDREA kan forårsake fosterskade basert på funn fra dyrestudier og legemidlets virkningsmekanisme [se KLINISK FARMAKOLOGI ]. Det er ingen data om bruk av HYDREA hos gravide kvinner for å informere om en legemiddelrelatert risiko. I reproduksjonsstudier på dyr ga administrering av hydroksyurea til drektige rotter og kaniner under organogenese embryotoksiske og teratogene effekter ved doser henholdsvis 0,8 ganger og 0,3 ganger den maksimale anbefalte daglige dosen for mennesker på mg/m2-basis (se Data ). Informer kvinner om den potensielle risikoen for et foster og unngå å bli gravid mens de behandles med HYDREA.
I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 %–4 % og 15 %–20 %.
Data
Dyredata
Hydroxyurea har vist seg å være et potent teratogen i en lang rekke dyremodeller, inkludert mus, hamstere, katter, miniatyrsvin, hunder og aper i doser innenfor 1 ganger den humane dosen gitt på mg/m2-basis. Hydroxyurea er embryotoksisk og forårsaker føtale misdannelser (delvis forbenede kraniebein, fravær av øyehuler, hydrocefali, todelte brystben, manglende lumbale ryggvirvler) ved 180 mg/kg/dag (omtrent 0,8 ganger den maksimale anbefalte daglige dosen til mennesker på mg/m2-basis) hos rotter og ved 30 mg/kg/dag (omtrent 0,3 ganger den maksimale anbefalte daglige dosen for mennesker på mg/m2-basis) hos kaniner. Embryotoksisitet var preget av redusert føtal levedyktighet, reduserte levende kullstørrelser og utviklingsforsinkelser. Hydroxyurea krysser placenta. Enkeltdoser på ≥375 mg/kg (ca. 1,7 ganger den maksimale anbefalte daglige dosen for mennesker på mg/m2-basis) til rotter forårsaket veksthemming og nedsatt læreevne.
Amming
Risikosammendrag
Hydroxyurea skilles ut i morsmelk. På grunn av potensialet for alvorlige bivirkninger hos et spedbarn som ammes fra hydroksyurea, inkludert karsinogenitet, må du avbryte ammingen under behandling med HYDREA.
Kvinner og menn med reproduktivt potensial
Graviditetstesting
Kontroller graviditetsstatusen til kvinner med reproduksjonspotensial før behandling med HYDREA starter.
Prevensjon
Kvinner
HYDREA kan forårsake fosterskader når det administreres til en gravid kvinne [se Svangerskap ]. Informer kvinner med reproduksjonsevne til å bruke effektiv prevensjon under og etter behandling med HYDREA i minst 6 måneder etter behandling. Råder kvinner til umiddelbart å rapportere graviditet.
Hanner
HYDREA 500mg kan skade sædceller og testikkelvev, noe som kan resultere i mulige genetiske abnormiteter. Menn med kvinnelige seksuelle partnere med reproduksjonspotensial bør bruke effektiv prevensjon under og etter behandling med HYDREA 500 mg i minst 1 år etter behandling [se Ikke-klinisk toksikologi ].
Infertilitet
Hanner
Basert på funn hos dyr og mennesker, kan mannlig fertilitet bli kompromittert ved behandling med HYDREA. Azoospermi eller oligospermi, noen ganger reversibel, har blitt observert hos menn. Informere mannlige pasienter om muligheten for spermkonservering før behandlingsstart [se BIVIRKNINGER og Ikke-klinisk toksikologi ].
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Eldre pasienter kan være mer følsomme for effekten av hydroksyurea og kan kreve et lavere doseregime. Hydroxyurea skilles ut av nyrene, og risikoen for bivirkninger av dette legemidlet kan være større hos pasienter med nedsatt nyrefunksjon. Fordi eldre pasienter er mer sannsynlig å ha nedsatt nyrefunksjon, bør det utvises forsiktighet ved dosevalg, og det kan være nyttig å overvåke nyrefunksjonen [se DOSERING OG ADMINISTRASJON ].
Nedsatt nyrefunksjon
Eksponeringen for hydroksyurea er høyere hos pasienter med kreatininclearance på mindre enn 60 ml/min eller hos pasienter med nyresykdom i sluttstadiet (ESRD). Reduser dosen og overvåk nøye de hematologiske parametrene når HYDREA 500mg skal administreres til disse pasientene [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Det er ingen data som støtter spesifikk veiledning for dosejustering hos pasienter med nedsatt leverfunksjon. Nøye overvåking av hematologiske parametere anbefales hos disse pasientene.
OVERDOSE
Akutt mukokutan toksisitet er rapportert hos pasienter som får hydroksyurea i doser flere ganger den terapeutiske dosen. Sårhet, fiolett erytem, ødem på håndflater og fotsåler etterfulgt av skjelling av hender og føtter, alvorlig generalisert hyperpigmentering av huden og stomatitt er også observert.
KONTRAINDIKASJONER
HYDREA 500mg er kontraindisert hos pasienter som har vist en tidligere overfølsomhet overfor hydroksyurea eller en annen komponent i formuleringen.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Den nøyaktige mekanismen som hydroksyurea produserer sine antineoplastiske effekter kan foreløpig ikke beskrives. Imidlertid gir rapportene fra forskjellige studier i vevskultur hos rotter og mennesker støtte til hypotesen om at hydroksyurea forårsaker en umiddelbar hemming av DNA-syntese ved å fungere som en ribonukleotidreduktaseinhibitor, uten å forstyrre syntesen av ribonukleinsyre eller protein. Denne hypotesen forklarer hvorfor hydroksyurea under visse forhold kan indusere teratogene effekter.
Tre virkningsmekanismer har blitt postulert for økt effektivitet av samtidig bruk av hydroksyureabehandling med bestråling på plateepitelkarsinomer (epidermoid) i hode og nakke. In vitro-studier som bruker kinesiske hamsterceller tyder på at hydroksyurea (1) er dødelig for normalt radioresistente S-stadiumceller, og (2) holder andre celler i cellesyklusen i G1- eller pre-DNA-syntesestadiet der de er mest utsatt for effekter av bestråling. Den tredje virkningsmekanismen har blitt teoretisert på grunnlag av in vitro-studier av HeLa-celler. Det ser ut til at hydroksyurea, ved inhibering av DNA-syntese, hindrer den normale reparasjonsprosessen til celler som er skadet, men ikke drept av bestråling, og reduserer dermed deres overlevelsesrate; RNA- og proteinsynteser har ikke vist noen endring.
Farmakokinetikk
Absorpsjon
Etter oral administrering av HYDREA, når hydroksyurea maksimal plasmakonsentrasjon i løpet av 1 til 4 timer. Gjennomsnittlig maksimal plasmakonsentrasjon og AUC øker mer enn proporsjonalt med økning av dose.
Det er ingen data om effekten av mat på absorpsjonen av hydroksyurea.
Fordeling
Hydroxyurea distribueres gjennom hele kroppen med et distribusjonsvolum som tilnærmer seg totalt kroppsvann.
Hydroxyurea konsentreres i leukocytter og erytrocytter.
Metabolisme
Opptil 60 % av en oral dose gjennomgår omdannelse gjennom mettbar levermetabolisme og en mindre nedbrytningsvei av urease funnet i tarmbakterier.
Utskillelse
Hos pasienter med sigdcelleanemi var gjennomsnittlig kumulativ urinrestitusjon av hydroksyurea ca. 40 % av administrert dose.
Spesifikke populasjoner
Nedsatt nyrefunksjon
Effekten av nedsatt nyrefunksjon på farmakokinetikken til hydroksyurea ble vurdert hos voksne pasienter med sigdcellesykdom og nedsatt nyrefunksjon. Pasienter med normal nyrefunksjon (kreatininclearance [CrCl] >80 mL/min), mild (CrCl 50-80 mL/min), moderat (CrCl = 30-60 ml/min). Reduser dosen av HYDREA 500 mg når det gis til pasienter med kreatininclearance på DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
PASIENTINFORMASJON
- . Det er risiko for myelosuppresjon. Overvåking av blodtellinger ukentlig gjennom hele behandlingen bør vektlegges hos pasienter som tar HYDREA [se ADVARSLER OG FORHOLDSREGLER ]. Råd pasientene til å rapportere tegn og symptomer på infeksjon eller blødning umiddelbart. . Informer pasienter om at det er risiko for kutan vaskulittisk toksisitet og sekundære maligniteter inkludert leukemi og hudkreft [se ADVARSLER OG FORHOLDSREGLER ]. . Informer kvinner om reproduksjonspotensiale om den potensielle risikoen for et foster og informer helsepersonell om en kjent eller mistenkt graviditet. Informer kvinner og menn med reproduksjonsevne til å bruke prevensjon under og etter behandling med HYDREA [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ]. . Råd pasientene til å informere helsepersonell dersom de har mottatt eller planlegger å motta vaksinasjoner mens de tar HYDREA 500 mg, da dette kan føre til en alvorlig infeksjon [se ADVARSLER OG FORHOLDSREGLER ]. . Råd kvinner til å slutte å amme under behandling med HYDREA [se Bruk i spesifikke populasjoner ]. . Pasienter med HIV-infeksjon bør kontakte legen sin for tegn og symptomer på pankreatitt, leverhendelser og perifer nevropati [se ADVARSLER OG FORHOLDSREGLER ]. . Erytem etter bestråling kan forekomme hos pasienter som har fått tidligere strålebehandling [se ADVARSLER OG FORHOLDSREGLER ]. . Informer pasienter om symptomene på potensiell lungetoksisitet og instruer dem om å søke øyeblikkelig legehjelp i tilfelle feber, hoste, dyspné eller andre luftveissymptomer [se ADVARSLER OG FORHOLDSREGLER ].
