Zofran 4mg, 8mg Ondansetron Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Zofran og hvordan brukes det?
Zofran 4mg er et reseptbelagt legemiddel som brukes som profylakse og for å behandle symptomer på kvalme og oppkast på grunn av visse medisiner eller postoperativt. Zofran 8mg kan brukes alene eller sammen med andre medisiner.
Zofran tilhører en klasse legemidler som kalles antiemetika, selektiv 5-HT3-antagonist.
Det er ikke kjent om Zofran 4mg er trygt og effektivt hos barn yngre enn 1 måned.
Hva er de mulige bivirkningene av Zofran?
Zofran kan forårsake alvorlige bivirkninger, inkludert:
- . alvorlig forstoppelse, . magesmerter, . oppblåsthet, . hodepine med brystsmerter og alvorlig svimmelhet, . besvimelse, . raske eller bankende hjerteslag, . gulfarging av hud eller øyne (gulsott) . tåkesyn, . midlertidig synstap, . opphisselse, . hallusinasjoner, . feber, . rask hjerterytme, . overaktive reflekser, . kvalme, . oppkast, . diaré, . tap av koordinasjon, og . besvimelse
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Zofran inkluderer:
- . diaré, . forstoppelse, . døsighet, og . trøtt følelse
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Zofran. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Den aktive ingrediensen i ZOFRAN 4 mg tabletter og ZOFRAN mikstur er ondansetronhydroklorid som dihydrat, den racemiske formen av ondansetron og et selektivt blokkeringsmiddel av serotonin 5-HT3-reseptortypen. Kjemisk er det (±) 1, 2, 3, 9-tetrahydro-9-metyl-3-[(2-metyl-1H-imidazol-1-yl)metyl]-4H-karbazol-4-on, monohydroklorid, dihydrat . Den har følgende strukturformel:
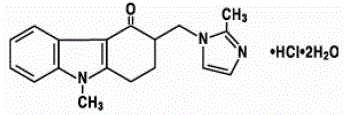
Den empiriske formelen er C18H19N3O·HCl·2H2O, som representerer en molekylvekt på 365,9.
Ondansetronhydrokloriddihydrat er et hvitt til off-white pulver som er løselig i vann og vanlig saltvann.
Den aktive ingrediensen i ZOFRAN 4mg ODT oralt desintegrerende tabletter er ondansetronbase, den racemiske formen av ondansetron, og et selektivt blokkeringsmiddel av serotonin 5-HT3-reseptortypen. Kjemisk er det (±) 1,2,3,9tetrahydro-9-metyl-3-[(2-metyl-1H-imidazol-1-yl)metyl]-4H-karbazol-4-on. Den har følgende strukturformel:
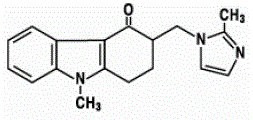
Den empiriske formelen er C18H19N3O som representerer en molekylvekt på 293,4.
Hver 4 mg ZOFRAN 8 mg tablett for oral administrering inneholder ondansetronhydrokloriddihydrat tilsvarende 4 mg ondansetron. Hver 8 mg ZOFRAN 8 mg tablett for oral administrering inneholder ondansetronhydrokloriddihydrat tilsvarende 8 mg ondansetron. Hver tablett inneholder også de inaktive ingrediensene hypromellose, gul jernoksid (kun 8 mg tablett), laktose, magnesiumstearat, mikrokrystallinsk cellulose, pregelatinisert stivelse, triacetin og titandioksid.
Hver 4 mg ZOFRAN 8 mg ODT oralt desintegrerende tablett for oral administrering inneholder 4 mg ondansetronbase. Hver 8 mg ZOFRAN 4 mg ODT oralt desintegrerende tablett for oral administrering inneholder 8 mg ondansetronbase. Hver ZOFRAN ODT-tablett inneholder også de inaktive ingrediensene aspartam, gelatin, mannitol, metylparabennatrium, propylparabennatrium og jordbærsmak. ZOFRAN ODT tabletter er en frysetørket, oralt administrert formulering av ondansetron som desintegrerer på tungen og krever ikke vann for å hjelpe til med oppløsning eller svelging.
Hver 5 ml ZOFRAN mikstur inneholder 5 mg ondansetronhydrokloriddihydrat tilsvarende 4 mg ondansetron. ZOFRAN 8mg mikstur inneholder de inaktive ingrediensene vannfri sitronsyre, renset vann, natriumbenzoat, natriumcitrat, sorbitol og jordbærsmak.
INDIKASJONER
ZOFRAN er indisert for forebygging av kvalme og oppkast assosiert med:
- . sterkt emetogen kreftkjemoterapi, inkludert cisplatin større enn eller lik 50 mg/m² . innledende og gjentatte kurs med moderat emetogen kreftkjemoterapi . strålebehandling hos pasienter som får enten total kroppsbestråling, enkelt høydosefraksjon til magen eller daglige fraksjoner til magen
ZOFRAN er også indisert for forebygging av postoperativ kvalme og/eller oppkast.
DOSERING OG ADMINISTRASJON
Dosering
De anbefalte doseringsregimene for voksne og pediatriske pasienter er beskrevet i henholdsvis tabell 1 og tabell 2. Tilsvarende doser av ZOFRAN tabletter, ZOFRAN ODT® oralt desintegrerende tabletter og ZOFRAN mikstur kan brukes om hverandre.
Dosering ved nedsatt leverfunksjon
Hos pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh-score på 10 eller høyere), ikke overskrid en total daglig dose på 8 mg [se Bruk i spesifikke populasjoner , KLINISK FARMAKOLOGI ].
Administrasjonsinstruksjoner for ZOFRAN ODT oralt desintegrerende tabletter
Ikke prøv å skyve ZOFRAN ODT oralt desintegrerende tabletter gjennom foliebaksiden. Med tørre hender, SKELL TILBAKE foliebaksiden av 1 blisterpakning og fjern forsiktig tabletten. Plasser UMIDDELBART ZOFRAN 4mg ODT oralt desintegrerende tablett på toppen av tungen der den vil løse seg opp i løpet av sekunder, og svelg deretter med spytt. Administrering med væske er ikke nødvendig.
HVORDAN LEVERES
Doseringsformer og styrker
ZOFRAN tabletter er ovale, filmdrasjerte tabletter merket med "Zofran" på den ene siden og er tilgjengelige i følgende styrker:
- . 4 mg - hvit tablett med "4" inngravert på den andre siden. . 8 mg - gul tablett med "8" inngravert på den andre siden.
ZOFRAN ODT oralt desintegrerende tabletter er hvite, runde og plankonvekse tabletter tilgjengelig i følgende styrker:
- . 4 mg - preget med "Z4" på den ene siden. . 8 mg - preget med "Z8" på den ene siden.
ZOFRAN 4mg mikstur, oppløsning 4 mg/5 ml, er en klar, fargeløs til lysegul væske med en karakteristisk jordbærlukt tilgjengelig i en 50 ml flaske.
Oppbevaring og håndtering
ZOFRAN nettbrett
4 mg (ondansetronhydrokloriddihydrat tilsvarende 4 mg ondansetron), er hvite, ovale, filmdrasjerte tabletter merket med "Zofran" på den ene siden og "4" på den andre i flasker med 30 tabletter (NDC 0078-0675-15 ).
Oppbevares mellom 2°C og 30°C (36°F og 86°F). Beskytt mot lys. Dispenser i tett, lysbestandig beholder som definert i USP.
8 mg (ondansetronhydrokloriddihydrat tilsvarende 8 mg ondansetron), er gule, ovale, filmdrasjerte tabletter merket med "Zofran" på den ene siden og "8" på den andre i flasker med 30 tabletter (NDC 0078-0676-15 ).
Oppbevares mellom 2°C og 30°C (36°F og 86°F). Beskytt mot lys. Dispenser i tett, lysbestandig beholder som definert i USP.
ZOFRAN 8mg ODT oralt desintegrerende tabletter
4 mg (som 4 mg ondansetronbase) er hvite, runde og plankonvekse tabletter merket med "Z4" på den ene siden i enhetsdosepakninger med 30 tabletter (NDC 0078-0679-19).
mg (som 8 mg ondansetronbase) er hvite, runde og plankonvekse tabletter merket med "Z8" på den ene siden i enhetsdosepakninger med 30 tabletter (NDC 0078-0680-19).
Oppbevares mellom 2°C og 30°C (36°F og 86°F).
ZOFRAN 4mg oral oppløsning
en klar, fargeløs til lysegul væske med en karakteristisk jordbærlukt, inneholder 5 mg ondansetronhydrokloriddihydrat tilsvarende 4 mg ondansetron per 5 ml i gule glassflasker på 50 ml med barnesikre lukkinger (NDC 0078-0677-22) .
Oppbevares oppreist mellom 15°C og 30°C (59°F og 86°F). Beskytt mot lys. Oppbevar flasker stående i kartonger.
Distribuert av: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Revidert: april 2021
BIVIRKNINGER
Følgende klinisk signifikante bivirkninger er beskrevet andre steder i merkingen:
- . Overfølsomhetsreaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . QT-forlengelse [se ADVARSLER OG FORHOLDSREGLER ] . Serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ] . Maskering av progressiv ileus og gastrisk oppblåsthet [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
Følgende bivirkninger er rapportert i kliniske studier med pasienter behandlet med ondansetron, den aktive ingrediensen i ZOFRAN. En årsakssammenheng til behandling med ZOFRAN var i mange tilfeller uklar.
Forebygging av kjemoterapi-indusert kvalme og oppkast
De vanligste bivirkningene rapportert hos mer enn eller lik 4 % av 300 voksne som fikk en enkeltdose på 24 mg ZOFRAN 4 mg oralt i 2 studier for forebygging av kvalme og oppkast assosiert med høyemetogen kjemoterapi (cisplatin større enn eller lik 50 mg) /m²) var: hodepine (11 %) og diaré (4 %).
De vanligste bivirkningene rapportert i 4 studier hos voksne for forebygging av kvalme og oppkast assosiert med moderat emetogen kjemoterapi (primært cyklofosfamidbaserte regimer) er vist i tabell 3.
Mindre vanlige bivirkninger
Sentralnervesystemet
Ekstrapyramidale reaksjoner (mindre enn 1 % av pasientene).
Hepatisk
Verdiene for aspartattransaminase (AST) og/eller alanintransaminase (ALT) overskred det dobbelte av øvre normalgrense hos omtrent 1 % til 2 % av 723 pasienter som fikk ZOFRAN 8 mg og cyklofosfamidbasert kjemoterapi i amerikanske kliniske studier. Økningene var forbigående og så ikke ut til å være relatert til dose eller varighet av behandlingen. Ved gjentatt eksponering forekom lignende forbigående økninger i transaminaseverdier i noen kurer, men symptomatisk leversykdom forekom ikke. Rollen til kreftkjemoterapi i disse biokjemiske endringene er uklar.
Leversvikt og død er rapportert hos kreftpasienter som samtidig får medisiner, inkludert potensielt hepatotoksisk cytotoksisk kjemoterapi og antibiotika. Etiologien til leversvikten er uklar.
Integumentær
Utslett (ca. 1 % av pasientene).
Annet (mindre enn 2 %)
Anafylaksi, bronkospasme, takykardi, angina, hypokalemi, elektrokardiografiske endringer, vaskulære okklusive hendelser og grand mal-anfall. Bortsett fra bronkospasmer og anafylaksi, er forholdet til ZOFRAN 4mg uklart.
Forebygging av strålingsindusert kvalme og oppkast
De vanligste bivirkningene (større enn eller lik 2 %) rapportert hos pasienter som fikk ZOFRAN og samtidig strålebehandling var lik de som ble rapportert hos pasienter som fikk ZOFRAN og samtidig kjemoterapi og var hodepine, forstoppelse og diaré.
Forebygging av postoperativ kvalme og oppkast
De vanligste bivirkningene rapportert hos voksne i forsøk(er) med forebygging av postoperativ kvalme og oppkast er vist i tabell 4. I disse forsøkene fikk pasientene samtidig flere perioperative og postoperative medisiner i begge behandlingsgruppene.
en crossover-studie med 25 forsøkspersoner ble hodepine rapportert hos 6 personer som fikk ZOFRAN 8 mg ODT oralt desintegrerende tablett med vann (24 %) sammenlignet med 2 personer som fikk ZOFRAN 8 mg ODT oralt desintegrerende tablett uten vann (8 %).
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av ondansetron etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Kardiovaskulær
Arytmier (inkludert ventrikulær og supraventrikulær takykardi, premature ventrikkelsammentrekninger og atrieflimmer), bradykardi, elektrokardiografiske endringer (inkludert andregrads hjerteblokk, QT/QTc-intervallforlengelse og ST-segmentdepresjon), hjertebank og synkope. I sjeldne tilfeller og hovedsakelig med intravenøs ondansetron, er forbigående EKG-forandringer, inkludert QT-intervallforlengelse, rapportert.
Generell
Skylling
Sjeldne tilfeller av overfølsomhetsreaksjoner, noen ganger alvorlige (f.eks. anafylaktiske reaksjoner, angioødem, bronkospasme, kortpustethet, hypotensjon, larynxødem, stridor) er også rapportert. Laryngospasme, sjokk og hjertestans har oppstått under allergiske reaksjoner hos pasienter som får injiserbart ondansetron.
Lever og galleveier
Leverenzymavvik.
Nedre luftveier
Hikke.
Nevrologi
Oculogyric krise, vises alene, så vel som med andre dystoniske reaksjoner.
Hud
Urticaria, Stevens-Johnsons syndrom og toksisk epidermal nekrolyse.
Øyelidelser
Tilfeller av forbigående blindhet, hovedsakelig under intravenøs administrering, er rapportert. Disse tilfellene av forbigående blindhet ble rapportert å gå over i løpet av noen få minutter opptil 48 timer.
NARKOTIKAHANDEL
Serotonerge legemidler
Serotonergt syndrom (inkludert endret mental status, autonom ustabilitet og nevromuskulære symptomer) er beskrevet etter samtidig bruk av 5-HT3-reseptorantagonister og andre serotonerge legemidler, inkludert SSRI og SNRI. Overvåk fremveksten av serotonergt syndrom. Hvis symptomer oppstår, seponer ZOFRAN 4mg og start støttende behandling [se ADVARSLER OG FORHOLDSREGLER ].
Legemidler som påvirker cytokrom P-450 enzymer
Ondansetron ser ikke ut til i seg selv å indusere eller hemme det cytokrom P-450 legemiddelmetaboliserende enzymsystemet i leveren [se KLINISK FARMAKOLOGI ]. Fordi ondansetron metaboliseres av hepatiske cytokrom P450 legemiddelmetaboliserende enzymer (CYP3A4, CYP2D6, CYP1A2), kan induktorer eller hemmere av disse enzymene endre clearance og dermed halveringstiden til ondansetron. Hos pasienter behandlet med potente induktorer av CYP3A4 (dvs. fenytoin, karbamazepin og rifampin), var clearance av ondansetron signifikant økt og ondansetron-blodkonsentrasjonen ble redusert. På grunnlag av tilgjengelige data anbefales imidlertid ingen dosejustering for ZOFRAN 8 mg for pasienter på disse legemidlene [se KLINISK FARMAKOLOGI ].
Tramadol
Selv om det ikke er observert noen farmakokinetisk legemiddelinteraksjon mellom ondansetron og tramadol, indikerer data fra 2 små studier at når det brukes sammen, kan ZOFRAN 8 mg øke pasientkontrollert administrering av tramadol. Overvåk pasienter for å sikre tilstrekkelig smertekontroll når ondansetron administreres sammen med tramadol.
Kjemoterapi
Karmustin, etoposid og cisplatin påvirker ikke farmakokinetikken til ondansetron.
en crossover-studie med 76 pediatriske pasienter økte ikke intravenøs ondansetron systemiske konsentrasjoner av høydose metotreksat.
Alfentanil og atracurium
ZOFRAN 4mg endrer ikke de respirasjonsdempende effektene produsert av alfentanil eller graden av nevromuskulær blokade produsert av atracurium. Interaksjoner med generell eller lokal anestesi er ikke studert.
Narkotikamisbruk og avhengighet
Dyrestudier har vist at ondansetron ikke er diskriminert som et benzodiazepin og heller ikke erstatter benzodiazepiner i direkte avhengighetsstudier.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Overfølsomhetsreaksjoner
Overfølsomhetsreaksjoner, inkludert anafylaksi og bronkospasme, er rapportert hos pasienter som har utvist overfølsomhet overfor andre selektive 5-HT3-reseptorantagonister. Hvis overfølsomhetsreaksjoner oppstår, avbryt bruken av ZOFRAN; behandles umiddelbart i henhold til standard for omsorg og overvåk til tegn og symptomer forsvinner [se KONTRAINDIKASJONER ].
QT-forlengelse
Endringer i elektrokardiogram (EKG), inkludert forlengelse av QT-intervallet, er sett hos pasienter som får ondansetron. I tillegg er tilfeller av Torsade de Pointes etter markedsføring blitt rapportert hos pasienter som bruker ZOFRAN. Unngå ZOFRAN 8mg hos pasienter med medfødt lang QT-syndrom. EKG-overvåking anbefales hos pasienter med elektrolyttavvik (f.eks. hypokalemi eller hypomagnesemi), kongestiv hjertesvikt, bradyarytmier eller pasienter som tar andre legemidler som fører til QT-forlengelse [se KLINISK FARMAKOLOGI ].
Serotonin syndrom
Utvikling av serotonergt syndrom er rapportert med 5-HT3-reseptorantagonister alene. De fleste rapporter har vært assosiert med samtidig bruk av serotonerge legemidler (f.eks. selektive serotoninreopptakshemmere (SSRI), serotonin og noradrenalin reopptakshemmere (SNRI), monoaminoksidasehemmere, mirtazapin, fentanyl, litium, tramadol og intravenøst). Noen av de rapporterte tilfellene var dødelige. Serotonergt syndrom som oppstår ved overdosering av ZOFRAN 4 mg alene er også rapportert. De fleste rapportene om serotonergt syndrom relatert til bruk av 5-HT3-reseptorantagonister skjedde på en post-anestesiavdeling eller et infusjonssenter.
Symptomer assosiert med serotonergt syndrom kan omfatte følgende kombinasjon av tegn og symptomer: endringer i mental status (f.eks. agitasjon, hallusinasjoner, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtrykk, svimmelhet, diaforese, rødme, hypertermi) nevromuskulære symptomer (f.eks. skjelving, rigiditet, myoklonus, hyperrefleksi, inkoordinasjon), anfall, med eller uten gastrointestinale symptomer (f.eks. kvalme, oppkast, diaré). Pasienter bør overvåkes for utvikling av serotonergt syndrom, spesielt ved samtidig bruk av ZOFRAN 4 mg og andre serotonerge legemidler. Hvis symptomer på serotonergt syndrom oppstår, seponer ZOFRAN og start støttende behandling. Pasienter bør informeres om økt risiko for serotonergt syndrom, spesielt hvis ZOFRAN brukes samtidig med andre serotonerge legemidler [se NARKOTIKAHANDEL , OVERDOSERING ].
Maskering av progressiv ileus og gastrisk distensjon
Bruk av ZOFRAN hos pasienter etter abdominal kirurgi eller hos pasienter med kjemoterapi-indusert kvalme og oppkast kan maskere en progressiv ileus og/eller gastrisk distensjon. Overvåk for redusert tarmaktivitet, spesielt hos pasienter med risikofaktorer for gastrointestinal obstruksjon.
ZOFRAN 8mg er ikke et legemiddel som stimulerer mage- eller tarmperistaltikk. Den skal ikke brukes i stedet for nasogastrisk suging.
Fenylketonuri
Fenylketonuriske pasienter bør informeres om at ZOFRAN ODT oralt desintegrerende tabletter inneholder fenylalanin (en komponent av aspartam). Hver 4-mg og 8-mg oralt desintegrerende tablett inneholder mindre enn 0,03 mg fenylalanin.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Kreftfremkallende effekter ble ikke sett i 2-års studier på rotter og mus med orale ondansetrondoser opp til henholdsvis 10 mg/kg per dag og 30 mg/kg per dag (omtrent 4 og 6 ganger den maksimale anbefalte orale dosen til mennesker på 24 mg per dag, basert på kroppsoverflate).
Ondansetron var ikke mutagent i standardtester for mutagenitet.
Oral administrering av ondansetron opp til 15 mg/kg per dag (ca. 6 ganger den maksimale anbefalte orale dosen til mennesker på 24 mg per dag, basert på kroppsoverflate) påvirket ikke fertiliteten eller generell reproduksjonsevne hos hann- og hunnrotter.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Publiserte epidemiologiske studier om sammenhengen mellom bruk av ondansetron og store fødselsskader har rapportert inkonsistente funn og har viktige metodiske begrensninger som utelukker konklusjoner om sikkerheten ved bruk av ondansetron under graviditet (se Data ). Tilgjengelige data etter markedsføring har ikke identifisert en medikamentassosiert risiko for spontanabort eller ugunstige utfall hos mor. Reproduksjonsstudier på rotter og kaniner viste ikke tegn på skade på fosteret når ondansetron ble administrert under organogenese med henholdsvis ca. 6 og 24 ganger den maksimale anbefalte orale dosen til mennesker på 24 mg/dag, basert på kroppsoverflate (se Data ).
Bakgrunnsrisikoen for store fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, spontanaborter eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanaborter i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Data
Menneskelige data
Tilgjengelige data om bruk av ondansetron hos gravide kvinner fra flere publiserte epidemiologiske studier utelukker en vurdering av en legemiddelassosiert risiko for uønskede fosterutfall på grunn av viktige metodiske begrensninger, inkludert usikkerheten om hvorvidt kvinner som fylte ut en resept faktisk tok medisinen, samtidig bruk av andre medisiner eller behandlinger, tilbakekallingsbias og andre ujusterte forstyrrelser.
Eksponering for ondansetron in utero har ikke vært assosiert med generelle store medfødte misdannelser i aggregerte analyser. En stor retrospektiv kohortstudie undersøkte 1970 kvinner som fikk resept på ondansetron under svangerskapet og rapporterte ingen sammenheng mellom eksponering for ondansetron og alvorlige medfødte misdannelser, spontanabort, dødfødsel, prematur fødsel, spedbarn med lav fødselsvekt eller spedbarn som er små for svangerskapsalderen.
To store retrospektive kohortstudier og en case-kontrollstudie har vurdert ondansetroneksponering i første trimester og risiko for kardiovaskulære defekter med inkonsistente funn. Relativ risiko (RR) varierte fra 0,97 (95 % KI 0,86 til 1,10) til 1,62 (95 % KI 1,04, 2,54). En undergruppeanalyse i en av kohortstudiene observerte at ondansetron var spesifikt assosiert med hjerteseptumdefekter (RR 2,05, 95 % KI 1,19, 3,28); denne sammenhengen ble imidlertid ikke bekreftet i andre studier.
Flere studier har vurdert ondansetron og risikoen for munnspalter med inkonsistente funn. En retrospektiv kohortstudie av 1,8 millioner svangerskap i den amerikanske Medicaid-databasen viste økt risiko for munnspalter blant 88 467 svangerskap der oral ondansetron ble foreskrevet i første trimester (RR 1,24, 95 % CI 1,03, 1,48), men ingen slik sammenheng var foreskrevet. rapportert med intravenøs ondansetron i 23 866 svangerskap (RR 0,95, 95 % KI 0,63, 1,43). I undergruppen kvinner som fikk begge administreringsformene var RR 1,07 (95 % KI 0,59, 1,93). To case-kontrollstudier, med data fra overvåkingsprogrammer for fødselsdefekter, rapporterte motstridende assosiasjoner mellom mors bruk av ondansetron og isolert ganespalte (OR 1,6 [95 % KI 1,1, 2,3] og 0,5 [95 % KI 0,3, 1,0]). Det er ukjent om ondansetroneksponering in utero i tilfeller av ganespalte skjedde i løpet av ganens dannelse (ganen dannes mellom 6. og 9. svangerskapsuke).
Dyredata
embryo-føtale utviklingsstudier på rotter og kaniner fikk gravide dyr orale doser av ondansetron opp til henholdsvis 15 mg/kg/dag og 30 mg/kg/dag i løpet av organogeneseperioden. Med unntak av en liten reduksjon i maternal kroppsvektøkning hos kaninene, var det ingen signifikant effekt av ondansetron på mors dyr eller utviklingen av avkommet. Ved doser på 15 mg/kg/dag hos rotter og 30 mg/kg/dag hos kaniner, var mors eksponeringsmargin omtrent 6 og 24 ganger den maksimale anbefalte orale dosen til mennesker på henholdsvis 24 mg/dag, basert på kroppsoverflate. .
en pre- og postnatal utviklingstoksisitetsstudie mottok drektige rotter orale doser av ondansetron opp til 15 mg/kg/dag fra dag 17 av svangerskapet til kull dag 21. Med unntak av en liten reduksjon i maternell kroppsvektsøkning, var det ingen effekter på de gravide rottene og den pre- og postnatale utviklingen av deres avkom, inkludert reproduksjonsevnen til den parede F1-generasjonen. Ved en dose på 15 mg/kg/dag hos rotter var mors eksponeringsmargin ca. 6 ganger den maksimale anbefalte orale dosen til mennesker på 24 mg/dag, basert på kroppsoverflate.
Amming
Risikosammendrag
Det er ikke kjent om ondansetron finnes i morsmelk. Det er ingen data om effekten av ZOFRAN 8mg på spedbarn som ammes eller effekten på melkeproduksjonen. Det er imidlertid påvist at ondansetron finnes i melken til rotter. Når et legemiddel er tilstede i animalsk melk, er det sannsynlig at legemidlet vil være tilstede i morsmelk.
De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for ZOFRAN 4mg og eventuelle potensielle bivirkninger på det ammede spedbarnet fra ZOFRAN eller fra den underliggende morstilstanden.
Pediatrisk bruk
Sikkerheten og effektiviteten til oralt administrert ZOFRAN er etablert hos pediatriske pasienter 4 år og eldre for å forebygge kvalme og oppkast forbundet med moderat emetogen kreftkjemoterapi. Bruk av ZOFRAN 4 mg i disse aldersgruppene støttes av bevis fra tilstrekkelige og godt kontrollerte studier av ZOFRAN hos voksne med tilleggsdata fra 3 åpne, ukontrollerte, ikke-amerikanske studier med 182 pediatriske pasienter i alderen 4 til 18 år med kreft som ble gitt en rekke cisplatin- eller noncisplatin-regimer [se DOSERING OG ADMINISTRASJON , Kliniske studier ].
Ytterligere informasjon om bruk av ondansetron hos pediatriske pasienter kan finnes i ZOFRAN Injeksjonsforskrivningsinformasjon.
Sikkerheten og effektiviteten av oralt administrert ZOFRAN 4mg er ikke fastslått hos pediatriske pasienter for:
- . forebygging av kvalme og oppkast assosiert med høyemetogen kreftkjemoterapi . forebygging av kvalme og oppkast forbundet med strålebehandling . forebygging av postoperativ kvalme og/eller oppkast
Geriatrisk bruk
Av det totale antallet forsøkspersoner som ble registrert i kreftkjemoterapi-indusert og postoperativ kvalme og oppkast i amerikanske og utenlandskontrollerte kliniske studier, som det var undergruppeanalyser for, var 938 (19 %) i alderen 65 år og eldre.
Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom forsøkspersoner 65 år og eldre og yngre forsøkspersoner. En reduksjon i clearance og økning i eliminasjonshalveringstid ble sett hos pasienter over 75 år sammenlignet med yngre personer [se KLINISK FARMAKOLOGI ]. Det var et utilstrekkelig antall pasienter over 75 år og eldre i de kliniske studiene til å tillate konklusjoner om sikkerhet eller effekt i denne aldersgruppen. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes. Ingen dosejustering er nødvendig hos eldre pasienter.
Nedsatt leverfunksjon
Ingen dosejustering er nødvendig hos pasienter med mild eller moderat nedsatt leverfunksjon.
Hos pasienter med alvorlig nedsatt leverfunksjon reduseres clearance og det tilsynelatende distribusjonsvolumet økes, noe som resulterer i en signifikant økning i halveringstiden til ondansetron. Overskrid derfor ikke en total daglig dose på 8 mg hos pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh-score på 10 eller høyere) [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
Ingen dosejustering anbefales for pasienter med noen grad av nedsatt nyrefunksjon (mild, moderat eller alvorlig). Det er ingen erfaring utover førstedagsadministrasjon av ondansetron [se KLINISK FARMAKOLOGI ].
OVERDOSE
Det finnes ingen spesifikk motgift for overdosering av ondansetron. Pasienter bør behandles med passende støttende terapi.
I tillegg til bivirkningene som er oppført ovenfor, har følgende bivirkninger blitt beskrevet ved overdosering av ondansetron: «Plutselig blindhet» (amaurose) av 2 til 3 minutters varighet pluss alvorlig forstoppelse oppstod hos en pasient som ble administrert 72 mg ondansetron intravenøst som en enkelt dose. Hypotensjon (og besvimelse) oppsto hos en pasient som tok 48 mg ZOFRAN-tabletter. Etter infusjon av 32 mg over bare en 4-minutters periode, ble det observert en vasovagal episode med forbigående andregrads hjerteblokk. I alle tilfeller forsvant bivirkningene fullstendig.
Pediatriske tilfeller forenlig med serotonergt syndrom er rapportert etter utilsiktede orale overdoser av ondansetron (over estimert inntak på 5 mg per kg) hos små barn. Rapporterte symptomer inkluderte somnolens, agitasjon, takykardi, takypné, hypertensjon, rødming, mydriasis, diaforese, myokloniske bevegelser, horisontal nystagmus, hyperrefleksi og anfall. Pasienter trengte støttebehandling, inkludert intubasjon i noen tilfeller, med fullstendig bedring uten følgetilstander innen 1 til 2 dager.
KONTRAINDIKASJONER
ZOFRAN er kontraindisert hos pasienter:
- . kjent for å ha overfølsomhet (f.eks. anafylaksi) overfor ondansetron eller noen av komponentene i formuleringen [se BIVIRKNINGER ] . får samtidig apomorfin på grunn av risikoen for alvorlig hypotensjon og bevissthetstap
KLINISK FARMAKOLOGI
Virkningsmekanismen
Ondansetron er en selektiv 5-HT3-reseptorantagonist. Selv om virkningsmekanismen ikke er fullstendig karakterisert, er ikke ondansetron en dopaminreseptorantagonist. Serotoninreseptorer av 5-HT3-typen er tilstede både perifert på vagale nerveterminaler og sentralt i kjemoreseptorens triggersone i området postrema. Det er ikke sikkert om ondansetrons antiemetiske virkning medieres sentralt, perifert eller på begge steder. Imidlertid ser cytotoksisk kjemoterapi ut til å være assosiert med frigjøring av serotonin fra enterokromaffincellene i tynntarmen. Hos mennesker øker urinutskillelsen av 5-hydroksyindoleddiksyre (5-HIAA) etter administrering av cisplatin parallelt med utbruddet av brekninger. Det frigjorte serotoninet kan stimulere vagale afferenter gjennom 5-HT3-reseptorene og sette i gang brekningsrefleksen.
Farmakodynamikk
Hos friske forsøkspersoner hadde intravenøse enkeltdoser på 0,15 mg/kg ondansetron ingen effekt på esophageal motilitet, gastrisk motilitet, lavere esophageal sphincter-trykk eller tynntarms transittid. Flerdagers administrering av ondansetron har vist seg å bremse kolontransit hos friske personer. Ondansetron har ingen effekt på plasmaprolaktinkonsentrasjonen.
Hjerteelektrofysiologi
Forlengelse av QTc-intervallet ble studert i en dobbeltblind, enkelt-intravenøs dose, placebo- og positivt kontrollert, crossover-studie med 58 friske forsøkspersoner. Maksimal gjennomsnittlig (95 % øvre konfidensgrense) forskjell i QTcF fra placebo etter baselinekorreksjon var 19,5 (21,8) millisekunder og 5,6 (7,4) millisekunder etter 15 minutters intravenøs infusjon av henholdsvis 32 mg og 8 mg ondansetroninjeksjon. En signifikant eksponering-respons-relasjon ble identifisert mellom ondansetronkonsentrasjon og ΔΔQTcF. Ved å bruke det etablerte eksponering-respons-forholdet, hadde 24 mg infundert intravenøst over 15 minutter en gjennomsnittlig predikert (95 % øvre prediksjonsintervall) ΔΔQTcF på 14,0 (16,3) millisekunder. I motsetning til dette hadde 16 mg infundert intravenøst over 15 minutter ved bruk av samme modell en gjennomsnittlig predikert (95 % øvre prediksjonsintervall) ΔΔQTcF på 9,1 (11,2) millisekunder. I denne studien forlenget ikke 8 mg-dosen infundert over 15 minutter QT-intervallet i noen klinisk relevant grad.
Farmakokinetikk
Absorpsjon
Ondansetron absorberes fra mage-tarmkanalen og gjennomgår noe first-pass metabolisme. Gjennomsnittlig biotilgjengelighet hos friske personer, etter administrering av en enkelt 8 mg tablett, er omtrent 56 %.
Systemisk eksponering for ondansetron øker ikke proporsjonalt med dosen. Arealet under kurve (AUC) fra en 16 mg tablett var 24 % større enn forutsagt fra en 8 mg tablettdose. Dette kan gjenspeile en viss reduksjon av first-pass metabolisme ved høyere orale doser.
Mateffekter
Biotilgjengeligheten økes også litt av tilstedeværelsen av mat.
Fordeling
Plasmaproteinbinding av ondansetron målt in vitro var 70 % til 76 % over konsentrasjonsområdet 10 til 500 ng/ml. Sirkulerende stoff distribueres også til erytrocytter.
Eliminering
Metabolisme og utskillelse
Ondansetron metaboliseres i stor grad hos mennesker, med ca. 5 % av en radiomerket dose gjenvunnet som moderstoffet fra urinen. Metabolittene observeres i urinen. Den primære metabolske veien er hydroksylering på indolringen etterfulgt av påfølgende glukuronid- eller sulfatkonjugering.
In vitro metabolismestudier har vist at ondansetron er et substrat for humane hepatiske cytokrom P-450 enzymer, inkludert CYP1A2, CYP2D6 og CYP3A4. Når det gjelder total omsetning av ondansetron, spilte CYP3A4 den dominerende rollen. På grunn av mangfoldet av metabolske enzymer som er i stand til å metabolisere ondansetron, er det sannsynlig at hemming eller tap av ett enzym (f.eks. genetisk mangel på CYP2D6) vil bli kompensert av andre og kan resultere i liten endring i den totale hastigheten for eliminering av ondansetron.
Selv om noen ikke-konjugerte metabolitter har farmakologisk aktivitet, finnes disse ikke i plasma i konsentrasjoner som sannsynligvis vil bidra signifikant til den biologiske aktiviteten til ondansetron.
Spesifikke populasjoner
Alder: Geriatrisk populasjon
En reduksjon i clearance og økning i eliminasjonshalveringstid er sett hos pasienter eldre enn 75 år sammenlignet med yngre personer [se Bruk i spesifikke populasjoner ].
Kjønn
Kjønnsforskjeller ble vist i bruken av ondansetron gitt som en enkeltdose. Omfanget og absorpsjonshastigheten er større hos kvinner enn menn. Langsommere clearance hos kvinner, et mindre tilsynelatende distribusjonsvolum (justert for vekt) og høyere absolutt biotilgjengelighet resulterte i høyere plasmakonsentrasjoner av ondansetron. Disse høyere plasmakonsentrasjonene kan delvis forklares med forskjeller i kroppsvekt mellom menn og kvinner. Det er ikke kjent om disse kjønnsrelaterte forskjellene var klinisk viktige. Mer detaljert farmakokinetisk informasjon finnes i tabell 5 og 6.
Nedsatt nyrefunksjon
Nedsatt nyrefunksjon forventes ikke å påvirke den totale clearance av ondansetron signifikant ettersom nyreclearance utgjør bare 5 % av den totale clearance. Imidlertid ble gjennomsnittlig plasmaclearance av ondansetron redusert med ca. 50 % hos pasienter med alvorlig nedsatt nyrefunksjon (kreatininclearance mindre enn 30 ml/min). Reduksjonen i clearance var variabel og ikke forenlig med en økning i halveringstid [se Bruk i spesifikke populasjoner ].
Nedsatt leverfunksjon
Hos pasienter med lett til moderat nedsatt leverfunksjon, reduseres clearance 2 ganger og gjennomsnittlig halveringstid økes til 11,6 timer sammenlignet med 5,7 timer hos friske personer. Hos pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh-score på 10 eller høyere), reduseres clearance 2-3 ganger og det tilsynelatende distribusjonsvolumet økes med en resulterende økning i halveringstiden til 20 timer [se DOSERING OG ADMINISTRASJON , Bruk i spesifikke populasjoner ].
Legemiddelinteraksjonsstudier
CYP 3A4 indusere
Eliminering av ondansetron kan påvirkes av cytokrom P-450-induktorer. I en farmakokinetisk studie med 16 epileptiske pasienter som ble opprettholdt kronisk på CYP3A4-indusere, karbamazepin eller fenytoin, ble det observert en reduksjon i AUC, Cmax og t½ av ondansetron. Dette resulterte i en betydelig økning i clearance av ondansetron. Denne økningen antas imidlertid ikke å være klinisk relevant [se NARKOTIKAHANDEL ].
Kjemoterapeutiske midler
Karmustin, etoposid og cisplatin påvirker ikke farmakokinetikken til ondansetron [se NARKOTIKAHANDEL ].
Antacida
Samtidig administrering av antacida endrer ikke absorpsjonen av ondansetron.
Kliniske studier
Forebygging av kjemoterapi-indusert kvalme og oppkast
Svært emetogen kjemoterapi
2 randomiserte, dobbeltblinde monoterapistudier var en enkelt 24 mg oral dose av ZOFRAN overlegen en relevant historisk placebokontroll i forebygging av kvalme og oppkast assosiert med høyemetogen kreftkjemoterapi, inkludert cisplatin større enn eller lik 50 mg/m². Steroidadministrasjon ble ekskludert fra disse kliniske studiene. Mer enn 90 % av pasientene som fikk en cisplatindose større enn eller lik 50 mg/m² i den historiske placebo-komparatoren, opplevde oppkast i fravær av antiemetisk behandling.
Den første studien sammenlignet orale doser av ondansetron 24 mg som enkeltdose, 8 mg hver 8. time for 2 doser og 32 mg som enkeltdose hos 357 voksne kreftpasienter som fikk kjemoterapiregimer som inneholder cisplatin større enn eller lik 50 mg/m² . Den første eller enkeltdosen ble administrert 30 minutter før kjemoterapi. Totalt fullførte 66 % av pasientene i gruppen ondansetron 24 mg én gang daglig, 55 % i gruppen ondansetron 8 mg to ganger daglig og 55 % i gruppen ondansetron 32 mg én gang daglig. den 24-timers prøveperioden med 0 emetiske episoder og ingen rednings-antiemetiske medisiner, det primære endepunktet for effekt. Hver av de 3 behandlingsgruppene ble vist å være statistisk signifikant bedre enn en historisk placebokontroll.
den samme studien opplevde 56 % av pasientene som fikk en enkelt 24 mg oral dose ondansetron ingen kvalme i løpet av den 24-timers prøveperioden, sammenlignet med 36 % av pasientene i den orale ondansetron 8 mg gruppen to ganger daglig ( P = 0,001) og 50 % i den orale ondansetron 32 mg en gang daglig-gruppen. Doseringsregimer av ZOFRAN 8 mg to ganger daglig og 32 mg én gang daglig anbefales ikke for forebygging av kvalme og oppkast assosiert med sterkt emetogen kjemoterapi [se DOSERING OG ADMINISTRASJON ].
I en andre studie ble effekten av en enkelt 24 mg oral dose av ZOFRAN 4 mg for forebygging av kvalme og oppkast assosiert med sterkt emetogen kreftkjemoterapi, inkludert cisplatin større enn eller lik 50 mg/m², bekreftet.
Moderat emetogen kjemoterapi
En randomisert, placebokontrollert, dobbeltblind studie ble utført i USA med 67 pasienter som fikk et cyklofosfamidbasert kjemoterapiregime som inneholder doksorubicin. Den første dosen på 8 mg ZOFRAN 8 mg ble administrert 30 minutter før starten av kjemoterapi, med en påfølgende dose 8 timer etter den første dosen, etterfulgt av 8 mg ZOFRAN 8 mg to ganger daglig i 2 dager etter avsluttet kjemoterapi. var betydelig mer effektiv enn placebo for å forhindre oppkast. Behandlingsresponsen var basert på det totale antallet emetiske episoder over den 3-dagers prøveperioden. Resultatene av denne studien er oppsummert i tabell 7.
en dobbeltblind amerikansk studie med 336 pasienter som fikk et cyklofosfamidbasert kjemoterapiregime som inneholder enten metotreksat eller doksorubicin, var ZOFRAN 8 mg administrert to ganger daglig like effektivt som ZOFRAN 8 mg administrert 3 ganger daglig for å forhindre kvalme og oppkast. ZOFRAN 8 mg tre ganger daglig er ikke et anbefalt regime for behandling av moderat emetogen kjemoterapi [se DOSERING OG ADMINISTRASJON ].
Behandlingsresponsen var basert på det totale antallet emetiske episoder over den 3-dagers prøveperioden. Se tabell 8 for detaljer om doseringsregimene som ble studert og resultatene av denne studien.
Re-behandling
I enkeltarmsstudier ble 148 pasienter som fikk cyklofosfamidbasert kjemoterapi behandlet på nytt med ZOFRAN 8 mg tre ganger daglig under påfølgende kjemoterapi i totalt 396 re-behandlingskurer. Ingen emetiske episoder forekom i 314 (79 %) av de gjentatte behandlingsforløpene, og bare 1 til 2 oppkastepisoder forekom i 43 (11%) av de gjentatte behandlingsforløpene.
Pediatriske forsøk
Tre åpne, enarmede, ikke-amerikanske studier har blitt utført med 182 pediatriske pasienter i alderen 4 til 18 år med kreft som ble gitt en rekke cisplatin- eller noncisplatin-regimer. Startdosen av ZOFRAN 4 mg injeksjon varierte fra 0,04 til 0,87 mg per kg (total dose på 2,16 mg til 12 mg) etterfulgt av administrering av orale doser av ZOFRAN 4 mg varierende fra 4 til 24 mg daglig i 3 dager. I disse studiene hadde 58 % av de 170 evaluerbare pasientene en fullstendig respons (ingen emetiske episoder) på dag 1. I 2 studier var responsraten på ZOFRAN 4 mg tre ganger daglig hos pasienter yngre enn 12 år lik ZOFRAN 8 mg tre ganger daglig hos pasienter 12 til 18 år. Forebygging av emesis hos disse pediatriske pasientene var i hovedsak den samme som for voksne.
Strålingsindusert kvalme og oppkast
Total kroppsbestråling
en randomisert, placebokontrollert, dobbeltblind studie med 20 pasienter, var 8 mg ZOFRAN administrert 1,5 timer før hver fraksjon av strålebehandling i 4 dager signifikant mer effektivt enn placebo for å forhindre oppkast indusert av bestråling av hele kroppen. Total kroppsbestråling besto av 11 fraksjoner (120 cGy per fraksjon) over 4 dager for totalt 1320 cGy. Pasientene fikk 3 fraksjoner i 3 dager, deretter 2 fraksjoner på dag 4.
Enkel høydose fraksjon strålebehandling
en aktiv-kontrollert, dobbeltblind studie med 105 pasienter som fikk enkelt høydose strålebehandling (800 til 1000 cGy) over en fremre eller bakre feltstørrelse på større enn eller lik 80 cm² til abdomen, var ZOFRAN 4mg signifikant mer effektivt enn metoklopramid med hensyn til fullstendig kontroll av brekninger (0 emetiske episoder). Pasientene fikk den første dosen ZOFRAN (8 mg) eller metoklopramid (10 mg) 1 til 2 timer før strålebehandling. Hvis strålebehandling ble gitt om morgenen, ble 8 mg ZOFRAN 8 mg eller 10 mg metoklopramid administrert sent på ettermiddagen og gjentatt igjen før leggetid. Hvis strålebehandling ble gitt om ettermiddagen, tok pasientene 8 mg ZOFRAN 4 mg eller 10 mg metoklopramid kun én gang før leggetid. Pasientene fortsatte dosene med oral medisin tre ganger daglig i 3 dager.
Daglig fraksjonert strålebehandling
en aktiv-kontrollert, dobbeltblind studie med 135 pasienter som fikk en 1- til 4-ukers kur med fraksjonert strålebehandling (180 cGy-doser) over en feltstørrelse på større enn eller lik 100 cm² til abdomen, var ZOFRAN 4mg signifikant mer effektivt enn proklorperazin med hensyn til fullstendig kontroll av brekninger (0 emetiske episoder). Pasientene fikk den første dosen av ZOFRAN (8 mg) eller proklorperazin (10 mg) 1 til 2 timer før den første daglige strålebehandlingsfraksjonen, med påfølgende 8 mg doser omtrent hver 8. time på hver dag med strålebehandling.
Postoperativ kvalme og oppkast
2 placebokontrollerte, dobbeltblinde studier (den ene utført i USA og den andre utenfor USA) med 865 kvinner som gjennomgikk kirurgiske inngrep på sykehus, ble ZOFRAN 16 mg som enkeltdose eller placebo administrert en time før induksjon av generell balansert anestesi (barbiturat, opioid, lystgass, nevromuskulær blokade og supplerende isofluran eller enfluran), var ZOFRAN-tabletter signifikant mer effektive enn placebo for å forhindre postoperativ kvalme og oppkast.
Ingen forsøk har blitt utført på menn.
PASIENTINFORMASJON
QT-forlengelse
Informer pasienter om at ZOFRAN kan forårsake alvorlige hjertearytmier, slik som QT-forlengelse. Instruer pasienter om å fortelle helsepersonell med en gang hvis de opplever en endring i hjertefrekvensen, hvis de føler seg svimmel, eller hvis de har en synkopal episode [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhetsreaksjoner
Informer pasienter om at ZOFRAN 4mg kan forårsake overfølsomhetsreaksjoner, noen så alvorlige som anafylaksi og bronkospasme. Instruer pasienter om å umiddelbart rapportere alle tegn og symptomer på overfølsomhetsreaksjoner, inkludert feber, frysninger, utslett eller pusteproblemer til helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Maskering av progressiv ileus og gastrisk distensjon
Informer pasienter etter abdominal kirurgi eller de med kjemoterapi-indusert kvalme og oppkast at ZOFRAN 4mg kan maskere tegn og symptomer på tarmobstruksjon. Instruer pasienter til umiddelbart å rapportere alle tegn eller symptomer forenlig med en potensiell tarmobstruksjon til helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Narkotikahandel
- . Instruer pasienten om å rapportere bruken av alle medisiner, spesielt apomorfin, til helsepersonell. Samtidig bruk av apomorfin og ZOFRAN kan forårsake et betydelig blodtrykksfall og tap av bevissthet. . Informer pasienter om muligheten for serotonergt syndrom ved samtidig bruk av ZOFRAN 8mg og et annet serotonergt middel, slik som medisiner for å behandle depresjon og migrene. Råd pasientene til å søke øyeblikkelig legehjelp hvis følgende symptomer oppstår: endringer i mental status, autonom ustabilitet, nevromuskulære symptomer med eller uten gastrointestinale symptomer [se ADVARSLER OG FORHOLDSREGLER ].
Administrering av ZOFRAN 4mg ODT oralt desintegrerende tabletter
Instruer pasienter om ikke å fjerne ZOFRAN 4mg ODT oralt desintegrerende tabletter fra blisterpakningen før rett før dosering.
- . Ikke prøv å skyve ZOFRAN 8mg ODT oralt desintegrerende tabletter gjennom foliebaksiden. . Med tørre hender trekker du av foliebaksiden av 1 blisterpakning og fjerner forsiktig tabletten. . Plasser umiddelbart ZOFRAN ODT oralt desintegrerende tablett på toppen av tungen der den vil løse seg opp i løpet av sekunder, og svelg deretter med spytt. . Administrering med væske er ikke nødvendig. . Avrivbare illustrerte klistremerker er festet til produktkartongen som kan leveres med resepten for å sikre riktig bruk og håndtering av produktet.
