Leukeran 2mg, 5mg Chlorambucil Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Leukeran 5mg og hvordan brukes det?
Leukeran 5mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på kronisk lymfatisk (lymfocytisk) leukemi og Hodgkins lymfom. Leukeran 5mg kan brukes alene eller sammen med andre medisiner.
Leukeran 5mg tilhører en klasse legemidler som kalles Antineoplastics, Alkylating.
Det er ikke kjent om Leukeran er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Leukeran?
Leukeran kan forårsake alvorlige bivirkninger, inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . anfall, . uvanlig masse eller klump, . alvorlig oppkast eller diaré, . ny eller forverret hoste, . lett blåmerker, . uvanlig blødning (nese, munn, vagina eller endetarm), . lilla eller røde punktflekker under huden, . kvalme, . smerter i øvre mage, . kløe, . tretthet, . tap av Appetit, . mørk urin, . leirefarget avføring, . gulfarging av hud eller øyne (gulsott), . feber, . hovent tannkjøtt, . smertefulle munnsår, . smerte ved svelging, . hudsår, . forkjølelses- eller influensasymptomer, . hoste, . problemer med å puste, . sår hals, . hudsmerter, og . et rødt eller lilla hudutslett som sprer seg (spesielt i ansiktet eller overkroppen) og forårsaker blemmer og avskalling
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Leukeran inkluderer:
- . feber, . blødning, og . influensasymptomer
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Leukeran. Spør legen din eller apoteket for mer informasjon.
ADVARSEL
LEUKERAN (klorambucil) kan undertrykke beinmargsfunksjonen alvorlig. Klorambucil er et kreftfremkallende stoff hos mennesker. Klorambucil er sannsynligvis mutagent og teratogent hos mennesker. Klorambucil produserer menneskelig infertilitet (se ADVARSLER OG FORHOLDSREGLER ).
BESKRIVELSE
LEUKERAN (klorambucil) ble først syntetisert av Everett et al. Det er et bifunksjonelt alkyleringsmiddel av nitrogensennepstypen som har vist seg aktivt mot utvalgte humane neoplastiske sykdommer. Klorambucil er kjent kjemisk som 4-[bis(2-kloretyl)amino]benzenbutansyre og har følgende strukturformel:
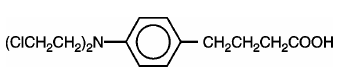
Klorambucil hydrolyserer i vann og har en pKa på 5,8.
LEUKERAN (klorambucil) er tilgjengelig i tablettform for oral administrering. Hver filmdrasjerte tablett inneholder 2 mg klorambucil og de inaktive ingrediensene kolloidalt silisiumdioksid, hypromellose, laktose (vannfri), makrogol/PEG 400, mikrokrystallinsk cellulose, rødt jernoksid, stearinsyre, titandioksid og gult jernoksid.
INDIKASJONER
LEUKERAN (klorambucil) er indisert for behandling av kronisk lymfatisk (lymfocytisk) leukemi, maligne lymfomer inkludert lymfosarkom, gigantisk follikulær lymfom og Hodgkins sykdom. Det er ikke helbredende for noen av disse lidelsene, men kan gi klinisk nyttig lindring.
DOSERING OG ADMINISTRASJON
Den vanlige orale dosen er 0,1 til 0,2 mg/kg kroppsvekt daglig i 3 til 6 uker etter behov. Dette utgjør vanligvis 4 til 10 mg per dag for gjennomsnittspasienten. Hele den daglige dosen kan gis på en gang. Disse dosene er for initiering av terapi eller for korte behandlingsforløp. Dosen må justeres nøye i henhold til pasientens respons og må reduseres så snart det er et brå fall i antall hvite blodlegemer. Pasienter med Hodgkins sykdom trenger vanligvis 0,2 mg/kg daglig, mens pasienter med andre lymfomer eller kronisk lymfatisk leukemi vanligvis bare trenger 0,1 mg/kg daglig. Når lymfatisk infiltrasjon av benmargen er tilstede, eller når benmargen er hypoplastisk, bør den daglige dosen ikke overstige 0,1 mg/kg (ca. 6 mg for gjennomsnittspasienten).
Alternative skjemaer for behandling av kronisk lymfatisk leukemi ved bruk av intermitterende, annenhver uke eller en gang månedlig pulsdose av klorambucil er rapportert. Intermitterende tidsplaner for klorambucil begynner med en initial enkeltdose på 0,4 mg/kg. Doser økes vanligvis med 0,1 mg/kg inntil kontroll av lymfocytose eller toksisitet er observert. Påfølgende doser modifiseres for å gi mild hematologisk toksisitet. Det antas at responsraten for kronisk lymfatisk leukemi på den annenhver uke eller en gang månedlig plan for administrering av klorambucil er lik eller bedre som den som tidligere er rapportert ved daglig administrering, og at hematologisk toksisitet var mindre enn eller lik den som ble funnet i studier med daglig klorambucil. .
Stråling og cellegift gjør benmargen mer sårbar for skade, og klorambucil bør brukes med spesiell forsiktighet innen 4 uker etter en full kur med strålebehandling eller kjemoterapi. Små doser av palliativ stråling over isolerte foci fjernt fra benmargen vil imidlertid vanligvis ikke redusere antallet nøytrofiler og blodplater. I disse tilfellene kan klorambucil gis i vanlig dosering.
Det er for tiden oppfattet at korte behandlingsforløp er tryggere enn kontinuerlig vedlikeholdsterapi, selv om begge metodene har vært effektive. Det må erkjennes at kontinuerlig terapi kan gi inntrykk av "vedlikehold" hos pasienter som faktisk er i remisjon og ikke har noe umiddelbar behov for ytterligere medikament. Hvis vedlikeholdsdosering brukes, bør den ikke overstige 0,1 mg/kg daglig og kan godt være så lav som 0,03 mg/kg daglig. En typisk vedlikeholdsdose er 2 mg til 4 mg daglig, eller mindre, avhengig av statusen til blodtellingene. Det kan derfor være ønskelig å seponere medikamentet etter at maksimal kontroll er oppnådd, siden intermitterende behandling gjenopptatt ved tilbakefall kan være like effektiv som kontinuerlig behandling.
Prosedyrer for riktig håndtering og avhending av kreftmedisiner bør brukes. Det er publisert flere retningslinjer om dette emnet.1-4 Det er ingen generell enighet om at alle prosedyrene som anbefales i retningslinjene er nødvendige eller hensiktsmessige.
Spesielle populasjoner
Nedsatt leverfunksjon
Pasienter med nedsatt leverfunksjon bør overvåkes nøye for toksisitet. Siden klorambucil primært metaboliseres i leveren, kan dosereduksjon vurderes hos pasienter med nedsatt leverfunksjon når de behandles med LEUKERAN. Det er imidlertid ikke tilstrekkelige data hos pasienter med nedsatt leverfunksjon til å gi en spesifikk doseringsanbefaling.
HVORDAN LEVERES
LEUKERAN leveres som brune, filmdrasjerte, runde, bikonvekse tabletter som inneholder 2 mg klorambucil i ravgule glassflasker med barnesikre lukkinger. Den ene siden er gravert med "GX EG3" og den andre siden er gravert med en "L."
Flaske med 25 ( NDC 76388-635-25)
Oppbevares i kjøleskap, 2° til 8°C (36° til 46°F).
REFERANSER
1. NIOSH-varsel: Forebygging av yrkesmessig eksponering for antineoplastiske og andre farlige legemidler i helsevesenet. 2004. US Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) publikasjon nr. 2004-165.
2. OSHA Technical Manual, TED 1-0.15A, Seksjon VI: Kapittel 2. Kontrollere yrkesmessig eksponering for farlige stoffer. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. American Society of Health-System Pharmacists. ASHP retningslinjer for håndtering av farlige legemidler. Am J Health-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., White, JM, & Kelleher, LO (red.) 2005. Chemotherapy and biotherapy guidelines and recommendations for practice (2nd. ed.) Pittsburgh, PA: Oncology Nursing Society.
Produsert av: Excella GmbH & Co. KG, Feucht, Tyskland. Revidert: mars 2017
BIVIRKNINGER
For å rapportere MISTENTLIGE BIVIRKNINGER, kontakt Aspen Global Inc. Toll-Free på 1-855-800-8165 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
Hematologisk
Den vanligste bivirkningen er benmargssuppresjon, anemi, leukopeni, nøytropeni, trombocytopeni eller pancytopeni. Selv om benmargssuppresjon ofte forekommer, er den vanligvis reversibel hvis klorambucil trekkes tilbake tidlig nok. Imidlertid er irreversibel benmargssvikt rapportert.
Gastrointestinale
Gastrointestinale forstyrrelser som kvalme og oppkast, diaré og munnsår forekommer sjelden.
CNS
Skjelving, muskelrykninger, myokloni, forvirring, agitasjon, ataksi, slappe pareser og hallusinasjoner er rapportert som sjeldne bivirkninger for klorambucil som går over ved seponering av legemidlet. Sjeldne, fokale og/eller generaliserte anfall er rapportert å forekomme hos både barn og voksne ved både terapeutiske daglige doser og pulserende regimer, og ved akutt overdose (se FORHOLDSREGLER : Generell ).
Dermatologisk
Allergiske reaksjoner som urticaria og angioneurotisk ødem er rapportert etter initial eller etterfølgende dosering. Hudoverfølsomhet (inkludert sjeldne rapporter om hudutslett som utvikler seg til erythema multiforme, toksisk epidermal nekrolyse og Stevens-Johnsons syndrom) er rapportert (se ADVARSLER ).
Diverse
Andre rapporterte bivirkninger inkluderer: lungefibrose, levertoksisitet og gulsott, medikamentfeber, perifer nevropati, interstitiell pneumoni, steril blærebetennelse, infertilitet, leukemi og sekundære maligniteter (se ADVARSLER ).

NARKOTIKAHANDEL
Det er ingen kjente legemiddel/legemiddelinteraksjoner med klorambucil.
ADVARSLER
På grunn av dets kreftfremkallende egenskaper, bør klorambucil ikke gis til pasienter med andre tilstander enn kronisk lymfatisk leukemi eller maligne lymfomer. Kramper, infertilitet, leukemi og sekundære maligniteter har blitt observert når klorambucil ble brukt i behandlingen av ondartede og ikke-maligne sykdommer.
Det er mange rapporter om akutt leukemi som oppstår hos pasienter med både ondartede og ikke-maligne sykdommer etter behandling med klorambucil. I mange tilfeller fikk disse pasientene også andre kjemoterapeutiske midler eller en eller annen form for strålebehandling. Kvantifisering av risikoen for klorambucil-induksjon av leukemi eller karsinom hos mennesker er ikke mulig. Evaluering av publiserte rapporter om utvikling av leukemi hos pasienter som har fått klorambucil (og andre alkylerende midler) antyder at risikoen for leukemogenese øker med både kronisk behandling og store kumulative doser. Det har imidlertid vist seg umulig å definere en kumulativ dose under hvilken det ikke er noen risiko for induksjon av sekundær malignitet. De potensielle fordelene ved behandling med klorambucil må veies på individuell basis mot den mulige risikoen for induksjon av en sekundær malignitet.
Klorambucil har vist seg å forårsake kromatid- eller kromosomskade hos mennesker. Både reversibel og permanent sterilitet er observert hos begge kjønn som har fått klorambucil.
En høy forekomst av sterilitet er dokumentert når klorambucil administreres til prepubertale og pubertale menn. Langvarig eller permanent azoospermi har også blitt observert hos voksne menn. Mens de fleste rapporter om gonadal dysfunksjon sekundært til klorambucil har relatert til menn, er induksjon av amenoré hos kvinner med alkyleringsmidler godt dokumentert og klorambucil er i stand til å produsere amenoré. Obduksjonsstudier av eggstokkene fra kvinner med ondartet lymfom behandlet med kombinasjonskjemoterapi inkludert klorambucil har vist varierende grad av fibrose, vaskulitt og uttømming av primordiale follikler.
Sjeldne tilfeller av hudutslett som utvikler seg til erythema multiforme, toksisk epidermal nekrolyse eller Stevens-Johnsons syndrom er rapportert. Klorambucil bør seponeres umiddelbart hos pasienter som utvikler hudreaksjoner.
Svangerskap
Graviditetskategori D
Klorambucil kan forårsake fosterskader når det administreres til en gravid kvinne. Unilateral renal agenesis er observert hos 2 avkom hvis mødre fikk klorambucil i løpet av første trimester. Urogenitale misdannelser, inkludert fravær av nyre, ble funnet hos fostre til rotter som fikk klorambucil. Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Hvis dette legemidlet brukes under graviditet, eller hvis pasienten blir gravid mens du tar dette legemidlet, bør pasienten informeres om den potensielle faren for fosteret. Kvinner i fertil alder bør rådes til å unngå å bli gravide.
FORHOLDSREGLER
Generell
Mange pasienter utvikler en sakte progressiv lymfopeni under behandlingen. Lymfocytttallet går vanligvis raskt tilbake til normale nivåer etter fullført medikamentell behandling. De fleste pasienter har noe nøytropeni etter den tredje behandlingsuken, og dette kan fortsette i opptil 10 dager etter siste dose. Deretter går nøytrofiltallet vanligvis raskt tilbake til det normale. Alvorlig nøytropeni ser ut til å være relatert til dosering og forekommer vanligvis bare hos pasienter som har fått en totaldose på 6,5 mg/kg eller mer i ett behandlingskur med kontinuerlig dosering. Omtrent en fjerdedel av alle pasienter som får den kontinuerlige doseplanen, og en tredjedel av de som får denne dosen i løpet av 8 uker eller mindre, kan forventes å utvikle alvorlig nøytropeni.
Selv om det ikke er nødvendig å seponere klorambucil ved første tegn på et fall i nøytrofiltall, må det huskes at fallet kan fortsette i 10 dager etter siste dose, og at når den totale dosen nærmer seg 6,5 mg/kg, er det en risiko for å forårsake irreversibel benmargsskade. Dosen av klorambucil bør reduseres hvis leukocytt- eller blodplateantallet faller under normale verdier og bør seponeres ved mer alvorlig depresjon.
Klorambucil bør ikke gis i fulle doser før 4 uker etter en full kur med strålebehandling eller kjemoterapi på grunn av benmargens sårbarhet for skade under disse tilstandene. Hvis leukocytt- eller blodplatetallet før behandling er redusert på grunn av benmargssykdomsprosessen før behandlingsstart, bør behandlingen settes i gang med redusert dose.
Vedvarende lavt antall nøytrofiler og blodplater eller perifer lymfocytose tyder på benmarginfiltrasjon. Hvis det bekreftes ved benmargsundersøkelse, bør den daglige dosen av klorambucil ikke overstige 0,1 mg/kg. Klorambucil ser ut til å være relativt fri for gastrointestinale bivirkninger eller andre bevis på toksisitet bortsett fra den benmargsdempende virkningen. Hos mennesker kan enkeltdoser på 20 mg eller mer gi kvalme og oppkast.
Barn med nefrotisk syndrom og pasienter som får høye pulsdoser av klorambucil kan ha økt risiko for anfall. Som med alle potensielt epileptogene legemidler, bør det utvises forsiktighet ved administrering av klorambucil til pasienter med tidligere anfallsforstyrrelser eller hodetraumer, eller som får andre potensielt epileptogene legemidler.
Administrering av levende vaksiner til immunkompromitterte pasienter bør unngås.
Laboratorietester
Pasienter må følges nøye for å unngå livstruende skade på benmargen under behandlingen. Ukentlig undersøkelse av blodet bør foretas for å bestemme hemoglobinnivåer, totalt og differensialt antall leukocytter og kvantitativt antall blodplater. I løpet av de første 3 til 6 ukene av behandlingen anbefales det også at tellinger av hvite blodlegemer gjøres 3 eller 4 dager etter hver av de ukentlige fullstendige blodtellingene. Galton et al har foreslått at det er nyttig for å følge pasienter å plotte blodtellingene på et diagram samtidig som kroppsvekt, temperatur, miltstørrelse osv. registreres. Det anses som farlig å la en pasient gå mer enn 2 uker uten hematologisk og klinisk undersøkelse under behandlingen.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Se ADVARSLER seksjon for informasjon om karsinogenese, mutagenese og svekkelse av fertilitet.
Svangerskap
Teratogene effekter
Graviditetskategori D
Se ADVARSLER seksjon.
Ammende mødre
Det er ikke kjent om dette legemidlet skilles ut i morsmelk. Fordi mange legemidler skilles ut i morsmelk og på grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn fra klorambucil, bør det tas en beslutning om å avbryte ammingen eller å avbryte medikamentet, tatt i betraktning stoffets betydning for moren.
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Kliniske studier av klorambucil inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Generelt bør dosevalg for en eldre pasient være forsiktig, vanligvis fra den lave enden av doseringsområdet, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling.
Bruk hos pasienter med nedsatt nyrefunksjon
Effekten av nedsatt nyrefunksjon på eliminering av klorambucil er ikke formelt studert. Renal eliminering av uendret klorambucil og dets viktigste aktive metabolitter, fenyleddiksyresennep, utgjør mindre enn 1 % av den administrerte dosen. I tillegg var det ikke nødvendig med dosejustering hos 2 dialysepasienter på klorambucil. Derfor forventes ikke nedsatt nyrefunksjon å påvirke eliminasjonen av klorambucil signifikant.
Bruk hos pasienter med nedsatt leverfunksjon
Ingen formelle studier er utført på pasienter med nedsatt leverfunksjon. Siden klorambucil primært metaboliseres i leveren, bør pasienter med nedsatt leverfunksjon overvåkes nøye for toksisitet, og dosereduksjon kan vurderes hos pasienter med nedsatt leverfunksjon når de behandles med LEUKERAN (se DOSERING OG ADMINISTRASJON ).
OVERDOSE
Reversibel pancytopeni var hovedfunnet ved utilsiktede overdoser av klorambucil. Nevrologisk toksisitet som strekker seg fra agitert atferd og ataksi til flere grand mal-anfall har også forekommet. Siden det ikke er noen kjent motgift, bør blodbildet overvåkes nøye og generelle støttetiltak bør settes i gang, sammen med passende blodtransfusjoner, om nødvendig. Klorambucil er ikke dialyserbart.
Orale LD50 enkeltdoser til mus er 123 mg/kg. Hos rotter gir en enkelt intraperitoneal dose på 12,5 mg/kg klorambucil typiske nitrogen-sennepeffekter; disse inkluderer atrofi av tarmslimhinnen og lymfoide vev, alvorlig lymfopeni som blir maksimal på 4 dager, anemi og trombocytopeni. Etter denne dosen begynner dyrene å komme seg i løpet av 3 dager og ser normale ut etter ca. en uke, selv om benmargen kanskje ikke blir helt normal før ca. 3 uker. En intraperitoneal dose på 18,5 mg/kg dreper ca. 50 % av rottene med utvikling av kramper. Så mye som 50 mg/kg er gitt oralt til rotter som enkeltdose, med restitusjon. En slik dose forårsaker bradykardi, overdreven salivasjon, hematuri, kramper og respiratorisk dysfunksjon.
KONTRAINDIKASJONER
Klorambucil bør ikke brukes til pasienter hvis sykdom har vist tidligere resistens mot midlet. Pasienter som har vist overfølsomhet overfor klorambucil bør ikke gis legemidlet. Det kan være kryssoverfølsomhet (hudutslett) mellom klorambucil og andre alkyleringsmidler.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Klorambucil, et aromatisk nitrogensennepsderivat, er et alkyleringsmiddel. Klorambucil forstyrrer DNA-replikasjon og induserer cellulær apoptose via akkumulering av cytosolisk p53 og påfølgende aktivering av Bax, en apoptosepromoter.
Farmakokinetikk
en studie av 12 pasienter som fikk orale enkeltdoser på 0,2 mg/kg LEUKERAN 5 mg, var gjennomsnittlig dosejustert (±SD) plasmaklorambucil Cmax 492 ± 160 ng/ml, AUC var 883 ± 329 ng.t/mL , gjennomsnittlig eliminasjonshalveringstid (t½) var 1,3 ± 0,5 timer, og Tmax var 0,83 ± 0,53 timer. For hovedmetabolitten, fenyleddiksyresennep (PAAM), var gjennomsnittlig dosejustert (± SD) plasma Cmax 306 ± 73 ng/mL, AUC var 1204 ± 285 ng.t/mL, gjennomsnittlig t½ var 1,8 ± 0,4 timer og Tmax var 1,9 ± 0,7 timer.
Etter orale enkeltdoser på 0,6 til 1,2 mg/kg, nås maksimale plasmanivåer av klorambucil (Cmax) innen 1 time, og den terminale eliminasjonshalveringstiden (t ) av moderlegemidlet er estimert til 1,5 timer.
Absorpsjon
Klorambucil absorberes raskt og fullstendig (>70 %) fra mage-tarmkanalen. I samsvar med den raske, forutsigbare absorpsjonen av klorambucil, har den interindividuelle variasjonen i plasmafarmakokinetikken til klorambucil vist seg å være relativt liten etter orale doser på mellom 15 og 70 mg (2 ganger intrapasient variasjon, og en 2 til 4 ganger) interpasient variasjon i AUC). Absorpsjonen av klorambucil reduseres når det tas etter mat. I en studie med ti pasienter økte matinntak median Tmax med 2 ganger og reduserte de dosejusterte Cmax- og AUC-verdiene med henholdsvis 55 % og 20 %.
Fordeling
Det tilsynelatende distribusjonsvolumet var i gjennomsnitt 0,31 l/kg etter en enkelt 0,2 mg/kg oral dose klorambucil hos 11 kreftpasienter med kronisk lymfatisk leukemi.
Klorambucil og dets metabolitter er i stor grad bundet til plasma- og vevsproteiner. In vitro er klorambucil 99 % bundet til plasmaproteiner, spesielt albumin. Cerebrospinalvæskenivåer av klorambucil er ikke bestemt.
Metabolisme
Klorambucil metaboliseres i stor grad i leveren primært til fenyleddiksyresennep, som har antineoplastisk aktivitet. Klorambucil og dets hovedmetabolitt gjennomgår oksidativ nedbrytning til monohydroksy- og dihydroksyderivater.
Utskillelse
Etter en enkelt dose radiomerket klorambucil (14C), vises ca. 20 % til 60 % av radioaktiviteten i urinen etter 24 timer. Igjen er mindre enn 1 % av urinradioaktiviteten i form av klorambucil eller fenyleddiksyresennep.
PASIENTINFORMASJON
Pasienter bør informeres om at de viktigste toksisitetene til klorambucil er relatert til overfølsomhet, legemiddelfeber, myelosuppresjon, levertoksisitet, infertilitet, anfall, gastrointestinal toksisitet og sekundære maligniteter. Pasienter bør aldri få lov til å ta stoffet uten medisinsk tilsyn og bør konsultere legen sin hvis de opplever hudutslett, blødninger, feber, gulsott, vedvarende hoste, anfall, kvalme, oppkast, amenoré eller uvanlige klumper/masser. Kvinner i fertil alder bør rådes til å unngå å bli gravide.
