Mobic 7.5mg, 15mg Meloxicam Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Mobic 15mg og hvordan brukes det?
Mobic 7.5mg er et reseptbelagt ikke-steroid antiinflammatorisk legemiddel som brukes til å behandle symptomene på slitasjegikt, revmatoid artritt og moderate til sterke smerter. Mobic 7,5 mg kan brukes alene eller sammen med andre medisiner.
Mobic er et ikke-steroidt antiinflammatorisk legemiddel (NSAID).
Det er ikke kjent om Mobic er trygt og effektivt for barn som veier mindre enn 132 lbs (60 kg).
Hva er de mulige bivirkningene av Mobic 7,5 mg?
- . noen form for hudutslett, . kortpustethet, . opphovning, . rask vektøkning, . blodig eller tjæreaktig avføring, . hoste opp blod eller oppkast som ser ut som kaffegrut, . kvalme, . smerter i øvre del av magen, . kløe, . føler meg sliten, . influensalignende symptomer, . tap av Appetit, . mørk urin, . leirefarget avføring, . gulfarging av øyne eller hud (gulsott), . blek hud, . tretthet, . svimmelhet, . kalde hender eller føtter, . lite eller ingen vannlating, og . hevelse i føttene eller anklene
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Mobic 15mg inkluderer:
- . magesmerter, . kvalme, . oppkast, . halsbrann, . diaré, . forstoppelse, . gass, . svimmelhet, og . forkjølelses- eller influensasymptomer
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Mobic. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
RISIKO FOR ALVORLIG HJERTE- OG GASTROINTESTINALE HENDELSER
Kardiovaskulære trombotiske hendelser
- . Ikke-steroide antiinflammatoriske legemidler (NSAIDs) forårsaker økt risiko for alvorlige kardiovaskulære trombotiske hendelser, inkludert hjerteinfarkt og hjerneslag, som kan være dødelige. Denne risikoen kan oppstå tidlig i behandlingen og kan øke med varigheten av bruken [se ADVARSLER OG FORHOLDSREGLER]. . MOBIC 7,5 mg er kontraindisert i forbindelse med koronar bypassoperasjon (CABG) [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER].
Gastrointestinal blødning, sårdannelse og perforering
- . NSAIDs forårsaker økt risiko for alvorlige gastrointestinale (GI) bivirkninger, inkludert blødning, sårdannelse og perforering av mage eller tarm, som kan være dødelig. Disse hendelsene kan oppstå når som helst under bruk og uten varselsymptomer. Eldre pasienter og pasienter med tidligere magesårsykdom og/eller GI-blødninger har større risiko for alvorlige GI-hendelser [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
MOBIC (meloksikam) er et ikke-steroid antiinflammatorisk legemiddel (NSAID). Hver pastellgul MOBIC 15 mg tablett inneholder 7,5 mg eller 15 mg meloksikam for oral administrering. Meloksikam er kjemisk betegnet som 4-hydroksy-2-metyl-N-(5metyl2tiazolyl)-2H-1,2-benzotiazin-3-karboksamid-1,1-dioksid. Molekylvekten er 351,4. Dens empiriske formel er C14H13N3O4S2 og den har følgende strukturformel:
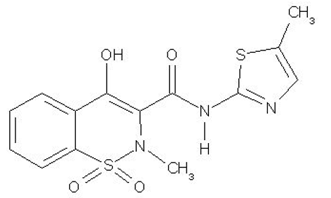
Meloksikam er et pastellgult fast stoff, praktisk talt uløselig i vann, med høyere løselighet observert i sterke syrer og baser. Det er svært lite løselig i metanol. Meloksikam har en tilsynelatende fordelingskoeffisient (log P)app = 0,1 i n-oktanol/buffer pH 7,4. Meloksikam har pKa-verdier på 1,1 og 4,2.
MOBIC 15mg er tilgjengelig som en tablett for oral administrering som inneholder 7,5 mg eller 15 mg meloksikam.
De inaktive ingrediensene i MOBIC 15 mg tabletter inkluderer kolloidalt silisiumdioksid, krospovidon, laktosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose, povidon og natriumsitratdihydrat.
INDIKASJONER
Artrose (OA)
MOBIC er indisert for lindring av tegn og symptomer på slitasjegikt [se Kliniske studier
Revmatoid artritt (RA)
MOBIC er indisert for lindring av tegn og symptomer på revmatoid artritt [se Kliniske studier ].
Juvenil Revmatoid Artritt (JRA) Pauciartikulær og polyartikulær kurs
MOBIC 7,5 mg er indisert for lindring av tegn og symptomer på pauciartikulært eller polyartikulært forløp Juvenil Revmatoid Artritt hos pasienter som veier ≥60 kg [se DOSERING OG ADMINISTRASJON og Kliniske studier ].
DOSERING OG ADMINISTRASJON
Generelle doseringsinstruksjoner
Vurder nøye de potensielle fordelene og risikoene ved MOBIC og andre behandlingsalternativer før du bestemmer deg for å bruke MOBIC. Bruk den laveste effektive dosen for den korteste varigheten i samsvar med individuelle pasientbehandlingsmål [se ADVARSLER OG FORHOLDSREGLER ].
Etter å ha observert responsen på innledende behandling med MOBIC, juster dosen for å passe den individuelle pasientens behov.
Hos voksne er maksimal anbefalt daglig oral dose av MOBIC 15 mg uavhengig av formulering. Hos pasienter med hemodialyse anbefales en maksimal daglig dose på 7,5 mg [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI
MOBIC kan tas uten hensyn til tidspunkt for måltider.
Artrose
For å lindre tegn og symptomer på slitasjegikt er den anbefalte orale start- og vedlikeholdsdosen MOBIC 7,5 mg én gang daglig. Noen pasienter kan få ekstra fordel ved å øke dosen til 15 mg én gang daglig.
Leddgikt
For å lindre tegn og symptomer på revmatoid artritt er den anbefalte orale start- og vedlikeholdsdosen MOBIC 7,5 mg 7,5 mg én gang daglig. Noen pasienter kan få ekstra fordel ved å øke dosen til 15 mg én gang daglig.
Juvenil Revmatoid Artritt (JRA) Pauciartikulær og polyartikulær kurs
For behandling av juvenil revmatoid artritt er den anbefalte orale dosen MOBIC 7,5 mg 7,5 mg én gang daglig hos barn som veier ≥60 kg. Det ble ikke vist noen ytterligere fordel ved å øke dosen over 7,5 mg i kliniske studier.
MOBIC tabletter skal ikke brukes til barn som veier
Nedsatt nyrefunksjon
Bruk av MOBIC 15 mg hos personer med alvorlig nedsatt nyrefunksjon anbefales ikke.
Hos pasienter på hemodialyse er maksimal dose av MOBIC 7,5 mg per dag [se KLINISK FARMAKOLOGI ].
Ikke-utskiftbarhet med andre formuleringer av meloksikam
MOBIC-tabletter har ikke vist tilsvarende systemisk eksponering for andre godkjente formuleringer av oral meloksikam. Derfor kan ikke MOBIC 7,5 mg tabletter byttes ut med andre formuleringer av oralt meloksikamprodukt selv om den totale milligramstyrken er den samme. Ikke erstatt tilsvarende dosestyrker av MOBIC 7,5 mg tabletter med andre formuleringer av oralt meloksikamprodukt.
HVORDAN LEVERES
Doseringsformer og styrker
MOBIC (meloksikam) tabletter:
- . 7,5 mg: pastellgul, rund, bikonveks, ubelagt tablett som inneholder meloksikam 7,5 mg. Imponert over Boehringer Ingelheim-logoen på den ene siden og bokstaven "M" på den andre. . 15 mg: pastellgul, avlang, bikonveks, ubelagt tablett som inneholder meloksikam 15 mg. Imponert med nettbrettkoden "15" på den ene siden og bokstaven "M" på den andre.
Oppbevaring og håndtering
MOBISK er tilgjengelig som en pastellgul, rund, bikonveks, ubestrøket tablett som inneholder meloksikam 7,5 mg eller som en pastellgul, avlang, bikonveks, ubelagt tablett som inneholder meloksikam 15 mg. 7,5 mg tabletten er preget med Boehringer Ingelheim-logoen på den ene siden, og på den andre siden, bokstaven "M". Tabletten på 15 mg er merket med tablettkoden "15" på den ene siden og bokstaven "M" på den andre.
MOBIC (meloksikam) tabletter 7,5 mg: NDC 0597-0029-01; 100 flasker
MOBIC (meloksikam) tabletter 15 mg: NDC 0597-0030-01; 100 flasker
Oppbevaring
Oppbevares ved 20°C til 25°C (68°F til 77°F); utflukter tillatt til 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ]. Oppbevar MOBIC-tabletter på et tørt sted.
Dispenser tabletter i en tett beholder.
Oppbevar dette og alle medisiner utilgjengelig for barn.
Distribuert av: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Revidert: april 2021
BIVIRKNINGER
Følgende bivirkninger er omtalt mer detaljert i andre deler av merkingen:
- . Kardiovaskulære trombotiske hendelser [se ADVARSEL i boks og ADVARSLER OG FORHOLDSREGLER ] . GI-blødning, sårdannelse og perforering [se ADVARSEL i boks og ADVARSLER OG FORHOLDSREGLER ] . Levertoksisitet [se ADVARSLER OG FORHOLDSREGLER ] . Hypertensjon [se ADVARSLER OG FORHOLDSREGLER ] . Hjertesvikt og ødem [se ADVARSLER OG FORHOLDSREGLER ] . Nyretoksisitet og hyperkalemi [se ADVARSLER OG FORHOLDSREGLER ] . Anafylaktiske reaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Alvorlige hudreaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) [se ADVARSLER OG FORHOLDSREGLER ] . Fostertoksisitet [se ADVARSLER OG FORHOLDSREGLER ] . Hematologisk toksisitet [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Voksne
Artrose og revmatoid artritt
MOBIC fase 2/3 kliniske studiedatabase inkluderer 10 122 OA-pasienter og 1012 RA-pasienter behandlet med MOBIC 7,5 mg/dag, 3505 OA-pasienter og 1351 RA-pasienter behandlet med MOBIC 15 mg/dag. MOBIC i disse dosene ble administrert til 661 pasienter i minst 6 måneder og til 312 pasienter i minst ett år. Omtrent 10 500 av disse pasientene ble behandlet i ti placebo- og/eller aktiv-kontrollerte slitasjegiktstudier og 2363 av disse pasientene ble behandlet i ti placebo- og/eller aktiv-kontrollerte revmatoid artritt-studier. Gastrointestinale (GI) bivirkninger var de hyppigst rapporterte bivirkningene i alle behandlingsgrupper på tvers av MOBIC 15 mg-studier.
En 12-ukers multisenter, dobbeltblind, randomisert studie ble utført med pasienter med slitasjegikt i kne eller hofte for å sammenligne effekten og sikkerheten til MOBIC 7,5 mg med placebo og med en aktiv kontroll. To 12-ukers multisenter, dobbeltblinde, randomiserte studier ble utført på pasienter med revmatoid artritt for å sammenligne effekten og sikkerheten til MOBIC med placebo.
Tabell 1a viser uønskede hendelser som oppstod i ≥2 % av MOBIC-behandlingsgruppene i en 12-ukers placebo- og aktivkontrollert artrosestudie.
Tabell 1b viser uønskede hendelser som oppstod i ≥2 % av MOBIC 7,5 mg-behandlingsgruppene i to 12-ukers placebokontrollerte revmatoid artritt-studier.
Bivirkningene som oppstod med MOBIC 15 mg hos ≥2 % av pasientene som ble behandlet kortvarig (4 til 6 uker) og langsiktig (6 måneder) i aktiv-kontrollerte slitasjegiktstudier er presentert i tabell 2.
Høyere doser MOBIC (22,5 mg og mer) har vært assosiert med økt risiko for alvorlige GI-hendelser; derfor bør den daglige dosen av MOBIC 15 mg ikke overstige 15 mg.
Pediatri
Pauciarticular og polyarticular Course Juvenil Reumatoid Arthritis (JRA)
Tre hundre og åttisju pasienter med pauciartikulært og polyartikulært forløp JRA ble eksponert for MOBIC 15 mg med doser fra 0,125 til 0,375 mg/kg per dag i tre kliniske studier. Disse studiene besto av to 12-ukers multisenter, dobbeltblinde, randomiserte studier (en med en 12-ukers åpen forlengelse og en med en 40-ukers forlengelse) og en 1-årig åpen PK-studie. Bivirkningene som ble observert i disse pediatriske studiene med MOBIC 15 mg, var av samme natur som erfaringene fra kliniske studier for voksne, selv om det var forskjeller i frekvens. Spesielt de følgende vanligste bivirkningene, magesmerter, oppkast, diaré, hodepine og pyreksi, var mer vanlige hos pediatriske enn i voksenstudiene. Utslett ble rapportert hos syv (
Følgende er en liste over bivirkninger som forekommer hos
Kroppen som helhet: allergisk reaksjon, ansiktsødem, tretthet, feber, hetetokter, ubehag, synkope, vektreduksjon, vektøkning
Kardiovaskulær: angina pectoris, hjertesvikt, hypertensjon, hypotensjon, hjerteinfarkt, vaskulitt
Sentral- og perifert nervesystem: kramper, parestesi, skjelving, svimmelhet
Gastrointestinale : kolitt, munntørrhet, sår på tolvfingertarmen, eruktasjon, øsofagitt, magesår, gastritt, gastroøsofageal refluks, gastrointestinal blødning, hematemese, hemorragisk sår på tolvfingertarmen, hemorragisk magesår, intestinal perforert, duatitis perforert, perforert bukspyttkjertel, perforert bukspyttkjertel, perforert bukspyttkjertel ulcerøs
Hjertefrekvens og rytme: arytmi, hjertebank, takykardi
Hematologisk: leukopeni, purpura, trombocytopeni
Lever og gallesystem: ALAT økt, AST økt, bilirubinemi, GGT økt, hepatitt
Metabolsk og ernæringsmessig : dehydrering
Psykiatrisk : unormal drømming, angst, økt appetitt, forvirring, depresjon, nervøsitet, somnolens
Luftveiene : astma, bronkospasme, dyspné
Hud og vedheng: alopecia, angioødem, bulløst utbrudd, lysfølsomhetsreaksjon, kløe, økt svette, urticaria
Spesielle sanser: unormalt syn, konjunktivitt, smaksperversjon, tinnitus
Urinsystemet: albuminuri, BUN økt, kreatinin økt, hematuri, nyresvikt
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av MOBIC etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering. Beslutninger om hvorvidt en uønsket hendelse fra spontane rapporter skal inkluderes i merkingen er vanligvis basert på en eller flere av følgende faktorer: (1) alvorligheten av hendelsen, (2) antall rapporter eller (3) styrken av årsakssammenhengen til legemiddel. Bivirkninger rapportert i verdensomspennende erfaring etter markedsføring eller litteratur inkluderer: akutt urinretensjon; agranulocytose; endringer i humør (som humørsvingninger); anafylaktoide reaksjoner inkludert sjokk; erythema multiforme; eksfoliativ dermatitt; interstitiell nefritt; gulsott; leversvikt; Stevens Johnson syndrom; giftig epidermal nekrolyse, og infertilitet kvinnelige.
NARKOTIKAHANDEL
Se tabell 3 for klinisk signifikante legemiddelinteraksjoner med meloksikam. Se også ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI .
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Kardiovaskulære trombotiske hendelser
Kliniske studier av flere COX-2 selektive og ikke-selektive NSAIDs av opptil tre års varighet har vist økt risiko for alvorlige kardiovaskulære (CV) trombotiske hendelser, inkludert hjerteinfarkt (MI) og hjerneslag, som kan være dødelige. Basert på tilgjengelige data er det uklart at risikoen for CV-trombotiske hendelser er lik for alle NSAIDs. Den relative økningen i alvorlige CV-trombotiske hendelser over baseline forårsaket av NSAID-bruk ser ut til å være lik hos de med og uten kjent CV-sykdom eller risikofaktorer for CV-sykdom. Pasienter med kjent CV-sykdom eller risikofaktorer hadde imidlertid en høyere absolutt forekomst av overskytende alvorlige CV-trombotiske hendelser, på grunn av økt baselinerate. Noen observasjonsstudier fant at denne økte risikoen for alvorlige CV-trombotiske hendelser begynte så tidlig som de første ukene av behandlingen. Økningen i CV-trombotisk risiko har blitt observert mest konsekvent ved høyere doser.
For å minimere den potensielle risikoen for en uønsket CV-hendelse hos NSAID-behandlede pasienter, bruk den laveste effektive dosen for kortest mulig varighet. Leger og pasienter bør være på vakt for utviklingen av slike hendelser, gjennom hele behandlingsforløpet, selv i fravær av tidligere CV-symptomer. Pasienter bør informeres om symptomene på alvorlige CV-hendelser og trinnene de skal ta hvis de oppstår.
Det er ingen konsistente bevis for at samtidig bruk av aspirin reduserer den økte risikoen for alvorlige CV-trombotiske hendelser forbundet med NSAID-bruk. Samtidig bruk av aspirin og et NSAID, som meloksikam, øker risikoen for alvorlige gastrointestinale (GI) hendelser [se ADVARSLER OG FORHOLDSREGLER ].
Status etter koronar bypass graft (CABG) kirurgi
To store, kontrollerte kliniske studier av et COX-2 selektivt NSAID for behandling av smerte i de første 10-14 dagene etter CABG-operasjon fant økt forekomst av hjerteinfarkt og hjerneslag. NSAIDs er kontraindisert ved CABG [se KONTRAINDIKASJONER ].
Pasienter etter MI
Observasjonsstudier utført i det danske folkeregisteret har vist at pasienter behandlet med NSAIDs i post-MI-perioden hadde økt risiko for reinfarkt, CV-relatert død og dødelighet av alle årsaker fra den første uken av behandlingen. I denne samme kohorten var forekomsten av død det første året etter MI 20 per 100 personår hos NSAID-behandlede pasienter sammenlignet med 12 per 100 personår hos ikke-NSAID-eksponerte pasienter. Selv om den absolutte dødsraten falt noe etter det første året etter MI, vedvarte den økte relative risikoen for død hos NSAID-brukere over minst de neste fire årene med oppfølging.
Unngå bruk av MOBIC 15mg hos pasienter med nylig hjerteinfarkt med mindre fordelene forventes å oppveie risikoen for tilbakevendende CV-trombotiske hendelser. Hvis MOBIC 15 mg brukes til pasienter med nylig MI, overvåk pasientene for tegn på hjerteiskemi.
Gastrointestinal blødning, sårdannelse og perforering
NSAIDs, inkludert meloksikam, kan forårsake alvorlige gastrointestinale (GI) bivirkninger, inkludert betennelse, blødning, sårdannelse og perforering av spiserøret, magen, tynntarmen eller tykktarmen, som kan være dødelig. Disse alvorlige bivirkningene kan oppstå når som helst, med eller uten varselsymptomer, hos pasienter behandlet med NSAIDs. Bare én av fem pasienter som utvikler en alvorlig øvre GI-bivirkning under NSAID-behandling er symptomatisk. Øvre GI-sår, grov blødning eller perforasjon forårsaket av NSAIDs forekom hos omtrent 1 % av pasientene behandlet i 3-6 måneder, og hos omtrent 2 % til 4 % av pasientene behandlet i ett år. Men selv kortvarig NSAID-behandling er ikke uten risiko.
Risikofaktorer for GI-blødning, sårdannelse og perforering
Pasienter med tidligere magesårsykdom og/eller GI-blødninger som brukte NSAIDs hadde en mer enn 10 ganger økt risiko for å utvikle GI-blødning sammenlignet med pasienter uten disse risikofaktorene. Andre faktorer som øker risikoen for GI-blødning hos pasienter behandlet med NSAIDs inkluderer lengre varighet av NSAID-behandling; samtidig bruk av orale kortikosteroider, aspirin, antikoagulantia eller selektive serotoninreopptakshemmere (SSRI); røyking; bruk av alkohol; eldre alder; og dårlig generell helsetilstand. De fleste postmarketingrapporter om fatale GI-hendelser skjedde hos eldre eller svekkede pasienter. I tillegg har pasienter med avansert leversykdom og/eller koagulopati økt risiko for GI-blødning.
Strategier for å minimere GI-risikoen hos NSAID-behandlede pasienter
- . Bruk den laveste effektive dosen for kortest mulig varighet. . Unngå administrering av mer enn ett NSAID om gangen. . Unngå bruk hos pasienter med høyere risiko med mindre fordelene forventes å oppveie den økte risikoen for blødning. For slike pasienter, så vel som de med aktiv GI-blødning, bør du vurdere alternative behandlinger andre enn NSAIDs. . Vær på vakt for tegn og symptomer på magesår og blødninger under NSAID-behandling. . Hvis det er mistanke om en alvorlig GI-bivirkning, initier umiddelbart evaluering og behandling, og seponer MOBIC 15mg inntil en alvorlig GI-bivirkning er utelukket. . Ved samtidig bruk av lavdose acetylsalisylsyre for hjerteprofylakse, overvåk pasienter tettere for tegn på GI-blødning [se NARKOTIKAHANDEL ].
Hepatotoksisitet
Forhøyelser av ALAT eller ASAT (tre eller flere ganger øvre normalgrense [ULN]) er rapportert hos omtrent 1 % av NSAID-behandlede pasienter i kliniske studier. I tillegg er det rapportert sjeldne, noen ganger dødelige, tilfeller av alvorlig leverskade, inkludert fulminant hepatitt, levernekrose og leversvikt.
Forhøyelser av ALAT eller ASAT (mindre enn tre ganger ULN) kan forekomme hos opptil 15 % av pasientene som behandles med NSAIDs inkludert meloksikam.
Informer pasienter om varseltegn og symptomer på levertoksisitet (f.eks. kvalme, tretthet, sløvhet, diaré, kløe, gulsott, ømhet i øvre øvre kvadrant og "influensalignende" symptomer). Hvis kliniske tegn og symptomer forenlig med leversykdom utvikles, eller hvis systemiske manifestasjoner oppstår (f.eks. eosinofili, utslett, etc.), avbryt MOBIC umiddelbart og utfør en klinisk evaluering av pasienten [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
Hypertensjon
NSAIDs, inkludert MOBIC, kan føre til ny oppstart eller forverring av eksisterende hypertensjon, som begge kan bidra til økt forekomst av CV-hendelser. Pasienter som tar angiotensin-konverterende enzym (ACE)-hemmere, tiaziddiuretika eller loop-diuretika kan ha nedsatt respons på disse behandlingene når de tar NSAIDs [se NARKOTIKAHANDEL ].
Overvåk blodtrykket (BP) under oppstart av NSAID-behandling og gjennom hele behandlingen.
Hjertesvikt og ødem
Coxib and traditional NSAID Trialists' Collaboration meta-analyse av randomiserte kontrollerte studier viste en omtrent to ganger økning i sykehusinnleggelser for hjertesvikt hos COX-2 selektivt behandlede pasienter og ikke-selektive NSAID-behandlede pasienter sammenlignet med placebo-behandlede pasienter. I en dansk nasjonal registerstudie av pasienter med hjertesvikt økte NSAID-bruk risikoen for MI, sykehusinnleggelse for hjertesvikt og død.
I tillegg har væskeretensjon og ødem blitt observert hos noen pasienter behandlet med NSAIDs. Bruk av meloksikam kan dempe CV-effektene til flere terapeutiske midler som brukes til å behandle disse medisinske tilstandene (f.eks. diuretika, ACE-hemmere eller angiotensinreseptorblokkere [ARB]) [se NARKOTIKAHANDEL ].
Unngå bruk av MOBIC 15mg hos pasienter med alvorlig hjertesvikt med mindre fordelene forventes å oppveie risikoen for forverret hjertesvikt. Hvis MOBIC brukes til pasienter med alvorlig hjertesvikt, overvåk pasientene for tegn på forverret hjertesvikt.
Nyretoksisitet og hyperkalemi
Nyretoksisitet
Langvarig administrering av NSAIDs, inkludert MOBIC, har resultert i nyrepapillær nekrose, nyresvikt, akutt nyresvikt og annen nyreskade.
Nyretoksisitet er også sett hos pasienter hvor nyreprostaglandiner har en kompenserende rolle i vedlikehold av nyreperfusjon. Hos disse pasientene kan administrering av et NSAID forårsake en doseavhengig reduksjon i prostaglandindannelse og, sekundært, i nyreblodstrømmen, noe som kan utløse åpenbar nyredekompensasjon. Pasienter med størst risiko for denne reaksjonen er de med nedsatt nyrefunksjon, dehydrering, hypovolemi, hjertesvikt, leverdysfunksjon, de som tar diuretika og ACE-hemmere eller ARB, og eldre. Seponering av NSAID-behandling etterfølges vanligvis av gjenoppretting til forbehandlingstilstand.
Nyreeffektene av MOBIC kan fremskynde progresjonen av nyredysfunksjon hos pasienter med eksisterende nyresykdom. Fordi noen MOBIC-metabolitter skilles ut av nyrene, overvåk pasienter for tegn på forverret nyrefunksjon.
Korriger volumstatus hos dehydrerte eller hypovolemiske pasienter før oppstart av MOBIC. Overvåk nyrefunksjonen hos pasienter med nedsatt nyre- eller leverfunksjon, hjertesvikt, dehydrering eller hypovolemi under bruk av MOBIC [se NARKOTIKAHANDEL ].
Ingen informasjon er tilgjengelig fra kontrollerte kliniske studier angående bruk av MOBIC 15mg hos pasienter med avansert nyresykdom. Unngå bruk av MOBIC 7,5 mg hos pasienter med avansert nyresykdom med mindre fordelene forventes å oppveie risikoen for forverret nyrefunksjon. Hvis MOBIC brukes hos pasienter med avansert nyresykdom, overvåk pasientene for tegn på forverret nyrefunksjon [se KLINISK FARMAKOLOGI ].
Hyperkalemi
Økning i serumkaliumkonsentrasjon, inkludert hyperkalemi, er rapportert ved bruk av NSAIDs, selv hos noen pasienter uten nedsatt nyrefunksjon. Hos pasienter med normal nyrefunksjon har disse effektene blitt tilskrevet en hyporeninemisk-hypoaldosteronismetilstand.
Anafylaktiske reaksjoner
Meloksikam har vært assosiert med anafylaktiske reaksjoner hos pasienter med og uten kjent overfølsomhet overfor meloksikam og hos pasienter med aspirinsensitiv astma [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Søk nødhjelp hvis en anafylaktisk reaksjon oppstår.
Forverring av astma relatert til aspirinfølsomhet
En underpopulasjon av pasienter med astma kan ha aspirinsensitiv astma som kan omfatte kronisk rhinosinusitt komplisert av nesepolypper; alvorlig, potensielt dødelig bronkospasme; og/eller intoleranse mot aspirin og andre NSAIDs. Fordi kryssreaktivitet mellom aspirin og andre NSAIDs er rapportert hos slike aspirinsensitive pasienter, er MOBIC kontraindisert hos pasienter med denne formen for aspirinsensitivitet [se KONTRAINDIKASJONER ]. Når MOBIC 15mg brukes til pasienter med eksisterende astma (uten kjent aspirinfølsomhet), overvåk pasientene for endringer i tegn og symptomer på astma.
Alvorlige hudreaksjoner
NSAIDs, inkludert meloksikam, kan forårsake alvorlige hudbivirkninger som eksfoliativ dermatitt, Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), som kan være dødelig. Disse alvorlige hendelsene kan oppstå uten forvarsel. Informer pasientene om tegn og symptomer på alvorlige hudreaksjoner, og å avbryte bruken av MOBIC ved første opptreden av hudutslett eller andre tegn på overfølsomhet. MOBIC er kontraindisert hos pasienter med tidligere alvorlige hudreaksjoner på NSAIDs [se KONTRAINDIKASJONER ].
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS)
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) er rapportert hos pasienter som tar NSAIDs som MOBIC. Noen av disse hendelsene har vært dødelige eller livstruende. DRESS gir vanligvis, men ikke utelukkende, feber, utslett, lymfadenopati og/eller hevelse i ansiktet. Andre kliniske manifestasjoner kan inkludere hepatitt, nefritt, hematologiske abnormiteter, myokarditt eller myositt. Noen ganger kan symptomer på DRESS ligne på en akutt virusinfeksjon. Eosinofili er ofte tilstede. Fordi denne lidelsen er variabel i presentasjonen, kan andre organsystemer som ikke er nevnt her være involvert. Det er viktig å merke seg at tidlige manifestasjoner av overfølsomhet, som feber eller lymfadenopati, kan være tilstede selv om utslett ikke er tydelig. Hvis slike tegn eller symptomer er tilstede, avbryt MOBIC og evaluer pasienten umiddelbart.
Fostertoksisitet
For tidlig stenging av føtal ductus arteriosus
Unngå bruk av NSAIDs, inkludert MOBIC, hos gravide kvinner ved ca. 30 ukers svangerskap og senere. NSAIDs, inkludert MOBIC, øker risikoen for for tidlig lukking av fosterets ductus arteriosus ved omtrent denne svangerskapsalderen.
Oligohydramnios/neonatal nyresvikt
Bruk av NSAIDs, inkludert MOBIC 15 mg, ved ca. 20 svangerskapsuker eller senere i svangerskapet kan forårsake fosterets nyresvikt som kan føre til oligohydramnios og, i noen tilfeller, nyresvikt hos nyfødte. Disse uønskede utfallene sees i gjennomsnitt etter dager til uker med behandling, selv om oligohydramnios sjelden har blitt rapportert så snart som 48 timer etter NSAID-start. Oligohydramnios er ofte, men ikke alltid, reversibelt ved seponering av behandlingen. Komplikasjoner av langvarig oligohydramnios kan for eksempel inkludere lemmerkontrakturer og forsinket lungemodning. I noen tilfeller etter markedsføring av nedsatt nyrefunksjon hos nyfødte, var invasive prosedyrer som utvekslingstransfusjon eller dialyse nødvendig.
Hvis NSAID-behandling er nødvendig mellom ca. 20 uker og 30 ukers svangerskap, begrense MOBIC-bruken til den laveste effektive dosen og kortest mulig varighet. Vurder ultralydovervåking av fostervann dersom MOBIC 15mg-behandling strekker seg utover 48 timer. Seponer MOBIC 15mg hvis oligohydramnios oppstår og følg opp i henhold til klinisk praksis [se Bruk i spesifikke populasjoner ].
Hematologisk toksisitet
Anemi har forekommet hos NSAID-behandlede pasienter. Dette kan skyldes okkult eller grovt blodtap, væskeretensjon eller en ufullstendig beskrevet effekt på erytropoesen. Hvis en pasient behandlet med MOBIC har tegn eller symptomer på anemi, overvåk hemoglobin eller hematokrit.
NSAIDs, inkludert MOBIC 7,5 mg, kan øke risikoen for blødningshendelser. Komorbide tilstander som koagulasjonsforstyrrelser eller samtidig bruk av warfarin, andre antikoagulantia, blodplatehemmere (f.eks. aspirin), serotoninreopptakshemmere (SSRI) og serotonin noradrenalin reopptakshemmere (SNRI) kan øke denne risikoen. Overvåk disse pasientene for tegn på blødning [se NARKOTIKAHANDEL ].
Maskering av betennelse og feber
Den farmakologiske aktiviteten til MOBIC 15mg for å redusere betennelse, og muligens feber, kan redusere nytten av diagnostiske tegn for å oppdage infeksjoner.
Laboratorieovervåking
Fordi alvorlig GI-blødning, hepatotoksisitet og nyreskade kan oppstå uten advarselssymptomer eller tegn, bør du vurdere å overvåke pasienter på langvarig NSAID-behandling med en CBC og en kjemiprofil med jevne mellomrom [se ADVARSLER OG FORHOLDSREGLER ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning som følger med hver resept som utleveres.
Informer pasienter, familier eller deres omsorgspersoner om følgende informasjon før behandling med et NSAID startes og med jevne mellomrom i løpet av pågående behandling.
Kardiovaskulære trombotiske hendelser
Råd pasientene til å være på vakt for symptomene på kardiovaskulære trombotiske hendelser, inkludert brystsmerter, kortpustethet, svakhet eller sløret tale, og å rapportere alle disse symptomene til helsepersonell umiddelbart [se ADVARSLER OG FORHOLDSREGLER ].
Gastrointestinal blødning, sårdannelse og perforering
Råd pasientene til å rapportere symptomer på sårdannelser og blødninger, inkludert epigastriske smerter, dyspepsi, melena og hematemese til helsepersonell. Ved samtidig bruk av lavdose aspirin for hjerteprofylakse, informer pasientene om økt risiko for tegn og symptomer på GI-blødning [se ADVARSLER OG FORHOLDSREGLER ].
Hepatotoksisitet
Informer pasienter om varseltegn og symptomer på levertoksisitet (f.eks. kvalme, tretthet, sløvhet, diaré, kløe, gulsott, ømhet i øvre øvre kvadrant og "influensalignende" symptomer). Hvis disse oppstår, instruer pasientene om å stoppe MOBIC 7,5 mg og oppsøke øyeblikkelig medisinsk behandling [se ADVARSLER OG FORHOLDSREGLER ].
Hjertesvikt og ødem
Råd pasientene til å være på vakt for symptomene på kongestiv hjertesvikt inkludert kortpustethet, uforklarlig vektøkning eller ødem og kontakte helsepersonell dersom slike symptomer oppstår [se ADVARSLER OG FORHOLDSREGLER ].
Anafylaktiske reaksjoner
Informer pasientene om tegn på en anafylaktisk reaksjon (f.eks. pustevansker, hevelse i ansikt eller hals). Instruer pasienter om å søke øyeblikkelig nødhjelp hvis disse oppstår [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Alvorlige hudreaksjoner, inkludert DRESS
Råd pasienter til å slutte å ta MOBIC umiddelbart hvis de utvikler noen form for utslett eller feber og kontakte helsepersonell så snart som mulig [se ADVARSLER OG FORHOLDSREGLER ].
Kvinnelig fruktbarhet
Informer kvinner med reproduksjonspotensiale som ønsker å bli gravide at NSAIDs, inkludert MOBIC 7,5 mg, kan være assosiert med en reversibel forsinkelse i eggløsningen [se Bruk i spesifikke populasjoner ].
Fostertoksisitet
Informer gravide kvinner om å unngå bruk av MOBIC 15mg og andre NSAIDs fra og med 30 ukers svangerskap på grunn av risikoen for for tidlig lukking av fosterets ductus arteriosus. Hvis behandling med MOBIC 15mg er nødvendig for en gravid kvinne mellom ca. 20 til 30 ukers svangerskap, informer henne om at hun kanskje må overvåkes for oligohydramnios, hvis behandlingen fortsetter i mer enn 48 timer [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Unngå samtidig bruk av NSAIDs
Informer pasientene om at samtidig bruk av MOBIC 15mg med andre NSAIDs eller salisylater (f.eks. diflunisal, salsalat) ikke anbefales på grunn av økt risiko for gastrointestinal toksisitet og liten eller ingen økning i effekt [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ]. Varsle pasienter om at NSAIDs kan være til stede i "reseptfri" medisiner for behandling av forkjølelse, feber eller søvnløshet.
Bruk av NSAIDs og lavdose aspirin
Informer pasienter om ikke å bruke lavdose aspirin samtidig med MOBIC 7,5 mg før de har snakket med helsepersonell [se NARKOTIKAHANDEL ].
For gjeldende forskrivningsinformasjon, skann koden eller ring Boehringer Ingelheim Pharmaceuticals, Inc. på 1-800-542-6257.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Det var ingen økning i tumorforekomst i langtidskarsinogenitetsstudier hos rotter (104 uker) og mus (99 uker) administrert meloksikam i orale doser opptil 0,8 mg/kg/dag hos rotter og opptil 8,0 mg/kg/dag i mus (opptil henholdsvis 0,5 og 2,6 ganger den maksimale anbefalte humane dosen [MRHD] på 15 mg/dag MOBIC 7,5 mg basert på kroppsoverflateareal [BSA] sammenligning).
Mutagenese
Meloksikam var ikke mutagent i en Ames-analyse, eller klastogen i en kromosomavviksanalyse med humane lymfocytter og en in vivo mikronukleustest i benmarg hos mus.
Nedsatt fruktbarhet
Meloksikam svekket ikke fertiliteten hos hann- og hunnrotter ved orale doser opp til 9 mg/kg/dag hos hanner og 5 mg/kg/dag hos hunner (henholdsvis opptil 5,8 og 3,2 ganger høyere enn MRHD basert på BSA sammenligning).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Bruk av NSAIDs, inkludert MOBIC, kan forårsake for tidlig lukking av fosterets ductus arteriosus og fosterets nyresvikt som fører til oligohydramnios og, i noen tilfeller, nyresvikt hos nyfødte. På grunn av disse risikoene, begrense dosen og varigheten av MOBIC-bruk mellom ca. 20 og 30 uker av svangerskapet, og unngå MOBIC-bruk ved ca. 30. svangerskapsuke og senere i svangerskapet (se Kliniske betraktninger , Data ).
For tidlig stenging av føtal ductus arteriosus
Bruk av NSAIDs, inkludert MOBIC 15 mg, ved ca. 30 ukers svangerskap eller senere i svangerskapet øker risikoen for for tidlig stenging av fosterets ductus arteriosus.
Oligohydramnios/neonatal nyresvikt
Bruk av NSAIDs ved ca. 20 ukers svangerskap eller senere i svangerskapet har vært assosiert med tilfeller av føtal nyresvikt som fører til oligohydramnios, og i noen tilfeller nyresvikt hos nyfødte.
Data fra observasjonsstudier angående potensielle embryoføtale risikoer ved bruk av NSAID hos kvinner i første eller andre trimester av svangerskapet er ikke konklusive.
I reproduksjonsstudier på dyr ble embryoføtal død observert hos rotter og kaniner behandlet i løpet av organogeneseperioden med meloksikam i orale doser tilsvarende 0,65- og 6,5 ganger maksimal anbefalt human dose (MRHD) av MOBIC. Økt forekomst av septumhjertedefekter ble observert hos kaniner behandlet gjennom hele embryogenese med meloksikam i en oral dose tilsvarende 78 ganger MRHD. I pre- og postnatale reproduksjonsstudier var det økt forekomst av dystoki, forsinket fødsel og redusert overlevelse av avkom ved 0,08 ganger MRHD for meloksikam. Ingen teratogene effekter ble observert hos rotter og kaniner behandlet med meloksikam under organogenese ved en oral dose tilsvarende 2,6 og 26 ganger MRHD [se Data ].
Basert på dyredata har prostaglandiner vist seg å ha en viktig rolle i endometrial vaskulær permeabilitet, blastocystimplantasjon og decidualisering. I dyrestudier resulterte administrering av prostaglandinsyntesehemmere som meloksikam i økt pre- og post-implantasjonstap. Prostaglandiner har også vist seg å ha en viktig rolle i fosterets nyreutvikling. I publiserte dyrestudier har prostaglandinsyntesehemmere blitt rapportert å svekke nyreutviklingen når de administreres i klinisk relevante doser.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den eller de angitte populasjonene er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Fetale/neonatale bivirkninger
For tidlig stenging av føtal ductus arteriosus
Unngå bruk av NSAIDs hos kvinner ved ca. 30 ukers svangerskap og senere i svangerskapet, fordi NSAIDs, inkludert MOBIC 7,5 mg, kan forårsake for tidlig lukking av fosterets ductus arteriosus (se Data ).
Oligohydramnios/neonatal nyresvikt
Hvis et NSAID er nødvendig ved ca. 20 ukers svangerskap eller senere i svangerskapet, begrense bruken til den laveste effektive dosen og kortest mulig varighet. Hvis behandlingen med MOBIC 15 mg varer utover 48 timer, bør du vurdere å overvåke med ultralyd for oligohydramnios. Hvis oligohydramnios oppstår, seponer MOBIC 7,5 mg og følg opp i henhold til klinisk praksis (se Data ).
Arbeid eller levering
Det er ingen studier på effekten av MOBIC 7,5 mg under fødsel eller fødsel. I dyrestudier hemmer NSAIDs, inkludert meloksikam, prostaglandinsyntesen, forårsaker forsinket fødsel og øker forekomsten av dødfødsler.
Data
Menneskelige data
For tidlig stenging av føtal ductus arteriosus
Publisert litteratur rapporterer at bruk av NSAIDs ved ca. 30 uker av svangerskapet og senere i svangerskapet kan forårsake for tidlig lukking av fosterets ductus arteriosus.
Oligohydramnios/neonatal nyresvikt
Publiserte studier og rapporter etter markedsføring beskriver mors NSAID-bruk ved ca. 20 ukers svangerskap eller senere i svangerskapet assosiert med føtal nyresvikt som fører til oligohydramnios, og i noen tilfeller, nyresvikt hos nyfødte. Disse uønskede utfallene sees i gjennomsnitt etter dager til uker med behandling, selv om oligohydramnios sjelden har blitt rapportert så snart som 48 timer etter NSAID-start. I mange tilfeller, men ikke alle, var nedgangen i fostervann forbigående og reversibel ved seponering av medikamentet. Det har vært et begrenset antall kasusrapporter om bruk av NSAID hos mor og nyresvikt hos nyfødte uten oligohydramnios, hvorav noen var irreversible. Noen tilfeller av nyresvikt hos nyfødte krevde behandling med invasive prosedyrer, som utvekslingstransfusjon eller dialyse.
Metodiske begrensninger ved disse postmarketing-studiene og rapportene inkluderer mangel på en kontrollgruppe; begrenset informasjon om dose, varighet og tidspunkt for medikamenteksponering; og samtidig bruk av andre medisiner. Disse begrensningene utelukker etablering av et pålitelig estimat av risikoen for uønskede føtale og neonatale utfall ved bruk av NSAID hos mor. Fordi de publiserte sikkerhetsdataene om nyfødte utfall hovedsakelig involverte premature spedbarn, er det usikkert om visse rapporterte risikoer for fullbårne spedbarn eksponert for NSAIDs ved bruk av mor kan generaliseres.
Dyredata
Meloksikam var ikke teratogent når det ble administrert til drektige rotter under føtal organogenese ved orale doser opptil 4 mg/kg/dag (2,6 ganger høyere enn MRHD på 15 mg MOBIC basert på BSA-sammenligning). Administrering av meloksikam til drektige kaniner gjennom hele embryogenese ga økt forekomst av septumdefekter i hjertet ved en oral dose på 60 mg/kg/dag (78 ganger høyere enn MRHD basert på BSA-sammenligning). Ingen effektnivå var 20 mg/kg/dag (26 ganger høyere enn MRHD basert på BSA-konvertering). Hos rotter og kaniner forekom embryodødelighet ved orale meloksikamdoser på henholdsvis 1 mg/kg/dag og 5 mg/kg/dag (henholdsvis 0,65- og 6,5 ganger høyere enn MRHD basert på BSA-sammenligning) når det ble administrert gjennom hele organogenesen .
Oral administrering av meloksikam til drektige rotter under sen svangerskap gjennom amming økte forekomsten av dystoki, forsinket fødsel og reduserte avkoms overlevelse ved meloksikamdoser på 0,125 mg/kg/dag eller mer (0,08 ganger MRHD basert på BSA-sammenligning).
Amming
Risikosammendrag
Det er ingen humane data tilgjengelig om meloksikam er tilstede i morsmelk, eller om effekten på spedbarn som ammes, eller på melkeproduksjonen. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for MOBIC og eventuelle skadelige effekter på det ammede spedbarnet fra MOBIC 15 mg eller fra den underliggende mors tilstand.
Data
Dyredata
Meloksikam var tilstede i melken til diegivende rotter i konsentrasjoner høyere enn i plasma.
Kvinner og menn med reproduktivt potensial
Infertilitet
Kvinner
Basert på virkningsmekanismen, kan bruk av prostaglandin-mediert NSAID, inkludert MOBIC, forsinke eller forhindre ruptur av eggstokkfollikler, som har vært assosiert med reversibel infertilitet hos noen kvinner. Publiserte dyrestudier har vist at administrering av prostaglandinsyntesehemmere har potensial til å forstyrre prostaglandinmediert follikulær ruptur som kreves for eggløsning. Små studier på kvinner behandlet med NSAIDs har også vist en reversibel forsinkelse i eggløsning. Vurder seponering av NSAIDs, inkludert MOBIC, hos kvinner som har vanskeligheter med å bli gravide eller som er under utredning av infertilitet.
Pediatrisk bruk
Sikkerheten og effektiviteten til meloksikam hos pediatriske JRA-pasienter fra 2 til 17 år har blitt evaluert i tre kliniske studier [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER og Kliniske studier ].
Geriatrisk bruk
Eldre pasienter, sammenlignet med yngre pasienter, har større risiko for NSAID-assosierte alvorlige kardiovaskulære, gastrointestinale og/eller renale bivirkninger. Hvis den forventede fordelen for den eldre pasienten oppveier disse potensielle risikoene, start doseringen i den lave enden av doseringsområdet og overvåk pasientene for bivirkninger [se ADVARSLER OG FORHOLDSREGLER ].
Nedsatt leverfunksjon
Ingen dosejustering er nødvendig hos pasienter med mild til moderat nedsatt leverfunksjon. Pasienter med alvorlig nedsatt leverfunksjon har ikke blitt tilstrekkelig studert. Siden meloksikam metaboliseres betydelig i leveren og levertoksisitet kan forekomme, bruk meloksikam med forsiktighet hos pasienter med nedsatt leverfunksjon [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
Ingen dosejustering er nødvendig hos pasienter med mild til moderat nedsatt nyrefunksjon. Pasienter med alvorlig nedsatt nyrefunksjon har ikke blitt undersøkt. Bruk av MOBIC 7,5 mg hos personer med alvorlig nedsatt nyrefunksjon anbefales ikke. Hos pasienter i hemodialyse bør meloksikam ikke overstige 7,5 mg per dag. Meloksikam er ikke dialyserbart [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
OVERDOSE
Symptomer etter akutte NSAID-overdoser har vanligvis vært begrenset til sløvhet, døsighet, kvalme, oppkast og epigastriske smerter, som generelt har vært reversible med støttebehandling. Gastrointestinal blødning har oppstått. Hypertensjon, akutt nyresvikt, respirasjonsdepresjon og koma har forekommet, men var sjeldne [se ADVARSLER OG FORHOLDSREGLER ].
Behandle pasienter med symptomatisk og støttende behandling etter en NSAID-overdosering. Det er ingen spesifikke motgift. Vurder brekninger og/eller aktivt kull (60 til 100 gram hos voksne, 1 til 2 gram per kg kroppsvekt hos pediatriske pasienter) og/eller osmotisk katarsis hos symptomatiske pasienter sett innen fire timer etter inntak eller hos pasienter med stor overdosering ( 5 til 10 ganger anbefalt dose). Tvunget diurese, alkalisering av urin, hemodialyse eller hemoperfusjon er kanskje ikke nyttig på grunn av høy proteinbinding.
Det er begrenset erfaring med overdosering av meloksikam. Kolestyramin er kjent for å akselerere clearance av meloksikam. Akselerert fjerning av meloksikam med 4 g orale doser kolestyramin gitt tre ganger daglig ble vist i en klinisk studie. Administrering av kolestyramin kan være nyttig etter en overdosering.
For ytterligere informasjon om overdoseringsbehandling, ring et giftkontrollsenter (1-800-222-1222).
KONTRAINDIKASJONER
MOBIC 15mg er kontraindisert hos følgende pasienter:
- . Kjent overfølsomhet (f.eks. anafylaktiske reaksjoner og alvorlige hudreaksjoner) overfor meloksikam eller noen komponenter i legemiddelet [se ADVARSLER OG FORHOLDSREGLER ] . Anamnese med astma, urticaria eller andre allergiske reaksjoner etter inntak av aspirin eller andre NSAIDs. Alvorlige, noen ganger fatale, anafylaktiske reaksjoner på NSAIDs er rapportert hos slike pasienter [se ADVARSLER OG FORHOLDSREGLER ] . I forbindelse med koronar bypass-operasjon (CABG) [se ADVARSLER OG FORHOLDSREGLER ]
KLINISK FARMAKOLOGI
Virkningsmekanismen
Meloksikam har smertestillende, anti-inflammatoriske og febernedsettende egenskaper.
Virkningsmekanismen til MOBIC, i likhet med andre NSAIDs, er ikke fullstendig forstått, men involverer hemming av cyklooksygenase (COX-1 og COX-2).
Meloksikam er en potent hemmer av prostaglandinsyntese in vitro. Meloksikamkonsentrasjoner oppnådd under behandling har gitt in vivo-effekter. Prostaglandiner sensibiliserer afferente nerver og potenserer virkningen av bradykinin for å indusere smerte i dyremodeller. Prostaglandiner er mediatorer av betennelse. Fordi meloksikam er en hemmer av prostaglandinsyntese, kan virkemåten skyldes en reduksjon av prostaglandiner i perifert vev.
Farmakokinetikk
Absorpsjon
Den absolutte biotilgjengeligheten til meloksikamkapsler var 89 % etter en enkelt oral dose på 30 mg sammenlignet med 30 mg IV bolusinjeksjon. Etter intravenøse enkeltdoser ble doseproporsjonal farmakokinetikk vist i området 5 mg til 60 mg. Etter flere orale doser var farmakokinetikken til meloksikamkapsler doseproporsjonal i området 7,5 mg til 15 mg. Gjennomsnittlig C ble oppnådd innen fire til fem timer etter at en 7,5 mg meloksikamtablett ble tatt under fastende forhold, noe som indikerer en forlenget medikamentabsorpsjon. Ved gjentatt dosering ble steady-state-konsentrasjoner nådd på dag 5. En andre topp av meloksikamkonsentrasjonen inntreffer rundt 12 til 14 timer etter dosen, noe som tyder på resirkulering av galle.
Meloksikam oral suspensjonsdoser på 7,5 mg/5 ml og 15 mg/10 ml har vist seg å være bioekvivalente med henholdsvis meloksikam 7,5 mg og 15 mg kapsler. Meloksikamkapsler har vist seg å være bioekvivalente med MOBIC 7,5 mg tabletter.
Mat og syrenøytraliserende effekter
Administrering av meloksikamkapsler etter en frokost med høyt fettinnhold (75 g fett) resulterte i at gjennomsnittlige maksimale legemiddelnivåer (dvs. Cmax) økte med ca. 22 % mens graden av absorpsjon (AUC) var uendret. Tiden til maksimal konsentrasjon (Tmax) ble oppnådd mellom 5 og 6 timer. Til sammenligning ble verken AUC- eller Cmax-verdiene for meloksikamsuspensjon påvirket etter et tilsvarende fettrikt måltid, mens gjennomsnittlige Tmax-verdier ble økt til ca. 7 timer. Ingen farmakokinetisk interaksjon ble påvist ved samtidig administrering av antacida. Basert på disse resultatene kan MOBIC 15 mg administreres uten hensyn til tidspunkt for måltider eller samtidig administrering av antacida.
Fordeling
Gjennomsnittlig distribusjonsvolum (Vss) av meloksikam er ca. 10 l. Meloksikam er ~99,4 % bundet til humane plasmaproteiner (primært albumin) innenfor det terapeutiske doseområdet. Fraksjonen av proteinbinding er uavhengig av legemiddelkonsentrasjon, over det klinisk relevante konsentrasjonsområdet, men synker til ~99 % hos pasienter med nyresykdom. Meloksikampenetrasjon i menneskelige røde blodlegemer, etter oral dosering, er mindre enn 10 %. Etter en radiomerket dose var over 90 % av radioaktiviteten påvist i plasma tilstede som uendret meloksikam.
Meloksikamkonsentrasjoner i leddvæske, etter en enkelt oral dose, varierer fra 40 % til 50 % av de i plasma. Den frie fraksjonen i leddvæske er 2,5 ganger høyere enn i plasma, på grunn av det lavere albumininnholdet i leddvæsken sammenlignet med plasma. Betydningen av denne penetrasjonen er ukjent.
Eliminering
Metabolisme
Meloksikam metaboliseres i stor grad i leveren. Meloksikammetabolitter inkluderer 5'- karboksymeloksikam (60 % av dosen), fra P-450-mediert metabolisme dannet ved oksidasjon av en mellommetabolitt 5'-hydroksymetylmeloksikam som også skilles ut i mindre grad (9 % av dosen) ). In vitro-studier indikerer at CYP2C9 (cytokrom P450-metaboliserende enzym) spiller en viktig rolle i denne metabolske veien med et mindre bidrag fra CYP3A4-isozymet. Pasientens peroksidaseaktivitet er sannsynligvis ansvarlig for de to andre metabolittene som står for henholdsvis 16 % og 4 % av den administrerte dosen. Alle de fire metabolittene er ikke kjent for å ha noen in vivo farmakologisk aktivitet.
Utskillelse
Utskillelse av meloksikam skjer hovedsakelig i form av metabolitter, og skjer i like stor grad i urin og avføring. Bare spor av den uendrede moderforbindelsen skilles ut i urinen (0,2 %) og avføring (1,6 %). Omfanget av urinutskillelsen ble bekreftet for umerkede multiple doser på 7,5 mg: 0,5 %, 6 % og 13 % av dosen ble funnet i urin i form av meloksikam, og 5'-hydroksymetyl og 5' -carboxy metabolitter, henholdsvis. Det er betydelig galle- og/eller enteral sekresjon av legemidlet. Dette ble vist når oral administrering av kolestyramin etter en enkelt IV-dose meloksikam reduserte AUC for meloksikam med 50 %.
Gjennomsnittlig eliminasjonshalveringstid (t1/2) varierer fra 15 timer til 20 timer. Eliminasjonshalveringstiden er konstant på tvers av dosenivåer, noe som indikerer lineær metabolisme innenfor det terapeutiske doseområdet. Plasmaclearance varierer fra 7 til 9 ml/min.
Spesifikke populasjoner
Pediatrisk
Etter administrering av enkeltdoser (0,25 mg/kg) og etter oppnåelse av steady state (0,375 mg/kg/dag), var det en generell trend med omtrent 30 % lavere eksponering hos yngre pasienter (2 til 6 år) sammenlignet med de eldre. pasienter (7 til 16 år). De eldre pasientene hadde meloksikameksponeringer tilsvarende (enkeltdose) eller lett redusert (steady state) som hos voksne pasienter, ved bruk av AUC-verdier normalisert til en dose på 0,25 mg/kg [se DOSERING OG ADMINISTRASJON ]. Halveringstiden for meloksikam (SD) var 15,2 (10,1) og 13,0 timer (3,0) for henholdsvis 2 til 6 år gamle pasienter og 7 til 16 år gamle pasienter.
I en kovariatanalyse var bruk av populasjonsfarmakokinetikk kroppsvekt, men ikke alder, det eneste prediktive kovariatet for forskjeller i tilsynelatende oral plasmaclearance for meloksikam. Kroppsvektnormaliserte tilsynelatende orale clearance-verdier var tilstrekkelige prediktorer for meloksikameksponering hos pediatriske pasienter.
Farmakokinetikken til MOBIC hos pediatriske pasienter under 2 år har ikke blitt undersøkt.
Geriatrisk
Eldre menn (≥65 år) viste meloksikam plasmakonsentrasjoner og steady-state farmakokinetikk tilsvarende unge menn. Eldre kvinner (≥65 år) hadde 47 % høyere AUCss og 32 % høyere Cmax,ss sammenlignet med yngre kvinner (≤55 år) etter normalisering av kroppsvekten. Til tross for de økte totale konsentrasjonene hos eldre kvinner, var bivirkningsprofilen sammenlignbar for begge eldre pasientpopulasjoner. En mindre fri fraksjon ble funnet hos eldre kvinnelige pasienter sammenlignet med eldre mannlige pasienter.
Kjønn
Unge kvinner viste noe lavere plasmakonsentrasjoner i forhold til unge hanner. Etter enkeltdoser på 7,5 mg MOBIC var gjennomsnittlig eliminasjonshalveringstid 19,5 timer for den kvinnelige gruppen sammenlignet med 23,4 timer for den mannlige gruppen. Ved steady state var dataene like (17,9 timer vs 21,4 timer). Denne farmakokinetiske forskjellen på grunn av kjønn er sannsynligvis av liten klinisk betydning. Det var linearitet i farmakokinetikken og ingen merkbar forskjell i Cmax eller Tmax på tvers av kjønn.
Nedsatt leverfunksjon
Etter en enkeltdose på 15 mg meloksikam var det ingen markant forskjell i plasmakonsentrasjoner hos pasienter med mild (Child-Pugh klasse I) eller moderat (Child-Pugh klasse II) nedsatt leverfunksjon sammenlignet med friske frivillige. Proteinbinding av meloksikam ble ikke påvirket av nedsatt leverfunksjon. Ingen dosejustering er nødvendig hos pasienter med mild til moderat nedsatt leverfunksjon. Pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh klasse III) har ikke blitt tilstrekkelig studert [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Nedsatt nyrefunksjon
Meloksikams farmakokinetikk er undersøkt hos personer med mild og moderat nedsatt nyrefunksjon. Totale plasmakonsentrasjoner av meloksikam avtok og total clearance av meloksikam økte med graden av nedsatt nyrefunksjon, mens frie AUC-verdier var like i alle gruppene. Den høyere meloksikamclearance hos personer med nedsatt nyrefunksjon kan skyldes økt andel av ubundet meloksikam som er tilgjengelig for levermetabolisme og påfølgende utskillelse. Ingen dosejustering er nødvendig hos pasienter med mild til moderat nedsatt nyrefunksjon. Pasienter med alvorlig nedsatt nyrefunksjon har ikke blitt tilstrekkelig studert. Bruk av MOBIC hos personer med alvorlig nedsatt nyrefunksjon anbefales ikke [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Hemodialyse
Etter en enkeltdose meloksikam var de frie Cmax-plasmakonsentrasjonene høyere hos pasienter med nyresvikt på kronisk hemodialyse (1 % fri fraksjon) sammenlignet med friske frivillige (0,3 % fri fraksjon). Hemodialyse reduserte ikke den totale legemiddelkonsentrasjonen i plasma; derfor er ytterligere doser ikke nødvendig etter hemodialyse. Meloksikam er ikke dialyserbart [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Legemiddelinteraksjonsstudier
Aspirin
Når NSAIDs ble administrert sammen med aspirin, ble proteinbindingen til NSAIDs redusert, selv om clearance av fri NSAID ikke ble endret. Når MOBIC 15 mg administreres med aspirin (1000 mg tre ganger daglig) til friske frivillige, hadde det en tendens til å øke AUC (10 %) og C (24 %) for meloksikam. Den kliniske betydningen av denne interaksjonen er ikke kjent. Se tabell 3 for klinisk signifikante legemiddelinteraksjoner av NSAIDs med aspirin [se NARKOTIKAHANDEL ].
Kolestyramin
Forbehandling i fire dager med kolestyramin økte clearance av meloksikam signifikant med 50 %. Dette resulterte i en reduksjon i t1/2, fra 19,2 timer til 12,5 timer, og en 35 % reduksjon i AUC. Dette antyder eksistensen av en resirkulasjonsvei for meloksikam i mage-tarmkanalen. Den kliniske relevansen av denne interaksjonen er ikke fastslått.
Cimetidin
Samtidig administrering av 200 mg cimetidin fire ganger daglig endret ikke enkeltdose-farmakokinetikken til 30 mg meloksikam.
Digoksin
Meloksikam 15 mg én gang daglig i 7 dager endret ikke plasmakonsentrasjonsprofilen til digoksin etter administrasjon av β-acetyldigoksin i 7 dager ved kliniske doser. In vitro-testing fant ingen proteinbindende legemiddelinteraksjon mellom digoksin og meloksikam.
Litium
en studie utført på friske personer ble gjennomsnittlig litiumkonsentrasjon og AUC økt med 21 % før dose hos personer som fikk litiumdoser fra 804 til 1072 mg to ganger daglig med meloksikam 15 mg daglig hver dag sammenlignet med forsøkspersoner som fikk litium alene [se NARKOTIKAHANDEL ].
Metotreksat
En studie med 13 pasienter med revmatoid artritt (RA) evaluerte effekten av flere doser meloksikam på farmakokinetikken til metotreksat tatt en gang i uken. Meloksikam hadde ingen signifikant effekt på farmakokinetikken til enkeltdoser metotreksat. In vitro fortrengte ikke metotreksat meloksikam fra dets humane serumbindingsseter [se NARKOTIKAHANDEL ].
Warfarin
Effekten av meloksikam på den antikoagulerende effekten av warfarin ble studert i en gruppe friske forsøkspersoner som fikk daglige doser warfarin som ga en INR (International Normalized Ratio) mellom 1,2 og 1,8. Hos disse pasientene endret ikke meloksikam warfarins farmakokinetikk og den gjennomsnittlige antikoagulerende effekten av warfarin bestemt av protrombintid. Imidlertid viste ett individ en økning i INR fra 1,5 til 2,1. Forsiktighet bør utvises ved administrering av MOBIC 15mg med warfarin siden pasienter på warfarin kan oppleve endringer i INR og økt risiko for blødningskomplikasjoner når en ny medisin introduseres [se NARKOTIKAHANDEL ].
Kliniske studier
Artrose og revmatoid artritt
Bruken av MOBIC 15 mg for behandling av tegn og symptomer på artrose i kne og hofte ble evaluert i en 12-ukers, dobbeltblind, kontrollert studie. MOBIC (3,75 mg, 7,5 mg og 15 mg daglig) ble sammenlignet med placebo. De fire primære endepunktene var etterforskerens globale vurdering, pasientens globale vurdering, pasientens smertevurdering og total WOMAC-score (et selvadministrert spørreskjema som tar for seg smerte, funksjon og stivhet). Pasienter på MOBIC 7,5 mg daglig og MOBIC 15 mg daglig viste signifikant forbedring i hvert av disse endepunktene sammenlignet med placebo.
Bruken av MOBIC for håndtering av tegn og symptomer på slitasjegikt ble evaluert i seks dobbeltblindede, aktivt kontrollerte studier utenfor USA, fra 4 uker til 6 måneders varighet. I disse studiene var effekten av MOBIC, i doser på 7,5 mg/dag og 15 mg/dag, sammenlignbar med piroksikam 20 mg/dag og diklofenak SR 100 mg/dag og i samsvar med effekten sett i den amerikanske studien.
Bruken av MOBIC 7,5 mg for behandling av tegn og symptomer på revmatoid artritt ble evaluert i en 12-ukers, dobbeltblind, kontrollert multinasjonal studie. MOBIC (7,5 mg, 15 mg og 22,5 mg daglig) ble sammenlignet med placebo. Det primære endepunktet i denne studien var ACR20-responsraten, et sammensatt mål på kliniske, laboratoriemessige og funksjonelle mål på RA-respons. Pasienter som fikk MOBIC 7,5 mg og 15 mg daglig viste signifikant forbedring i det primære endepunktet sammenlignet med placebo. Ingen økte fordeler ble observert med dosen på 22,5 mg sammenlignet med dosen på 15 mg.
Juvenil Revmatoid Artritt (JRA) Pauciartikulær og polyartikulær kurs
Bruken av MOBIC 7,5 mg for behandling av tegn og symptomer på pauciartikulær eller polyartikulær juvenil revmatoid artritt hos pasienter 2 år og eldre ble evaluert i to 12-ukers, dobbeltblindede, parallellarmede, aktivt kontrollerte studier .
Begge studiene inkluderte tre armer: naproksen og to doser meloksikam. I begge studiene begynte doseringen av meloksikam ved 0,125 mg/kg/dag (maksimalt 7,5 mg) eller 0,25 mg/kg/dag (maksimalt 15 mg), og doseringen av naproksen begynte med 10 mg/kg/dag. En studie brukte disse dosene gjennom den 12-ukers doseringsperioden, mens den andre inkorporerte en titrering etter 4 uker til doser på 0,25 mg/kg/dag og 0,375 mg/kg/dag (maksimalt 22,5 mg) meloksikam og 15 mg/kg /dag av naproxen.
Effektanalysen brukte ACR Pediatric 30 responder-definisjonen, en sammensetning av foreldre- og etterforskervurderinger, tellinger av aktive ledd og ledd med begrenset bevegelsesområde og erytrocyttsedimentasjonshastighet. Andelen respondere var lik i alle tre gruppene i begge studiene, og ingen forskjell ble observert mellom meloksikamdosegruppene.
PASIENTINFORMASJON
Medisineringsveiledning for ikke-steroide antiinflammatoriske legemidler (NSAIDs)
Hva er den viktigste informasjonen jeg bør vite om medisiner som kalles ikke-steroide antiinflammatoriske legemidler (NSAIDs)?
NSAIDs kan forårsake alvorlige bivirkninger, inkludert:
- . Økt risiko for hjerteinfarkt eller hjerneslag som kan føre til døden. Denne risikoen kan oppstå tidlig i behandlingen og kan øke:
- . med økende doser av NSAIDs . ved lengre bruk av NSAIDs
Ikke ta NSAIDs rett før eller etter en hjerteoperasjon kalt "koronararterie bypass graft (CABG)."
Unngå å ta NSAIDs etter et nylig hjerteinfarkt, med mindre helsepersonell ber deg om det. Du kan ha økt risiko for et nytt hjerteinfarkt hvis du tar NSAIDs etter et nylig hjerteinfarkt.
- . Økt risiko for blødninger, sår og rifter (perforering) av spiserøret (rør som fører fra munnen til magesekken), mage og tarm:
- . når som helst under bruk . uten varselsymptomer . som kan forårsake død
Risikoen for å få sår eller blødning øker med:
- . tidligere historie med magesår, eller mage- eller tarmblødninger ved bruk av NSAIDs . tar medisiner kalt "kortikosteroider", "antikoagulantia", "SSRI" eller "SNRI" økende doser av NSAIDs . lengre bruk av NSAIDs . røyking . drikker alkohol . eldre alder . dårlig helse . avansert leversykdom . blødningsproblemer
NSAIDs skal kun brukes:
- . akkurat som foreskrevet . ved lavest mulig dose for din behandling . for kortest mulig tid
Hva er NSAIDs?
NSAIDs brukes til å behandle smerte og rødhet, hevelse og varme (betennelse) fra medisinske tilstander som forskjellige typer leddgikt, menstruasjonssmerter og andre typer kortvarige smerter.
Hvem bør ikke ta NSAIDs?
Ikke ta NSAIDs:
- . hvis du har hatt et astmaanfall, elveblest eller annen allergisk reaksjon med aspirin eller andre NSAIDs. . rett før eller etter bypassoperasjon.
Før du tar NSAIDs, fortell helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
- . har lever- eller nyreproblemer . har høyt blodtrykk . har astma . er gravid eller planlegger å bli gravid. Å ta NSAIDs ved ca. 20 uker av svangerskapet eller senere kan skade det ufødte barnet. Hvis du trenger å ta NSAIDs i mer enn 2 dager når du er mellom 20 og 30 uker av svangerskapet, kan det hende at helsepersonell må overvåke mengden væske i livmoren rundt babyen din. Du bør ikke ta NSAIDs etter ca. 30 uker med graviditet. . ammer eller planlegger å amme.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte eller reseptfrie medisiner, vitaminer eller urtetilskudd. NSAIDs og noen andre medisiner kan samhandle med hverandre og forårsake alvorlige bivirkninger. Ikke begynn å ta noen ny medisin uten å snakke med helsepersonell først.
Hva er de mulige bivirkningene av NSAIDs?
NSAIDs kan forårsake alvorlige bivirkninger, inkludert:
Se "Hva er den viktigste informasjonen jeg bør vite om medisiner kalt ikke-steroide antiinflammatoriske legemidler (NSAIDs)?"
- . nytt eller verre høyt blodtrykk . hjertefeil . leverproblemer inkludert leversvikt . nyreproblemer inkludert nyresvikt . lavt antall røde blodlegemer (anemi) . livstruende hudreaksjoner . livstruende allergiske reaksjoner
Andre bivirkninger av NSAIDs inkluderer: magesmerter, forstoppelse, diaré, gass, halsbrann, kvalme, oppkast og svimmelhet.
Få nødhjelp umiddelbart hvis du får noen av følgende symptomer:
- . kortpustethet eller problemer med å puste . brystsmerter . svakhet i en del eller side av kroppen din . utydelig tale . hevelse i ansiktet eller halsen
Slutt å ta NSAID og ring legen din med en gang hvis du får noen av følgende symptomer:
- . kvalme . mer sliten eller svakere enn vanlig . diaré . kløe . huden eller øynene dine ser gule ut . fordøyelsesbesvær eller magesmerter . influensalignende symptomer . spy blod . det er blod i avføringen eller den er svart og klissete som tjære . uvanlig vektøkning . hudutslett eller blemmer med feber . hevelse i armer, ben, hender og føtter
Hvis du tar for mye av NSAID-en, ring legen din eller få medisinsk hjelp med en gang.
Dette er ikke alle mulige bivirkninger av NSAIDs. For mer informasjon, spør helsepersonell eller apotek om NSAIDs.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Annen informasjon om NSAIDs:
- . Aspirin er et NSAID, men det øker ikke sjansen for hjerteinfarkt. Aspirin kan forårsake blødninger i hjernen, magen og tarmen. Aspirin kan også forårsake sår i mage og tarm. . Noen NSAIDs selges i lavere doser uten resept (reseptfri). Snakk med helsepersonell før du bruker reseptfrie NSAIDs i mer enn 10 dager.
Generell informasjon om sikker og effektiv bruk av NSAIDs
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk NSAIDs for en tilstand det ikke er foreskrevet for. Ikke gi NSAIDs til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Hvis du vil ha mer informasjon om NSAIDs, snakk med helsepersonell. Du kan spørre apoteket eller helsepersonell om informasjon om NSAIDs som er skrevet for helsepersonell.
Denne medisinveiledningen er godkjent av US Food and Drug Administration.
