Legemidler ved kreft: Nolvadex 10mg, 20mg Tamoxifen Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Nolvadex og hvordan brukes det?
Nolvadex 10mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på brystkreft. Nolvadex kan brukes alene eller sammen med andre medisiner.
Nolvadex 20mg tilhører en klasse legemidler som kalles antineoplastiske, østrogenreseptorantagonister.
Det er ikke kjent om Nolvadex 20mg er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Nolvadex 20mg?
Nolvadex kan forårsake alvorlige bivirkninger, inkludert:
- . synsforandringer, . øyesmerter, . lett blåmerker eller blødninger, . humørsvingninger, . hevelse i ankler eller føtter, og . uvanlig tretthet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Nolvadex inkluderer:
- . hetetokter, . rødme, . endringer i menstruasjonsperioder, . kvalme, . kramper i benet, . magekramper, . beinsmerter, . Muskelsmerte, . hoste, . opphovning, . utmattelse, . hår tynning, . hodepine, . depresjon, og . tap av seksuell evne/interesse (hos menn)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Nolvadex. Spør legen din eller apoteket for mer informasjon.
ADVARSEL
For kvinner med Ductal Carcinoma in Situ (DCIS) og kvinner med høy risiko for brystkreft: Alvorlige og livstruende hendelser assosiert med NOLVADEX (tamoxifencitrat) i risikoreduksjonsinnstillingen (kvinner med høy risiko for kreft og kvinner med DCIS) inkluderer livmorkreft, hjerneslag og lungeemboli. Insidensrater for disse hendelsene ble estimert fra NSABP P-1-studien (se KLINISK FARMAKOLOGI-Kliniske studier - Reduksjon i forekomst av brystkreft hos høyrisikokvinner ). Uterin malignitet består av både endometrieadenokarsinom (insidensrate per 1000 kvinneår på 2,20 for NOLVADEX (tamoxifen citrate) vs 0,71 for placebo) og livmorsarkom (insidensrate per 1000 kvinneår på 0,17tam for NOLVADEX0citrat) (0,17tam for placebo) placebo)*. For slag var insidensraten per 1000 kvinneår 1,43 for NOLVADEX (tamoxifencitrat) vs 1,00 for placebo**. For lungeemboli var insidensraten per 1000 kvinneår 0,75 for NOLVADEX (tamoxifencitrat) mot 0,25 for placebo**.
Noen av slagene, lungeemboliene og livmorkreftene var dødelige.
Helsepersonell bør diskutere de potensielle fordelene versus den potensielle risikoen ved disse alvorlige hendelsene med kvinner med høy risiko for brystkreft og kvinner med DCIS som vurderer NOLVADEX (tamoxifencitrat) for å redusere risikoen for å utvikle brystkreft.
Fordelene med NOLVADEX (tamoxifen citrate) oppveier risikoen hos kvinner som allerede er diagnostisert med brystkreft.
REFERANSER
*Oppdaterte langtidsoppfølgingsdata (median lengde på oppfølging er 6,9 år) fra NSABP P-1 studie. Se ADVARSLER: Effekter på livmor-endometriekreft og livmorsarkom .
**Se tabell 3 under KLINISK FARMAKOLOGI-Kliniske studier .
BESKRIVELSE
NOLVADEX® (tamoxifen citrate) tabletter, et ikke-steroid antiøstrogen, er til oral administrering. NOLVADEX (tamoxifen citrate) tabletter er tilgjengelige som:
10 mg tabletter
Hver tablett inneholder 15,2 mg tamoxifen citrat som tilsvarer 10 mg tamoxifen.
20 mg tabletter
Hver tablett inneholder 30,4 mg tamoxifen citrat som tilsvarer 20 mg tamoxifen.
Inaktive ingredienser: karboksymetylcellulose kalsium, magnesiumstearat, mannitol og stivelse.
Kjemisk sett er NOLVADEX (tamoxifencitrat) trans-isomeren av et trifenyletylenderivat. Det kjemiske navnet er (Z)2-[4-(1,2-difenyl-1-butenyl)fenoksy]-N,N-dimetyletanamin 2-hydroksy-1,2,3-propantrikarboksylat (1:1). De strukturelle og empiriske formlene er:
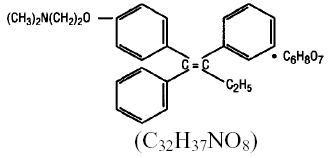
Tamoxifen citrate har en molekylvekt på 563,62, pKa' er 8,85, likevektsløseligheten i vann ved 37°C er 0,5 mg/ml og i 0,02 N HCl ved 37°C er den 0,2 mg/ml.
INDIKASJONER
Metastatisk brystkreft
NOLVADEX (tamoxifen citrate) er effektiv i behandlingen av metastatisk brystkreft hos kvinner og menn. Hos premenopausale kvinner med metastatisk brystkreft er NOLVADEX (tamoxifen citrate) et alternativ til ooforektomi eller ovariebestråling. Tilgjengelig dokumentasjon indikerer at pasienter hvis svulster er østrogenreseptorpositive, har større sannsynlighet for å dra nytte av NOLVADEX (tamoxifencitrat)-behandling.
Adjuvant behandling av brystkreft
NOLVADEX (tamoxifen citrate) er indisert for behandling av nodepositiv brystkreft hos kvinner etter total mastektomi eller segmentell mastektomi, aksillær disseksjon og brystbestråling. I noen NOLVADEX (tamoxifen citrat) adjuvansstudier har mesteparten av fordelen hittil vært i undergruppen med fire eller flere positive aksillære noder.
NOLVADEX (tamoxifen citrate) er indisert for behandling av aksillær node-negativ brystkreft hos kvinner etter total mastektomi eller segmentell mastektomi, aksillær disseksjon og brystbestråling.
Østrogen- og progesteronreseptorverdiene kan bidra til å forutsi hvorvidt adjuvant NOLVADEX (tamoxifen citrat)-behandling sannsynligvis vil være fordelaktig.
NOLVADEX (tamoxifen citrate) reduserer forekomsten av kontralateral brystkreft hos pasienter som får adjuvant NOLVADEX (tamoxifen citrat) behandling for brystkreft.
Duktalt karsinom in situ (DCIS)
Hos kvinner med DCIS, etter brystkirurgi og stråling, er NOLVADEX (tamoxifencitrat) indisert for å redusere risikoen for invasiv brystkreft (se ADVARSEL i boks i begynnelsen av etiketten). Beslutningen om behandling med NOLVADEX (tamoxifen citrat) for å redusere forekomsten av brystkreft bør være basert på en individuell vurdering av fordelene og risikoene ved NOLVADEX (tamoxifen citrat) behandling.
Aktuelle data fra kliniske studier støtter fem års adjuvant NOLVADEX (tamoxifen citrate) behandling for pasienter med brystkreft.
Reduksjon i forekomst av brystkreft hos høyrisikokvinner
NOLVADEX (tamoxifen citrate) er indisert for å redusere forekomsten av brystkreft hos kvinner med høy risiko for brystkreft. Denne effekten ble vist i en studie av 5 års planlagt varighet med en median oppfølging på 4,2 år. 25 prosent av deltakerne fikk stoff i 5 år. De langsiktige effektene er ikke kjent. I denne studien var det ingen innvirkning av tamoxifen på total eller brystkreftrelatert dødelighet (se ADVARSEL i boks i begynnelsen av etiketten).
NOLVADEX (tamoxifen citrate) er kun indisert for kvinner med høy risiko. "Høy risiko" er definert som kvinner minst 35 år med en 5-års predikert risiko for brystkreft ≥ 1,67 %, beregnet av Gail-modellen.
Eksempler på kombinasjoner av faktorer som forutsier en 5-års risiko ≥ 1,67 % er:
Alder 35 eller eldre og en av følgende kombinasjoner av faktorer:
- . En førstegradsslektning med brystkreft i historien, 2 eller flere godartede biopsier og en brystbiopsi som viser atypisk hyperplasi; eller . Minst 2 førstegradsslektninger med en historie med brystkreft, og en personlig historie med minst én brystbiopsi; eller . LCIS
Alder 40 eller eldre og en av følgende kombinasjoner av faktorer:
- . Én førstegradsslektning med brystkreft i historien, 2 eller flere godartede biopsier, alder ved første levende fødsel 25 eller eldre, og alder ved menarche 11 eller yngre; eller . Minst 2 førstegrads slektninger med en historie med brystkreft, og alder ved første levende fødsel 19 eller yngre; eller . En førstegrads slektning med en historie med brystkreft, og en personlig historie med en brystbiopsi som viser atypisk hyperplasi.
Alder 45 eller eldre og en av følgende kombinasjoner av faktorer:
- . Minst 2 førstegradsslektninger med en historie med brystkreft og alder ved første levende fødsel 24 år eller yngre; eller . En førstegrads slektning med brystkreft i historien med en personlig historie med en godartet brystbiopsi, alder ved menarche 11 eller mindre og alder ved første levende fødsel 20 eller mer.
Alder 50 eller eldre og en av følgende kombinasjoner av faktorer:
- . Minst 2 førstegrads slektninger med en historie med brystkreft; eller . Anamnese med en brystbiopsi som viser atypisk hyperplasi, og alder ved første levende fødsel 30 eller eldre og alder ved menarche 11 eller mindre; eller . Anamnese med minst to brystbiopsier med en historie med atypisk hyperplasi, og alder ved første levende fødsel 30 eller mer.
Alder 55 eller eldre og en av følgende kombinasjoner av faktorer:
- . En førstegrads slektning med en historie med brystkreft med en personlig historie med en godartet brystbiopsi og alder ved menarche 11 eller mindre; eller . Anamnese med minst 2 brystbiopsier med en historie med atypisk hyperplasi, og alder ved første levende fødsel 20 eller eldre.
Alder 60 eller eldre og:
- . 5-års predikert risiko for brystkreft ≥ 1,67 %, beregnet av Gail-modellen.
For kvinner hvis risikofaktorer ikke er beskrevet i eksemplene ovenfor, er Gail-modellen nødvendig for å estimere absolutt risiko for brystkreft. Helsepersonell kan få et Gail Model Risk Assessment Tool ved å ringe 1-800-544-2007.
Det er utilstrekkelig data tilgjengelig angående effekten av NOLVADEX (tamoxifencitrat) på brystkreftforekomst hos kvinner med arvelige mutasjoner (BRCA1, BRCA2) til å kunne gi spesifikke anbefalinger om effektiviteten av NOLVADEX (tamoxifencitrat) hos disse pasientene.
Etter en vurdering av risikoen for å utvikle brystkreft, bør beslutningen om behandling med NOLVADEX (tamoxifen citrat) for reduksjon av brystkreftforekomsten baseres på en individuell vurdering av fordelene og risikoene ved NOLVADEX (tamoxifen citrat) behandling. I NSABP P-1-studien reduserte behandling med NOLVADEX (tamoxifencitrat) risikoen for å utvikle brystkreft i løpet av oppfølgingsperioden av studien, men eliminerte ikke risikoen for brystkreft (se tabell 3 i KLINISK FARMAKOLOGI ).
DOSERING OG ADMINISTRASJON
For pasienter med brystkreft er anbefalt daglig dose 20-40 mg. Doser større enn 20 mg per dag bør gis i delte doser (morgen og kveld).
tre adjuvansstudier med enkeltmiddel hos kvinner ble én 10 mg NOLVADEX (tamoxifen citrat) tablett administrert to (ECOG og NATO) eller tre (Toronto) ganger daglig i to år. I NSABP B-14 adjuvant studie på kvinner med node-negativ brystkreft ble én 10 mg NOLVADEX (tamoxifen citrat) tablett gitt to ganger daglig i minst 5 år. Resultatene fra B-14-studien tyder på at fortsettelse av behandlingen utover fem år ikke gir ytterligere fordeler (se KLINISK FARMAKOLOGI ). I EBCTCG 1995-oversikten var reduksjonen i residiv og dødelighet større i de studiene som brukte tamoxifen i ca. 5 år enn i de som brukte tamoxifen i en kortere behandlingsperiode. Det var ingen indikasjoner på at doser større enn 20 mg per dag var mer effektive. Aktuelle data fra kliniske studier støtter 5 års adjuvant NOLVADEX (tamoxifen citrate) behandling for pasienter med brystkreft.
Duktalt karsinom in situ (DCIS)
Anbefalt dose er NOLVADEX (tamoxifen citrat) 20 mg daglig i 5 år.
Reduksjon i forekomst av brystkreft hos høyrisikokvinner
Anbefalt dose er NOLVADEX (tamoxifen citrat) 20 mg daglig i 5 år. Det er ingen data som støtter bruken av NOLVADEX (tamoxifencitrat) annet enn i 5 år (se KLINISK FARMAKOLOGI-Kliniske studier - Reduksjon i forekomst av brystkreft hos høyrisikokvinner ).
HVORDAN LEVERES
10 mg tabletter som inneholder tamoxifen som sitrat i en mengde tilsvarende 10 mg tamoxifen (rund, bikonveks, ubelagt, hvit tablett identifisert med NOLVADEX (tamoxifen citrate) 600 preget på den ene siden og en cameo preget på den andre siden) leveres i flasker med 60 stk. tabletter. NDC 0310-0600-60.
20 mg tabletter som inneholder tamoxifen som sitrat i en mengde tilsvarende 20 mg tamoxifen (rund, bikonveks, ubelagt, hvit tablett identifisert med NOLVADEX (tamoxifen citrate) 604 preget på den ene siden og en cameo preget på den andre siden) leveres i flasker med 30 stk. tabletter. NDC 0310-0604-30.
Oppbevares ved kontrollert romtemperatur, 20-25°C (68-77°F) [se USP]. Fordel i en godt lukket, lysbestandig beholder.
*Coumadin® er et registrert varemerke for Bristol-Myers Squibb Pharmaceuticals. Alle andre varemerker er eiendommen til AstraZeneca-gruppen, AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437. Rev 27-09-05. FDA revisjonsdato: 3/9/2006
BIVIRKNINGER
Bivirkninger av NOLVADEX (tamoxifencitrat) er relativt milde og sjelden alvorlige nok til å kreve seponering av behandling hos brystkreftpasienter.
Fortsatte kliniske studier har resultert i ytterligere informasjon som bedre indikerer forekomsten av bivirkninger med NOLVADEX (tamoxifencitrat) sammenlignet med placebo.
Metastatisk brystkreft
Økt ben- og svulstsmerter og også lokal sykdomsoppbluss har forekommet, som noen ganger er assosiert med god tumorrespons. Pasienter med økte bensmerter kan trenge ytterligere smertestillende midler. Pasienter med bløtvevssykdom kan ha plutselige økninger i størrelsen på eksisterende lesjoner, noen ganger assosiert med markert erytem i og rundt lesjonene og/eller utvikling av nye lesjoner. Når de oppstår, ses beinsmertene eller sykdomsutbruddet kort tid etter oppstart av NOLVADEX (tamoxifencitrat) og avtar vanligvis raskt.
Hos pasienter behandlet med NOLVADEX (tamoxifen citrat) for metastatisk brystkreft, er den hyppigste bivirkningen av NOLVADEX (tamoxifen citrat) hetetokter.
Andre bivirkninger som sees sjelden er hyperkalsemi, perifert ødem, avsmak for mat, pruritus vulvae, depresjon, svimmelhet, ørhet, hodepine, hårtynning og/eller delvis hårtap og vaginal tørrhet.
Premenopausale kvinner
Følgende tabell oppsummerer forekomsten av bivirkninger rapportert med en frekvens på 2 % eller mer fra kliniske studier (Ingle, Pritchard, Buchanan) som sammenlignet NOLVADEX (tamoxifen citrat)-behandling med ovarieablasjon hos premenopausale pasienter med metastatisk brystkreft.
Mannlig brystkreft
NOLVADEX (tamoxifen citrate) tolereres godt hos menn med brystkreft. Rapporter fra litteraturen og kasusrapporter tyder på at sikkerhetsprofilen til NOLVADEX (tamoxifencitrat) hos menn er lik den som er sett hos kvinner. Tap av libido og impotens har resultert i seponering av tamoksifenbehandling hos mannlige pasienter. Også hos oligospermiske menn behandlet med tamoxifen var LH, FSH, testosteron og østrogennivåer forhøyet. Ingen signifikante kliniske endringer ble rapportert.
Adjuvant brystkreft
NSABP B-14-studien ble kvinner med aksillær node-negativ brystkreft randomisert til 5 års NOLVADEX (tamoxifen citrat) 20 mg/dag eller placebo etter primær kirurgi. De rapporterte bivirkningene er tabellert nedenfor (gjennomsnittlig oppfølging på ca. 6,8 år) og viser bivirkninger som er mer vanlige på NOLVADEX (tamoxifencitrat) enn på placebo. Forekomsten av hetetokter (64 % vs. 48 %), vaginal utflod (30 % vs. 15 %) og uregelmessig menstruasjon (25 % vs. 19 %) var høyere med NOLVADEX (tamoxifencitrat) sammenlignet med placebo. Alle andre bivirkninger forekom med lignende frekvens i de 2 behandlingsgruppene, med unntak av trombotiske hendelser; en høyere forekomst ble sett hos pasienter behandlet med NOLVADEX (tamoxifen citrat) (gjennom 5 år, 1,7 % vs. 0,4 %). To av pasientene behandlet med NOLVADEX (tamoxifen citrate) som hadde trombotiske hendelser døde.
Eastern Cooperative Oncology Group (ECOG) adjuvant brystkreftstudie, ble NOLVADEX (tamoxifen citrate) eller placebo administrert i 2 år til kvinner etter mastektomi. Sammenlignet med placebo, viste NOLVADEX (tamoxifen citrate) en signifikant høyere forekomst av hetetokter (19 % vs. 8 % for placebo). Forekomsten av alle andre bivirkninger var lik i de 2 behandlingsgruppene med unntak av trombocytopeni der forekomsten for NOLVADEX (tamoxifencitrat) var 10 % vs. 3 % for placebo, en observasjon av statistisk signifikans på grensen.
andre adjuvante studier, Toronto og NOLVADEX (tamoxifen citrate) Adjuvant Trial Organization (NATO), fikk kvinner enten NOLVADEX (tamoxifen citrate) eller ingen behandling. I Toronto-studien ble hetetokter observert hos 29 % av pasientene for NOLVADEX (tamoxifencitrat) vs. 1 % i den ubehandlede gruppen. I NATO-studien ble hetetokter og vaginal blødning rapportert hos henholdsvis 2,8 % og 2,0 % av kvinnene for NOLVADEX (tamoxifencitrat) vs. 0,2 % for hver i den ubehandlede gruppen.
Anastrozol Adjuvant Trial - Studie av Anastrozol sammenlignet med NOLVADEX (tamoxifen citrate) for adjuvant behandling av tidlig brystkreft (se KLINISK FARMAKOLOGI - kliniske studier).
Ved en median oppfølging på 33 måneder viste ikke kombinasjonen av anastrozol og NOLVADEX (tamoxifencitrat) noen effektfordel sammenlignet med NOLVADEX (tamoxifencitrat)-behandling gitt alene hos alle pasienter så vel som i den hormonreseptorpositive subpopulasjonen. Denne behandlingsarmen ble avviklet fra forsøket. Median varighet av adjuvant behandling for sikkerhetsevaluering var 59,8 måneder og 59,6 måneder for pasienter som fikk henholdsvis anastrozol 1 mg og NOLVADEX (tamoxifen citrat) 20 mg.
Bivirkninger som oppstår med en forekomst på minst 5 % i begge behandlingsgruppene under behandling eller innen 14 dager etter avsluttet behandling er presentert i følgende tabell.
Bivirkninger som oppstår med en forekomst på minst 5 % i begge behandlingsgruppene under behandling, eller innen 14 dager etter avsluttet behandling
Visse bivirkninger og kombinasjoner av bivirkninger ble prospektivt spesifisert for analyse, basert på de kjente farmakologiske egenskapene og bivirkningsprofilene til de to legemidlene (se følgende tabell).
Antall (%) pasienter med forhåndsspesifisert bivirkning i anastrozol-adjuvansstudien1
Pasienter som fikk anastrozol hadde en økning i leddlidelser (inkludert leddgikt, artrose og artralgi) sammenlignet med pasienter som fikk NOLVADEX (tamoxifencitrat). Pasienter som fikk anastrozol hadde en økning i forekomsten av alle frakturer (spesielt brudd i ryggraden, hoften og håndleddet) [315 (10 %)] sammenlignet med pasienter som fikk NOLVADEX (tamoxifencitrat) [209 (7 %)]. Pasienter som fikk anastrozol hadde en reduksjon i hetetokter, vaginal blødning, vaginal utflod, endometriekreft, venøse tromboemboliske hendelser og iskemiske cerebrovaskulære hendelser sammenlignet med pasienter som fikk NOLVADEX (tamoxifencitrat).
Pasienter som fikk NOLVADEX (tamoxifencitrat) hadde en reduksjon i hyperkolesterolemi (108 [3,5 %) sammenlignet med pasienter som fikk anastrozol (278 [9 %)]. Angina pectoris ble rapportert hos 71 [2,3 %] pasienter i anastrozol-armen og 51 [1,6 %] pasienter i NOLVADEX (tamoxifen citrat)-armen; hjerteinfarkt ble rapportert hos 37 [1,2 %] pasienter i anastrozol-armen og hos 34 [1,1 %] pasienter i NOLVADEX (tamoxifen citrat)-armen.
Resultater fra den adjuvante bensubstudien etter 12 og 24 måneder viste at pasienter som fikk anastrozol hadde en gjennomsnittlig reduksjon i både korsryggen og total hoftebenmineraltetthet (BMD) sammenlignet med baseline. Pasienter som fikk NOLVADEX (tamoxifencitrat) hadde en gjennomsnittlig økning i både korsryggen og total hofte-BMD sammenlignet med baseline.
Duktalt karsinom in situ (DCIS)
Typen og frekvensen av bivirkninger i NSABP B-24-studien var i samsvar med de som ble observert i de andre adjuvansstudiene utført med NOLVADEX (tamoxifencitrat).
Reduksjon i forekomst av brystkreft hos høyrisikokvinner
NSABP P-1-studien var det en økning i fem alvorlige bivirkninger i NOLVADEX (tamoxifen citrat)-gruppen: endometriekreft (33 tilfeller i NOLVADEX (tamoxifen citrat)-gruppen vs. 14 i placebogruppen); lungeemboli (18 tilfeller i NOLVADEX (tamoxifen citrat)-gruppen vs. 6 i placebogruppen); dyp venetrombose (30 tilfeller i NOLVADEX (tamoxifen citrate)-gruppen mot 19 i placebogruppen); hjerneslag (34 tilfeller i NOLVADEX (tamoxifen citrate)-gruppen vs. 24 i placebogruppen); kataraktdannelse (540 tilfeller i NOLVADEX (tamoxifen citrat)-gruppen vs. 483 i placebogruppen) og kataraktkirurgi (101 tilfeller i NOLVADEX (tamoxifen citrat)-gruppen vs. 63 i placebogruppen) (Se ADVARSLER og tabell 3 in KLINISK FARMAKOLOGI ).
Følgende tabell viser bivirkningene observert i NSABP P-1 etter behandlingsarm. Bare bivirkninger som er mer vanlige med NOLVADEX (tamoxifencitrat) enn placebo er vist.
NSABP P-1-studien trakk 15,0 % og 9,7 % av deltakerne som fikk henholdsvis NOLVADEX (tamoxifen citrate) og placebo-behandling seg fra studien av medisinske årsaker. Følgende er de medisinske årsakene til å trekke seg fra henholdsvis NOLVADEX (tamoxifencitrat) og placeboterapi: Hetetokter (3,1 % mot 1,5 %) og utflod fra skjeden (0,5 % vs. 0,1 %).
I NSABP P-1-studien trakk 8,7 % og 9,6 % av deltakerne som fikk henholdsvis NOLVADEX (tamoxifen citrate) og placebo-behandling av ikke-medisinske årsaker.
NSABP P-1-studien forekom hetetokter uansett alvorlighetsgrad hos 68 % av kvinnene på placebo og hos 80 % av kvinnene på NOLVADEX (tamoxifencitrat). Alvorlige hetetokter forekom hos 28 % av kvinnene på placebo og 45 % av kvinnene på NOLVADEX (tamoxifencitrat). Vaginal utflod forekom hos 35 % og 55 % av kvinnene på henholdsvis placebo og NOLVADEX (tamoxifencitrat); og var alvorlig hos henholdsvis 4,5 % og 12,3 %. Det var ingen forskjell i forekomsten av vaginal blødning mellom behandlingsarmene.
Pediatriske pasienter - McCune-Albright syndrom
Gjennomsnittlig livmorvolum økte etter 6 måneders behandling og doblet seg ved slutten av den ettårige studien. En årsakssammenheng er ikke fastslått; Imidlertid er det observert en økning i forekomsten av endometrieadenokarsinom og livmorsarkom hos voksne behandlet med NOLVADEX (se ADVARSEL i boks ), anbefales fortsatt overvåking av McCune-Albright-pasienter behandlet med NOLVADEX (tamoxifencitrat) for langtidseffekter. Sikkerheten og effekten av NOLVADEX (tamoxifen citrate) for jenter i alderen to til 10 år med McCune-Albright syndrom og tidlig pubertet har ikke blitt undersøkt etter ett års behandling. Langtidseffektene av NOLVADEX (tamoxifen citrat)-behandling hos jenter er ikke fastslått.
Erfaring etter markedsføring
Mindre hyppig rapporterte bivirkninger er vaginal blødning, vaginal utflod, menstruasjonsuregelmessigheter, hudutslett og hodepine. Vanligvis har disse ikke vært av tilstrekkelig alvorlighetsgrad til å kreve dosereduksjon eller seponering av behandlingen. Svært sjeldne rapporter om erythema multiforme, Stevens-Johnsons syndrom, bulløs pemfigoid, interstitiell pneumonitt og sjeldne rapporter om overfølsomhetsreaksjoner inkludert angioødem har blitt rapportert ved behandling med NOLVADEX (tamoxifencitrat). I noen av disse tilfellene var tiden til utbruddet mer enn ett år. I sjeldne tilfeller kan forhøyede serumtriglyseridnivåer, i noen tilfeller med pankreatitt, være assosiert med bruk av NOLVADEX (tamoxifencitrat) (se FORHOLDSREGLER- Interaksjoner med legemiddel/laboratorietesting seksjon).
NARKOTIKAHANDEL
Når NOLVADEX (tamoxifencitrat) brukes i kombinasjon med antikoagulantia av kumarintype, kan det oppstå en signifikant økning i antikoagulasjonseffekten. Der slik samtidig administrering eksisterer, anbefales nøye overvåking av pasientens protrombintid.
I NSABP P-1-studien var kvinner som trengte antikoagulantia av kumarin-type av en eller annen grunn ikke kvalifisert for å delta i studien (se KONTRAINDIKASJONER ).
Det er økt risiko for tromboemboliske hendelser når cytotoksiske midler brukes i kombinasjon med NOLVADEX (tamoxifencitrat).
Tamoxifen reduserte plasmakonsentrasjonen av letrozol med 37 %. Effekten av tamoxifen på metabolisme og utskillelse av andre antineoplastiske legemidler, som cyklofosfamid og andre legemidler som krever oksidaser med blandet funksjon for aktivering, er ikke kjent. Plasmakonsentrasjoner av tamoksifen og N-desmetyltamoxifen har vist seg å bli redusert ved samtidig administrering med rifampin eller aminoglutetimid. Induksjon av CYP3A4-mediert metabolisme anses å være mekanismen for disse reduksjonene; andre CYP3A4-induserende midler er ikke studert for å bekrefte denne effekten.
En pasient som fikk NOLVADEX (tamoxifencitrat) med fenobarbital samtidig viste et steady state serumnivå av tamoxifen lavere enn det som ble observert for andre pasienter (dvs. 26 ng/ml vs. gjennomsnittsverdi på 122 ng/ml). Den kliniske betydningen av dette funnet er imidlertid ikke kjent. Rifampin induserte metabolismen av tamoxifen og reduserte plasmakonsentrasjonen av tamoxifen signifikant hos 10 pasienter. Aminoglutetimid reduserer plasmakonsentrasjonene av tamoxifen og N-desmetyltamoxifen. Medroksyprogesteron reduserer plasmakonsentrasjonen av N-desmetyl, men ikke tamoxifen.
Samtidig bromokriptinbehandling har vist seg å øke serumtamoxifen og N-desmetyltamoxifen.
Basert på kliniske og farmakokinetiske resultater fra anastrozol-adjuvansstudien, bør NOLVADEX (tamoxifencitrat) ikke administreres sammen med anastrozol (se KLINISK FARMAKOLOGI - Legemiddel-legemiddelinteraksjoner seksjon).
Interaksjoner med legemiddel-/laboratorietesting
Under overvåking etter markedsføring ble T4-økninger rapportert for noen få postmenopausale pasienter, noe som kan forklares med økning i thyreoideabindende globulin. Disse økningene ble ikke ledsaget av klinisk hypertyreose.
Variasjoner i den karyopyknotiske indeksen på vaginale utstryk og ulike grader av østrogeneffekt på celleprøver er sjelden sett hos postmenopausale pasienter som har fått NOLVADEX (tamoxifencitrat).
Etter markedsføringen av NOLVADEX (tamoxifen citrat) har sjeldne tilfeller av hyperlipidemier blitt rapportert. Periodisk overvåking av plasmatriglyserider og kolesterol kan være indisert hos pasienter med eksisterende hyperlipidemier (se pkt. BIVIRKNINGER – Opplevelse etter markedsføring seksjon).
ADVARSLER
Effekter hos pasienter med metastaserende brystkreft
Som med annen additiv hormonbehandling (østrogener og androgener), har hyperkalsemi blitt rapportert hos enkelte brystkreftpasienter med skjelettmetastaser innen noen få uker etter oppstart av behandling med NOLVADEX (tamoxifencitrat). Hvis hyperkalsemi oppstår, bør passende tiltak iverksettes, og dersom det er alvorlig, bør NOLVADEX (tamoxifencitrat) seponeres.
Effekter på livmor-endometriekreft og livmorsarkom
Økt forekomst av uterine maligniteter er rapportert i forbindelse med NOLVADEX (tamoxifen citrat) behandling. Den underliggende mekanismen er ukjent, men kan være relatert til den østrogenlignende effekten av NOLVADEX (tamoxifencitrat). De fleste uterine maligniteter sett i forbindelse med NOLVADEX (tamoxifen citrat) er klassifisert som adenokarsinom i endometrium. Imidlertid har sjeldne livmorsarkomer, inkludert maligne blandede mullerian-svulster (MMMT), også blitt rapportert. Uterin sarkom er generelt assosiert med et høyere FIGO-stadium (III/IV) ved diagnose, dårligere prognose og kortere overlevelse. Uterin sarkom har blitt rapportert å forekomme hyppigere blant langtidsbrukere (≥ 2 år) av NOLVADEX (tamoxifen citrat) enn ikke-brukere. Noen av livmorkreftene (endometriekarsinom eller livmorsarkom) har vært dødelige.
NSABP P-1 studien, blant deltakere randomisert til NOLVADEX (tamoxifen citrat) var det en statistisk signifikant økning i forekomsten av endometriekreft (33 tilfeller av invasiv endometriekreft, sammenlignet med 14 tilfeller blant deltakere randomisert til placebo (RR=2,48) , 95 % KI: 1,27-4,92). De 33 tilfellene hos deltakere som fikk NOLVADEX (tamoxifen citrat) var FIGO stadium I, inkludert 20 IA, 12 IB og 1 IC endometriale adenokarsinomer. Hos deltakere randomisert til placebo, var Stage I FIGO (8 IA og 5 IB) og 1 var FIGO Stage IV. Fem kvinner på NOLVADEX (tamoxifen citrate) og 1 på placebo fikk postoperativ strålebehandling i tillegg til kirurgi. Denne økningen ble først og fremst observert blant kvinner minst 50 år ved tidspunkt for randomisering (26 tilfeller av invasiv endometriekreft, sammenlignet med 6 tilfeller blant deltakere randomisert til placebo (RR=4,50, 95 % KI: 1,78-13,16). Blant kvinner ≤ 49 år på randomiseringstidspunktet var det 7 tilfeller av i nvasiv endometriekreft, sammenlignet med 8 tilfeller blant deltakere randomisert til placebo (RR=0,94, 95 % KI: 0,28-2,89). Hvis alder på diagnosetidspunktet vurderes, var det 4 tilfeller av endometriekreft blant deltakerne ≤ 49 randomisert til NOLVADEX (tamoxifen citrat) sammenlignet med 2 blant deltakerne randomisert til placebo (RR=2,21, 95 % KI: 0,4-12,0). For kvinner ≥ 50 ved diagnosetidspunktet var det 29 tilfeller blant deltakerne randomisert til NOLVADEX (tamoxifencitrat) sammenlignet med 12 blant kvinner på placebo (RR=2,5, 95 % KI: 1,3-4,9). Risikoforholdene var like i de to gruppene, selv om færre hendelser forekom hos yngre kvinner. De fleste (29 av 33 tilfeller i NOLVADEX (tamoxifen citrat)-gruppen) endometriekreft ble diagnostisert hos symptomatiske kvinner, selv om 5 av 33 tilfeller i NOLVADEX (tamoxifen citrat)-gruppen forekom hos asymptomatiske kvinner. Blant kvinner som fikk NOLVADEX (tamoxifencitrat) oppsto hendelsene mellom 1 og 61 måneder (gjennomsnitt=32 måneder) fra behandlingsstart.
en oppdatert gjennomgang av langtidsdata (median lengde på total oppfølging er 6,9 år, inkludert blindet oppfølging) på 8 306 kvinner med en intakt livmor ved randomisering i NSABP P-1 risikoreduksjonsstudien, viser forekomsten av begge adenokarsinomer og sjeldne livmorsarkomer ble økt hos kvinner som tok NOLVADEX (tamoxifencitrat). Under blind oppfølging var det 36 tilfeller av FIGO Stage I endometrieadenokarsinom (22 var FIGO Stage IA, 13 IB og 1 IC) hos kvinner som fikk NOLVADEX (tamoxifen citrat) og 15 tilfeller hos kvinner som fikk placebo [14 var FIGO Stage I (9 IA og 5 IB), og 1 tilfelle var FIGO Stage IV]. Av pasientene som fikk NOLVADEX (tamoxifencitrat) og utviklet endometriekreft, fikk en med stadium IA og 4 med stadium IB kreft strålebehandling. I placebogruppen fikk en pasient med FIGO Stage 1B-kreft strålebehandling og pasienten med FIGO Stage IVB-kreft fikk kjemoterapi og hormonbehandling. Under total oppfølging ble endometrieadenokarsinom rapportert hos 53 kvinner randomisert til NOLVADEX (tamoxifen citrat) (30 tilfeller av FIGO Stage IA, 20 var Stage IB, 1 var Stage IC og 2 var Stage IIIC), og 17 kvinner randomisert til placebo (9 tilfeller var FIGO Stage IA, 6 var Stage IB, 1 var Stage IIIC og 1 var Stage IVB) (insidens per 1000 kvinneår på henholdsvis 2,20 og 0,71). Noen pasienter fikk postoperativ strålebehandling i tillegg til kirurgi. Livmorsarkomer ble rapportert hos 4 kvinner randomisert til NOLVADEX (tamoxifencitrat) (1 var FIGO IA, 1 var FIGO IB, 1 var FIGO IIA og 1 var FIGO IIIC) og en pasient randomisert til placebo (FIGO 1A); insidens per 1000 kvinneår på henholdsvis 0,17 og 0,04. Av pasientene som ble randomisert til NOLVADEX (tamoxifencitrat), var FIGO IA- og IB-tilfellene henholdsvis MMMT og sarkom; FIGO II var en MMMT; og FIGO III var et sarkom; og den ene pasienten randomisert til placebo hadde en MMMT. En lignende økt forekomst av endometrieadenokarsinom og livmorsarkom ble observert blant kvinner som fikk NOLVADEX (tamoxifen citrat) i fem andre NSABP kliniske studier.
Alle pasienter som får eller tidligere har mottatt NOLVADEX (tamoxifencitrat) som rapporterer unormal vaginal blødning, bør evalueres umiddelbart. Pasienter som får eller tidligere har fått NOLVADEX (tamoxifen citrat) bør gjennomgå årlige gynekologiske undersøkelser og de bør umiddelbart informere legen sin dersom de opplever unormale gynekologiske symptomer, f.eks. menstruasjonsuregelmessigheter, unormale vaginale blødninger, endringer i vaginal utflod eller bekkensmerter eller press.
I P-1-studien endret ikke endometrieprøvetaking påvisningsraten for endometriekreft sammenlignet med kvinner som ikke gjennomgikk endometrieprøvetaking (0,6 % med prøvetaking, 0,5 % uten prøvetaking) for kvinner med en intakt livmor. Det er ingen data som tyder på at rutinemessig endometrieprøvetaking hos asymptomatiske kvinner som tar NOLVADEX (tamoxifencitrat) for å redusere forekomsten av brystkreft vil være fordelaktig.
Ikke-maligne effekter på livmoren
En økt forekomst av endometrieforandringer inkludert hyperplasi og polypper er rapportert i forbindelse med NOLVADEX (tamoxifen citrat) behandling. Forekomsten og mønsteret av denne økningen tyder på at den underliggende mekanismen er relatert til de østrogene egenskapene til NOLVADEX (tamoxifencitrat).
Det har vært noen få rapporter om endometriose og uterine fibroider hos kvinner som får NOLVADEX (tamoxifencitrat). Den underliggende mekanismen kan skyldes den delvise østrogene effekten av NOLVADEX (tamoxifencitrat). Ovariecyster har også blitt observert hos et lite antall premenopausale pasienter med avansert brystkreft som har blitt behandlet med NOLVADEX (tamoxifencitrat).
NOLVADEX (tamoxifen citrate) er rapportert å forårsake menstruasjonsuregelmessighet eller amenoré.
Tromboemboliske effekter av NOLVADEX (tamoxifen citrat)
Det er bevis på økt forekomst av tromboemboliske hendelser, inkludert dyp venetrombose og lungeemboli, under NOLVADEX (tamoxifen citrat)-behandling. Når NOLVADEX (tamoxifen citrat) administreres sammen med kjemoterapi, kan det være en ytterligere økning i forekomsten av tromboemboliske effekter. For behandling av brystkreft bør risikoen og fordelene ved NOLVADEX (tamoxifencitrat) vurderes nøye hos kvinner med tromboemboliske hendelser i anamnesen. I en liten delstudie (N=81) av NSABP P-1 studien, så det ut til at det ikke var noen fordel å screene kvinner for faktor V Leiden og protrombin mutasjoner G20210A som et middel til å identifisere de som kanskje ikke er passende kandidater for NOLVADEX (tamoxifen) sitrat) terapi.
Data fra NSABP P-1-studien viser at deltakere som fikk NOLVADEX (tamoxifencitrat) uten en historie med lungeemboli (PE) hadde en statistisk signifikant økning i lungeemboli (18-NOLVADEX (tamoxifencitrat), 6-placebo, RR=3,01 95 % KI: 1,15-9,27). Tre av lungeemboliene, alle i NOLVADEX (tamoxifen citrat)-armen, var dødelige. Åttisju prosent av tilfellene av lungeemboli oppstod hos kvinner minst 50 år gamle ved randomisering. Blant kvinner som fikk NOLVADEX (tamoxifencitrat), dukket hendelsene opp mellom 2 og 60 måneder (gjennomsnitt=27 måneder) fra behandlingsstart.
denne samme populasjonen ble det sett en ikke-statistisk signifikant økning i dyp venetrombose (DVT) i NOLVADEX (tamoxifen citrate)-gruppen (30-NOLVADEX (tamoxifen citrate), 19-placebo; RR=1,59, 95 % KI: 0,86 -2,98). Den samme økningen i relativ risiko ble sett hos kvinner ≤ 49 og hos kvinner ≥ 50, selv om færre hendelser forekom hos yngre kvinner. Kvinner med tromboemboliske hendelser var i faresonen for en andre relatert hendelse (7 av 25 kvinner på placebo, 5 av 48 kvinner på NOLVADEX (tamoxifen citrat)) og hadde risiko for komplikasjoner av hendelsen og dens behandling (0/25 på placebo, 4/48 på NOLVADEX (tamoxifen citrate) ). Blant kvinner som fikk NOLVADEX (tamoxifencitrat), oppstod dype venetrombosehendelser mellom 2 og 57 måneder (gjennomsnitt=19 måneder) fra behandlingsstart.
Det var en ikke-statistisk signifikant økning i hjerneslag blant pasienter randomisert til NOLVADEX (tamoxifencitrat) (24-Placebo; 34-NOLVADEX (tamoxifencitrat); RR=1,42; 95 % KI 0,82-2,51). Seks av de 24 slagene i placebogruppen ble ansett som hemorragiske og 10 av de 34 slagene i NOLVADEX-gruppen (tamoxifencitrat) ble kategorisert som hemorragiske. Sytten av de 34 slagene i NOLVADEX (tamoxifen citrat)-gruppen ble ansett som okklusive og 7 ble ansett for å ha ukjent etiologi. Fjorten av de 24 slagene på placeboarmen ble rapportert å være okklusive og 4 med ukjent etiologi. Blant disse slagene var 3 slag i placebogruppen og 4 slag i NOLVADEX-gruppen (tamoxifencitrat) dødelige. Åttiåtte prosent av slagene skjedde hos kvinner som var minst 50 år gamle på randomiseringstidspunktet. Blant kvinner som fikk NOLVADEX (tamoxifencitrat), skjedde hendelsene mellom 1 og 63 måneder (gjennomsnitt=30 måneder) fra behandlingsstart.
Effekter på leveren: Leverkreft
I den svenske studien med adjuvans NOLVADEX (tamoxifen citrate) 40 mg/dag i 2-5 år, er det rapportert 3 tilfeller av leverkreft i NOLVADEX (tamoxifen citrat)-behandlet gruppe vs. 1 tilfelle i observasjonsgruppen (se FORHOLDSREGLER- Karsinogenese ). I andre kliniske studier som evaluerer NOLVADEX (tamoxifencitrat), er det hittil ikke rapportert noen tilfeller av leverkreft.
Ett tilfelle av leverkreft ble rapportert i NSABP P-1 hos en deltaker randomisert til NOLVADEX (tamoxifencitrat).
Effekter på leveren: Ikke-maligne effekter
NOLVADEX (tamoxifencitrat) har vært assosiert med endringer i leverenzymnivåer, og i sjeldne tilfeller, et spekter av mer alvorlige leveravvik, inkludert fettlever, kolestase, hepatitt og levernekrose. Noen få av disse alvorlige tilfellene inkluderte dødsfall. I de fleste rapporterte tilfeller er forholdet til NOLVADEX (tamoxifencitrat) usikkert. Det er imidlertid rapportert om noen positive re- og dechallenges.
I NSABP P-1-studien ble det observert få grad 3-4 endringer i leverfunksjon (SGOT, SGPT, bilirubin, alkalisk fosfatase) (10 på placebo og 6 på NOLVADEX (tamoxifen citrat) ). Serumlipider ble ikke systematisk samlet.
Andre kreftformer
En rekke andre primære svulster, som forekommer på andre steder enn endometriet, er rapportert etter behandling av brystkreft med NOLVADEX (tamoxifen citrat) i kliniske studier. Data fra NSABP B-14- og P-1-studiene viser ingen økning i andre (ikke-uterin) kreftformer blant pasienter som får NOLVADEX (tamoxifencitrat). Hvorvidt en økt risiko for andre (ikke-livmor) kreftformer er assosiert med NOLVADEX (tamoxifen citrat) er fortsatt usikkert og blir fortsatt evaluert.
Effekter på øyet
Øyeforstyrrelser, inkludert hornhinneforandringer, reduksjon i fargesynspersepsjon, retinal venetrombose og retinopati er rapportert hos pasienter som får NOLVADEX (tamoxifencitrat). Økt forekomst av grå stær og behov for kataraktkirurgi er rapportert hos pasienter som får NOLVADEX (tamoxifencitrat).
NSABP P-1-studien var en økt risiko for borderline signifikans for utvikling av grå stær blant de kvinnene uten grå stær ved baseline (540-NOLVADEX (tamoxifen citrate); 483-placebo; RR=1,13, 95 % KI: 1,00-1,28) observert. Blant disse samme kvinnene var NOLVADEX (tamoxifen citrate) assosiert med økt risiko for å ha grå stær (101-NOLVADEX (tamoxifen citrate); 63-placebo; RR=1,62, 95 % KI 1,18-2,22) (se tabell 3 i KLINISK FARMAKOLOGI ). Blant alle kvinnene i studien (med eller uten grå stær ved baseline), var NOLVADEX (tamoxifen citrat) assosiert med økt risiko for å ha kataraktkirurgi (201-NOLVADEX (tamoxifen citrate); 129-placebo; RR=1,58, 95 % CI 1,26-1,97). Det var ikke nødvendig med øyeundersøkelser under studien. Ingen andre konklusjoner angående oftalmiske hendelser uten katarakt kan trekkes.
Graviditetskategori D
NOLVADEX (tamoxifen citrate) kan forårsake fosterskader når det administreres til en gravid kvinne. Kvinner bør rådes til ikke å bli gravide mens de tar NOLVADEX (tamoxifen citrat) eller innen 2 måneder etter seponering av NOLVADEX (tamoxifen citrat) og bør bruke barriere eller ikke-hormonelle prevensjonsmidler hvis de er seksuelt aktive. Tamoxifen forårsaker ikke infertilitet, selv i nærvær av menstruasjonsuregelmessigheter. Effekter på reproduktive funksjoner forventes fra stoffets antiøstrogene egenskaper. I reproduksjonsstudier på rotter ved dosenivåer lik eller under human dose, ble ikke-teratogene utviklingsskelettforandringer sett og ble funnet reversible. I tillegg, i fertilitetsstudier på rotter og i teratologistudier på kaniner med doser på eller under de som ble brukt hos mennesker, ble det observert en lavere forekomst av embryoimplantasjon og en høyere forekomst av fosterdød eller forsinket vekst i utero, med langsommere læringsatferd hos noen rotteunger sammenlignet med historiske kontroller. Flere drektige silkeabber ble dosert med 10 mg/kg/dag (omtrent 2 ganger den daglige maksimale anbefalte humane dosen på mg/m²-basis) under organogenese eller i siste halvdel av svangerskapet. Ingen deformasjoner ble sett, og selv om dosen var høy nok til å avslutte drektigheten hos noen dyr, viste de som opprettholdt drektigheten ingen tegn på teratogene misdannelser.
gnagermodeller for utvikling av fosterets reproduksjonskanal, forårsaket tamoksifen (ved doser 0,002 til 2,4 ganger den daglige maksimale anbefalte humane dosen på mg/m²-basis) endringer hos begge kjønn som ligner de som forårsakes av østradiol, etynylestradiol og dietylstilbestrol. Selv om den kliniske relevansen av disse endringene er ukjent, ligner noen av disse endringene, spesielt vaginal adenose, de som er sett hos unge kvinner som ble eksponert for dietylstilbestrol in utero og som har en risiko på 1 av 1000 for å utvikle klarcellet adenokarsinom av skjeden eller livmorhalsen. Til dags dato har det ikke vist seg at eksponering for tamoksifen forårsaker vaginal adenose, eller klarcellet adenokarsinom i skjeden eller livmorhalsen, hos unge kvinner. Imidlertid har bare et lite antall unge kvinner blitt eksponert for tamoxifen in utero, og et mindre antall har blitt fulgt lenge nok (til alderen 15-20) for å avgjøre om vaginal eller cervikal neoplasi kan oppstå som et resultat av denne eksponeringen.
Det finnes ingen tilstrekkelige og godt kontrollerte studier av tamoxifen hos gravide kvinner. Det har vært et lite antall rapporter om vaginal blødning, spontane aborter, fødselsskader og fosterdød hos gravide kvinner. Hvis dette legemidlet brukes under graviditet, eller pasienten blir gravid mens du tar dette legemidlet, eller innen ca. to måneder etter avsluttet behandling, bør pasienten informeres om den potensielle risikoen for fosteret, inkludert den potensielle langsiktige risikoen for en DES- som syndrom.
Reduksjon i forekomst av brystkreft hos høyrisikokvinner – Graviditetskategori D
For seksuelt aktive kvinner i fertil alder bør behandling med NOLVADEX (tamoxifen citrat) startes under menstruasjon. Hos kvinner med menstruasjonsuregelmessigheter er negativ B-HCG rett før behandlingsstart tilstrekkelig (se FORHOLDSREGLER-INFORMASJON FOR PASIENTER - Reduksjon i forekomst av brystkreft hos høyrisikokvinner ).
FORHOLDSREGLER
Generell
Nedgang i antall blodplater, vanligvis til 50 000-100 000/mm³, sjelden lavere, er av og til rapportert hos pasienter som tar NOLVADEX (tamoxifencitrat) mot brystkreft. Hos pasienter med betydelig trombocytopeni har sjeldne blødningsepisoder forekommet, men det er usikkert om disse episodene skyldes NOLVADEX (tamoxifencitrat)-behandling. Leukopeni har blitt observert, noen ganger i forbindelse med anemi og/eller trombocytopeni. Det har vært sjeldne rapporter om nøytropeni og pancytopeni hos pasienter som får NOLVADEX (tamoxifencitrat); dette kan noen ganger være alvorlig.
I NSABP P-1 studien opplevde 6 kvinner på NOLVADEX (tamoxifen citrat) og 2 på placebo grad 3-4 fall i blodplatetall (≤ 50 000/mm³).
Informasjon til pasienter
Pasienter bør instrueres til å lese Medisinveiledning leveres i henhold til loven når NOLVADEX 10mg dispenseres. Den komplette teksten til Medisinveiledning er trykket på nytt på slutten av dette dokumentet.
Reduksjon i invasiv brystkreft og DCIS hos kvinner med DCIS
Kvinner med DCIS behandlet med lumpektomi og strålebehandling som vurderer NOLVADEX (tamoxifencitrat) for å redusere forekomsten av en ny brystkrefthendelse, bør vurdere risikoen og fordelene ved behandlingen, siden behandling med NOLVADEX (tamoxifencitrat) reduserte forekomsten av invasiv brystkreft. kreft, men har ikke vist seg å påvirke overlevelse (se tabell 1 i KLINISK FARMAKOLOGI ).
Reduksjon i forekomst av brystkreft hos høyrisikokvinner
Kvinner som har høy risiko for brystkreft kan vurdere å ta NOLVADEX (tamoxifen citrat)-behandling for å redusere forekomsten av brystkreft. Hvorvidt fordelene med behandling anses å oppveie risikoen avhenger av en kvinnes personlige helsehistorie og hvordan hun veier fordelene og risikoene. NOLVADEX (tamoxifen citrate)-behandling for å redusere forekomsten av brystkreft er derfor kanskje ikke egnet for alle kvinner med høy risiko for brystkreft. Kvinner som vurderer behandling med NOLVADEX (tamoxifencitrat) bør konsultere helsepersonell for en vurdering av de potensielle fordelene og risikoene før de starter behandling for reduksjon i forekomst av brystkreft (se tabell 3 i KLINISK FARMAKOLOGI ). Kvinner bør forstå at NOLVADEX (tamoxifencitrat) reduserer forekomsten av brystkreft, men kanskje ikke eliminerer risikoen. NOLVADEX (tamoxifencitrat) reduserte forekomsten av små østrogenreseptorpositive svulster, men endret ikke forekomsten av østrogenreseptornegative svulster eller større svulster. Hos kvinner med brystkreft som har høy risiko for å utvikle en ny brystkreft, reduserte behandling med ca. 5 år med NOLVADEX (tamoxifencitrat) den årlige forekomsten av en ny brystkreft med ca. 50 %.
Kvinner som er gravide eller planlegger å bli gravide bør ikke ta NOLVADEX (tamoxifencitrat) for å redusere risikoen for brystkreft. Effektiv ikke-hormonell prevensjon må brukes av alle premenopausale kvinner som tar NOLVADEX (tamoxifencitrat) og i ca. to måneder etter avsluttet behandling dersom de er seksuelt aktive. Tamoxifen forårsaker ikke infertilitet, selv i nærvær av menstruasjonsuregelmessigheter. For seksuelt aktive kvinner i fertil alder bør behandling med NOLVADEX (tamoxifen citrat) startes under menstruasjon. Hos kvinner med menstruasjonsuregelmessigheter er negativ B-HCG rett før behandlingsstart tilstrekkelig (se ADVARSLER - Graviditetskategori D ).
To europeiske studier av tamoxifen for å redusere risikoen for brystkreft ble utført og viste ingen forskjell i antall brystkrefttilfeller mellom tamoxifen- og placeboarmen. Disse studiene hadde forsøksdesign som skilte seg fra NSABP P-1, var mindre enn NSABP P-1, og inkluderte kvinner med lavere risiko for brystkreft enn de i P-1.
Overvåking under NOLVADEX (tamoxifen citrate) terapi
Kvinner som tar eller tidligere har tatt NOLVADEX (tamoxifencitrat) bør instrueres om å søke øyeblikkelig legehjelp for nye brystklumper, vaginale blødninger, gynekologiske symptomer (menstruasjonsuregelmessigheter, endringer i vaginal utflod eller bekkensmerter eller trykk), symptomer på hevelse i bena eller ømhet, uforklarlig kortpustethet eller endringer i synet. Kvinner bør informere alle omsorgsgivere, uavhengig av årsaken til evalueringen, om at de tar NOLVADEX (tamoxifencitrat).
Kvinner som tar NOLVADEX (tamoxifencitrat) for å redusere forekomsten av brystkreft, bør gjennomgå en brystundersøkelse, en mammografi og en gynekologisk undersøkelse før oppstart av behandlingen. Disse studiene bør gjentas med jevne mellomrom under behandling, i tråd med god medisinsk praksis. Kvinner som tar NOLVADEX (tamoxifencitrat) som adjuvant brystkreftbehandling bør følge de samme overvåkingsprosedyrene som for kvinner som tar NOLVADEX (tamoxifencitrat) for å redusere forekomsten av brystkreft. Kvinner som tar NOLVADEX (tamoxifen citrat) som behandling for metastatisk brystkreft, bør gjennomgå denne overvåkingsplanen med sin behandler og velge passende modaliteter og tidsplan for evaluering.
Laboratorietester
Periodiske fullstendige blodtellinger, inkludert blodplatetall, og periodiske leverfunksjonsprøver bør innhentes.
Under ATAC-studien ble flere pasienter som fikk anastrozol rapportert å ha forhøyet serumkolesterol sammenlignet med pasienter som fikk NOLVADEX (tamoxifencitrat) (henholdsvis 9 % versus 3,5 %).
Karsinogenese
En konvensjonell karsinogenesestudie på rotter ved doser på 5, 20 og 35 mg/kg/dag (omtrent én, tre og syv ganger den daglige maksimale anbefalte dosen til mennesker på mg/m²-basis) administrert ved oral sonde i opptil 2 år ) avslørte en signifikant økning i hepatocellulært karsinom ved alle doser. Forekomsten av disse svulstene var signifikant høyere blant rotter som fikk 20 eller 35 mg/kg/dag (69 %) sammenlignet med de som fikk 5 mg/kg/dag (14 %). I en separat studie ble rotter administrert tamoksifen med 45 mg/kg/dag (omtrent ni ganger den daglige maksimale anbefalte humane dosen på mg/m²-basis); hepatocellulær neoplasi ble vist etter 3 til 6 måneder.
Granulosacelle ovarietumorer og interstitielle celle testikkeltumorer ble observert i to separate musestudier. Musene ble administrert de trans- og racemiske formene av tamoxifen i 13 til 15 måneder i doser på 5, 20 og 50 mg/kg/dag (omtrent halvparten, to og fem ganger den daglige anbefalte humane dosen på en mg/m² basis).
Mutagenese
Det ble ikke funnet noe genotoksisk potensial i et konvensjonelt batteri av in vivo og in vitro tester med pro- og eukaryote testsystemer med legemiddelmetaboliserende systemer. Økte nivåer av DNA-addukter ble imidlertid observert ved 32P etter-merking i DNA fra rottelever og dyrkede humane lymfocytter. Tamoxifen har også vist seg å øke nivåene av mikronukleusdannelse in vitro i human lymfoblastoidcellelinje (MCL-5). Basert på disse funnene er tamoxifen genotoksisk i gnagere og humane MCL-5-celler.
Nedsatt fertilitet
Tamoxifen forårsaket svekkelse av fertilitet og unnfangelse hos hunnrotter ved doser på 0,04 mg/kg/dag (omtrent 0,01 ganger den daglige maksimale anbefalte humane dosen på mg/m²-basis) ved dosering i to uker før paring til og med dag 7 av svangerskapet . Ved denne dosen ble fertilitets- og reproduksjonsindeksene markant redusert med total fosterdødelighet. Fosterdødeligheten ble også økt ved doser på 0,16 mg/kg/dag (omtrent 0,03 ganger den daglige maksimale anbefalte humane dosen på mg/m²-basis) når hunnrotter ble doseret fra dag 7-17 av svangerskapet. Tamoxifen ga abort, for tidlig fødsel og fosterdød hos kaniner som fikk doser lik eller større enn 0,125 mg/kg/dag (omtrent 0,05 ganger den daglige maksimale anbefalte humane dosen på mg/m²-basis). Det var ingen teratogene endringer hos verken rotter eller kaniner.
Graviditetskategori D
Se ADVARSLER .
Ammende mødre
Tamoxifen er rapportert å hemme amming. To placebokontrollerte studier på over 150 kvinner har vist at tamoksifen hemmer tidlig melkeproduksjon etter fødselen betydelig. I begge studiene ble tamoksifen administrert innen 24 timer etter levering i mellom 5 og 18 dager. Effekten av tamoxifen på etablert melkeproduksjon er ikke kjent.
Det er ingen data som viser hvorvidt tamoxifen skilles ut i morsmelk. Hvis det utskilles, er det ingen data angående effekten av tamoxifen i morsmelk på spedbarn eller dyr som ammes. Direkte neonatal eksponering av tamoksifen til mus og rotter (ikke via morsmelk) ga imidlertid 1) reproduksjonsskader hos kvinnelige gnagere (liknende de som sees hos mennesker etter intrauterin eksponering for dietylstilbestrol) og 2) funksjonelle defekter i reproduksjonskanalen hos hanner. gnagere som testikkelatrofi og arrestasjon av spermatogenese.
Det er ikke kjent om NOLVADEX (tamoxifencitrat) skilles ut i morsmelk. På grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn fra NOLVADEX (tamoxifen citrat), bør kvinner som tar NOLVADEX (tamoxifen citrat) ikke amme.
Reduksjon i forekomst av brystkreft hos høyrisikokvinner med DCIS
Det er ikke kjent om NOLVADEX (tamoxifencitrat) skilles ut i morsmelk. På grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn fra NOLVADEX (tamoxifen citrat), bør kvinner som tar NOLVADEX (tamoxifen citrat) ikke amme.
Pediatrisk bruk
Sikkerheten og effekten av NOLVADEX (tamoxifen citrate) for jenter i alderen to til 10 år med McCune-Albright syndrom og tidlig pubertet har ikke blitt undersøkt etter ett års behandling. Langtidseffektene av NOLVADEX (tamoxifen citrate) behandling for jenter er ikke fastslått. Hos voksne behandlet med NOLVADEX (tamoxifen citrat) er det observert en økning i forekomsten av uterine maligniteter, slag og lungeemboli (se ADVARSEL i boks , og KLINISK FARMAKOLOGI-Kliniske studier-McCune-Albright syndrom underseksjon).
Geriatrisk bruk
NSABP P-1-studien var prosentandelen kvinner minst 65 år 16 %. Kvinner over 70 år utgjorde 6 % av deltakerne. En reduksjon i brystkreftforekomst ble sett blant deltakere i hver av undergruppene: Totalt ble det sett 28 og 10 invasive brystkreftformer blant deltakere 65 og eldre i henholdsvis placebo- og NOLVADEX-gruppene (tamoxifencitrat). På tvers av alle andre utfall gjenspeiler resultatene i denne undergruppen resultatene observert i undergruppen av kvinner som er minst 50 år gamle. Ingen generelle forskjeller i tolerabilitet ble observert mellom eldre og yngre pasienter (se KLINISK FARMAKOLOGI - Kliniske studier - Reduksjon i forekomst av brystkreft hos høyrisikokvinner seksjon).
NSABP B-24-studien var prosentandelen kvinner minst 65 år 23 %. Kvinner over 70 år utgjorde 10 % av deltakerne. Totalt 14 og 12 invasive brystkreftformer ble sett blant deltakere 65 og eldre i henholdsvis placebo- og NOLVADEX-gruppene (tamoxifencitrat). Denne undergruppen er for liten til å trekke noen konklusjoner om effekt. På tvers av alle andre endepunkter var resultatene i denne undergruppen sammenlignbare med resultatene til yngre kvinner som ble registrert i denne studien. Ingen generelle forskjeller i tolerabilitet ble observert mellom eldre og yngre pasienter.
OVERDOSE
Tegn observert ved de høyeste dosene etter studier for å bestemme LD50 hos dyr var respirasjonsvansker og kramper.
Akutt overdosering hos mennesker er ikke rapportert. I en studie av avanserte metastatiske kreftpasienter som spesifikt bestemte den maksimalt tolererte dosen NOLVADEX (tamoxifencitrat) ved evaluering av bruken av svært høye doser for å reversere multimedikamentresistens, ble akutt nevrotoksisitet manifestert ved skjelving, hyperrefleksi, ustø gangart og svimmelhet notert. Disse symptomene oppsto innen 3-5 dager etter begynnelsen av NOLVADEX (tamoxifencitrat) og forsvant innen 2-5 dager etter avsluttet behandling. Ingen permanent nevrologisk toksisitet ble notert. En pasient opplevde et anfall flere dager etter at NOLVADEX (tamoxifen citrat) ble seponert og nevrotoksiske symptomer hadde forsvunnet. Årsakssammenhengen mellom anfallet og NOLVADEX (tamoxifen citrat)-behandling er ukjent. Doser gitt til disse pasientene var alle større enn 400 mg/m² startdose, etterfulgt av vedlikeholdsdoser på 150 mg/m² NOLVADEX (tamoxifencitrat) gitt to ganger daglig.
samme studie ble forlengelse av QT-intervallet på elektrokardiogrammet observert når pasienter fikk doser høyere enn 250 mg/m² startdose, etterfulgt av vedlikeholdsdoser på 80 mg/m² NOLVADEX (tamoxifencitrat) gitt to ganger daglig. For en kvinne med en kroppsoverflate på 1,5 m² var den minimale startdosen og vedlikeholdsdosene gitt der nevrologiske symptomer og QT-endringer oppstod minst 6 ganger høyere i forhold til maksimal anbefalt dose.
Ingen spesifikk behandling for overdosering er kjent; Behandlingen må være symptomatisk.
KONTRAINDIKASJONER
NOLVADEX (tamoxifen citrate) er kontraindisert hos pasienter med kjent overfølsomhet overfor stoffet eller noen av dets ingredienser.
Reduksjon i forekomst av brystkreft hos høyrisikokvinner og kvinner med DCIS
NOLVADEX (tamoxifen citrate) er kontraindisert hos kvinner som trenger samtidig kumarin-type antikoagulasjonsbehandling eller hos kvinner med en historie med dyp venetrombose eller lungeemboli.
KLINISK FARMAKOLOGI
NOLVADEX (tamoxifen citrate) er et ikke-steroidt middel som har vist kraftige antiøstrogene egenskaper i dyretestsystemer. De antiøstrogene effektene kan være relatert til dets evne til å konkurrere med østrogen om bindingssteder i målvev som bryst. Tamoxifen hemmer induksjonen av brystkarsinom hos rotter indusert av dimetylbenzantracen (DMBA) og forårsaker regresjon av allerede etablerte DMBA-induserte svulster. I denne rottemodellen ser det ut til at tamoxifen utøver sine antitumoreffekter ved å binde østrogenreseptorene.
I cytosoler avledet fra humane brystadenokarsinomer, konkurrerer tamoxifen med østradiol om østrogenreseptorprotein.
Absorpsjon og distribusjon
Etter en enkelt oral dose på 20 mg tamoxifen oppstod en gjennomsnittlig maksimal plasmakonsentrasjon på 40 ng/ml (område 35 til 45 ng/ml) ca. 5 timer etter dosering. Nedgangen i plasmakonsentrasjoner av tamoksifen er bifasisk med en terminal eliminasjonshalveringstid på ca. 5 til 7 dager. Den gjennomsnittlige maksimale plasmakonsentrasjonen av N-desmetyltamoxifen er 15 ng/ml (område 10 til 20 ng/ml). Kronisk administrering av 10 mg tamoxifen gitt to ganger daglig i 3 måneder til pasienter resulterer i gjennomsnittlige steady-state plasmakonsentrasjoner på 120 ng/ml (område 67-183 ng/ml) for tamoxifen og 336 ng/ml (område 148-654 ng/ mL) for N-desmetyltamoxifen. Gjennomsnittlig steady-state plasmakonsentrasjon av tamoxifen og N-desmetyltamoxifen etter administrering av 20 mg tamoxifen én gang daglig i 3 måneder er 122 ng/ml (område 71-183 ng/ml) og 353 ng/ml (område 152-706 ng) /ml), henholdsvis. Etter oppstart av behandlingen oppnås steady state-konsentrasjoner for tamoxifen i løpet av ca. 4 uker, og steady-state-konsentrasjoner for N-desmetyltamoxifen oppnås i løpet av ca. 8 uker, noe som antyder en halveringstid på ca. 14 dager for denne metabolitten. I en steady-state, crossover-studie med 10 mg NOLVADEX (tamoxifen citrat) tabletter gitt to ganger daglig kontra en 20 mg NOLVADEX (tamoxifen citrat) tablett gitt én gang daglig, var 20 mg NOLVADEX (tamoxifen citrat) tabletten bioekvivalent med 10 mg NOLVADEX (tamoxifen citrat) tabletter.
Metabolisme
Tamoxifen metaboliseres i stor grad etter oral administrering. N-desmetyltamoxifen er hovedmetabolitten som finnes i pasientens plasma. Den biologiske aktiviteten til N-desmetyltamoxifen ser ut til å være lik den til tamoxifen. 4-hydroksytamoxifen og et sidekjede primært alkoholderivat av tamoksifen har blitt identifisert som mindre metabolitter i plasma. Tamoxifen er et substrat for cytokrom P-450 3A, 2C9 og 2D6, og en hemmer av P-glykoprotein.
Utskillelse
Studier på kvinner som fikk 20 mg 14C-tamoxifen har vist at omtrent 65 % av den administrerte dosen ble skilt ut fra kroppen over en periode på 2 uker med fekal utskillelse som primær eliminasjonsvei. Legemidlet utskilles hovedsakelig som polare konjugater, med uendret legemiddel og ukonjugerte metabolitter som utgjør mindre enn 30 % av den totale fekale radioaktiviteten.
Spesielle populasjoner
Effekten av alder, kjønn og rase på farmakokinetikken til tamoxifen er ikke fastslått. Effekten av redusert leverfunksjon på metabolismen og farmakokinetikken til tamoxifen er ikke fastslått.
Pediatriske pasienter
Farmakokinetikken til tamoxifen og N-desmetyltamoxifen ble karakterisert ved å bruke en populasjonsfarmakokinetisk analyse med sparsomme prøver per pasient hentet fra 27 kvinnelige pediatriske pasienter i alderen 2 til 10 år inkludert i en studie designet for å evaluere sikkerheten, effekten og farmakokinetikken til NOLVADEX (tamoxifen) sitrat) ved behandling av McCune-Albright syndrom. Rike data fra to farmakokinetiske studier av tamoksifensitrat der 59 postmenopausale kvinner med brystkreft fullførte studiene ble inkludert i analysen for å bestemme den strukturelle farmakokinetiske modellen for tamoksifen. En modell med ett rom ga best tilpasning til dataene.
Hos pediatriske pasienter var en gjennomsnittlig steady state peak plasmakonsentrasjon (Css, max) og AUC på henholdsvis 187 ng/mL og 4110 ng time/ml, og Css, max forekom ca. 8 timer etter dosering. Clearance (CL/F) som kroppsvekt justert hos kvinnelige pediatriske pasienter var omtrent 2,3 ganger høyere enn hos kvinnelige brystkreftpasienter. I den yngste kohorten av kvinnelige pediatriske pasienter (2-6 år) var CL/F 2,6 ganger høyere; i den eldste kohorten (7-10,9 åringer) var CL/F omtrent 1,9 ganger høyere. Eksponering for N-desmetyltamoxifen var sammenlignbar mellom pediatriske og voksne pasienter. Sikkerheten og effekten av NOLVADEX (tamoxifen citrate) for jenter i alderen to til 10 år med McCune-Albright syndrom og tidlig pubertet har ikke blitt undersøkt etter ett års behandling. Langtidseffektene av NOLVADEX (tamoxifen citrat)-behandling hos jenter er ikke fastslått. Hos voksne behandlet med NOLVADEX (tamoxifen citrat) er det observert en økning i forekomsten av uterine maligniteter, slag og lungeemboli (se ADVARSEL i boks ).
Legemiddel-legemiddelinteraksjoner
In vitro-studier viste at erytromycin, ciklosporin, nifedipin og diltiazem kompetitivt hemmet dannelsen av N-desmetyltamoxifen med tilsynelatende K1 på henholdsvis 20, 1, 45 og 30 µM. Den kliniske betydningen av disse in vitro-studiene er ukjent.
Tamoxifen reduserte plasmakonsentrasjonen av letrozol med 37 % når disse legemidlene ble administrert samtidig. Rifampin, en cytokrom P-450 3A4-induktor reduserte tamoxifen AUC og Cmax med henholdsvis 86 % og 55 %. Aminoglutetimid reduserer plasmakonsentrasjonene av tamoxifen og N-desmetyltamoxifen. Medroksyprogesteron reduserer plasmakonsentrasjonen av N-desmetyl, men ikke tamoxifen.
adjuvantstudien med anastrozol reduserte samtidig administrering av anastrozol og NOLVADEX (tamoxifencitrat) hos brystkreftpasienter anastrozolplasmakonsentrasjonen med 27 % sammenlignet med de som ble oppnådd med anastrozol alene; samtidig administrasjon påvirket imidlertid ikke farmakokinetikken til tamoxifen eller N-desmetyltamoxifen (se FORHOLDSREGLER - MEDIKEMELSIKOLOGISKE INTERAKSJONER ). NOLVADEX (tamoxifen citrat) skal ikke gis samtidig med anastrozol.
Kliniske studier
Metastatisk brystkreft
Premenopausale kvinner (NOLVADEX (tamoxifen citrate) vs. ablasjon)
Tre prospektive, randomiserte studier (Ingle, Pritchard, Buchanan) sammenlignet NOLVADEX (tamoxifencitrat) med ovarieablasjon (ooforektomi eller ovariebestråling) hos premenopausale kvinner med avansert brystkreft. Selv om den objektive responsraten, tid til behandlingssvikt og overlevelse var lik for begge behandlingene, forhindret den begrensede pasientakkumuleringen en demonstrasjon av ekvivalens. I en oversiktsanalyse av overlevelsesdata fra de 3 studiene, var fareforholdet for død (NOLVADEX (tamoxifencitrat)/ovarieablasjon) 1,00 med tosidige 95 % konfidensintervaller på 0,73 til 1,37. Forhøyede serum- og plasmaøstrogener har blitt observert hos premenopausale kvinner som får NOLVADEX (tamoxifencitrat), men dataene fra de randomiserte studiene tyder ikke på en negativ effekt av denne økningen. Et begrenset antall premenopausale pasienter med sykdomsprogresjon under NOLVADEX (tamoxifen citrat)-behandling responderte på påfølgende ovarieablasjon.
Mannlig brystkreft
Publiserte resultater fra 122 pasienter (119 evaluerbare) og kasusrapporter hos 16 pasienter (13 evaluerbare) behandlet med NOLVADEX (tamoxifen citrate) har vist at NOLVADEX (tamoxifen citrate) er effektiv for palliativ behandling av mannlig brystkreft. 66 av disse 132 evaluerbare pasientene responderte på NOLVADEX (tamoxifen citrate) som utgjør en objektiv responsrate på 50 %.
Adjuvant brystkreft
Oversikt
Early Breast Cancer Trialists' Collaborative Group (EBCTCG) gjennomførte verdensomspennende oversikter over systemisk adjuvant terapi for tidlig brystkreft i 1985, 1990 og igjen i 1995. I 1998 ble 10-års utfallsdata rapportert for 36 689 kvinner i 5 av 5 randomiserte studier. adjuvans NOLVADEX (tamoxifen citrate) ved bruk av doser på 20-40 mg/dag i 1-5+ år. 25 prosent av pasientene fikk 1 år eller mindre prøvebehandling, 52 % fikk 2 år og 23 % fikk ca. 5 år. 48 prosent av svulstene var østrogenreseptor (ER) positive (> 10 fmol/mg), 21 % var ER dårlige (
Blant kvinner med ER-positiv eller ukjent brystkreft og positive noder som fikk ca. 5 års behandling, var total overlevelse etter 10 år 61,4 % for NOLVADEX (tamoxifencitrat) vs. 50,5 % for kontroll (logrank 2p
Effekten av den planlagte varigheten av tamoxifen kan beskrives som følger. Hos kvinner med ER-positiv eller ukjent brystkreft som fikk 1 år eller mindre, 2 år eller ca. 5 år med NOLVADEX (tamoxifencitrat), var den proporsjonale reduksjonen i dødelighet henholdsvis 12 %, 17 % og 26 % (trend signifikant ved 2p
Fordelen er mindre tydelig for kvinner med ER dårlig brystkreft der den proporsjonale reduksjonen i residiv var 10 % (2p = 0,007) for alle varighetsperioder samlet, eller 9 % (2p = 0,02) hvis kontralaterale brystkreftformer er ekskludert. Tilsvarende reduksjon i dødelighet var 6 % (NS). Effekten av ca. 5 år med NOLVADEX (tamoxifen citrat) på residiv og dødelighet var lik uavhengig av alder og samtidig kjemoterapi. Det var ingen indikasjoner på at doser større enn 20 mg per dag var mer effektive.
Anastrozol Adjuvant ATAC Trial - Studie av Anastrozol sammenlignet med NOLVADEX (tamoxifen citrate) for adjuvant behandling av tidlig brystkreft - En anastrozol adjuvant studie ble utført på 9366 postmenopausale kvinner med operabel brystkreft som ble randomisert til å motta adjuvant behandling med enten anastrozol 1 mg daglig, NOLVADEX (tamoxifen citrat) 20 mg daglig, eller en kombinasjon av disse to behandlingene i fem år eller inntil tilbakefall. av sykdommen. Ved en median oppfølging på 33 måneder viste ikke kombinasjonen av anastrozol og NOLVADEX (tamoxifen citrat) noen effektfordel sammenlignet med NOLVADEX (tamoxifen citrat) behandling alene hos alle pasienter så vel som i den hormonreseptorpositive subpopulasjonen. Denne behandlingsarmen ble avviklet fra forsøket. Vennligst se KLINISK FARMAKOLOGI-Spesielle populasjoner-Medikament-legemiddelinteraksjoner , FORHOLDSREGLER-Laboratorietester , FORHOLDSREGLER-Medikamentinteraksjoner og BIVIRKNINGER seksjoner for sikkerhetsinformasjon fra denne utprøvingen. Vennligst se den fullstendige forskrivningsinformasjonen for ARIMIDEX® (anastrozol) 1 mg tabletter for ytterligere informasjon om denne studien.
Pasienter i de to monoterapiarmene i ATAC-studien ble behandlet i median 60 måneder (5 år) og fulgt i median 68 måneder. Sykdomsfri overlevelse i intent-to-treat-populasjonen var statistisk signifikant forbedret [Hazard Ratio (HR) = 0,87, 95 % KI: 0,78, 0,97, p=0,0127] i anastrazol-armen sammenlignet med NOLVADEX (tamoxifen citrat)-armen .
Node Positiv - Individuelle studier
To studier (Hubay og NSABP B-09) viste en forbedret sykdomsfri overlevelse etter radikal eller modifisert radikal mastektomi hos postmenopausale kvinner eller kvinner 50 år eller eldre med kirurgisk helbredelig brystkreft med positive aksillære noder når NOLVADEX (tamoxifen citrat) ble lagt til adjuvant cytotoksisk kjemoterapi. I Hubay-studien ble NOLVADEX (tamoxifen citrate) tilsatt "lequo;low-dose" CMF (cyklofosfamid, metotreksat og fluorouracil). I NSABP B-09-studien ble NOLVADEX (tamoxifencitrat) tilsatt melfalan [L-fenylalaninsennep (P)] og fluorouracil (F).
Hubay-studien var det mer sannsynlig at pasienter med en positiv (mer enn 3 fmol) østrogenreseptor hadde fordel. I NSABP B-09-studien med kvinner i alderen 50-59 år var det bare kvinner med både østrogen- og progesteronreseptornivåer på 10 fmol eller mer som hadde klart fordel, mens det var en ikke-statistisk signifikant trend mot uønsket effekt hos kvinner med både østrogen- og progesteronreseptornivåer mindre enn 10 fmol. Hos kvinner i alderen 60-70 år var det en trend mot en gunstig effekt av NOLVADEX (tamoxifen citrate) uten noe klart forhold til østrogen- eller progesteronreseptorstatus.
Tre prospektive studier (ECOG-1178, Toronto, NATO) med NOLVADEX (tamoxifen citrat) adjuvant som enkeltmiddel viste en forbedret sykdomsfri overlevelse etter total mastektomi og aksillær disseksjon for postmenopausale kvinner med positive aksillære noder sammenlignet med placebo/ingen behandlingskontroller . NATO-studien viste også en samlet overlevelsesgevinst.
Node negativ - individuelle studier
NSABP B-14, en prospektiv, dobbeltblind, randomisert studie, sammenlignet NOLVADEX (tamoxifen citrat) med placebo hos kvinner med aksillær node-negativ, østrogenreseptor positiv (≥ 10 fmol/mg cytosolprotein) brystkreft (som adjuvant terapi) , etter total mastektomi og aksillær disseksjon, eller segmentell reseksjon
PASIENTINFORMASJON
MEDISINERINGSVEILEDNING
NOLVADEX (tamoxifen citrate) ® (NOLE-vah-dex) Tabletter Generisk navn: tamoxifen (ta-MOX-I-fen)
Skrevet for kvinner som bruker NOLVADEX (tamoxifen citrat) for å redusere sin høye sjanse for å få brystkreft eller som har ductal carcinoma in situ (DCIS)
Denne medisinguiden diskuterer kun bruken av NOLVADEX (tamoxifencitrat) for å redusere sjansen for å få brystkreft hos høyrisikokvinner og hos kvinner som behandles for DCIS.
Personer som tar NOLVADEX (tamoxifen citrate) å behandle brystkreft har andre fordeler og andre beslutninger å ta enn kvinner med høy risiko eller kvinner med duktalt karsinom in situ (DCIS) som tar NOLVADEX (tamoxifencitrat) for å redusere sjansen for å få brystkreft. Hvis du allerede har brystkreft, snakk med legen din om hvordan fordelene ved å behandle brystkreft med NOLVADEX (tamoxifencitrat) sammenlignes med risikoen som er beskrevet i dette dokumentet.
Hvorfor bør jeg lese denne medisinveiledningen?
Denne veiledningen har informasjon som hjelper deg med å bestemme om du skal bruke NOLVADEX (tamoxifencitrat) for å redusere sjansen for å få brystkreft.
Du og legen din bør snakke om hvorvidt den mulige fordelen med NOLVADEX (tamoxifencitrat) for å redusere den høye sjansen for å få brystkreft er større enn den mulige risikoen. Legen din har et spesielt dataprogram eller håndholdt kalkulator for å fortelle om du er i høyrisikogruppen. Hvis du har DCIS og har blitt behandlet med kirurgi og strålebehandling, kan legen din forskrive NOLVADEX (tamoxifencitrat) for å redusere sjansen for å få invasiv (spredning) brystkreft.
Les denne veiledningen nøye før du starter NOLVADEX (tamoxifen citrate) . Det er viktig å lese informasjonen du får hver gang du får mer medisin. Det kan være noe nytt. Denne veiledningen forteller deg ikke alt om NOLVADEX (tamoxifen citrate) og gjør det ikke ta plassen til å snakke med legen din.
Bare du og legen din kan avgjøre om NOLVADEX (tamoxifencitrat) er riktig for deg.
Hva er den viktigste informasjonen jeg bør vite om bruk av NOLVADEX (tamoxifen citrate) for å redusere sjansen for å få brystkreft?
NOLVADEX (tamoxifen citrate) er en reseptbelagt medisin som er som østrogen (kvinnelig hormon) på noen måter og annerledes på andre måter. I brystet kan NOLVADEX (tamoxifen citrate) blokkere østrogens effekter. Fordi det gjør dette, kan NOLVADEX (tamoxifencitrat) blokkere veksten av brystkreft som trenger østrogen for å vokse (kreft som er østrogen- eller progesteronreseptorpositive).
NOLVADEX (tamoxifen citrate) kan redusere sjansen for å få brystkreft hos kvinner med en høyere sjanse enn normalt for å få brystkreft i løpet av de neste fem årene (høyrisikokvinner) og kvinner med DCIS.
Fordi høyrisikokvinner ikke har kreft ennå, er det viktig å tenke nøye gjennom om den mulige fordelen med NOLVADEX (tamoxifencitrat) for å redusere sjansen for å få brystkreft er større enn den mulige risikoen.
Denne medisinguiden gjennomgår risikoene og fordelene ved å bruke NOLVADEX (tamoxifencitrat) for å redusere sjansen for å få brystkreft hos høyrisikokvinner og kvinner med DCIS. Det gjør denne guiden ikke diskutere de spesielle fordelene og beslutningene for personer som allerede har brystkreft.
Hvorfor bruker kvinner og menn NOLVADEX (tamoxifen citrate)?
NOLVADEX (tamoxifen citrate) har mer enn én bruk. NOLVADEX (tamoxifen citrate) brukes:
for å redusere sjansen for å få brystkreft hos kvinner med høyere sjanse enn normalt for å få brystkreft i løpet av de neste 5 årene (høyrisikokvinner)
for å redusere sjansen for å få invasiv (spredning) brystkreft hos kvinner som ble operert og bestrålet for ductal carcinoma in situ (DCIS). DCIS betyr at kreften bare er inne i melkekanalene.
å behandle brystkreft hos kvinner etter at de har avsluttet tidlig behandling. Tidlig behandling kan omfatte kirurgi, stråling og kjemoterapi. NOLVADEX (tamoxifen citrate) kan hindre kreften i å spre seg til andre deler av kroppen. Det kan også redusere kvinnens sjanse for å få en ny brystkreft. hos kvinner og menn,
å behandle brystkreft som har spredt seg til andre deler av kroppen (metastatisk brystkreft).
Denne veiledningen snakker kun om bruk av NOLVADEX (tamoxifencitrat) for å redusere sjansen for å få brystkreft (#1 og #2 ovenfor).
Hva er fordelene med NOLVADEX (tamoxifen citrate) for å redusere sjansen for å få brystkreft hos høyrisikokvinner og hos kvinner behandlet for DCIS?
En stor amerikansk studie så på høyrisiko kvinner og sammenlignet de som tok NOLVADEX (tamoxifen citrate) i 5 år med andre som tok en pille uten NOLVADEX (tamoxifen citrate) (placebo). Høyrisikokvinner ble definert som kvinner som har 1,7 % eller større sjanse for å få brystkreft i løpet av de neste 5 årene, basert på et spesielt dataprogram. I denne studien:
- . Av hver 1000 høyrisiko kvinner som tok placebo , hvert år fikk ca 7 brystkreft. . Av hver 1000 høyrisiko kvinner som tok NOLVADEX (tamoxifen citrate) , hvert år fikk ca 4 brystkreft.
Studien viste at høyrisikokvinner som tok NOLVADEX (tamoxifencitrat) i gjennomsnitt reduserte sjansene for å få brystkreft med 44 %, fra 7 av 1000 til 4 av 1000.
En annen amerikansk studie så på kvinner med DCIS og sammenlignet de som tok NOLVADEX (tamoxifencitrat) i 5 år med andre som tok placebo. I denne studien:
- . Av hver 1000 kvinner med DCIS som tok placebo hvert år fikk rundt 17 brystkreft. . Av hver 1000 kvinner med DCIS som tok NOLVADEX (tamoxifen citrate) , hvert år fikk rundt 10 brystkreft.
Studien viste at kvinner med DCIS som tok NOLVADEX (tamoxifencitrat) i gjennomsnitt reduserte sjansene for å få invasiv (spredning) brystkreft med 43 %, fra 17 av 1000 til 10 av 1000.
Disse studiene betyr ikke at å ta NOLVADEX (tamoxifencitrat) vil redusere din personlige sjanse for å få brystkreft. Vi vet ikke hva fordelene vil være for en kvinne som tar NOLVADEX (tamoxifen citrate) for å redusere sjansen for å få brystkreft.
Hva er risikoen ved NOLVADEX (tamoxifen citrate)?
I studiene beskrevet under "Hva er fordelene med NOLVADEX (tamoxifen citrate)?", fikk høyrisikokvinnene som tok NOLVADEX (tamoxifen citrate) visse bivirkninger i høyere hastighet enn de som tok placebo.
Noen av disse bivirkningene kan forårsake død.
I en studie, hos kvinner som fortsatt hadde livmoren
- . Av hver 1000 kvinner som tok placebo, fikk 1 endometriekreft (kreft i livmorslimhinnen) hvert år og ingen fikk livmorsarkom (kreft i livmorkroppen). . Av hver 1000 kvinner som tok NOLVADEX (tamoxifen citrat), fikk 2 hvert år endometriekreft og færre enn 1 fikk livmorsarkom.
Disse resultatene viser at i gjennomsnitt hos kvinner med høy risiko som fortsatt hadde livmoren , NOLVADEX (tamoxifen citrate) doblet sjansen for å få livmorkreft fra 1 av 1000 til 2 av 1000, og det økte sjansen for å få livmorsarkom. Dette betyr ikke at å ta NOLVADEX (tamoxifencitrat) vil doble din personlige sjanse for å få endometriekreft eller øke sjansen for å få livmorsarkom. Vi vet ikke hva denne risikoen vil være for en kvinne. Risikoen er annerledes for kvinner som ikke lenger har livmoren.
For alle kvinner i denne studien økte det å ta NOLVADEX (tamoxifencitrat) risikoen for å få en blodpropp i lungene eller venene, eller for å få hjerneslag. I noen tilfeller døde kvinner av disse effektene.
NOLVADEX (tamoxifencitrat) økte risikoen for å få grå stær (uklarhet av øyelinsen) eller behov for operasjon for grå stær. (Se "Hva er de mulige bivirkningene av NOLVADEX (tamoxifen citrate)?" for mer informasjon om bivirkninger.)
Hva vet vi ikke om å ta NOLVADEX (tamoxifen citrate) for å redusere sjansen for å få brystkreft?
Vi vet ikke
- . hvis NOLVADEX (tamoxifen citrate) reduserer sjansen for å få brystkreft hos kvinner som har unormale brystkreftgener (BRCA1 og BRCA2) . hvis du tar NOLVADEX (tamoxifen citrate) i 5 år reduserer antallet brystkreft som en kvinne vil få i løpet av livet, eller hvis det bare forsinker noen brystkreftformer . hvis NOLVADEX (tamoxifen citrate) hjelper en kvinne å leve lenger . effekten av å ta NOLVADEX (tamoxifen citrat) med hormonerstatningsterapi (HRT), p-piller eller androgener (mannlige hormoner) . fordelene ved å ta NOLVADEX (tamoxifencitrat) hvis du er under 35 år
Det gjøres studier for å lære mer om de langsiktige fordelene og risikoene ved bruk av NOLVADEX (tamoxifencitrat) for å redusere sjansen for å få brystkreft.
Hva er de mulige bivirkningene av NOLVADEX (tamoxifen citrate)?
Den vanligste bivirkningen av NOLVADEX (tamoxifencitrat) er hetetokter. Dette er ikke et tegn på et alvorlig problem.
Den nest vanligste bivirkningen er utflod fra skjeden. Hvis utfloden er blodig, kan det være et tegn på et alvorlig problem. [Se "Endringer i slimhinnen (endometrium) eller livmorkroppen" nedenfor.]
Mindre vanlige, men alvorlige bivirkninger av NOLVADEX (tamoxifencitrat) er oppført nedenfor. Disse kan oppstå når som helst. Ring legen din umiddelbart hvis du har noen tegn på bivirkninger som er oppført nedenfor:
- . Endringer i slimhinnen (endometrium) eller livmorkroppen. Disse endringene kan bety at alvorlige problemer begynner, inkludert kreft i livmoren. Tegnene på endringer i livmoren er:
- . Vaginal blødning eller blodig utflod som kan ha en rusten eller brun farge. Du bør ringe legen din selv om det bare oppstår en liten mengde blødninger. . Endring i den månedlige blødningen, for eksempel i mengden eller tidspunktet for blødning eller økt koagulering. . Smerter eller trykk i bekkenet (under navlen).
- . plutselige brystsmerter, kortpustethet, hoste opp blod . smerte, ømhet eller hevelse i ett eller begge bena dine
- . plutselig svakhet, prikking eller nummenhet i ansiktet, armen eller benet, spesielt på den ene siden av kroppen . plutselig forvirring, problemer med å snakke eller forstå . plutselige problemer med å se på ett eller begge øyne . plutselige problemer med å gå, svimmelhet, tap av balanse eller koordinasjon . plutselig kraftig hodepine uten kjent årsak
Dette er ikke alle mulige bivirkninger av NOLVADEX (tamoxifen citrate). For en fullstendig liste, spør legen din eller apoteket.
Hvem bør ikke ta NOLVADEX (tamoxifen citrate)?
Ikke ta NOLVADEX (tamoxifen citrate) uansett grunn hvis du
- . Er gravid eller planlegger å bli gravid mens du tar NOLVADEX (tamoxifencitrat) eller i løpet av 2 måneder etter at du slutter å ta NOLVADEX (tamoxifencitrat). NOLVADEX (tamoxifen citrate) kan skade det ufødte barnet ditt. Det tar omtrent 2 måneder å fjerne NOLVADEX (tamoxifencitrat) fra kroppen din. For å være sikker på at du ikke er gravid, kan du begynne å ta NOLVADEX (tamoxifencitrat) mens du har menstruasjon. Eller du kan ta en graviditetstest for å være sikker på at du ikke er gravid før du begynner. . Ammer. Vi vet ikke om NOLVADEX (tamoxifencitrat) kan passere gjennom melken din og skade babyen din. . Har hatt en allergisk reaksjon på NOLVADEX (tamoxifen citrate) eller tamoxifen (det andre navnet på NOLVADEX (tamoxifen citrate) ), eller til noen av dets inaktive ingredienser.
Hvis du blir gravid mens du tar NOLVADEX (tamoxifencitrat), må du slutte å ta det med en gang og kontakte legen din. NOLVADEX (tamoxifen citrate) kan skade det ufødte barnet ditt. Ikke ta NOLVADEX (tamoxifen citrate) for å redusere sjansen for å få brystkreft hvis
- . Du har noen gang hatt en blodpropp som trengte medisinsk behandling. . Du tar medisiner for å tynne blodet ditt, som warfarin (også kalt Coumadin®*). . Din evne til å bevege deg rundt er begrenset de fleste av dine våkne timer. . Du er i faresonen for blodpropp. Legen din kan fortelle deg om du har høy risiko for blodpropp. . Du har ikke større sjanse enn normalt for å få brystkreft. Legen din kan fortelle deg om du er en kvinne med høy risiko.
Hvordan skal jeg ta NOLVADEX (tamoxifen citrate)?
- . Svelg tabletten(e) hele sammen med vann eller annen alkoholfri væske. Du kan ta NOLVADEX (tamoxifencitrat) med eller uten mat. Ta medisinen hver dag. Det kan være lettere å huske hvis du tar det til samme tid hver dag. . Hvis du glemmer en dose, ta den når du husker det, og ta deretter neste dose som vanlig. Hvis det nesten er tid for neste dose eller du husker neste dose, ikke ta ekstra tabletter for å gjøre opp den glemte dosen. . Ta NOLVADEX (tamoxifen citrate) i 5 år, med mindre legen din forteller deg noe annet.
Hva bør jeg unngå mens jeg tar NOLVADEX (tamoxifen citrate)?
- . Ikke bli gravid mens du tar NOLVADEX (tamoxifencitrat) eller i 2 måneder etter at du har sluttet. NOLVADEX (tamoxifen citrate) kan stoppe hormonelle prevensjonsmetoder fra å virke. Hormonelle metoder inkluderer p-piller, plaster, injeksjoner, ringer og implantater. Derfor, mens du tar NOLVADEX (tamoxifencitrat), bruke prevensjonsmetoder som ikke bruker hormoner, slik som kondomer, membraner med sæddrepende middel eller vanlige spiraler. Hvis du blir gravid, må du slutte å ta NOLVADEX (tamoxifencitrat) umiddelbart og ringe legen din. . Ikke amme. Vi vet ikke om NOLVADEX (tamoxifencitrat) kan passere gjennom melken din og om det kan skade babyen.
Hva bør jeg gjøre mens jeg tar NOLVADEX (tamoxifen citrate)?
- . Ta regelmessige gynekologiske kontroller ("kvinnelige undersøkelser"), brystundersøkelser og mammografi. Legen din vil fortelle deg hvor ofte. Disse vil se etter tegn på brystkreft og kreft i endometrium (slimhinnen i livmoren). Fordi NOLVADEX (tamoxifen citrate) ikke forhindrer all brystkreft, og du kan få andre typer kreft, trenger du disse undersøkelsene for å finne eventuelle kreftformer så tidlig som mulig. . Fordi NOLVADEX (tamoxifen citrate) kan forårsake alvorlige bivirkninger, vær nøye med kroppen din. Tegn du bør se etter er oppført i "Hva er de mulige bivirkningene av NOLVADEX (tamoxifen citrate)?" . Fortell alle legene at du ser at du tar NOLVADEX (tamoxifencitrat). . Fortell legen din med en gang hvis du har nye brystklumper.
Generell informasjon om sikker og effektiv bruk av NOLVADEX (tamoxifen citrate)
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Legen din har foreskrevet NOLVADEX (tamoxifencitrat) kun til deg. Ikke gi det til andre mennesker, selv om de har en lignende tilstand, fordi det kan skade dem. Ikke bruk den for en tilstand som den ikke er foreskrevet for.
Denne medisinveiledningen er et sammendrag av informasjon om NOLVADEX (tamoxifencitrat) for kvinner som bruker NOLVADEX (tamoxifencitrat) for å redusere sin høye sjanse for å få brystkreft eller som har DCIS. Spør legen din eller apoteket hvis du ønsker mer informasjon om NOLVADEX (tamoxifencitrat). De kan gi deg informasjon om NOLVADEX (tamoxifen citrate) som er skrevet for helsepersonell. For mer informasjon om NOLVADEX (tamoxifen citrate) eller brystkreft, vennligst besøk www.NOLVADEX (tamoxifen citrate) .com eller ring 1-800-236-9933.
Ingredienser: tamoxifen citrat, karboksymetylcellulose kalsium, magnesiumstearat, mannitol og stivelse.
Denne medisinveiledningen er godkjent av US Food and Drug Administration
