Actos 15mg, 30mg Pioglitazone Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Actos og hvordan brukes det?
Actos 15mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på type 2 diabetes mellitus. Actos kan brukes alene eller sammen med andre medisiner.
Actos er et antidiabetisk, tiazolidindioner medikament.
Det er ikke kjent om Actos 15mg er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Actos 15mg?
Actos kan forårsake alvorlige bivirkninger, inkludert:
- . kortpustethet (spesielt når du legger deg), . uvanlig tretthet, . opphovning, . rask vektøkning, . rosa eller rød urin, . smertefull eller vanskelig vannlating, . ny eller forverret trang til å urinere, . synsforandringer, og . plutselige, uvanlige smerter i hånden, armen eller foten
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Actos inkluderer:
- . hodepine, . muskelsmerter, og . forkjølelsessymptomer (tett nese, bihulesmerter, nysing, sår hals)
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
Dette er ikke alle mulige bivirkninger av Actos. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
KONGESTIV HJERTESVIKT
- . Tiazolidindioner, inkludert ACTOS 15mg, forårsaker eller forverrer kongestiv hjertesvikt hos noen pasienter [se ADVARSLER OG FORHOLDSREGLER ]. . Etter oppstart av ACTOS 30 mg, og etter doseøkninger, overvåk pasientene nøye for tegn og symptomer på hjertesvikt (f.eks. overdreven, rask vektøkning, dyspné og/eller ødem). Hvis hjertesvikt utvikler seg, bør det behandles i henhold til gjeldende standarder for omsorg og seponering eller dosereduksjon av ACTOS 15 mg må vurderes. . ACTOS anbefales ikke til pasienter med symptomatisk hjertesvikt. . Oppstart av ACTOS hos pasienter med etablert New York Heart Association (NYHA) klasse III eller IV hjertesvikt er kontraindisert [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
ACTOS-tabletter er en tiazolidindion og en agonist for peroksisomproliferatoraktivert reseptor (PPAR) gamma som inneholder en oral antidiabetisk medisin: pioglitazon.
Pioglitazon [(±)-5-[[4-[2-(5-etyl-2-pyridinyl)etoksy]fenyl]metyl]-2,4-]tiazolidindionmonohydroklorid inneholder ett asymmetrisk karbon, og forbindelsen syntetiseres og brukes som den racemiske blandingen. De to enantiomerene av pioglitazon omdannes in vivo. Ingen forskjeller ble funnet i den farmakologiske aktiviteten mellom de to enantiomerene. Strukturformelen er som vist:
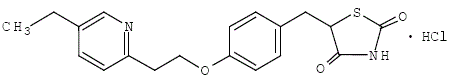
Pioglitazonhydroklorid er et luktfritt hvitt krystallinsk pulver som har en molekylformel på C19H20N2O3S•HCl og en molekylvekt på 392,90 dalton. Det er løselig i N,Ndimetylformamid, lett løselig i vannfri etanol, veldig lite løselig i aceton og acetonitril, praktisk talt uløselig i vann og uoppløselig i eter.
ACTOS er tilgjengelig som en tablett for oral administrering som inneholder 15 mg, 30 mg eller 45 mg pioglitazon (som base) formulert med følgende hjelpestoffer: laktos 30 mg monohydrat NF, hydroksypropylcellulose NF, karboksymetylcellulose kalsium NF og magnesiumstearat NF.
INDIKASJONER
Monoterapi og kombinasjonsterapi
ACTOS 30mg er indisert som et tillegg til kosthold og trening for å forbedre glykemisk kontroll hos voksne med type 2 diabetes mellitus i flere kliniske omgivelser [se Kliniske studier ].
Viktige bruksbegrensninger
ACTOS 15mg utøver sin antihyperglykemiske effekt kun i nærvær av endogent insulin. ACTOS 30mg skal ikke brukes til å behandle type 1 diabetes eller diabetisk ketoacidose, da det ikke vil være effektivt i disse innstillingene.
Vær forsiktig hos pasienter med leversykdom [se ADVARSLER OG FORHOLDSREGLER ].
DOSERING OG ADMINISTRASJON
Anbefalinger for alle pasienter
ACTOS 15 mg bør tas én gang daglig og kan tas uten hensyn til måltider.
Anbefalt startdose for pasienter uten kongestiv hjertesvikt er 15 mg eller 30 mg én gang daglig.
Anbefalt startdose for pasienter med kongestiv hjertesvikt (NYHA klasse I eller II) er 15 mg én gang daglig.
Dosen kan titreres i trinn på 15 mg opp til maksimalt 45 mg én gang daglig basert på glykemisk respons bestemt av HbA1c.
Etter oppstart av ACTOS 30 mg eller med doseøkning, overvåk pasientene nøye for bivirkninger relatert til væskeretensjon som vektøkning, ødem og tegn og symptomer på kongestiv hjertesvikt [se BOKS ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Levertester (serumalanin og aspartataminotransferaser, alkalisk fosfatase og total bilirubin) bør tas før ACTOS startes. Rutinemessig periodisk overvåking av leverprøver under behandling med ACTOS 30 mg anbefales ikke hos pasienter uten leversykdom. Pasienter som har unormale leverprøver før oppstart av ACTOS eller som viser seg å ha unormale leverprøver mens de tar ACTOS, bør behandles som beskrevet under Advarsler og forholdsregler [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Samtidig bruk med en insulinsekretagog eller insulin
Hvis hypoglykemi oppstår hos en pasient som administreres samtidig med ACTOS 30 mg og en insulinsekretagog (f.eks. sulfonylurea), bør dosen av insulinsekretagogen reduseres.
Hvis hypoglykemi oppstår hos en pasient som samtidig får ACTOS 30 mg og insulin, bør insulindosen reduseres med 10 % til 25 %. Ytterligere justeringer av insulindosen bør individualiseres basert på glykemisk respons.
Samtidig bruk med sterke CYP2C8-hemmere
Samtidig administrering av ACTOS 30 mg og gemfibrozil, en sterk CYP2C8-hemmer, øker pioglitazoneksponeringen ca. 3 ganger. Derfor er maksimal anbefalt dose av ACTOS 15 mg daglig når det brukes i kombinasjon med gemfibrozil eller andre sterke CYP2C8-hemmere [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
Rund tablett inneholder pioglitazon som følger:
- . 15 mg: Hvit til off-white, preget med "ACTOS" på den ene siden og "15" på den andre . 30 mg: Hvit til off-white, preget med "ACTOS" på den ene siden og "30" på den andre . 45 mg: Hvit til off-white, preget med "ACTOS" på den ene siden og "45" på den andre
Oppbevaring og håndtering
ACTOS er tilgjengelig i 15 mg, 30 mg og 45 mg tabletter som følger:
15 mg tablett : Hvit til off-white, rund, konveks tablett uten skår med "ACTOS" på den ene siden og "15" på den andre, tilgjengelig i:
NDC 64764-151-04 Flasker à 30 stk NDC 64764-151-05 Flasker à 90 stk NDC 64764-151-06 Flasker à 500 stk
30 mg tablett Hvit til off-white, rund, flat tablett uten delestrek med "ACTOS" på den ene siden og "30" på den andre, tilgjengelig i:
NDC 64764-301-14 flasker à 30 stk NDC 64764-301-15 flasker à 90 stk NDC 64764-301-16 Flasker à 500 stk
45 mg tablett : Hvit til off-white, rund, flat tablett uten delestrek med "ACTOS" på den ene siden og "45" på den andre, tilgjengelig i:
NDC 64764-451-24 Flasker à 30 stk NDC 64764-451-25 Flasker à 90 stk NDC 64764-451-26 Flasker à 500 stk
Oppbevaring
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP-kontrollert romtemperatur]. Hold beholderen tett lukket og beskytt mot lys, fuktighet og fuktighet.
Distribuert av: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Revidert: Des 2017
BIVIRKNINGER
Følgende alvorlige bivirkninger er omtalt andre steder i merkingen:
- . Kongestiv hjertesvikt [se BOKS ADVARSEL og ADVARSLER OG FORHOLDSREGLER ] . Ødem [se ADVARSLER OG FORHOLDSREGLER ] . Brudd [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Over 8500 pasienter med type 2-diabetes har blitt behandlet med ACTOS i randomiserte, dobbeltblinde, kontrollerte kliniske studier, inkludert 2605 pasienter med type 2-diabetes og makrovaskulær sykdom behandlet med ACTOS 30 mg i den kliniske PROactive-studien. I disse studiene har over 6000 pasienter blitt behandlet med ACTOS i seks måneder eller lenger, over 4500 pasienter har blitt behandlet med ACTOS 15 mg i ett år eller lenger, og over 3000 pasienter har blitt behandlet med ACTOS i minst to år.
seks sammenslåtte 16 til 26 ukers placebokontrollert monoterapi og 16 til 24 ukers tilleggskombinasjonsbehandlingsstudier, var forekomsten av seponeringer på grunn av bivirkninger 4,5 % for pasienter behandlet med ACTOS 30 mg og 5,8 % for komparator- behandlede pasienter. De vanligste bivirkningene som førte til seponering var relatert til utilstrekkelig glykemisk kontroll, selv om forekomsten av disse hendelsene var lavere (1,5 %) med ACTOS 30 mg enn med placebo (3,0 %).
I PROactive-studien var forekomsten av abstinenser på grunn av bivirkninger 9,0 % for pasienter behandlet med ACTOS 30 mg og 7,7 % for placebobehandlede pasienter. Kongestiv hjertesvikt var den vanligste alvorlige bivirkningen som førte til abstinenser hos 1,3 % av pasientene behandlet med ACTOS 30 mg og 0,6 % av pasientene behandlet med placebo.
Vanlige bivirkninger: 16-til 26-ukers monoterapiforsøk
En oppsummering av forekomsten og typen vanlige bivirkninger rapportert i tre sammenslåtte 16 til 26 ukers placebokontrollerte monoterapistudier av ACTOS er gitt i tabell 1. Termer som er rapportert representerer de som oppstod med en forekomst på >5 % og mer vanlig. hos pasienter behandlet med ACTOS 15 mg enn hos pasienter som fikk placebo. Ingen av disse bivirkningene var relatert til ACTOS-dose.
Vanlige uønskede hendelser: 16- til 24-ukers tilleggskombinasjonsterapiforsøk
En oppsummering av den generelle forekomsten og typene av vanlige bivirkninger rapportert i studier med ACTOS tillegg til sulfonylurea er gitt i tabell 2. Termer som er rapportert representerer de som oppstod med en forekomst på >5 % og mer vanlig med de høyeste testede dose ACTOS.
En oppsummering av den generelle forekomsten og typene av vanlige bivirkninger rapportert i studier med ACTOS 30 mg tillegg til metformin er gitt i tabell 3. Termer som er rapportert representerer de som skjedde med en insidens på >5 % og mer vanlig med den høyeste testet dose av ACTOS.
Tabell 4 oppsummerer forekomsten og typene av vanlige bivirkninger rapportert i studier med ACTOS-tillegg til insulin. Termer som er rapportert representerer de som oppstod med en forekomst på >5 % og mer vanlig med den høyeste testede dosen av ACTOS.
En oppsummering av den generelle forekomsten og typene av vanlige uønskede hendelser rapportert i PROactive-studien er gitt i tabell 5. Termer som er rapportert representerer de som oppstod med en forekomst på >5 % og mer vanlig hos pasienter behandlet med ACTOS enn hos pasienter som fikk placebo.
Kongestiv hjertesvikt
En oppsummering av forekomsten av uønskede hendelser relatert til kongestiv hjertesvikt er gitt i tabell 6 for 16- til 24-ukers tillegg til sulfonylurea-studier, for 16- til 24-ukers tillegg til insulinstudier, og for 16- til 24-ukers tillegg til metforminstudier. Ingen av hendelsene var dødelige.
Pasienter med type 2 diabetes og NYHA klasse II eller tidlig klasse III kongestiv hjertesvikt ble randomisert til å motta 24 ukers dobbeltblind behandling med enten ACTOS 30 mg i daglige doser på 30 mg til 45 mg (n=262) eller glyburid i daglige doser på 10 mg til 15 mg (n=256). En oppsummering av forekomsten av uønskede hendelser relatert til kongestiv hjertesvikt rapportert i denne studien er gitt i tabell 7.
Hjertesvikthendelser som førte til sykehusinnleggelse som skjedde under PROactive-studien er oppsummert i tabell 8.
Kardiovaskulær sikkerhet
PROactive-studien ble 5238 pasienter med type 2-diabetes og en historie med makrovaskulær sykdom randomisert til ACTOS (N=2605), tvangstitrert opp til 45 mg daglig eller placebo (N=2633) i tillegg til standardbehandling. Nesten alle pasientene (95 %) fikk kardiovaskulære medisiner (betablokkere, ACE-hemmere, angiotensin II-reseptorblokkere, kalsiumkanalblokkere, nitrater, diuretika, aspirin, statiner og fibrater). Ved baseline hadde pasientene en gjennomsnittsalder på 62 år, gjennomsnittlig varighet av diabetes på 9,5 år og gjennomsnittlig HbA1c på 8,1%. Gjennomsnittlig varighet av oppfølging var 34,5 måneder. Hovedformålet med denne studien var å undersøke effekten av ACTOS på dødelighet og makrovaskulær morbiditet hos pasienter med type 2 diabetes mellitus som hadde høy risiko for makrovaskulære hendelser. Den primære effektvariabelen var tiden til den første forekomsten av enhver hendelse i et kardiovaskulært sammensatt endepunkt som inkluderte dødelighet av alle årsaker, ikke-fatalt hjerteinfarkt (MI) inkludert stille hjerteinfarkt, hjerneslag, akutt koronarsyndrom, hjerteintervensjon inkludert koronar bypasstransplantasjon eller perkutan intervensjon, større benamputasjon over ankelen og bypass-operasjon eller revaskularisering i benet. Totalt 514 (19,7 %) pasienter behandlet med ACTOS 15 mg og 572 (21,7 %) placebobehandlede pasienter opplevde minst én hendelse fra det primære sammensatte endepunktet (hazard ratio 0,90; 95 % konfidensintervall: 0,80, 1,02; p=0,10 ).
Selv om det ikke var noen statistisk signifikant forskjell mellom ACTOS og placebo for den treårige forekomsten av en første hendelse innenfor denne kompositten, var det ingen økning i dødelighet eller i totale makrovaskulære hendelser med ACTOS. Antall første forekomster og totale individuelle hendelser som bidrar til det primære sammensatte endepunktet er vist i tabell 9.
Vektøkning
Doserelatert vektøkning oppstår når ACTOS 30 mg brukes alene eller i kombinasjon med andre antidiabetiske medisiner. Mekanismen for vektøkning er uklar, men involverer sannsynligvis en kombinasjon av væskeretensjon og fettansamling.
Tabell 10 og 11 oppsummerer endringene i kroppsvekt med ACTOS og placebo i 16- til 26-ukers randomiserte, dobbeltblinde monoterapi- og 16- til 24-ukers kombinasjonsbehandlingsstudier og i PROactive-studien.
Ødem
Ødem forårsaket av å ta ACTOS er reversibelt når ACTOS seponeres. Ødemet krever vanligvis ikke sykehusinnleggelse med mindre det er samtidig kongestiv hjertesvikt. En oppsummering av hyppigheten og typene av ødembivirkninger som forekommer i kliniske undersøkelser av ACTOS 30 mg er gitt i tabell 12.
Levereffekter
Det har hittil ikke vært bevis for indusert levertoksisitet med ACTOS i databasen for kontrollerte kliniske studier av ACTOS. En randomisert, dobbeltblind 3-årig studie som sammenlignet ACTOS 15 mg med glyburid som tillegg til metformin- og insulinbehandling ble spesielt utviklet for å evaluere forekomsten av serum-ALAT-økning til mer enn tre ganger øvre grense for referanseområdet, målt hver åtte uker i de første 48 ukene av forsøket og deretter hver 12. uke. Totalt 3/1051 (0,3 %) pasienter behandlet med ACTOS og 9/1046 (0,9 %) pasienter behandlet med glyburid utviklet ALAT-verdier større enn tre ganger øvre grense for referanseområdet. Ingen av pasientene behandlet med ACTOS i ACTOS-databasen for kontrollerte kliniske studier til dags dato har hatt en serum-ALAT større enn tre ganger øvre grense for referanseområdet og en tilsvarende total bilirubin større enn to ganger øvre grense for referanseområdet, en kombinasjon som predikerer potensialet for alvorlig medikamentindusert leverskade.
Hypoglykemi
I de kliniske studiene med ACTOS 15 mg ble det rapportert bivirkninger av hypoglykemi basert på klinisk vurdering fra etterforskerne og krevde ikke bekreftelse med fingerstikk-glukosetesting.
I den 16-ukers tilleggsstudien til sulfonylurea var forekomsten av rapportert hypoglykemi 3,7 % med ACTOS 30 mg og 0,5 % med placebo. I den 16-ukers tilleggsstudien med insulin var forekomsten av rapportert hypoglykemi 7,9 % med ACTOS 15 mg, 15,4 % med ACTOS 30 mg og 4,8 % med placebo.
Forekomsten av rapportert hypoglykemi var høyere med ACTOS 45 mg sammenlignet med ACTOS 30 mg i både den 24-ukers tilleggsstudien til sulfonylurea (15,7 % vs. 13,4 %) og i den 24-ukers tilleggsstudien med insulin (47,8). % vs. 43,5 %).
Tre pasienter i disse fire studiene ble innlagt på sykehus på grunn av hypoglykemi. Alle tre pasientene fikk ACTOS 30 mg (0,9 %) i den 24-ukers tilleggsstudien med insulin. Ytterligere 14 pasienter rapporterte alvorlig hypoglykemi (definert som å forårsake betydelig forstyrrelse av pasientens vanlige aktiviteter) som ikke krevde sykehusinnleggelse. Disse pasientene fikk ACTOS 45 mg i kombinasjon med sulfonylurea (n=2) eller ACTOS 30 mg eller 45 mg i kombinasjon med insulin (n=12).
Urinblæresvulster
Tumorer ble observert i urinblæren hos hannrotter i den toårige karsinogenitetsstudien [se Ikke-klinisk toksikologi ]. I løpet av den treårige PROactive-studien ble 14 pasienter av 2605 (0,54 %) randomisert til ACTOS og 5 av 2633 (0,19 %) randomiserte til placebo diagnostisert med blærekreft. Etter å ha ekskludert pasienter hvor eksponeringen for studiemedisinen var mindre enn ett år ved diagnosen blærekreft, var det 6 (0,23 %) tilfeller på ACTOS 15 mg og to (0,08 %) tilfeller på placebo. Etter fullføring av studien ble en stor undergruppe av pasienter observert i opptil 10 ekstra år, med liten ekstra eksponering for ACTOS. I løpet av de 13 årene med både PROaktiv og observasjonsoppfølging var forekomsten av blærekreft ikke forskjellig mellom pasienter randomisert til ACTOS eller placebo (HR =1,00; 95 % KI: 0,59-1,72) [se ADVARSLER OG FORHOLDSREGLER ].
Laboratorieavvik
Hematologiske effekter
ACTOS 15mg kan forårsake reduksjoner i hemoglobin og hematokrit. I placebokontrollerte monoterapistudier falt gjennomsnittlige hemoglobinverdier med 2 % til 4 % hos pasienter behandlet med ACTOS sammenlignet med en gjennomsnittlig endring i hemoglobin på -1 % til +1 % hos placebobehandlede pasienter. Disse endringene skjedde hovedsakelig i løpet av de første 4 til 12 ukene av behandlingen og forble relativt konstante deretter. Disse endringene kan være relatert til økt plasmavolum assosiert med ACTOS 30 mg-behandling og er sannsynligvis ikke assosiert med noen klinisk signifikante hematologiske effekter.
Kreatinfosfokinase
Under protokollspesifisert måling av serumkreatinfosfokinase (CPK) i ACTOS 15 mg kliniske studier, ble det observert en isolert økning i CPK til mer enn 10 ganger øvre grense for referanseområdet hos ni (0,2 %) pasienter behandlet med ACTOS (verdier av 2150 til 11400 IE/L) og hos ingen komparatorbehandlede pasienter. Seks av disse ni pasientene fortsatte å motta ACTOS 15 mg, to pasienter ble registrert å ha CPK-økning på den siste doseringsdagen og en pasient avbrøt ACTOS på grunn av forhøyelsen. Disse økningene forsvant uten noen tilsynelatende kliniske følgetilstander. Forholdet mellom disse hendelsene og ACTOS 30 mg-behandling er ukjent.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av ACTOS etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det vanligvis ikke mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering.
- . Nyoppstått eller forverret diabetisk makulaødem med nedsatt synsskarphet [se ADVARSLER OG FORHOLDSREGLER ]. . Fatal og ikke-dødelig leversvikt [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing rapporter om kongestiv hjertesvikt er rapportert hos pasienter behandlet med ACTOS, både med og uten tidligere kjent hjertesykdom og både med og uten samtidig insulinadministrasjon.
Etter markedsføring har det vært rapporter om uvanlig raske økninger i vekt og økninger utover det som generelt er observert i kliniske studier. Pasienter som opplever slike økninger bør vurderes for væskeansamling og volumrelaterte hendelser som overdreven ødem og kongestiv hjertesvikt [se BOKS ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
NARKOTIKAHANDEL
Sterke CYP2C8-hemmere
En hemmer av CYP2C8 (f.eks. gemfibrozil) øker eksponeringen (arealet under serumkonsentrasjon-tid-kurven eller AUC) og halveringstiden (t½) for pioglitazon signifikant. Derfor er maksimal anbefalt dose av ACTOS 15 mg daglig hvis det brukes i kombinasjon med gemfibrozil eller andre sterke CYP2C8-hemmere [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
CYP2C8 indusere
En induktor av CYP2C8 (f.eks. rifampin) kan redusere eksponeringen (AUC) av pioglitazon betydelig. Derfor, hvis en induser av CYP2C8 startes eller stoppes under behandling med ACTOS 30 mg, kan endringer i diabetesbehandlingen være nødvendig basert på klinisk respons uten å overskride maksimal anbefalt daglig dose på 45 mg for ACTOS [se KLINISK FARMAKOLOGI ].
Topiramat
En reduksjon i eksponeringen av pioglitazon og dets aktive metabolitter ble observert ved samtidig administrering av pioglitazon og topiramat [se KLINISK FARMAKOLOGI ]. Den kliniske relevansen av denne reduksjonen er ukjent; men når ACTOS og topiramat brukes samtidig, overvåk pasienter for adekvat glykemisk kontroll.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Kongestiv hjertesvikt
ACTOS 15mg, som andre tiazolidindioner, kan forårsake doserelatert væskeretensjon når det brukes alene eller i kombinasjon med andre antidiabetiske medisiner og er mest vanlig når ACTOS 30mg brukes i kombinasjon med insulin. Væskeretensjon kan føre til eller forverre kongestiv hjertesvikt. Pasienter bør observeres for tegn og symptomer på kongestiv hjertesvikt. Hvis kongestiv hjertesvikt utvikler seg, bør den behandles i henhold til gjeldende standarder for omsorg og seponering eller dosereduksjon av ACTOS må vurderes [se BOKS ADVARSEL , KONTRAINDIKASJONER , og BIVIRKNINGER ].
Hypoglykemi
Pasienter som får ACTOS i kombinasjon med insulin eller andre antidiabetiske medisiner (spesielt insulinsekretagoger som sulfonylurea) kan ha risiko for hypoglykemi. En reduksjon i dosen av den samtidige antidiabetiske medisinen kan være nødvendig for å redusere risikoen for hypoglykemi [se DOSERING OG ADMINISTRASJON ].
Levereffekter
Det har vært rapporter etter markedsføring om fatal og ikke-dødelig leversvikt hos pasienter som tar ACTOS 15 mg, selv om rapportene ikke inneholder tilstrekkelig informasjon som er nødvendig for å fastslå den sannsynlige årsaken. Det har ikke vært bevis for legemiddelindusert levertoksisitet i ACTOS 30 mg kontrollerte kliniske studiedatabase til dags dato [se BIVIRKNINGER ].
Pasienter med type 2-diabetes kan ha fettleversykdom eller hjertesykdom med episodisk kongestiv hjertesvikt, som begge kan forårsake unormale leverprøver, og de kan også ha andre former for leversykdom, hvorav mange kan behandles eller behandles. Derfor anbefales det å innhente et levertestpanel (serumalaninaminotransferase [ALT], aspartataminotransferase [AST], alkalisk fosfatase og total bilirubin) og vurdere pasienten før ACTOS-behandling startes. Hos pasienter med unormale leverprøver bør ACTOS 15 mg initieres med forsiktighet.
Mål levertester umiddelbart hos pasienter som rapporterer symptomer som kan indikere leverskade, inkludert tretthet, anoreksi, ubehag i øvre høyre del av magen, mørk urin eller gulsott. I denne kliniske sammenhengen, hvis pasienten viser seg å ha unormale leverprøver (ALT større enn 3 ganger øvre grense for referanseområdet), bør ACTOS 15 mg-behandling avbrytes og undersøkelse gjøres for å fastslå den sannsynlige årsaken. ACTOS bør ikke startes på nytt hos disse pasientene uten en annen forklaring på unormale leverprøver.
Pasienter som har serum-ALAT større enn tre ganger referanseområdet med total serumbilirubin større enn to ganger referanseområdet uten alternative etiologier, er i fare for alvorlig legemiddelindusert leverskade, og bør ikke startes på nytt med ACTOS. For pasienter med mindre forhøyelser av serum-ALAT eller bilirubin og med en alternativ sannsynlig årsak, kan behandling med ACTOS brukes med forsiktighet.
Urinblæresvulster
Tumorer ble observert i urinblæren hos hannrotter i den toårige karsinogenitetsstudien [se Ikke-klinisk toksikologi ]. I tillegg ble 14 pasienter av 2605 (0,54 %) randomisert til ACTOS 15 mg og 5 av 2633 (0,19 %) randomiserte til placebo diagnostisert med blærekreft i løpet av den treårige kliniske studien med PROactive. Etter å ha ekskludert pasienter hvor eksponeringen for studiemedisinen var mindre enn ett år ved diagnosen blærekreft, var det 6 (0,23 %) tilfeller på ACTOS 30 mg og to (0,08 %) tilfeller på placebo. Etter fullføring av studien ble en stor undergruppe av pasienter observert i opptil 10 ekstra år, med liten ekstra eksponering for ACTOS. I løpet av de 13 årene med både PROaktiv og observasjonsoppfølging var forekomsten av blærekreft ikke forskjellig mellom pasienter randomisert til ACTOS 30 mg eller placebo (HR = 1,00; [95 % KI: 0,59-1,72]).
Funn angående risiko for blærekreft hos pasienter eksponert for ACTOS varierer mellom observasjonsstudier; noen fant ikke økt risiko for blærekreft assosiert med ACTOS 30mg, mens andre gjorde det.
En stor prospektiv 10-årig observasjonskohortstudie utført i USA fant ingen statistisk signifikant økning i risikoen for blærekreft hos diabetespasienter som noen gang har blitt eksponert for ACTOS, sammenlignet med de som aldri har blitt eksponert for ACTOS (HR = 1,06 [95 % KI 0,89-1,26) ]).
En retrospektiv kohortstudie utført med data fra Storbritannia fant en statistisk signifikant sammenheng mellom stadig eksponering for ACTOS og blærekreft (HR: 1,63; [95 % KI: 1,22-2,19]).
Assosiasjoner mellom kumulativ dose eller kumulativ varighet av eksponering for ACTOS 15mg og blærekreft ble ikke oppdaget i noen studier inkludert den 10-årige observasjonsstudien i USA, men i andre. Inkonsekvente funn og begrensninger som ligger i disse og andre studier utelukker konkluderende tolkninger av observasjonsdataene.
ACTOS kan være assosiert med en økning i risikoen for urinblæresvulster. Det er utilstrekkelig data til å avgjøre om pioglitazon er en tumorpromoter for urinblæresvulster.
Følgelig bør ACTOS ikke brukes hos pasienter med aktiv blærekreft, og fordelene med glykemisk kontroll versus ukjent risiko for tilbakefall av kreft med ACTOS bør vurderes hos pasienter med tidligere blærekreft.
Ødem
I kontrollerte kliniske studier ble ødem rapportert hyppigere hos pasienter behandlet med ACTOS 30 mg enn hos placebobehandlede pasienter og er doserelatert [se BIVIRKNINGER ]. Etter markedsføring har det blitt mottatt rapporter om nye oppståtte eller forverrede ødem.
ACTOS 15 mg bør brukes med forsiktighet hos pasienter med ødem. Fordi tiazolidindioner, inkludert ACTOS, kan forårsake væskeretensjon, som kan forverre eller føre til kongestiv hjertesvikt, bør ACTOS 30 mg brukes med forsiktighet hos pasienter med risiko for kongestiv hjertesvikt. Pasienter som behandles med ACTOS bør overvåkes for tegn og symptomer på kongestiv hjertesvikt [se BOKS ADVARSEL , Kongestiv hjertesvikt og PASIENTINFORMASJON ].
Brudd
PROactive (den prospektive Pioglitazon Clinical Trial in Macrovascular Events) ble 5238 pasienter med type 2 diabetes og en historie med makrovaskulær sykdom randomisert til ACTOS (N=2605), tvangstitrert opp til 45 mg daglig eller placebo (N=2633) i tillegg til standard på omsorg. I løpet av en gjennomsnittlig oppfølging på 34,5 måneder var forekomsten av benbrudd hos kvinner 5,1 % (44/870) for ACTOS 30 mg versus 2,5 % (23/905) for placebo. Denne forskjellen ble registrert etter det første behandlingsåret og vedvarte i løpet av studien. De fleste bruddene som ble observert hos kvinnelige pasienter var ikke-vertebrale frakturer inkludert underekstremitet og distale overekstremitet. Ingen økning i forekomsten av brudd ble observert hos menn behandlet med ACTOS (1,7 %) versus placebo (2,1 %). Risikoen for brudd bør vurderes i behandlingen av pasienter, spesielt kvinnelige pasienter, behandlet med ACTOS, og oppmerksomhet bør gis til å vurdere og opprettholde beinhelse i henhold til gjeldende standarder for omsorg.
Makulaødem
Makulaødem er rapportert etter markedsføring hos diabetespasienter som tok ACTOS eller et annet tiazolidindion. Noen pasienter hadde tåkesyn eller nedsatt synsskarphet, mens andre ble diagnostisert ved rutinemessig oftalmologisk undersøkelse.
De fleste pasientene hadde perifert ødem på det tidspunktet makulaødem ble diagnostisert. Noen pasienter hadde bedring i makulaødem etter seponering av tiazolidindion.
Pasienter med diabetes bør ha regelmessige øyeundersøkelser av en øyelege i henhold til gjeldende standarder for omsorg. Pasienter med diabetes som rapporterer visuelle symptomer bør umiddelbart henvises til en øyelege, uavhengig av pasientens underliggende medisiner eller andre fysiske funn [se BIVIRKNINGER ].
Makrovaskulære utfall
Det har ikke vært noen kliniske studier som har etablert konklusive bevis på makrovaskulær risikoreduksjon med ACTOS.
Informasjon om pasientveiledning
Se FDA-godkjent pasientmerking ( PASIENTINFORMASJON ).
- . Det er viktig å instruere pasientene til å følge kostholdsinstruksjonene og å få testet blodsukker og glykosylert hemoglobin regelmessig. I perioder med stress som feber, traumer, infeksjoner eller operasjoner, kan medisinbehov endres, og pasienter bør påminnes om å søke lege omgående. . Pasienter som opplever en uvanlig rask vektøkning eller ødem eller som utvikler kortpustethet eller andre symptomer på hjertesvikt mens de bruker ACTOS, bør umiddelbart rapportere disse symptomene til en lege. . Fortell pasienter om umiddelbart å slutte å ta ACTOS og søke øyeblikkelig legehjelp hvis det er uforklarlig kvalme, oppkast, magesmerter, tretthet, anoreksi eller mørk urin, da disse symptomene kan skyldes levertoksisitet. . Fortell pasientene om umiddelbart å rapportere tegn på makroskopisk hematuri eller andre symptomer som dysuri eller urintrang som utvikler seg eller øker under behandlingen, da disse kan skyldes blærekreft. . Fortell pasientene om å ta ACTOS 15 mg en gang daglig. ACTOS 15 mg kan tas med eller uten måltider. Hvis en dose glemmes på én dag, bør dosen ikke dobles neste dag. . Ved bruk av kombinasjonsbehandling med insulin eller andre antidiabetiske medisiner, bør risikoen for hypoglykemi, dens symptomer og behandling, og tilstander som disponerer for utviklingen, forklares for pasienter og deres familiemedlemmer. . Informer kvinnelige pasienter om at behandling med ACTOS 30 mg, som andre tiazolidindioner, kan føre til en utilsiktet graviditet hos noen premenopausale anovulatoriske kvinner på grunn av dens effekt på eggløsning [se Bruk i spesifikke populasjoner ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
En toårig karsinogenitetsstudie ble utført på hann- og hunnrotter ved orale doser opptil 63 mg/kg (ca. 14 ganger den maksimale anbefalte orale dosen til mennesker på 45 mg basert på mg/m2). Legemiddelinduserte svulster ble ikke observert i noe organ bortsett fra urinblæren hos hannrotter. Benigne og/eller ondartede overgangscelle-neoplasmer ble observert hos hannrotter ved 4 mg/kg/dag og over (omtrent lik maksimal anbefalt oral dose til mennesker basert på mg/m2). Urinsten med påfølgende irritasjon og hyperplasi ble postulert som mekanismen for blæresvulster observert hos hannrotter. En to-årig mekanistisk studie på hannrotter som benyttet diettforsuring for å redusere dannelsen av tannstein ble fullført i 2009. Kostforsuring avtok, men opphevet ikke de hyperplastiske forandringene i blæren. Tilstedeværelsen av tannstein forverret den hyperplastiske responsen på pioglitazon, men ble ikke ansett som den primære årsaken til de hyperplastiske endringene.
Relevansen for mennesker av blærefunnene hos hannrotten kan ikke utelukkes.

En toårig karsinogenitetsstudie ble også utført på hann- og hunnmus ved orale doser opptil 100 mg/kg/dag (omtrent 11 ganger den maksimale anbefalte orale dosen til mennesker basert på mg/m2). Ingen medikamentinduserte svulster ble observert i noe organ.
Pioglitazonhydroklorid var ikke mutagent i en rekke genetiske toksikologiske studier, inkludert Ames-bakterieanalysen, en pattedyrcelle-forover-genmutasjonsanalyse (CHO/HPRT og AS52/XPRT), en in vitro cytogenetisk analyse som bruker CHL-celler, en ikke-planlagt DNA-synteseanalyse og en in vivo mikronukleusanalyse.
Ingen bivirkninger på fertilitet ble observert hos hann- og hunnrotter ved orale doser opptil 40 mg/kg pioglitazonhydroklorid daglig før og gjennom parring og svangerskap (omtrent ni ganger den maksimale anbefalte orale dosen til mennesker basert på mg/m2).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Begrensede data med ACTOS hos gravide kvinner er ikke tilstrekkelig til å bestemme en medikamentassosiert risiko for alvorlige fødselsskader eller spontanabort. Det er risiko for mor og foster forbundet med dårlig kontrollert diabetes under svangerskapet [se Kliniske betraktninger ].
I reproduksjonsstudier på dyr ble ingen uønskede utviklingseffekter observert når pioglitazon ble administrert til drektige rotter og kaniner under organogenese ved eksponeringer opp til henholdsvis 5 og 35 ganger den kliniske dosen på 45 mg, basert på kroppsoverflate [se Data ].
Estimert bakgrunnsrisiko for store fødselsskader er 6-10 % hos kvinner med pre-svangerskapsdiabetes med HbA1c >7 og er rapportert å være så høy som 20-25 % hos kvinner med HbA1c >10. Estimert bakgrunnsrisiko for spontanabort for den angitte populasjonen er ukjent. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2-4 % og 15-20 %.
Kliniske betraktninger
Sykdomsrelatert mors- og/eller embryo-/fosterrisiko
Dårlig kontrollert diabetes under svangerskapet øker mors risiko for diabetisk ketoacidose, svangerskapsforgiftning, spontane aborter, prematur fødsel, dødfødsel og fødselskomplikasjoner. Dårlig kontrollert diabetes øker fosterrisikoen for store fødselsskader, dødfødsel og makrosomirelatert sykelighet.
Data
Dyredata
Pioglitazon administrert til drektige rotter under organogenese forårsaket ikke uønskede utviklingseffekter ved en dose på 20 mg/kg (~5 ganger 45 mg klinisk dose), men forsinket fødsel og redusert embryoføtal levedyktighet ved 40 og 80 mg/kg, eller ≥ 9 ganger 45 mg klinisk dose, etter kroppsoverflate. Hos drektige kaniner som ble administrert pioglitazon under organogenese, ble det ikke observert uønskede utviklingseffekter ved 80 mg/kg (~35 ganger 45 mg klinisk dose), men redusert embryoføtal levedyktighet ved 160 mg/kg, eller ~69 ganger 45 mg klinisk. dose, etter kroppsoverflate. Når gravide rotter fikk pioglitazon under sen drektighet og amming, oppsto forsinket postnatal utvikling, tilskrevet redusert kroppsvekt, hos avkom ved maternelle doser på 10 mg/kg og over eller ≥2 ganger den kliniske dosen på 45 mg, etter kroppsoverflate.
Amming
Risikosammendrag
Det er ingen informasjon om tilstedeværelsen av pioglitazon i morsmelk, virkningene på spedbarnet som ammes, eller effekten på melkeproduksjonen. Pioglitazon finnes i rottemelk; På grunn av artsspesifikke forskjeller i laktasjonsfysiologi kan det imidlertid hende at dyredata ikke kan forutsi medikamentnivåer i morsmelk på en pålitelig måte. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for ACTOS 15mg og eventuelle potensielle bivirkninger på det ammede spedbarnet fra ACTOS 30mg eller fra den underliggende morens tilstand.
Kvinner og menn med reproduktivt potensial
Diskuter potensialet for utilsiktet graviditet med premenopausale kvinner, da behandling med ACTOS, som andre tiazolidindioner, kan føre til eggløsning hos noen anovulatoriske kvinner.
Pediatrisk bruk
Sikkerhet og effektivitet av ACTOS hos pediatriske pasienter er ikke fastslått.
ACTOS 15mg anbefales ikke til bruk hos pediatriske pasienter basert på bivirkninger observert hos voksne, inkludert væskeretensjon og kongestiv hjertesvikt, frakturer og urinblæresvulster [se ADVARSLER OG FORHOLDSREGLER ].
Geriatrisk bruk
Totalt 92 pasienter (15,2 %) behandlet med ACTOS i de tre sammenslåtte 16 til 26 ukers dobbeltblinde, placebokontrollerte monoterapistudiene var ≥65 år gamle og to pasienter (0,3 %) var ≥75 år. I de to sammenslåtte 16- til 24-ukers tilleggsstudiene til sulfonylurea var 201 pasienter (18,7 %) behandlet med ACTOS 30 mg ≥65 år og 19 (1,8 %) var ≥75 år. I de to sammenslåtte 16- til 24-ukers tilleggsstudiene til metformin, var 155 pasienter (15,5 %) behandlet med ACTOS ≥65 år og 19 (1,9 %) var ≥75 år. I de to sammenslåtte 16- til 24-ukers tilleggsstudiene til insulin, var 272 pasienter (25,4%) behandlet med ACTOS ≥65 år og 22 (2,1%) var ≥75 år.
I PROactive var 1068 pasienter (41,0%) behandlet med ACTOS ≥65 år og 42 (1,6%) var ≥75 år.
farmakokinetiske studier med pioglitazon ble det ikke observert signifikante forskjeller i farmakokinetiske parametere mellom eldre og yngre pasienter [se KLINISK FARMAKOLOGI ].
Selv om kliniske erfaringer ikke har identifisert forskjeller i effektivitet og sikkerhet mellom eldre (≥65 år) og yngre pasienter, er disse konklusjonene begrenset av små utvalgsstørrelser for pasienter ≥75 år.
OVERDOSE
Under kontrollerte kliniske studier ble det rapportert ett tilfelle av overdosering med ACTOS 30 mg. En mannlig pasient tok 120 mg per dag i fire dager, deretter 180 mg per dag i syv dager. Pasienten nektet for noen kliniske symptomer i denne perioden.
Ved overdosering bør passende støttebehandling initieres i henhold til pasientens kliniske tegn og symptomer.
KONTRAINDIKASJONER
- . Oppstart hos pasienter med etablert NYHA klasse III eller IV hjertesvikt [se BOKS ADVARSEL ]. . Bruk hos pasienter med kjent overfølsomhet overfor pioglitazon eller andre komponenter i ACTOS.
KLINISK FARMAKOLOGI
Virkningsmekanismen
ACTOS 15mg er et tiazolidindion som er avhengig av tilstedeværelsen av insulin for sin virkningsmekanisme. ACTOS reduserer insulinresistens i periferien og i leveren, noe som resulterer i økt insulinavhengig glukosedisponering og redusert hepatisk glukoseproduksjon. Pioglitazon er ikke en insulinsekretagog. Pioglitazon er en agonist for peroksisomproliferatoraktivert reseptor-gamma (PPAR?). PPAR-reseptorer finnes i vev som er viktige for insulinvirkning som fettvev, skjelettmuskulatur og lever. Aktivering av PPAR? nukleære reseptorer modulerer transkripsjonen av en rekke insulinresponsive gener som er involvert i kontrollen av glukose og lipidmetabolisme.
dyremodeller for diabetes reduserer pioglitazon hyperglykemi, hyperinsulinemi og hypertriglyseridemi som er karakteristisk for insulinresistente tilstander som type 2 diabetes. De metabolske endringene som produseres av pioglitazon resulterer i økt respons av insulinavhengig vev og er observert i en rekke dyremodeller for insulinresistens.
Fordi pioglitazon forsterker effekten av sirkulerende insulin (ved å redusere insulinresistens), senker det ikke blodsukkeret i dyremodeller som mangler endogent insulin.
Farmakodynamikk
Kliniske studier viser at ACTOS 15mg forbedrer insulinfølsomheten hos insulinresistente pasienter. ACTOS forbedrer cellulær respons på insulin, øker insulinavhengig glukose-disponering og forbedrer leverfølsomheten for insulin. Hos pasienter med type 2-diabetes resulterer den reduserte insulinresistensen produsert av ACTOS i lavere plasmaglukosekonsentrasjoner, lavere plasmainsulinkonsentrasjoner og lavere HbA1c-verdier. I kontrollerte kliniske studier hadde ACTOS en additiv effekt på glykemisk kontroll når det ble brukt i kombinasjon med et sulfonylurea, metformin eller insulin [se Kliniske studier ].
Pasienter med lipidavvik ble inkludert i kliniske studier med ACTOS. Totalt sett hadde pasienter behandlet med ACTOS 15 mg gjennomsnittlig reduksjon i serumtriglyserider, gjennomsnittlig økning i HDL-kolesterol og ingen konsistente gjennomsnittlige endringer i LDL og totalkolesterol. Det er ingen avgjørende bevis for makrovaskulær fordel med ACTOS [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
en 26-ukers, placebokontrollert, dosevarierende monoterapistudie, sank gjennomsnittlig serumtriglyserider i dosegruppene 15 mg, 30 mg og 45 mg ACTOS 15 mg sammenlignet med en gjennomsnittlig økning i placebogruppen. Gjennomsnittlig HDL-kolesterol økte i større grad hos pasienter behandlet med ACTOS 30 mg enn hos placebobehandlede pasienter. Det var ingen konsistente forskjeller for LDL og totalkolesterol hos pasienter behandlet med ACTOS sammenlignet med placebo (se tabell 14).
I de to andre monoterapistudiene (16 uker og 24 uker) og i kombinasjonsterapistudier med sulfonylurea (16 uker og 24 uker), metformin (16 uker og 24 uker) eller insulin (16 uker og 24 uker), var resultatene generelt samsvarer med dataene ovenfor.
Farmakokinetikk
Etter administrering én gang daglig av ACTOS 15 mg, oppnås steady-state serumkonsentrasjoner av både pioglitazon og dets viktigste aktive metabolitter, M-III (ketoderivat av pioglitazon) og M-IV (hydroksylderivat av pioglitazon), innen syv dager. Ved steady-state når M-III og M-IV serumkonsentrasjoner lik eller større enn pioglitazon. Ved steady-state, hos både friske frivillige og pasienter med type 2-diabetes, utgjør pioglitazon omtrent 30 % til 50 % av maksimale totale serumkonsentrasjoner av pioglitazon (pioglitazon pluss aktive metabolitter) og 20 % til 25 % av total AUC.
Cmax, AUC og bunnserumkonsentrasjoner (Cmin) for pioglitazon og M-III og M-IV økte proporsjonalt med administrerte doser på 15 mg og 30 mg per dag.
Absorpsjon
Etter oral administrering av pioglitazon var Tmax for pioglitazon innen to timer. Mat forsinker Tmax til tre til fire timer, men endrer ikke graden av absorpsjon (AUC).
Fordeling
Gjennomsnittlig tilsynelatende distribusjonsvolum (Vd/F) av pioglitazon etter enkeltdoseadministrasjon er 0,63 ± 0,41 (gjennomsnittlig ± SD) L/kg kroppsvekt. Pioglitazon er i stor grad proteinbundet (>99 %) i humant serum, hovedsakelig til serumalbumin. Pioglitazon binder seg også til andre serumproteiner, men med lavere affinitet. M-III og M-IV er også i stor grad bundet (>98%) til serumalbumin.
Metabolisme
Pioglitazon metaboliseres i stor grad ved hydroksylering og oksidasjon; metabolittene omdannes også delvis til glukuronid- eller sulfatkonjugater. Metabolittene M-III og M-IV er de viktigste sirkulerende aktive metabolittene hos mennesker.
In vitro-data viser at flere CYP-isoformer er involvert i metabolismen av pioglitazon, som inkluderer CYP2C8 og, i mindre grad, CYP3A4 med ytterligere bidrag fra en rekke andre isoformer, inkludert den hovedsakelig ekstrahepatiske CYP1A1. In vivo-studie av pioglitazon i kombinasjon med gemfibrozil, en sterk CYP2C8-hemmer, viste at pioglitazon er et CYP2C8-substrat [se DOSERING OG ADMINISTRASJON og NARKOTIKAHANDEL ]. Urin 6β-hydroksykortisol/kortisol-forhold målt hos pasienter behandlet med ACTOS 30 mg viste at pioglitazon ikke er en sterk CYP3A4-enzyminduser.
Utskillelse og eliminering
Etter oral administrering gjenfinnes ca. 15 % til 30 % av pioglitazondosen i urinen. Renal eliminering av pioglitazon er ubetydelig, og legemidlet utskilles primært som metabolitter og deres konjugater. Det antas at det meste av den orale dosen skilles ut i gallen enten uendret eller som metabolitter og elimineres i avføringen.
Gjennomsnittlig serumhalveringstid (t1/2) for pioglitazon og dets metabolitter (M-III og M-IV) varierer fra henholdsvis tre til syv timer og 16 til 24 timer. Pioglitazon har en tilsynelatende klaring, CL/F, beregnet til å være fem til syv l/time.
Nedsatt nyrefunksjon
Eliminasjonshalveringstiden i serum for pioglitazon, M-III og M-IV forblir uendret hos pasienter med moderat (kreatininclearance [CLcr] 30 til 50 ml/min) og alvorlig (CLcr
Nedsatt leverfunksjon
Sammenlignet med friske kontroller har forsøkspersoner med nedsatt leverfunksjon (Child-Turcotte-Pugh grad B/C) en ca. 45 % reduksjon i pioglitazon og totalt pioglitazon (pioglitazon, M-III og M-IV) gjennomsnittlig Cmax, men ingen endring i gjennomsnittlige AUC-verdier. Det er derfor ikke nødvendig med dosejustering hos pasienter med nedsatt leverfunksjon.
Det er rapporter om leversvikt etter markedsføring med ACTOS, og kliniske studier har generelt ekskludert pasienter med serum-ALAT >2,5 ganger øvre grense for referanseområdet. Vær forsiktig hos pasienter med leversykdom [se ADVARSLER OG FORHOLDSREGLER ].
Geriatriske pasienter
Hos friske eldre personer var ikke Cmax for pioglitazon signifikant forskjellig, men AUC-verdiene var omtrent 21 % høyere enn de som ble oppnådd hos yngre personer. Gjennomsnittlig t1/2 for pioglitazon var også forlenget hos eldre forsøkspersoner (omtrent ti timer) sammenlignet med yngre personer (omtrent syv timer). Disse endringene var ikke av en størrelsesorden som ville anses som klinisk relevante.
Pediatriske pasienter
Sikkerhet og effekt av pioglitazon hos pediatriske pasienter er ikke fastslått. ACTOS 15mg anbefales ikke til bruk hos pediatriske pasienter [se Bruk i spesifikke populasjoner ].
Kjønn
Gjennomsnittlige Cmax- og AUC-verdier for pioglitazon ble økt med 20 % til 60 % hos kvinner sammenlignet med menn. I kontrollerte kliniske studier var HbA1c-reduksjoner fra baseline generelt større for kvinner enn for menn (gjennomsnittlig forskjell i HbA1c 0,5%). Fordi behandlingen bør individualiseres for hver pasient for å oppnå glykemisk kontroll, anbefales ingen dosejustering basert på kjønn alene.
Etnisitet
Farmakokinetiske data blant ulike etniske grupper er ikke tilgjengelig.
Legemiddel-legemiddelinteraksjoner
Dyretoksikologi og/eller farmakologi
Hjerteforstørrelse har blitt observert hos mus (100 mg/kg), rotter (4 mg/kg og over) og hunder (3 mg/kg) behandlet oralt med pioglitazonhydroklorid (ca. 11, 1 og 2 ganger maksimalt anbefalt oralt menneske. dose for henholdsvis mus, rotter og hunder basert på mg/m2). I en ettårig rottestudie forekom legemiddelrelatert tidlig død på grunn av tilsynelatende hjertedysfunksjon ved en oral dose på 160 mg/kg/dag (omtrent 35 ganger den maksimale anbefalte orale dosen til mennesker basert på mg/m2). Hjerteforstørrelse ble sett i en 13-ukers studie på aper ved orale doser på 8,9 mg/kg og over (omtrent fire ganger den maksimale anbefalte orale dosen for mennesker basert på mg/m2), men ikke i en 52-ukers studie ved orale doser opptil 32 mg/kg (ca. 13 ganger maksimal anbefalt oral dose til mennesker basert på mg/m2).
Kliniske studier
Monoterapi
Tre randomiserte, dobbeltblindede, placebokontrollerte studier med varighet fra 16 til 26 uker ble utført for å evaluere bruken av ACTOS som monoterapi hos pasienter med type 2 diabetes. Disse studiene undersøkte ACTOS 15 mg i doser opptil 45 mg eller placebo én gang daglig hos totalt 865 pasienter.
I en 26-ukers dosevarierende monoterapistudie ble 408 pasienter med type 2 diabetes randomisert til å motta 7,5 mg, 15 mg, 30 mg eller 45 mg ACTOS, eller placebo én gang daglig. Behandling med tidligere antidiabetika ble avbrutt åtte uker før den dobbeltblinde perioden. Behandling med 15 mg, 30 mg og 45 mg ACTOS 30 mg ga statistisk signifikante forbedringer i HbA1c og fastende plasmaglukose (FPG) ved endepunktet sammenlignet med placebo (se figur 1, tabell 17).
Figur 1 viser tidsforløpet for endringer i HbA1c i denne 26-ukers studien.
Figur 1. Gjennomsnittlig endring fra baseline for HbA1c i en 26-ukers placebokontrollert studie med doseintervall (observerte verdier)
en 24-ukers placebokontrollert monoterapistudie ble 260 pasienter med type 2-diabetes randomisert til en av to ACTOS-behandlingsgrupper med tvungen titrering eller en simulerttrert placebogruppe. Behandling med tidligere antidiabetika ble avbrutt seks uker før den dobbeltblinde perioden. I en ACTOS 15 mg-behandlingsgruppe fikk pasientene en startdose på 7,5 mg én gang daglig. Etter fire uker ble dosen økt til 15 mg én gang daglig, og etter ytterligere fire uker ble dosen økt til 30 mg én gang daglig for resten av forsøket (16 uker). I den andre ACTOS-behandlingsgruppen fikk pasientene en startdose på 15 mg én gang daglig og ble titrert til 30 mg én gang daglig og 45 mg én gang daglig på lignende måte. Behandling med ACTOS 15 mg, som beskrevet, ga statistisk signifikante forbedringer i HbA1c og FPG ved endepunkt sammenlignet med placebo (se tabell 18).
en 16-ukers monoterapistudie ble 197 pasienter med type 2 diabetes randomisert til behandling med 30 mg ACTOS eller placebo én gang daglig. Behandling med tidligere antidiabetika ble avbrutt seks uker før den dobbeltblinde perioden. Behandling med 30 mg ACTOS ga statistisk signifikante forbedringer i HbA1c og FPG ved endepunktet sammenlignet med placebo (se tabell 19).
Kombinasjonsterapi
Tre 16-ukers, randomiserte, dobbeltblinde, placebokontrollerte kliniske studier ble utført for å evaluere effekten av ACTOS (15 mg og/eller 30 mg) på glykemisk kontroll hos pasienter med type 2 diabetes som var utilstrekkelig kontrollert (HbA1c ≥8) %) til tross for gjeldende behandling med sulfonylurea, metformin eller insulin. I tillegg ble det utført tre 24-ukers randomiserte, dobbeltblindede kliniske studier for å evaluere effekten av ACTOS 30 mg vs. ACTOS 45 mg på glykemisk kontroll hos pasienter med type 2 diabetes som var utilstrekkelig kontrollert (HbA1c ≥8%) til tross for gjeldende behandling med sulfonylurea, metformin eller insulin. Tidligere diabetesbehandling kan ha vært monoterapi eller kombinasjonsbehandling.
Tillegg til sulfonylurea-forsøk
To kliniske studier ble utført med ACTOS i kombinasjon med et sulfonylurea. Begge studiene inkluderte pasienter med type 2 diabetes på en hvilken som helst dose av et sulfonylurea, enten alene eller i kombinasjon med et annet antidiabetisk middel. Alle andre antidiabetika ble seponert minst tre uker før studiebehandlingen startet.
I den første studien ble 560 pasienter randomisert til å motta 15 mg eller 30 mg ACTOS 30 mg eller placebo én gang daglig i 16 uker i tillegg til deres nåværende sulfonylurea-kur. Behandling med ACTOS som tillegg til sulfonylurea ga statistisk signifikante forbedringer i HbA1c og FPG ved endepunkt sammenlignet med placebo tillegg til sulfonylurea (se tabell 20).
den andre studien ble 702 pasienter randomisert til å motta 30 mg eller 45 mg ACTOS én gang daglig i 24 uker i tillegg til deres nåværende sulfonylurea-kur. Gjennomsnittlig reduksjon fra baseline ved uke 24 i HbA1c var 1,6 % for 30 mg-dosen og 1,7 % for 45 mg-dosen (se tabell 21). Gjennomsnittlig reduksjon fra baseline ved uke 24 i FPG var 52 mg/dL for 30 mg dose og 56 mg/dL for 45 mg dose.
Den terapeutiske effekten av ACTOS i kombinasjon med sulfonylurea ble observert hos pasienter uavhengig av sulfonylureapose.
Tillegg til metforminforsøk
To kliniske studier ble utført med ACTOS 30 mg i kombinasjon med metformin. Begge studiene inkluderte pasienter med type 2 diabetes på en hvilken som helst dose metformin, enten alene eller i kombinasjon med et annet antidiabetisk middel. Alle andre antidiabetika ble seponert minst tre uker før studiebehandlingen startet.
den første studien ble 328 pasienter randomisert til å motta enten 30 mg ACTOS eller placebo én gang daglig i 16 uker i tillegg til deres nåværende metforminregime. Behandling med ACTOS 30 mg som tillegg til metformin ga statistisk signifikante forbedringer i HbA1c og FPG ved endepunktet sammenlignet med placebo tillegg til metformin (se tabell 22).
I den andre studien ble 827 pasienter randomisert til å motta enten 30 mg eller 45 mg ACTOS 30 mg én gang daglig i 24 uker i tillegg til deres nåværende metforminregime. Gjennomsnittlig reduksjon fra baseline ved uke 24 i HbA1c var 0,8 % for 30 mg-dosen og 1,0 % for 45 mg-dosen (se tabell 23). Gjennomsnittlig reduksjon fra baseline ved uke 24 i FPG var 38 mg/dL for 30 mg dose og 51 mg/dL for 45 mg dose.
Den terapeutiske effekten av ACTOS i kombinasjon med metformin ble observert hos pasienter uavhengig av metformindosen.
Tillegg til insulinprøver
To kliniske studier ble utført med ACTOS 15 mg i kombinasjon med insulin. Begge studiene inkluderte pasienter med type 2 diabetes på insulin, enten alene eller i kombinasjon med et annet antidiabetisk middel. Alle andre antidiabetika ble trukket tilbake før studiebehandlingen startet. I den første studien ble 566 pasienter randomisert til å motta enten 15 mg eller 30 mg ACTOS 15 mg eller placebo én gang daglig i 16 uker i tillegg til insulinkuren. Behandling med ACTOS 30 mg som tillegg til insulin ga statistisk signifikante forbedringer i HbA1c og FPG ved endepunktet sammenlignet med placebo-tillegg til insulin (se tabell 24). Gjennomsnittlig daglig insulindose ved baseline i hver behandlingsgruppe var ca. 70 enheter. Flertallet av pasientene (75 % totalt, 86 % behandlet med placebo, 77 % behandlet med ACTOS 15 mg og 61 % behandlet med ACTOS 30 mg) hadde ingen endring i sin daglige insulindose fra baseline til det siste studiebesøket. Gjennomsnittlig endring fra baseline i daglig dose insulin (inkludert pasienter uten insulindosemodifikasjoner) var -3 enheter hos pasientene behandlet med ACTOS 15 mg, -8 enheter hos pasientene behandlet med ACTOS 30 mg og -1 enhet hos pasienter behandlet med placebo.
den andre studien ble 690 pasienter som fikk en median på 60 enheter per dag insulin randomisert til å motta enten 30 mg eller 45 mg ACTOS én gang daglig i 24 uker i tillegg til sitt nåværende insulinregime. Gjennomsnittlig reduksjon fra baseline ved uke 24 i HbA1c var 1,2 % for 30 mg-dosen og 1,5 % for 45 mg-dosen. Gjennomsnittlig reduksjon fra baseline ved uke 24 i FPG var 32 mg/dL for 30 mg dose og 46 mg/dL for 45 mg dose (se tabell 25). Gjennomsnittlig daglig insulindose ved baseline i begge behandlingsgruppene var omtrent 70 enheter. Flertallet av pasientene (55 % totalt, 58 % behandlet med ACTOS 30 mg og 52 % behandlet med ACTOS 45 mg) hadde ingen endring i sin daglige insulindose fra baseline til det siste studiebesøket. Gjennomsnittlig endring fra baseline i daglig insulindose (inkludert pasienter uten insulindosemodifikasjoner) var -5 enheter hos pasientene behandlet med ACTOS 30 mg og -8 enheter hos pasientene behandlet med ACTOS 45 mg.
Den terapeutiske effekten av ACTOS i kombinasjon med insulin ble observert hos pasienter uavhengig av insulindosen.
PASIENTINFORMASJON
ACTOS (ak-TOS) (pioglitazon) Tabletter
Les denne medisinveiledningen nøye før du begynner å ta ACTOS 15mg og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med legen din om din medisinske tilstand eller din behandling. Spør legen din eller apoteket hvis du har spørsmål om ACTOS.
Hva er den viktigste informasjonen jeg bør vite om ACTOS?
ACTOS kan forårsake alvorlige bivirkninger, inkludert ny eller verre hjertesvikt.
- . ACTOS 15mg kan føre til at kroppen din holder på ekstra væske (væskeretensjon), noe som fører til hevelse (ødem) og vektøkning. Ekstra kroppsvæske kan gjøre noen hjerteproblemer verre eller føre til hjertesvikt. Hjertesvikt betyr at hjertet ikke pumper blod godt nok . Ikke ta ACTOS hvis du har alvorlig hjertesvikt . Hvis du har hjertesvikt med symptomer (som kortpustethet eller hevelse), selv om disse symptomene ikke er alvorlige, kan det hende at ACTOS ikke er riktig for deg
Ring legen din umiddelbart hvis du har noen av følgende:
- . hevelse eller væskeretensjon, spesielt i anklene eller bena . kortpustethet eller pusteproblemer, spesielt når du legger deg . en uvanlig rask vektøkning . uvanlig tretthet
ACTOS kan ha andre alvorlige bivirkninger. Se "Hva er de mulige bivirkningene av ACTOS?"
Hva er ACTOS?
ACTOS 15mg er et reseptbelagt legemiddel som brukes sammen med kosthold og trening for å forbedre blodsukkerkontrollen (glukose) hos voksne med type 2 diabetes. ACTOS er et diabetesmedisin kalt pioglitazon som kan tas alene eller sammen med andre diabetesmedisiner.
Det er ikke kjent om ACTOS er trygt og effektivt hos barn under 18 år. ACTOS anbefales ikke til barn.
ACTOS er ikke for personer med type 1 diabetes.
ACTOS 30mg er ikke for personer med diabetisk ketoacidose (økte ketoner i blodet eller urinen).
Hvem bør ikke ta ACTOS?
Se "Hva er den viktigste informasjonen jeg bør vite om ACTOS 15mg?"
Ikke ta ACTOS 15 mg hvis du:
- . har alvorlig hjertesvikt . er allergisk mot noen av ingrediensene i ACTOS. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser i ACTOS
Snakk med legen din før du tar ACTOS hvis du har en av disse tilstandene.
Hva bør jeg fortelle legen min før jeg tar ACTOS 30mg?
Før du tar ACTOS, fortell legen din dersom du:
- . har hjertesvikt . har type 1 ("juvenil") diabetes eller hatt diabetisk ketoacidose . har en type diabetisk øyesykdom som forårsaker hevelse bak i øyet (makulaødem) . har leverproblemer . har eller har hatt kreft i blæren . er gravid eller planlegger å bli gravid. Det er ikke kjent om ACTOS 15mg kan skade det ufødte barnet ditt. Snakk med legen din hvis du er gravid eller planlegger å bli gravid om den beste måten å kontrollere blodsukkernivået mens du er gravid . er en premenopausal kvinne (før "livsendringen") som ikke har menstruasjon regelmessig eller i det hele tatt. ACTOS 30mg kan øke sjansen for å bli gravid. Snakk med legen din om prevensjonsvalg mens du tar ACTOS. Fortell legen din umiddelbart hvis du blir gravid mens du tar ACTOS . ammer eller planlegger å amme. Det er ikke kjent om ACTOS går over i melken din og om det kan skade babyen din. Snakk med legen din om den beste måten å kontrollere blodsukkernivået mens du ammer
Fortell legen din om alle medisinene du tar inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
ACTOS 30mg og noen av de andre medisinene dine kan påvirke hverandre. Du må kanskje endre dosen av ACTOS 15 mg eller visse andre legemidler.
Kjenn til medisinene du tar. Hold en liste over medisinene dine og vis den til legen din og apoteket før du begynner på et nytt legemiddel. De vil fortelle deg om det er greit å ta ACTOS 15mg sammen med andre medisiner.
Hvordan bør jeg ta ACTOS 15mg?
- . Ta ACTOS 15mg nøyaktig slik legen din sier at du skal ta det . Legen din kan endre dosen av ACTOS. Ikke endre ACTOS-dosen din med mindre legen din ber deg om det . ACTOS kan forskrives alene eller sammen med andre diabetesmedisiner. Dette vil avhenge av hvor godt blodsukkeret ditt er kontrollert . Ta ACTOS 15 mg én gang hver dag, med eller uten mat . Hvis du glemmer en dose på ACTOS 15 mg, ta neste dose som foreskrevet med mindre legen din forteller deg noe annet. Ikke ta to doser på én gang neste dag . Hvis du tar for mye ACTOS, ring legen din eller gå til nærmeste legevakt umiddelbart . Hvis kroppen din er under stress som feber, infeksjon, ulykke eller operasjon, kan det hende at dosen av diabetesmedisinene dine må endres. Ring legen din med en gang . Hold deg til kostholdet og treningsprogrammene dine og test blodsukkeret ditt regelmessig mens du tar ACTOS . Legen din bør ta visse blodprøver før du begynner og mens du tar ACTOS . Legen din bør også ta hemoglobin A1C-testing for å sjekke hvor godt blodsukkeret ditt er kontrollert med ACTOS . Legen din bør sjekke øynene dine regelmessig mens du tar ACTOS
Hva er de mulige bivirkningene av ACTOS?
ACTOS kan forårsake alvorlige bivirkninger, inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om ACTOS?" . lavt blodsukker (hypoglykemi). Dette kan skje hvis du hopper over måltider, hvis du også bruker et annet legemiddel som senker blodsukkeret, eller hvis du har visse medisinske problemer. Stivhet, svimmelhet, skjelving eller sult kan oppstå hvis blodsukkeret ditt er for lavt. Ring legen din hvis lavt blodsukker er et problem for deg . leverproblemer. Ring legen din umiddelbart hvis du har:
- . kvalme eller oppkast . magesmerter . uvanlig eller uforklarlig tretthet . tap av Appetit . mørk urin . gulfarging av huden eller det hvite i øynene
- . blod eller en rød farge i urinen . økt behov for å urinere . smerte mens du tisser
De vanligste bivirkningene av ACTOS inkluderer:
- . forkjølelseslignende symptomer (øvre luftveisinfeksjon) . hodepine . bihulebetennelse . Muskelsmerte . sår hals
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle bivirkningene av ACTOS. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare ACTOS 15mg?
- . Oppbevar ACTOS 15 mg ved 68 °F til 77 °F (20 °C til 25 °C). Oppbevar ACTOS i originalemballasjen og beskytt mot lys . Hold ACTOS-flasken tett lukket og hold tablettene tørre . Hold ACTOS og alle legemidler utilgjengelig for barn
Generell informasjon om sikker og effektiv bruk av ACTOS
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk ACTOS for en tilstand det ikke er foreskrevet for. Ikke gi ACTOS til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Denne medisinguiden oppsummerer den viktigste informasjonen om ACTOS. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre legen din eller apoteket om informasjon om ACTOS som er skrevet for helsepersonell. For mer informasjon, gå til www.actos.com eller ring 1-877-825-3327.
Hva er ingrediensene i ACTOS 15mg?
Aktiv ingrediens: pioglitazon Inaktive ingredienser: laktos 15mge monohydrat, hydroksypropylcellulose, karboksymetylcellulose kalsium og magnesiumstearat
Denne medisinveiledningen er godkjent av US Food and Drug Administration.
