Amaryl 1mg, 2mg, 4mg Glimepiride Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Amaryl 1mg og hvordan brukes det?
Amaryl 4mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på type 2 diabetes mellitus. Amaryl 4mg kan brukes alene eller sammen med andre medisiner.
Amaryl 2mg tilhører en klasse legemidler som kalles antidiabetika, sulfonylurea.
Det er ikke kjent om Amaryl er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Amaryl?
Amaryl kan forårsake alvorlige bivirkninger, inkludert:
- . blek eller gulnet hud, . mørk farget urin, . forvirring, . svakhet, og . feber
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Amaryl inkluderer:
- . hodepine, . svimmelhet, . svakhet, . kvalme, og . lavt blodsukker
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Amaryl. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
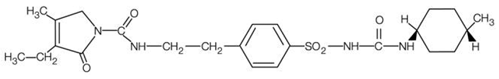
AMARYL er et oralt sulfonylurea som inneholder virkestoffet glimepirid. Kjemisk er glimepirid identifisert som 1-[[p-[2-(3-etyl-4-metyl-2-okso-3-pyrrolin-1-karboksamido) etyl]fenyl]sulfonyl]-3-(trans-4- metylcykloheksyl)urea (C24H34N4O5S) med en molekylvekt på 490,62. Glimepirid er et hvitt til gulhvitt, krystallinsk, luktfritt til praktisk talt luktfritt pulver og er praktisk talt uløselig i vann. Strukturformelen er:
AMARYL tabletter inneholder virkestoffet glimepirid og følgende inaktive ingredienser: laktose (vannholdig), natriumstivelsesglykolat, povidon, mikrokrystallinsk cellulose og magnesiumstearat. I tillegg inneholder AMARYL 1 mg tabletter jernoksid rødt, AMARYL 2 mg tabletter inneholder jernoksid gult og FD&C Blue #2 Aluminium Lake, og AMARYL 4 mg tabletter inneholder FD&C Blue #2 Aluminium Lake.
INDIKASJONER
AMARYL 2mg er indisert som et tillegg til kosthold og trening for å forbedre glykemisk kontroll hos voksne med type 2 diabetes mellitus [se Kliniske studier ].
Viktige bruksbegrensninger
AMARYL skal ikke brukes til behandling av type 1 diabetes mellitus eller diabetisk ketoacidose, da det ikke vil være effektivt i disse settingene.
DOSERING OG ADMINISTRASJON
Anbefalt dosering
AMARYL 1mg bør administreres sammen med frokost eller dagens første hovedmåltid.
Anbefalt startdose av AMARYL er 1 mg eller 2 mg én gang daglig. Pasienter med økt risiko for hypoglykemi (f.eks. eldre eller pasienter med nedsatt nyrefunksjon) bør startes med 1 mg én gang daglig [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Etter å ha nådd en daglig dose på 2 mg, kan ytterligere doseøkninger gjøres i trinn på 1 mg eller 2 mg basert på pasientens glykemiske respons. Opptitrering bør ikke forekomme hyppigere enn hver 1-2 uke. Et konservativt titreringsskjema anbefales for pasienter med økt risiko for hypoglykemi [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Maksimal anbefalt dose er 8 mg én gang daglig.
Pasienter som overføres til AMARYL 1 mg fra sulfonylurea med lengre halveringstid (f.eks. klorpropamid) kan ha overlappende medikamenteffekt i 1-2 uker og bør overvåkes på passende måte for hypoglykemi.
Når colesevelam administreres samtidig med glimepirid, reduseres maksimal plasmakonsentrasjon og total eksponering for glimepirid. Derfor bør AMARYL 2 mg administreres minst 4 timer før colesevelam.
HVORDAN LEVERES
Doseringsformer og styrker
AMARYL 4mg er formulert som tabletter av:
- . 1 mg (rosa, flatt, avlang med hakk på sidene i dobbelt halvering, merket med "AMA RYL" på den ene siden) . 2 mg (grønn, flatt, avlang med hakk på sidene i dobbelt halvering, merket med "AMA RYL" på den ene siden) . 4 mg (blått, flatt, avlangt med hakk på sidene i dobbelt halvering, merket med "AMA RYL" på den ene siden)
Oppbevaring og håndtering
AMARYL tabletter er tilgjengelige i følgende styrker og pakningsstørrelser:
1 mg (rosa, flatt, avlang med hakk på sidene i dobbelt halvering, påtrykt "AMA RYL" på den ene siden) i flasker med 100 stk. NDC 0039-0221-10)
2 mg (grønn, flat, avlang med hakkede sider i dobbelt halvering, påtrykt "AMA RYL" på den ene siden) i flasker med 100 stk. NDC 0039-0222-10)
4 mg (blått, flatt, avlangt med hakkede sider ved dobbelt halvering, påtrykt "AMA RYL" på den ene siden) i flasker med 100 stk. NDC 0039-0223-10)
Oppbevares ved 25°C (77°F); utflukter tillatt til 20 - 25 °C (68 - 77 °F) (se USP kontrollert romtemperatur ).
Dispenser i godt lukkede beholdere med sikkerhetslukker.
sanofi-aventis US LLC, Bridgewater, NJ 08807, ET SANOFI-SELSKAP. Revidert desember 2016
BIVIRKNINGER
Følgende alvorlige bivirkninger er omtalt mer detaljert nedenfor og andre steder i merkingen:
- . Hypoglykemi [se ADVARSLER OG FORHOLDSREGLER ] . Hemolytisk anemi [se ADVARSLER OG FORHOLDSREGLER ]
I kliniske studier var de vanligste bivirkningene med AMARYL 4 mg hypoglykemi, svimmelhet, asteni, hodepine og kvalme.
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Omtrent 2800 pasienter med type 2-diabetes har blitt behandlet med AMARYL 4mg i de kontrollerte kliniske studiene. I disse studiene ble ca. 1700 pasienter behandlet med AMARYL i minst 1 år.
Tabell 1 oppsummerer andre bivirkninger enn hypoglykemi som ble rapportert i 11 sammenslåtte placebokontrollerte studier, enten de anses å være mulig eller sannsynligvis relatert til studiemedisinering. Behandlingsvarigheten varierte fra 13 uker til 12 måneder. Termer som er rapportert representerer de som oppstod med en insidens på ≥ 5 % blant AMARYL-behandlede pasienter og mer vanlig enn hos pasienter som fikk placebo.
Hypoglykemi
I en randomisert, dobbeltblind, placebokontrollert monoterapistudie av 14 ukers varighet, gjennomgikk pasienter som allerede var på sulfonylureabehandling en 3-ukers utvaskingsperiode og ble deretter randomisert til AMARYL 1 mg, 4 mg, 8 mg eller placebo. Pasienter randomisert til AMARYL 4 mg eller 8 mg gjennomgikk tvungen titrering fra en startdose på 1 mg til disse sluttdosene, som tolerert [se Kliniske studier ]. Den totale forekomsten av mulig hypoglykemi (definert ved tilstedeværelsen av minst ett symptom som etterforskeren mente kan være relatert til hypoglykemi; en samtidig glukosemåling var ikke nødvendig) var 4 % for AMARYL 1 mg, 17 % for AMARYL 4 mg, 16 % for AMARYL 8 mg og 0 % for placebo. Alle disse hendelsene ble selvbehandlet.
I en randomisert, dobbeltblind, placebokontrollert monoterapistudie av 22 ukers varighet, fikk pasientene en startdose på enten 1 mg AMARYL eller placebo daglig. Dosen av AMARYL 2 mg ble titrert til et fastende plasmaglukosemål på 90-150 mg/dL. Endelige daglige doser av AMARYL 2 mg var 1, 2, 3, 4, 6 eller 8 mg [se Kliniske studier ]. Den totale forekomsten av mulig hypoglykemi (som definert ovenfor for den 14-ukers studien) for AMARYL vs. placebo var 19,7 % vs. 3,2 %. Alle disse hendelsene ble selvbehandlet.
Vektøkning: AMARYL, som alle sulfonylurea, kan forårsake vektøkning [se Kliniske studier ].
Allergiske reaksjoner: kliniske studier forekom allergiske reaksjoner, som pruritus, erytem, urticaria og morbilliforme eller makulopapulære utbrudd hos mindre enn 1 % av AMARYL-behandlede pasienter. Disse kan gå over til tross for fortsatt behandling med AMARYL. Det er rapporter etter markedsføring om mer alvorlige allergiske reaksjoner (f.eks. dyspné, hypotensjon, sjokk) [se ADVARSLER OG FORHOLDSREGLER ].
Laboratorietester
Forhøyet serumalaninaminotransferase (ALT): I 11 sammenslåtte placebokontrollerte studier av AMARYL utviklet 1,9 % av AMARYL-behandlede pasienter og 0,8 % av placebobehandlede pasienter serum-ALAT større enn 2 ganger øvre grense for referanseområdet.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av AMARYL etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
- . Alvorlige overfølsomhetsreaksjoner, inkludert anafylaksi, angioødem og Stevens-Johnsons syndrom [se ADVARSLER OG FORHOLDSREGLER ] . Hemolytisk anemi hos pasienter med og uten G6PD-mangel [se ADVARSLER OG FORHOLDSREGLER ] . Nedsatt leverfunksjon (f.eks. med kolestase og gulsott), samt hepatitt, som kan utvikle seg til leversvikt. . Porphyria cutanea tarda, lysfølsomhetsreaksjoner og allergisk vaskulitt . Leukopeni, agranulocytose, aplastisk anemi og pancytopeni . Trombocytopeni (inkludert alvorlige tilfeller med blodplatetall mindre enn 10 000/μL) og trombocytopenisk purpura . Leverporfyrireaksjoner og disulfiramlignende reaksjoner . Hyponatremi og syndrom av upassende antidiuretisk hormonsekresjon (SIADH), oftest hos pasienter som bruker andre medisiner eller som har medisinske tilstander som er kjent for å forårsake hyponatremi eller øke frigjøringen av antidiuretisk hormon . Dysgeusi . Alopecia
NARKOTIKAHANDEL
Legemidler som påvirker glukosemetabolismen
En rekke medisiner påvirker glukosemetabolismen og kan kreve dosejustering av AMARYL 4 mg og spesielt nøye overvåking for hypoglykemi eller forverret glykemisk kontroll.
Følgende er eksempler på medisiner som kan øke den glukosesenkende effekten av sulfonylurea, inkludert AMARYL 2mg, øke mottakelighet for og/eller intensitet av hypoglykemi: orale antidiabetiske medisiner, pramlintidacetat, insulin, angiotensin-konverterende enzym (ACE)-hemmere, H2-reseptorantagonister, fibrater, propoksyfen, pentoksifyllin, somatostatinanaloger, anabole steroider og androgener, cyklofosfamid, fenyramidol, guanetidin, flukonazol, sulfinpyrazon, tetracykliner, klaritromycin, disopyramid, og de medikamenter som er sterkt bundet til proteiner, kinolotin, f.eks. ikke-steroide antiinflammatoriske legemidler, salisylater, sulfonamider, kloramfenikol, kumariner, probenecid og monoaminoksidasehemmere. Når disse medisinene administreres til en pasient som får AMARYL, overvåk pasienten nøye for hypoglykemi. Når disse medikamentene blir trukket tilbake fra en pasient som får AMARYL 2mg, overvåk pasienten nøye for forverret glykemisk kontroll.
Følgende er eksempler på medisiner som kan redusere den glukosesenkende effekten av sulfonylurea, inkludert AMARYL, som fører til forverret glykemisk kontroll: danazol, glukagon, somatropin, proteasehemmere, atypiske antipsykotiske medisiner (f.eks. olanzapin og klozapin), barbiturater, diazoksid, , rifampin, tiazider og andre diuretika, kortikosteroider, fenotiaziner, skjoldbruskhormoner, østrogener, orale prevensjonsmidler, fenytoin, nikotinsyre, sympatomimetika (f.eks. epinefrin, albuterol, terbutalin) og isoniazid. Når disse medikamentene gis til en pasient som får AMARYL 2mg, overvåk pasienten nøye for forverret glykemisk kontroll. Når disse medikamentene blir trukket tilbake fra en pasient som får AMARYL 2mg, overvåk pasienten nøye for hypoglykemi.
Betablokkere, klonidin og reserpin kan føre til enten potensering eller svekkelse av AMARYLs glukosesenkende effekt.
Både akutt og kronisk alkoholinntak kan potensere eller svekke den glukosesenkende virkningen av AMARYL 1 mg på en uforutsigbar måte.
Tegnene på hypoglykemi kan være redusert eller fraværende hos pasienter som tar sympatolytiske legemidler som betablokkere, klonidin, guanetidin og reserpin.
Mikonazol
En potensiell interaksjon mellom oral mikonazol og sulfonylurea som fører til alvorlig hypoglykemi er rapportert. Hvorvidt denne interaksjonen også forekommer med andre doseringsformer av mikonazol er ikke kjent.
Cytokrom P450 2C9 Interaksjoner
Det kan være en interaksjon mellom glimepirid og hemmere (f.eks. flukonazol) og induktorer (f.eks. rifampin) av cytokrom P450 2C9. Flukonazol kan hemme metabolismen av glimepirid, og forårsake økte plasmakonsentrasjoner av glimepirid som kan føre til hypoglykemi. Rifampin kan indusere metabolismen av glimepirid, og forårsake reduserte plasmakonsentrasjoner av glimepirid som kan føre til forverret glykemisk kontroll.
Samtidig administrering av Colesevelam
Colesevelam kan redusere maksimal plasmakonsentrasjon og total eksponering av glimepirid når de to administreres samtidig. Absorpsjonen reduseres imidlertid ikke når glimepirid administreres 4 timer før colesevelam. Derfor bør AMARYL administreres minst 4 timer før colesevelam.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Hypoglykemi
Alle sulfonylurea, inkludert AMARYL, kan forårsake alvorlig hypoglykemi [se BIVIRKNINGER ]. Pasientens evne til å konsentrere seg og reagere kan bli svekket som følge av hypoglykemi. Disse svekkelsene kan utgjøre en risiko i situasjoner der disse evnene er spesielt viktige, for eksempel ved å kjøre bil eller bruke andre maskiner. Alvorlig hypoglykemi kan føre til bevisstløshet eller kramper og kan føre til midlertidig eller permanent svekkelse av hjernefunksjonen eller død.
Pasienter må være utdannet til å gjenkjenne og håndtere hypoglykemi. Vær forsiktig når du starter og øker AMARYL 2 mg doser hos pasienter som kan være disponert for hypoglykemi (f.eks. eldre, pasienter med nedsatt nyrefunksjon, pasienter på andre antidiabetiske medisiner). Svekkede eller underernærte pasienter, og de med nedsatt binyre, hypofyse eller leverfunksjon er spesielt utsatt for den hypoglykemiske virkningen av glukosesenkende medisiner. Hypoglykemi er også mer sannsynlig å oppstå når kaloriinntaket er mangelfullt, etter hard eller langvarig trening, eller når alkohol inntas.
Tidlige varselsymptomer på hypoglykemi kan være forskjellige eller mindre uttalte hos pasienter med autonom nevropati, eldre og hos pasienter som tar beta-adrenerge blokkerende medisiner eller andre sympatolytiske midler. Disse situasjonene kan føre til alvorlig hypoglykemi før pasienten er klar over hypoglykemien.
Overfølsomhetsreaksjoner
Det har vært rapporter etter markedsføring om overfølsomhetsreaksjoner hos pasienter behandlet med AMARYL, inkludert alvorlige reaksjoner som anafylaksi, angioødem og Stevens-Johnsons syndrom. Hvis det er mistanke om en overfølsomhetsreaksjon, må du umiddelbart seponere AMARYL, vurdere andre potensielle årsaker til reaksjonen og igangsette alternativ behandling for diabetes.

Hemolytisk anemi
Sulfonylurea kan forårsake hemolytisk anemi hos pasienter med glukose 6-fosfatdehydrogenase (G6PD) mangel. Fordi AMARYL 4mg er et sulfonylurea, utvis forsiktighet hos pasienter med G6PD-mangel og vurder bruk av et ikke-sulfonylurea-alternativ. Det er også postmarketing rapporter om hemolytisk anemi hos pasienter som får AMARYL 1mg som ikke hadde kjent G6PD-mangel [se BIVIRKNINGER ].
Økt risiko for kardiovaskulær dødelighet med sulfonylurea
Administrering av orale hypoglykemiske legemidler er rapportert å være assosiert med økt kardiovaskulær dødelighet sammenlignet med behandling med diett alene eller diett pluss insulin. Denne advarselen er basert på studien utført av University Group Diabetes Program (UGDP), en langsiktig, prospektiv klinisk studie designet for å evaluere effektiviteten av glukosesenkende legemidler for å forebygge eller forsinke vaskulære komplikasjoner hos pasienter med ikke-insulinavhengige diabetes. Studien involverte 823 pasienter som ble tilfeldig fordelt til en av fire behandlingsgrupper UGDP rapporterte at pasienter behandlet i 5 til 8 år med diett pluss en fast dose tolbutamid (1,5 gram per dag) hadde en kardiovaskulær dødelighet på omtrent 2-½ ganger pasienter behandlet med diett alene. En signifikant økning i total dødelighet ble ikke observert, men bruken av tolbutamid ble avbrutt basert på økningen i kardiovaskulær dødelighet, og dermed begrenset muligheten for studien til å vise en økning i total dødelighet. Til tross for uenighet om tolkningen av disse resultatene, gir funnene fra UGDP-studien et tilstrekkelig grunnlag for denne advarselen. Pasienten bør informeres om potensielle risikoer og fordeler ved AMARYL 4 mg og om alternative behandlingsformer. Selv om bare ett medikament i sulfonylurea-klassen (tolbutamid) ble inkludert i denne studien, er det forsvarlig fra et sikkerhetssynspunkt å vurdere at denne advarselen også kan gjelde for andre orale hypoglykemiske legemidler i denne klassen, i lys av deres nære likheter i form av handling og kjemisk struktur.
Makrovaskulære utfall
Det har ikke vært noen kliniske studier som har etablert konklusive bevis på makrovaskulær risikoreduksjon med AMARYL eller andre antidiabetiske legemidler.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese og svekkelse av fruktbarhet
Studier på rotter med doser på opptil 5000 deler per million (ppm) i fullfôr (ca. 340 ganger maksimal anbefalt human dose, basert på overflateareal) i 30 måneder viste ingen tegn på karsinogenese. Hos mus resulterte administrering av glimepirid i 24 måneder i en økning i benign pankreasadenomdannelse som var doserelatert og antas å være et resultat av kronisk pankreasstimulering. Ingen adenomdannelse hos mus ble observert ved en dose på 320 ppm i fullfôr, eller 46-54 mg/kg kroppsvekt/dag. Dette er omtrent 35 ganger den maksimale anbefalte dosen for mennesker på 8 mg én gang daglig basert på overflateareal.
Glimepirid var ikke-mutagent i en rekke in vitro- og in vivo-mutagenisitetsstudier (Ames-test, somatisk cellemutasjon, kromosomavvik, ikke-planlagt DNA-syntese og mikronukleustest hos mus).
Det var ingen effekt av glimepirid på fertilitet hos hannmus hos dyr eksponert opp til 2500 mg/kg kroppsvekt (> 1700 ganger maksimal anbefalt human dose basert på overflateareal). Glimepirid hadde ingen effekt på fertiliteten til hann- og hunnrotter administrert opp til 4000 mg/kg kroppsvekt (omtrent 4000 ganger maksimal anbefalt human dose basert på overflateareal).
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori C
Det er ingen tilstrekkelige og godt kontrollerte studier av AMARYL 2mg hos gravide kvinner. I dyrestudier var det ingen økning i medfødte anomalier, men en økning i fosterdødsfall forekom hos rotter og kaniner ved glimepiriddoser 50 ganger (rotter) og 0,1 ganger (kaniner) den maksimale anbefalte dosen til mennesker (basert på kroppsoverflate). Denne føtotoksisiteten, observert kun ved doser som induserer mors hypoglykemi, antas å være direkte relatert til den farmakologiske (hypoglykemiske) virkningen av glimepirid og har på lignende måte blitt observert med andre sulfonylurea. AMARYL skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret. Fordi data tyder på at unormalt blodsukker under graviditet er assosiert med en høyere forekomst av medfødte abnormiteter, bør diabetesbehandling under graviditet opprettholde blodsukkeret så nær det normale som mulig.
Ikke-ratatogene effekter
Langvarig alvorlig hypoglykemi (4 til 10 dager) er rapportert hos nyfødte født av mødre som får sulfonylurea på tidspunktet for fødselen.
Ammende mødre
Det er ikke kjent om AMARYL 1mg skilles ut i morsmelk. Under pre- og postnatale studier på rotter var signifikante konsentrasjoner av glimepirid til stede i morsmelk og serum til valpene. Avkom fra rotter som ble utsatt for høye nivåer av glimepirid under drektighet og amming utviklet skjelettdeformiteter bestående av forkortning, fortykkelse og bøyning av humerus i løpet av den postnatale perioden. Disse skjelettdeformasjonene ble bestemt til å være et resultat av amming fra mødre eksponert for glimepirid. Basert på disse dyredataene og potensialet for hypoglykemi hos et ammende spedbarn, bør det tas en beslutning om å avbryte ammingen eller seponere AMARYL 2 mg, tatt i betraktning viktigheten av AMARYL for moren.
Pediatrisk bruk
Farmakokinetikken, effekten og sikkerheten til AMARYL 4mg har blitt evaluert hos pediatriske pasienter med type 2 diabetes som beskrevet nedenfor. AMARYL 4mg anbefales ikke til pediatriske pasienter på grunn av dets bivirkninger på kroppsvekt og hypoglykemi.
Farmakokinetikken til en 1 mg enkeltdose AMARYL ble evaluert hos 30 pasienter med type 2 diabetes (mann = 7; kvinner = 23) mellom 10 og 17 år. Gjennomsnittlig (± SD) AUC (339±203 ng·time/mL), Cmax (102±48 ng/mL) og t½ (3,1±1,7 timer) for glimepirid var sammenlignbare med historiske data fra voksne (AUC(0-siste) ) 315±96 ng·time/mL, Cmax 103±34 ng/mL og t½ 5,3±4,1 timer).
Sikkerheten og effekten av AMARYL hos pediatriske pasienter ble evaluert i en enkeltblind, 24-ukers studie som randomiserte 272 pasienter (8-17 år) med type 2 diabetes til AMARYL (n=135) eller metformin (n=137) ). Både behandlingsnaive pasienter (de som ble behandlet med kun diett og trening i minst 2 uker før randomisering) og tidligere behandlede pasienter (de som tidligere ble behandlet eller for tiden ble behandlet med andre orale antidiabetiske medisiner i minst 3 måneder) var kvalifisert til å delta. Pasienter som fikk orale antidiabetika på tidspunktet for studiestart, avbrøt disse medisinene før randomisering uten en utvaskingsperiode. AMARYL ble initiert med 1 mg, og deretter titrert opp til 2, 4 eller 8 mg (gjennomsnittlig siste dose 4 mg) gjennom uke 12, målrettet en selvovervåket fastende blodsukker i fingerstikk
Etter 24 uker var den totale gjennomsnittlige behandlingsforskjellen i HbA1c mellom AMARYL 4 mg og metformin 0,2 %, og favoriserte metformin (95 % konfidensintervall -0,3 % til +0,6 %). Basert på disse resultatene oppfylte ikke studien sitt primære mål om å vise en tilsvarende reduksjon i HbA1c med AMARYL 4 mg sammenlignet med metformin.
Bivirkningsprofilen hos pediatriske pasienter behandlet med AMARYL 2mg var lik den som ble observert hos voksne [se BIVIRKNINGER ].
Hypoglykemiske hendelser dokumentert ved blodsukkerverdier
Geriatrisk bruk
kliniske studier med AMARYL 2 mg var 1053 av 3491 pasienter (30%) > 65 år. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse pasientene og yngre pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes.
Det var ingen signifikante forskjeller i glimepirids farmakokinetikk mellom pasienter med type 2 diabetes ≤ 65 år (n=49) og de > 65 år (n=42) [se KLINISK FARMAKOLOGI ].
Glimepirid skilles hovedsakelig ut av nyrene. Eldre pasienter har større sannsynlighet for å ha nedsatt nyrefunksjon. I tillegg kan hypoglykemi være vanskelig å gjenkjenne hos eldre [se DOSERING OG ADMINISTRASJON og ADVARSLER OG FORHOLDSREGLER ]. Vær forsiktig når du starter AMARYL og øker dosen av AMARYL 1 mg hos denne pasientpopulasjonen.
Nedsatt nyrefunksjon
For å minimere risikoen for hypoglykemi er den anbefalte startdosen av AMARYL 1 mg daglig for alle pasienter med type 2 diabetes og nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON og ADVARSLER OG FORHOLDSREGLER ].
En titreringsstudie med flere doser ble utført på 16 pasienter med type 2 diabetes og nedsatt nyrefunksjon ved bruk av doser fra 1 mg til 8 mg daglig i 3 måneder. Baseline kreatininclearance varierte fra 10-60 ml/min. Farmakokinetikken til AMARYL ble evaluert i titreringsstudien med flere doser, og resultatene var i samsvar med de som ble observert hos pasienter som ble inkludert i en enkeltdosestudie. I begge studiene økte den relative totale clearance av AMARYL når nyrefunksjonen var nedsatt. Begge studiene viste også at eliminasjonen av de to hovedmetabolittene ble redusert hos pasienter med nedsatt nyrefunksjon [se KLINISK FARMAKOLOGI ].
OVERDOSE
En overdosering av AMARYL 2 mg, som med andre sulfonylurea, kan gi alvorlig hypoglykemi. Milde episoder av hypoglykemi kan behandles med oral glukose. Alvorlige hypoglykemiske reaksjoner utgjør medisinske nødsituasjoner som krever umiddelbar behandling. Alvorlig hypoglykemi med koma, anfall eller nevrologisk svekkelse kan behandles med glukagon eller intravenøs glukose. Fortsatt observasjon og ytterligere karbohydratinntak kan være nødvendig fordi hypoglykemi kan gjenta seg etter tilsynelatende klinisk bedring [se ADVARSLER OG FORHOLDSREGLER ].
KONTRAINDIKASJONER
AMARYL er kontraindisert hos pasienter med en historie med overfølsomhetsreaksjoner mot:
- . Glimepirid eller noen av produktets ingredienser [se ADVARSLER OG FORHOLDSREGLER ].
Sulfonamidderivater: Pasienter som har utviklet en allergisk reaksjon på sulfonamidderivater kan utvikle en allergisk reaksjon på AMARYL. Ikke bruk AMARYL 4mg hos pasienter som har en historie med en allergisk reaksjon på sulfonamidderivater.
Rapporterte overfølsomhetsreaksjoner inkluderer kutane utbrudd med eller uten kløe samt mer alvorlige reaksjoner (f.eks. anafylaksi, angioødem, Stevens-Johnsons syndrom, dyspné) [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Glimepirid senker først og fremst blodsukkeret ved å stimulere frigjøringen av insulin fra betacellene i bukspyttkjertelen. Sulfonylurea binder seg til sulfonylureareseptoren i bukspyttkjertelens betacelleplasmamembran, noe som fører til lukking av den ATP-sensitive kaliumkanalen, og stimulerer derved frigjøringen av insulin.
Farmakodynamikk
Hos friske personer var tiden for å oppnå maksimal effekt (minimum blodsukkerkonsentrasjon) ca. 2-3 timer etter orale enkeltdoser av AMARYL. Effekten av AMARYL på HbA1c, fastende plasmaglukose og post-prandial glukose har blitt vurdert i kliniske studier [se Kliniske studier ].
Farmakokinetikk
Absorpsjon
Studier med enkelt orale doser av glimepirid hos friske forsøkspersoner og med flere orale doser hos pasienter med type 2 diabetes viste maksimale legemiddelkonsentrasjoner (Cmax) 2 til 3 timer etter dose. Når glimepirid ble gitt sammen med måltider, ble gjennomsnittlig Cmax og AUC (areal under kurven) redusert med henholdsvis 8 % og 9 %.
Glimepirid akkumuleres ikke i serum etter gjentatt dosering. Farmakokinetikken til glimepirid er ikke forskjellig mellom friske personer og pasienter med type 2 diabetes. Clearance av glimepirid etter oral administrering endres ikke over doseområdet 1 mg til 8 mg, noe som indikerer lineær farmakokinetikk.
Hos friske personer var de intra- og interindividuelle variasjonene av glimepirids farmakokinetiske parametere henholdsvis 15-23 % og 24-29 %.
Fordeling
Etter intravenøs dosering hos friske forsøkspersoner var distribusjonsvolumet (Vd) 8,8 l (113 ml/kg), og total kroppsclearance (CL) var 47,8 ml/min. Proteinbindingen var større enn 99,5 %.
Metabolisme
Glimepirid metaboliseres fullstendig ved oksidativ biotransformasjon etter enten en intravenøs eller oral dose. De viktigste metabolittene er cykloheksylhydroksymetylderivatet (M1) og karboksylderivatet (M2). Cytokrom P450 2C9 er involvert i biotransformasjonen av glimepirid til M1. M1 metaboliseres videre til M2 av ett eller flere cytosoliske enzymer. M2 er inaktiv. Hos dyr har M1 omtrent en tredjedel av den farmakologiske aktiviteten til glimepirid, men det er uklart om M1 resulterer i klinisk betydningsfulle effekter på blodsukker hos mennesker.
Utskillelse
Når 14C-glimepirid ble gitt oralt til 3 friske mannlige forsøkspersoner, ble ca. 60 % av den totale radioaktiviteten gjenfunnet i urinen i løpet av 7 dager. M1 og M2 utgjorde 80-90 % av radioaktiviteten som ble gjenvunnet i urinen. Forholdet mellom M1 og M2 i urinen var omtrent 3:2 hos to forsøkspersoner og 4:1 hos ett forsøksperson. Omtrent 40 % av den totale radioaktiviteten ble gjenvunnet i avføring. M1 og M2 utgjorde ca. 70 % (forholdet mellom M1 og M2 var 1:3) av radioaktiviteten som ble gjenvunnet i feces. Ingen foreldremedikamenter ble gjenfunnet fra urin eller avføring. Etter intravenøs dosering hos pasienter ble ingen signifikant utskillelse av glimepirid eller dets M1-metabolitt observert.
Geriatriske pasienter
En sammenligning av glimepirids farmakokinetikk hos pasienter med type 2 diabetes ≤ 65 år og de > 65 år ble evaluert i en flerdosestudie med AMARYL 6 mg daglig. Det var ingen signifikante forskjeller i glimepirids farmakokinetikk mellom de to aldersgruppene. Gjennomsnittlig AUC ved steady state for de eldre pasientene var omtrent 13 % lavere enn for de yngre pasientene; den gjennomsnittlige vektjusterte clearance for de eldre pasientene var omtrent 11 % høyere enn for de yngre pasientene.
Kjønn
Det var ingen forskjeller mellom menn og kvinner i farmakokinetikken til glimepirid når det ble justert for forskjeller i kroppsvekt.
Løp
Det er ikke utført studier for å vurdere effekten av rase på glimepirids farmakokinetikk, men i placebokontrollerte studier av AMARYL 2mg hos pasienter med type 2 diabetes var reduksjonen i HbA sammenlignbar hos kaukasiere (n = 536), svarte (n = 63) , og latinamerikanere (n = 63).
Nedsatt nyrefunksjon
En enkeltdose, åpen studie AMARYL 3 mg ble administrert til pasienter med mild, moderat og alvorlig nedsatt nyrefunksjon som estimert ved kreatininclearance (CLcr): Gruppe I besto av 5 pasienter med lett nedsatt nyrefunksjon (CLcr > 50 ml/min. ), gruppe II besto av 3 pasienter med moderat nedsatt nyrefunksjon (CLcr = 20-50 ml/min) og gruppe III besto av 7 pasienter med alvorlig nedsatt nyrefunksjon (CLcr
Nedsatt leverfunksjon
Det er ukjent om det er en effekt av nedsatt leverfunksjon på AMARYL 1 mg farmakokinetikk fordi farmakokinetikken til AMARYL 1 mg ikke er tilstrekkelig evaluert hos pasienter med nedsatt leverfunksjon.
Overvektige pasienter
Farmakokinetikken til glimepirid og dets metabolitter ble målt i en enkeltdosestudie med 28 pasienter med type 2 diabetes som enten hadde normal kroppsvekt eller var sykelig overvektige. Mens tmax, clearance og distribusjonsvolumet for glimepirid hos sykelig overvektige pasienter var lik de i normalvektsgruppen, hadde sykelig overvektige lavere Cmax og AUC enn de med normal kroppsvekt. Gjennomsnittlig Cmax, AUC0-24, AUC0-∞-verdier for glimepirid hos normale versus sykelig overvektige pasienter var 547 ± 218 ng/ml vs. 410 ± 124 ng/mL, 3210 ± 1030 timer·ng/ml vs. ± 1820 timer. hhv. timer·ng/ml og 4000 ± 1320 timer·ng/ml vs. 3280 ± 1360 timer·ng/ml.
Narkotikahandel
Aspirin: en randomisert, dobbeltblind, to-perioders crossover-studie, ble friske forsøkspersoner gitt enten placebo eller aspirin 1 gram tre ganger daglig i en total behandlingsperiode på 5 dager. På dag 4 i hver studieperiode ble en enkelt 1 mg dose av AMARYL 4 mg administrert. AMARYL 4 mg-dosene ble atskilt med en 14-dagers utvaskingsperiode. Samtidig administrering av aspirin og AMARYL 4 mg resulterte i en 34 % reduksjon i gjennomsnittlig glimepirid AUC og en 4 % reduksjon i gjennomsnittlig glimepirid Cmax.
Colesevelam: Samtidig administrering av colesevelam og glimepirid resulterte i reduksjoner i glimepirid AUC0-∞ og Cmax på henholdsvis 18 % og 8 %. Når glimepirid ble administrert 4 timer før colesevelam, var det ingen signifikant endring i glimepirid AUC0-∞ og Cmax, henholdsvis -6 % og 3 % [se DOSERING OG ADMINISTRASJON og NARKOTIKAHANDEL ].
Cimetidin og Ranitidin: en randomisert, åpen 3-veis crossover-studie fikk friske forsøkspersoner enten en enkelt 4 mg dose av AMARYL alene, AMARYL med ranitidin (150 mg to ganger daglig i 4 dager; AMARYL 2 mg ble administrert på dag 3), eller AMARYL 2 mg med cimetidin (800 mg daglig i 4 dager; AMARYL ble administrert på dag 3). Samtidig administrering av cimetidin eller ranitidin med en enkelt 4 mg oral dose av AMARYL 4 mg endret ikke absorpsjonen og disponeringen av glimepirid signifikant.
Propranolol: en randomisert, dobbeltblind, to-perioders crossover-studie, ble friske forsøkspersoner gitt enten placebo eller propranolol 40 mg tre ganger daglig i en total behandlingsperiode på 5 dager. På dag 4 eller hver studieperiode ble en enkelt dose på 2 mg AMARYL 4 mg administrert. AMARYL 4 mg-dosene ble atskilt med en 14-dagers utvaskingsperiode. Samtidig administrering av propranolol og AMARYL 1 mg økte glimepirid Cmax, AUC og T½ signifikant med henholdsvis 23 %, 22 % og 15 %, og reduserte glimepirid CL/f med 18 %. Utvinningen av M1 og M2 fra urin ble ikke endret.
Warfarin: en åpen toveis crossover-studie fikk friske forsøkspersoner 4 mg AMARYL 2 mg daglig i 10 dager. Enkeltdoser på 25 mg warfarin ble administrert 6 dager før oppstart av AMARYL og på dag 4 av AMARYL-administrasjon. Samtidig administrering av AMARYL endret ikke farmakokinetikken til R- og S-warfarin-enantiomerer. Ingen endringer ble observert i warfarins plasmaproteinbinding. AMARYL 1 mg resulterte i en statistisk signifikant reduksjon i den farmakodynamiske responsen på warfarin. Reduksjonene i gjennomsnittlig areal under protrombintid (PT)-kurven og maksimale PT-verdier under AMARYL-behandling var henholdsvis 3,3 % og 9,9 %, og er usannsynlig å være klinisk relevante.
Kliniske studier
Monoterapi
Totalt 304 pasienter med type 2-diabetes som allerede er behandlet med sulfonylureaterapi, deltok i en 14-ukers, multisenter, randomisert, dobbeltblind, placebokontrollert studie som evaluerte sikkerheten og effekten av AMARYL 1 mg monoterapi. Pasientene avbrøt sin sulfonylurea-behandling og gikk deretter inn i en 3-ukers placebo-utvaskingsperiode etterfulgt av randomisering i 1 av 4 behandlingsgrupper: placebo (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) og AMARYL 8 mg (n=76). Alle pasienter randomisert til AMARYL 4 mg startet 1 mg daglig. Pasienter randomisert til AMARYL 4 mg eller 8 mg hadde blindet, tvungen titrering av AMARYL 2 mg-dosen med ukentlige intervaller, først til 4 mg og deretter til 8 mg, så lenge dosen ble tolerert, inntil den randomiserte dosen var nådd. Pasienter randomisert til 4 mg-dosen nådde den tildelte dosen ved uke 2. Pasienter randomisert til 8 mg-dosen nådde den tildelte dosen ved uke 3. Så snart det randomiserte dosenivået var nådd, skulle pasientene opprettholdes på den dosen frem til uke 14. Omtrent 66 % av de placebobehandlede pasientene fullførte studien sammenlignet med 81 % av pasientene behandlet med glimepirid 1 mg og 92 % av pasientene behandlet med glimepirid 4 mg eller 8 mg. Sammenlignet med placebo ga behandling med AMARYL 1 mg, 4 mg og 8 mg daglig statistisk signifikante forbedringer i HbA1c sammenlignet med placebo (tabell 3).
Totalt 249 pasienter som var behandlingsnaive eller som hadde mottatt begrenset behandling med antidiabetisk behandling tidligere, ble randomisert til å motta 22 ukers behandling med enten AMARYL (n=123) eller placebo (n=126) i et multisenter, randomisert , dobbeltblind, placebokontrollert, dosetitreringsforsøk. Startdosen av AMARYL var 1 mg daglig og ble titrert oppover eller nedover med 2-ukers intervaller til et mål FPG på 90-150 mg/dL. Blodsukkernivåer for både FPG og PPG ble analysert i laboratoriet. Etter 10 ukers dosejustering ble pasientene opprettholdt på optimal dose (1, 2, 3, 4, 6 eller 8 mg) i de resterende 12 ukene av studien. Behandling med AMARYL 2 mg ga statistisk signifikante forbedringer i HbA1c og FPG sammenlignet med placebo (tabell 4).
PASIENTINFORMASJON
Informer pasientene om viktigheten av å følge kostholdsinstruksjoner, av et regelmessig treningsprogram og av regelmessig testing av blodsukker.
Informer pasienter om potensielle bivirkninger av AMARYL 1mg inkludert hypoglykemi og vektøkning.
Forklar symptomene og behandlingen av hypoglykemi samt tilstander som disponerer for hypoglykemi. Pasienter bør informeres om at evnen til å konsentrere seg og reagere kan bli svekket som følge av hypoglykemi. Dette kan utgjøre en risiko i situasjoner der disse evnene er spesielt viktige, for eksempel ved å kjøre bil eller bruke andre maskiner.
Pasienter med diabetes bør rådes til å informere helsepersonell dersom de er gravide, vurderer graviditet, ammer eller vurderer å amme.
