Prandin 0.5mg, 1mg, 2mg Repaglinide Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Prandin 2mg og hvordan brukes det?
Prandin 1mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på type 2 diabetes mellitus. Prandin kan brukes alene eller sammen med andre medisiner.
Prandin tilhører en klasse legemidler som kalles Antidiabetika, Maglitinides Derivates.
Det er ikke kjent om Prandin 1mg er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Prandin?
Prandin kan forårsake alvorlige bivirkninger, inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . sterke smerter i øvre del av magen sprer seg til ryggen, . kvalme, . oppkast, . rask puls, . blek eller gulnet hud, . mørk farget urin, . feber, . forvirring, . svakhet, . sår hals, . brenner i øynene dine, . hudsmerter, og . etterfulgt av et rødt eller lilla hudutslett som sprer seg (spesielt i ansiktet eller overkroppen) og forårsaker blemmer og avskalling
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Prandin inkluderer:
- . lavt blodsukker, . kvalme, . diaré, . hodepine, . ryggsmerte, . leddsmerter, og . forkjølelsessymptomer (tett nese, nysing, sår hals)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Prandin. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
PRANDIN (repaglinid) er et oralt blodsukkersenkende medikament av glinidklassen. Repaglinid, S(+)2-etoksy-4(2((3-metyl-1-(2-(1piperidinyl)fenyl)-butyl)amino)-2-oksoetyl)benzosyre, er kjemisk ikke relatert til oralt sulfonylurea-insulin sekretagoger.
Strukturell formel for repaglinid
Repaglinid er et hvitt til off-white pulver med molekylformel C27H36N2O4 og en molekylvekt på 452,6. PRANDIN tabletter inneholder 0,5 mg, 1 mg eller 2 mg repaglinid. I tillegg inneholder hver tablett følgende inaktive ingredienser: kalsiumhydrogenfosfat (vannfri), mikrokrystallinsk cellulose, maisstivelse, polakrilinkalium, povidon, glyserol (85%), magnesiumstearat, meglumin og poloksamer. 1 mg og 2 mg tablettene inneholder jernoksider (henholdsvis gule og røde) som fargestoffer.
INDIKASJONER
PRANDIN er indisert som et tillegg til kosthold og trening for å forbedre glykemisk kontroll hos voksne med type 2 diabetes mellitus.
Bruksbegrensning
PRANDIN skal ikke brukes til pasienter med type 1 diabetes mellitus eller til behandling av diabetisk ketoacidose.
DOSERING OG ADMINISTRASJON
Anbefalt dosering og administrasjon
Den anbefalte startdosen for pasienter med HbA1c er mindre enn 8 % er 0,5 mg oralt før hvert måltid. For pasienter hvis HbA1c er 8 % eller høyere er startdosen 1 eller 2 mg oralt før hvert måltid.
Det anbefalte doseområdet er 0,5 mg til 4 mg før måltider, med en maksimal daglig dose på 16 mg. Pasientens dose bør dobles opp til 4 mg med hvert måltid inntil tilfredsstillende glykemisk kontroll er oppnådd. Det bør gå minst én uke for å vurdere respons etter hver dosejustering.
Instruer pasientene om å ta PRANDIN innen 30 minutter før måltider. PRANDIN 2mg kan doseres 2, 3 eller 4 ganger daglig som respons på endringer i pasientens måltidsmønster.
Hos pasienter som hopper over måltider, instruer pasientene om å hoppe over den planlagte dosen PRANDIN 1 mg for å redusere risikoen for hypoglykemi. Hos pasienter som opplever hypoglykemi, bør dosen av PRANDIN 1mg reduseres [se ADVARSLER OG FORHOLDSREGLER ].
Pasienter med alvorlig nedsatt nyrefunksjon
Hos pasienter med alvorlig nedsatt nyrefunksjon (CrCl = 20 til 40 ml/min) initieres PRANDIN 0,5 mg oralt før hvert måltid. Gradvis titrere dosen, om nødvendig for å oppnå glykemisk kontroll.
Doseendringer for legemiddelinteraksjoner
Dosejusteringer anbefales hos pasienter som samtidig tar sterke CYP3A4- eller CYP2C8-hemmere eller sterke CYP3A4- eller CYP2C8-induktorer [se NARKOTIKAHANDEL , KLINISK FARMAKOLOGI ].
Samtidig bruk med gemfibrozil er kontraindisert [se KONTRAINDIKASJONER ].
Unngå samtidig bruk av PRANDIN 2mg og klopidogrel. Hvis samtidig bruk ikke kan unngås, start PRANDIN med 0,5 mg før hvert måltid og ikke overskrid en total daglig dose på 4 mg [se NARKOTIKAHANDEL , KLINISK FARMAKOLOGI ].
Ikke overskrid en total daglig dose på 6 mg PRANDIN 2 mg hos pasienter som får ciklosporin [se NARKOTIKAHANDEL , KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
- . mg tabletter (gule, runde, bikonvekse tabletter, merket med "745" på den ene siden og "C" på den andre siden) . 2 mg tabletter (rosa, runde, bikonvekse tabletter, merket med "747" på den ene siden og "C" på den andre siden)
PRANDIN (repaglinid) tabletter, 1 mg , leveres som gule, runde, bikonvekse tabletter, merket med "745" på den ene siden og "C" på den andre siden. De er tilgjengelige som følger:
100 flasker NDC 60846-882-01
PRANDIN (repaglinid) tabletter, 2 mg , leveres som rosa, runde, bikonvekse tabletter, merket med "747" på den ene siden og 'C' på den andre siden. De er tilgjengelige som følger:
100 flasker NDC 60846-884-01
Oppbevares ved 20° til 25°C (68° til 77°F) [se USP kontrollert romtemperatur]. Beskytt mot fuktighet. Hold flaskene tett lukket.
Dispenser i tette beholdere med sikkerhetslukker.
Distribuert av: Amneal Specialty, en avdeling av Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. Revidert: Mar 2019
BIVIRKNINGER
Følgende alvorlige bivirkning er også beskrevet andre steder i merkingen:
Hypoglykemi [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt varierende design, kan det hende at bivirkningsratene rapportert i en klinisk studie ikke lett kan sammenlignes med de frekvensene som er rapportert i en annen klinisk studie, og reflekterer kanskje ikke frekvensene som faktisk observeres i klinisk praksis.
PRANDIN 1mg har blitt administrert til 2931 individer under kliniske studier. Omtrent 1500 av disse personene med type 2-diabetes har blitt behandlet i minst 3 måneder, 1000 i minst 6 måneder og 800 i minst 1 år. Flertallet av disse personene (1228) fikk PRANDIN i en av fem 1-årige, aktivt kontrollerte studier. I løpet av ett år ble 13 % av PRANDIN 1 mg pasienter seponert på grunn av bivirkninger. De vanligste bivirkningene som førte til abstinens var hyperglykemi, hypoglykemi og relaterte symptomer.
Tabell 1 viser de vanlige bivirkningene for PRANDIN-pasienter sammenlignet med placebo i studier med en varighet på 12 til 24 uker.
Hypoglykemi
I kliniske studier med PRANDIN 1mg er hypoglykemi den vanligste bivirkningen. Mild eller moderat hypoglykemi forekom hos 31 % av PRANDIN 1 mg-behandlede pasienter og 7 % av placebobehandlede pasienter [se ADVARSLER OG FORHOLDSREGLER ].
Hypoglykemi ble rapportert hos 16 % av 1228 PRANDIN-pasienter, 20 % av 417 glyburidpasienter og 19 % av 81 glipizidpasienter i 1-års kontrollerte studier. Av PRANDIN-behandlede pasienter med symptomatisk hypoglykemi utviklet ingen koma eller krevde sykehusinnleggelse.
I en 24-ukers placebokontrollert studie hadde pasienter som var naive til oral behandling med hypoglykemiske midler og pasienter med HbA1c under 8 % ved baseline en høyere frekvens av hypoglykemi.
Vektøkning
Det var ingen gjennomsnittlig økning i kroppsvekt når pasienter tidligere behandlet med orale hypoglykemiske midler ble byttet til PRANDIN. Gjennomsnittlig vektøkning hos pasienter behandlet med PRANDIN 0,5 mg og ikke tidligere behandlet med sulfonylureapreparater var 3,3 %.
Kardiovaskulære hendelser
Forekomsten av totale alvorlige kardiovaskulære bivirkninger, inkludert iskemi, var høyere for PRANDIN (51/1228 eller 4 %) enn for sulfonylureapreparater (13/498 eller 3 %) i kontrollerte kliniske komparatorstudier.
Syv kontrollerte kliniske studier inkluderte PRANDIN kombinasjonsbehandling med NPH-insulin (n=431), insulinformuleringer alene (n=388) eller andre kombinasjoner (sulfonylurea pluss NPH-insulin eller PRANDIN 1mg pluss metformin) (n=120). Det var seks alvorlige bivirkninger av myokardiskemi hos pasienter behandlet med PRANDIN 0,5 mg pluss NPH-insulin fra to studier, og én hendelse hos pasienter som brukte insulinformuleringer alene fra en annen studie [se ADVARSLER OG FORHOLDSREGLER ].
Kombinasjonsterapi med tiazolidindioner
Hypoglykemi
løpet av 24-ukers behandlings kliniske studier av PRANDIN-rosiglitazon eller PRANDIN-pioglitazon kombinasjonsbehandling (totalt 250 pasienter i kombinasjonsbehandling), forekom hypoglykemi (blodglukose
Perifert ødem og hjertesvikt
Perifert ødem ble rapportert hos 12 av 250 (4,8 %) PRANDIN-tiazolidindion-kombinasjonspasienter og 3 av 124 (2,4 %) tiazolidindion-monoterapipasienter, uten tilfeller rapportert i disse studiene for PRANDIN-monoterapi. Det var rapporter om episoder med ødem med kongestiv hjertesvikt hos 2 av 250 pasienter (0,8 %) behandlet med PRANDIN-tiazolidindion-behandling. Begge pasientene hadde tidligere koronarsykdom og ble friske etter behandling med vanndrivende midler. Ingen sammenlignbare tilfeller i monoterapibehandlingsgruppene ble rapportert.
Vektøkning
Gjennomsnittlig vektøkning assosiert med kombinasjons-, PRANDIN- og pioglitazonbehandling var henholdsvis 5,5 kg, 0,3 kg og 2,0 kg. Gjennomsnittlig vektøkning assosiert med kombinasjons-, PRANDIN- og rosiglitazonbehandling var henholdsvis 4,5 kg, 1,3 kg og 3,3 kg.
Sjeldne uønskede hendelser (
Mindre vanlige uønskede kliniske eller laboratoriemessige hendelser observert i kliniske studier inkluderte forhøyede leverenzymer, trombocytopeni, leukopeni og anafylaktoide reaksjoner.
Postmarketing-erfaring
Følgende tilleggsbivirkninger er identifisert under bruk av PRANDIN etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det generelt ikke mulig å pålitelig estimere frekvensen eller en årsakssammenheng med legemiddeleksponering.
- . Alopecia . Hemolytisk anemi . Pankreatitt . Stevens-Johnsons syndrom . Alvorlig leverdysfunksjon inkludert gulsott og hepatitt
NARKOTIKAHANDEL
Klinisk viktige legemiddelinteraksjoner med PRANDIN
Tabell 3 inkluderer en liste over legemidler med klinisk viktige legemiddelinteraksjoner når de administreres samtidig med PRANDIN 1mg og instruksjoner for å forebygge eller håndtere dem.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Hypoglykemi
Alle glinider, inkludert PRANDIN 0,5 mg, kan forårsake hypoglykemi [se BIVIRKNINGER ]. Alvorlig hypoglykemi kan forårsake anfall, kan være livstruende eller forårsake død. Hypoglykemi kan svekke konsentrasjonsevne og reaksjonstid; dette kan sette en person og andre i fare i situasjoner der disse evnene er viktige (f.eks. å kjøre bil eller bruke andre maskiner).
Hypoglykemi kan oppstå plutselig og symptomene kan variere hos hvert individ og endre seg over tid hos samme individ. Symptomatisk bevissthet om hypoglykemi kan være mindre uttalt hos pasienter med langvarig diabetes, hos pasienter med diabetisk nervesykdom, hos pasienter som bruker medisiner som blokkerer det sympatiske nervesystemet (f.eks. betablokkere) [se NARKOTIKAHANDEL ], eller hos pasienter som opplever tilbakevendende hypoglykemi.
Faktorer som kan øke risikoen for hypoglykemi inkluderer endringer i måltidsmønster (f.eks. innhold av makronæringsstoffer), endringer i fysisk aktivitetsnivå, endringer i samtidig administrert medisin [se NARKOTIKAHANDEL ], og samtidig bruk med andre antidiabetika. Pasienter med nedsatt nyre- eller leverfunksjon kan ha høyere risiko for hypoglykemi [se Bruk i spesifikke populasjoner ].
Pasienter bør administrere PRANDIN 0,5 mg før måltider og instrueres om å hoppe over dosen med PRANDIN hvis et måltid hoppes over. Hos pasienter som opplever hypoglykemi, bør dosen av PRANDIN reduseres [se DOSERING OG ADMINISTRASJON ]. Pasienter og omsorgspersoner må være utdannet til å gjenkjenne og håndtere hypoglykemi. Selvkontroll av blodsukker spiller en viktig rolle i forebygging og behandling av hypoglykemi. Hos pasienter med høyere risiko for hypoglykemi og pasienter som har redusert symptomatisk bevissthet om hypoglykemi, anbefales økt frekvens av blodsukkermåling.
Alvorlige kardiovaskulære bivirkninger ved samtidig bruk med NPH-insulin
På tvers av syv kontrollerte studier var det seks alvorlige bivirkninger av myokardiskemi hos pasienter behandlet med PRANDIN 0,5 mg pluss NPH-insulin fra to studier, og en hendelse hos pasienter som brukte insulinformuleringer alene fra en annen studie [se BIVIRKNINGER ]. PRANDIN er ikke indisert for bruk i kombinasjon med NPH-insulin.
Makrovaskulære utfall
Det har ikke vært noen kliniske studier som har etablert konklusive bevis på makrovaskulær risikoreduksjon med PRANDIN.

Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
en 104-ukers karsinogenitetsstudie på rotter ved doser opp til 120 mg/kg/dag, som er omtrent 60 ganger klinisk eksponering på mg/m2-basis, var forekomsten av benigne adenomer i skjoldbruskkjertelen og leveren økt hos hannrotter. Ingen bevis for kreftfremkallende egenskaper ble funnet hos hunnrotter. Den høyere forekomsten av skjoldbruskkjertel- og leversvulster hos hannrotter ble ikke sett ved lavere doser på henholdsvis 30 mg/kg/dag og 60 mg/kg/dag (som er over henholdsvis 15 og 30 ganger klinisk eksponering på en mg/m2 basis). I en 104-ukers karsinogenitetsstudie på mus ved doser opptil 500 mg/kg/dag, ble det ikke funnet tegn på karsinogenitet hos mus (som er omtrent 125 ganger klinisk eksponering på mg/m2-basis).
Repaglinid var ikke-gentoksisk i en rekke in vivo- og in vitro-studier: bakteriell mutagenese (Ames-test), in vitro forovercellemutasjonsanalyse i V79-celler (HGPRT), in vitro kromosomavviksanalyse i humane lymfocytter, uplanlagt og replikerende DNA-syntese i rottelever, og in vivo mus og rotte mikronucleus tester.
I en fertilitetsstudie hos rotter ble repaglinid administrert til hann- og hunnrotter i doser opp til henholdsvis 300 og 80 mg/kg/dag. Ingen uønskede effekter på fertilitet ble observert (som er over 40 ganger klinisk eksponering på mg/m2-basis).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Begrensede data med bruk av PRANDIN og repaglinid hos gravide kvinner er utilstrekkelige til å informere om en legemiddelrelatert risiko for alvorlige fødselsskader eller spontanabort. Det er risiko for mor og foster forbundet med dårlig kontrollert diabetes under svangerskapet [se Kliniske betraktninger ].
Repaglidin ble vist å ikke være teratogent i dyrestudier (rotter og kaniner). Embryotoksisitet, unormal utvikling av lemmer hos rottefoster ble observert hos hunnrotter som ble eksponert for høye doser i siste fase av svangerskapet.
Den estimerte bakgrunnsrisikoen for store fødselsskader er 6 % til 10 % hos kvinner med pre-svangerskapsdiabetes med HbA1c >7 og har blitt rapportert å være så høy som 20 % til 25 % hos kvinner med HbA1c >10. Estimert bakgrunnsrisiko for spontanabort for den angitte populasjonen er ukjent. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Sykdomsrelatert risiko for mor og/eller embryo/foster
Dårlig kontrollert diabetes under svangerskapet øker mors risiko for diabetisk ketoacidose, svangerskapsforgiftning, spontane aborter, prematur fødsel, dødfødsel og fødselskomplikasjoner. Dårlig kontrollert diabetes øker fosterrisikoen for store fødselsskader, dødfødsel og makrosomirelatert sykelighet.
Data
Menneskelige data
Det er ikke tilstrekkelige data om utviklingsrisiko forbundet med bruk av PRANDIN 2mg hos gravide kvinner.
Dyredata
Repaglinid var ikke teratogent hos rotter eller kaniner ved doser 40 ganger (rotter) og ca. 0,8 ganger (kanin) klinisk eksponering (på mg/m2-basis) gjennom hele svangerskapet. Avkom fra rottedamer som ble eksponert for repaglinid ved 15 ganger klinisk eksponering på mg/m2 basis i løpet av dagene 17 til 22 av svangerskapet og under amming utviklet ikke-teratogene skjelettdeformiteter bestående av forkortning, fortykkelse og bøyning av humerus i løpet av den postnatale perioden. Denne effekten ble ikke sett ved doser opptil 2,5 ganger klinisk eksponering (på mg/m2-basis) på dag 1 til 22 av svangerskapet eller ved høyere doser gitt i løpet av dag 1 til 16 av svangerskapet.
Amming
Risikosammendrag
Det er ingen informasjon om tilstedeværelsen av PRANDIN 0,5 mg i morsmelk, effekten på det ammende spedbarnet eller effekten på melkeproduksjonen. Repaglinid ble påvist i rottemelk, men på grunn av artsspesifikke forskjeller i laktasjonsfysiologi, kan det hende at dyredata ikke kan forutsi medikamentnivåer i morsmelk på en pålitelig måte. Utviklingen og helsegevinstene ved amming bør vurderes sammen med morens kliniske behov for PRANDIN og eventuelle skadelige effekter på det ammede spedbarnet fra PRANDIN eller fra underliggende mors tilstander.
Kliniske betraktninger
Selv om det ikke er kjent om repaglinid utskilles i morsmelk, er noen orale midler kjent for å utskilles via denne ruten. Fordi potensialet for hypoglykemi hos ammende spedbarn kan eksistere, og på grunn av effektene på ammende dyr, bør det tas en beslutning om hvorvidt PRANDIN skal seponeres hos ammende mødre, eller om mødre skal slutte med ammingen. Hvis PRANDIN seponeres og dietten alene er utilstrekkelig for å kontrollere blodsukkeret, bør insulinbehandling vurderes.
Data
I reproduksjonsstudier på rotter ble det påvist målbare nivåer av repaglinid i morsmelk til mor og reduserte blodsukkernivåer ble observert hos valpene. Kryssfosterstudier indikerte at skjelettforandringer [se Svangerskap ] kunne induseres hos kontrollunger som ble ammet av behandlede mor, selv om dette skjedde i mindre grad enn de valpene som ble behandlet in utero.
Pediatrisk bruk
Sikkerhet og effektivitet er ikke fastslått hos pediatriske pasienter.
Geriatrisk bruk
kliniske studier av 24 uker eller lengre varighet, var 415 pasienter over 65 år og ingen pasienter eldre enn 75 år. I ettårige, aktivt kontrollerte studier ble det ikke sett forskjeller i effektivitet eller bivirkninger mellom disse forsøkspersonene og de under 65. Det var ingen økning i frekvens eller alvorlighetsgrad av hypoglykemi hos eldre personer, men større følsomhet hos noen eldre individer for PRANDIN 0,5 mg-behandling kan ikke utelukkes.
Nedsatt nyrefunksjon
Farmakokinetiske studier av repaglinid ble utført hos pasienter med mild til moderat nedsatt nyrefunksjon (CrCl = 40 til 80 ml/min) og alvorlig nedsatt nyrefunksjon (CrCl = 20 til 40 ml/min). Initial dosejustering er ikke nødvendig hos pasienter med mild til moderat nedsatt nyrefunksjon. Pasienter med alvorlig nedsatt nyrefunksjon bør imidlertid starte PRANDIN-behandling med 0,5 mg dose og titreres nøye [se DOSERING OG ADMINISTRASJON ].
Studier ble ikke utført på pasienter med kreatininclearance under 20 ml/min eller pasienter med nyresvikt som krever hemodialyse.
Nedsatt leverfunksjon
En enkeltdosestudie ble utført med 12 pasienter med kronisk leversykdom. Pasienter med moderat til alvorlig nedsatt leverfunksjon hadde høyere og mer langvarige serumkonsentrasjoner. Derfor bør PRANDIN 0,5 mg brukes med forsiktighet hos pasienter med nedsatt leverfunksjon. Lengre intervaller mellom dosejusteringer kan være nødvendig for å gi full vurdering av responsen.
OVERDOSE
Alvorlige hypoglykemiske reaksjoner med koma, anfall eller annen nevrologisk svekkelse kan oppstå og utgjøre medisinske nødsituasjoner som krever umiddelbar sykehusinnleggelse. Hypoglykemiske symptomer uten tap av bevissthet eller nevrologiske funn bør behandles aggressivt med oral glukose og justeringer i medikamentdosering og/eller måltidsmønster. Tett overvåking kan fortsette inntil legen er forsikret om at pasienten er utenfor fare. Pasienter bør overvåkes nøye i minimum 24 til 48 timer, siden hypoglykemi kan komme tilbake etter tilsynelatende klinisk bedring. Det er ingen bevis for at PRANDIN kan dialyseres ved bruk av hemodialyse.
KONTRAINDIKASJONER
PRANDIN er kontraindisert hos pasienter med:
- . Samtidig bruk av gemfibrozil [se NARKOTIKAHANDEL ] . Kjent overfølsomhet overfor repaglinid eller inaktive ingredienser
KLINISK FARMAKOLOGI
Virkningsmekanismen
Repaglinid senker blodsukkernivået ved å stimulere frigjøringen av insulin fra bukspyttkjertelen. Denne handlingen er avhengig av fungerende beta (ß)-celler i bukspyttkjerteløyene. Insulinfrigjøring er glukoseavhengig og avtar ved lave glukosekonsentrasjoner.
Repaglinid lukker ATP-avhengige kaliumkanaler i ß-cellemembranen ved å binde seg til karakteriserbare steder. Denne kaliumkanalblokkeringen depolariserer ß-cellen, noe som fører til åpning av kalsiumkanaler. Den resulterende økte kalsiumtilstrømningen induserer insulinsekresjon. Ionekanalmekanismen er svært vevselektiv med lav affinitet for hjerte- og skjelettmuskulatur.
Farmakodynamikk
En fire ukers, dobbeltblind, placebokontrollert dose-respons-studie ble utført på 138 pasienter med type 2 diabetes ved bruk av doser fra 0,25 (ikke en godkjent dose) til 4 mg tatt med hvert av tre måltider. PRANDIN-behandling resulterte i doseproporsjonal glukosereduksjon over hele doseområdet. Plasmainsulinnivået økte etter måltider og gikk tilbake til baseline før neste måltid. Det meste av den fastende blodsukkersenkende effekten ble påvist innen 1 til 2 uker.
en dobbeltblind, placebokontrollert, 3-måneders dosetitreringsstudie, ble PRANDIN 0,5 mg eller placebodoser for hver pasient økt ukentlig fra 0,25 mg (ikke en godkjent dose) gjennom 0,5, 1 og 2 mg, til maksimalt på 4 mg, inntil et fastende plasmaglukosenivå (FPG)
Doseringen av PRANDIN 0,5 mg i forhold til måltidsrelatert insulinfrigjøring ble studert i tre studier inkludert 58 pasienter. Glykemisk kontroll ble opprettholdt i en periode hvor måltidet og doseringsmønsteret var variert (2, 3 eller 4 måltider per dag; før måltider x 2, 3 eller 4) sammenlignet med en periode på 3 vanlige måltider og 3 doser per dag ( før måltider x 3). Den blodsukkersenkende effekten var ikke forskjellig når PRANDIN 0,5 mg ble administrert ved starten av et måltid, 15 minutter før eller 30 minutter før måltidet.
Farmakokinetikk
De farmakokinetiske parametrene til repaglinid oppnådd fra en enkeltdose-crossover-studie på friske forsøkspersoner og fra en flerdose-, parallell-, doseproporsjonalitetsstudie (0,5, 1, 2 og 4 mg) hos pasienter med type 2-diabetes er oppsummert i tabeller. 5 og 6. Disse dataene indikerer at repaglinid ikke akkumuleres i serum. Clearance av oral repaglinid endret seg ikke over doseområdet på 0,5 til 4 mg, noe som indikerer en lineær sammenheng mellom dose og plasmanivåer av legemiddel.
Absorpsjon
Etter oral administrering absorberes repaglinid fullstendig fra mage-tarmkanalen. Etter enkelt- og multiple orale doser hos friske forsøkspersoner eller hos pasienter, inntreffer maksimale plasmanivåer (Cmax) innen 1 time (Tmax). Repaglinid elimineres fra blodstrømmen med en halveringstid på ca. 1 time. Gjennomsnittlig absolutt biotilgjengelighet er 56 %. Når repaglinid ble gitt sammen med mat ble gjennomsnittlig Tmax ikke endret, men gjennomsnittlig Cmax og AUC (areal under tid/plasmakonsentrasjonskurven) ble redusert med henholdsvis 20 % og 12,4 %.
Fordeling
Etter intravenøs (IV) dosering hos friske forsøkspersoner var distribusjonsvolumet ved steady-state (Vss) 31 L, og total kroppsclearance (CL) var 38 L/time. Proteinbinding og binding til humant serumalbumin var større enn 98 %.
Metabolisme og eliminering
Repaglinid metaboliseres fullstendig ved oksidativ biotransformasjon og direkte konjugering med glukuronsyre etter enten en IV eller oral dose. De viktigste metabolittene er en oksidert dikarboksylsyre (M2), det aromatiske aminet (M1) og acylglukuronid (M7). Cytokrom P-450-enzymsystemet, spesifikt 2C8 og 3A4, har vist seg å være involvert i N-dealkyleringen av repaglinid til M2 og den videre oksidasjonen til M1. Metabolitter bidrar ikke til den glukosesenkende effekten av repaglinid. Innen 96 timer etter dosering med 14C-repaglinid som en enkelt, oral dose, ble ca. 90 % av radiomerket gjenfunnet i feces og ca. 8 % i urinen. Bare 0,1 % av dosen fjernes i urinen som moderforbindelse. Hovedmetabolitten (M2) utgjorde 60 % av den administrerte dosen. Mindre enn 2 % av moderlegemidlet ble gjenfunnet i avføring. Repaglinid ser ut til å være et substrat for aktiv hepatisk opptakstransportør (organisk aniontransporterende protein OATP1B1).
Variasjon av eksponering
Repaglinid AUC etter gjentatte doser på 0,25 til 4 mg med hvert måltid varierer over et bredt område. De intra-individuelle og interindividuelle variasjonskoeffisientene var henholdsvis 36 % og 69 %. AUC over det terapeutiske doseområdet inkluderte 69 til 1005 ng/ml*time, men AUC-eksponering opptil 5417 ng/ml*time ble nådd i doseøkningsstudier uten tilsynelatende uheldige konsekvenser.
Spesifikke populasjoner
Geriatrisk
Friske frivillige ble behandlet med et regime på 2 mg PRANDIN 0,5 mg tatt før hvert av 3 måltider. Det var ingen signifikante forskjeller i farmakokinetikken for repaglinid mellom pasientgruppen Bruk i spesifikke populasjoner ].
Kjønn
En sammenligning av farmakokinetikken hos menn og kvinner viste at AUC over doseområdet 0,5 mg til 4 mg var 15 % til 70 % høyere hos kvinner med type 2 diabetes. Denne forskjellen ble ikke reflektert i frekvensen av hypoglykemiske episoder (mann: 16 %; kvinner: 17 %) eller andre bivirkninger.
Løp
Det er ikke utført noen farmakokinetiske studier for å vurdere effekten av rase, men i en amerikansk 1-års studie på pasienter med type 2 diabetes var den blodsukkersenkende effekten sammenlignbar mellom kaukasiere (n=297) og afroamerikanere (n= 33). I en amerikansk dose-respons-studie var det ingen åpenbar forskjell i eksponering (AUC) mellom kaukasiere (n=74) og latinamerikanere (n=33).
Nedsatt nyrefunksjon
Enkeltdose og steady-state farmakokinetikk av repaglinid ble sammenlignet mellom pasienter med type 2 diabetes og normal nyrefunksjon (CrCl > 80 ml/min), mild til moderat nedsatt nyrefunksjon (CrCl = 40 til 80 ml/min) og alvorlig. nedsatt nyrefunksjon (CrCl = 20 til 40 ml/min). Både AUC og Cmax for repaglinid var like hos pasienter med normal og lett til moderat nedsatt nyrefunksjon (henholdsvis gjennomsnittsverdier 56,7 ng/ml*time vs 57,2 ng/ml*time og 37,5 ng/ml vs 37,7 ng/mL). med alvorlig redusert nyrefunksjon hadde forhøyede gjennomsnittlige AUC- og Cmax-verdier (henholdsvis 98,0 ng/ml*time og 50,7 ng/ml), men denne studien viste kun en svak korrelasjon mellom repaglinidnivåer og kreatininclearance.
Nedsatt leverfunksjon
En enkeltdose, åpen studie ble utført på 12 friske forsøkspersoner og 12 pasienter med kronisk leversykdom (CLD) klassifisert etter Child-Pugh-skala og koffeinclearance. Pasienter med moderat til alvorlig nedsatt leverfunksjon hadde høyere og mer langvarige serumkonsentrasjoner av både totalt og ubundet repaglinid enn friske personer (AUChealthy: 91,6 ng/mL*time; AUCCLD-pasienter: 368,9 ng/ml*time; Cmax, friske: 46,7 ng/ml; Cmax, CLD-pasienter: 105,4 ng/ml). AUC var statistisk korrelert med koffeinclearance. Ingen forskjell i glukoseprofiler ble observert på tvers av pasientgrupper.
Legemiddel-legemiddelinteraksjoner
Legemiddelinteraksjonsstudier utført på friske frivillige viser at PRANDIN 0,5 mg ikke hadde noen klinisk relevant effekt på de farmakokinetiske egenskapene til digoksin, teofyllin eller warfarin. Samtidig administrering av cimetidin og PRANDIN 1 mg endret ikke absorpsjonen og disponeringen av repaglinid signifikant.
tillegg ble følgende legemidler studert hos friske frivillige med samtidig administrering av PRANDIN.
Kliniske studier
Monoterapiforsøk
En dobbeltblind, placebokontrollert studie ble utført med 362 pasienter behandlet i 24 uker. HbA1c for de PRANDIN-behandlede gruppene (1 og 4 mg grupper kombinert) ved slutten av studien ble redusert med 2,1 % og 1,7 % sammenlignet med den placebobehandlede gruppen hos behandlingsnaive pasienter og hos pasienter tidligere behandlet med orale hypoglykemiske midler, hhv. I denne studien med faste doser viste pasienter som var behandlingsnaive for oral behandling med hypoglykemiske midler og pasienter med en HbA1c under 8 % ved baseline større blodsukkerreduksjon.
Kombinasjonsforsøk
PRANDIN i kombinasjon med metformin
PRANDIN ble studert i kombinasjon med metformin hos 83 pasienter som ikke var tilfredsstillende kontrollert på trening, kosthold og metformin alene. PRANDIN 2 mg dosering ble titrert i 4 til 8 uker, etterfulgt av en 3-måneders vedlikeholdsperiode. Kombinasjonsbehandling med PRANDIN 1 mg og metformin resulterte i statistisk signifikant forbedring av HbA1c og fastende plasmaglukose (FPG) sammenlignet med PRANDIN 2 mg eller metformin monoterapi (tabell 8). I denne studien hvor metformindosen ble holdt konstant, viste kombinasjonsbehandlingen av PRANDIN og metformin dosebesparende effekter med hensyn til PRANDIN. Forbedringen i HbA1c og FPG i kombinasjonsgruppen ble oppnådd ved en lavere daglig PRANDIN 0,5 mg dose enn i PRANDIN monoterapigruppen (tabell 8).
PRANDIN 1mg i kombinasjon med pioglitazon
Et kombinasjonsbehandlingsregime med PRANDIN og pioglitazon (N=123) ble sammenlignet med PRANDIN alene (N=61) og pioglitazon alene (N=62) i en 24-ukers studie som inkluderte 246 pasienter tidligere behandlet med sulfonylurea eller metformin monoterapi (HbA1c) > 7,0 %). PRANDIN 1 mg-dose ble titrert i løpet av de første 12 ukene, etterfulgt av en 12-ukers vedlikeholdsperiode. Kombinasjonsbehandling resulterte i statistisk signifikant forbedring i HbA1c og FPG sammenlignet med monoterapi (Figur 1). Endringene fra baseline for fullførere i henholdsvis FPG (mg/dL) og HbA1c (%) var: -39,8 mg/dL og -0,1 % for PRANDIN, -35,3 mg/dL og -0,1 % for pioglitazon og -92,4 mg/ dL og -1,9 % for kombinasjonen. I denne studien der pioglitazondosen ble holdt konstant, viste kombinasjonsterapigruppen dosebesparende effekter med hensyn til PRANDIN (se figur 1-forklaring). Forbedringen i HbA1c og FPG i kombinasjonsgruppen ble oppnådd ved en lavere daglig PRANDIN-dose enn i PRANDIN monoterapigruppen.
Figur 1: PRANDIN i kombinasjon med pioglitazon: HbA1c-verdier
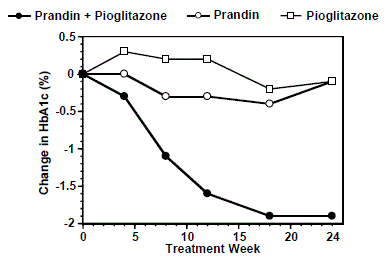
LEGENDE
HbA1c-verdier etter studieuke for pasienter som fullførte studien (kombinasjon, N = 101; PRANDIN 1 mg, N = 35, pioglitazon, N = 26). Personer med FPG over 270 mg/dL ble trukket fra studien.
Pioglitazondose: fastsatt til 30 mg/dag; PRANDIN 1 mg median sluttdose: 6 mg/dag for kombinasjon og 10 mg/dag for monoterapi.
PRANDIN i kombinasjon med rosiglitazon
Et kombinasjonsbehandlingsregime med PRANDIN og rosiglitazon ble sammenlignet med monoterapi med begge midler alene i en 24-ukers studie som inkluderte 252 pasienter tidligere behandlet med sulfonylurea eller metformin (HbA1c > 7,0 %). Kombinasjonsbehandling resulterte i statistisk signifikant forbedring i HbA1c og FPG sammenlignet med monoterapi (tabell 9 nedenfor). De glykemiske effektene av kombinasjonsbehandlingen var dosebesparende med hensyn til både total daglig PRANDIN 1 mg-dose og total daglig rosiglitazondose (se Tabell 9 Legend). Forbedringen i HbA1c og FPG i kombinasjonsterapigruppen ble oppnådd med lavere daglig dose av PRANDIN 1 mg og rosiglitazon, sammenlignet med de respektive monoterapigruppene.
PASIENTINFORMASJON
Hypoglykemi
Informer pasienter om at PRANDIN 2mg kan forårsake hypoglykemi og instruer pasienter og deres omsorgspersoner om prosedyrer for selvbehandling, inkludert glukoseovervåking og behandling av hypoglykemi. Informer pasientene om at deres evne til å konsentrere seg og reagere kan bli svekket som følge av hypoglykemi. Hos pasienter med høyere risiko for hypoglykemi og pasienter som har redusert symptomatisk bevissthet om hypoglykemi, anbefales økt frekvens av blodsukkermåling [se ADVARSLER OG FORHOLDSREGLER ].
Administrasjon
Instruer pasienter om å ta PRANDIN 0,5 mg innen 30 minutter før måltider. Instruer pasientene om å hoppe over dosen PRANDIN når et måltid hoppes over [se DOSERING OG ADMINISTRASJON ].
Narkotikahandel
Diskuter potensielle legemiddelinteraksjoner med pasienter og informer dem om potensielle legemiddelinteraksjoner med PRANDIN [se NARKOTIKAHANDEL ].
