Aristocort 4mg Triamcinolone Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Aristocort og hvordan brukes det?
Aristocort 4mg er et reseptbelagt legemiddel som brukes til å behandle symptomer på allergiske lidelser, leddgikt, blodsykdommer, . Aristocort 4mg kan brukes alene eller sammen med andre medisiner.
Aristocort tilhører en klasse legemidler kalt kortikosteroid; Glukokortikoid.
Det er ikke kjent om Aristocort 4mg er trygt og effektivt hos barn yngre enn 1 år.
Hva er de mulige bivirkningene av Aristocort?
Aristocort kan forårsake alvorlige bivirkninger, inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . forverring av hudtilstanden din, . rødhet, varme, hevelse, væsker eller alvorlig irritasjon av behandlet hud, . tåkesyn, . tunnelsyn, . øyesmerter, . ser glorier rundt lys, . økt tørst, . økt vannlating, . tørr i munnen, . lukt av fruktig pust, . vektøkning (spesielt i ansiktet eller øvre del av ryggen og overkroppen), . sakte sårheling, . tynn eller misfarget hud, . økt kroppsbehåring, . muskel svakhet, . kvalme, . diaré, . tretthet, . humørsvingninger, . menstruasjonsforandringer, og . seksuelle endringer
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Aristocort inkluderer:
- . svie, kløe, tørrhet eller annen irritasjon av behandlet hud, . rødhet eller skorpe rundt hårsekkene, . rødhet eller kløe rundt munnen, . allergisk hudreaksjon, . strekkmerker, . kviser, . økt kroppshårvekst, . tynn hud eller misfarging, og . hvitt eller "beskjært" utseende på huden (forårsaket av belegg behandlet med en tett bandasje eller annen belegg)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Aristocort. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
IKKE TIL BRUK HOS NYBØRNE
IKKE TIL INTRAVENØS BRUK
INNEHOLDER BENZYLALKOHOL
BESKRIVELSE
Aristocort® Forte er en steril suspensjon av 40 mg/ml triamcinolondiacetat (mikronisert) suspendert i en bærer bestående av:
Saltsyre og/eller natriumhydroksid kan brukes under produksjonen for å justere pH i suspensjonen til ca. 6.
Triamcinolondiacetat er praktisk talt uløselig i vann; løselig i kloroform; lite løselig i alkohol og metanol; og lett løselig i eter. Dette preparatet er egnet for parenteral administrering gjennom en 23-gauge nål (eller større), men IKKE egnet for intravenøs bruk. Det kan administreres intramuskulært, intraartikulært eller intrasynovialt, avhengig av situasjonen.
Irreversibel klumping oppstår når dette produktet er frosset.
Kjemisk er triamcinolondiacetat 9-fluor-11ß,16',17,21-tetrahydroksypregna-1,4-dien-3,20-dion 16,21-diacetat.
Molekylvekten er 478,51. Dens strukturformel er:
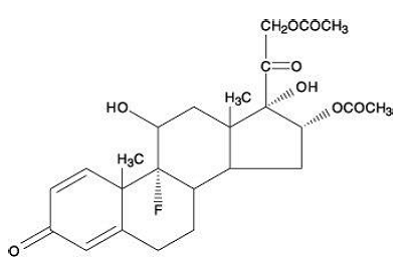
Triamcinolondiacetat forekommer som et hvitt til off-white, mikrokrystallinsk pulver.
INDIKASJONER
Der oral behandling ikke er mulig, er Aristocort® Forte (triamcinolondiacetat injiserbar suspensjon), 40 mg/ml, indisert for intramuskulær bruk som følger:
Allergiske tilstander
Kontroll av alvorlige eller invalidiserende allergiske tilstander som er vanskelige å behandle med tilstrekkelige utprøvinger av konvensjonell behandling ved astma, atopisk dermatitt, kontaktdermatitt, overfølsomhetsreaksjoner for medikamenter, flerårig eller sesongbetont allergisk rhinitt, serumsyke, transfusjonsreaksjoner.
Dermatologiske sykdommer
Bullous dermatitis herpetiformis, eksfoliativ erythroderma, mycosis fungoides, pemphigus, alvorlig erythema multiforme (Stevens-Johnsons syndrom).
Endokrine lidelser
Primær eller sekundær binyrebarkinsuffisiens (hydrokortison eller kortison er det foretrukne stoffet; syntetiske analoger kan brukes sammen med mineralokortikoider der det er aktuelt; i spedbarnsalderen er mineralokortikoidtilskudd av spesiell betydning), medfødt binyrehyperplasi, hyperkalsemi assosiert med kreft, ikke-suppurativ tyreoiditt.
Gastrointestinal sykdom
For å rydde pasienten over en kritisk periode av sykdommen ved regional enteritt og ulcerøs kolitt.
Hematologiske lidelser
Ervervet (autoimmun) hemolytisk anemi, Diamond-Blackfan-anemi, ren rødcelleaplasi, utvalgte tilfeller av sekundær trombocytopeni.
Diverse
Trikinose med nevrologisk eller myokardinvolvering, tuberkuløs meningitt med subaraknoidal blokkering eller forestående blokkering når det brukes med passende antituberkuløs kjemoterapi.
Neoplastiske sykdommer
For palliativ behandling av leukemier og lymfomer.
Nervesystemet
Akutte forverringer av multippel sklerose; cerebralt ødem assosiert med primær eller metastatisk hjernesvulst, eller kraniotomi.
Oftalmiske sykdommer
Sympatisk oftalmi, uveitt og okulære inflammatoriske tilstander som ikke reagerer på aktuelle kortikosteroider.
Nyresykdommer
For å indusere diurese eller remisjon av proteinuri ved idiopatisk nefrotisk syndrom eller det som skyldes lupus erythematosus.
Luftveissykdommer
Berylliose, fulminerende eller disseminert lungetuberkulose når det brukes samtidig med passende antituberkuløs kjemoterapi, idiopatiske eosinofile pneumonier, symptomatisk sarkoidose.
Revmatiske lidelser
Som tilleggsterapi for kortvarig administrering (for å få pasienten over en akutt episode eller forverring) ved akutt giktartritt; akutt revmatisk karditt; ankyloserende spondylitt; psoriasisartritt; revmatoid artritt, inkludert juvenil revmatoid artritt (utvalgte tilfeller kan kreve vedlikeholdsbehandling med lav dose). For behandling av dermatomyositt, polymyositt og systemisk lupus erythematosus.
For intraartikulær eller bløtvevsadministrasjon
Intraartikulær eller bløtvevsadministrering av Aristocort® Forte er indisert som tilleggsterapi for korttidsadministrasjon (for å få pasienten over en akutt episode eller forverring) ved akutt giktartritt, akutt og subakutt bursitt, akutt uspesifikk tenosynovitt, epikondylitt, revmatoid artritt, synovitt av slitasjegikt.
For intralesional administrasjon
Intralesjonell administrering av Aristocort® Forte er indisert for alopecia areata; discoid lupus erythematosus; keloider; lokaliserte hypertrofiske, infiltrerte, inflammatoriske lesjoner av granuloma annulare, lichen planus, lichen simplex chronicus (neurodermatitt) og psoriatiske plakk; necrobiosis lipoidica diabeticorum.
Det kan også være nyttig i cystiske svulster av en aponeurose eller sene (ganglia).
DOSERING OG ADMINISTRASJON
MERK: INNEHOLDER BENZYLALKOHOL (se ADVARSLER og FORHOLDSREGLER: Pediatrisk bruk)
På grunn av mulig fysisk inkompatibilitet, bør Aristocort® Forte Sterile Vandig Suspensjon ikke fortynnes eller blandes med andre løsninger.
Generell
Den initiale intramuskulære dosen av triamcinolondiacetat injiserbar suspensjon kan variere fra 3 til 48 mg per dag avhengig av den spesifikke sykdomsenheten som behandles. Imidlertid, i visse overveldende, akutte, livstruende situasjoner, kan administrering i doser som overskrider de vanlige dosene være berettiget og kan være i multipler av de orale dosene.
Det bør understrekes at doseringskravene er varierende og må tilpasses på grunnlag av sykdommen under behandling og pasientens respons. Etter at en gunstig respons er notert, bør riktig vedlikeholdsdose bestemmes ved å redusere den initiale legemiddeldosen i små dekrementer med passende tidsintervaller inntil den laveste dosen som vil opprettholde en adekvat klinisk respons er nådd. Situasjoner som kan gjøre dosejusteringer nødvendige er endringer i klinisk status sekundært til remisjoner eller forverringer i sykdomsprosessen, pasientens individuelle medikamentrespons og effekten av pasientens eksponering for stressende situasjoner som ikke er direkte relatert til sykdomsenheten under behandling. I sistnevnte situasjon kan det være nødvendig å øke dosen av kortikosteroidet i en tidsperiode som samsvarer med pasientens tilstand. Hvis stoffet skal stoppes etter langvarig behandling, anbefales det at det seponeres gradvis i stedet for brått.
Ved behandling av akutte forverringer av multippel sklerose anbefales daglige doser på 160 mg triamcinolon i en uke etterfulgt av 64 mg annenhver dag i en måned (se FORHOLDSREGLER : Nevrologisk/psykiatrisk ).
Hos pediatriske pasienter kan startdosen av triamcinolon variere avhengig av den spesifikke sykdomsenheten som behandles. Utvalget av startdoser er 0,11 til 1,6 mg/kg/dag fordelt på tre eller fire doser (3,2 til 48 mg/m² bsa/dag).
For sammenligningsformål er følgende tilsvarende milligramdosering av de forskjellige glukokortikoidene:
Disse doseforholdene gjelder kun for oral eller intravenøs administrering av disse forbindelsene. Når disse stoffene eller deres derivater injiseres intramuskulært eller i leddrom, kan deres relative egenskaper bli sterkt endret.
Spesifikk
Aristocort® Forte Parenteral er triamcinolondiacetat injiserbar suspensjon (40 mg/ml) suspendert i en egnet bærer. Suspensjonen med full styrke kan benyttes. Topisk etylkloridspray kan brukes lokalt før injeksjon.
Siden dette produktet er utformet for enkel administrasjon, kan en kanyle med liten boring (ikke mindre enn 23 gauge) brukes.
Intramuskulært
Selv om Aristocort® Forte Parenteral kan administreres intramuskulært for initial behandling, foretrekker de fleste leger å justere dosen oralt inntil tilstrekkelig kontroll er oppnådd. Intramuskulær administrering gir en vedvarende eller depotvirkning som kan brukes til å supplere eller erstatte initial oral terapi. Med intramuskulær terapi, er større tilsyn med mengden steroid som brukes, mulig hos pasienten som er inkonsekvent i å følge en oral doseringsplan. Ved vedlikeholdsbehandling er pasient-til-pasient-responsen ikke ensartet, og derfor må dosen individualiseres for optimal kontroll.
Gjennomsnittlig dose er 40 mg (1 ml) administrert intramuskulært en gang i uken for tilstander der antiinflammatorisk virkning er ønsket.
Generelt kan en enkelt parenteral dose 4 til 7 ganger den orale daglige dosen forventes å kontrollere pasienten fra 4 til 7 dager opp til 3 til 4 uker. Doseringen bør justeres til det punktet hvor tilstrekkelig, men ikke nødvendigvis fullstendig lindring av symptomene oppnås.
Intraartikulær og Intrasynovial
Den vanlige dosen varierer fra 5 til 40 mg. Gjennomsnittet for kneet er for eksempel 25 mg. Virkningens varighet varierer fra en uke til 2 måneder. Akutt betente ledd kan imidlertid kreve hyppigere injeksjoner.
Et mindre startdoseområde av triamcinolondiacetat injiserbar suspensjon kan gi den ønskede effekten når medikamentet administreres for å gi en lokalisert konsentrasjon. Injeksjonsstedet og injeksjonsvolumet bør vurderes nøye når triamcinolondiacetat administreres for dette formålet.
En bestemt dose avhenger i stor grad av størrelsen på leddet.
Streng kirurgisk asepsis er obligatorisk. Legen bør være kjent med anatomiske sammenhenger som beskrevet i standard lærebøker. Aristocort® Forte Parenteral kan brukes i alle tilgjengelige ledd unntatt mellomvirvelene. Generelt anbefales intrasynovial terapi under følgende omstendigheter:
. Når systemisk steroidbehandling er kontraindisert på grunn av bivirkninger som magesår. . Når det er ønskelig å sikre avlastning i ett eller to spesifikke ledd. . Når godt systemisk vedlikehold ikke klarer å kontrollere oppblussing i noen få ledd, og det er ønskelig å sikre lindring uten å øke oral behandling.Slik behandling bør ikke anses å utgjøre en kur, for selv om denne metoden vil lindre leddsymptomene, utelukker den ikke behovet for de konvensjonelle tiltakene som vanligvis brukes.
Det foreslås at infiltrasjon av bløtvevet ved lokalbedøvelse går før intraartikulær injeksjon. En 24 gauge eller større nål på en tørr sprøyte kan settes inn i leddet og overflødig væske suges opp. De første timene etter injeksjon kan det være lokalt ubehag i leddet, men dette følges vanligvis raskt av effektiv smertelindring og forbedring av lokal funksjon.
HVORDAN LEVERES
Aristocort® Forte (triamcinolondiacetat injiserbar suspensjon), 40 mg/ml, parenteral, ikke til intravenøs bruk, leveres som følger:
NDC 0781-3037-71 40 mg/mL (1 mL Fyll i et 2 mL hetteglass), esker med 1 NDC 0781-3037-75 40 mg/mL (5 mL Fyll i et 10 mL hetteglass), esker med 1
Beskytt mot lys.
IKKE FRYSE
RISTE GODT
Oppbevares ved 20°-25°C (68°-77°F) [se USP kontrollert romtemperatur ].
Irreversibel klumping oppstår når produktet fryses.
Produsert i Canada av: Sandoz Canada Inc. for Sandoz Inc., Princeton, NJ 08540
BIVIRKNINGER
(oppført alfabetisk, under hver underseksjon)
Allergiske reaksjoner
Allergiske eller overfølsomhetsreaksjoner, anafylaktoide reaksjoner, anafylaksi, angioødem.
Kardiovaskulær
Bradykardi, hjertestans, hjertearytmier, hjerteforstørrelse, sirkulasjonskollaps, kongestiv hjertesvikt, fettemboli, hypertensjon, hypertrofisk kardiomyopati hos premature spedbarn, myokardruptur etter nylig hjerteinfarkt (se ADVARSLER ), lungeødem, synkope, takykardi, tromboembolisme, tromboflebitt, vaskulitt.
Dermatologisk
Akne, allergisk dermatitt, kutan og subkutan atrofi, tørr skjellete hud, ekkymoser og petekkier, ødem, erytem, hyperpigmentering, hypopigmentering, nedsatt sårtilheling, økt svette, utslett, steril abscess, striae, undertrykte reaksjoner på hudprøver, tynn skjør hud, tynn hud. tynt hodehår, urticaria.
Endokrine
Redusert karbohydrat- og glukosetoleranse, utvikling av cushingoid tilstand, glykosuri, hirsutisme, hypertrikose, økt behov for insulin eller orale hypoglykemiske midler ved diabetes, manifestasjoner av latent diabetes mellitus, menstruasjonsuregelmessigheter, sekundær adrenokortikal og hypofyse manglende respons (spesielt i tider med stress, som ved traumer, kirurgi eller sykdom), undertrykkelse av vekst hos pediatriske pasienter.
Væske- og elektrolyttforstyrrelser
Kongestiv hjertesvikt hos mottakelige pasienter, væskeretensjon, hypokalemisk alkalose, kaliumtap, natriumretensjon.
Gastrointestinale
Abdominal oppblåsthet, dysfunksjon av tarm/blære (etter intratekal administrering), forhøyede leverenzymer i serum (vanligvis reversible ved seponering), hepatomegali, økt appetitt, kvalme, pankreatitt, magesår med mulig perforasjon og blødning, perforering av tynn- og tykktarmen (spesielt hos pasienter med inflammatorisk tarmsykdom), ulcerøs øsofagitt.
Metabolsk
Negativ nitrogenbalanse på grunn av proteinkatabolisme.
Muskuloskeletal
Aseptisk nekrose av lår- og humeralhoder, kalsinose (etter intraartikulær eller intralesjonell bruk), Charcot-lignende artropati, tap av muskelmasse, muskelsvakhet, osteoporose, patologisk brudd på lange bein, postinjeksjonsoppbluss (etter intraartikulær bruk ), steroid myopati, seneruptur, vertebrale kompresjonsfrakturer.
Nevrologisk/psykiatrisk
Kramper, depresjon, emosjonell ustabilitet, eufori, hodepine, økt intrakranielt trykk med papilleødem (pseudotumor cerebri) vanligvis etter seponering av behandlingen, søvnløshet, humørsvingninger, nevritt, nevropati, parestesi, personlighetsforandringer, psykiske lidelser, vertigo. Arachnoiditt, meningitt, paraparese/paraplegi og sensoriske forstyrrelser har oppstått etter intratekal administrering (se ADVARSLER : Nevrologisk ).
Oftalmisk
Eksophthalmos, glaukom, økt intraokulært trykk, posterior subkapsulær katarakt, sjeldne tilfeller av blindhet assosiert med periokulære injeksjoner.
Annen
Unormale fettavleiringer, redusert motstand mot infeksjon, hikke, økt eller redusert motilitet og antall sædceller, infeksjoner på injeksjonsstedet etter ikke-steril administrering (se ADVARSLER ), ubehag, måneansikt, vektøkning.
NARKOTIKAHANDEL
Aminoglutetimid
Aminoglutetimid kan føre til tap av kortikosteroidindusert binyresuppresjon.
Amfotericin B-injeksjon og kaliumdepleterende midler
Når kortikosteroider administreres samtidig med kaliumdepleterende midler (dvs. amfotericin B, diuretika), bør pasienter observeres nøye for utvikling av hypokalemi. Det har vært rapportert tilfeller der samtidig bruk av amfotericin B og hydrokortison ble etterfulgt av hjerteforstørrelse og kongestiv hjertesvikt.
Antibiotika
Makrolidantibiotika er rapportert å forårsake en signifikant reduksjon i kortikosteroidclearance (se NARKOTIKAHANDEL : Hepatiske enzymhemmere ).

Antikolinesteraser
Samtidig bruk av antikolinesterasemidler og kortikosteroider kan gi alvorlig svakhet hos pasienter med myasthenia gravis. Om mulig bør antikolinesterasemidler seponeres minst 24 timer før oppstart av kortikosteroidbehandling.
Antikoagulantia, Oral
Samtidig administrering av kortikosteroider og warfarin resulterer vanligvis i hemming av respons på warfarin, selv om det har vært noen motstridende rapporter. Derfor bør koagulasjonsindekser overvåkes ofte for å opprettholde ønsket antikoagulasjonseffekt.
Antidiabetikere
Fordi kortikosteroider kan øke blodsukkerkonsentrasjonen, kan dosejusteringer av antidiabetika være nødvendig.
Antituberkulære legemidler
Serumkonsentrasjoner av isoniazid kan reduseres.
Kolestyramin
Kolestyramin kan øke clearance av kortikosteroider.
Syklosporin
Økt aktivitet av både ciklosporin og kortikosteroider kan forekomme når de to brukes samtidig. Kramper er rapportert ved denne samtidige bruken.
Digitalis glykosider
Pasienter på digitalisglykosider kan ha økt risiko for arytmier på grunn av hypokalemi.
Østrogener, inkludert orale prevensjonsmidler
Østrogener kan redusere levermetabolismen til visse kortikosteroider, og dermed øke effekten.
Hepatiske enzymindusere (f.eks. barbiturater, fenytoin, karbamazepin, rifampin)
Legemidler som induserer cytokrom P450 3A4 enzymaktivitet kan øke metabolismen av kortikosteroider og kreve at dosen av kortikosteroidet økes.
Leverenzymhemmere (f.eks. ketokonazol, makrolidantibiotika som erytromycin og troleandomycin)
Legemidler som hemmer cytokrom P450 3A4 enzymaktivitet har potensial til å resultere i økte plasmakonsentrasjoner av kortikosteroider.
Ketokonazol
Ketokonazol har blitt rapportert å redusere metabolismen av visse kortikosteroider betydelig med opptil 60 %, noe som fører til økt risiko for kortikosteroidbivirkninger.
Ikke-steroide antiinflammatoriske midler (NSAIDs)
Samtidig bruk av aspirin (eller andre ikke-steroide antiinflammatoriske midler) og kortikosteroider øker risikoen for gastrointestinale bivirkninger. Aspirin bør brukes med forsiktighet i forbindelse med kortikosteroider ved hypoprotrombinemi. Clearance av salisylater kan øke ved samtidig bruk av kortikosteroider.
Hudprøver
Kortikosteroider kan undertrykke reaksjoner på hudtester.
Vaksiner
Pasienter på langvarig behandling med kortikosteroider kan vise en redusert respons på toksoider og levende eller inaktiverte vaksiner på grunn av hemming av antistoffrespons. Kortikosteroider kan også potensere replikasjonen av enkelte organismer som finnes i levende svekkede vaksiner. Rutinemessig administrering av vaksiner eller toksoider bør utsettes inntil kortikosteroidbehandling seponeres hvis mulig (se ADVARSLER : Vaksinasjon ).
ADVARSLER
Alvorlige nevrologiske bivirkninger ved epidural administrasjon
Alvorlige nevrologiske hendelser, noen med døden til følge, er rapportert ved epidural injeksjon av kortikosteroider. Spesifikke hendelser rapportert inkluderer, men er ikke begrenset til, ryggmargsinfarkt, paraplegi, quadriplegi, kortikal blindhet og hjerneslag. Disse alvorlige nevrologiske hendelsene er rapportert med og uten bruk av fluoroskopi. Sikkerheten og effektiviteten av epidural administrering av kortikosteroider er ikke fastslått, og kortikosteroider er ikke godkjent for denne bruken
Generell
Dette produktet inneholder benzylalkohol som er potensielt giftig når det administreres lokalt til nevralt vev. Eksponering for store mengder benzylalkohol har vært assosiert med toksisitet (hypotensjon, metabolsk acidose), spesielt hos nyfødte, og økt forekomst av kernicterus, spesielt hos små premature spedbarn. Det har vært sjeldne rapporter om dødsfall, primært hos premature spedbarn, assosiert med eksponering for store mengder benzylalkohol. Administrering av høye doser medikamenter som inneholder dette konserveringsmidlet må ta hensyn til den totale mengden administrert benzylalkohol. Mengden benzylalkohol som toksisitet kan oppstå ved er ikke kjent. Hvis pasienten trenger mer enn anbefalte doser eller andre medisiner som inneholder dette konserveringsmidlet, må legen vurdere den daglige metabolske belastningen av benzylalkohol fra disse kombinerte kildene (se FORHOLDSREGLER : Pediatrisk bruk ).
Det er avgjørende at egnet teknikk brukes under administrering av Aristocort® Forte og at man sørger for riktig plassering av legemidlet.
Sjeldne tilfeller av anafylaktoide reaksjoner har forekommet hos pasienter som får kortikosteroidbehandling (se BIVIRKNINGER ).
Økt dosering av hurtigvirkende kortikosteroider er indisert hos pasienter på kortikosteroidbehandling som er utsatt for uvanlig stress før, under og etter den stressende situasjonen.
Resultater fra en multisenter, randomisert, placebokontrollert studie med metylprednisolonhemisuccinat, et IV-kortikosteroid, viste en økning i tidlig (ved 2 uker) og sen (ved 6 måneder) dødelighet hos pasienter med kranietraumer som ble fastslått å ikke ha andre klare indikasjoner for kortikosteroidbehandling. Høye doser av systemiske kortikosteroider, inkludert Aristocort®, bør ikke brukes til behandling av traumatisk hjerneskade.
Kardio-nyre
Gjennomsnittlige og store doser kortikosteroider kan forårsake forhøyet blodtrykk, salt- og vannretensjon og økt utskillelse av kalium. Det er mindre sannsynlig at disse effektene oppstår med de syntetiske derivatene, bortsett fra når de brukes i store doser. Saltbegrensning i kosten og kaliumtilskudd kan være nødvendig. Alle kortikosteroider øker kalsiumutskillelsen.
Litteraturrapporter antyder en tilsynelatende sammenheng mellom bruk av kortikosteroider og venstre ventrikkels frie veggruptur etter et nylig hjerteinfarkt; derfor bør behandling med kortikosteroider brukes med stor forsiktighet hos disse pasientene.
Endokrine
Kortikosteroider kan gi reversibel hypothalamus-hypofyse adrenal (HPA) aksesuppresjon med potensial for glukokortikosteroidinsuffisiens etter seponering av behandlingen. Legemiddelindusert sekundær binyrebarksvikt kan minimeres ved gradvis reduksjon av dosen. Denne typen relativ insuffisiens kan vedvare i flere måneder etter seponering av behandlingen; Derfor bør hormonbehandling gjenopptas i enhver situasjon med stress som oppstår i denne perioden.
Metabolsk clearance av kortikosteroider er redusert hos hypothyroidpasienter og økt hos hypertyreoidepasienter. Endringer i skjoldbruskkjertelstatus hos pasienten kan nødvendiggjøre justering av dosen.
Infeksjoner
Generell
Pasienter som tar kortikosteroider er mer utsatt for infeksjoner enn friske personer. Det kan være redusert motstand og manglende evne til å lokalisere infeksjon når kortikosteroider brukes. Infeksjon med et hvilket som helst patogen (viralt, bakterielt, sopp-, protozo- eller helmintisk) hvor som helst i kroppen kan være assosiert med bruk av kortikosteroider alene eller i kombinasjon med andre immunsuppressive midler. Disse infeksjonene kan være milde, men kan være alvorlige og til tider dødelige. Med økende doser av kortikosteroider øker forekomsten av smittsomme komplikasjoner. Kortikosteroider kan også maskere noen tegn på nåværende infeksjon.
Soppinfeksjoner
Kortikosteroider kan forverre systemiske soppinfeksjoner og bør derfor ikke brukes i nærvær av slike infeksjoner med mindre de er nødvendige for å kontrollere legemiddelreaksjoner. Det har vært rapportert tilfeller der samtidig bruk av amfotericin B og hydrokortison ble etterfulgt av hjerteforstørrelse og kongestiv hjertesvikt (se FORHOLDSREGLER : NARKOTIKAHANDEL : Amfotericin B-injeksjon og kaliumdepleterende midler ).
Spesielle patogener
Latent sykdom kan aktiveres eller det kan være en forverring av interkurrente infeksjoner på grunn av patogener, inkludert de som er forårsaket av Amoeba, Candida, Cryptococcus, Mycobacterium, Nocardia, Pneumocystis, Toxoplasma.
Det anbefales at latent amebiasis eller aktiv amebiasis utelukkes før oppstart av kortikosteroidbehandling hos enhver pasient som har tilbrakt tid i tropene eller hos en pasient med uforklarlig diaré.
På samme måte bør kortikosteroider brukes med stor forsiktighet hos pasienter med kjent eller mistenkt Strongyloides (trådorm) angrep. Hos slike pasienter kan kortikosteroidindusert immunsuppresjon føre til Strongyloides hyperinfeksjon og disseminasjon med utbredt larvemigrasjon, ofte ledsaget av alvorlig enterokolitt og potensielt fatal gramnegativ septikemi.
Kortikosteroider bør ikke brukes ved cerebral malaria.
Tuberkulose
Bruk av kortikosteroider ved aktiv tuberkulose bør begrenses til de tilfellene av fulminerende eller disseminert tuberkulose der kortikosteroidet brukes til behandling av sykdommen i forbindelse med et passende antituberkuløst regime.
Hvis kortikosteroider er indisert hos pasienter med latent tuberkulose eller tuberkulinreaktivitet, er nøye observasjon nødvendig da reaktivering av sykdommen kan forekomme. Under langvarig kortikosteroidbehandling bør disse pasientene få kjemoprofylakse.
Vaksinasjon
Administrering av levende eller levende svekkede vaksiner er kontraindisert hos pasienter som får immunsuppressive doser av kortikosteroider. Drepte eller inaktiverte vaksiner kan administreres. Responsen på slike vaksiner kan imidlertid ikke forutsies. Vaksinasjonsprosedyrer kan utføres hos pasienter som får kortikosteroider som erstatningsterapi, for eksempel for Addisons sykdom.
Virale infeksjoner
Vannkopper og meslinger kan ha et mer alvorlig eller til og med dødelig forløp hos pediatriske og voksne pasienter på kortikosteroider. Hos pediatriske og voksne pasienter som ikke har hatt disse sykdommene, bør det utvises spesiell forsiktighet for å unngå eksponering. Bidraget fra den underliggende sykdommen og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kjent. Ved eksponering for vannkopper kan profylakse med varicella zoster immunglobulin (VZIG) være indisert. Ved eksponering for meslinger kan profylakse med immunglobulin (IG) være indisert. (Se de respektive pakningsvedleggene for fullstendig VZIG- og IG-reseptinformasjon .) Hvis det utvikler seg vannkopper, bør behandling med antivirale midler vurderes.
Nevrologisk
Rapporter om alvorlige bivirkninger har blitt assosiert med den intratekale administrasjonsmåten (se BIVIRKNINGER : Nevrologisk/psykiatrisk ).
Oftalmisk
Bruk av kortikosteroider kan gi bakre subkapsulær katarakt, glaukom med mulig skade på synsnervene, og kan øke etableringen av sekundære øyeinfeksjoner på grunn av bakterier, sopp eller virus. Bruk av systemiske kortikosteroider anbefales ikke ved behandling av optikusnevritt og kan føre til økt risiko for nye episoder. Kortikosteroider bør brukes med forsiktighet hos pasienter med okulær herpes simplex på grunn av mulig hornhinneperforasjon. Kortikosteroider bør ikke brukes ved aktiv okulær herpes simplex.
FORHOLDSREGLER
Generell
Dette produktet, som mange andre steroidformuleringer, er følsomt for varme. Derfor bør det ikke autoklaveres når det er ønskelig å sterilisere utsiden av hetteglasset.
Den laveste mulige dosen kortikosteroid bør brukes for å kontrollere tilstanden under behandling. Når reduksjon i dose er mulig, bør reduksjonen skje gradvis.
Siden komplikasjoner ved behandling med glukokortikoider er avhengig av dosestørrelsen og behandlingens varighet, må det tas en risiko/nytte-avgjørelse i hvert enkelt tilfelle med hensyn til dose og behandlingsvarighet og om daglig eller intermitterende behandling skal brukes. .
Kaposis sarkom er rapportert å forekomme hos pasienter som får kortikosteroidbehandling, oftest for kroniske tilstander. Seponering av kortikosteroider kan føre til klinisk bedring.
Atrofi på injeksjonsstedet er rapportert.
Kardio-nyre
Siden natriumretensjon med resulterende ødem og kaliumtap kan forekomme hos pasienter som får kortikosteroider, bør disse midlene brukes med forsiktighet hos pasienter med kongestiv hjertesvikt, hypertensjon eller nyresvikt.
Endokrine
Legemiddelindusert sekundær binyrebarksvikt kan minimeres ved gradvis reduksjon av dosen. Denne typen relativ insuffisiens kan vedvare i flere måneder etter seponering av behandlingen; Derfor bør hormonbehandling gjenopptas i enhver situasjon med stress som oppstår i denne perioden. Siden mineralokortikoidsekresjon kan være svekket, bør salt og/eller et mineralokortikoid administreres samtidig.
Gastrointestinale
Steroider bør brukes med forsiktighet ved aktivt eller latent magesår, divertikulitt, friske intestinale anastomoser og uspesifikk ulcerøs kolitt, siden de kan øke risikoen for perforasjon.
Tegn på peritoneal irritasjon etter gastrointestinal perforering hos pasienter som får kortikosteroider kan være minimale eller fraværende.
Det er en forsterket effekt på grunn av økt metabolisme av kortikosteroider hos pasienter med cirrhose.
Intraartikulær og mykt vevsadministrasjon
Intraartikulært injiserte kortikosteroider kan absorberes systemisk.
Passende undersøkelse av eventuell tilstedeværende leddvæske er nødvendig for å utelukke en septisk prosess.
En markant økning i smerte ledsaget av lokal hevelse, ytterligere begrensning av leddbevegelser, feber og ubehag tyder på septisk artritt. Hvis denne komplikasjonen oppstår og diagnosen sepsis er bekreftet, bør passende antimikrobiell behandling settes i gang.
Injeksjon av et steroid på et infisert sted skal unngås. Lokal injeksjon av et steroid i et tidligere infisert ledd anbefales vanligvis ikke.
Muskuloskeletal
Kortikosteroider reduserer bendannelse og øker benresorpsjon både gjennom deres effekt på kalsiumregulering (dvs. reduserende absorpsjon og økende utskillelse) og hemming av osteoblastfunksjon. Dette, sammen med en reduksjon i proteinmatrisen i beinet sekundært til en økning i proteinkatabolisme, og redusert kjønnshormonproduksjon, kan føre til hemming av beinvekst hos pediatriske pasienter og utvikling av osteoporose i alle aldre. Spesielle hensyn bør tas til pasienter med økt risiko for osteoporose (dvs. postmenopausale kvinner) før behandling med kortikosteroider startes.
Nevrologisk/psykiatrisk
Selv om kontrollerte kliniske studier har vist at kortikosteroider er effektive for å fremskynde løsningen av akutte forverringer av multippel sklerose, viser de ikke at de påvirker det endelige utfallet eller den naturlige historien til sykdommen. Studiene viser at relativt høye doser kortikosteroider er nødvendig for å demonstrere en signifikant effekt. (Se DOSERING OG ADMINISTRASJON .)
En akutt myopati har blitt observert ved bruk av høye doser kortikosteroider, som oftest forekommer hos pasienter med forstyrrelser i nevromuskulær overføring (f.eks. myasthenia gravis), eller hos pasienter som får samtidig behandling med nevromuskulært blokkerende legemidler (f.eks. pancuronium). Denne akutte myopatien er generalisert, kan involvere okulære og respiratoriske muskler, og kan resultere i quadriparese. Økning av kreatininkinase kan forekomme. Klinisk bedring eller bedring etter seponering av kortikosteroider kan kreve uker til år.
Psykiske forstyrrelser kan oppstå når kortikosteroider brukes, alt fra eufori, søvnløshet, humørsvingninger, personlighetsforandringer og alvorlig depresjon til ærlige psykotiske manifestasjoner. Også eksisterende emosjonell ustabilitet eller psykotiske tendenser kan forverres av kortikosteroider.
Oftalmisk
Intraokulært trykk kan bli forhøyet hos noen individer. Hvis steroidbehandling fortsetter i mer enn 6 uker, bør intraokulært trykk overvåkes.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Det er ikke utført tilstrekkelige studier på dyr for å fastslå om kortikosteroider har et potensial for karsinogenese eller mutagenese.
Steroider kan øke eller redusere motilitet og antall sædceller hos noen pasienter.
Svangerskap
Teratogene effekter
Graviditetskategori C
Kortikosteroider har vist seg å være teratogene hos mange arter når de gis i doser tilsvarende den humane dosen. Dyrestudier der kortikosteroider er gitt til gravide mus, rotter og kaniner har gitt økt forekomst av ganespalte hos avkommet. Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Kortikosteroider bør kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret. Spedbarn født av mødre som har fått kortikosteroider under graviditet bør observeres nøye for tegn på hypoadrenalisme.
Ammende mødre
Systemisk administrerte kortikosteroider vises i morsmelk og kan undertrykke vekst, forstyrre endogen kortikosteroidproduksjon eller forårsake andre uheldige effekter. På grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn fra kortikosteroider, bør det tas en beslutning om å fortsette ammingen, eller seponere medikamentet, tatt i betraktning stoffets betydning for moren.
Pediatrisk bruk
Dette produktet inneholder benzylalkohol som konserveringsmiddel. Benzylalkohol, en komponent i dette produktet, har blitt assosiert med alvorlige bivirkninger og død, spesielt hos pediatriske pasienter. "Gispesyndromet" (karakterisert av sentralnervesystemets depresjon, metabolsk acidose, gispende åndedrett og høye nivåer av benzylalkohol og dets metabolitter funnet i blod og urin) har blitt assosiert med benzylalkoholdoser > 99 mg/kg/dag hos nyfødte og nyfødte med lav fødselsvekt. Ytterligere symptomer kan inkludere gradvis nevrologisk forverring, anfall, intrakraniell blødning, hematologiske abnormiteter, hudsammenbrudd, lever- og nyresvikt, hypotensjon, bradykardi og kardiovaskulær kollaps. Selv om normale terapeutiske doser av dette produktet gir mengder benzylalkohol som er vesentlig lavere enn de som er rapportert i forbindelse med "gipesyndromet", er den minste mengden benzylalkohol som toksisitet kan oppstå ved ikke kjent. Premature spedbarn og spedbarn med lav fødselsvekt, så vel som pasienter som får høye doser, kan ha større sannsynlighet for å utvikle toksisitet. Utøvere som administrerer dette og andre medisiner som inneholder benzylalkohol bør vurdere den kombinerte daglige metabolske belastningen av benzylalkohol fra alle kilder.
Effekten og sikkerheten til kortikosteroider i den pediatriske populasjonen er basert på det veletablerte effektforløpet til kortikosteroider som er likt i pediatriske og voksne populasjoner. Publiserte studier gir bevis på effekt og sikkerhet hos pediatriske pasienter for behandling av nefrotisk syndrom (> 2 år) og aggressive lymfomer og leukemier (> 1 måneds alder). Andre indikasjoner for pediatrisk bruk av kortikosteroider, f.eks. alvorlig astma og tungpustethet, er basert på tilstrekkelige og velkontrollerte studier utført på voksne, med utgangspunkt i at sykdomsforløpet og deres patofysiologi anses å være vesentlig likt i begge populasjoner.
Bivirkningene av kortikosteroider hos pediatriske pasienter er de samme som hos voksne (se BIVIRKNINGER ). I likhet med voksne bør pediatriske pasienter observeres nøye med hyppige målinger av blodtrykk, vekt, høyde, intraokulært trykk og klinisk evaluering for tilstedeværelse av infeksjon, psykososiale forstyrrelser, tromboemboli, magesår, grå stær og osteoporose. Pediatriske pasienter som behandles med kortikosteroider på en hvilken som helst måte, inkludert systemisk administrerte kortikosteroider, kan oppleve en reduksjon i veksthastigheten. Denne negative påvirkningen av kortikosteroider på vekst har blitt observert ved lave systemiske doser og i fravær av laboratoriebevis på HPA-aksesuppresjon (dvs. cosyntropinstimulering og basale kortisolplasmanivåer). Veksthastighet kan derfor være en mer sensitiv indikator på systemisk kortikosteroideksponering hos pediatriske pasienter enn noen vanlig brukte tester av HPA-aksefunksjon. Den lineære veksten til pediatriske pasienter behandlet med kortikosteroider bør overvåkes, og de potensielle veksteffektene av forlenget behandling bør veies opp mot kliniske fordeler og tilgjengeligheten av behandlingsalternativer. For å minimere potensielle veksteffekter av kortikosteroider, bør pediatriske pasienter titreres til laveste effektive dose.
Geriatrisk bruk
Kliniske studier inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Generelt bør dosevalg for en eldre pasient være forsiktig, vanligvis fra den lave enden av doseringsområdet, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling.
OVERDOSE
Behandling av akutt overdosering er støttende og symptomatisk behandling. For kronisk overdosering i møte med alvorlig sykdom som krever kontinuerlig steroidbehandling, kan dosen av kortikosteroidet bare reduseres midlertidig, eller alternativ dagbehandling kan introduseres.
KONTRAINDIKASJONER
Aristocort® Forte er kontraindisert hos pasienter som er overfølsomme overfor noen komponenter i dette produktet.
Intramuskulære kortikosteroidpreparater er kontraindisert for idiopatisk trombocytopenisk purpura.
Aristocort® Forte er kontraindisert for intratekal administrering. Rapporter om alvorlige medisinske hendelser har blitt assosiert med denne administreringsveien.
Arisotcort Forte er kontraindisert for bruk hos premature spedbarn fordi formuleringen inneholder benzylalkohol (se ADVARSLER og FORHOLDSREGLER : Pediatrisk bruk ).
Arisotcort Forte er kontraindisert ved systemiske soppinfeksjoner, bortsett fra når det administreres som en intraartikulær injeksjon for lokaliserte leddtilstander (se ADVARSLER : Infeksjoner : Soppinfeksjoner ).
KLINISK FARMAKOLOGI
Glukokortikoider, naturlig forekommende og syntetiske, er binyrebarksteroider som lett adsorberes fra mage-tarmkanalen.
Naturlig forekommende glukokortikoider (hydrokortison og kortison), som også har saltholdende egenskaper, brukes som erstatningsterapi ved binyrebarkmangeltilstander. Deres syntetiske analoger brukes først og fremst for deres anti-inflammatoriske effekter ved lidelser i mange organsystemer.
Triamcinolondiacetat er i hovedsak blottet for mineralokortikoid aktivitet når det administreres i terapeutiske doser, og forårsaker liten eller ingen natriumretensjon med minimal eller fraværende kaliumutskillelse.
PASIENTINFORMASJON
Pasienter bør advares mot å avbryte bruken av kortikosteroider brått eller uten medisinsk tilsyn, for å informere eventuelle medisinske behandlere om at de tar kortikosteroider og å søke medisinsk råd umiddelbart dersom de skulle utvikle feber eller andre tegn på infeksjon.
Personer som er på kortikosteroider bør advares om å unngå eksponering for vannkopper eller meslinger. Pasienter bør også informeres om at dersom de blir eksponert, bør lege kontaktes uten forsinkelse.
