Clarinex 5mg Desloratadine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
CLARINEX® (desloratadin) Tabletter
BESKRIVELSE
CLARINEX (desloratadin) tabletter er lyseblå, runde, filmdrasjerte tabletter som inneholder 5 mg desloratadin, et antihistamin, som skal administreres oralt. CLARINEX 5mg tabletter inneholder også følgende hjelpestoffer: dibasisk kalsiumfosfatdihydrat USP, mikrokrystallinsk cellulose NF, maisstivelse NF, talkum USP, karnaubavoks NF, hvit voks NF, beleggmateriale bestående av laktosemonohydrat, hypromellose, titandioksyd, polyetylendioksyd, FD&C Blue #2 Aluminium Lake.
CLARINEX mikstur er en klar oransje væske som inneholder 0,5 mg/1 ml desloratadin. Den orale løsningen inneholder følgende inaktive ingredienser: propylenglykol USP, sorbitolløsning USP, sitronsyre (vannfri) USP, natriumcitratdihydrat USP, natriumbenzoat NF, dinatriumedetat USP, renset vann USP. Den inneholder også granulert sukker, naturlig og kunstig smak for tyggegummi, og FDC Yellow #6 fargestoff.
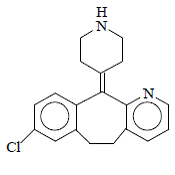
Desloratadin er et hvitt til off-white pulver som er lett løselig i vann, men svært løselig i etanol og propylenglykol. Den har en empirisk formel: C19H19ClN2 og en molekylvekt på 310,8. Det kjemiske navnet er 8-klor-6,11-dihydro-11-(4-piperdinyliden)-5H-benzo[5,6]cyklohepta[1,2-b]pyridin og har følgende struktur:
INDIKASJONER
Sesongbetinget allergisk rhinitt
CLARINEX® er indisert for lindring av nasale og ikke-nasale symptomer på sesongmessig allergisk rhinitt hos pasienter 2 år og eldre.
Flerårig allergisk rhinitt
CLARINEX er indisert for lindring av nasale og ikke-nasale symptomer på flerårig allergisk rhinitt hos pasienter 6 måneder og eldre.
Kronisk idiopatisk urtikaria
CLARINEX 5mg er indisert for symptomatisk lindring av kløe, reduksjon i antall elveblest og størrelse på elveblest, hos pasienter med kronisk idiopatisk urticaria 6 måneder og eldre.
DOSERING OG ADMINISTRASJON
Selv om en oralt desintegrerende tablettformulering av desloratadin kan være tilgjengelig på markedet, markedsføres ikke lenger CLARINEX® RediTabs®-tabletter.
CLARINEX 5mg tabletter, oral oppløsning eller RediTabs tabletter kan tas uten hensyn til måltider. Plasser CLARINEX (desloratadine) RediTabs tabletter på tungen og la dem gå i oppløsning før de svelges. Tablettdesintegrasjon skjer raskt. Administreres med eller uten vann. Ta tabletten umiddelbart etter åpning av blisterpakningen.
Den alderstilpassede dosen av CLARINEX mikstur bør administreres med en kommersielt tilgjengelig målende dråpetreller eller sprøyte som er kalibrert til å gi 2 ml og 2,5 ml (½ teskje).
Voksne og ungdom 12 år og over
Den anbefalte dosen av CLARINEX tabletter eller CLARINEX RediTabs tabletter er én 5 mg tablett én gang daglig. Den anbefalte dosen av CLARINEX mikstur er 2 teskjeer (5 mg i 10 ml) én gang daglig.
Barn i alderen 6 til 11 år
Den anbefalte dosen av CLARINEX mikstur er 1 teskje (2,5 mg i 5 ml) én gang daglig. Den anbefalte dosen av CLARINEX RediTabs tabletter er én 2,5 mg tablett én gang daglig.
Barn fra 12 måneder til 5 år
Den anbefalte dosen av CLARINEX 5 mg mikstur er ½ teskje (1,25 mg i 2,5 ml) én gang daglig.
Barn i alderen 6 til 11 måneder
Den anbefalte dosen av CLARINEX mikstur er 2 ml (1 mg) én gang daglig.
Voksne med nedsatt lever- eller nyrefunksjon
Hos voksne pasienter med nedsatt lever- eller nyrefunksjon anbefales en startdose på én 5 mg tablett annenhver dag basert på farmakokinetiske data. Doseringsanbefaling for barn med nedsatt lever- eller nyrefunksjon kan ikke gis på grunn av mangel på data [se KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
CLARINEX tabletter er lyseblå, filmdrasjerte tabletter preget med "C5" som inneholder 5 mg desloratadin. CLARINEX mikstur er en klar oransje-farget væske som inneholder 0,5 mg desloratadin/1 ml.
Oppbevaring og håndtering
CLARINEX 5mg tabletter: Pregede "C5", lyseblå, filmdrasjerte tabletter som er pakket i plastflasker av høy tetthet av polyetylen på 100 stk. NDC 0085-1264-01).
CLARINEX 5mg oral oppløsning: Klar oransje-farget væske som inneholder 0,5 mg/1 ml desloratadin i en 16-unse gul glassflaske ( NDC 0085-1334-01) og en 4-unse Amber glassflaske ( NDC 0085-1334-02).
Oppbevaring
CLARINEX tabletter: Beskytt Unit-of-Use emballasje og Unit-Dose Hospital Pack mot overdreven fuktighet. Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP kontrollert romtemperatur ]. Varmesensitiv. Unngå eksponering ved eller over 30°C (86°F).
CLARINEX oral oppløsning: Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP kontrollert romtemperatur ]. Beskytt mot lys.
Produsert for: Merck Sharp & Dohme Corp., et datterselskap av MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revidert: mars 2019
BIVIRKNINGER
Følgende bivirkninger er omtalt mer detaljert i andre deler av etiketten:
- . Overfølsomhetsreaksjoner. [Se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
Voksne og ungdom
Allergisk rhinitt
I flerdose placebokontrollerte studier fikk 2834 pasienter i alderen 12 år eller eldre CLARINEX tabletter i doser på 2,5 mg til 20 mg daglig, hvorav 1655 pasienter fikk anbefalt daglig dose på 5 mg. Hos pasienter som fikk 5 mg daglig, var frekvensen av bivirkninger lik mellom CLARINEX 5 mg og placebobehandlede pasienter. Prosentandelen av pasientene som trakk seg for tidlig på grunn av uønskede hendelser var 2,4 % i CLARINEX 5 mg-gruppen og 2,6 % i placebogruppen. Det var ingen alvorlige bivirkninger i disse studiene hos pasienter som fikk desloratadin. Alle bivirkninger som ble rapportert av mer enn eller lik 2 % av pasientene som fikk den anbefalte daglige dosen av CLARINEX 5 mg tabletter (5 mg én gang daglig), og som var mer vanlige med CLARINEX tabletter enn placebo, er oppført i tabell 1.
Frekvensen og omfanget av laboratorie- og elektrokardiografiske abnormiteter var lik hos CLARINEX og placebo-behandlede pasienter.
Det var ingen forskjeller i bivirkninger for undergrupper av pasienter som definert av kjønn, alder eller rase.
Kronisk idiopatisk urtikaria
I multiple-dose, placebokontrollerte studier av kronisk idiopatisk urticaria, fikk 211 pasienter i alderen 12 år eller eldre CLARINEX 5 mg tabletter og 205 fikk placebo. Bivirkninger som ble rapportert av mer enn eller lik 2 % av pasientene som fikk CLARINEX 5 mg tabletter og som var mer vanlige med CLARINEX 5 mg enn placebo, var (hyppighet for henholdsvis CLARINEX 5 mg og placebo): hodepine (14 %, 13 %) , kvalme (5 %, 2 %), tretthet (5 %, 1 %), svimmelhet (4 %, 3 %), faryngitt (3 %, 2 %), dyspepsi (3 %, 1 %) og myalgi (3 %, 1%).
Pediatri
To hundre og førtiseks pediatriske forsøkspersoner i alderen 6 måneder til 11 år fikk CLARINEX mikstur i 15 dager i tre placebokontrollerte kliniske studier. Pediatriske personer i alderen 6 til 11 år fikk 2,5 mg én gang daglig, personer i alderen 1 til 5 år fikk 1,25 mg én gang daglig, og personer i alderen 6 til 11 måneder fikk 1,0 mg én gang daglig.
Hos forsøkspersoner i alderen 6 til 11 år ble ingen individuelle bivirkninger rapportert av 2 prosent eller flere av forsøkspersonene.
Hos forsøkspersoner i alderen 2 til 5 år var bivirkninger rapportert for CLARINEX og placebo hos minst 2 prosent av forsøkspersonene som fikk CLARINEX 5 mg oral oppløsning og med en frekvens som var høyere enn placebo feber (5,5 %, 5,4 %), urinveisinfeksjon (3,6 %). %, 0 %) og varicella (3,6 %, 0 %).
Hos forsøkspersoner i alderen 12 måneder til 23 måneder var bivirkninger rapportert for CLARINEX 5 mg-produktet og placebo hos minst 2 prosent av forsøkspersonene som fikk CLARINEX mikstur og med en frekvens som var høyere enn placebo feber (16,9 %, 12,9 %), diaré ( 15,4 %, 11,3 %), øvre luftveisinfeksjoner (10,8 %, 9,7 %), hoste (10,8 %, 6,5 %), økt appetitt (3,1 %, 1,6 %), emosjonell labilitet (3,1 %, 0 %), neseblødning ( 3,1 %, 0 %), parasittinfeksjon (3,1 %, 0 %), faryngitt (3,1 %, 0 %), makulopapulær utslett (3,1 %, 0 %).
Hos forsøkspersoner i alderen 6 måneder til 11 måneder var bivirkninger rapportert for CLARINEX 5 mg og placebo hos minst 2 prosent av forsøkspersonene som fikk CLARINEX 5 mg oral oppløsning og med en frekvens som var høyere enn placebo, øvre luftveisinfeksjoner (21,2 %, 12,9 %). diaré (19,7 %, 8,1 %), feber (12,1 %, 1,6 %), irritabilitet (12,1 %, 11,3 %), hoste (10,6 %, 9,7 %), somnolens (9,1 %, 8,1 %), bronkitt (6,1 %, 0 %), mellomørebetennelse (6,1 %, 1,6 %), oppkast (6,1 %, 3,2 %), anoreksi (4,5 %, 1,6 %), faryngitt (4,5 %, 1,6 %), søvnløshet (4,5 %, 0 %), rhinoré (4,5 %, 3,2 %), erytem (3,0 %, 1,6 %) og kvalme (3,0 %, 0 %).
Det var ingen klinisk betydningsfulle endringer i noen elektrokardiografiske parametere, inkludert QTc-intervallet. Bare én av de 246 pediatriske forsøkspersonene som fikk CLARINEX 5 mg mikstur i de kliniske studiene, avbrøt behandlingen på grunn av en bivirkning.
Erfaring etter markedsføring
Fordi uønskede hendelser rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering. Følgende spontane bivirkninger er rapportert under markedsføringen av desloratadin:
Hjertesykdommer: takykardi, hjertebank
Sykdommer i luftveiene, thorax og mediastinum: dyspné
Hud- og subkutane vevssykdommer: utslett, kløe
Forstyrrelser i nervesystemet: psykomotorisk hyperaktivitet, bevegelsesforstyrrelser (inkludert dystoni, tics og ekstrapyramidale symptomer), anfall (rapportert hos pasienter med og uten en kjent anfallsforstyrrelse)
Forstyrrelser i immunsystemet: overfølsomhetsreaksjoner (som urticaria, ødem og anafylaksi)
Undersøkelser: forhøyede leverenzymer inkludert bilirubin
Lever og galleveier: hepatitt
Metabolisme og ernæringsforstyrrelser: økt appetitt
NARKOTIKAHANDEL
Hemmere av Cytokrom P450 3A4
kontrollerte kliniske studier resulterte samtidig administrering av desloratadin med ketokonazol, erytromycin eller azitromycin i økte plasmakonsentrasjoner av desloratadin og 3 hydroksydesloratadin, men det var ingen klinisk relevante endringer i sikkerhetsprofilen til desloratadin. [Se KLINISK FARMAKOLOGI ]
Fluoksetin
I kontrollerte kliniske studier resulterte samtidig administrering av desloratadin og fluoksetin, en selektiv serotoninreopptakshemmer (SSRI), i økte plasmakonsentrasjoner av desloratadin og 3-hydroksydesloratadin, men det var ingen klinisk relevante endringer i sikkerhetsprofilen til desloratadin. [Se KLINISK FARMAKOLOGI ]
Cimetidin
I kontrollerte kliniske studier resulterte samtidig administrering av desloratadin og cimetidin, en histamin H2-reseptorantagonist, i økte plasmakonsentrasjoner av desloratadin og 3 hydroksydesloratadin, men det var ingen klinisk relevante endringer i sikkerhetsprofilen til desloratadin. [Se KLINISK FARMAKOLOGI ]
Narkotikamisbruk og avhengighet
Det er ingen informasjon som tyder på at misbruk eller avhengighet forekommer med CLARINEX tabletter.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Overfølsomhetsreaksjoner
Overfølsomhetsreaksjoner inkludert utslett, pruritus, urticaria, ødem, dyspné og anafylaksi er rapportert etter administrering av desloratadin. Hvis en slik reaksjon oppstår, bør behandlingen med CLARIINEX 5 mg avbrytes og alternativ behandling vurderes. [Se BIVIRKNINGER ]
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Informasjon til pasienter
- . Pasienter bør instrueres om å bruke CLARIINEX 5 mg som anvist. . Siden det ikke er mateffekter på biotilgjengeligheten, kan pasienter instrueres om at CLARINEX 5 mg tabletter, oral oppløsning eller RediTabs tabletter kan tas uten hensyn til måltider. . Pasienter bør rådes til ikke å øke dosen eller doseringsfrekvensen da studier ikke har vist økt effektivitet ved høyere doser og somnolens kan forekomme. . Fenylketonurika: CLARINEX RediTabs tabletter inneholder fenylalanin.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenitetsstudier
Det karsinogene potensialet til desloratadin ble vurdert ved å bruke en loratadinstudie på rotter og en desloratadinstudie på mus. I en 2-årig studie på rotter ble loratadin administrert i dietten i doser på opptil 25 mg/kg/dag (estimert desloratadin- og desloratadinmetabolitteksponering var omtrent 30 ganger AUC hos mennesker ved anbefalt daglig oral dose). En signifikant høyere forekomst av hepatocellulære svulster (kombinerte adenomer og karsinomer) ble observert hos menn gitt 10 mg/kg/dag loratadin og hos menn og kvinner gitt 25 mg/kg/dag loratadin. Den estimerte desloratadin- og desloratadinmetabolitteksponeringen hos rotter som fikk 10 mg/kg loratadin var omtrent 7 ganger AUC hos mennesker ved anbefalt daglig oral dose. Den kliniske betydningen av disse funnene ved langtidsbruk av desloratadin er ikke kjent.
en 2-årig diettstudie på mus, viste hanner og hunner gitt opp til henholdsvis 16 mg/kg/dag og 32 mg/kg/dag desloratadin ingen signifikant økning i forekomsten av noen svulster. Den estimerte desloratadin- og desloratadinmetabolitteksponeringen hos mus ved disse dosene var henholdsvis 12 og 27 ganger AUC hos mennesker ved anbefalt daglig oral dose.
Genotoksisitetsstudier
I genotoksisitetsstudier med desloratadin var det ingen tegn på genotoksisk potensial i en omvendt mutasjonsanalyse (Salmonella/E. coli pattedyrmikrosom bakteriell mutagenitetsanalyse) eller i 2 analyser for kromosomavvik (humant perifert blod lymfocytt klastogenisitetsanalyse og mikronucle boneus analyse ).
Nedsatt fruktbarhet
Det var ingen effekt på kvinnelig fertilitet hos rotter ved desloratadindoser på opptil 24 mg/kg/dag (estimert desloratadin- og desloratadinmetabolitteksponering var omtrent 130 ganger AUC hos mennesker ved anbefalt daglig oral dose). En hannspesifikk reduksjon i fertilitet, demonstrert ved reduserte unnfangelsesrater hos kvinner, redusert spermantall og bevegelighet, og histopatologiske testikkelforandringer, oppstod ved en oral desloratadindose på 12 mg/kg hos rotter (estimert desloratadin- og desloratadinmetabolitteksponering var omtrent 45 ganger høyere enn AUC hos mennesker ved anbefalt daglig oral dose). Desloratadin hadde ingen effekt på fertilitet hos rotter ved en oral dose på 3 mg/kg/dag (estimert desloratadin- og desloratadinmetabolitteksponering var ca. 8 ganger AUC hos mennesker ved anbefalt daglig oral dose).
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori C
Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for human respons, bør desloratadin kun brukes under graviditet hvis det er klart nødvendig.
Desloratadin var ikke teratogent hos rotter eller kaniner ved henholdsvis ca. 210 og 230 ganger arealet under konsentrasjon-tid-kurven (AUC) hos mennesker ved anbefalt daglig oral dose. En økning i pre-implantasjonstap og et redusert antall implantasjoner og fostre ble imidlertid notert i en separat studie på hunnrotter med omtrent 120 ganger AUC hos mennesker ved anbefalt daglig oral dose. Redusert kroppsvekt og langsom opprettingsrefleks ble rapportert hos unger ved omtrent 50 ganger eller høyere enn AUC hos mennesker ved anbefalt daglig oral dose. Desloratadin hadde ingen effekt på utviklingen av valpen ved ca. 7 ganger AUC hos mennesker ved anbefalt daglig oral dose. AUC-ene i sammenligning refererte til henholdsvis desloratadineksponeringen hos kaniner og summen av eksponeringen for desloratadin og dets metabolitter hos rotter. [Se Ikke-klinisk toksikologi ]
Ammende mødre
Desloratadin går over i morsmelk; derfor bør det tas en beslutning om å avbryte ammingen eller å avbryte desloratadin, tatt i betraktning fordelene med legemidlet for den ammende moren og den mulige risikoen for barnet.
Pediatrisk bruk
Den anbefalte dosen av CLARINEX 5mg mikstur i den pediatriske populasjonen er basert på kryssstudiesammenligning av plasmakonsentrasjonen av CLARINEX 5mg hos voksne og pediatriske personer. Sikkerheten til CLARINEX mikstur er fastslått hos 246 pediatriske personer i alderen 6 måneder til 11 år i tre placebokontrollerte kliniske studier. Siden forløpet av sesongmessig og flerårig allergisk rhinitt og kronisk idiopatisk urticaria og effekten av CLARINEX er tilstrekkelig like i pediatriske og voksne populasjoner, tillater det ekstrapolering fra effektdata for voksne til pediatriske pasienter. Effektiviteten til CLARINEX 5 mg oral oppløsning i disse aldersgruppene støttes av bevis fra tilstrekkelige og godt kontrollerte studier av CLARINEX 5 mg tabletter hos voksne. Sikkerheten og effektiviteten til CLARINEX 5 mg tabletter eller CLARINEX 5 mg oral oppløsning er ikke vist hos pediatriske pasienter under 6 måneder. [Se KLINISK FARMAKOLOGI ]
CLARINEX RediTabs 2,5 mg tablett har ikke blitt evaluert hos pediatriske pasienter. Bioekvivalens av CLARINEX 5 mg RediTabs Tablet og den tidligere markedsførte RediTabs Tablet ble etablert hos voksne. I forbindelse med de beskrevne dosefinnende studiene i pediatri, støtter de farmakokinetiske dataene for CLARINEX 5 mg RediTabs bruken av 2,5 mg dosestyrke hos pediatriske pasienter i alderen 6 til 11 år.
Geriatrisk bruk
Kliniske studier av desloratadin inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Annen rapportert klinisk erfaring har ikke identifisert forskjeller mellom eldre og yngre pasienter. Generelt bør dosevalg for en eldre pasient være forsiktig, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling. [Se KLINISK FARMAKOLOGI ]
Nedsatt nyrefunksjon
Dosejustering for pasienter med nedsatt nyrefunksjon anbefales [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Dosejustering for pasienter med nedsatt leverfunksjon anbefales [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
OVERDOSE
I tilfelle overdose, vurder standardtiltak for å fjerne uabsorbert legemiddel. Symptomatisk og støttende behandling anbefales. Desloratadin og 3-hydroksydesloratadin elimineres ikke ved hemodialyse.
Informasjon om akutt overdosering er begrenset til erfaring fra bivirkningsrapporter etter markedsføring og fra kliniske studier utført under utviklingen av CLARINEX 5 mg-produktet. I en dosevarierende studie ble det rapportert søvnighet ved doser på 10 mg og 20 mg/dag.
I en annen studie ble det ikke rapportert noen klinisk relevante bivirkninger hos normale mannlige og kvinnelige frivillige som fikk daglige enkeltdoser med CLARINEX 45 mg i 10 dager [se KLINISK FARMAKOLOGI ].

Dødelighet forekom hos rotter ved orale doser på 250 mg/kg eller mer (estimert desloratadin- og desloratadinmetabolitteksponering var omtrent 120 ganger AUC hos mennesker ved anbefalt daglig oral dose). Den orale dødelige dosen hos mus var 353 mg/kg (estimert desloratadineksponering var omtrent 290 ganger den daglige orale dosen for mennesker på mg/m²-basis). Ingen dødsfall forekom ved orale doser opptil 250 mg/kg hos aper (estimert desloratadineksponering var omtrent 810 ganger den daglige orale dosen hos mennesker på mg/m²-basis).
KONTRAINDIKASJONER
CLARINEX 5mg tabletter, RediTabs og oral oppløsning er kontraindisert hos pasienter som er overfølsomme overfor denne medisinen eller noen av ingrediensene i det eller for loratadin [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Desloratadin er en langtidsvirkende trisyklisk histaminantagonist med selektiv H1-reseptor histaminantagonistaktivitet. Reseptorbindingsdata indikerer at ved en konsentrasjon på 2-3 ng/ml (7 nanomolar), viser desloratadin signifikant interaksjon med den humane histamin H1-reseptoren. Desloratadin hemmet frigjøring av histamin fra humane mastceller in vitro. Resultater av en radiomerket vevsfordelingsstudie på rotter og en radioligand H1-reseptorbindingsstudie på marsvin viste at desloratadin ikke lett krysset blod-hjernebarrieren. Den kliniske betydningen av dette funnet er ukjent.
Farmakodynamikk
Wheal Og Flare
Human histamin hud wheal studier etter enkelt og gjentatte 5-mg doser av desloratadin har vist at stoffet viser en antihistaminisk effekt etter 1 time; denne aktiviteten kan vedvare i så lenge som 24 timer. Det var ingen tegn på histaminindusert hudhveltakyfylakse i desloratadin 5-mg-gruppen i løpet av den 28-dagers behandlingsperioden. Den kliniske relevansen av histamin-hvalhudtesting er ukjent.
Effekter på QTc
Enkelte daglige doser på 45 mg ble gitt til normale mannlige og kvinnelige frivillige i 10 dager. Alle EKG-er oppnådd i denne studien ble manuelt lest på en blind måte av en kardiolog. Hos CLARINEX-behandlede personer var det en økning i gjennomsnittlig hjertefrekvens på 9,2 slag/min i forhold til placebo. QT-intervallet ble korrigert for hjertefrekvens (QTc) med både Bazett- og Fridericia-metodene. Ved bruk av QTc (Bazett) var det en gjennomsnittlig økning på 8,1 msek hos CLARIINEX-behandlede personer i forhold til placebo. Ved bruk av QTc (Fridericia) var det en gjennomsnittlig økning på 0,4 msek hos CLARIINEX-behandlede personer i forhold til placebo. Ingen klinisk relevante bivirkninger ble rapportert.
Farmakokinetikk
Absorpsjon
Etter oral administrering av en desloratadin 5 mg tablett én gang daglig i 10 dager til normale friske frivillige, skjedde gjennomsnittlig tid til maksimal plasmakonsentrasjon (Tmax) ca. 3 timer etter dose og gjennomsnittlig steady state maksimal plasmakonsentrasjon (Cmax) og AUC av Det ble observert henholdsvis 4 ng/mL og 56,9 ng.hr/mL. Verken mat eller grapefruktjuice hadde effekt på biotilgjengeligheten (Cmax og AUC) av desloratadin.
Den farmakokinetiske profilen til CLARINEX oral oppløsning ble evaluert i en treveis crossover-studie med 30 voksne frivillige. En enkeltdose på 10 ml CLARINEX mikstur som inneholder 5 mg desloratadin var bioekvivalent med en enkeltdose på 5 mg CLARINEX tablett. Mat hadde ingen effekt på biotilgjengeligheten (AUC og Cmax) til CLARIINEX 5 mg mikstur.
Den farmakokinetiske profilen til CLARINEX 5 mg RediTabs tabletter ble evaluert i en treveis crossover-studie med 24 voksne frivillige. En enkelt CLARINEX RediTabs-tablett inneholdende 5 mg desloratadin var bioekvivalent med en enkelt 5-mg CLARINEX RediTabs-tablett (original formulering) for både desloratadin og 3-hydroksydesloratadin. Mat og vann hadde ingen effekt på biotilgjengeligheten (AUC og Cmax) til CLARINEX RediTabs tabletter.
Fordeling
Desloratadin og 3-hydroksydesloratadin er henholdsvis ca. 82 % til 87 % og 85 % til 89 % bundet til plasmaproteiner. Proteinbinding av desloratadin og 3-hydroksydesloratadin var uendret hos personer med nedsatt nyrefunksjon.
Metabolisme
Desloratadin (en hovedmetabolitt av loratadin) metaboliseres i stor grad til 3-hydroksydesloratadin, en aktiv metabolitt, som deretter glukuronideres. Enzymet(e) som er ansvarlige for dannelsen av 3-hydroksydesloratadin er ikke identifisert. Data fra kliniske studier indikerer at en undergruppe av den generelle befolkningen har nedsatt evne til å danne 3hydroksydesloratadin, og er dårlige omsettere av desloratadin. I farmakokinetiske studier (n=3748) var omtrent 6 % av forsøkspersonene dårlige metabolisatorer av desloratadin (definert som et individ med et AUC-forhold på 3-hydroksydesloratadin til desloratadin på mindre enn 0,1, eller et individ med en desloratadinhalveringstid på over 50 timer ). Disse farmakokinetiske studiene inkluderte personer i alderen 2 til 70 år, inkludert 977 personer i alderen 2 til 5 år, 1575 personer i alderen 6 til 11 år og 1196 personer i alderen 12 til 70 år. Det var ingen forskjell i prevalensen av dårlige metabolisatorer på tvers av aldersgrupper. Hyppigheten av dårlige metabolisatorer var høyere hos svarte (17 %, n=988) sammenlignet med kaukasiere (2 %, n=1 462) og latinamerikanere (2 %, n=1 063). Medianeksponeringen (AUC) for desloratadin hos de dårlige metabolisatorene var omtrent 6 ganger høyere enn hos pasientene som ikke er dårlige metabolisatorer. Personer som metaboliserer dårlig desloratadin kan ikke identifiseres prospektivt og vil bli eksponert for høyere nivåer av desloratadin etter dosering med anbefalt dose desloratadin. I multidose kliniske sikkerhetsstudier, hvor metabolisatorstatus ble identifisert, ble totalt 94 dårlige metabolisatorer og 123 normale metabolisatorer registrert og behandlet med CLARINEX oral oppløsning i 15-35 dager. I disse studiene ble det ikke observert noen generelle forskjeller i sikkerhet mellom dårlige metaboliserere og normale metabolisatorer. Selv om det ikke er sett i disse studiene, kan en økt risiko for eksponeringsrelaterte bivirkninger hos pasienter som er dårlige forbrennere ikke utelukkes.
Eliminering
Gjennomsnittlig plasmaeliminasjonshalveringstid for desloratadin var ca. 27 timer. Cmax og AUC-verdier økte på en doseproporsjonal måte etter orale enkeltdoser mellom 5 og 20 mg. Graden av akkumulering etter 14 dagers dosering var i samsvar med halveringstiden og doseringsfrekvensen. En human massebalansestudie dokumenterte en utvinning på omtrent 87 % av 14C-desloratadin-dosen, som var likt fordelt i urin og avføring som metabolske produkter. Analyse av plasma 3hydroksydesloratadin viste lignende Tmax og halveringstid sammenlignet med desloratadin.
Spesielle populasjoner
Geriatriske fag
Hos eldre personer (≥65 år gamle; n=17) etter administrering av flere doser av CLARINEX 5 mg tabletter, var gjennomsnittlig Cmax og AUC-verdier for desloratadin 20 % høyere enn hos yngre personer (
Pediatriske fag
Hos forsøkspersoner 6 til 11 år ga en enkeltdose på 5 ml CLARINEX mikstur som inneholder 2,5 mg desloratadin, i plasmakonsentrasjoner av desloratadin tilsvarende de som ble oppnådd hos voksne som fikk en enkelt 5 mg CLARINEX tablett. Hos forsøkspersoner 2 til 5 år ga en enkeltdose på 2,5 ml CLARINEX mikstur som inneholder 1,25 mg desloratadin, i plasmakonsentrasjoner av desloratadin tilsvarende de som ble oppnådd hos voksne som fikk en enkelt 5 mg CLARINEX tablett. Imidlertid var Cmax og AUC for metabolitten (3-hydroksydesloratadin) 1,27 og 1,61 ganger høyere for 5 mg oral oppløsning administrert til voksne sammenlignet med Cmax og AUC oppnådd hos barn i alderen 2 til 11 år som fikk 1,25- 2,5 mg CLARINEX mikstur.
En enkeltdose på enten 2,5 ml eller 1,25 ml CLARINEX 5 mg oral oppløsning inneholdende henholdsvis 1,25 mg eller 0,625 mg desloratadin ble administrert til personer i alderen 6 til 11 måneder og 12 til 23 måneder. Resultatene av en populasjonsfarmakokinetisk analyse indikerte at en dose på 1 mg for personer i alderen 6 til 11 måneder og 1,25 mg for personer i alderen 12 til 23 måneder er nødvendig for å oppnå plasmakonsentrasjoner av desloratadin tilsvarende de som oppnås hos voksne administrert en enkelt 5- mg dose CLARINEX mikstur.
CLARINEX 5 mg RediTabs 2,5 mg tablett har ikke blitt evaluert hos pediatriske pasienter. Bioekvivalens av CLARINEX 5mg RediTabs-tabletter og de originale CLARINEX 5mg RediTabs-tablettene ble etablert hos voksne. I forbindelse med de beskrevne dosefinnende studiene i pediatri, støtter de farmakokinetiske dataene for CLARINEX 5 mg RediTabs tabletter bruken av 2,5 mg dosestyrke hos pediatriske pasienter i alderen 6 til 11 år.
Nedsatt nyre
Desloratadins farmakokinetikk etter en enkeltdose på 7,5 mg ble karakterisert hos pasienter med mild (n=7; kreatininclearance 51-69 mL/min/1,73 m²), moderat (n=6; kreatininclearance 34-43 mL/min/1,73 m²) ), og alvorlig (n=6; kreatininclearance 5-29 ml/min/1,73 m²) nedsatt nyrefunksjon eller hemodialyseavhengige (n=6) pasienter. Hos pasienter med lett og moderat nedsatt nyrefunksjon økte median Cmax og AUC med henholdsvis ca. 1,2 og 1,9 ganger i forhold til personer med normal nyrefunksjon. Hos pasienter med alvorlig nedsatt nyrefunksjon eller som var hemodialyseavhengige, økte Cmax- og AUC-verdiene med henholdsvis ca. 1,7 og 2,5 ganger. Minimale endringer i 3-hydroksydesloratadinkonsentrasjoner ble observert. Desloratadin og 3-hydroksydesloratadin ble dårlig fjernet ved hemodialyse. Plasmaproteinbinding av desloratadin og 3-hydroksydesloratadin var uendret av nedsatt nyrefunksjon. Dosejustering for pasienter med nedsatt nyrefunksjon anbefales [se DOSERING OG ADMINISTRASJON ].
Nedsatt lever
Desloratadins farmakokinetikk ble karakterisert etter en enkelt oral dose hos pasienter med mild (n=4), moderat (n=4) og alvorlig (n=4) nedsatt leverfunksjon som definert av Child-Pugh-klassifiseringen av leverfunksjon og 8 personer med normal leverfunksjon. Pasienter med nedsatt leverfunksjon, uavhengig av alvorlighetsgrad, hadde omtrent 2,4 ganger økning i AUC sammenlignet med normale personer. Den tilsynelatende orale clearance av desloratadin hos pasienter med mild, moderat og alvorlig nedsatt leverfunksjon var henholdsvis 37 %, 36 % og 28 % av den hos normale personer. En økning i gjennomsnittlig eliminasjonshalveringstid for desloratadin hos pasienter med nedsatt leverfunksjon ble observert. For 3-hydroksydesloratadin var gjennomsnittlige Cmax- og AUC-verdier for pasienter med nedsatt leverfunksjon ikke statistisk signifikant forskjellig fra personer med normal leverfunksjon. Dosejustering for pasienter med nedsatt leverfunksjon anbefales [se DOSERING OG ADMINISTRASJON ].
Kjønn
Kvinnelige forsøkspersoner behandlet i 14 dager med CLARINEX 5 mg tabletter hadde henholdsvis 10 % og 3 % høyere desloratadin Cmax og AUC-verdier sammenlignet med mannlige forsøkspersoner. Cmax- og AUC-verdiene for 3-hydroksydesloratadin ble også økt med henholdsvis 45 % og 48 % hos kvinner sammenlignet med menn. Det er imidlertid ikke sannsynlig at disse tilsynelatende forskjellene er klinisk relevante, og derfor anbefales ingen dosejustering.
Løp
Etter 14 dagers behandling med CLARINEX-tabletter var Cmax- og AUC-verdiene for desloratadin henholdsvis 18 % og 32 % høyere hos svarte sammenlignet med kaukasiere. For 3-hydroksydesloratadin var det en tilsvarende 10 % reduksjon i Cmax og AUC-verdier hos svarte sammenlignet med kaukasiere. Disse forskjellene er sannsynligvis ikke klinisk relevante og derfor anbefales ingen dosejustering.
Narkotikahandel
to kontrollerte crossover kliniske farmakologiske studier på friske menn (n=12 i hver studie) og kvinnelige (n=12 i hver studie) frivillige, ble desloratadin 7,5 mg (1,5 ganger daglig dose) én gang daglig administrert sammen med erytromycin 500 mg hver 8. timer eller ketokonazol 200 mg hver 12. time i 10 dager. I tre separate kontrollerte, parallellgruppe kliniske farmakologistudier, har desloratadin i den kliniske dosen på 5 mg blitt administrert samtidig med azitromycin 500 mg etterfulgt av 250 mg én gang daglig i 4 dager (n=18) eller med fluoksetin 20 mg én gang daglig i 7 dager etter en 23-dagers forbehandlingsperiode med fluoksetin (n=18) eller med cimetidin 600 mg hver 12. time i 14 dager (n=18) under steady-state forhold til normale friske mannlige og kvinnelige frivillige. Selv om økte plasmakonsentrasjoner (Cmax og AUC0-24 timer) av desloratadin og 3hydroksydesloratadin ble observert (se tabell 2), var det ingen klinisk relevante endringer i sikkerhetsprofilen til desloratadin, vurdert av elektrokardiografiske parametere (inkludert det korrigerte QT-intervallet). kliniske laboratorietester, vitale tegn og uønskede hendelser.
dyretoksikologi og/eller farmakologi studier av reproduktiv toksikologi
Desloratadin var ikke teratogent hos rotter ved doser opp til 48 mg/kg/dag (estimert desloratadin- og desloratadinmetabolitteksponering var omtrent 210 ganger AUC hos mennesker ved anbefalt daglig oral dose) eller hos kaniner ved doser opp til 60 mg/kg/ dag (estimert desloratadineksponering var ca. 230 ganger AUC hos mennesker ved anbefalt daglig oral dose). I en separat studie ble en økning i pre-implantasjonstap og et redusert antall implantasjoner og fostre observert hos hunnrotter ved 24 mg/kg (estimert desloratadin- og desloratadinmetabolitteksponering var omtrent 120 ganger AUC hos mennesker ved anbefalt daglig oralt dose). Redusert kroppsvekt og langsom opprettingsrefleks ble rapportert hos unger ved doser på 9 mg/kg/dag eller høyere (estimert desloratadin- og desloratadinmetabolitteksponering var omtrent 50 ganger eller høyere enn AUC hos mennesker ved anbefalt daglig oral dose). Desloratadin hadde ingen effekt på utviklingen av valpen ved en oral dose på 3 mg/kg/dag (estimert desloratadin- og desloratadinmetabolitteksponering var ca. 7 ganger AUC hos mennesker ved anbefalt daglig oral dose).
Kliniske studier
Sesongbetinget allergisk rhinitt
Den kliniske effekten og sikkerheten til CLARINEX tabletter ble evaluert hos over 2300 pasienter i alderen 12 til 75 år med sesongmessig allergisk rhinitt. Totalt 1838 pasienter mottok 2,5 til 20 mg/dag CLARINEX i 4 dobbeltblinde, randomiserte, placebokontrollerte kliniske studier av 2 til 4 ukers varighet utført i USA. Resultatene av disse studiene viste effektiviteten og sikkerheten til CLARINEX 5 mg ved behandling av voksne og unge pasienter med sesongmessig allergisk rhinitt. I en dosevarierende studie ble CLARINEX 2,5 til 20 mg/dag studert. Doser på 5, 7,5, 10 og 20 mg/dag var bedre enn placebo; og ingen ytterligere fordel ble sett ved doser over 5,0 mg. I samme studie ble det observert en økning i forekomsten av somnolens ved doser på 10 mg/dag og 20 mg/dag (henholdsvis 5,2 % og 7,6 %) sammenlignet med placebo (2,3 %).
to 4-ukers studier av 924 pasienter (i alderen 15 til 75 år) med sesongbetont allergisk rhinitt og samtidig astma, forbedret CLARINEX 5 mg tabletter 5 mg én gang daglig rhinittsymptomer, uten reduksjon i lungefunksjon. Dette understøtter sikkerheten ved administrering av CLARINEX 5 mg tabletter til voksne pasienter med sesongmessig allergisk rhinitt med mild til moderat astma.
CLARINEX tabletter 5 mg én gang daglig reduserte den totale symptomskåren (summen av individuelle skårer av nasale og ikke-nasale symptomer) signifikant hos pasienter med sesongmessig allergisk rhinitt. Se tabell 3.
Det var ingen signifikante forskjeller i effektiviteten til CLARINEX 5 mg tabletter 5 mg på tvers av undergrupper av pasienter definert av kjønn, alder eller rase.
Flerårig allergisk rhinitt
Den kliniske effekten og sikkerheten til CLARINEX tabletter 5 mg ble evaluert hos over 1300 pasienter i alderen 12 til 80 år med flerårig allergisk rhinitt. Totalt 685 pasienter mottok 5 mg/dag av CLARINEX 5 mg i to dobbeltblindede, randomiserte, placebokontrollerte kliniske studier av 4 ukers varighet utført i USA og internasjonalt. I en av disse studiene ble CLARINEX 5 mg tabletter 5 mg én gang daglig vist å redusere den totale symptomskåren signifikant hos pasienter med flerårig allergisk rhinitt (tabell 4).
Kronisk idiopatisk urtikaria
Effekten og sikkerheten til CLARINEX 5 mg tabletter 5 mg én gang daglig ble studert hos 416 pasienter med kronisk idiopatisk urticaria i alderen 12 til 84 år, hvorav 211 fikk CLARINEX. I to dobbeltblindede, placebokontrollerte, randomiserte kliniske studier av seks ukers varighet, ved den forhåndsspesifiserte en-ukes primære evalueringen, reduserte CLARINEX-tabletter signifikant alvorlighetsgraden av kløe sammenlignet med placebo (tabell 5). Sekundære endepunkter ble også evaluert, og i løpet av den første uken av behandlingen reduserte CLARINEX 5 mg tabletter 5 mg de sekundære endepunktene, "Antall elveblest" og "Størrelsen på den største bikuben", sammenlignet med placebo.
Den kliniske sikkerheten til CLARINEX mikstur ble dokumentert i tre, 15-dagers, dobbeltblinde, placebokontrollerte sikkerhetsstudier på pediatriske personer med en dokumentert anamnese med allergisk rhinitt, kronisk idiopatisk urticaria eller personer som var kandidater for antihistaminbehandling. I den første studien ble 2,5 mg CLARINEX oral oppløsning administrert til 60 pediatriske personer i alderen 6 til 11 år. Den andre studien evaluerte 1,25 mg CLARINEX oral oppløsning administrert til 55 pediatriske personer i alderen 2 til 5 år. I den tredje studien ble 1,25 mg CLARINEX 5 mg mikstur administrert til 65 pediatriske personer i alderen 12 til 23 måneder og 1,0 mg CLARINEX mikstur ble administrert til 66 pediatriske personer i alderen 6 til 11 måneder. Resultatene av disse studiene demonstrerte sikkerheten til CLALINEX 5 mg oral oppløsning hos pediatriske personer i alderen 6 måneder til 11 år.
PASIENTINFORMASJON
CLARINEX® (CLA-RI-NEX) (desloratadin) tabletter, RediTabs® og mikstur
Les pasientinformasjonen som følger med CLARINEX® før du begynner å ta den og hver gang du får påfyll. Det kan komme ny informasjon. Dette pakningsvedlegget er et sammendrag av informasjonen til pasienter. Legen din eller apoteket kan gi deg ytterligere informasjon. Dette pakningsvedlegget erstatter ikke å snakke med legen din om din medisinske tilstand eller behandling.
Hva er Clarinex 5mg?
CLARINEX er et reseptbelagt legemiddel som inneholder legemidlet desloratadin (et antihistamin).
CLARINEX brukes til å kontrollere symptomene på:
- . sesongbetont allergisk rhinitt (nysing, tett nese, rennende nese og kløe i nesen) hos personer 2 år og eldre. . flerårig allergisk rhinitt (nysing, tett nese, rennende nese og kløe i nesen) hos personer 6 måneder og eldre. . kronisk idiopatisk urticaria (langvarig kløe) og for å redusere antall og størrelse på elveblest hos personer 6 måneder og eldre.
CLARINEX er ikke for barn yngre enn 6 måneder.
Hvem bør ikke ta Clarinex?
Ikke ta Clarinex 5 mg hvis du:
- . er allergisk mot desloratadin eller noen av ingrediensene i CLARINEX tabletter, CLARINEX RediTabs® eller CLARINEX mikstur. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser. . er allergiske mot loratadin (Alavert, Claritin).
Snakk med legen din før du tar dette legemidlet hvis du har spørsmål om hvorvidt du skal ta dette legemidlet.
Hva bør jeg fortelle legen min før jeg tar CLARIINEX 5mg?
Før du tar Clarinex 5mg, fortell legen din dersom du:
- . har lever- eller nyreproblemer. . har andre medisinske tilstander. . er gravid eller planlegger å bli gravid. Det er ikke kjent om Clarinex 5mg vil skade det ufødte barnet ditt. Snakk med legen din dersom du er gravid eller planlegger å bli gravid. . ammer eller planlegger å amme. CLARINEX 5mg kan gå over i morsmelk. Snakk med legen din om den beste måten å mate babyen din på hvis du tar CLALINEX.
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. CLARINEX 5mg kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan CLARINEX 5mg virker. Fortell legen din spesielt hvis du tar:
- . ketokonazol (Nizoral) . erytromycin (Ery-tab, Eryc, PCE) . azitromycin (Zithromax, Zmax) . antihistaminer . fluoksetin (Prozac) . cimetidin (Tagamet)
Kjenn til medisinene du tar. Hold en liste over medisinene dine og vis den til legen din og apoteket når du får en ny medisin.
Hvordan skal jeg ta Clarinex?
- . Ta CLARINEX 5mg nøyaktig slik legen din sier at du skal ta det. . Ikke endre dosen av CLARINEX 5 mg eller ta oftere enn foreskrevet. . CLARINEX 5mg kan tas med eller uten mat. . Plasser CLARINEX RediTabs Tablet på tungen og la den løse seg opp før du svelger den. CLARINEX 5mg RediTabs kan tas med eller uten vann. Ta din CLARINEX 5mg RediTabs tablett umiddelbart etter at du har åpnet blisterpakningen. . Ta CLARINEX mikstur med en målende dropper eller oral sprøyte som kan måle 2 mL eller 2,5 mL. Spør apoteket om en dråpe eller sprøyte hvis du ikke har en. . Hvis du tar for mye CLARINEX, ring legen din eller få legehjelp umiddelbart.
Hva er de mulige bivirkningene av CLARINEX tabletter?
CLARINEX 5mg kan forårsake alvorlige bivirkninger, inkludert:
- . Allergiske reaksjoner. Slutt å ta CLARINEX 5mg og ring legen din med en gang eller få nødhjelp hvis du har noen av disse symptomene:
- . utslett . kløe . utslett . hevelse av leppene, tungen, ansiktet og halsen . kortpustethet eller problemer med å puste
De vanligste bivirkningene av CLARINEX hos voksne og barn 12 år og eldre med allergisk rhinitt inkluderer:
- . sår hals . tørr i munnen . Muskelsmerte . tretthet . søvnighet . Menstruasjonssmerter
Økt søvnighet eller tretthet kan oppstå hvis du tar mer CLARINEX enn legen har foreskrevet deg.
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle de mulige bivirkningene av CLARINEX. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare Clarinex 5mg?
- . butikk CLARINEX tabletter mellom 59 °F til 86 °F (15 °C til 30 °C). . CLARINEX tabletter er følsomme for varme. Oppbevares ikke over 30°C (86°F). . Beskytte CLARINEX 5mg tabletter fra fuktighet. . butikk CLARINEX 5mg oral oppløsning mellom 59 °F til 86 °F (15 °C til 30 °C). Beskytt CLARINEX 5mg mikstur mot lys.
Beholde CLARINEX tabletter, RediTabs tabletter , og Oral løsning og alle medisiner utilgjengelig for barn.
Generell informasjon om CLARINEX
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i et pasientvedlegg. Ikke bruk CLARINEX 5mg for en tilstand det ikke er foreskrevet for. Ikke gi Clarinex 5 mg til andre mennesker, selv om de har samme tilstand som du har. Det kan skade dem.
Dette pakningsvedlegget for pasientinformasjon oppsummerer den viktigste informasjonen om CLARINEX. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre apoteket eller legen om informasjon om CLARINEX som er skrevet for helsepersonell.
For mer informasjon, gå til www.CLARINEX.com
Hva er ingrediensene i Clarinex 5mg?
Aktiv ingrediens: desloratadin
Pasienter med fenylketonuri: CLARINEX RediTabs tabletter inneholder fenylalanin.
Inaktive ingredienser i CLARINEX 5mg tabletter: dibasisk kalsiumfosfatdihydrat USP, mikrokrystallinsk cellulose NF, maisstivelse NF, talkum USP, karnaubavoks NF, hvit voks NF, beleggmateriale bestående av laktosemonohydrat, hypromellose, titandioksid, polyetylenglykol og FD&C Blue #2 Aluminium Lake.
Inaktive ingredienser i CLARINEX 5mg oral løsning: propylenglykol USP, sorbitolløsning USP, sitronsyre (vannfri) USP, natriumcitratdihydrat USP, natriumbenzoat NF, dinatriumedetat USP, renset vann USP. Den inneholder også granulert sukker, naturlig og kunstig smak for tyggegummi og FDC Yellow #6 fargestoff.
