Rhinocort 100mcg Budesonide Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Rhinocort Aqua og hvordan brukes det?
Rhinocort Aqua (budesonid) nesespray er et steroid som brukes til å behandle nesesymptomer som tetthet, nysing og rennende nese forårsaket av sesongmessige eller helårsallergier. Rhinocort Aqua nesespray brukes også for å forhindre at nesepolypper kommer tilbake etter kirurgisk fjerning.
Hva er bivirkningene av Rhinocort 100mcg Aqua?
Vanlige bivirkninger av Rhinocort Aqua nesespray inkluderer:
- . tørr nese/hals eller irritasjon, . sår hals, . hoste, . nysing, . neseblod, . ubehagelig smak/lukt, . sår eller hvite flekker inne i eller rundt nesen, eller . smerte, hevelse, svie, kløe eller irritasjon rundt nesen.
Fortell legen din dersom du har sjeldne, men alvorlige bivirkninger av Rhinocort Aqua nesespray, inkludert:
- . tap av smak eller lukt, eller . smerter eller sår i nesen.
BESKRIVELSE
Budesonid, den aktive ingrediensen i RHINOCORT AQUA (budesonid) nesespray, er et anti-inflammatorisk syntetisk kortikosteroid.
Det er kjemisk betegnet som (RS)-11-beta, 16-alfa, 17, 21-tetrahydroksypregna-l,4-dien-3,20-dion syklisk 16, 17-acetal med butyraldehyd.
Budesonid leveres som en blanding av to epimerer (22R og 22S).
Den empiriske formelen til budesonid er C25H34O6 og dens molekylvekt er 430,5.
Dens strukturformel er:
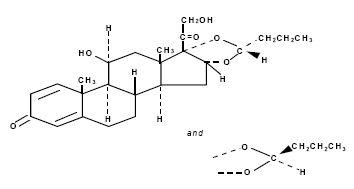
Budesonid er et hvitt til off-white, luktfritt pulver som er praktisk talt uløselig i vann og heptan, lite løselig i etanol og fritt løselig i kloroform.
Dens fordelingskoeffisient mellom oktanol og vann ved pH 5 er 1,6 x 103.
RHINOCORT AQUA (budesonid) nesespray er en uparfymert, oppmålt dose, manuell pumpesprayformulering som inneholder en mikronisert suspensjon av budesonid i et vandig medium. Mikrokrystallinsk cellulose og karboksymetylcellulosenatrium, vannfri dekstrose, polysorbat 80, dinatriumedetat, kaliumsorbat og renset vann er inneholdt i dette mediet; saltsyre tilsettes for å justere pH til et mål på 4,5.
RHINOCORT 100 mcg AQUA nesespray gir 32 mcg budesonid per spray.
Hver flaske RHINOCORT 100 mcg AQUA (budesonid) nesespray 32 mcg inneholder 120 doserte sprayer etter innledende priming.
Før første gangs bruk må beholderen ristes forsiktig og pumpen må primes ved å aktivere åtte ganger. Hvis den brukes daglig, trenger ikke pumpen å fylles på nytt. Hvis den ikke brukes i to påfølgende dager, primer du med én spray eller til en fin spray vises. Hvis den ikke er brukt i mer enn 14 dager, skyll applikatoren og fyll på nytt med to sprayer eller til en fin spray vises.
INDIKASJONER
Behandling av sesongbetont eller flerårig allergisk rhinitt
RHINOCORT AQUA (budesonid) nesespray er indisert for behandling av nesesymptomer på sesongmessig eller flerårig allergisk rhinitt hos voksne og barn fra seks år og eldre.
DOSERING OG ADMINISTRASJON
Den anbefalte startdosen for voksne og barn 6 år og eldre er 64 mcg per dag administrert som én spray per nesebor med RHINOCORT AQUA (budesonid) nesespray 32 mcg én gang daglig. Noen pasienter som ikke oppnår symptomkontroll ved anbefalt startdose kan ha nytte av en økt dose. Maksimal anbefalt dose for voksne (12 år og eldre) er 256 mikrogram per dag administrert som fire sprayer per nesebor én gang daglig av RHINOCORT AQUA (budesonid) nesespray 32 mikrogram og maksimal anbefalt dose for pediatriske pasienter (6 til
Det er alltid ønskelig å titrere en individuell pasient til den laveste effektive dosen for å redusere muligheten for bivirkninger. En bedring i nesesymptomer kan observeres hos pasienter innen 10 timer etter første gangs bruk av RHINOCORT 100mcg AQUA (budesonid) nesespray, men klinisk bedring tar vanligvis 1-2 dager med maksimal nytte på ca. 2 uker. Når maksimal fordel er oppnådd og symptomene har blitt kontrollert, kan reduksjon av dosen være effektiv for å opprettholde kontroll over symptomene på allergisk rhinitt hos pasienter som opprinnelig ble kontrollert med høyere doser.
Før første gangs bruk må beholderen ristes forsiktig og pumpen må primes ved å aktivere åtte ganger. Hvis den brukes daglig, trenger ikke pumpen å fylles på nytt. Hvis den ikke brukes i to påfølgende dager, primer du med én spray eller til en fin spray vises. Hvis den ikke er brukt i mer enn 14 dager, skyll applikatoren og fyll på nytt med to sprayer eller til en fin spray vises. Rist beholderen forsiktig før hver bruk.
Illustrert Pasientens bruksanvisning følger med hver pakke med RHINOCORT AQUA (budesonid) nesespray 32 mcg.
HVORDAN LEVERES
Doseringsformer og styrker
RHINOCORT AQUA (budesonid) Nesespray er en nesespraysuspensjon. Hver spray gir 32 mcg budesonid. Hver flaske RHINOCORT 100 mcg AQUA (budesonid) nesespray 32 mcg inneholder 120 doserte sprayer etter innledende priming.
RHINOCORT 100 mcg AQUA (budesonid) nesespray 32 mcg er tilgjengelig i en ravgul glassflaske med pumpespray med oppmålt dose og grønn beskyttelseshette. RHINOCORT 100 mcg AQUA (budesonid) nesespray 32 mcg ( NDC 0186-1070-08) gir 120 målte sprayer etter første priming; netto fyllvekt 8,6 g. RHINOCORT 100 mcg AQUA (budesonid) nesespray 32 mcg flasken er fylt med et overskudd for å imøtekomme primingsaktiviteten. Flasken bør kasseres etter 120 sprayer etter initial priming, siden mengden budesonid som leveres per spray deretter kan være vesentlig mindre enn den merkede dosen. Hver spray gir 32 mcg budesonid til pasienten.
RHINOCORT 100mcg AQUA (budesonid) nesespray skal oppbevares ved kontrollert romtemperatur, 20 til 25°C (68 til 77°F) med ventilen oppe. Må ikke fryses. Beskytt mot lys. Rist forsiktig før bruk. Ikke spray i øynene.
Distribuert av: AstraZeneca LP, Wilmington, DE 19850. Revidert: 12/2010
BIVIRKNINGER
Systemiske og intranasale kortikosteroider kan føre til følgende:
- . Neseblødning, Candida albicans-infeksjon, perforering av neseseptum og nedsatt sårheling [se ADVARSLER OG FORHOLDSREGLER ]. . Overfølsomhet inkludert anafylaksi [se ADVARSLER OG FORHOLDSREGLER ]. . Immunsuppresjon [se ADVARSLER OG FORHOLDSREGLER ]. . Hyperkortisisme og binyresuppresjon [se ADVARSLER OG FORHOLDSREGLER ]. . Veksteffekt [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ]. . Grønn stær og grå stær [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Forekomsten av vanlige bivirkninger i tabell 1 er basert på to amerikanske og fem ikke-amerikanske kontrollerte kliniske studier hos 1 526 pasienter med sesongmessig eller flerårig rhinitt hos voksne og barn ≥ 6 år behandlet med RHINOCORT AQUA (budesonid) nesespray i doser opptil 400 mcg en gang daglig i 3-6 uker. Denne populasjonen inkluderte 745 kvinner og 781 menn med en gjennomsnittsalder på 31 år (spredning på 6-85 år, 349 var 6
En lignende bivirkningsprofil ble observert i undergruppen av pediatriske pasienter i alderen 6 til 12 år. Disse pasientene er inkludert i tabell 1.
To til tre prosent (2-3%) av pasientene i kliniske studier avbrøt behandlingen på grunn av bivirkninger. Systemiske kortikosteroidbivirkninger ble ikke rapportert under kontrollerte kliniske studier med RHINOCORT AQUA (budesonid) nesespray.
Hvis anbefalte doser overskrides, eller hvis individer er spesielt følsomme, kan symptomer på hyperkortisisme, dvs. Gushings syndrom, og binyrebarksuppresjon oppstå.
Erfaring etter markedsføring
Følgende bivirkninger er rapportert under bruk av RHINOCORT AQUA (budesonid) nesespray etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Forstyrrelser i immunsystemet: umiddelbare og forsinkede overfølsomhetsreaksjoner (inkludert anafylaktisk reaksjon, urticaria, utslett, dermatitt, angioødem og kløe), [se ADVARSLER OG FORHOLDSREGLER og KONTRAINDIKASJONER ]
Øyelidelser: glaukom, økt intraokulært trykk, grå stær [se ADVARSLER OG FORHOLDSREGLER ]
Sykdommer i luftveiene, thorax og mediastinum: perforering av neseseptum, anosmi, svelglidelser (halsirritasjon, halssmerter, hoven hals, brennende hals og kløende hals) og hvesing
Hjertesykdommer: hjertebank
Muskel- og bindevevslidelser: vekstundertrykkelse [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ]
NARKOTIKAHANDEL
Hemmere av Cytokrom P450 3A4
Hovedmetabolismen av kortikosteroider, inkludert budesonid, er via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4). Etter oral administrering av ketokonazol, en sterk hemmer av CYP3A4, økte gjennomsnittlig plasmakonsentrasjon av oralt administrert budesonid. Samtidig administrering av CYP3A4 kan hemme metabolismen av og øke den systemiske eksponeringen for budesonid. Forsiktighet bør utvises når man vurderer samtidig administrering av RHINOCORT AQUA (budesonid) nesespray med langvarig ketokonazol og andre kjente sterke CYP3A4-hemmere (f.eks. ritonavir, atazanavir klaritromycin, indinavir itrakonazol, nefazodon nelfinavir-saquinavir, telithromycin) ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Lokale neseeffekter
Epistaxis
I kliniske studier av 3 til 52 ukers varighet ble neseblødning observert hyppigere hos pasienter behandlet med RHINOCORT 100mcg AQUA (budesonid) nesespray enn de som fikk placebo [se BIVIRKNINGER ].
Candida-infeksjon
kliniske studier med budesonid administrert intranasalt har utvikling av lokaliserte infeksjoner i nese og svelg med Candida albicans forekommet. Når en slik infeksjon utvikler seg, kan det kreve behandling med passende lokal eller systemisk terapi og seponering av behandling med RHINOCORT AQUA (budesonid) nesespray. Pasienter som bruker RHINOCORT AQUA (budesonid) nesespray over flere måneder eller lenger bør undersøkes med jevne mellomrom for tegn på Candida-infeksjon eller andre tegn på bivirkninger på neseslimhinnen.
Perforering av neseseptum
Forekomster av perforering av neseseptum er rapportert etter intranasal påføring av kortikosteroider, inkludert budesonid [se BIVIRKNINGER ].
Nedsatt sårheling
På grunn av den hemmende effekten av kortikosteroider på sårtilheling, bør pasienter som nylig har opplevd neseseptumsår, neseoperasjoner eller nesetraumer ikke bruke et nesekortikosteroid før tilheling har funnet sted.
Overfølsomhetsreaksjoner inkludert anafylaksi
Overfølsomhetsreaksjoner inkludert anafylaktisk reaksjon, urticaria, utslett, dermatitt, angioødem og kløe kan forekomme [se KONTRAINDIKASJONER og BIVIRKNINGER, erfaring etter markedsføring ].
Immunsuppresjon
Pasienter som bruker legemidler som undertrykker immunsystemet er mer utsatt for infeksjoner enn friske personer. Vannkopper og meslinger, for eksempel, kan ha et mer alvorlig eller til og med dødelig forløp hos mottakelige barn eller voksne som bruker kortikosteroider. Hos slike barn eller voksne som ikke har hatt disse sykdommene eller blitt skikkelig immunisert, bør det utvises spesiell forsiktighet for å unngå eksponering. Hvordan dosen, ruten og varigheten av kortikosteroidadministrasjon påvirker risikoen for å utvikle en spredt infeksjon er ikke kjent. Bidraget fra den underliggende sykdommen og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kjent. Ved eksponering for vannkopper kan behandling med varicella zoster immunglobulin (VZIG) eller sammenslått intravenøst immunglobulin (WIG), etter behov, være indisert. Ved eksponering for meslinger kan profylakse med sammenslått intramuskulært immunglobulin (IG) være indisert. (Se de respektive pakningsvedleggene for fullstendig VZIG- og IG-reseptinformasjon ). Hvis det utvikler seg vannkopper, kan behandling med antivirale midler vurderes.
Det kliniske forløpet av vannkopper eller meslingerinfeksjon hos pasienter på intranasale eller inhalerte kortikosteroider er ikke studert. Selv om det ikke finnes data for intranasale kortikosteroider, har en klinisk studie undersøkt immunresponsen til varicellavaksinen hos astmapasienter i alderen 12 måneder til 8 år som ble behandlet med budesonid inhalasjonssuspensjon.
En åpen, ikke-randomisert klinisk studie undersøkte immunresponsen overfor varicellavaksine hos 243 astmapasienter i alderen 12 måneder til 8 år som ble behandlet med budesonid-inhalasjonssuspensjon 0,25 mg til 1 mg daglig (n=151) eller astmabehandling uten kortikosteroider. (n=92) (dvs. beta-agonister, leukotrienreseptorantagonister eller kromoner). Prosentandelen av pasienter som utviklet en seroprotektiv antistofftiter ≥ 5,0 (gpELISA-verdi) som respons på vaksinasjonen var lik hos pasienter behandlet med budesonid-inhalasjonssuspensjon (85 %) sammenlignet med pasienter behandlet med astmabehandling uten kortikosteroider (90 %). Ingen pasienter behandlet med budesonid-inhalasjonssuspensjon utviklet vannkopper som et resultat av vaksinasjon.
Kortikosteroider bør brukes med forsiktighet, hvis i det hele tatt, hos pasienter med aktiv eller stillestående tuberkuloseinfeksjon, ubehandlet sopp-, bakterie-, systemisk virus- eller parasittinfeksjon; eller okulær herpes simplex.
Effekter på hypotalamus-hypofyse-binyrene
Hyperkortisisme og binyresuppresjon: Når intranasale steroider brukes i høyere doser enn anbefalt eller hos mottakelige personer ved anbefalte doser, kan systemiske kortikosteroideffekter som hyperkortisisme og binyresuppresjon oppstå. Hvis slike endringer oppstår, bør doseringen av RHINOCORT 100mcg AQUA (budesonid) nesespray seponeres sakte, i samsvar med aksepterte prosedyrer for seponering av oral kortikosteroidbehandling.
Utskifting av et systemisk kortikosteroid med et lokalt kortikosteroid kan være ledsaget av tegn på binyrebarksvikt, og i tillegg kan noen pasienter oppleve symptomer på kortikosteroidabstinenser, f.eks. ledd- og/eller muskelsmerter, tretthet, svakhet, kvalme, oppkast, hypotensjon, slapphet og depresjon. Pasienter som tidligere er behandlet i lengre perioder med systemiske kortikosteroider, bør avvennes sakte når de overføres til topikale kortikosteroider og nøye overvåkes for akutt binyrebarksvikt som respons på stress. Hos de pasienter som har astma eller andre kliniske tilstander som krever langvarig systemisk kortikosteroidbehandling, kan for rask reduksjon i systemiske kortikosteroider føre til en alvorlig forverring av symptomene deres.
Interaksjoner med sterke cytokrom P450 3A4-hemmere
Forsiktighet bør utvises når man vurderer samtidig administrering av RHINOCORT AQUA nesespray med ketokonazol og andre kjente sterke CYP3A4-hemmere (f.eks. ritonavir, atazanavir, klaritromycin, indinavir, itrakonazol, nefazodon, nelfinavir, sakinavir-effekt relatert til, telitromycin) systemisk eksponering for budesonid kan forekomme [se DRUGSINTERAKSJONER, KLINISK FARMAKOLOGI ].
Effekt på vekst
Intranasale kortikosteroider, inkludert budesonid, kan forårsake en reduksjon i veksthastigheten når de administreres til pediatriske pasienter. Overvåk veksten rutinemessig hos pediatriske pasienter som får langtidsbehandling med RHINOCORT 100mcg AQUA (budesonid) nesespray. For å minimere de systemiske effektene av intranasale kortikosteroider, inkludert RHINOCORT AQUA (budesonid) nesespray, titreres hver pasients dose til den laveste dosen som effektivt kontrollerer hans/hennes symptomer [se Bruk i spesifikke populasjoner, pediatrisk bruk ].
Grønn stær og grå stær
Glaukom, økt intraokulært trykk og grå stær er rapportert etter intranasal påføring av kortikosteroider, inkludert budesonid. Derfor er nøye overvåking nødvendig hos pasienter med endret syn eller med en historie med økt intraokulært trykk, glaukom og/eller grå stær [se BIVIRKNINGER ].
Informasjon om pasientveiledning
[Se FDA-godkjent pasientmerking ]
Pasienter som behandles med RHINOCORT 100mcg AQUA (budesonid) nesespray bør motta følgende informasjon og instruksjoner. Denne informasjonen er ment å hjelpe pasienten med sikker og effektiv bruk av medisinen. Det er ikke en avsløring av alle mulige negative eller tiltenkte effekter. For riktig bruk av RHINOCORT 100mcg AQUA (budesonid) nesespray og for å oppnå maksimal forbedring, bør pasienten lese og følge den medfølgende FDA-godkjente pasientmerkingen.
Lokale neseeffekter
Pasienter bør informeres om at neseblødning og lokaliserte infeksjoner med Candida albicans forekom i nese og svelg hos noen pasienter. Hvis candidiasis utvikler seg, bør den behandles med passende lokal eller systemisk terapi og avbryte behandlingen med RHINOCORT 100mcg AQUA (budesonid) nesespray. I tillegg er nasale kortikosteroider assosiert med perforering av neseseptum og nedsatt sårtilheling. Pasienter som nylig har opplevd nesesår, neseoperasjoner eller nesetraumer bør ikke bruke RHINOCORT AQUA (budesonid) nesespray før tilheling har funnet sted [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhet inkludert anafylaksi
Pasienter bør informeres om at overfølsomhetsreaksjoner inkludert anafylaktisk reaksjon, urticaria, utslett, dermatitt, angioødem og pruritus er rapportert ved bruk av RHINOCORT AQUA (budesonid) nesespray. Avbryt
RHINOCORT AQUA (budesonid) nesespray hvis slike reaksjoner oppstår [se KONTRAINDIKASJONER, ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Immunsuppresjon
Pasienter som er på immunsuppressive doser av kortikosteroider bør advares om å unngå eksponering for vannkopper eller meslinger og, hvis de blir utsatt, konsultere legen sin uten forsinkelse. Pasienter bør informeres om potensiell forverring av eksisterende tuberkulose, sopp, bakteriell, viral eller parasittisk infeksjon eller okulær herpes simplex [se ADVARSLER OG FORHOLDSREGLER ].
Redusert veksthastighet
Pasienter bør informeres om at intranasale kortikosteroider, inkludert budesonid, kan forårsake en reduksjon i veksthastigheten når de gis til pediatriske pasienter. Leger bør følge nøye med på veksten til barn og ungdom som tar kortikosteroider uansett vei [se ADVARSLER OG FORHOLDSREGLER ].
Grønn stær og grå stær
Pasienter bør informeres om at langvarig bruk av intranasale kortikosteroider, inkludert budesonid, kan øke risikoen for enkelte øyeproblemer (grå stær og glaukom). Pasienter bør informere sin helsepersonell dersom en endring i synet observeres mens de bruker RHINOCORT AQUA (budesonid) nesespray [se ADVARSLER OG FORHOLDSREGLER ].
Bruk daglig
Pasienter bør bruke RHINOCORT 100mcg AQUA (budesonid) nesespray med jevne mellomrom siden effektiviteten avhenger av regelmessig bruk. Pasienter kan merke en bedring i nesesymptomer innen 10 timer etter første gangs bruk av RHINOCORT AQUA (budesonid) nesespray. Maksimal fordel kan kanskje ikke oppnås før ca. 2 uker etter behandlingsstart [se DOSERING OG ADMINISTRASJON ].
Pasienter bør ta medisinen som anvist og bør ikke overskride den foreskrevne dosen. Pasienten bør kontakte legen dersom symptomene ikke blir bedre etter to uker, eller hvis tilstanden forverres. Pasienter som opplever tilbakevendende episoder med neseblødning (neseblod) eller ubehag i neseseptum mens de tar denne medisinen, bør kontakte legen sin. For riktig bruk av RHINOCORT AQUA (budesonid) nesespray og for å oppnå maksimal forbedring, bør pasienten lese og følge den medfølgende pasientinformasjonen nøye. Ikke bruk RHINOCORT 100mcg AQUA (budesonid) nesespray etter at merket antall sprayer har blitt brukt (inkluderer ikke priming) eller etter utløpsdatoen som er angitt på kartongen eller flaskeetiketten.
Hvordan du bruker RHINOCORT 100mcg AQUA (budesonid) nesespray
Pasienter bør instrueres nøye om bruken av dette legemiddelet for å sikre optimal doselevering [se PASIENTINFORMASJON ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
en 104-ukers oral studie på Sprague-Dawley-rotter ble det observert en statistisk signifikant økning i forekomsten av gliomer hos hannrottene som fikk en oral dose budesonid 50 mcg/kg/dag (omtrent to ganger den maksimale anbefalte daglige intranasale dosen i voksne og barn på mcg/m2 basis). Ingen tumorgenisitet ble sett hos hannrotter ved orale doser opptil 25 mcg/kg (omtrent lik maksimal anbefalt daglig intranasal dose hos voksne og barn på mcg/m2-basis, og hos hunnrotter ved orale doser opptil 50 mcg/kg ca. to ganger den maksimale anbefalte daglige intranasale dosen hos voksne og barn på mcg/m2-basis). I ytterligere to toårige studier med Fischer- og Sprague-Dawley-hannrotter forårsaket budesonid ingen gliomer ved en oral dose på 50 mcg/kg (omtrent to ganger den maksimale anbefalte daglige intranasale dosen hos voksne og barn på mcg/m2-basis). Hos Sprague-Dawley-hannrottene forårsaket imidlertid budesonid en statistisk signifikant økning i forekomsten av hepatocellulære svulster ved en oral dose på 50 mcg/kg (omtrent to ganger den maksimale anbefalte daglige intranasale dosen hos voksne og barn på en mcg/m2-basis ). De samtidige referansekortikosteroidene (prednisolon og triamcinolonacetonid) i disse to studiene viste lignende funn.
Det var ingen bevis på en kreftfremkallende effekt når budesonid ble administrert oralt i 91 uker til mus i doser på opptil 200 mcg/kg/dag (ca. 3 ganger den maksimale anbefalte daglige intranasale dosen hos voksne og barn på en mcg/m2-basis) .
Budesonid var ikke mutagent eller klastogent i seks forskjellige testsystemer: Ames Salmonella/mikrosomplatetest, musemikronukleustest, muselymfomtest, kromosomavvikstest i humane lymfocytter, kjønnsbundet recessiv letal test i Drosophila melanogaster og DNA-reparasjonsanalyse hos rotte hepatocyttkultur.
Hos rotter hadde budesonid ingen effekt på fertiliteten ved subkutane doser opp til 80 mcg/kg (ca. 3 ganger maksimal anbefalt daglig intranasal dose hos voksne på mcg/m2 basis).
Ved en subkutan dose på 20 mcg/kg/dag (mindre enn den maksimale anbefalte daglige intranasale dosen hos voksne på mcg/m2-basis), reduksjon i mors kroppsvektøkning, prenatal levedyktighet og levedyktighet til ungene ved fødsel og under amming ble observert. Ingen slike effekter ble observert ved 5 mcg/kg (mindre enn den maksimale anbefalte daglige intranasale dosen hos voksne på mcg/m2-basis).
Bruk i spesifikke populasjoner
Svangerskap
Teratogene effekter: Graviditetskategori B. Effekten av budesonid på svangerskapsutfall hos mennesker har blitt evaluert gjennom vurderinger av fødselsregistre knyttet til mors bruk av inhalert budesonid (dvs. PULMICORT TURBUHALER) og intranasalt administrert budesonid (dvs. RHINOCORT 100mcg AQUA) Nabudesonid. Resultatene fra populasjonsbaserte prospektive kohort epidemiologiske studier som gjennomgår data fra tre svenske registre som dekker omtrent 99 % av svangerskapene fra 1995-2001 (dvs. svensk medisinsk fødselsregister; register over medfødte misdannelser; barnkardiologisk register) indikerer ingen økt risiko for total medfødte misdannelser fra bruk av inhalert eller intranasal budesonid tidlig i svangerskapet.
Medfødte misdannelser ble studert hos 2014 spedbarn født av mødre som rapporterte bruk av inhalert budesonid for astma tidlig i svangerskapet (vanligvis 10-12 uker etter siste menstruasjon), perioden da de fleste store organmisdannelser oppstår.1 Frekvensen av generelle medfødte misdannelser var lik sammenlignet med den generelle befolkningsraten (henholdsvis 3,8 % vs. 3,5 %). Antallet spedbarn født med orofaciale spalter og hjertefeil var likt det forventede antallet i den generelle befolkningen (henholdsvis 4 barn vs. 3,3 og 18 barn vs. 17-18). I en oppfølgingsstudie som brakte det totale antallet spedbarn til 2 534, var frekvensen av generelle medfødte misdannelser blant spedbarn hvis mødre ble eksponert for inhalert budesonid tidlig i svangerskapet ikke forskjellig fra frekvensen for alle nyfødte babyer i samme periode (3,6 % ).2 En tredje studie fra det svenske medisinske fødselsregisteret av 2 968 svangerskap eksponert for inhalert budesonid, hvorav de fleste var eksponeringer i første trimester, rapportert svangerskapsalder, fødselsvekt, fødselslengde, dødfødsler og flere fødsler tilsvarende for eksponerte spedbarn sammenlignet med ikke-eksponerte spedbarn.3
Medfødte misdannelser ble studert hos 2 113 spedbarn født av mødre som rapporterte bruk av intranasal budesonid tidlig i svangerskapet. Hyppigheten av generelle medfødte misdannelser var lik sammenlignet med den generelle populasjonsraten (henholdsvis 4,5 % vs. 3,5 %). Justert oddsratio (OR) var 1,06 (95 % KI 0,86-1,31). Antallet spedbarn født med orofaciale spalter var likt det forventede antallet i den generelle befolkningen (henholdsvis 3 barn vs. 3). Antallet spedbarn født med hjertefeil var høyere enn forventet i den generelle befolkningen (henholdsvis 28 barn mot 17,8). Den systemiske eksponeringen fra intranasal budesonid er 6 ganger mindre enn fra inhalert budesonid, og en assosiasjon av hjertedefekter ble ikke sett med høyere eksponeringer av budesonid.
Til tross for dyrefunnene ser det ut til at muligheten for fosterskader er liten dersom stoffet brukes under graviditet. Likevel, fordi studiene på mennesker ikke kan utelukke muligheten for skade, bør RHINOCORT AQUA (budesonid) nesespray kun brukes under graviditet hvis det er klart nødvendig.
Budesonid ga fostertap, reduserte valpevekter og skjelettavvik ved en subkutan dose hos kaniner som var omtrent 2 ganger den maksimale anbefalte daglige intranasale dosen hos voksne på en mcg/m2-basis og ved en subkutan dose hos rotter som var omtrent 16 ganger maksimal anbefalt daglig intranasal dose hos voksne på en mcg/m2 basis. Ingen teratogene eller embryocidale effekter ble observert hos rotter når budesonid ble administrert ved inhalasjon i doser opptil ca. 8 ganger den maksimale anbefalte daglige intranasale dosen hos voksne på en mcg/m2-basis.
Erfaring med orale kortikosteroider siden de ble introdusert i farmakologiske, i motsetning til fysiologiske doser, tyder på at gnagere er mer utsatt for teratogene effekter fra kortikosteroider enn mennesker.
Ikke-ratatogene effekter: Hypoadrenalisme kan forekomme hos spedbarn født av mødre som får kortikosteroider under graviditet. Slike spedbarn bør observeres nøye.
Ammende mødre
Budesonid skilles ut i morsmelk. Data med budesonid levert via tørrpulverinhalator indikerer at den totale daglige orale dosen av budesonid tilgjengelig i morsmelk til spedbarnet er omtrent 0,3 % til 1 % av dosen inhalert av moren [se KLINISK FARMAKOLOGI, farmakokinetikk, spesielle populasjoner, sykepleie ]. Det er ikke utført studier spesifikt hos ammende kvinner med RHINOCORT 100mcg AQUA nesespray; Imidlertid vil dosen av budesonid som er tilgjengelig for spedbarnet i morsmelk, som en prosentandel av mors dose, forventes å være lik. RHINOCORT AQUA (budesonid) nesespray skal kun brukes til ammende kvinner hvis det er klinisk hensiktsmessig. Forskrivere bør veie de kjente fordelene ved amming for mor og spedbarn opp mot den potensielle risikoen for minimal budesonideksponering hos spedbarnet. Doseringshensyn inkluderer resept eller titrering til den laveste klinisk effektive dosen og bruk av RHINOCORT 100mcg AQUA (budesonid) nesespray umiddelbart etter amming for å maksimere tidsintervallet mellom dosering og amming for å minimere spedbarns eksponering.
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter under 6 år er ikke fastslått.
Kontrollerte kliniske studier har vist at intranasale kortikosteroider kan forårsake reduksjon i veksthastighet hos pediatriske pasienter. Denne effekten har blitt observert i fravær av laboratoriebevis på undertrykkelse av hypothalamus-hypofyse-binyrene (HPA)-aksen, noe som tyder på at veksthastigheten er en mer følsom indikator på systemisk kortikosteroideksponering hos pediatriske pasienter enn noen vanlig brukte tester av HPA-aksefunksjonen. . De langsiktige effektene av denne reduksjonen i veksthastighet assosiert med intranasale kortikosteroider, inkludert virkningen på den endelige voksenhøyden, er ukjent. Potensialet for "catch-up" vekst etter seponering av behandling med intranasale kortikosteroider er ikke tilstrekkelig studert.
Veksten av pediatriske pasienter som får intranasale kortikosteroider, inkludert RHINOCORT 100 mcg AQUA (budesonid) nesespray, bør overvåkes rutinemessig (f.eks. via stadiometri). Potensielle veksteffekter av langvarig behandling bør veies opp mot kliniske fordeler og risikoer og fordeler forbundet med alternative behandlinger. For å minimere de systemiske effektene av intranasale kortikosteroider, inkludert RHINOCORT AQUA (budesonid) nesespray, bør hver pasient titreres til den laveste dosen som effektivt kontrollerer symptomene hans/hennes.
En ettårig placebokontrollert klinisk vekststudie ble utført med 229 pediatriske pasienter (alder 4 til 8 år) for å vurdere effekten av RHINOCORT AQUA (budesonid) nesespray (enkeltdose på 64 mikrogram, den anbefalte startdosen) for barn i alderen 6 år og oppover) på veksthastighet. Fra en populasjon på 141 pasienter som fikk RHINOCORT 100 mcg AQUA (budesonid) nesespray og 67 som fikk placebo, var punktestimatet for veksthastighet med RHINOCORT AQUA (budesonid) nesespray 0,25 cm/år lavere enn det som ble notert med placebo (95 % konfidensert intervall) fra 0,59 cm/år lavere enn placebo til 0,08 cm/år høyere enn placebo).
en studie av astmatiske barn 5-12 år, hadde de som ble behandlet med budesonid administrert via en tørrpulverinhalator 200 mcg to ganger daglig (n=311) en 1,1-centimeter (0,433 tommer) reduksjon i vekst sammenlignet med de som fikk placebo ( n=418) ved slutten av ett år; forskjellen mellom disse to behandlingsgruppene økte ikke ytterligere over tre år med tilleggsbehandling. Ved slutten av fire år hadde barn behandlet med budesonid-tørrpulverinhalator og barn behandlet med placebo lignende veksthastigheter. Konklusjoner fra denne studien kan forvirres av ulik bruk av kortikosteroider i behandlingsgruppene og inkludering av data fra pasienter som oppnår pubertet i løpet av studien.
De systemiske effektene av inhalerte kortikosteroider er relatert til systemisk eksponering for slike legemidler. Farmakokinetiske studier har vist at hos både voksne og barn forventes systemisk eksponering for budesonid ved de høyeste anbefalte dosene av RHINOCORT AQUA (budesonid) nesespray ikke å være større enn eksponering ved de laveste anbefalte dosene via en tørrpulverinhalator. Derfor forventes de systemiske effektene (HPA-aksen og vekst) av budesonid levert fra RHINOCORT AQUA (budesonid) nesespray ikke å være større enn det som er rapportert for inhalert budesonid når det administreres via tørrpulverinhalatoren.
Potensialet for at RHINOCORT 100 mcg AQUA (budesonid) nesespray kan forårsake veksthemming hos følsomme pasienter eller når det gis i doser over 64 mcg daglig, kan ikke utelukkes. Det anbefalte doseringsområdet for pasienter i alderen 6 til 11 år er 64 til 128 mikrogram per dag [se DOSERING OG ADMINISTRASJON ].
Geriatrisk bruk
Av de 2 461 pasientene i kliniske studier av RHINOCORT 100 mcg AQUA (budesonid) nesespray, var 5 % 60 år og eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre forsøkspersoner, bortsett fra en bivirkningsrapporteringsfrekvens av neseblødning som økte med alderen. Videre har ikke annen rapportert klinisk erfaring identifisert noen andre forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos noen eldre individer kan ikke utelukkes.
Nedsatt leverfunksjon
Formelle farmakokinetiske studier med RHINOCORT 100mcg AQUA (budesonid) nesespray er ikke utført hos pasienter med nedsatt leverfunksjon. Siden budesonid hovedsakelig elimineres av levermetabolisme, kan imidlertid nedsatt leverfunksjon føre til akkumulering av budesonid i plasma. Pasienter med leversykdom bør derfor overvåkes nøye.
OVERDOSE
Akutt overdosering med denne doseringsformen er usannsynlig siden en 120 sprayflaske med RHINOCORT 100 mcg AQUA (budesonid) nesespray 32 mcg bare inneholder ca. 5,4 mg budesonid. Kronisk overdosering kan føre til tegn/symptomer på hyperkortisisme [se ADVARSLER OG FORHOLDSREGLER ].
KONTRAINDIKASJONER
RHINOCORT AQUA (budesonid) nesespray er kontraindisert hos pasienter med overfølsomhet overfor noen av ingrediensene [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Budesonid er et anti-inflammatorisk kortikosteroid som viser kraftig glukokortikoid aktivitet og svak mineralokortikoid aktivitet. I standard in vitro- og dyremodeller har budesonid omtrent 200 ganger høyere affinitet for glukokortikoidreseptoren og en 1000 ganger høyere topisk antiinflammatorisk styrke enn kortisol (rottekrotonolje øreødemanalyse). Som et mål på systemisk aktivitet er budesonid 40 ganger kraftigere enn kortisol når det administreres subkutant og 25 ganger kraftigere når det administreres oralt i rottethymus-involusjonsanalysen. Den kliniske betydningen av dette er ukjent.
Aktiviteten til RHINOCORT 100mcg AQUA nesespray skyldes hovedstoffet budesonid. I glukokortikoidreseptoraffinitetsstudier var 22R-formen to ganger så aktiv som 22S-epimeren. In vitro-studier indikerte at de to formene for budesonid ikke konverterer hverandre.
Den nøyaktige mekanismen for kortikosteroidvirkninger på betennelse ved sesongmessig og flerårig allergisk rhinitt er ikke godt kjent. Betennelse er en viktig komponent i patogenesen av sesongmessig og flerårig allergisk rhinitt. Kortikosteroider har et bredt spekter av hemmende aktiviteter mot flere celletyper (f.eks. mastceller, eosinofiler, nøytrofiler, makrofager og lymfocytter) og mediatorer (f.eks. histamin, eikosanoider, leukotriener og cytokiner) involvert i allergisk og ikke-allergisk-mediert betennelse. Disse antiinflammatoriske virkningene til kortikosteroider kan bidra til deres effektivitet ved sesongmessig og flerårig allergisk rhinitt.
Farmakodynamikk
En 3-ukers klinisk studie i sesongmessig rhinitt, som sammenlignet RHINOCORT 100mcg neseinhalator, oralt inntatt budesonid og placebo hos 98 pasienter med allergisk rhinitt på grunn av bjørkepollen, viste at den terapeutiske effekten av RHINOCORT neseinhalator kan tilskrives topiske effekter budesonid.

HPA-akseeffekter
Effekten av RHINOCORT 100mcg AQUA (budesonid) nesespray på binyrefunksjonen har blitt evaluert i flere kliniske studier. I en fire ukers klinisk studie viste 61 voksne pasienter som fikk 256 mikrogram daglig med RHINOCORT AQUA (budesonid) nesespray ingen signifikante forskjeller fra pasienter som fikk placebo i plasmakortisolnivåer målt før og 60 minutter etter 0,25 mg intramuskulært cosyntropin. Det var ingen konsistente forskjeller i 24-timers kortisolmålinger i urin hos pasienter som fikk opptil 400 mcg daglig. Lignende resultater ble sett i en studie av 150 barn og ungdom i alderen 6 til 17 med flerårig rhinitt som ble behandlet med 256 mcg daglig i opptil 12 måneder.
Etter behandling med anbefalt maksimal daglig dose av RHINOCORT AQUA (budesonid) nesespray (256 mcg) i syv dager, var det en liten, men statistisk signifikant reduksjon i arealet under plasmakortisol-tidskurven over 24 timer (AUC0-24 timer) ) hos friske voksne frivillige.
En doserelatert undertrykkelse av 24-timers kortisolutskillelse i urin ble observert etter administrering av RHINOCORT AQUA (budesonid) nesespraydoser fra 100-800 mikrogram daglig i opptil fire dager hos 78 friske voksne frivillige. Den kliniske relevansen av disse resultatene er ukjent.
Farmakokinetikk
Absorpsjon
Etter intranasal administrering av en enkeltdose RHINOCORT AQUA (budesonid) nesespray (128 mcg), inntreffer den gjennomsnittlige maksimale plasmakonsentrasjonen på ca. 0,3 nmol/L ca. 0,5 timer etter dosering. Sammenlignet med en intravenøs dose når ca. 34 % av den leverte intranasale dosen den systemiske sirkulasjonen, hvorav det meste absorberes gjennom neseslimhinnen. Mens budesonid absorberes godt fra mage-tarmkanalen, er den orale biotilgjengeligheten av budesonid lav (~10 %), primært på grunn av omfattende førstegangsmetabolisme i leveren.
Fordeling
Distribusjonsvolumet av budesonid var ca. 2-3 l/kg. Det var 85-90 % bundet til plasmaproteiner. Distribusjonsvolumet for 22R-epimeren er nesten det dobbelte av 22S-epimeren. Proteinbindingen var konstant over et konsentrasjonsområde (1-100 nmol/L) oppnådd med, og overskredet, anbefalte doser av RHINOCORT 100mcg AQUA nesespray. Budesonid viste liten eller ingen binding til kortikosteroidbindende globulin. Budesonid kom raskt i likevekt med røde blodceller på en konsentrasjonsuavhengig måte med et blod/plasma-forhold på ca. 0,8.
Metabolisme
In vitro-studier med humane leverhomogenater har vist at budesonid metaboliseres raskt og omfattende. To hovedmetabolitter dannet via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4)-katalysert biotransformasjon har blitt isolert og identifisert som 16a-hydroksyprednisolon og 6p-hydroksybudesonid. Kortikosteroidaktiviteten til hver av disse to metabolittene er mindre enn 1 % av den til moderforbindelsen. Ingen kvalitativ forskjell mellom in vitro og in vivo metabolske mønstre er påvist. Ubetydelig metabolsk inaktivering ble observert i humane lunge- og serumpreparater.
Utskillelse/Eliminering
22R-formen av budesonid ble fortrinnsvis eliminert av leveren med systemisk clearance på 1,4 l/min vs. 1,0 l/min for 22S-formen. Den terminale halveringstiden, 2 til 3 timer, var den samme for begge epimerene og var uavhengig av dose. Budesonid ble skilt ut i urin og avføring i form av metabolitter. Omtrent 2/3 av en intranasal radiomerket dose ble gjenvunnet i urinen og resten i avføringen. Det ble ikke påvist uforandret budesonid i urinen.
Spesifikke populasjoner
Geriatrisk
Farmakokinetikken til RHINOCORT 100mcg AQUA (budesonid) nesespray hos geriatriske pasienter har ikke blitt spesifikt studert.
Pediatrisk
Etter administrering av RHINOCORT 100 mcg AQUA (budesonid) nesespray, var tiden for å nå maksimale legemiddelkonsentrasjoner og plasmahalveringstid lik hos barn og voksne. Barn hadde plasmakonsentrasjoner omtrent det dobbelte av det som ble observert hos voksne, hovedsakelig på grunn av forskjeller i vekt mellom barn og voksne.
Kjønn
Det er ikke utført noen spesifikke farmakokinetiske studier for å evaluere effekten av kjønn på budesonids farmakokinetikk. Etter administrering av 400 mcg RHINOCORT 100 mcg AQUA (budesonid) nesespray til 7 mannlige og 8 kvinnelige frivillige i en farmakokinetisk studie, ble det imidlertid ikke funnet store kjønnsforskjeller i de farmakokinetiske parameterne.
Løp
Det er ikke utført noen spesifikke studier for å evaluere effekten av rase på budesonids farmakokinetikk.
Ammende mødre
Disponeringen av budesonid ved oral inhalasjon fra en tørrpulverinhalator i doser på 200 eller 400 mcg to ganger daglig i minst 3 måneder ble studert hos åtte ammende kvinner med astma fra 1 til 6 måneder etter fødselen. Systemisk eksponering for budesonid hos disse kvinnene ser ut til å være sammenlignbar med den hos ikke-ammende kvinner med astma fra andre studier. Morsmelk oppnådd over åtte timer etter dosering avslørte at den maksimale konsentrasjonen av budesonid for dosene på 400 og 800 mikrogram var henholdsvis 0,39 og 0,78 nmol/L, og inntraff innen 45 minutter etter dosering. Den estimerte orale daglige dosen av budesonid fra morsmelk til spedbarnet var omtrent 0,007 og 0,014 mikrogram/kg/dag for de to doseregimene som ble brukt i denne studien, som representerer omtrent 0,3 % til 1 % av dosen inhalert av moren. Budesonidnivåer i plasmaprøver fra fem spedbarn ca. 90 minutter etter amming (og ca. 140 minutter etter legemiddeladministrering til moren) var under kvantifiserbare nivåer ( Bruk i spesifikke populasjoner, ammende mødre ].
Nedsatt nyre eller lever
Farmakokinetikken til budesonid er ikke undersøkt hos pasienter med nedsatt nyrefunksjon. Redusert leverfunksjon kan påvirke eliminasjonen av kortikosteroider. Farmakokinetikken til budesonid ble påvirket av kompromittert leverfunksjon, noe som fremgår av en doblet systemisk tilgjengelighet etter oralt inntak. Relevansen av dette funnet for intranasalt administrert budesonid er ikke fastslått.
Legemiddel-legemiddelinteraksjoner
Hemmere av cytokrom P450-enzymer
Ketokonazol: Ketokonazol, en sterk hemmer av cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4), det viktigste metabolske enzymet for kortikosteroider, økte plasmanivåer av oralt inntatt budesonid [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ].
Cimetidin: Ved anbefalte doser hadde cimetidin, en uspesifikk hemmer av CYP-enzymer, en liten, men klinisk ubetydelig effekt på farmakokinetikken til oral budesonid.
dyretoksikologi og/eller farmakologi
Budesonid var teratogent og embryocidalt hos kaniner og rotter. Budesonid ga fostertap, reduserte valpevekter og skjelettavvik ved en subkutan dose på 25 mcg/kg hos kaniner (ca. 2 ganger den maksimale anbefalte daglige intranasale dosen hos voksne på mcg/m2-basis) og ved en subkutan dose på 500 mcg /kg hos rotter (omtrent 16 ganger maksimal anbefalt daglig intranasal dose hos voksne på en mcg/m2-basis). Ingen teratogene eller embryocidale effekter ble observert hos rotter når budesonid ble administrert ved inhalasjonsdoser på opptil 250 mcg/kg (ca. 8 ganger den maksimale anbefalte daglige intranasale dosen hos voksne på en mcg/m2-basis).
Kliniske studier
Den terapeutiske effekten av RHINOCORT AQUA (budesonid) nesespray har blitt evaluert i placebokontrollerte kliniske studier av sesongmessig og flerårig allergisk rhinitt av 3-6 ukers varighet.
Antall pasienter behandlet med budesonid i disse studiene var 90 menn og 51 kvinner i alderen 6-12 år og 691 menn og 694 kvinner 12 år og eldre. Pasientene var hovedsakelig kaukasiske.
Samlet sett viste resultatene fra disse kliniske studiene at RHINOCORT AQUA (budesonid) nesespray administrert én gang daglig gir statistisk signifikant reduksjon i alvorlighetsgraden av nesesymptomer på sesongmessig og flerårig allergisk rhinitt inkludert rennende nese, nysing og tett nese.
En forbedring av nesesymptomer kan observeres hos pasienter innen 10 timer etter første gangs bruk av RHINOCORT 100 mcg AQUA (budesonid) nesespray. Denne tiden til debut støttes av en miljøeksponeringsenhetsstudie hos pasienter med sesongmessig allergisk rhinitt som viste at RHINOCORT 100mcg AQUA (budesonid) nesespray førte til en statistisk signifikant forbedring av nesesymptomer sammenlignet med placebo med 10 timer. Ytterligere støtte kommer fra en klinisk studie av pasienter med perennial allergisk rhinitt som viste en statistisk signifikant forbedring av nesesymptomer for både RHINOCORT AQUA (budesonid) nesespray og for den aktive komparatoren (mometasonfuroat) sammenlignet med placebo med 8 timer. Begynnelsen ble også vurdert i denne studien med maksimal nasal inspiratorisk strømningshastighet, og dette endepunktet viste ikke effekt for noen av de aktive behandlingene. Selv om statistisk signifikante forbedringer i nesesymptomer sammenlignet med placebo ble notert i løpet av 8-10 timer i disse studiene, skjer omtrent halvparten til to tredjedeler av den endelige kliniske forbedringen med RHINOCORT 100mcg AQUA (budesonid) nesespray i løpet av de første 1-2 dagene, og maksimal fordel kan ikke oppnås før ca. 2 uker etter behandlingsstart.
REFERANSER
Kallen B, Rydhstroem H, Aberg A. Medfødte misdannelser etter bruk av inhalert budesonid tidlig i svangerskapet. Obstet Gynecol 1999; 93:392-395.
2 Ericson A, Kallen B. Bruk av legemidler under graviditet: unik svensk registreringsmetode som kan forbedres. Sveriges Läkemedelsverk 1999; 1:8-11.
3 Norjavaara E, Gerhardsson de Verdier M. Normale graviditetsutfall i en populasjonsbasert studie inkludert 2968 gravide kvinner eksponert for budesonid. J Allergy Clin Immunol 2003;! 11:736-742.
PASIENTINFORMASJON
RHINOCORT 100mcg AQUA (budesonid) ® (RINE-o-cort AH-kwa) (budesonid) Nesespray
Kun til bruk i nesen
Les pasientinformasjonen som følger med RHINOCORT 100mcg AQUA (budesonid) nesespray før du begynner å bruke den og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller behandling. Hvis du har spørsmål om RHINOCORT AQUA (budesonid) nesespray, spør helsepersonell eller apotek.
Hva er RHINOCORT 100mcg AQUA (budesonid) nesespray?
RHINOCORT AQUA (budesonid) Nesespray er en reseptbelagt medisin som brukes til å behandle sesongmessige og helårsallergisymptomer hos voksne og barn 6 år og eldre.
RHINOCORT AQUA nesespray inneholder budesonid, som er et menneskeskapt (syntetisk) kortikosteroid. Intranasale kortikosteroider er naturlige hormoner som finnes i kroppen som reduserer hevelse i neseslimhinnen. Når du sprayer RHINOCORT 100mcg AQUA (budesonid) nesespray inn i nesen, bidrar det til å redusere nesesymptomene på allergisk rhinitt (betennelse i neseslimhinnen), som tett nese, rennende nese, kløe og nysing.
Sikkerheten og effektiviteten til RHINOCORT 100mcg AQUA (budesonid) nesespray er ikke vist hos barn under 6 år.
Hvem bør ikke bruke RHINOCORT AQUA (budesonid) nesespray?
Ikke bruk RHINOCORT 100mcg AQUA (budesonid) nesespray:
- . dersom du er allergisk mot budesonid eller noen av innholdsstoffene i RHINOCORT AQUA nesespray. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingrediensene i RHINOCORT AQUA (budesonid) nesespray.
Hva bør jeg fortelle helsepersonell før jeg bruker RHINOCORT 100mcg AQUA (budesonid) nesespray?
Før du bruker RHINOCORT AQUA (budesonid) nesespray, fortell helsepersonell eller apotek dersom du:
- . har nylig vært rundt noen med vannkopper eller meslinger . har leverproblemer . har ubehandlede infeksjoner . noen gang har hatt en infeksjon kalt tuberkulose . har en øyeinfeksjon . nylig har hatt en operasjon eller en skade på nesen . har andre medisinske tilstander . er gravid eller planlegger å bli gravid. Det er ikke kjent om RHINOCORT 100mcg AQUA (budesonid) nesespray vil skade det ufødte barnet. Snakk med legen din dersom du er gravid eller planlegger å bli gravid. . ammer eller planlegger å amme. RHINOCORT 100mcg AQUA (budesonid) nesespray kan gå over i morsmelk. Snakk med legen din om den beste måten å mate babyen din på hvis du tar RHINOCORT AQUA (budesonid) nesespray.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
RHINOCORT AQUA (budesonid) nesespray kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan RHINOCORT 100mcg AQUA (budesonid) nesespray virker.
Kjenn til medisinene du tar. Ha en liste over medisinene dine med deg for å vise helsepersonell og apotek når du får en ny medisin.
Hvordan skal jeg bruke RHINOCORT 100mcg AQUA (budesonid) nesespray?
- . RHINOCORT 100mcg AQUA (budesonid) nesespray er kun til bruk i nesen. Ikke spray det i øynene eller munnen. . Bruk RHINOCORT AQUA (budesonid) nesespray nøyaktig slik helsepersonell ber deg bruke den. . Det er svært viktig at du bruker RHINOCORT AQUA (budesonid) nesespray regelmessig. Ikke slutt å bruke RHINOCORT AQUA (budesonid) nesespray eller endre dosen uten å snakke med helsepersonell, selv om du føler deg bedre. . Snakk med helsepersonell hvis symptomene dine ikke blir bedre etter å ha tatt RHINOCORT AQUA (budesonid) nesespray i 2 uker, eller hvis symptomene dine blir verre. . En voksen bør hjelpe et lite barn med å bruke denne medisinen. . Se pasientens bruksanvisning på slutten av dette pakningsvedlegget for fullstendig informasjon om hvordan du bruker RHINOCORT AQUA (budesonid) nesespray.
Hva er de mulige bivirkningene av RHINOCORT AQUA (budesonid) nesespray?
RHINOCORT 100mcg AQUA (budesonid) nesespray kan forårsake alvorlige bivirkninger, inkludert:
- . hull i brusken inne i nesen (perforering av neseseptum). Fortell helsepersonell hvis du har en pipelyd fra nesen når du puster. . langsom sårtilheling. Du bør ikke bruke RHINOCORT 100mcg AQUA (budesonid) nesespray før nesen har grodd hvis du har et sår i nesen, hvis du har operert nesen eller hvis nesen har blitt skadet. . soppinfeksjon i nesen. . allergiske reaksjoner. Fortell helsepersonell eller få medisinsk hjelp med en gang hvis du har:
- . hudutslett, rødhet eller hevelse . alvorlig kløe . hevelse i ansikt, munn og tunge
Ring helsepersonell eller få medisinsk hjelp med en gang hvis du har symptomer på noen av de alvorlige bivirkningene som er oppført ovenfor.
De vanligste bivirkningene av RHINOCORT 100mcg AQUA (budesonid) nesespray inkluderer:
- . neseblod . sår hals . pustevansker som tungpustethet eller stramming av brystet . hoste . irritasjon av nesen din
Fortell helsepersonell dersom du har en bivirkning som plager deg eller ikke forsvinner.
Dette er ikke alle de mulige bivirkningene av RHINOCORT 100mcg AQUA (budesonid) nesespray. For mer informasjon, spør helsepersonell eller apotek.
Ring helsepersonell for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
Du kan rapportere bivirkninger til AstraZeneca på 1-800-236-9933.
Hva bør jeg vite om allergisk rhinitt?
"Rhinitt" betyr betennelse i neseslimhinnen. Det kalles noen ganger "høysnue". Allergisk rhinitt kan være forårsaket av allergi mot pollen, dander fra dyr, husstøvmidd og muggsporer. Hvis du har allergisk rhinitt, blir nesen tett, rennende og kløende. Du kan også nyse mye. Du kan ha røde, kløende, rennende øyne; kløende hals; eller blokkerte, kløende ører.
RHINOCORT AQUA (budesonid) Nesespray hjelper til med å lindre nesesymptomene.
Hvis du også har kløende, rennende øyne, bør du fortelle det til helsepersonell. Han eller hun kan foreskrive ytterligere medisiner for å behandle disse symptomene.
Hvordan bør jeg oppbevare RHINOCORT AQUA (budesonid) nesespray?
- . Oppbevar RHINOCORT AQUA (budesonid) nesespray ved 68 °F til 77 °F (20 °C til 25 °C). . Ikke frys RHINOCORT AQUA (budesonid) nesespray. . Beskytt RHINOCORT 100mcg AQUA (budesonid) nesespray mot lys. . Ikke bruk RHINOCORT 100mcg AQUA (budesonid) nesespray etter at merket antall sprayer har blitt brukt (inkluderer ikke priming) eller etter utløpsdatoen som er angitt på kartongen eller flaskeetiketten. . Behold den grønne beskyttelseshetten på RHINOCORT AQUA (budesonid) nesespray når den ikke er i bruk. (Vær snill å se Før bruk på baksiden ). . Oppbevar RHINOCORT 100mcg AQUA (budesonid) nesespray og alle medisiner utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av RHINOCORT AQUA (budesonid) nesespray:
Ikke bruk RHINOCORT 100mcg AQUA (budesonid) nesespray for en tilstand som den ikke er foreskrevet for. Ikke gi RHINOCORT AQUA (budesonid) nesespray til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Dette Pasientinformasjonsheftet oppsummerer den viktigste informasjonen om RHINOCORT 100mcg AQUA (budesonid) nesespray. Hvis du vil ha mer informasjon, snakk med helsepersonell. Du kan spørre apoteket eller helsepersonell om informasjon om RHINOCORT 100mcg AQUA (budesonid) nesespray som er skrevet for helsepersonell.
For mer informasjon, gå til www.astrazeneca-us.com eller ring AstraZeneca på 1-800-236-9933.
Hva er ingrediensene i RHINOCORT AQUA (budesonid) nesespray?
Aktiv ingrediens: budesonid
Inaktive ingredienser: Mikrokrystallinsk cellulose og karboksymetylcellulosenatrium, vannfri dekstrose, polysorbat 80, dinatriumedetat, kaliumsorbat og renset vann, og saltsyre.
Pasientens bruksanvisning
Kun til bruk i nesen. Ikke spray i øynene eller munnen.
Les pasientens bruksanvisning nøye før du begynner å bruke RHINOCORT 100mcg AQUA (budesonid) nesespray. Hvis du har spørsmål, spør helsepersonell
Figur A 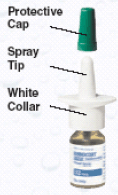
Slik fyller du RHINOCORT AQUA (budesonid) nesespray
Før du bruker RHINOCORT AQUA (budesonid) nesespray, må flasken primes. For å prime RHINOCORT 100mcg AQUA (budesonid) nesespray:
1. Trekk for å fjerne den grønne beskyttelseshetten fra nesesprayenheten.
2. Rist flasken forsiktig i noen sekunder før hver bruk.
3. Hold flasken godt, som vist i figur B, med pekefingeren og langfingeren på hver side av spraytuppen og tommelen under flasken.
Figur B 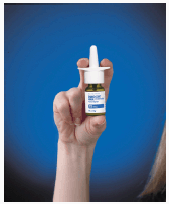
4. Aktiver pumpen ved å trykke raskt og fast på den hvite kragen mens du holder i bunnen av flasken med tommelen.
5. Før første gangs bruk av RHINOCORT AQUA (budesonid) nesespray, rist flasken forsiktig. Pumpen skal primes ved å trykke den hvite kragen ned 8 ganger. Pumpen er nå klar til bruk. Hvis den brukes daglig, trenger ikke pumpen å fylles på nytt. Hvis den ikke er brukt i 2 dager på rad, primer du med 1 spray eller til en fin spray vises. Hvis ikke brukt på mer enn 14 dager, skyll spraytuppen på pumpen ved å bruke rengjøringstrinnene som er oppført på slutten av dette pakningsvedlegget. Etter rengjøring, fyll på nytt med 2 sprayer eller til en fin spray vises.
Hver flaske RHINOCORT AQUA (budesonid) nesespray inneholder nok medisin til at du kan spraye medisin fra flasken 120 ganger etter at flasken er primet.
Du bør ikke bruke flasken med RHINOCORT 100mcg AQUA (budesonid) nesespray etter 120 sprayer. Ekstra spray etter 120 inneholder kanskje ikke riktig mengde medisin. Du bør holde styr på antall spray du bruker fra hver flaske RHINOCORT 100mcg AQUA nesespray og kaste eventuell gjenværende medisin som kan være igjen i flasken. Fyll på resepten din månedlig.
Slik bruker du din RHINOCORT 100mcg AQUA (budesonid) nesespray
Følg disse instruksjonene for daglig bruk av RHINOCORT AQUA (budesonid) nesespray:
. Blås forsiktig nesen for å rense neseborene, om nødvendig. . Rist flasken forsiktig i noen sekunder og fjern den grønne beskyttelseshetten. . Hold flasken godt med pekefingeren og langfingeren på hver side av spraytuppen og tommelen under flasken (se Figur C ). Figur C 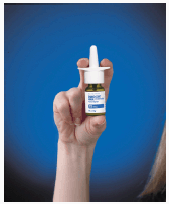
4. Sett spraytuppen inn i neseboret (tuppen skal ikke nå langt inn i nesen). Lukk det andre neseboret med en finger og len hodet litt fremover slik at sprayen vil sikte mot baksiden av nesen (se Figur D ).
Figur D 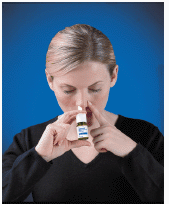
5. For hver spray aktiverer du pumpen ved å trykke raskt og fast på den hvite kragen mens du holder bunnen av flasken med tommelen. Pust forsiktig innover gjennom neseboret.
6. Etter å ha sprayet inn i neseboret, len hodet bakover i noen sekunder (se Figur E ).
Figur E 
7. Hvis en ny spray er nødvendig i det samme neseboret, gjenta trinn 3 til 6.
8. Gjenta trinn 3 til 7 for det andre neseboret ditt.
9. Unngå å blåse nesen i 15 minutter etter at du har brukt RHINOCORT 100mcg AQUA (budesonid) nesespray.
10. Tørk av sprøytespissen med en ren serviett (se Figur F ), og sett på den grønne beskyttelseshetten. Oppbevar flasken i oppreist stilling.
Figur F 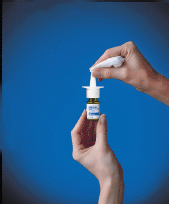
Slik rengjør du din RHINOCORT 100mcg AQUA (budesonid) nesespray
Figur G 
Skyll den grønne beskyttelseshetten og sprøytespissen regelmessig. Å gjøre dette:
. Fjern den grønne beskyttelseshetten og løft av sprøytespissen (se Figur G ). . Vask kun den grønne beskyttelseshetten og sprøytespissen i varmt vann og skyll dem i kaldt vann fra springen. . 3. La den grønne beskyttelseshetten og spraytuppen lufttørke helt før du setter sammen nesesprayen. . Hvis sprøytespissen blir blokkert, kan den fjernes ved å gjenta trinn 1 til 3. Ikke fjern blokkeringen av neseapplikatoren med en nål eller annen skarp gjenstand.For ytterligere informasjon om RHINOCORT 100mcg AQUA (budesonid) ® nesespray, vennligst ring AstraZeneca informasjonssenter, mandag til fredag, kl. 08.00 - 18.00 ET, unntatt helligdager kl. 1-800-236-9933.
