Aciphex 10mg, 20mg Rabeprazole Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Aciphex 10mg og hvordan brukes det?
Aciphex 10mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på gastroøsofageal reflukssykdom (GERD), Helicobacter Pylori og tarmsår. Aciphex 10mg kan brukes alene eller sammen med andre medisiner.
Aciphex er en protonpumpehemmer.
Det er ikke kjent om Aciphex 20mg tablett med forsinket frigjøring er trygg og effektiv hos barn under 12 år. Det er ikke kjent om Aciphex 10mg tablett med forsinket frigjøring (dryss) er trygt og effektivt hos barn yngre enn 1 år.
Hva er de mulige bivirkningene av Aciphex 10mg?
Aciphex kan forårsake alvorlige bivirkninger, inkludert:
- . sterke magesmerter, . blodig diaré, . plutselig smerte eller problemer med å bevege hofte, håndledd eller rygg, . anfall (kramper), . urinere mindre enn vanlig, . blod i urinen, . opphovning, . rask vektøkning, . leddsmerter, . hudutslett på kinnene eller armene forverret av sollys, . svimmelhet, . rask eller uregelmessig hjertefrekvens, . rystende eller rykkende muskelbevegelser (skjelvinger), . føler seg nervøs, . muskelkramper eller spasmer i hender eller føtter, . hoste, . problemer med å svelge eller kvele, . hodepine, . svakhet, . blåmerker, . uvanlig blødning (neseblod, tannkjøtt), . rød eller rosa urin, . kraftig menstruasjonsstrøm, . blodig eller tjæreaktig avføring, . hoste opp blod eller oppkast som ser ut som kaffegrut, . blødning som er vanskelig å kontrollere,
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Aciphex inkluderer:
- . hodepine, . kvalme, . oppkast, . diaré, . forstoppelse, . magesmerter,
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Aciphex. Spør legen din eller apoteket for mer informasjon.
BESKRIVELSE
Den aktive ingrediensen i ACIPHEX 20 mg tabletter med forsinket frigivelse er rabeprazolnatrium, som er en protonpumpehemmer. Det er en substituert benzimidazol kjent kjemisk som 2-[[[4-(3metoksypropoksy)-3-metyl-2-pyridinyl]-metyl]sulfinyl]-1H-benzimidazol-natriumsalt. Den har en empirisk formel på C18H20N3NaO3S og en molekylvekt på 381,42. Rabeprazolnatrium er et hvitt til svakt gulhvitt fast stoff. Det er svært løselig i vann og metanol, fritt løselig i etanol, kloroform og etylacetat og uløselig i eter og n-heksan. Stabiliteten til rabeprazolnatrium er en funksjon av pH; det brytes raskt ned i sure medier, og er mer stabilt under alkaliske forhold. Den strukturelle figuren er:
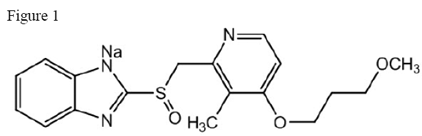
ACIPHEX er tilgjengelig for oral administrering som enterisk drasjerte tabletter med forsinket frigivelse som inneholder 20 mg rabeprazolnatrium.
Inaktive ingredienser i 20 mg tabletten er karnaubavoks, krospovidon, diacetylerte monoglyserider, etylcellulose, hydroksypropylcellulose, hypromelloseftalat, magnesiumstearat, mannitol, propylenglykol, natriumhydroksid, natriumstearylfumarat, talkum og titandioksid. Gult jernoksid er fargestoffet for tablettbelegget. Rødt jernoksid er blekkpigmentet.
INDIKASJONER
Helbredelse av erosiv eller ulcerøs GERD hos voksne
ACIPHEX 20 mg tabletter med forsinket frigivelse er indisert for korttidsbehandling (4 til 8 uker) for helbredelse og symptomatisk lindring av erosiv eller ulcerøs gastroøsofageal reflukssykdom (GERD). For de pasientene som ikke har helbredet etter 8 ukers behandling, kan en ytterligere 8-ukers kur med ACIPHEX vurderes.
Vedlikehold av helbredelse av erosiv eller ulcerøs GERD hos voksne
ACIPHEX tabletter med forsinket frigjøring er indisert for å opprettholde tilheling og reduksjon i tilbakefall av halsbrannsymptomer hos pasienter med erosiv eller ulcerøs gastroøsofageal reflukssykdom (GERD Maintenance). Kontrollerte studier strekker seg ikke utover 12 måneder.
Behandling av symptomatisk GERD hos voksne
ACIPHEX 20 mg tabletter med forsinket frigivelse er indisert for behandling av halsbrann på dagtid og om natten og andre symptomer assosiert med GERD hos voksne i opptil 4 uker.
Tilheling av duodenalsår hos voksne
ACIPHEX 20 mg tabletter med forsinket frigivelse er indisert for kortvarig (opptil fire uker) behandling for tilheling og symptomatisk lindring av duodenalsår. De fleste pasienter helbreder innen fire uker.
Helicobacter Pylori utryddelse for å redusere risikoen for tilbakefall av duodenalsår hos voksne
ACIPHEX 10 mg tabletter med forsinket frigjøring, i kombinasjon med amoksicillin og klaritromycin som et regime med tre legemidler, er indisert for behandling av pasienter med H. pylori-infeksjon og duodenalsårsykdom (aktiv eller i anamnesen de siste 5 årene) for å utrydde H. pylori . Utryddelse av H. pylori har vist seg å redusere risikoen for tilbakefall av duodenalsår.
Hos pasienter som mislykkes i behandlingen, bør følsomhetstesting utføres. Hvis resistens mot klaritromycin er påvist eller følsomhetstesting ikke er mulig, bør alternativ antimikrobiell behandling settes i gang [se KLINISK FARMAKOLOGI og den fullstendige forskrivningsinformasjonen for klaritromycin].
Behandling av patologiske hypersekretoriske tilstander, inkludert Zollinger-Ellison syndrom hos voksne
ACIPHEX tabletter med forsinket frigjøring er indisert for langtidsbehandling av patologiske hypersekretoriske tilstander, inkludert Zollinger-Ellisons syndrom.
Behandling av symptomatisk GERD hos ungdomspasienter 12 år og eldre
ACIPHEX 20 mg tabletter med forsinket frigivelse er indisert for behandling av symptomatisk GERD hos ungdom 12 år og eldre i opptil 8 uker.
DOSERING OG ADMINISTRASJON
Tabell 1 viser anbefalt dosering av ACIPHEX tabletter med forsinket frigjøring hos voksne og ungdomspasienter 12 år og eldre. Bruk av ACIPHEX tabletter med forsinket frigivelse anbefales ikke til bruk hos pediatriske pasienter i alderen 1 år til under 12 år fordi den laveste tilgjengelige tablettstyrken (20 mg) overstiger anbefalt dose for disse pasientene. Bruk en annen rabeprazol-formulering for pediatriske pasienter 1 år til under 12 år.
Administrasjonsinstruksjoner
- . Svelg ACIPHEX 20 mg tabletter med forsinket frigjøring hele. Ikke tygg, knus eller del tabletter. . For behandling av duodenalsår, ta ACIPHEX tabletter med forsinket frigjøring etter et måltid. . For å utrydde Helicobacter pylori, ta ACIPHEX 20 mg tabletter med forsinket frigjøring sammen med mat. . For alle andre indikasjoner kan ACIPHEX tabletter med forsinket frigivelse tas med eller uten mat. . Ta en glemt dose så snart som mulig. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og gå tilbake til normal tidsplan. Ikke ta to doser samtidig.
HVORDAN LEVERES
Doseringsformer og styrker
ACIPHEX 10 mg tabletter med forsinket frigivelse leveres i én styrke, 20 mg. Tablettene er runde, lysegule, enterisk belagte, bikonvekse tabletter. "ACIPHEX 20" er merket med rødt på den ene siden av tabletten.
Oppbevaring og håndtering
ACIPHEX 20 mg leveres som lysegule enterisk-drasjerte tabletter med forsinket frigivelse. Navnet og styrken, i mg, (ACIPHEX 20) er trykt på den ene siden.
Flasker på 30 ( NDC 69784-243-30)
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP kontrollert romtemperatur ]. Beskytt mot fuktighet.
Distribuert av Eisai Inc., Woodcliff Lake, NJ 07677. Revidert: mars 2022
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i merkingen:
- . Akutt Tubulointerstitiell nefritis [se ADVARSLER OG FORHOLDSREGLER ] . Clostridium difficile-assosiert diaré [se ADVARSLER OG FORHOLDSREGLER ] . Benbrudd [se ADVARSLER OG FORHOLDSREGLER ] . Alvorlige kutane bivirkninger [se ADVARSLER OG FORHOLDSREGLER ] . Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ] . Cyanokobalamin (vitamin B-12) mangel [se ADVARSLER OG FORHOLDSREGLER ] . Hypomagnesemi og mineralmetabolisme [se ADVARSLER OG FORHOLDSREGLER ] . Fundic kjertelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske studier
Fordi kliniske studier utføres under varierende forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke ratene observert i praksis.
Voksne
Dataene beskrevet nedenfor gjenspeiler eksponering for ACIPHEX tabletter med forsinket frigivelse hos 1064 voksne pasienter eksponert i opptil 8 uker. Studiene var primært placebo- og aktivkontrollerte studier på voksne pasienter med erosiv eller ulcerøs gastroøsofageal reflukssykdom (GERD), duodenalsår og magesår. Befolkningen hadde en gjennomsnittsalder på 53 år (spredning 18-89 år) og hadde et forhold på omtrent 60 % menn: 40 % kvinner. Rasefordelingen var 86% kaukasiske, 8% afroamerikanske, 2% asiatiske og 5% andre. De fleste pasienter fikk enten 10 mg, 20 mg eller 40 mg per dag av ACIPHEX 20 mg tabletter med forsinket frigivelse.
En analyse av bivirkninger som opptrådte hos ≥2 % av pasientene behandlet med ACIPHEX 10 mg tabletter med forsinket frigivelse (n=1064) og med en høyere frekvens enn placebo (n=89) i kontrollerte nordamerikanske og europeiske akuttbehandlingsstudier, avslørte følgende bivirkninger: smerte (3 % vs. 1 %), faryngitt (3 % vs. 2 %), flatulens (3 % vs. 1 %), infeksjon (2 % vs. 1 %) og forstoppelse (2 % vs. 1%).
Tre langsiktige vedlikeholdsstudier besto av totalt 740 voksne pasienter; minst 54 % av voksne pasienter ble eksponert for ACIPHEX 20 mg tabletter med forsinket frigivelse i 6 måneder og minst 33 % ble eksponert i 12 måneder. Av de 740 voksne pasientene fikk 247 (33 %) og 241 (33 %) pasienter henholdsvis 10 mg og 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse, mens 169 (23 %) pasienter fikk placebo og 83 (11 %) omeprazol.
Sikkerhetsprofilen til rabeprazol i vedlikeholdsstudiene hos voksne var i samsvar med det som ble observert i de akutte studiene.
Mindre vanlige bivirkninger sett i kontrollerte kliniske studier (
Kombinasjonsbehandling med amoxicillin og klaritromycin
I kliniske studier med kombinasjonsbehandling med rabeprazol pluss amoksicillin og klaritromycin (RAC), ble det ikke observert noen bivirkninger unike for denne medikamentkombinasjonen. I den amerikanske multisenterstudien var de hyppigst rapporterte legemiddelrelaterte bivirkningene for pasienter som fikk RAC-behandling i 7 eller 10 dager diaré (8 % og 7 %) og smaksperversjon (henholdsvis 6 % og 10 %).
Det ble ikke observert noen klinisk signifikante laboratorieavvik som er spesielle for legemiddelkombinasjonene.
For mer informasjon om bivirkninger eller laboratorieendringer med amoxicillin eller klaritromycin, se deres respektive forskrivningsinformasjon, avsnittet Bivirkninger.
Pediatri
en multisenter, åpen studie av ungdomspasienter i alderen 12 til 16 år med en klinisk diagnose av symptomatisk GERD eller endoskopisk påvist GERD, var bivirkningsprofilen lik den for voksne. Bivirkningene rapportert uten hensyn til forhold til ACIPHEX 20 mg tabletter med forsinket frigivelse som oppstod hos ≥2 % av 111 pasienter var hodepine (9,9 %), diaré (4,5 %), kvalme (4,5 %), oppkast (3,6 %) og magesmerter (3,6 %). De relaterte rapporterte bivirkningene som oppstod hos ≥2 % av pasientene var hodepine (5,4 %) og kvalme (1,8 %). Det var ingen bivirkninger rapportert i denne studien som ikke tidligere ble observert hos voksne.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av rabeprazol etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering:
Blod og lymfesystem lidelser: agranulocytose, hemolytisk anemi, leukopeni, pancytopeni, trombocytopeni
Øre- og labyrintlidelser: svimmelhet
Øyelidelser: tåkesyn
Gastrointestinale lidelser: fundic kjertel polypper
Generelle lidelser og administrasjonsbetingelser: plutselig død
Lever og gallesykdommer: gulsott
Forstyrrelser i immunsystemet: anafylaksi, angioødem, systemisk lupus erythematosus, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse (noen dødelig), DRESS, AGEP
Infeksjoner og angrep: Clostridium difficile-assosiert diaré
Undersøkelser: Økning i protrombintid/INR (hos pasienter behandlet med samtidig warfarin), TSH-økninger
Metabolisme og ernæringsforstyrrelser: hyperammonemi, hypomagnesemi, hypokalsemi, hypokalemi [Advarsler og forholdsregler 5.8], hyponatremi
Sykdommer i muskel- og skjelettsystemet: beinbrudd, rabdomyolyse
Forstyrrelser i nervesystemet: koma
Psykiatriske lidelser: delirium, desorientering
Nyre- og urinveislidelser: interstitiell nefritt
Respiratoriske, thorax- og mediastinumsykdommer: interstitiell lungebetennelse
Hud- og subkutane vevslidelser: alvorlige dermatologiske reaksjoner inkludert bulløse og andre legemiddelutbrudd i huden, kutan lupus erythematosus, erythema multiforme
NARKOTIKAHANDEL
Tabell 2 inkluderer legemidler med klinisk viktige legemiddelinteraksjoner og interaksjon med diagnostikk når de administreres samtidig med ACIPHEX 10 mg tabletter med forsinket frigivelse og instruksjoner for å forebygge eller håndtere dem.
Se merkingen av legemidler som brukes samtidig for å få mer informasjon om interaksjoner med PPI.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Tilstedeværelse av gastrisk malignitet
Hos voksne utelukker ikke symptomatisk respons på behandling med ACIPHEX 10 mg tilstedeværelse av gastrisk malignitet. Vurder ytterligere oppfølging og diagnostisk testing hos voksne pasienter som har en suboptimal respons eller et tidlig symptomatisk tilbakefall etter fullført behandling med PPI.
Interaksjon med Warfarin
Steady state-interaksjoner mellom rabeprazol og warfarin er ikke tilstrekkelig evaluert hos pasienter. Det har vært rapporter om økt INR og protrombintid hos pasienter som får en protonpumpehemmer og warfarin samtidig. Økning i INR og protrombintid kan føre til unormal blødning og til og med død. Pasienter som behandles med ACIPHEX 10 mg tabletter med forsinket frigjøring og warfarin samtidig, kan trenge å overvåkes for økning i INR og protrombintid [se NARKOTIKAHANDEL ].
Akutt Tubulointerstitiell nefritis
Akutt tubulointerstitiell nefritt (TIN) er observert hos pasienter som tar PPI og kan forekomme når som helst under PPI-behandling. Pasienter kan ha forskjellige tegn og symptomer fra symptomatiske overfølsomhetsreaksjoner til uspesifikke symptomer på nedsatt nyrefunksjon (f.eks. ubehag, kvalme, anoreksi). I rapporterte kasusserier ble noen pasienter diagnostisert på biopsi og i fravær av ekstrarenale manifestasjoner (f.eks. feber, utslett eller artralgi).
Seponer ACIPHEX og evaluer pasienter med mistanke om akutt TIN [se KONTRAINDIKASJON ].
Clostridium Difficile-assosiert diaré
Publiserte observasjonsstudier tyder på at PPI-behandling som ACIPHEX kan være assosiert med økt risiko for Clostridium difficile-assosiert diaré, spesielt hos sykehusinnlagte pasienter. Denne diagnosen bør vurderes for diaré som ikke forbedres [se BIVIRKNINGER ].
Pasienter bør bruke den laveste dosen og korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles.
Clostridium difficile-assosiert diaré (CDAD) er rapportert ved bruk av nesten alle antibakterielle midler. For mer informasjon spesifikt for antibakterielle midler (klaritromycin og amoksicillin) indisert for bruk i kombinasjon med ACIPHEX, se avsnittene Advarsler og forsiktighetsregler i den tilsvarende forskrivningsinformasjonen.
Benbrudd
Flere publiserte observasjonsstudier hos voksne tyder på at PPI-behandling kan være assosiert med økt risiko for osteoporose-relaterte frakturer i hofte, håndledd eller ryggrad. Risikoen for brudd var økt hos pasienter som fikk høye doser, definert som flere daglige doser, og langvarig PPI-behandling (ett år eller lenger). Pasienter bør bruke den laveste dosen og korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles. Pasienter med risiko for osteoporose-relaterte frakturer bør behandles i henhold til etablerte behandlingsretningslinjer [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER ].
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, inkludert Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), medikamentreaksjoner med eosinofili og systemiske symptomer (DRESS), og akutt generalisert eksantematøs pustulose (AGEP) er rapportert i forbindelse med bruk av PPI. [se BIVIRKNINGER ]. Seponer ACIPHEX ved første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhet og vurder videre evaluering.
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er rapportert hos pasienter som tar PPI, inkludert rabeprazol. Disse hendelsene har oppstått både som ny debut og en forverring av eksisterende autoimmun sykdom. Flertallet av PPI-induserte lupus erythematosus-tilfeller var CLE.
Den vanligste formen for CLE rapportert hos pasienter behandlet med PPI var subakutt CLE (SCLE) og oppstod innen uker til år etter kontinuerlig medikamentell behandling hos pasienter fra spedbarn til eldre. Generelt ble histologiske funn observert uten organinvolvering.
Systemisk lupus erythematosus (SLE) er sjeldnere rapportert enn CLE hos pasienter som får PPI. PPI-assosiert SLE er vanligvis mildere enn ikke-medikamentindusert SLE. Utbruddet av SLE oppstod vanligvis innen dager til år etter behandlingsstart, hovedsakelig hos pasienter fra unge voksne til eldre. Flertallet av pasientene hadde utslett; artralgi og cytopeni ble imidlertid også rapportert.
Unngå administrasjon av PPI lenger enn medisinsk indisert. Hvis tegn eller symptomer forenlig med CLE eller SLE observeres hos pasienter som får ACIPHEX, seponer legemidlet og henvis pasienten til riktig spesialist for evaluering. De fleste pasienter blir bedre ved seponering av PPI alene i løpet av 4 til 12 uker. Serologisk testing (f.eks. ANA) kan være positiv og forhøyede serologiske testresultater kan ta lengre tid å løse enn kliniske manifestasjoner.
Cyanokobalamin (vitamin B-12) mangel
Daglig behandling med syredempende medisiner over lang tid (f.eks. lengre enn 3 år) kan føre til malabsorpsjon av cyanokobalamin (vitamin B-12) forårsaket av hypo- eller aklorhydri. Sjeldne rapporter om cyanokobalaminmangel som oppstår ved syredempende behandling er rapportert i litteraturen. Denne diagnosen bør vurderes dersom kliniske symptomer forenlig med cyanokobalaminmangel observeres hos pasienter behandlet med ACIPHEX.
Hypomagnesemi og mineralmetabolisme
Hypomagnesemi, symptomatisk og asymptomatisk, er sjelden rapportert hos pasienter behandlet med PPI i minst tre måneder, i de fleste tilfeller etter et års behandling. Alvorlige bivirkninger inkluderer tetany, arytmier og anfall. Hypomagnesemi kan føre til hypokalsemi og/eller hypokalemi og kan forverre underliggende hypokalsemi hos risikopasienter. Hos de fleste pasienter krevde behandling av hypomagnesemi magnesiumerstatning og seponering av PPI.
For pasienter som forventes å være på langvarig behandling eller som tar PPI sammen med medisiner som digoksin eller legemidler som kan forårsake hypomagnesemi (f.eks. diuretika), kan helsepersonell vurdere å overvåke magnesiumnivåer før oppstart av PPI-behandling og med jevne mellomrom [se BIVIRKNINGER ].
Vurder å overvåke magnesium- og kalsiumnivåer før oppstart av ACIPHEX og med jevne mellomrom under behandling hos pasienter med en eksisterende risiko for hypokalsemi (f.eks. hypoparatyreoidisme). Suppler med magnesium og/eller kalsium etter behov. Hvis hypokalsemi er motstandsdyktig mot behandling, bør du vurdere å seponere PPI.
Interaksjon med metotreksat
Litteratur tyder på at samtidig bruk av PPI med metotreksat (primært i høye doser; se forskrivningsinformasjon om metotreksat) kan øke og forlenge serumkonsentrasjoner av metotreksat og/eller dets metabolitt, noe som muligens kan føre til metotreksat toksisitet. Ved administrering av høydose metotreksat kan en midlertidig seponering av PPI vurderes hos noen pasienter [se NARKOTIKAHANDEL ].
Fundic kjertelpolypper
PPI-bruk er assosiert med økt risiko for fundiske kjertelpolypper som øker ved langvarig bruk, spesielt utover ett år. De fleste PPI-brukere som utviklet fundiske kjertelpolypper var asymptomatiske og fundiske kjertelpolypper ble identifisert ved endoskopi. Bruk den korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning ).
Akutt Tubulointerstitiell nefritis
Råd pasienten eller omsorgspersonen til å ringe pasientens helsepersonell umiddelbart hvis de opplever tegn og/eller symptomer assosiert med akutt tubulointerstitiell nefritt [se ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-assosiert diaré
Råd pasienten eller omsorgspersonen til umiddelbart å ringe pasientens helsepersonell dersom de opplever diaré som ikke blir bedre [se ADVARSLER OG FORHOLDSREGLER ].
Benbrudd
Råd pasienten eller omsorgspersonen til å rapportere eventuelle brudd, spesielt i hoften, håndleddet eller ryggraden, til pasientens helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Alvorlige kutane bivirkninger
Råd pasienten eller omsorgspersonen til å seponere ACIPHEX 20mg og rapportere eventuelle tegn og symptomer på en alvorlig kutan bivirkning eller andre tegn på overfølsomhet til helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Kutan og systemisk lupus erythematosus
Råd pasienten eller omsorgspersonen til umiddelbart å ringe pasientens helsepersonell for nye eller forverrede symptomer assosiert med kutan eller systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ].
Cyanokobalamin (vitamin B-12) mangel
Råd pasienten eller omsorgspersonen til å rapportere alle kliniske symptomer som kan være assosiert med cyanokobalaminmangel til pasientens helsepersonell dersom de har fått ACIPHEX 20 mg i mer enn 3 år [se ADVARSLER OG FORHOLDSREGLER ].
Hypomagnesemi og mineralmetabolisme
Råd pasienten eller omsorgspersonen til å rapportere alle kliniske symptomer som kan være assosiert med hypomagnesemi, hypokalsemi, hypokalemi og hyponatremi til pasientens helsepersonell, hvis de har fått ACIPHEX i minst 3 måneder [se ADVARSLER OG FORHOLDSREGLER ].
Narkotikahandel
Råd pasienter til å rapportere til helsepersonell dersom de tar produkter som inneholder rilpivirin [se KONTRAINDIKASJONER ], warfarin, digoksin eller høydose metotreksat [se ADVARSLER OG FORHOLDSREGLER ].
Administrasjon
- . Svelg ACIPHEX 10mg tabletter med forsinket frigjøring hele. Ikke tygg, knus eller del tablettene. . For behandling av duodenalsår, ta ACIPHEX tabletter med forsinket frigjøring etter et måltid. . For å utrydde Helicobacter pylori, ta ACIPHEX 20 mg tabletter med forsinket frigjøring sammen med mat. . For alle andre indikasjoner kan ACIPHEX 10 mg tabletter med forsinket frigivelse tas med eller uten mat. . Ta en glemt dose så snart som mulig. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og gå tilbake til normal tidsplan. Ikke ta to doser samtidig.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
en 88/104-ukers karsinogenitetsstudie på CD-1-mus ga rabeprazol ved orale doser opptil 100 mg/kg/dag ingen økt tumorforekomst. Den høyeste testede dosen ga en systemisk eksponering for rabeprazol (AUC) på 1,40 μg•time/mL, som er 1,6 ganger eksponeringen hos mennesker (plasma AUC0-∞ = 0,88 μg•time/mL) ved anbefalt dose for GERD (20 mg/ dag). I en 28-ukers karsinogenitetsstudie på p53+/-transgene mus, forårsaket ikke rabeprazol ved orale doser på 20, 60 og 200 mg/kg/dag en økning i forekomsten av svulster, men ga hyperplasi i mageslimhinnen ved alle doser. Den systemiske eksponeringen for rabeprazol ved 200 mg/kg/dag er omtrent 17 til 24 ganger eksponeringen hos mennesker ved anbefalt dose for GERD. I en 104-ukers karsinogenitetsstudie på Sprague-Dawley-rotter ble hanner behandlet med orale doser på 5, 15, 30 og 60 mg/kg/dag og hunner med 5, 15, 30, 60 og 120 mg/kg/dag. . Rabeprazol produserte gastrisk enterokromaffin-lignende (ECL) cellehyperplasi hos hann- og hunnrotter og ECL-cellekarsinoidsvulster hos hunnrotter ved alle doser inkludert den laveste testede dosen. Den laveste dosen (5 mg/kg/dag) ga en systemisk eksponering for rabeprazol (AUC) på ca. 0,1 μg•time/mL, som er ca. 0,1 ganger den menneskelige eksponeringen ved anbefalt dose for GERD. Hos hannrotter ble det ikke observert behandlingsrelaterte svulster ved doser opp til 60 mg/kg/dag som ga en plasmaeksponering for rabeprazol (AUC) på ca. 0,2 μg•time/ml (0,2 ganger den menneskelige eksponeringen ved anbefalt dose for GERD).
Rabeprazol var positiv i Ames-testen, den kinesiske hamsterens ovariecelle (CHO/HGPRT) fremre mutasjonstest og muselymfomcelle (L5178Y/TK+/–) fremre mutasjonstest. Dens demetylerte metabolitten var også positiv i Ames-testen. Rabeprazol var negativt i in vitro-kromosomavvikstesten for kinesisk hamster-lungecelle, in vivo-musmikronukleustesten og in vivo- og ex vivo-testene for uplanlagt DNA-syntese av rottehepatocytter (UDS).
Rabeprazol ved intravenøse doser på opptil 30 mg/kg/dag (plasma-AUC på 8,8 μg•time/ml, ca. 10 ganger human eksponering ved anbefalt dose for GERD) ble ikke funnet å ha noen effekt på fertilitet og reproduksjonsevne hos menn og menn. hunnrotter.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Det er ingen tilgjengelige humane data på bruk av ACIPHEX 10 mg hos gravide kvinner for å informere om den medikamentassosierte risikoen. Bakgrunnsrisikoen for store fødselsskader og spontanabort for de angitte populasjonene er ukjent. Imidlertid er bakgrunnsrisikoen i den generelle befolkningen i USA for alvorlige fødselsskader 2 til 4 % og for spontanabort er 15 til 20 % av klinisk anerkjente svangerskap. Ingen bevis for uønskede utviklingseffekter ble sett i reproduksjonsstudier på dyr med rabeprazol administrert under organogenese ved 13 og 8 ganger det menneskelige arealet under plasmakonsentrasjon-tid-kurven (AUC) ved anbefalt dose for GERD, i henholdsvis rotter og kaniner [se Data ].
Endringer i benmorfologi ble observert hos avkom av rotter behandlet med orale doser av en annen PPI gjennom det meste av drektighet og amming. Når mors administrering var begrenset til kun svangerskap, var det ingen effekter på beinfysisk morfologi hos avkommet i noen alder [se Data ].
Data
Dyredata
Embryo-føtale utviklingsstudier er utført på rotter under organogenese ved intravenøse doser av rabeprazol opp til 50 mg/kg/dag (plasma-AUC på 11,8 μg•time/mL, omtrent 13 ganger human eksponering ved anbefalt oral dose for GERD) og kaniner ved intravenøse doser opptil 30 mg/kg/dag (plasma-AUC på 7,3 μg•time/mL, ca. 8 ganger menneskelig eksponering ved anbefalt oral dose for GERD) og har ikke avdekket bevis for skade på fosteret pga. rabeprazol.
Administrering av rabeprazol til rotter sent i svangerskapet og under amming i en oral dose på 400 mg/kg/dag (ca. 195 ganger den orale dosen hos mennesker basert på mg/m²) resulterte i reduksjoner i kroppsvektøkning hos valpene.
En pre- og postnatal utviklingstoksisitetsstudie på rotter med ytterligere endepunkter for å evaluere beinutvikling ble utført med en annen PPI ved omtrent 3,4 til 57 ganger en oral human dose på kroppsoverflatebasis. Redusert lårbenslengde, bredde og tykkelse på kortikalt bein, redusert tykkelse på tibialvekstplaten og minimal til mild benmargshypocellularitet ble observert ved doser av denne PPI lik eller større enn 3,4 ganger en oral human dose på basis av kroppsoverflate. . Fysisk dysplasi i lårbenet ble også observert hos avkom etter in utero og laktasjonseksponering for PPI ved doser lik eller større enn 33,6 ganger en oral human dose på basis av kroppsoverflate. Effekter på maternalt bein ble observert hos drektige og diegivende rotter i en pre- og postnatal toksisitetsstudie når PPI ble administrert i orale doser på 3,4 til 57 ganger en oral human dose på basis av kroppsoverflate. Når rotter ble doseret fra svangerskapsdag 7 til avvenning på postnatal dag 21, ble det observert en statistisk signifikant reduksjon i maternal femurvekt på opptil 14 % (sammenliknet med placebobehandling) ved doser lik eller større enn 33,6 ganger en oral human dose på basis av kroppsoverflate.
En oppfølgingsstudie av utviklingstoksisitet hos rotter med ytterligere tidspunkter for å evaluere ungbeinutvikling fra postnatal dag 2 til voksen alder ble utført med en annen PPI ved orale doser på 280 mg/kg/dag (ca. 68 ganger en oral human dose på en kroppsoverflatebasis) der medikamentadministrasjonen var fra enten svangerskapsdag 7 eller svangerskapsdag 16 til fødsel. Når mors administrering var begrenset til kun svangerskap, var det ingen effekter på beinfysisk morfologi hos avkommet uansett alder.
Amming
Risikosammendrag
Ammingsstudier er ikke utført for å vurdere tilstedeværelsen av rabeprazol i morsmelk, effekten av rabeprazol på spedbarnet som ammes, eller effekten av rabeprazol på melkeproduksjonen. Rabeprazol finnes i rottemelk. Utviklingen og helsegevinstene ved amming bør vurderes sammen med morens kliniske behov for ACIPHEX og eventuelle skadelige effekter på det ammede spedbarnet fra ACIPHEX eller fra den underliggende morstilstanden.
Pediatrisk bruk
Sikkerheten og effektiviteten til ACIPHEX 20 mg tabletter med forsinket frigjøring er fastslått hos pediatriske pasienter for ungdomspasienter 12 år og eldre for behandling av symptomatisk GERD. Bruk av ACIPHEX 20 mg tabletter med forsinket frigjøring i denne aldersgruppen støttes av adekvate og godt kontrollerte studier hos voksne og en multisenter, randomisert, åpen parallell-gruppestudie med 111 ungdomspasienter i alderen 12 til 16 år. Pasientene hadde en klinisk diagnose av symptomatisk GERD, eller mistenkt eller endoskopisk påvist GERD og ble randomisert til enten 10 mg eller 20 mg én gang daglig i opptil 8 uker for evaluering av sikkerhet og effekt. Bivirkningsprofilen hos ungdomspasienter var lik den for voksne. De relaterte rapporterte bivirkningene som oppsto hos ≥2 % av pasientene var hodepine (5 %) og kvalme (2 %). Det var ingen bivirkninger rapportert i disse studiene som ikke tidligere ble observert hos voksne.
Sikkerheten og effektiviteten til ACIPHEX 10 mg tabletter med forsinket frigivelse er ikke fastslått hos pediatriske pasienter for:
- . Helbredelse av erosiv eller ulcerøs GERD . Vedlikehold av helbredelse av erosiv eller ulcerøs GERD . Behandling av symptomatisk GERD . Heling av duodenalsår . Helicobacter pylori utryddelse for å redusere risikoen for tilbakefall av duodenalsår . Behandling av patologiske hypersekretoriske tilstander, inkludert Zollinger-Ellison syndrom
ACIPHEX 20 mg tabletter med forsinket frigivelse anbefales ikke til bruk hos pediatriske pasienter under 12 år fordi tablettstyrken overstiger anbefalt dose for disse pasientene [se DOSERING OG ADMINISTRASJON ]. For pediatriske pasienter 1 år til under 12 år bør du vurdere en annen rabeprazolformulering. Sikkerheten og effektiviteten til en annen doseringsform og doseringsstyrke av rabeprazol er etablert hos pediatriske pasienter 1 til 11 år for behandling av GERD.
Data for unge dyr
Studier på unge og unge voksne rotter og hunder ble utført. I juvenile dyrestudier ble rabeprazolnatrium administrert oralt til rotter i opptil 5 uker og til hunder i opptil 13 uker, hver med start på dag 7 post-partum og etterfulgt av en 13-ukers restitusjonsperiode. Rotter ble dosert med 5, 25 eller 150 mg/kg/dag og hunder fikk doser på 3, 10 eller 30 mg/kg/dag. Dataene fra disse studiene var sammenlignbare med de som ble rapportert for unge voksne dyr. Farmakologisk medierte endringer, inkludert økte serumgastrinnivåer og mageforandringer, ble observert ved alle dosenivåer hos både rotter og hunder. Disse observasjonene var reversible over de 13 uker lange restitusjonsperiodene. Selv om kroppsvekter og/eller krone-rumpe-lengder ble minimalt redusert under dosering, ble det ikke observert noen effekter på utviklingsparametrene hos verken juvenile rotter eller hunder.
Når unge dyr ble behandlet i 28 dager med en annen PPI i doser lik eller større enn 34 ganger den daglige orale humane dosen på basis av kroppsoverflate, ble den totale veksten påvirket og behandlingsrelaterte reduksjoner i kroppsvekt (omtrent 14 %) og kroppsvektøkning, og reduksjoner i lårbensvekt og lårbenslengde ble observert.
Geriatrisk bruk
Av det totale antallet forsøkspersoner (n=2009) i kliniske studier av ACIPHEX 20 mg tabletter med forsinket frigivelse, var 19 % 65 år og over, mens 4 % var 75 år og eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre personer, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes.
Nedsatt leverfunksjon
Administrering av ACIPHEX tabletter med forsinket frigivelse til pasienter med mild til moderat nedsatt leverfunksjon (henholdsvis Child-Pugh klasse A og B) resulterte i økt eksponering og redusert eliminasjon [se KLINISK FARMAKOLOGI ]. Ingen dosejustering er nødvendig hos pasienter med mild til moderat nedsatt leverfunksjon. Det er ingen informasjon om pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh klasse C). Unngå bruk av ACIPHEX tabletter med forsinket frigjøring hos pasienter med alvorlig nedsatt leverfunksjon; men hvis behandling er nødvendig, overvåk pasienter for bivirkninger [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ].
OVERDOSE
Sju rapporter om utilsiktet overdosering med rabeprazol er mottatt. Maksimal rapportert overdose var 80 mg. Det var ingen kliniske tegn eller symptomer assosiert med noen rapportert overdose. Pasienter med Zollinger-Ellisons syndrom har blitt behandlet med opptil 120 mg rabeprazol én gang daglig. Ingen spesifikk motgift for rabeprazol er kjent. Rabeprazol er mye proteinbundet og er ikke lett dialyserbart.
Ved overdosering bør behandlingen være symptomatisk og støttende.
Hvis overeksponering oppstår, ring ditt giftkontrollsenter på 1-800-222-1222 for oppdatert informasjon om håndtering av forgiftning eller overdosering.
KONTRAINDIKASJONER
- . ACIPHEX 10 mg er kontraindisert hos pasienter med kjent overfølsomhet overfor rabeprazol, substituerte benzimidazoler eller en hvilken som helst komponent i formuleringen. Overfølsomhetsreaksjoner kan omfatte anafylaksi, anafylaktisk sjokk, angioødem, bronkospasme, akutt tubulointerstitiell nefritt og urticaria [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ]. . PPI, inkludert ACIPHEX, er kontraindisert med produkter som inneholder rilpivirin [se NARKOTIKAHANDEL ]. . For informasjon om kontraindikasjoner for antibakterielle midler (klaritromycin og amoksicillin) indisert i kombinasjon med ACIPHEX 20 mg tabletter med forsinket frigivelse, se avsnittet Kontraindikasjoner i pakningsvedlegget.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Rabeprazol tilhører en klasse av antisekretoriske forbindelser (substituerte benzimidazol-protonpumpehemmere) som ikke viser antikolinerge eller histamin H2-reseptorantagonistegenskaper, men som undertrykker magesyresekresjonen ved å hemme mage-H+, K+ATPase ved den sekretoriske overflaten av magen. parietalcelle. Fordi dette enzymet regnes som syrepumpen (proton) i parietalcellen, har rabeprazol blitt karakterisert som en gastrisk protonpumpehemmer. Rabeprazol blokkerer det siste trinnet i magesyresekresjonen.
I gastriske parietalceller protoneres rabeprazol, akkumuleres og omdannes til et aktivt sulfenamid. Når det studeres in vitro, aktiveres rabeprazol kjemisk ved pH 1,2 med en halveringstid på 78 sekunder. Det hemmer syretransport i mageblærer fra svin med en halveringstid på 90 sekunder.
Farmakodynamikk
Antisekretorisk aktivitet
Den antisekretoriske effekten begynner innen én time etter oral administrering av 20 mg ACIPHEX 20 mg tabletter med forsinket frigjøring. Median hemmende effekt av rabeprazol på 24-timers surhet i magen er 88 % av maksimal etter første dose. En 20 mg dose av ACIPHEX tabletter med forsinket frigjøring hemmer basal- og peptonmåltidsstimulert syresekresjon versus placebo med henholdsvis 86 % og 95 %, og øker prosentandelen av en 24-timers periode som mage-pH>3 fra 10 % til 65 % (se tabellen nedenfor). Denne relativt forlengede farmakodynamiske virkningen sammenlignet med den korte farmakokinetiske halveringstiden (1 til 2 timer) gjenspeiler den vedvarende inaktiveringen av H+, K+ATPase.
Sammenlignet med placebo, reduserte 10 mg, 20 mg og 40 mg ACIPHEX tabletter med forsinket frigjøring, administrert én gang daglig i 7 dager, signifikant intragastrisk surhet med alle doser for hvert av fire måltidsrelaterte intervaller og 24-timersperioden totalt sett. I denne studien var det ingen statistisk signifikante forskjeller mellom doser; det var imidlertid en signifikant doserelatert reduksjon i intragastrisk surhet. Evnen til rabeprazol å forårsake en doserelatert reduksjon i gjennomsnittlig intragastrisk surhet er illustrert nedenfor.

Etter administrering av 20 mg ACIPHEX 20 mg tabletter med forsinket frigjøring én gang daglig i åtte dager, var gjennomsnittlig prosent av tiden mage-pH større enn 3 eller mage-pH større enn 4 etter en enkelt dose (dag 1) og flere doser (dag 8) betydelig større enn placebo (se tabellen nedenfor). Nedgangen i surhet i magen og økningen i mage-pH observert med 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse administrert én gang daglig i åtte dager ble sammenlignet med de samme parametrene for placebo, som illustrert nedenfor:
Effekter på syreeksponering i spiserøret
Hos pasienter med GERD og moderat til alvorlig esophageal syreeksponering, reduserte en dose på 20 mg og 40 mg per dag av ACIPHEX 20 mg tabletter med forsinket frigivelse 24-timers esophageal syreeksponering. Etter syv dagers behandling, sank prosentandelen av tid som esophageal pH var mindre enn 4 fra baseline på 24,7 % for 20 mg og 23,7 % for 40 mg, til henholdsvis 5,1 % og 2,0 %. Normalisering av 24-timers intraøsofageal syreeksponering var korrelert til mage-pH større enn 4 i minst 35 % av 24-timersperioden; dette nivået ble oppnådd hos 90 % av pasientene som fikk ACIPHEX 20 mg og hos 100 % av pasientene som fikk ACIPHEX 40 mg. Med ACIPHEX 20 mg og 40 mg per dag ble signifikante effekter på gastrisk og esophageal pH observert etter én dag med behandling, og mer uttalt etter syv dagers behandling.
Effekter på serumgastrin
Median fastende gastrinnivå økte på en doserelatert måte hos pasienter behandlet én gang daglig med ACIPHEX 10 mg tabletter med forsinket frigivelse i opptil åtte uker for ulcerøs eller erosiv øsofagitt og hos pasienter behandlet i opptil 52 uker for å forhindre tilbakefall av sykdom. Gruppens medianverdier holdt seg innenfor normalområdet.
Hos en gruppe personer behandlet med 20 mg ACIPHEX tabletter med forsinket frigivelse i 4 uker ble det observert en dobling av gjennomsnittlig serumgastrinkonsentrasjon. Omtrent 35 % av disse behandlede pasientene utviklet serumgastrinkonsentrasjoner over den øvre normalgrensen.
Effekter på enterokromaffinlignende (ECL) celler
Økt serumgastrin sekundært til antisekretoriske midler stimulerer proliferasjon av gastriske ECL-celler som over tid kan resultere i ECL-cellehyperplasi hos rotter og mus og gastriske karsinoider hos rotter, spesielt hos hunner [se Ikke-klinisk toksikologi ].
Hos over 400 pasienter behandlet med ACIPHEX tabletter med forsinket frigivelse (10 eller 20 mg) én gang daglig i opptil ett år, økte forekomsten av ECL-cellehyperplasi med tid og dose, noe som er i samsvar med den farmakologiske virkningen til protonpumpehemmeren. Ingen pasienter utviklet adenomatoide, dysplastiske eller neoplastiske forandringer av ECL-celler i mageslimhinnen. Ingen pasient utviklet karsinoide svulster som ble observert hos rotter.
Endokrine effekter
Studier på mennesker i opptil ett år har ikke avdekket klinisk signifikante effekter på det endokrine systemet. Hos friske mannlige forsøkspersoner behandlet med ACIPHEX tabletter med forsinket frigivelse i 13 dager, er ingen klinisk relevante endringer påvist i følgende undersøkte endokrine parametere: 17 β-østradiol, thyroidstimulerende hormon, tri-jodtyronin, tyroksin, tyroksinbindende protein, parathyroid hormon, insulin, glukagon, renin, aldosteron, follikkelstimulerende hormon, luteotrofisk hormon, prolaktin, somatotrofisk hormon, dehydroepiandrosteron, kortisolbindende globulin og urin-6β-hydroksykortisol, serumtestosteron og døgnkortisolprofil.
Andre effekter
Hos mennesker behandlet med ACIPHEX 10 mg tabletter med forsinket frigjøring i opptil ett år, er det ikke sett noen systemiske effekter på sentralnervesystemet, lymfoide, hematopoietiske, nyre-, lever-, kardiovaskulære eller respiratoriske system. Ingen data er tilgjengelig om langtidsbehandling med ACIPHEX 10 mg tabletter med forsinket frigjøring og okulære effekter.
Farmakokinetikk
Etter oral administrering av 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse, oppstår maksimale plasmakonsentrasjoner (Cmax) av rabeprazol over et område på 2 til 5 timer (Tmax). Rabeprazols Cmax og AUC er lineære over et oralt doseområde på 10 mg til 40 mg. Det er ingen merkbar akkumulering når doser på 10 mg til 40 mg administreres hver 24. time; farmakokinetikken til rabeprazol endres ikke ved gjentatt dosering.
Absorpsjon
Absolutt biotilgjengelighet for en 20 mg oral tablett av rabeprazol (sammenlignet med intravenøs administrering) er omtrent 52 %. Når ACIPHEX 10 mg tabletter med forsinket frigivelse administreres sammen med et fettrikt måltid, er Tmax variabel; som samtidig matinntak kan forsinke absorpsjonen med opptil 4 timer eller lenger. Cmax og omfanget av rabeprazolabsorpsjon (AUC) er imidlertid ikke signifikant endret. ACIPHEX tabletter med forsinket frigivelse kan derfor tas uten hensyn til tidspunkt for måltider.
Fordeling
Rabeprazol er 96,3 % bundet til humane plasmaproteiner.
Eliminering
Metabolisme
Rabeprazol metaboliseres i stor grad. En betydelig del av rabeprazol metaboliseres via systemisk ikke-enzymatisk reduksjon til en tioeterforbindelse. Rabeprazol metaboliseres også til sulfon- og desmetylforbindelser via cytokrom P450 i leveren. Tioteren og sulfonen er de primære metabolittene målt i humant plasma. Disse metabolittene ble ikke observert å ha signifikant antisekretorisk aktivitet. In vitro-studier har vist at rabeprazol metaboliseres i leveren primært av cytokrom P450 3A (CYP3A) til en sulfonmetabolitt og cytokrom P450 2C19 (CYP2C19) til desmetylrabeprazol. CYP2C19 viser en kjent genetisk polymorfisme på grunn av dens mangel i noen underpopulasjoner (f.eks. 3 til 5 % av kaukasiere og 17 til 20 % av asiater). Rabeprazol-metabolismen er langsom i disse underpopulasjonene, derfor omtales de som dårlige metaboliserere av stoffet.
Utskillelse
Etter en enkelt 20 mg oral dose av 14C-merket rabeprazol ble ca. 90 % av legemidlet eliminert i urinen, primært som tioeterkarboksylsyre; dets glukuronid og merkaptursyremetabolitter. Resten av dosen ble gjenvunnet i avføringen. Total utvinning av radioaktivitet var 99,8 %. Ingen uendret rabeprazol ble gjenfunnet i urin eller avføring.
Spesifikke populasjoner
Geriatriske pasienter
Hos 20 friske eldre forsøkspersoner som fikk 20 mg ACIPHEX tabletter med forsinket frigivelse én gang daglig i syv dager, ble AUC-verdiene omtrent doblet og Cmax økte med 60 % sammenlignet med verdier i en parallell yngre kontrollgruppe. Det var ingen tegn på legemiddelakkumulering etter administrering én gang daglig [se Bruk i spesifikk populasjon ].
Pediatriske pasienter
Farmakokinetikken til rabeprazol ble studert hos 12 ungdomspasienter med GERD i alderen 12 til 16 år, i en multisenterstudie. Pasientene fikk 20 mg ACIPHEX tabletter med forsinket frigivelse én gang daglig i fem eller syv dager. En tilnærmet 40 % økning i rabeprazoleksponering ble notert etter 5 til 7 dagers dosering sammenlignet med eksponeringen etter 1 dags dosering. Farmakokinetiske parametere hos ungdomspasienter med GERD 12 til 16 år var innenfor området som ble observert hos friske voksne personer.
Mannlige og kvinnelige pasienter og rase- eller etniske grupper
I analyser justert for kroppsmasse og høyde, viste rabeprazols farmakokinetikk ingen klinisk signifikante forskjeller mellom mannlige og kvinnelige forsøkspersoner. I studier som brukte forskjellige formuleringer av rabeprazol, var AUC0-∞-verdiene for friske japanske menn omtrent 50 til 60 % høyere enn verdier avledet fra sammenslåtte data fra friske menn i USA.
Pasienter med nedsatt nyrefunksjon
Hos 10 pasienter med stabil nyresykdom i sluttstadiet som krever vedlikeholdshemodialyse (kreatininclearance ≤5 ml/min/1,73 m²), ble det ikke observert noen klinisk signifikante forskjeller i farmakokinetikken til rabeprazol etter en enkelt 20 mg dose av ACIPHEX 20 mg tabletter med forsinket frigivelse. sammenlignet med 10 friske personer.
Pasienter med nedsatt leverfunksjon
I en enkeltdosestudie med 10 pasienter med mild til moderat nedsatt leverfunksjon (henholdsvis Child-Pugh klasse A og B) som ble administrert en enkeltdose på 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse, ble AUC0-24 omtrent doblet, eliminasjonen halveringstiden var 2 til 3 ganger høyere, og total kroppsclearance ble redusert til mindre enn halvparten sammenlignet med verdier hos friske menn.
en flerdosestudie med 12 pasienter med mild til moderat nedsatt leverfunksjon som ble administrert 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse én gang daglig i åtte dager, økte AUC0-∞- og Cmax-verdiene med ca. 20 % sammenlignet med verdier hos friske alders- og kjønnstilpassede fag. Disse økningene var ikke statistisk signifikante.
Det finnes ingen informasjon om rabeprazoldisponering hos pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh klasse C) [se Bruk i spesifikke populasjoner ].
Legemiddelinteraksjonsstudier
Kombinert administrering med antimikrobielle midler
Seksten friske forsøkspersoner genotypet som omfattende metabolisatorer med hensyn til CYP2C19 ble gitt 20 mg ACIPHEX tabletter med forsinket frigivelse, 1000 mg amoxicillin, 500 mg klaritromycin eller alle 3 legemidlene i en fireveis crossover-studie. Hver av de fire regimene ble administrert to ganger daglig i 6 dager. AUC og Cmax for klaritromycin og amoksicillin var ikke forskjellige etter kombinert administrering sammenlignet med verdier etter enkelt administrering. Imidlertid økte AUC og Cmax for rabeprazol med henholdsvis 11 % og 34 % etter kombinert administrering. AUC og Cmax for 14-hydroksyklaritromycin (aktiv metabolitt av klaritromycin) økte også med henholdsvis 42 % og 46 %. Denne økningen i eksponering for rabeprazol og 14-hydroksyklaritromycin forventes ikke å gi sikkerhetsproblemer.
Effekter av andre legemidler på Rabeprazol
Antacida
Samtidig administrering av ACIPHEX 20 mg tabletter med forsinket frigivelse og antacida ga ingen klinisk relevante endringer i plasmakonsentrasjonen av rabeprazol.
Effekter av Rabeprazol på andre legemidler
Studier på friske personer har vist at rabeprazol ikke har klinisk signifikante interaksjoner med andre legemidler som metaboliseres av CYP450-systemet, slik som teofyllin (CYP1A2) gitt som enkelt orale doser, diazepam (CYP2C9 og CYP3A4) som en enkelt intravenøs dose, og fenytoin ( CYP2C9 og CYP2C19) gitt som en enkelt intravenøs dose (med supplerende oral dosering). Steady state-interaksjoner mellom rabeprazol og andre legemidler som metaboliseres av dette enzymsystemet er ikke studert hos pasienter.
Klopidogrel
Klopidogrel metaboliseres til sin aktive metabolitt delvis av CYP2C19. En studie med friske personer inkludert CYP2C19 omfattende og middels metabolisatorer som fikk administrering én gang daglig av klopidogrel 75 mg samtidig med placebo eller med 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse (n=36), i 7 dager, ble utført. Gjennomsnittlig AUC for den aktive metabolitten til klopidogrel ble redusert med ca. 12 % (gjennomsnittlig AUC-ratio var 88 %, med 90 % KI på 81,7 til 95,5 %) når ACIPHEX tabletter med forsinket frigivelse ble administrert samtidig sammenlignet med administrering av klopidogrel og placebo [se NARKOTIKAHANDEL ].
Digoksin
Hos friske voksne forsøkspersoner (n=16) resulterte samtidig administrering av 20 mg rabeprazolnatrium-tabletter med forsinket frigjøring med 2,5 mg én gang daglige doser av digoksin ved steady state i ca. 29 % og 19 % økning i gjennomsnittlig Cmax og AUC(0- 24) av digoksin [se NARKOTIKAHANDEL ].
Ketokonazol
Hos friske voksne forsøkspersoner (n=19) resulterte samtidig administrasjon av 20 mg rabeprazolnatrium-tabletter med forsinket frigjøring ved steady state med en enkelt 400 mg oral dose ketokonazol i omtrent en gjennomsnittlig reduksjon på 31 % i både Cmax og AUC(0- inf) av ketokonazol [se NARKOTIKAHANDEL ].
Syklosporin
In vitro-inkubasjoner med humane levermikrosomer indikerte at rabeprazol hemmet cyklosporinmetabolismen med en IC50 på 62 mikromolar, en konsentrasjon som er over 50 ganger høyere enn Cmax hos friske frivillige etter 14 dagers dosering med 20 mg ACIPHEX 10mg forsinket tabletter. Denne graden av hemming er lik den av omeprazol ved ekvivalente konsentrasjoner.
Mikrobiologi
Følgende in vitro-data er tilgjengelige, men den kliniske betydningen er ukjent.
Rabeprazolnatrium, amoksicillin og klaritromycin som et regime med tre legemidler har vist seg å være aktive mot de fleste stammer av Helicobacter pylori in vitro og ved kliniske infeksjoner [se INDIKASJONER OG BRUK , Kliniske studier ].
Helicobacter pylori
Følsomhetstesting av H. pylori-isolater ble utført for amoxicillin og klaritromycin ved bruk av agarfortynningsmetodikk1, og minimumshemmende konsentrasjoner (MICs) ble bestemt.
Standardiserte følsomhetstestprosedyrer krever bruk av laboratoriekontrollmikroorganismer for å kontrollere de tekniske aspektene ved laboratorieprosedyrene.
Forekomst av antibiotikaresistente organismer blant kliniske isolater
Forbehandlingsmotstand
Klaritromycin forbehandlingsresistensrate (MIC ≥1 mcg/ml) mot H. pylori var 9 % (51/560) ved baseline i alle behandlingsgruppene kombinert. Mer enn 99 % (558/560) av pasientene hadde H. pylori-isolater som ble ansett for å være følsomme (MIC ≤0,25 mcg/ml) for amoksicillin ved baseline. To pasienter hadde baseline H. pylori-isolater med en amoxicillin MIC på 0,5 mcg/ml.
For informasjon om følsomhetstesting om Helicobacter pylori, se avsnittet Mikrobiologi i forskrivningsinformasjon for klaritromycin og amoksicillin.
Pasienter med vedvarende H. pylori-infeksjon etter behandling med rabeprazol, amoxicillin og klaritromycin vil sannsynligvis ha klaritromycinresistente kliniske isolater. Derfor bør klaritromycin-følsomhetstesting utføres når det er mulig. Hvis resistens mot klaritromycin er påvist eller følsomhetstesting ikke er mulig, bør alternativ antimikrobiell behandling settes i gang.
Amoxicillin-følsomhetstestresultater og kliniske/bakteriologiske resultater
den amerikanske multisenterstudien hadde mer enn 99 % (558/560) av pasientene H. pylori-isolater som ble ansett for å være følsomme (MIC ≤0,25 mcg/ml) for amoksicillin ved baseline. De to andre pasientene hadde baseline H. pylori isolater med en amoxicillin MIC på 0,5 mcg/ml, og begge isolatene var klaritromycin-resistente ved baseline; i ett tilfelle ble H. pylori utryddet. I 7- og 10-dagers behandlingsgruppene ble henholdsvis 75 % (107/145) og 79 % (112/142) av pasientene som hadde amoxicillin-følsomme MIC-er (≤0,25 mcg/ml) utryddet av H. pylori. . Ingen pasienter utviklet amoxicillin-resistent H. pylori under behandlingen.
Farmakogenomikk
en klinisk studie med evaluering av ACIPHEX tabletter med forsinket frigjøring hos voksne japanske pasienter kategorisert etter CYP2C19-genotype (n=6 per genotypekategori), var magesyresuppresjonen høyere hos dårlige metabolisatorer sammenlignet med omfattende metabolisatorer. Dette kan skyldes høyere plasmanivåer av rabeprazol hos dårlige metabolisatorer. Den kliniske relevansen av dette er ikke kjent. Hvorvidt interaksjoner mellom rabeprazolnatrium og andre legemidler som metaboliseres av CYP2C19 vil være forskjellig mellom omfattende metabolisatorer og dårlige metabolisatorer har ikke blitt studert.
Kliniske studier
Helbredelse av erosiv eller ulcerøs GERD hos voksne
en amerikansk, multisenter, randomisert, dobbeltblind, placebokontrollert studie ble 103 pasienter behandlet i opptil åtte uker med placebo, 10 mg, 20 mg eller 40 mg ACIPHEX tabletter med forsinket frigivelse én gang daglig. For denne og alle studier av GERD-helbredelse var det kun pasienter med GERD-symptomer og minst grad 2 øsofagitt (modifisert Hetzel-Dent-graderingsskala) som var kvalifisert for oppføring. Endoskopisk helbredelse ble definert som grad 0 eller 1. Hver rabeprazoldose var signifikant bedre enn placebo når det gjaldt å produsere endoskopisk helbredelse etter fire og åtte ukers behandling. Prosentandelen av pasienter som demonstrerte endoskopisk helbredelse var som følger:
tillegg var det en statistisk signifikant forskjell til fordel for ACIPHEX 10 mg, 20 mg og 40 mg doser sammenlignet med placebo i uke 4 og 8 med hensyn til fullstendig oppløsning av GERD halsbrannfrekvens (p≤0,026). Alle ACIPHEX-gruppene rapporterte signifikant høyere grad av fullstendig oppløsning av alvorlighetsgraden av GERD-halsbrann på dagtid sammenlignet med placebo ved uke 4 og 8 (p≤0,036). Gjennomsnittlig reduksjon fra baseline i daglig syrenøytraliserende dose var statistisk signifikant for alle ACIPHEX-gruppene sammenlignet med placebo både i uke 4 og 8 (p≤0,007).
I en nordamerikansk multisenter, randomisert, dobbeltblind, aktiv-kontrollert studie av 336 pasienter, var prosentandelen av pasienter som ble helbredet ved endoskopi etter fire og åtte ukers behandling statistisk overlegen hos pasientene behandlet med ACIPHEX tabletter med forsinket frigjøring sammenlignet med ranitidin. :
En dose på 20 mg én gang daglig av ACIPHEX tabletter med forsinket frigivelse var signifikant mer effektiv enn ranitidin 150 mg fire ganger daglig i prosentandelen av pasienter med fullstendig oppløsning av halsbrann i uke 4 og 8 (p
Den anbefalte dosen av ACIPHEX 10 mg tabletter med forsinket frigivelse er 20 mg én gang daglig i 4 til 8 uker.
Langsiktig vedlikehold av helbredelse av erosiv eller ulcerøs GERD hos voksne
Det langsiktige vedlikeholdet av helbredelse hos pasienter med erosiv eller ulcerøs GERD som tidligere ble helbredet med gastrisk antisekretorisk terapi ble vurdert i to amerikanske, multisenter, randomiserte, dobbeltblinde, placebokontrollerte studier med identisk design av 52 ukers varighet. De to studiene randomiserte henholdsvis 209 og 285 pasienter til å motta enten 10 mg eller 20 mg ACIPHEX tabletter med forsinket frigivelse én gang daglig eller placebo. Som vist i tabell 10 og 11 nedenfor, var pasienter behandlet med ACIPHEX tabletter med forsinket frigjøring signifikant bedre enn placebo i begge studiene med hensyn til opprettholdelse av helbredelse av GERD og andelen pasienter som forble fri for halsbrannsymptomer ved 52 uker. Den anbefalte dosen av ACIPHEX 20 mg tabletter med forsinket frigivelse er 20 mg én gang daglig.
Behandling av symptomatisk GERD hos voksne
To amerikanske, multisenter, dobbeltblinde, placebokontrollerte studier ble utført på 316 voksne pasienter med halsbrann på dagtid og om natten. Pasienter rapporterte 5 eller flere perioder med moderat til svært alvorlig halsbrann under placebobehandlingsfasen uken før randomisering. Pasienter ble bekreftet ved endoskopi å ikke ha noen esophageal erosjoner.
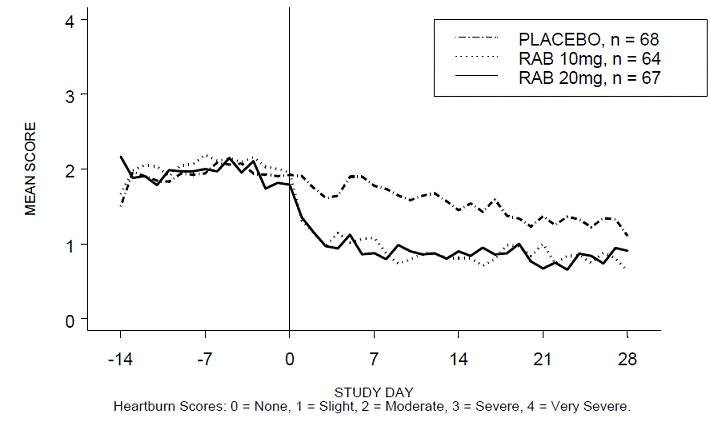
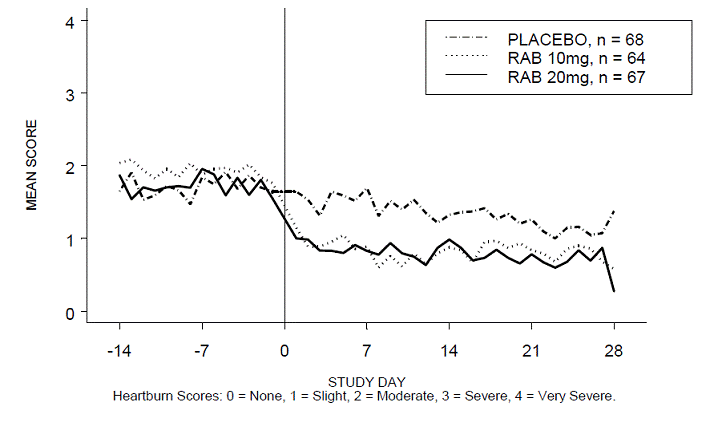
Prosentandelen av halsbrannfrie perioder på dagtid og/eller nattetid var høyere med 20 mg ACIPHEX 20 mg tabletter med forsinket frigjøring sammenlignet med placebo i løpet av de 4 ukene med studien i studie RABUSA-2 (47 % vs. 23 %) og studie RAB-USA- 3 (52 % vs. 28 %). Den gjennomsnittlige reduksjonen fra baseline i gjennomsnittlig score for halsbrann på dagtid og natt var signifikant høyere for ACIPHEX 20 mg sammenlignet med placebo ved uke 4. Grafiske visninger som viser gjennomsnittlig dag- og nattscore er gitt i figur 2 til 5.
Figur 2: Gjennomsnittlig mål for halsbrann på dagtid RAB-USA-2
Figur 3: Gjennomsnittlig score for halsbrann om natten RAB-USA-2
Figur 4: Gjennomsnittlig mål for halsbrann på dagtid RAB-USA-3 Figur 3: Gjennomsnittlig mål for halsbrann på dagtid RAB - USA –3
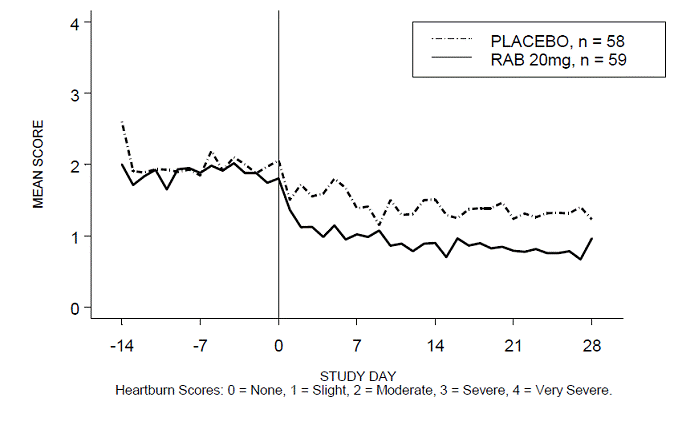
Figur 5: Gjennomsnittlig score for halsbrann om natten RAB-USA-3
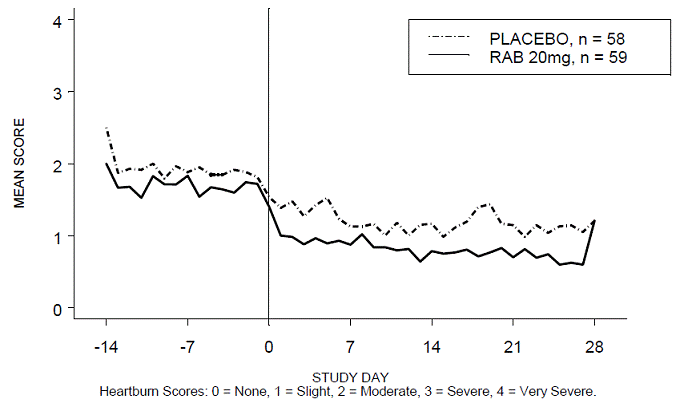
I tillegg viste den kombinerte analysen av disse to studiene at 20 mg ACIPHEX 10 mg tabletter med forsinket frigivelse forbedret andre GERD-assosierte symptomer (regurgitasjon, raping og tidlig metthetsfølelse) signifikant innen uke 4 sammenlignet med placebo (alle p-verdier
En dose på 20 mg ACIPHEX 20 mg tabletter med forsinket frigivelse reduserte også signifikant daglig syrenøytraliserende forbruk versus placebo over 4 uker (p
Den anbefalte dosen av ACIPHEX tabletter med forsinket frigivelse er 20 mg én gang daglig i 4 uker.
Tilheling av duodenalsår hos voksne
en amerikansk, randomisert, dobbeltblind, multisenterstudie som vurderte effektiviteten av 20 mg og 40 mg ACIPHEX 10 mg tabletter med forsinket frigjøring én gang daglig versus placebo for å helbrede endoskopisk definerte duodenalsår, ble 100 pasienter behandlet i opptil fire uker. ACIPHEX var signifikant bedre enn placebo når det gjaldt tilheling av duodenalsår. Prosentandelen av pasienter med endoskopisk helbredelse er presentert nedenfor:
Ved uke 2 og 4 rapporterte signifikant flere pasienter i gruppene ACIPHEX 20 og 40 mg fullstendig oppløsning av sårsmertefrekvens (p≤0,018), alvorlighetsgrad av smerte på dagtid (p≤0,023) og alvorlighetsgrad av smerte om natten (p≤0,035) sammenlignet med placebopasienter. Det eneste unntaket var 40 mg-gruppen versus placebo ved uke 2 for smertefrekvens i duodenalsår (p=0,094). Signifikante forskjeller i oppløsning av smerte på dagtid og natt ble notert i begge ACIPHEX-gruppene i forhold til placebo ved slutten av den første uken av studien. Signifikante reduksjoner i daglig bruk av antacida ble også notert i begge ACIPHEX-gruppene sammenlignet med placebo ved uke 2 og 4 (p
En internasjonal randomisert, dobbeltblind, aktiv-kontrollert studie ble utført med 205 pasienter som sammenlignet 20 mg ACIPHEX tabletter med forsinket frigivelse én gang daglig med 20 mg omeprazol én gang daglig. Studien ble designet for å gi minst 80 % kraft for å utelukke en forskjell på minst 10 % mellom ACIPHEX 10 mg og omeprazol, forutsatt fire ukers helbredende responsrate på 93 % for begge grupper. Hos pasienter med endoskopisk definerte duodenalsår behandlet i opptil fire uker, var ACIPHEX sammenlignbar med omeprazol når det gjaldt heling av duodenalsår. Prosentandelen av pasienter med endoskopisk helbredelse etter to og fire uker er presentert nedenfor:
ACIPHEX 20 mg og omeprazol var sammenlignbare når det gjaldt å gi fullstendig oppløsning av symptomene.
Den anbefalte dosen av ACIPHEX 20 mg tabletter med forsinket frigivelse er 20 mg én gang daglig i 4 uker.
Helicobacter pylori utryddelse hos pasienter med magesårsykdom eller symptomatisk ikke-ulcussykdom hos voksne
Den amerikanske multisenterstudien var en dobbeltblind, parallell-gruppe sammenligning av ACIPHEX tabletter med forsinket frigivelse, amoxicillin og klaritromycin i 3, 7 eller 10 dager vs. omeprazol, amoksicillin og klaritromycin i 10 dager. Behandlingen besto av rabeprazol 20 mg to ganger daglig, amoxicillin 1000 mg to ganger daglig og klaritromycin 500 mg to ganger daglig (RAC) eller omeprazol 20 mg to ganger daglig, amoksicillin 1000 mg to ganger daglig og klaritromycin 500 mg to ganger daglig (OAC). Pasienter med H. pylori-infeksjon ble stratifisert i forholdet 1:1 for de med magesårsykdom (aktiv eller har hatt magesår de siste fem årene) [PUD] og de som var symptomatiske, men uten magesårsykdom [NPUD], som bestemt ved øvre gastrointestinal endoskopi. De totale H. pylori-utryddelsesratene, definert som negativ 13C-UBT for H. pylori ≥6 uker fra slutten av behandlingen, er vist i følgende tabell. Utryddelsesratene i 7-dagers og 10-dagers RAC-regimer ble funnet å være lik 10-dagers OAC-regimer ved bruk av enten Intent-to-Treat (ITT) eller Per-Protocol (PP) populasjoner. Eradikasjonsrater i RAC 3-dagers regimet var dårligere enn de andre regimene.
Den anbefalte dosen av ACIPHEX 20 mg tabletter med forsinket frigivelse er 20 mg to ganger daglig med amoxicillin og klaritromycin i 7 dager.
Patologiske hypersekretoriske tilstander, inkludert Zollinger-Ellison syndrom hos voksne
Tolv pasienter med idiopatisk gastrisk hypersekresjon eller Zollinger-Ellisons syndrom har blitt behandlet med suksess med ACIPHEX 10 mg tabletter med forsinket frigivelse i doser fra 20 til 120 mg i opptil 12 måneder. ACIPHEX 10mg ga tilfredsstillende hemming av magesyresekresjon hos alle pasienter og fullstendig oppløsning av tegn og symptomer på syre-peptisk sykdom der det er tilstede. ACIPHEX 20mg forhindret også tilbakefall av gastrisk hypersekresjon og manifestasjoner av syre-peptisk sykdom hos alle pasienter. De høye dosene av ACIPHEX som ble brukt til å behandle denne lille gruppen av pasienter med gastrisk hypersekresjon ble godt tolerert.
Den anbefalte startdosen av ACIPHEX tabletter med forsinket frigivelse er 60 mg én gang daglig.
REFERANSER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder for fortynning Antimikrobielle mottakelighetstester for bakterier som vokser aerobt; Godkjent standard - tiende utgave. CLSI Document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
PASIENTINFORMASJON
ACIPHEX® (a-se-feks) (rabeprazolnatrium) tabletter med forsinket frigjøring
Hva er den viktigste informasjonen jeg bør vite om ACIPHEX 10mg?
Du bør ta ACIPHEX 20 mg nøyaktig som foreskrevet, med lavest mulig dose og i kortest mulig tid.
ACIPHEX 20mg kan hjelpe dine syrerelaterte symptomer, men du kan fortsatt ha alvorlige mageproblemer. Snakk med legen din.
ACIPHEX 20mg kan forårsake alvorlige bivirkninger, inkludert:
- . En type nyreproblem (akutt tubulointerstitiell nefritt). Noen personer som tar medisiner med protonpumpehemmere (PPI), inkludert ACIPHEX, kan utvikle et nyreproblem kalt akutt tubulointerstitiell nefritt som kan oppstå når som helst under behandling med ACIPHEX. Ring legen din med en gang hvis du har en reduksjon i mengden du tisser eller hvis du har blod i urinen. . Diaré forårsaket av en infeksjon (Clostridium difficile) i tarmene dine. Ring legen din med en gang hvis du har vannaktig avføring eller magesmerter som ikke går over. Du har kanskje feber eller ikke. . Benbrudd (hofte, håndledd eller ryggrad). Benbrudd i hoften, håndleddet eller ryggraden kan forekomme hos personer som tar flere daglige doser av PPI-medisiner og over en lengre periode (et år eller lenger). Fortell legen din dersom du har et beinbrudd, spesielt i hoften, håndleddet eller ryggraden. . Visse typer lupus erythematosus. Lupus erythematosus er en autoimmun lidelse (kroppens immunceller angriper andre celler eller organer i kroppen). Noen mennesker som tar PPI-medisiner, inkludert ACIPHEX, kan utvikle visse typer lupus erythematosus eller ha forverring av lupus de allerede har. Ring legen din med en gang hvis du har nye eller forverrede leddsmerter eller utslett på kinnene eller armene som blir verre i solen.
Snakk med legen din om risikoen for disse alvorlige bivirkningene.
ACIPHEX 10mg kan ha andre alvorlige bivirkninger. Se "Hva er de mulige bivirkningene av ACIPHEX 10mg?"
Hva er ACIPHEX 20mg?
ACIPHEX 10mg er et reseptbelagt legemiddel kalt en protonpumpehemmer (PPI).
ACIPHEX 20mg reduserer mengden syre i magen.
Hos voksne, ACIPHEX brukes til:
- . 8 uker opptil 16 uker for å helbrede syrerelatert skade på slimhinnen i spiserøret (kalt erosiv øsofagitt eller EE) og for å lindre symptomer, som halsbrannsmerter. . opprettholde tilheling av spiserøret og lindring av symptomer relatert til EE. Det er ikke kjent om ACIPHEX 20mg er trygt og effektivt ved bruk i mer enn 12 måneder (1 år). . opptil 4 uker for å behandle halsbrann på dagtid og om natten og andre symptomer som oppstår med gastroøsofageal reflukssykdom (GERD). . opptil 4 uker for helbredelse og lindring av symptomer på duodenalsår. . 7 dager med visse antibiotikamedisiner for å behandle en infeksjon og magesår (duodenal) forårsaket av bakterier kalt H. pylori. . langtidsbehandling av tilstander der magen lager for mye syre. Dette inkluderer en sjelden tilstand kalt Zollinger-Ellisons syndrom.
Hos ungdom 12 år og eldre, ACIPHEX 10mg brukes i opptil 8 uker for å behandle symptomer på GERD.
Det er ikke kjent om ACIPHEX er trygt og effektivt hos barn under 12 år for annen bruk.
ACIPHEX tabletter med forsinket frigivelse skal ikke brukes til barn under 12 år.
Ikke ta ACIPHEX 10mg hvis du er:
- . allergisk mot rabeprazol, andre PPI-medisiner eller noen av ingrediensene i ACIPHEX. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser. . tar et legemiddel som inneholder rilpivirin (EDURANT, COMPLERA, ODEFSEY) som brukes til å behandle HIV-1 (humant immunsviktvirus).
Før du tar ACIPHEX, fortell legen din om alle dine medisinske tilstander, inkludert hvis du:
- . har lave magnesiumnivåer, lave kalsiumnivåer og lave kaliumnivåer i blodet. . har leverproblemer. . er gravid eller planlegger å bli gravid. Det er ikke kjent om ACIPHEX 20mg kan skade det ufødte barnet ditt. . ammer eller planlegger å amme. Det er ikke kjent om ACIPHEX 10mg går over i morsmelk. Snakk med legen din om den beste måten å mate babyen din på hvis du tar ACIPHEX.
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Spesielt fortell legen din hvis du tar et antibiotikum som inneholder klaritromycin eller amoxicillin eller hvis du tar warfarin (COUMADIN, JANTOVEN), metotreksat (OTREXUP, RASUVO, TREXALL, XATMEP), digoksin (LANOXIN) eller en vannpille (vanndrivende).
Hvordan skal jeg ta ACIPHEX?
- . Ta ACIPHEX nøyaktig som foreskrevet. . ACIPHEX tas vanligvis 1 gang hver dag. Legen din vil fortelle deg når på dagen du skal ta ACIPHEX, basert på din medisinske tilstand. . ACIPHEX 10 mg kan tas med eller uten mat. Legen din vil fortelle deg om du skal ta dette legemidlet med eller uten mat basert på din medisinske tilstand. . Svelg hver ACIPHEX 20 mg tablett hele. Ikke tygg, knus eller del ACIPHEX 10 mg tabletter. Fortell legen din dersom du ikke kan svelge tabletter hele. . Hvis du glemmer en dose ACIPHEX 10 mg, ta den så snart som mulig. Hvis det nesten er tid for neste dose, bør du ikke ta den glemte dosen. Du bør ta neste dose til vanlig tid. Ikke ta 2 doser samtidig. . Hvis du tar for mye ACIPHEX 20mg, ring legen din eller giftkontrollsenteret på 1-800-222-1222 med en gang, eller gå til nærmeste legevakt. . Hvis legen din foreskriver antibiotika med ACIPHEX, les pasientinformasjonen som følger med antibiotikamedisinene før du tar dem.
Hva er de mulige bivirkningene av ACIPHEX 20mg?
ACIPHEX 10mg kan forårsake alvorlige bivirkninger, inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om ACIPHEX 20mg?" . Interaksjon med warfarin. Å ta warfarin med en PPI-medisin kan føre til økt risiko for blødning og død. Hvis du tar warfarin, kan legen din sjekke blodet ditt for å se om du har økt risiko for blødning. Hvis du tar warfarin under behandling med ACIPHEX 20 mg, fortell legen din umiddelbart dersom du har tegn eller symptomer på blødning, inkludert:
- . smerte, hevelse eller ubehag . hodepine, svimmelhet eller svakhet . uvanlige blåmerker (blåmerker som skjer uten kjent årsak eller som vokser i størrelse) . neseblod . blødende tannkjøtt . blødning fra kutt tar lang tid å stoppe . menstruasjonsblødninger som er tyngre enn normalt . rosa eller brun urin . rød eller svart avføring . hoster opp blod . oppkast blod eller oppkast som ser ut som kaffegrut
- . Hudutslett som kan ha blemmer, avskalling eller blødning på noen del av huden din (inkludert leppene, øynene, munnen, nesen, kjønnsorganene, hendene eller føttene). . Du kan også ha feber, frysninger, kroppssmerter, kortpustethet eller forstørrede lymfeknuter.
Slutt å ta ACIPHEX 20mg og ring legen din umiddelbart. Disse symptomene kan være det første tegn på en alvorlig hudreaksjon.
De vanligste bivirkningene av ACIPHEX 20mg hos voksne inkluderer: smerte, sår hals, gass, infeksjon og forstoppelse.
De vanligste bivirkningene av ACIPHEX hos ungdom 12 år og eldre inkluderer: hodepine, diaré, kvalme, oppkast og magesmerter.
Dette er ikke alle de mulige bivirkningene av ACIPHEX. Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare ACIPHEX?
Oppbevar ACIPHEX-tabletter på et tørt sted ved romtemperatur mellom 20 °C til 25 °C (68 °F til 77 °F).
Oppbevar ACIPHEX 20mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av ACIPHEX.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk ACIPHEX for en tilstand det ikke er foreskrevet for. Ikke gi ACIPHEX til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Du kan spørre legen din eller apoteket om informasjon om ACIPHEX som er skrevet for helsepersonell.
Hva er ingrediensene i ACIPHEX 10mg?
Aktiv ingrediens: rabeprazolnatrium
Inaktive ingredienser: karnaubavoks, krospovidon, diacetylerte monoglyserider, etylcellulose, hydroksypropylcellulose, hypromelloseftalat, magnesiumstearat, mannitol, natriumhydroksid, natriumstearylfumarat, talkum og titandioksid. Gult jernoksid er fargestoffet for tablettbelegget. Rødt jernoksid er blekkpigmentet.
Denne medisinveiledningen er godkjent av US Food and Drug Administration. Revidert: 03/2022
