Prevacid 15mg, 30mg Lansoprazole Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Prevacid og hvordan brukes det?
Prevacid 15mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på mage- og tarmsår og for å redusere mengden syre som produseres i magen. Prevacid 15mg kan brukes alene eller sammen med andre medisiner.
- . Prevacid 15mg er en protonpumpehemmer.
Hva er de mulige bivirkningene av Prevacid 30mg?
Prevacid 30mg kan forårsake alvorlige bivirkninger inkludert:
- . sterke magesmerter, . diaré som inneholder blod, . anfall (kramper, . problemer med vannlating, . blod i urinen, . opphovning, . rask vektøkning, . svimmelhet, . rask eller uregelmessig hjertefrekvens, . rister, . rykkende muskelbevegelser, . føler seg nervøs, . muskelkramper eller spasmer i hender eller føtter, . hoste, . føler at du blir kvalt, . leddsmerter, og . hudutslett på kinnene eller armene som forverres i sollys
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Prevacid 15mg inkluderer:
- . kvalme, . magesmerter, . diaré, . forstoppelse, og . hodepine
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Prevacid. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
FORORD (lansoprazol) oralt desintegrerende tabletter med forsinket frigivelse
BESKRIVELSE
Den aktive ingrediensen i PREVACID 30 mg kapsler med forsinket frigjøring og PREVACID 15 mg SoluTab orale desintegrasjonstabletter med forsinket frigivelse er lansoprazol, en substituert benzimidazol, 2-[[[3-metyl-4-(2,2,2trifluoretoksy]-2-pyridyl]-2- metyl] sulfinyl] benzimidazol, en forbindelse som hemmer magesyresekresjon. Dens empiriske formel er C16H14F3N3O2S med en molekylvekt på 369,37. Lansoprazol har følgende struktur:
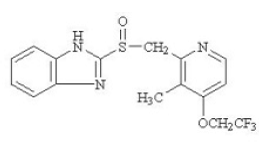
Lansoprazol er et hvitt til brunhvitt luktfritt krystallinsk pulver som smelter ved nedbrytning ved ca. 166°C. Lansoprazol er fritt løselig i dimetylformamid; løselig i metanol; lite løselig i etanol; lett løselig i etylacetat, diklormetan og acetonitril; svært lite løselig i eter, og praktisk talt uløselig i heksan og vann.
Lansoprazol er stabilt når det utsettes for lys i opptil to måneder. Nedbrytningshastigheten av forbindelsen i en vandig løsning øker med synkende pH. Nedbrytningshalveringstiden for legemiddelsubstansen i en vandig løsning ved 25°C er ca. 0,5 timer ved pH 5,0 og ca. 18 timer ved pH 7,0.
PREVACID leveres i kapsler med forsinket frigjøring og PREVACID 15 mg SoluTab leveres i oralt desintegrerende tabletter med forsinket frigivelse (SoluTab) for oral administrering.
PREVACID er tilgjengelig i to doseringsstyrker: 15 og 30 mg lansoprazol per kapsel. Hver kapsel med forsinket frigjøring inneholder enterisk belagte granuler bestående av 15 eller 30 mg lansoprazol (aktiv ingrediens) og følgende inaktive ingredienser: sukkerkule, sukrose, metakrylsyrekopolymer, lavsubstituert hydroksypropylcellulose, stivelse, magnesiumkarbonat, talkum, polyetylen glykol, titandioksid, polysorbat 80, hydroksypropylcellulose, kolloidalt silisiumdioksid, D&C Red No. 28, FD&C Blue No. 1, FD&C Green No. 31, og FD&C Red No. 40.
PREVACID 30mg SoluTab er tilgjengelig i to doseringsstyrker: 15 og 30 mg lansoprazol per tablett. Hver oralt desintegrerende tablett med forsinket frigjøring inneholder enterisk belagte mikrogranuler bestående av 15 eller 30 mg lansoprazol (aktiv ingrediens) og følgende inaktive ingredienser: mannitol, metakrylsyre, hydroksypropylcellulose, laktosemonohydrat-mikrokrystallinsk cellulosesfære, trikroetylcellulosesitrat, polyakrylat, magnesiumkarbonat, aspartam2, glycerylmonostearat, hypromellose, magnesiumstearat, sitronsyre, titandioksid, talkum, kunstig jordbærsmak, polyetylenglykol, polysorbat 80 og jernoksid.
1PREVACID 15 mg kun kapsler. 2Phenylketonurics: PREVACID SoluTab inneholder fenylalanin 2,5 mg per 15 mg tablett og 5,1 mg per 30 mg tablett.
INDIKASJONER
Behandling av aktivt duodenalsår
PREVACID og PREVACID SoluTab er indisert hos voksne for korttidsbehandling (i fire uker) for helbredelse og symptomlindring av aktivt duodenalsår [se Kliniske studier ].
Utryddelse av H. pylori for å redusere risikoen for tilbakefall av duodenalsår
Trippelterapi: PREVACID eller PREVACID SoluTab/amoxicillin/klaritromycin
PREVACID eller PREVACID 30 mg SoluTab i kombinasjon med amoksicillin pluss klaritromycin som trippelbehandling er indisert hos voksne for behandling av pasienter med H. pylori-infeksjon og duodenalsårsykdom (aktiv eller ett års historie med duodenalsår) for å utrydde H. pylori. Utryddelse av H. pylori har vist seg å redusere risikoen for tilbakefall av duodenalsår [se Kliniske studier ].
Vennligst se den fullstendige forskrivningsinformasjonen for amoxicillin og klaritromycin.
Dobbel terapi: PREVACID eller PREVACID SoluTab/amoxicillin
PREVACID eller PREVACID 15 mg SoluTab i kombinasjon med amoksicillin som dobbel terapi er indisert hos voksne for behandling av pasienter med H. pylori-infeksjon og duodenalsårsykdom (aktiv eller ett års historie med duodenalsår) som enten er allergiske eller intolerante overfor klaritromycin eller hos hvem resistens mot klaritromycin er kjent eller mistenkt (se forskrivningsinformasjonen for klaritromycin, avsnittet Mikrobiologi). Utryddelse av H. pylori har vist seg å redusere risikoen for tilbakefall av duodenalsår [se Kliniske studier ].
Vennligst se den fullstendige forskrivningsinformasjonen for amoxicillin.
Vedlikehold av helbredede duodenalsår
PREVACID og PREVACID SoluTab er indisert hos voksne for å opprettholde tilheling av duodenalsår. Kontrollerte studier strekker seg ikke utover 12 måneder [se Kliniske studier ].
Behandling av aktivt godartet magesår
PREVACID og PREVACID 30 mg SoluTab er indisert til voksne for korttidsbehandling (opptil åtte uker) for helbredelse og symptomlindring av aktivt godartet magesår [se Kliniske studier ].
Heling av NSAID-assosiert magesår
PREVACID 30mg og PREVACID SoluTab er indisert til voksne for behandling av NSAID-assosiert magesår hos pasienter som fortsetter bruk av NSAIDs. Kontrollerte studier varte ikke lenger enn åtte uker [se Kliniske studier ].
Risikoreduksjon av NSAID-assosiert magesår
PREVACID 15mg og PREVACID SoluTab er indisert hos voksne for å redusere risikoen for NSAID-assosierte magesår hos pasienter med dokumentert magesår i anamnesen som trenger bruk av NSAID. Kontrollerte studier strakk seg ikke utover 12 uker [se Kliniske studier ].
Behandling av symptomatisk gastroøsofageal reflukssykdom (GERD)
PREVACID 15mg og PREVACID 30mg SoluTab er indisert for korttidsbehandling hos voksne og pediatriske pasienter i alderen 12 til 17 år (opptil åtte uker) og pediatriske pasienter i alderen 1 til 11 år (opptil 12 uker) for behandling av halsbrann og andre symptomer assosiert med GERD [se Kliniske studier ].
Behandling av erosiv øsofagitt (EE)
PREVACID 15mg og PREVACID 30mg SoluTab er indisert for korttidsbehandling hos voksne og pediatriske pasienter i alderen 12 til 17 år (opptil åtte uker) og pediatriske pasienter i alderen 1 til 11 år (opptil 12 uker) for helbredelse og symptomlindring av alle karakterer av EE.
For voksne som ikke helbreder med PREVACID 30mg eller PREVACID 15mg SoluTab i åtte uker (5 til 10%), kan det være nyttig å gi ytterligere åtte ukers behandling. Hvis det er et tilbakefall av erosiv øsofagitt, kan en ytterligere åtte ukers kur med PREVACID 30 mg eller PREVACID SoluTab vurderes [se Kliniske studier ].
Vedlikehold av helbredelse av EE
PREVACID og PREVACID SoluTab er indisert til voksne for å opprettholde helbredelse av EE. Kontrollerte studier strakk seg ikke utover 12 måneder [se Kliniske studier ].
Patologiske hypersekretoriske tilstander inkludert Zollinger-Ellison syndrom (ZES)
PREVACID 15mg og PREVACID SoluTab er indisert til voksne for langtidsbehandling av patologiske hypersekretoriske tilstander, inkludert Zollinger-Ellisons syndrom [se Kliniske studier ].
DOSERING OG ADMINISTRASJON
Anbefalt voksendosering etter indikasjon
Anbefalt pediatrisk dosering etter indikasjon
Pediatriske pasienter i alderen 1 til 11 år
I kliniske studier ble ikke PREVACID administrert utover 12 uker hos 1 til 11 åringer. Det er ikke kjent om PREVACID er trygt og effektivt hvis det brukes lenger enn anbefalt varighet. Ikke overskrid anbefalt dose og bruksvarighet hos pediatriske pasienter som skissert nedenfor [se Bruk i spesifikke populasjoner ].
Nedsatt leverfunksjon
Den anbefalte dosen er 15 mg oralt daglig hos pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh C) [se Bruk i spesifikke populasjoner ].
Viktig administrasjonsinformasjon
- . Ta PREVACID eller PREVACID 30mg SoluTab før måltider. . Ikke knus eller tygg PREVACID 15mg kapsel eller PREVACID 30mg SoluTab. . Ta PREVACID eller PREVACID 30 mg SoluTab minst 30 minutter før sukralfat [se NARKOTIKAHANDEL ]. . Antacida kan brukes samtidig med PREVACID eller PREVACID SoluTab. . Glemte doser: Hvis en dose glemmes, gis så snart som mulig. Imidlertid, hvis neste planlagte dose er ventet, ikke ta den glemte dosen, og ta neste dose i tide. Ikke ta to doser på en gang for å gjøre opp for en glemt dose.
PREVACID kapsler
- . Svelg hele; ikke tygg. . For pasienter som har problemer med å svelge kapsler, kan PREVACID kapsler åpnes og administreres oralt eller via en nasogastrisk sonde i myk mat eller væsker spesifisert nedenfor. . Administrering av PREVACID i andre matvarer eller væsker enn de som er diskutert nedenfor er ikke studert klinisk og anbefales derfor ikke.
Administrasjon i myk mat (eplemos, ENSURE pudding, cottage cheese, yoghurt eller silte pærer):
. Åpne kapsel. . Dryss intakte granulat på en spiseskje med enten eplemos, ENSURE pudding, cottage cheese, yoghurt eller silte pærer. . Svelg umiddelbart.Administrering i væsker (eplejuice, appelsinjuice eller tomatjuice):
. Åpne kapsel. . Dryss intakte granuler i et lite volum av enten eplejuice, appelsinjuice eller tomatjuice (60 ml – ca. to unser). . Bland kort. . Svelg umiddelbart. . For å sikre fullstendig tilførsel av dosen, skyll glasset med to eller flere volumer juice og svelg innholdet umiddelbart.Administrering med eplejuice gjennom en nasogastrisk sonde (≥16 fransk)
. Åpne kapsel. . Dryss intakte granuler i 40 ml eplejuice. . Bland kort. . Trekk opp blandingen med en sprøyte med kateterspiss. . Injiser gjennom den nasogastriske sonden inn i magen. . Skyll med ekstra eplejuice for å tømme røret.PREVACID 15mg SoluTab
- . Ikke knekk eller kutt. . Plasser tabletten på tungen, la den gå i oppløsning, med eller uten vann, til mikrogranulene kan svelges. Ikke tygg mikrogranulene. . Nettbrettet desintegrerer vanligvis på mindre enn ett minutt. . Alternativt, for barn eller andre pasienter som har problemer med å svelge tabletter, kan PREVACID SoluTab administreres med vann via oral sprøyte eller NG-slange som følger:
Administrering med vann i en oral sprøyte
. Plasser en 15 mg tablett i oral sprøyte og trekk opp 4 mL vann, eller legg en 30 mg tablett i oral sprøyte og trekk opp 10 mL vann. . Rist forsiktig for å gi en rask spredning. . Etter at tabletten er dispergert, administrer innholdet i munnen innen 15 minutter etter blanding. Ikke oppbevar vann- og mikrogranulatblandingen for senere bruk. . Fyll sprøyten på nytt med ca. 2 mL (5 mL for 30 mg tabletten) vann, rist forsiktig og administrer eventuelt gjenværende innhold.Administrering med vann via et NG-rør (≥8 fransk)
. Plasser en 15 mg tablett i en kateterspisssprøyte og trekk opp 4 mL vann, eller plasser en 30 mg tablett i en kateterspisssprøyte og trekk opp 10 mL vann. . Rist forsiktig for å gi en rask spredning. . Etter at tabletten er dispergert, rist kateterspisssprøyten forsiktig for å forhindre at mikrogranulene setter seg, og injiser blandingen umiddelbart gjennom NG-røret inn i magen innen 15 minutter etter blanding. Ikke oppbevar vann- og mikrogranulatblandingen for senere bruk. . Fyll igjen kateterspisssprøyten med ca. 5 ml vann, rist forsiktig og skyll røret.HVORDAN LEVERES
Doseringsformer og styrker
PREVACID 15mg kapsler med forsinket frigjøring
- . 15 mg styrke er en ugjennomsiktig, rosa og grønn kapsel merket med "TAP" og "PREVACID 15". . 30 mg styrke er en ugjennomsiktig, rosa og svart kapsel merket med "TAP" og "PREVACID 30".
PREVACID 30mg SoluTab oralt desintegrerende tabletter med forsinket frigivelse
- . Styrken 15 mg er en hvit til gulaktig hvit, ubestrøget rund tablett som inneholder oransje til mørkebrune prikker med "15" preget på den ene siden. . Styrken 30 mg er en hvit til gulaktig hvit, ubestrøget rund tablett som inneholder oransje til mørkebrune prikker med "30" preget på den ene siden.
Oppbevaring og håndtering
PREVACID kapsler med forsinket frigjøring , 15 mg, er ugjennomsiktige, rosa og grønne med "TAP" og "PREVACID 15" påtrykt på kapslene. 30 mg-kapslene med forsinket frigjøring er ugjennomsiktige, rosa og svarte med "TAP" og "PREVACID 30" påtrykt på kapslene. De er tilgjengelige som følger:
PREVACID 30mg SoluTab oralt desintegrerende tabletter med forsinket frigivelse , 15 mg, er hvite til gulhvite, runde, ikke-drasjerte tabletter som inneholder oransje til mørkebrune flekker, med "15" preget på den ene siden av tabletten. De 30 mg er hvite til gulhvite, runde, ikke-drasjerte tabletter som inneholder oransje til mørkebrune prikker, med "30" preget på den ene siden av tabletten. Nettbrettene er tilgjengelige som følger:
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F)[se USP kontrollert romtemperatur ].
Distribuert av: Takeda Pharmaceuticals America, Inc., Deerfield, IL 60015. Revidert: Jun 2018
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i merkingen:
- . Akutt Tubulointerstitiell nefritis [se ADVARSLER OG FORHOLDSREGLER ] . Clostridium difficile-assosiert diaré [se ADVARSLER OG FORHOLDSREGLER ] . Benbrudd [se ADVARSLER OG FORHOLDSREGLER ] . Alvorlige kutane bivirkninger [se ADVARSLER OG FORHOLDSREGLER ] . Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ] . Cyanokobalamin (vitamin B12) mangel [se ADVARSLER OG FORHOLDSREGLER ] . Hypomagnesemi og mineralmetabolisme [se ADVARSLER OG FORHOLDSREGLER ] . Fundic kjertelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
På verdensbasis har over 10 000 pasienter blitt behandlet med PREVACID 30 mg i fase 2 eller fase 3 kliniske studier som involverer ulike doser og behandlingsvarigheter. Generelt har behandling med PREVACID 30 mg blitt godt tolerert i både korttids- og langtidsstudier.
Følgende bivirkninger ble rapportert av den behandlende legen for å ha en mulig eller sannsynlig relasjon til medikamentet hos 1 % eller flere av PREVACID-behandlede pasienter og forekom i større grad hos PREVACID-behandlede pasienter enn placebo-behandlede pasienter i tabell 1.
Hodepine ble også sett med mer enn 1 % forekomst, men var mer vanlig på placebo. Forekomsten av diaré var lik mellom pasienter som fikk placebo og pasienter som fikk 15 og 30 mg PREVACID, men høyere hos pasientene som fikk 60 mg PREVACID (henholdsvis 2,9, 1,4, 4,2 og 7,4 %).
Den hyppigst rapporterte mulige eller sannsynligvis behandlingsrelaterte bivirkningen under vedlikeholdsbehandling var diaré.
risikoreduksjonsstudien av PREVACID for NSAID-assosierte magesår, var forekomsten av diaré for pasienter behandlet med PREVACID 30 mg, misoprostol og placebo henholdsvis 5, 22 og 3 %.
En annen studie for samme indikasjon, der pasienter tok enten en COX-2-hemmer eller lansoprazol og naproxen, viste at sikkerhetsprofilen var lik den tidligere studien. Ytterligere reaksjoner fra denne studien som ikke tidligere er observert i andre kliniske studier med PREVACID 30 mg inkluderte kontusjon, duodenitt, epigastrisk ubehag, spiserørsforstyrrelse, tretthet, sult, hiatal brokk, heshet, nedsatt magetømming, metaplasi og nedsatt nyrefunksjon.
Ytterligere bivirkninger som forekommer hos mindre enn 1 % av pasientene eller forsøkspersonene som fikk PREVACID 15 mg i innenlandske studier, er vist nedenfor:
Kroppen som en helhet - mageforstørret, allergisk reaksjon, asteni, ryggsmerter, candidiasis, karsinom, brystsmerter (ikke annet spesifisert), frysninger, ødem, feber, influensasyndrom, halitose, infeksjon (ikke annet spesifisert), ubehag, nakkesmerter, nakkestivhet, smerte , bekkensmerter
Sirkulasjonssystem - angina, arytmi, bradykardi, cerebrovaskulær ulykke/hjerneinfarkt, hypertensjon/hypotensjon, migrene, hjerteinfarkt, hjertebank, sjokk (sirkulasjonssvikt), synkope, takykardi, vasodilatasjon
Fordøyelsessystemet - unormal avføring, anoreksi, bezoar, kardiospasme, kolelithiasis, kolitt, munntørrhet, dyspepsi, dysfagi, enteritt, eruktasjon, esophageal stenose, esophageal ulcus, øsofagitt, fekal misfarging, flatulens, gastrisk nodules gastropsengitis gastropsengitis, gastrisk angitt gastropsengitis , gastrointestinal lidelse, gastrointestinal blødning, glossitt, tannkjøttblødning, hematemesis, økt appetitt, økt spyttutskillelse, melena, munnsår, kvalme og brekninger, kvalme og oppkast og diaré, gastrointestinal moniliasis, endetarmsbetennelse, endetarmsbetennelse, endetarmsbetennelse, tungelidelse, ulcerøs kolitt, ulcerøs stomatitt
Endokrine system - diabetes mellitus, struma, hypotyreose Hemisk og lymfesystemet - anemi, hemolyse, lymfadenopati
Metabolisme og ernæringsforstyrrelser - avitaminose, gikt, dehydrering, hyperglykemi/hypoglykemi, perifert ødem, vektøkning/tap
Muskel- og skjelettsystemet - artralgi, leddgikt, beinlidelse, leddsykdom, leggkramper, muskel- og skjelettsmerter, myalgi, myasteni, ptosis, synovitt
nervesystemet - unormale drømmer, agitasjon, hukommelsestap, angst, apati, forvirring, kramper, demens, depersonalisering, depresjon, diplopi, svimmelhet, emosjonell labilitet, hallusinasjoner, hemiplegi, forverret fiendtlighet, hyperkinesi, hypertoni, hypestesi, søvnløshet, redusert libido, redusert/increness, nervøsitet nevrose, parestesi, søvnforstyrrelse, somnolens, tenkeabnormitet, tremor, svimmelhet
Luftveiene - astma, bronkitt, økt hoste, dyspné, neseblødning, hemoptyse, hikke, laryngeal neoplasi, lungefibrose, faryngitt, pleural lidelse, lungebetennelse, luftveisforstyrrelser, øvre luftveisbetennelse/infeksjon, rhinitt, bihulebetennelse, stridor
Hud og vedheng - akne, alopecia, kontakteksem, tørr hud, fast utbrudd, hårlidelse, makulopapulært utslett, neglelidelse, kløe, utslett, hudkarsinom, hudlidelse, svette, urticaria
Spesielle sanser - unormalt syn, amblyopi, blefaritt, tåkesyn, grå stær, konjunktivitt, døvhet, tørre øyne, øre/øyelidelse, øyesmerter, glaukom, mellomørebetennelse, parosmi, fotofobi, retinal degenerasjon/forstyrrelse, smakstap, smaksforstyrrelser, tinnitus, syn feltfeil
Urogenital system - unormal menstruasjon, brystforstørrelse, brystsmerter, ømhet i brystene, dysmenoré, dysuri, gynekomasti, impotens, nyresten, nyresmerter, leukoré, menorragi, menstruasjonsforstyrrelse, penisforstyrrelse, polyuri, testikkellidelse, urinrørssmerter, urinfrekvens, urinveisinfeksjon, urintrang, nedsatt vannlating, vaginitt
Postmarketing-erfaring
Ytterligere bivirkninger er rapportert siden PREVACID og PREVACID 30 mg SoluTab ble markedsført. De fleste av disse tilfellene er utenlandske og en sammenheng med PREVACID 15mg eller PREVACID SoluTab er ikke etablert. Fordi disse reaksjonene ble rapportert frivillig fra en populasjon av ukjent størrelse, kan det ikke gjøres estimater for frekvens. Disse hendelsene er oppført nedenfor av COSTART-kroppssystem.
Kroppen som en helhet - anafylaktiske/anafylaktoide reaksjoner, systemisk lupus erythematosus;
Fordøyelsessystemet - hepatotoksisitet, pankreatitt, oppkast;
Hemisk og lymfesystem - agranulocytose, aplastisk anemi, hemolytisk anemi, leukopeni, nøytropeni, pancytopeni, trombocytopeni og trombotisk trombocytopenisk purpura;
Infeksjoner og angrep - Clostridium difficile-assosiert diaré;
Metabolisme og ernæringsforstyrrelser - hypomagnesemi, hypokalsemi, hypokalemi, hyponatremi;
Muskel- og skjelettsystemet - beinbrudd, myositt;
Hud og vedheng - alvorlige dermatologiske reaksjoner inkludert erythema multiforme, SJS/TEN (noen dødelig), DRESS, AGEP, kutan lupus erythematosus;
Spesielle sanser - taleforstyrrelse;
Urogenital system - interstitiell nefritt, urinretensjon.
Kombinasjonsterapi med amoxicillin og klaritromycin
I kliniske studier med kombinasjonsbehandling med PREVACID pluss amoksicillin og klaritromycin, og PREVACID 30 mg pluss amoksicillin, ble det ikke observert noen bivirkninger særegne for disse legemiddelkombinasjonene. Bivirkninger som har oppstått har vært begrenset til de som tidligere har vært rapportert med PREVACID 15 mg, amoksicillin eller klaritromycin.
Trippelterapi: PREVACID/amoxicillin/klaritromycin
De hyppigst rapporterte bivirkningene for pasienter som fikk trippelbehandling i 14 dager var diaré (7 %), hodepine (6 %) og smaksforstyrrelser (5 %). Det var ingen statistisk signifikante forskjeller i frekvensen av rapporterte bivirkninger mellom 10 og 14 dagers trippelbehandlingsregimer. Ingen behandlingsutløste bivirkninger ble observert med signifikant høyere forekomster med trippelbehandling enn med noe dobbeltbehandlingsregime.
Dobbel terapi: PREVACID/amoxicillin
De hyppigst rapporterte bivirkningene for pasienter som fikk PREVACID 30 mg tre ganger daglig pluss amoxicillin tre ganger daglig dobbeltbehandling var diaré (8 %) og hodepine (7 %). Ingen behandlingsutløste bivirkninger ble observert i signifikant høyere forekomst med PREVACID 30 mg tre ganger daglig pluss amoksicillin tre ganger daglig dobbel behandling enn med PREVACID 15 mg alene.
For informasjon om bivirkninger med antibakterielle midler (amoksicillin og klaritromycin) indisert i kombinasjon med PREVACID eller PREVACID SoluTab, se avsnittet Bivirkninger i forskrivningsinformasjonen.
Laboratorieverdier
Følgende endringer i laboratorieparametre hos pasienter som fikk PREVACID 30 mg ble rapportert som bivirkninger:
Unormale leverfunksjonstester, økt SGOT (AST), økt SGPT (ALT), økt kreatinin, økt alkalisk fosfatase, økte globuliner, økt GGTP, økt/redusert/unormal WBC, unormal AG ratio, unormal RBC, bilirubinemi, økt kalium i blodet, økt blodurea, krystallurin tilstede, eosinofili, hemoglobin redusert, hyperlipemi, økt/redusert elektrolytter, økt/redusert kolesterol, økte glukokortikoider, økt LDH, økte/reduserte/unormale blodplater, økte gastrinnivåer og positivt fekalt okkult blod. Urinavvik som albuminuri, glykosuri og hematuri ble også rapportert. Ytterligere isolerte laboratorieavvik ble rapportert.
de placebokontrollerte studiene, da SGOT (AST) og SGPT (ALT) ble evaluert, hadde 0,4 % (4/978) og 0,4 % (11/2677) pasienter, som fikk henholdsvis placebo og PREVACID, enzymøkninger større enn tre ganger øvre grense for normalområdet ved siste behandlingsbesøk. Ingen av disse pasientene som fikk PREVACID 30 mg rapporterte gulsott på noe tidspunkt under studien.
I kliniske studier med kombinasjonsbehandling med PREVACID 15 mg pluss amoxicillin og klaritromycin, og PREVACID pluss amoxicillin, ble det ikke observert økte laboratorieavvik spesielt for disse legemiddelkombinasjonene.
For informasjon om endringer i laboratorieverdier med antibakterielle midler (amoksicillin og klaritromycin) indisert i kombinasjon med PREVACID eller PREVACID 30mg SoluTab, se avsnittet Bivirkninger i forskrivningsinformasjonen.
NARKOTIKAHANDEL
Tabell 2 og 3 inkluderer legemidler med klinisk viktige legemiddelinteraksjoner og interaksjon med diagnostikk når de administreres samtidig med PREVACID 15mg eller PREVACID SoluTab og instruksjoner for å forebygge eller håndtere dem.
Se merkingen av legemidler som brukes samtidig for å få mer informasjon om interaksjoner med PPI.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Tilstedeværelse av gastrisk malignitet
Hos voksne utelukker ikke symptomatisk respons på behandling med PREVACID 15mg eller PREVACID SoluTab tilstedeværelse av gastrisk malignitet. Vurder ytterligere oppfølging og diagnostisk testing hos voksne pasienter som har en suboptimal respons eller et tidlig symptomatisk tilbakefall etter fullført behandling med PPI. Vurder også en endoskopi hos eldre pasienter.
Akutt Tubulointerstitiell nefritis
Akutt tubulointerstial nefritt (TIN) er observert hos pasienter som tar PPI og kan forekomme når som helst under PPI-behandling. Pasienter kan ha forskjellige tegn og symptomer fra symptomatiske overfølsomhetsreaksjoner til uspesifikke symptomer på nedsatt nyrefunksjon (f.eks. ubehag, kvalme, anoreksi). I rapporterte kasusserier ble noen pasienter diagnostisert på biopsi og i fravær av ekstrarenale manifestasjoner (f.eks. feber, utslett eller artralgi). Seponer PREVACID eller PREVACID 15mg SoluTab og evaluer pasienter med mistanke om akutt TIN [se KONTRAINDIKASJONER ].
Clostridium Difficile-assosiert diaré
Publiserte observasjonsstudier tyder på at PPI-behandling som PREVACID 30mg og PREVACID 30mg SoluTab kan være assosiert med økt risiko for Clostridium difficile-assosiert diaré (CDAD), spesielt hos sykehusinnlagte pasienter. Denne diagnosen bør vurderes for diaré som ikke forbedres [se BIVIRKNINGER ].
Pasienter bør bruke den laveste dosen og korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles.
CDAD er rapportert ved bruk av nesten alle antibakterielle midler. For mer informasjon spesifikt for antibakterielle midler (klaritromycin og amoksicillin) indisert for bruk i kombinasjon med PREVACID 15mg eller PREVACID 15mg SoluTab, se avsnittet Advarsler og forsiktighetsregler i forskrivningsinformasjonen deres.
Benbrudd
Flere publiserte observasjonsstudier tyder på at PPI-behandling kan være assosiert med økt risiko for osteoporose-relaterte frakturer i hofte, håndledd eller ryggrad. Risikoen for brudd var økt hos pasienter som fikk høye doser, definert som flere daglige doser, og langvarig PPI-behandling (ett år eller lenger). Pasienter bør bruke den laveste dosen og korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles. Pasienter med risiko for osteoporose-relaterte frakturer bør behandles i henhold til etablerte behandlingsretningslinjer [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER ].
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, inkludert Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), medikamentreaksjoner med eosinofili og systemiske symptomer (DRESS), og akutt generalisert eksantematøs pustulose (AGEP) er rapportert i forbindelse med bruk av PPI. [se BIVIRKNINGER ]. Seponer PREVACID 30mg eller PREVACID SoluTab ved de første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhet og vurder videre evaluering.
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er rapportert hos pasienter som tar PPI, inkludert lansoprazol. Disse hendelsene har oppstått både som ny debut og en forverring av eksisterende autoimmun sykdom. Flertallet av PPI-induserte lupus erythematosus-tilfeller var CLE.
Den vanligste formen for CLE rapportert hos pasienter behandlet med PPI var subakutt CLE (SCLE) og oppstod innen uker til år etter kontinuerlig medikamentell behandling hos pasienter fra spedbarn til eldre. Generelt ble histologiske funn observert uten organinvolvering.
Systemisk lupus erythematosus (SLE) er sjeldnere rapportert enn CLE hos pasienter som får PPI. PPI-assosiert SLE er vanligvis mildere enn ikke-medikamentindusert SLE. Utbruddet av SLE oppstod vanligvis innen dager til år etter behandlingsstart, hovedsakelig hos pasienter fra unge voksne til eldre. Flertallet av pasientene hadde utslett; artralgi og cytopeni ble imidlertid også rapportert.
Unngå administrasjon av PPI lenger enn medisinsk indisert. Hvis tegn eller symptomer forenlig med CLE eller SLE observeres hos pasienter som får PREVACID 15mg eller PREVACID SoluTab, seponer legemidlet og henvis pasienten til riktig spesialist for evaluering. De fleste pasienter forbedres ved seponering av PPI alene i løpet av fire til 12 uker. Serologisk testing (f.eks. ANA) kan være positiv og forhøyede serologiske testresultater kan ta lengre tid å løse enn kliniske manifestasjoner.
Cyanokobalamin (vitamin B12) mangel
Daglig behandling med syredempende medisiner over lang tid (f.eks. lengre enn tre år) kan føre til malabsorpsjon av cyanokobalamin (vitamin B12) forårsaket av hypo- eller aklorhydri. Sjeldne rapporter om cyanokobalaminmangel som oppstår ved syredempende behandling er rapportert i litteraturen. Denne diagnosen bør vurderes dersom kliniske symptomer forenlig med cyanokobalaminmangel observeres hos pasienter behandlet med PREVACID eller PREVACID SoluTab.
Hypomagnesemi og mineralmetabolisme
Hypomagnesemi, symptomatisk og asymptomatisk, er sjelden rapportert hos pasienter behandlet med PPI i minst tre måneder, i de fleste tilfeller etter et års behandling. Alvorlige bivirkninger inkluderer tetany, arytmier og anfall. Hypomagnesemi kan føre til hypokalsemi og/eller hypokalemi og kan forverre underliggende hypokalsemi hos risikopasienter. Hos de fleste pasienter krevde behandling av hypomagnesemi magnesiumerstatning og seponering av PPI.
For pasienter som forventes å være på langvarig behandling eller som tar PPI sammen med medisiner som digoksin eller legemidler som kan forårsake hypomagnesemi (f.eks. diuretika), kan helsepersonell vurdere å overvåke magnesiumnivåer før oppstart av PPI-behandling og med jevne mellomrom [se BIVIRKNINGER ].
Vurder å overvåke magnesium- og kalsiumnivåer før oppstart av PREVACID 30mg eller PREVACID SoluTab og med jevne mellomrom under behandling hos pasienter med en eksisterende risiko for hypokalsemi (f.eks. hypoparatyreose). Suppler med magnesium og/eller kalsium etter behov. Hvis hypokalsemi er motstandsdyktig mot behandling, bør du vurdere å seponere PPI.
Interaksjoner med undersøkelser for nevroendokrine svulster
Serumkromogranin A (CgA) nivåer øker sekundært til medikamentinduserte reduksjoner i magesyre. Det økte CgA-nivået kan forårsake falske positive resultater i diagnostiske undersøkelser for nevroendokrine svulster. Helsepersonell bør midlertidig stoppe lansoprazolbehandlingen minst 14 dager før vurdering av CgA-nivåer og vurdere å gjenta testen hvis initiale CgA-nivåer er høye. Hvis det utføres serielle tester (f.eks. for overvåking), bør det samme kommersielle laboratoriet brukes for testing, da referanseområder mellom tester kan variere [se NARKOTIKAHANDEL , KLINISK FARMAKOLOGI ].
Interaksjon med metotreksat
Litteratur tyder på at samtidig bruk av PPI med metotreksat (primært ved høye doser) kan øke og forlenge serumnivåer av metotreksat og/eller dets metabolitt, noe som muligens kan føre til metotreksat toksisitet. Ved administrering av høydose metotreksat kan en midlertidig seponering av PPI vurderes hos noen pasienter [se NARKOTIKAHANDEL , KLINISK FARMAKOLOGI ].
Pasienter med fenylketonuri
Fenylalanin kan være skadelig for pasienter med fenylketonuri (PKU). PREVACID 30mg SoluTab inneholder fenylalanin, en komponent av aspartam. Hver 15 mg tablett inneholder 2,5 mg og hver 30 mg tablett inneholder 5,1 mg fenylalanin. Før du forskriver PREVACID SoluTab til en pasient med PKU, bør du vurdere den kombinerte daglige mengden fenylalanin fra alle kilder, inkludert PREVACID 30 mg SoluTab.
Fundic kjertelpolypper
PPI-bruk er assosiert med økt risiko for fundiske kjertelpolypper som øker ved langvarig bruk, spesielt utover ett år. De fleste PPI-brukere som utviklet fundiske kjertelpolypper var asymptomatiske og fundiske kjertelpolypper ble identifisert ved endoskopi. Bruk den korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles.
Risiko for fortykning av hjerteklaff hos pediatriske pasienter under ett år
PREVACID 30mg og PREVACID SoluTab er ikke godkjent hos pediatriske pasienter under ett år. Ikke-kliniske studier på unge rotter med lansoprazol har vist en negativ effekt av hjerteklafffortykkelse. Risikoen for hjerteklaffskade ser ikke ut til å være relevant for pasienter 1 år og eldre [se Bruk i spesifikke populasjoner ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning og Instruksjoner for bruk ).
Råd pasientene til å:
Akutt Tubulointerstitiell nefritis
Ringe helsepersonell hvis de opplever tegn og/eller symptomer assosiert med akutt tubulointerstitiell nefritt [se ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-assosiert diaré
Å umiddelbart ringe helsepersonell hvis de opplever diaré som ikke blir bedre [se ADVARSLER OG FORHOLDSREGLER ].
Benbrudd
For å rapportere eventuelle brudd, spesielt i hofte, håndledd eller ryggrad, til helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Alvorlige kutane bivirkninger
For å seponere PREVACID eller PREVACID 30mg SoluTab og umiddelbart ringe helsepersonell for videre evaluering [se ADVARSLER OG FORHOLDSREGLER ].
Kutan og systemisk lupus erythematosus
Å umiddelbart ringe helsepersonell for nye eller forverrede symptomer assosiert med kutan eller systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ].
Cyanokobalamin (vitamin B12) mangel
 Šrapportere eventuelle kliniske symptomer som kan være assosiert med cyanokobalamin-mangel til helsepersonell, hvis de har fått PREVACID eller PREVACID SoluTab i mer enn tre år [se ADVARSLER OG FORHOLDSREGLER ].
Hypomagnesemi og mineral
Metabolisme For å rapportere eventuelle kliniske symptomer som kan være assosiert med hypomagnesemi, hypokalsemi og/eller hypokalemi til helsepersonell, hvis de har fått PREVACID eller PREVACID 15 mg SoluTab i minst tre måneder [se ADVARSLER OG FORHOLDSREGLER ].
Narkotikahandel
Råd pasienter til å rapportere til helsepersonell dersom de tar produkter som inneholder rilpivirin [se KONTRAINDIKASJONER ] eller høydose metotreksat [se ADVARSLER OG FORHOLDSREGLER ].
Svangerskap
Informer en gravid kvinne om den potensielle risikoen for et foster. Gi kvinner med reproduksjonspotensial råd om å informere helsepersonell om kjent eller mistenkt graviditet [se Bruk i spesifikke populasjoner ].
Administrasjon
- . Glemte doser: Hvis en dose glemmes, gis så snart som mulig. Imidlertid, hvis neste planlagte dose er ventet, ikke ta den glemte dosen, og ta neste dose i tide. Ikke ta to doser på en gang for å gjøre opp for en glemt dose.
- . PREVACID eller PREVACID 30mg SoluTab bør tas før du spiser. . Ikke knus eller tygg PREVACID 15mg kapsel eller PREVACID SoluTab. . Ta PREVACID eller PREVACID 30 mg SoluTab minst 30 minutter før sukralfat. . Fenylketonurika: Inneholder fenylalanin 2,5 mg per 15 mg PREVACID 30 mg SoluTab-tablett og 5,1 mg per 30 mg PREVACID SoluTab-tablett.
PREVACID kapsler
- . Svelg hele; ikke tygg. . For pasienter som har problemer med å svelge kapsler:
- . PREVACID 15mg kapsler kan åpnes og drysses på eplemos, ENSURE pudding, cottage cheese, yoghurt eller silte pærer . PREVACID 15 mg kapsler kan også tømmes i et lite volum av enten eplejuice, appelsinjuice eller tomatjuice . Alternativt kan PREVACID-kapsler administreres med eplejuice via nasogastrisk sonde . Se bruksanvisningen for en beskrivelse av alle forberedelses- og administreringsinstruksjoner
PREVACID SoluTab
- . Ikke knekk eller kutt. . Plasser nettbrettet på tungen; la den gå i oppløsning, med eller uten vann, til partiklene kan svelges. Ikke tygg partiklene. . Nettbrettet desintegrerer vanligvis på mindre enn ett minutt. . Alternativt, for barn eller andre pasienter som har problemer med å svelge tabletter, kan PREVACID 30mg SoluTab administreres med vann via oral sprøyte eller NG-slange, som beskrevet i bruksanvisningen.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
to 24 måneders karsinogenitetsstudier ble Sprague-Dawley-rotter behandlet med orale lansoprazoldoser på 5 til 150 mg/kg/dag, omtrent én til 40 ganger eksponeringen på kroppsoverflate (mg/m²) for en person på 50 kg. av gjennomsnittlig høyde [1,46 m² kroppsoverflate (BSA)] gitt den anbefalte dosen til mennesker på 30 mg/dag. Lansoprazol produserte doserelatert gastrisk enterokromaffin-lignende (ECL) cellehyperplasi og ECL-cellekarsinoider hos både hann- og hunnrotter. Det økte også forekomsten av intestinal metaplasi av mageepitelet hos begge kjønn. Hos hannrotter ga lansoprazol en doserelatert økning av interstitielle celleadenomer i testikkel. Forekomsten av disse adenomene hos rotter som fikk doser på 15 til 150 mg/kg/dag (fire til 40 ganger anbefalt human dose basert på BSA) oversteg den lave bakgrunnsforekomsten (område = 1,4 til 10 %) for denne rottestammen.
en 24 måneders karsinogenitetsstudie ble CD-1-mus behandlet med orale lansoprazoldoser på 15 til 600 mg/kg/dag, to til 80 ganger anbefalt human dose basert på BSA. Lansoprazol ga en doserelatert økt forekomst av gastrisk ECL-cellehyperplasi. Det ga også en økt forekomst av levertumorer (hepatocellulært adenom pluss karsinom). Svulstforekomsten hos hannmus behandlet med 300 og 600 mg/kg/dag (40 til 80 ganger anbefalt human dose basert på BSA) og hunnmus behandlet med 150 til 600 mg/kg/dag (20 til 80 ganger anbefalt menneskelig dose) dose basert på BSA) overskred området for bakgrunnsforekomster i historiske kontroller for denne musestammen. Lansoprazolbehandling ga adenom i rete testis hos hannmus som fikk 75 til 600 mg/kg/dag (10 til 80 ganger anbefalt human dose basert på BSA).
En 26 ukers p53 (+/-) transgen mus karsinogenitetsstudie var ikke positiv.
Lansoprazol var positivt i Ames-testen og in vitro-analysen av human lymfocytt-kromosomavvik. Lansoprazol var ikke genotoksisk i ex vivo-testen for uplanlagt DNA-syntese av rottehepatocytter (UDS), mikronukleustesten in vivo eller kromosomavvikstesten for benmargsceller hos rotter.
Lansoprazol ved orale doser opptil 150 mg/kg/dag (40 ganger anbefalt human dose basert på BSA) ble funnet å ikke ha noen effekt på fertilitet og reproduksjonsevne hos hann- og hunnrotter.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Tilgjengelige data fra publiserte observasjonsstudier indikerer generelt ikke en sammenheng mellom uønskede graviditetsutfall med lansoprazolbehandling (se Data ).
I reproduksjonsstudier på dyr ga oral administrering av lansoprazol til rotter under organogenese gjennom amming ved 6,4 ganger den maksimale anbefalte humane dosen reduksjoner hos avkommet i femurvekt, lårbenslengde, krone-rumpslengde og vekstplatetykkelse (kun hanner) på postnatal dag 21 (se Data ). Disse effektene var assosiert med reduksjon i kroppsvektøkning. Informer gravide kvinner om den potensielle risikoen for fosteret.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for de angitte populasjonene er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 til 4 % og 15 til 20 %.
Hvis PREVACID 15mg eller PREVACID 15mg SoluTab administreres med klaritromycin, gjelder graviditetsinformasjonen for klaritromycin også for kombinasjonsregimet. Se forskrivningsinformasjonen for klaritromycin for mer informasjon om bruk under graviditet.
Data
Menneskelige data
Tilgjengelige data fra publiserte observasjonsstudier viste ikke en sammenheng mellom uønskede graviditetsrelaterte utfall og lansoprazolbruk. Metodiske begrensninger av disse observasjonsstudiene kan ikke definitivt fastslå eller utelukke noen medikamentrelatert risiko under graviditet. I en prospektiv studie av European Network of Teratology Information Services, ble resultater fra en gruppe på 62 gravide kvinner administrert median daglige doser på 30 mg lansoprazol sammenlignet med en kontrollgruppe på 868 gravide kvinner som ikke tok noen PPI. Det var ingen forskjell i frekvensen av store misdannelser mellom kvinner eksponert for PPI og kontrollgruppen, tilsvarende en relativ risiko (RR)=1,04, [95 % konfidensintervall (KI) 0,25-4,21]. I en populasjonsbasert retrospektiv kohortstudie som dekker alle levendefødte i Danmark fra 1996 til 2008, var det ingen signifikant økning i alvorlige fødselsdefekter under analyse av første trimestereksponering for lansoprazol hos 794 levendefødte. En metaanalyse som sammenlignet 1 530 gravide kvinner eksponert for PPI i minst første trimester med 133 410 ueksponerte gravide kvinner, viste ingen signifikant økning i risiko for medfødte misdannelser eller spontan abort med eksponering for PPI (for store misdannelser Odds Ratio (OR)=1,12 , [95 % KI 0,86-1,45] og for spontanaborter OR=1,29, [95 % KI 0,841,97]).
Dyredata
Ingen bivirkninger på embryo-føtal utvikling forekom i studier utført på gravide rotter ved orale lansoprazoldoser på opptil 150 mg/kg/dag (40 ganger anbefalt human dose [30 mg/dag] basert på kroppsoverflate) administrert under organogenese og gravide kaniner ved orale lansoprazoldoser på opptil 30 mg/kg/dag (16 ganger anbefalt human dose basert på kroppsoverflate) administrert under organogenese.
En pre- og postnatal utviklingstoksisitetsstudie på rotter med ytterligere endepunkter for å evaluere beinutvikling ble utført med lansoprazol i orale doser på 10 til 100 mg/kg/dag (0,7 til 6,4 ganger den maksimale anbefalte human lansoprazoldosen på 30 mg basert på AUC [område under plasmakonsentrasjon-tid-kurven]) administrert under organogenese gjennom amming. Maternelle effekter observert ved 100 mg/kg/dag (6,4 ganger den maksimale anbefalte humane lansoprazoldosen på 30 mg basert på AUC) inkluderte økt svangerskapsperiode, redusert kroppsvektøkning under svangerskapet og redusert matinntak. Antall dødfødsler ble økt ved denne dosen, noe som kan ha vært sekundært til maternell toksisitet. Kroppsvekten til valpene ble redusert med 100 mg/kg/dag fra og med postnatal dag 11. Femurvekt, lårbenslengde og krone-rumpelengde ble redusert med 100 mg/kg/dag på postnatal dag 21. Femurvekt var fortsatt redusert i 100 mg/kg/dag-gruppen i alderen 17 til 18 uker. Vekstplatetykkelsen ble redusert hos hannene på 100 mg/kg/dag på postnatal dag 21, og ble økt hos mennene på 30 og 100 mg/kg/dag i alderen 17 til 18 uker. Effektene på beinparametre var assosiert med reduksjon i kroppsvektøkning.
Amming
Risikosammendrag
Det er ingen informasjon om tilstedeværelsen av lansoprazol i morsmelk, effektene på spedbarnet som ammes, eller effekten på melkeproduksjonen. Lansoprazol og dets metabolitter er imidlertid tilstede i rottemelk. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for PREVACID 30mg eller PREVACID 30mg SoluTab og eventuelle potensielle bivirkninger på det ammede barnet fra PREVACID 30mg eller PREVACID SoluTab eller fra den underliggende morens tilstand.
Pediatrisk bruk
Sikkerheten og effektiviteten til PREVACID 15mg og PREVACID 30mg SoluTab er etablert hos pediatriske pasienter i alderen ett år til 17 år for korttidsbehandling av symptomatisk GERD og erosiv øsofagitt.
kliniske studier av symptomatisk GERD og erosiv øsofagitt ble ikke PREVACID 30 mg administrert utover 12 uker hos pasienter i alderen ett år til 11 år. Det er ikke kjent om PREVACID 30mg og PREVACID SoluTab er trygge og effektive hvis de brukes lenger enn anbefalt varighet. Ikke overskrid anbefalt dose og bruksvarighet hos pediatriske pasienter (se Toksisitetsdata for unge dyr ).
PREVACID var ikke effektivt hos pediatriske pasienter med symptomatisk GERD fra en måned til under ett år i en multisenter, dobbeltblind, placebokontrollert studie. Derfor er sikkerhet og effektivitet ikke fastslått hos pasienter under ett år. Ikke-kliniske studier på juvenile rotter har vist en negativ effekt av hjerteklafffortykkelse og beinforandringer ved lansoprazoldoser høyere enn den maksimale anbefalte ekvivalente humane dosen.
Nyfødt til mindre enn ett år
Farmakokinetikken til lansoprazol ble studert hos pediatriske pasienter med GERD i alderen mindre enn 28 dager og 1 til 11 måneder. Sammenlignet med friske voksne som fikk 30 mg, hadde nyfødte høyere eksponering (gjennomsnittlig vektbasert normalisert AUC-verdi 2,04 og 1,88 ganger høyere ved doser på henholdsvis 0,5 og 1 mg/kg/dag). Spedbarn i alderen ≤10 uker hadde clearance og eksponeringsverdier som var lik nyfødte. Spedbarn i alderen over 10 uker som fikk 1 mg/kg/dag hadde gjennomsnittlige AUC-verdier som var lik voksne som fikk en dose på 30 mg.
Lansoprazol ble ikke funnet å være effektivt i en amerikansk og polsk fire ukers, multisenter, dobbeltblind, placebokontrollert, parallellgruppestudie av 162 pasienter mellom en måned og under 12 måneder med symptomatisk GERD basert på en medisinsk historie av gråt/oppstyr/irritabilitet assosiert med mating som ikke hadde reagert på konservativ GERD-behandling (dvs. ikke-farmakologisk intervensjon) i syv til 14 dager. Pasienter mottatt
lansoprazol som en suspensjon daglig (0,2 til 0,3 mg/kg/dag hos spedbarn ≤10 uker eller 1,0 til 1,5 mg/kg/dag hos spedbarn over 10 uker eller placebo) i opptil fire uker med dobbeltblind behandling.
Det primære effektendepunktet ble vurdert ved mer enn 50 % reduksjon fra baseline i enten prosentandelen av matinger med en episode med gråt/oppstyr/irritabilitet eller varigheten (minutter) av en episode med gråt/oppstyr/irritasjon innen én time etter mating.
Det var ingen forskjell i prosentandelen av respondere mellom lansoprazol pediatrisk suspensjonsgruppen og placebogruppen (54 % i begge gruppene).
Det var ingen bivirkninger rapportert i pediatriske kliniske studier (en måned til under 12 måneder) som ikke tidligere ble observert hos voksne.
Basert på resultatene fra fase 3-effektstudien ble lansoprazol ikke vist å være effektivt. Derfor støtter ikke disse resultatene bruken av lansoprazol ved behandling av symptomatisk GERD hos spedbarn.
Ett år til 11 år
I en ukontrollert, åpen amerikansk multisenterstudie ble 66 pediatriske pasienter (ett år til 11 år) med GERD tildelt, basert på kroppsvekt, til å motta en startdose på enten PREVACID 15 mg daglig hvis ≤30 kg eller PREVACID 30 mg daglig hvis mer enn 30 kg administreres i åtte til 12 uker. PREVACID-dosen ble økt (opptil 30 mg to ganger daglig) hos 24 av 66 pediatriske pasienter etter to eller flere ukers behandling dersom de forble symptomatiske. Ved baseline hadde 85 % av pasientene milde til moderate generelle GERD-symptomer (vurdert ved etterforskerintervju), 58 % hadde ikke-erosiv GERD og 42 % hadde erosiv øsofagitt (vurdert ved endoskopi).
Etter åtte til 12 uker med PREVACID 15 mg-behandling, viste intent-to-treat-analysen en omtrentlig 50 % reduksjon i frekvens og alvorlighetsgrad av GERD-symptomer.
21 av 27 pasienter med erosiv øsofagitt ble helbredet etter åtte uker og 100 % av pasientene ble helbredet etter 12 uker ved endoskopi (tabell 4).
en studie med 66 pediatriske pasienter i aldersgruppen ett år til 11 år etter behandling med PREVACID 15 mg gitt oralt i doser på 15 mg daglig til 30 mg to ganger daglig, var økninger i serumgastrinnivåer lik de som ble observert i voksne studier. Median fastende serumgastrinnivåer økte 89 % fra 51 pg/ml ved baseline til 97 pg/ml [interkvartilområde (25. til 75. persentil) på 71 til 130 pg/ml] ved det siste besøket.
Den pediatriske sikkerheten til PREVACID 30 mg kapsler har blitt vurdert hos 66 pediatriske pasienter i alderen ett til 11 år. Av de 66 pasientene med GERD tok 85 % (56/66) PREVACID 30 mg i åtte uker og 15 % (10/66) tok det i 12 uker.
De hyppigst rapporterte (to eller flere pasienter) behandlingsrelaterte bivirkningene hos pasienter i alderen 1 til 11 år (N=66) var forstoppelse (5 %) og hodepine (3 %).
Tolv år til 17 år
en ukontrollert, åpen amerikansk multisenterstudie ble 87 ungdomspasienter (12 år til 17 år) med symptomatisk GERD behandlet med PREVACID i åtte til 12 uker. Baseline øvre endoskopier klassifiserte disse pasientene i to grupper: 64 (74 %) ikke-erosiv GERD og 23 (26 %) erosiv øsofagitt (EE). De ikke-erosive GERD-pasientene fikk PREVACID 15 mg daglig i åtte uker og EE-pasientene fikk PREVACID 30 mg daglig i åtte til 12 uker. Ved baseline hadde 89 % av disse pasientene milde til moderate generelle GERD-symptomer (vurdert av etterforskerintervjuer). I løpet av åtte uker med PREVACID 15 mg-behandling opplevde ungdomspasienter en 63 % reduksjon i frekvens og en 69 % reduksjon i alvorlighetsgrad av GERD-symptomer basert på dagbokresultater.
21 av 22 (95,5 %) pasienter med erosiv øsofagitt i ungdom ble helbredet etter åtte ukers behandling med PREVACID 15 mg. En pasient forble uhelbredt etter 12 ukers behandling (tabell 5).
Hos disse 87 ungdomspasientene var økninger i serumgastrinnivåer lik de som ble observert i voksne studier, median fastende serumgastrinnivå økte med 42 % fra 45 pg/mL ved baseline til 64 pg/ml [interkvartilområde (25. til 75. persentil) av 44 til 88 pg/ml] ved siste besøk. (Normale serumgastrinnivåer er 25 til 111 pg/ml.)
Sikkerheten til PREVACID kapsler har blitt vurdert hos disse 87 ungdomspasientene. Av de 87 ungdomspasientene med GERD tok 6 % (5/87) PREVACID 15 mg i mindre enn seks uker, 93 % (81/87) i seks til 10 uker og 1 % (1/87) i mer enn 10 uker .
De hyppigst rapporterte (minst 3 %) behandlingsrelaterte bivirkningene hos disse pasientene var hodepine (7 %), magesmerter (5 %), kvalme (3 %) og svimmelhet (3 %). Behandlingsrelatert svimmelhet, rapportert i denne forskrivningsinformasjonen som forekommende hos mindre enn 1 % av voksne pasienter, ble rapportert i denne studien av tre ungdomspasienter med ikke-erosiv GERD, som hadde svimmelhet samtidig med andre reaksjoner (som migrene, dyspné, og oppkast).
Toksisitetsdata for unge dyr
Hjerteklaff fortykkelse
to orale toksisitetsstudier forekom fortykning av mitralhjerteklaffen hos unge rotter behandlet med lansoprazol. Hjerteklafffortykkelse ble observert primært med oral dosering startet på postnatal dag 7 (alder tilsvarende neonatale mennesker) og postnatal dag 14 (menneskelig alder ekvivalent på omtrent ett år) ved doser på 250 mg/kg/dag og høyere (på postnatal dag 7 og postnatal dag 14, henholdsvis 6,2 ganger og 4,2 ganger den daglige pediatriske dosen på 15 mg hos pediatriske pasienter i alderen ett til 11 år som veier 30 kg eller mindre, basert på AUC). Behandlingsvarigheten assosiert med hjerteklafffortykkelse varierte fra 5 dager til 8 uker. Funnene snudde eller gikk mot reversibilitet etter en 4-ukers medikamentfri restitusjonsperiode. Forekomsten av hjerteklafffortykning etter start av dosering på postnatal dag 21 (menneskelig alder ekvivalent på ca. to år) var begrenset til en enkelt rotte (1/24) i grupper gitt 500 mg/kg/dag i 4 eller 8 uker (ca. 5,2 ganger den daglige pediatriske dosen på 15 mg hos pediatriske pasienter i alderen ett til 11 år som veier 30 kg eller mindre, basert på AUC). Basert på eksponeringsmarginer ser ikke risikoen for hjerteklaffskade ut til å være relevant for pasienter fra ett år og eldre.
Beinforandringer
I en åtte ukers oral toksisitetsstudie på juvenile rotter med dosering startet på postnatal dag 7, doser lik eller større enn 100 mg/kg/dag (2,5 ganger den daglige pediatriske dosen på 15 mg hos barn i alderen ett til 11 år som veier 30 år) kg eller mindre, basert på AUC) ga forsinket vekst, med svekkelse av vektøkning observert så tidlig som postnatal dag 10 (alder tilsvarende neonatale mennesker). Ved slutten av behandlingen inkluderte tegn på nedsatt vekst ved 100 mg/kg/dag og høyere reduksjoner i kroppsvekt (14 til 44 % sammenlignet med kontroller), absolutt vekt av flere organer, femurvekt, femurlengde og krone. rumpe lengde. Femoral vekstplatetykkelse ble redusert kun hos menn og bare ved dosen 500 mg/kg/dag. Effektene knyttet til forsinket vekst vedvarte gjennom slutten av den fire uker lange restitusjonsperioden. Langtidsdata ble ikke samlet inn.
Geriatrisk bruk
Av det totale antallet pasienter (n=21 486) i kliniske studier av PREVACID, var 16 % av pasientene i alderen 65 år og over, mens 4 % var 75 år og eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse pasientene og yngre pasienter, og annen rapportert klinisk erfaring har ikke identifisert signifikante forskjeller i respons mellom geriatriske og yngre pasienter, men større sensitivitet hos noen eldre individer kan ikke utelukkes [se KLINISK FARMAKOLOGI ].

Nedsatt leverfunksjon
Hos pasienter med ulike grader av kronisk nedsatt leverfunksjon var eksponeringen for lansoprazol økt sammenlignet med friske personer med normal leverfunksjon [se KLINISK FARMAKOLOGI ]. Ingen dosejustering for PREVACID eller PREVACID SoluTab er nødvendig for pasienter med mild (Child-Pugh klasse A) eller moderat (Child-Pugh klasse B) nedsatt leverfunksjon. Den anbefalte dosen er 15 mg oralt daglig hos pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh klasse C) [se DOSERING OG ADMINISTRASJON ].
OVERDOSE
Lansoprazol fjernes ikke fra sirkulasjonen ved hemodialyse. I en rapportert overdose inntok en pasient 600 mg PREVACID 15 mg uten bivirkninger. Orale lansoprazoldoser opptil 5000 mg/kg hos rotter [omtrent 1300 ganger 30 mg human dose basert på kroppsoverflate (BSA)] og i mus (ca. 675,7 ganger 30 mg human dose basert på BSA) ga ikke dødsfall eller eventuelle kliniske tegn.
Ved overeksponering bør behandlingen være symptomatisk og støttende.
Hvis overeksponering oppstår, ring ditt giftkontrollsenter på 1-800-222-1222 for oppdatert informasjon om håndtering av forgiftning eller overeksponering.
KONTRAINDIKASJONER
- . PREVACID 15mg og PREVACID 15mg SoluTab er kontraindisert hos pasienter med kjent overfølsomhet overfor en hvilken som helst komponent i formuleringen. Overfølsomhetsreaksjoner kan omfatte anafylaksi, anafylaktisk sjokk, angioødem, bronkospasme, akutt tubulointerstitiell nefritt og urticaria [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ]. . Protonpumpehemmere (PPI), inkludert PREVACID og PREVACID SoluTab, er kontraindisert med produkter som inneholder rilpivirin [se NARKOTIKAHANDEL ]. . For informasjon om kontraindikasjoner for antibakterielle midler (klaritromycin og amoxicillin) indisert i kombinasjon med PREVACID eller PREVACID 30 mg SoluTab, se avsnittet Kontraindikasjoner i forskrivningsinformasjonen.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Lansoprazol tilhører en klasse av antisekretoriske forbindelser, de substituerte benzimidazolene, som undertrykker magesyresekresjon ved spesifikk hemming av (H+, K+)-ATPase-enzymsystemet ved den sekretoriske overflaten av den gastriske parietalcellen. Fordi dette enzymsystemet betraktes som syrepumpen (proton) i parietalcellen, har lansoprazol blitt karakterisert som en magesyrepumpehemmer, ved at den blokkerer det siste trinnet i syreproduksjonen. Denne effekten er doserelatert og fører til hemming av både basal og stimulert magesyresekresjon uavhengig av stimulus. Lansoprazol viser ikke antikolinerg eller histamin type 2-antagonistaktivitet.
Farmakodynamikk
Antisekretorisk aktivitet
Etter oral administrering ble lansoprazol vist å redusere basalsyreproduksjonen signifikant og signifikant øke den gjennomsnittlige mage-pH og prosentvis av tiden mage-pH var større enn tre og større enn fire. Lansoprazol reduserte også signifikant måltidsstimulert magesyreproduksjon og sekresjonsvolum, samt pentagastrinstimulert syreproduksjon. Hos pasienter med hypersekresjon av syre reduserte lansoprazol signifikant basal og pentagastrinstimulert magesyresekresjon. Lansoprazol hemmet den normale økningen i sekresjonsvolum, surhet og syreproduksjon indusert av insulin.
De intragastriske pH-resultatene fra en femdagers, farmakodynamisk crossover-studie med 15 og 30 mg lansoprazol én gang daglig er presentert i tabell 6:
Etter startdosen i denne studien ble økt mage-pH sett i løpet av én til to timer med 30 mg lansoprazol og to til tre timer med 15 mg lansoprazol. Etter flere daglige doseringer ble økt mage-pH sett i løpet av den første timen etter dosering med 30 mg lansoprazol og innen én til to timer etter dosering med 15 mg lansoprazol.
Syresuppresjon kan øke effekten av antimikrobielle midler for å utrydde Helicobacter pylori (H. pylori). Prosentandelen av tiden gastrisk pH ble forhøyet over fem og seks ble evaluert i en crossover-studie av PREVACID gitt daglig, to ganger daglig og tre ganger daglig (tabell 7).
Inhiberingen av magesyresekresjon målt ved intragastrisk pH gikk gradvis tilbake til normal i løpet av to til fire dager etter flere doser. Det var ingen indikasjon på rebound gastrisk surhet.
Enterokromaffin-lignende (ECL) celleeffekter
Under livstidseksponering av rotter med inntil 150 mg/kg/dag lansoprazol dosert syv dager per uke, ble markert hypergastrinemi observert etterfulgt av ECL-celleproliferasjon og dannelse av karsinoide svulster, spesielt hos hunnrotter. Gastriske biopsiprøver fra magekroppen fra ca. 150 pasienter behandlet kontinuerlig med lansoprazol i minst ett år, viste ikke tegn på ECL-celleeffekter tilsvarende de som ble sett i rottestudier. Langtidsdata er nødvendig for å utelukke muligheten for økt risiko for utvikling av gastriske svulster hos pasienter som får langtidsbehandling med lansoprazol [se Ikke-klinisk toksikologi ].
Andre mageeffekter hos mennesker
Lansoprazol påvirket ikke slimhinneblodstrømmen i fundus i magen signifikant. På grunn av den normale fysiologiske effekten forårsaket av hemming av magesyresekresjon, ble det sett en reduksjon på ca. 17 % i blodstrømmen i antrum, pylorus og duodenal bulb. Lansoprazol forsinket magetømmingen av fordøyelige faste stoffer betydelig. Lansoprazol økte serumpepsinogennivåer og reduserte pepsinaktivitet under basale forhold og som respons på måltidsstimulering eller insulininjeksjon. Som med andre midler som øker intragastrisk pH, var økninger i mage-pH assosiert med økning i nitratreduserende bakterier og forhøyet nitrittkonsentrasjon i magesaft hos pasienter med magesår. Ingen signifikant økning i nitrosaminkonsentrasjoner ble observert.
Serum Gastrin Effekter
Hos over 2100 pasienter økte median fastende serumgastrinnivåer 50 til 100 % fra baseline, men holdt seg innenfor normalområdet etter behandling med 15 til 60 mg oral lansoprazol. Disse økningene nådde et platå innen to måneder etter behandling og returnerte til nivåer før behandling innen fire uker etter seponering av behandlingen.
Økt gastrin forårsaker enterokromaffinlignende cellehyperplasi og økte serum-CgA-nivåer. De økte CgA-nivåene kan forårsake falske positive resultater i diagnostiske undersøkelser for nevroendokrine svulster [se ADVARSLER OG FORHOLDSREGLER ].
Endokrine effekter
Menneskelige studier i opptil ett år har ikke påvist noen klinisk signifikante effekter på det endokrine systemet. Hormoner som er studert inkluderer testosteron, luteiniserende hormon (LH), follikkelstimulerende hormon (FSH), kjønnshormonbindende globulin (SHBG), dehydroepiandrosteronsulfat (DHEA-S), prolaktin, kortisol, østradiol, insulin, aldosteron, parathormon, glukagon, skjoldbruskstimulerende hormon (TSH), trijodtyronin (T3), tyroksin (T4) og somatotropt hormon (STH). Lansoprazol i orale doser på 15 til 60 mg i opptil ett år hadde ingen klinisk signifikant effekt på seksuell funksjon. I tillegg hadde lansoprazol i orale doser på 15 til 60 mg i to til åtte uker ingen klinisk signifikant effekt på skjoldbruskfunksjonen. I 24 måneders karsinogenitetsstudier hos Sprague-Dawley-rotter med daglige lansoprazoldoser på opptil 150 mg/kg, ble proliferative endringer i Leydig-cellene i testiklene, inkludert benign neoplasma, økt sammenlignet med kontrollrotter.
Andre effekter
Det er ikke funnet noen systemiske effekter av lansoprazol på sentralnervesystemet, lymfoide, hematopoietiske, nyre-, lever-, kardiovaskulære eller respiratoriske systemer hos mennesker. Blant 56 pasienter som hadde omfattende baseline øyeevalueringer, ble det ikke observert visuell toksisitet etter lansoprazolbehandling (opptil 180 mg/dag) i opptil 58 måneder. Etter livslang eksponering for lansoprazol hos rotter ble det sett fokal pankreasatrofi, diffus lymfoid hyperplasi i thymus og spontan retinal atrofi.
Farmakokinetikk
Absorpsjon
PREVACID 15mg og PREVACID SoluTab inneholder en enterisk belagt granulatformulering av lansoprazol (fordi lansoprazol er syrelabilt), slik at absorpsjon av lansoprazol starter først etter at granulene forlater magen. De gjennomsnittlige maksimale plasmanivåene av lansoprazol inntreffer etter ca. 1,7 timer. Etter en enkeltdoseadministrasjon av 15 til 60 mg oral lansoprazol, var maksimale plasmakonsentrasjoner (Cmax) av lansoprazol og arealet under plasmakonsentrasjonskurvene (AUCs) av lansoprazol omtrent proporsjonale med administrert dose. Lansoprazol akkumuleres ikke og dets farmakokinetikk er uendret ved gjentatt dosering. Den absolutte biotilgjengeligheten er over 80 %. Hos friske personer var gjennomsnittlig (±SD) plasmahalveringstid 1,5 (±1,0) timer. Både Cmax og AUC reduseres med ca. 50 til 70 % hvis lansoprazol gis 30 minutter etter mat, sammenlignet med fastetilstanden. Det er ingen signifikant mateffekt dersom lansoprazol gis før måltider.
Fordeling
Lansoprazol er 97 % bundet til plasmaproteiner. Plasmaproteinbinding er konstant over konsentrasjonsområdet 0,05 til 5 mcg/ml.
Eliminering
Metabolisme
Lansoprazol metaboliseres i stor grad i leveren. To metabolitter er identifisert i målbare mengder i plasma (de hydroksylerte sulfinyl- og sulfonderivatene av lansoprazol). Disse metabolittene har svært liten eller ingen antisekretorisk aktivitet. Lansoprazol antas å bli transformert til to aktive arter som hemmer syresekresjon ved å blokkere protonpumpen [(H+, K+)-ATPase-enzymsystemet] ved den sekretoriske overflaten av den gastriske parietalcellen. De to aktive artene er ikke til stede i den systemiske sirkulasjonen. Halveringstiden for plasmaeliminering av lansoprazol er mindre enn to timer mens den syrehemmende effekten varer mer enn 24 timer. Derfor reflekterer ikke plasmaelimineringshalveringstiden for lansoprazol varigheten av undertrykkelse av magesyresekresjon.
Utskillelse
Etter oral enkeltdose administrering av PREVACID ble praktisk talt ingen uforandret lansoprazol utskilt i urinen. I en studie, etter en enkelt oral dose av 14Clansoprazol, ble omtrent en tredjedel av den administrerte strålingen utskilt i urinen og to tredjedeler ble gjenvunnet i avføringen. Dette innebærer en betydelig biliær utskillelse av lansoprazolmetabolittene.
Spesifikke populasjoner
Pediatriske pasienter
1 til 17 år
Farmakokinetikken til lansoprazol ble studert hos pediatriske pasienter med GERD i alderen ett til 11 år og 12 til 17 år i to separate kliniske studier. Hos barn i alderen ett til 11 år ble lansoprazol dosert 15 mg daglig for personer som veide ≤30 kg og 30 mg daglig for personer som veide mer enn 30 kg. Gjennomsnittlige Cmax- og AUC-verdier observert på dag 5 av doseringen var lik mellom de to dosegruppene og ble ikke påvirket av vekt eller alder innenfor hver vektjustert dosegruppe som ble brukt i studien. Hos ungdommer i alderen 12 til 17 år ble forsøkspersoner randomisert til å få lansoprazol med 15 eller 30 mg daglig. Gjennomsnittlige Cmax- og AUC-verdier for lansoprazol ble ikke påvirket av kroppsvekt eller alder; og nesten doseproporsjonale økninger i gjennomsnittlig Cmax og AUC-verdier ble observert mellom de to dosegruppene i studien. Totalt sett var lansoprazols farmakokinetikk hos pediatriske pasienter i alderen ett til 17 år lik den som ble observert hos friske voksne personer.
Geriatriske pasienter
Clearance av lansoprazol er redusert hos eldre, med eliminasjonshalveringstiden økt med ca. 50 til 100 %. Fordi gjennomsnittlig halveringstid hos eldre forblir mellom 1,9 og 2,9 timer, resulterer ikke gjentatt dosering én gang daglig i akkumulering av lansoprazol. Maksimal plasmanivå ble ikke økt hos eldre [se Bruk i spesifikke populasjoner ].
Mannlige og kvinnelige pasienter
I en studie som sammenlignet 12 mannlige og seks kvinnelige forsøkspersoner som fikk lansoprazol, ble det ikke funnet noen kjønnsrelaterte forskjeller i farmakokinetikk og intragastriske pH-resultater.
Rase- eller etniske grupper
De samlede gjennomsnittlige farmakokinetiske parametrene for PREVACID fra tolv amerikanske studier (N=513) ble sammenlignet med gjennomsnittlige farmakokinetiske parametere fra to asiatiske studier (N=20). Gjennomsnittlig AUC for PREVACID 30 mg hos asiatiske personer var omtrent det dobbelte av det som ble sett i sammenslåtte amerikanske data; den interindividuelle variasjonen var imidlertid høy. Cmax-verdiene var sammenlignbare.
Pasienter med nedsatt nyrefunksjon
Hos pasienter med alvorlig nedsatt nyrefunksjon ble plasmaproteinbindingen redusert med 1 til 1,5 % etter administrering av 60 mg lansoprazol. Pasienter med nedsatt nyrefunksjon hadde en forkortet eliminasjonshalveringstid og redusert total AUC (fri og bundet). AUC for fritt lansoprazol i plasma var imidlertid ikke relatert til graden av nedsatt nyrefunksjon; og Cmax og Tmax (tid for å nå maksimal konsentrasjon) var ikke forskjellige fra Cmax og Tmax fra personer med normal nyrefunksjon. Derfor var farmakokinetikken til lansoprazol ikke klinisk forskjellig hos pasienter med mild, moderat eller alvorlig nedsatt nyrefunksjon sammenlignet med friske personer med normal nyrefunksjon.
Pasienter med nedsatt leverfunksjon
Hos pasienter med mild (Child-Pugh klasse A) eller moderat (Child-Pugh klasse B) nedsatt leverfunksjon var det en omtrentlig 3 ganger økning i gjennomsnittlig AUC sammenlignet med friske personer med normal leverfunksjon etter flere orale doser på 30 mg PREVACID 30 mg i sju dager. Den tilsvarende gjennomsnittlige plasmahalveringstiden for lansoprazol ble forlenget fra 1,5 til fire timer (Child-Pugh A) eller fem timer (Child-Pugh B).
Hos pasienter med kompensert og dekompensert cirrhose var det en omtrentlig 6- og 5-dobling av AUC, henholdsvis, sammenlignet med friske personer med normal leverfunksjon etter en enkelt oral dose på 30 mg PREVACID [se DOSERING OG ADMINISTRASJON , Bruk i spesifikke populasjoner ].
Legemiddelinteraksjonsstudier
Effekt av Lansoprazol på andre legemidler
Cytokrom P450-interaksjoner
Lansoprazol metaboliseres gjennom cytokrom P450-systemet, spesielt gjennom isozymene CYP3A og CYP2C19. Studier har vist at PREVACID 15mg ikke har klinisk signifikante interaksjoner med andre legemidler metabolisert av cytokrom P450-systemet, som warfarin, antipyrin, indometacin, ibuprofen, fenytoin, propranolol, prednison, diazepam eller klaritromycin hos friske personer. Disse forbindelsene metaboliseres gjennom forskjellige cytokrom P450 isozymer inkludert CYP1A2, CYP2C9, CYP2C19, CYP2D6 og CYP3A.
Teofyllin
Når PREVACID 30 mg ble administrert samtidig med teofyllin (CYP1A2, CYP3A), ble det sett en mindre økning (10 %) i clearance av teofyllin. På grunn av den lille størrelsen og retningen til effekten på teofyllinclearance, er det usannsynlig at denne interaksjonen er av klinisk bekymring [se NARKOTIKAHANDEL ].
Metotreksat og 7-hydroksymetotreksat
en åpen, enarms, åtte dagers, farmakokinetisk studie av 28 voksne pasienter med revmatoid artritt (som krevde kronisk bruk av 7,5 til 15 mg metotreksat gitt ukentlig), administrering av syv dager med naproxen 500 mg to ganger daglig og PREVACID 30 mg daglig hadde ingen effekt på farmakokinetikken til metotreksat og 7-hydroksymetotreksat. Selv om denne studien ikke var designet for å vurdere sikkerheten til denne kombinasjonen av legemidler, ble det ikke observert noen alvorlige bivirkninger. Imidlertid ble denne studien utført med lave doser metotreksat. En legemiddelinteraksjonsstudie med høye doser metotreksat er ikke utført [se ADVARSLER OG FORHOLDSREGLER ].
Amoksicillin
PREVACID 30 mg har heller ikke vist seg å ha noen klinisk signifikant interaksjon med amoxicillin.
Sukralfat
I en enkeltdose-crossover-studie som undersøkte PREVACID 30 mg administrert alene og samtidig med sukralfat 1 gram, ble absorpsjonen av lansoprazol forsinket og biotilgjengeligheten ble redusert med 17 % når det ble administrert samtidig med sukralfat [se DOSERING OG ADMINISTRASJON , NARKOTIKAHANDEL ].
Antacida
kliniske studier ble syrenøytraliserende midler administrert samtidig med PREVACID 15 mg, og det var ingen tegn på endring i effekten av PREVACID.
Klopidogrel
Klopidogrel metaboliseres til sin aktive metabolitt delvis av CYP2C19. En studie av friske forsøkspersoner som var CYP2C19 omfattende metabolisatorer, som fikk en gang daglig administrering av klopidogrel 75 mg alene eller samtidig med PREVACID 30 mg (n=40), i ni dager, ble utført. Gjennomsnittlig AUC for den aktive metabolitten til klopidogrel ble redusert med ca. 14 % (gjennomsnittlig AUC-ratio var 86 %, med 90 % KI på 80 til 92 %) når PREVACID ble administrert samtidig sammenlignet med administrering av klopidogrel alene.
Farmakodynamiske parametere ble også målt og viste at endringen i hemming av blodplateaggregering (indusert av 5 mcM ADP) var relatert til endringen i eksponeringen for klopidogrel aktiv metabolitt. Effekten på eksponering for den aktive metabolitten til klopidogrel og på klopidogrel-indusert blodplatehemming anses ikke som klinisk viktig.
Effekten av andre stoffer på Lansoprazol
Fordi lansoprazol metaboliseres av CYP2C19 og CYP3A4, kan induktorer og hemmere av disse enzymene potensielt endre eksponeringen av lansoprazol.
Mikrobiologi
Mikrobiologi
Lansoprazol, klaritromycin og/eller amoxicillin har vist seg å være aktive mot de fleste stammer av Helicobacter pylori in vitro og ved kliniske infeksjoner [se INDIKASJONER OG BRUK ].
Helicobacter Pylori forbehandlingsmotstand
Klaritromycin-forbehandlingsresistens (≥2,0 mcg/ml) var 9,5 % (91/960) ved E-test og 11,3 % (12/106) ved agarfortynning i de kliniske studiene med dobbel og trippelterapi (M93-125, M93-130, M93131, M95-392 og M95-399).
Forbehandlingsfølsomme isolater for amoksicillin (≤0,25 mcg/ml) forekom hos henholdsvis 97,8 % (936/957) og 98,0 % (98/100) av pasientene i de kliniske studiene med dobbelt- og trippelterapi ved E-test og agarfortynning. 21 av 957 pasienter (2,2 %) ved E-test, og to av 100 pasienter (2,0 %) ved agarfortynning, hadde amoxicillin-forbehandlings-MICs på større enn 0,25 mcg/ml. En pasient på 14 dagers trippelbehandlingsregime hadde en ubekreftet minimumshemmende konsentrasjon av amoxicillin (MIC) før behandling på over 256 mcg/ml ved E-test, og pasienten ble utryddet av H. pylori (tabell 8).
Pasienter som ikke er utryddet av H. pylori etter trippelbehandling med lansoprazol/amoxicillin/klaritromycin, vil sannsynligvis ha klaritromycinresistent H. pylori. For de pasienter som mislykkes i behandlingen, bør klaritromycinfølsomhetstesting utføres når det er mulig. Pasienter med klaritromycinresistent H. pylori bør ikke behandles med trippelbehandling med lansoprazol/amoxicillin/klaritromycin eller med regimer som inkluderer klaritromycin som eneste antimikrobielle middel.
Amoxicillin-følsomhetstestresultater og kliniske/bakteriologiske resultater
de kliniske studiene med dobbel og trippel terapi ble 82,6 % (195/236) av pasientene som hadde forbehandlingsfølsomme MICs (≤0,25 mcg/ml) utryddet av H. pylori. Av de med amoxicillin-MIC-verdier på over 0,25 mcg/ml før behandling, hadde tre av seks H. pylori utryddet. Totalt 30 % (21/70) av pasientene mislyktes med lansoprazol 30 mg tre ganger daglig/amoxicillin 1 g tre ganger daglig dobbeltbehandling og totalt 12,8 % (22/172) av pasientene mislyktes i 10 og 14 dagers trippel. terapiregimer. Resultatene etter behandling ble ikke oppnådd hos 11 av pasientene som mislyktes i behandlingen. Ni av de 11 pasientene med amoxicillin etter behandlings-MIC som mislyktes i trippelbehandlingsregimet, hadde også klaritromycinresistente H. pylori-isolater.
Følsomhetstest for Helicobacter pylori
For informasjon om følsomhetstesting om Helicobacter pylori, se Mikrobiologiseksjon i forskrivningsinformasjon for klaritromycin og amoksicillin .
Kliniske studier
Duodenalsår
en amerikansk multisenter, dobbeltblind, placebokontrollert, dose-respons (15, 30 og 60 mg PREVACID én gang daglig) studie av 284 pasienter med endoskopisk dokumentert sår på tolvfingertarmen, var prosentandelen av pasienter helbredet etter to og fire uker. signifikant høyere med alle doser av PREVACID enn med placebo. Det var ingen tegn på større eller tidligere respons med de to høyere dosene sammenlignet med PREVACID 15 mg. Basert på denne studien og den andre studien beskrevet nedenfor, er den anbefalte dosen av PREVACID 15 mg ved duodenalsår 15 mg per dag (tabell 9).
PREVACID 15 mg var signifikant mer effektivt enn placebo for å lindre magesmerter dag og natt og redusere mengden syrenøytraliserende midler per dag.
en andre amerikansk multisenterstudie, også dobbeltblind, placebokontrollert, dosesammenligning (15 og 30 mg PREVACID 15 mg én gang daglig), og inkludert en sammenligning med ranitidin, hos 280 pasienter med endoskopisk dokumentert duodenalsår, viste prosentandelen av pasienter som ble helbredet etter fire uker var signifikant høyere med begge doser av PREVACID 15 mg enn med placebo. Det var ingen tegn på større eller tidligere respons med høyere dose av PREVACID. Selv om 15 mg-dosen av PREVACID var overlegen ranitidin etter fire uker, gjør mangelen på signifikant forskjell etter to uker og fraværet av en forskjell mellom 30 mg PREVACID og ranitidin den komparative effektiviteten til de to midlene ubestemt (tabell 10) [ se INDIKASJONER OG BRUK ].
Utryddelse av H. pylori for å redusere risikoen for tilbakefall av duodenalsår
Randomiserte, dobbeltblinde kliniske studier utført i USA på pasienter med H. pylori og duodenalsår (definert som et aktivt sår eller historie med sår innen ett år) evaluerte effekten av PREVACID i kombinasjon med amoxicillin og klaritromycin som trippel 14 dagbehandling eller i kombinasjon med amoxicillin som dobbel 14 dagers behandling for utryddelse av H. pylori. Basert på resultatene fra disse studiene, ble sikkerheten og effekten av to forskjellige utryddelsesregimer fastslått:
Trippelterapi : PREVACID 30 mg to ganger daglig/amoxicillin 1 g to ganger daglig/klaritromycin 500 mg to ganger daglig
Dobbel terapi : PREVACID 30 mg tre ganger daglig/amoxicillin 1 g tre ganger daglig
Alle behandlingene var i 14 dager. H. pylori-utryddelse ble definert som to negative tester (kultur og histologi) fire til seks uker etter avsluttet behandling.
Trippelterapi ble vist å være mer effektiv enn alle mulige kombinasjoner av dobbel terapi. Dobbel terapi ble vist å være mer effektiv enn begge monoterapiene. Utryddelse av H. pylori har vist seg å redusere risikoen for tilbakefall av duodenalsår.
En randomisert, dobbeltblind klinisk studie utført i USA på pasienter med H. pylori og tolvfingertarmsårsykdom (definert som et aktivt sår eller historie med sår innen ett år) sammenlignet effekten av PREVACID trippelbehandling i 10 og 14 dager. Denne studien viste at 10 dagers trippelterapi var ekvivalent med 14 dagers trippelterapi for å utrydde H. pylori (tabell 11 og 12) [se INDIKASJONER OG BRUK ].
Vedlikehold av helbredede duodenalsår
PREVACID har vist seg å forhindre tilbakefall av duodenalsår. To uavhengige, dobbeltblinde, multisenter, kontrollerte studier ble utført på pasienter med endoskopisk bekreftet helbredet duodenalsår. Pasientene forble helbredet betydelig lenger og antall tilbakefall av duodenalsår var signifikant mindre hos pasienter behandlet med PREVACID 15 mg enn hos pasienter behandlet med placebo over en 12 måneders periode (tabell 13) [se INDIKASJONER OG BRUK ].
I studie nr. 2 ble det ikke observert noen signifikant forskjell mellom PREVACID 15 og 30 mg for å opprettholde remisjon.
Magesår
I en amerikansk multisenter, dobbeltblind, placebokontrollert studie av 253 pasienter med endoskopisk dokumentert magesår, var prosentandelen av pasienter helbredet ved fire og åtte uker signifikant høyere med PREVACID 15 og 30 mg én gang daglig enn med placebo (tabell 14) ) [se INDIKASJONER OG BRUK ].
Pasienter behandlet med en hvilken som helst PREVACID-dose rapporterte signifikant mindre magesmerter dag og natt sammen med færre dager med syrenøytraliserende bruk og færre syrenøytraliserende tabletter brukt per dag enn placebogruppen.
Uavhengig underbyggelse av effektiviteten av PREVACID 30 mg ble gitt ved en metaanalyse av publiserte og upubliserte data.
Heling av NSAID-assosiert magesår
to amerikanske og kanadiske multisenter, dobbeltblinde, aktiv-kontrollerte studier av pasienter med endoskopisk bekreftet NSAID-assosiert magesår som fortsatte NSAID-bruken, var prosentandelen av pasienter som ble helbredet etter åtte uker statistisk signifikant høyere med 30 mg PREVACID enn med den aktive kontrollen. Totalt 711 pasienter ble inkludert i studien, og 701 pasienter ble behandlet. Pasientene varierte i alder fra 18 til 88 år (median alder 59 år), med 67 % kvinnelige pasienter og 33 % mannlige pasienter. Rase ble fordelt som følger: 87 % kaukasisk, 8 % svart, 5 % annet. Det var ingen statistisk signifikant forskjell mellom PREVACID 30 mg daglig og den aktive kontrollen på symptomlindring (dvs. magesmerter) (tabell 15) [se INDIKASJONER OG BRUK ].
Risikoreduksjon av NSAID-assosiert magesår
en stor amerikansk, multisenter, dobbeltblind, placebo- og misoprostolkontrollert (misoprostol blindet kun for endoskopisten) studie hos pasienter som krevde kronisk bruk av et NSAID og som hadde en historie med endoskopisk dokumentert magesår, var andelen av Pasienter som forble fri for magesår etter fire, åtte og 12 uker var signifikant høyere med 15 eller 30 mg PREVACID 15 mg enn placebo. Totalt 537 pasienter ble inkludert i studien, og 535 pasienter ble behandlet. Pasientene varierte i alder fra 23 til 89 år (median alder 60 år), med 65 % kvinnelige pasienter og 35 % mannlige pasienter. Rase ble fordelt som følger: 90 % kaukasisk, 6 % svart, 4 % annet. 30 mg-dosen av PREVACID viste ingen ytterligere fordel i risikoreduksjon av det NSAID-assosierte magesåret enn 15 mg-dosen (tabell 16) [se INDIKASJONER OG BRUK ].
Symptomatisk gastroøsofageal reflukssykdom (GERD)
Symptomatisk GERD
en amerikansk multisenter, dobbeltblind, placebokontrollert studie av 214 pasienter med hyppige GERD-symptomer, men ingen esophageal erosjoner ved endoskopi, ble det observert signifikant større lindring av halsbrann assosiert med GERD ved administrering av lansoprazol 15 mg én gang daglig opptil åtte uker enn med placebo. Ingen signifikant ytterligere fordel av lansoprazol 30 mg én gang daglig ble observert.
Intent-to-treat-analysene viste signifikant reduksjon i frekvens og alvorlighetsgrad av halsbrann dag og natt. Data for frekvens og alvorlighetsgrad for den åtte ukers behandlingsperioden er presentert i tabell 17 og i figur 1 og 2:
Figur 1: Gjennomsnittlig alvorlighetsgrad av halsbrann etter studiedag for evaluerbare pasienter (3=alvorlig, 2=moderat, 1=mild, 0=ingen)
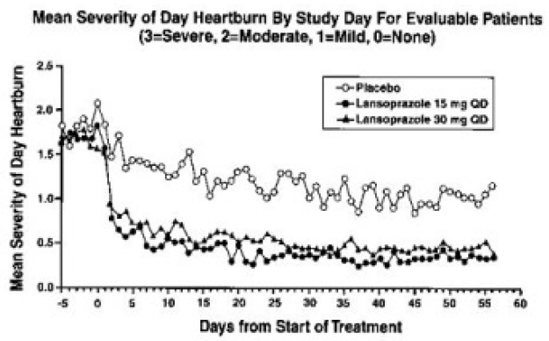
Figur 2: Gjennomsnittlig alvorlighetsgrad av halsbrann etter undersøkelsesdag for evaluerbare pasienter (3=alvorlig, 2=moderat, 1=mild, 0=ingen)
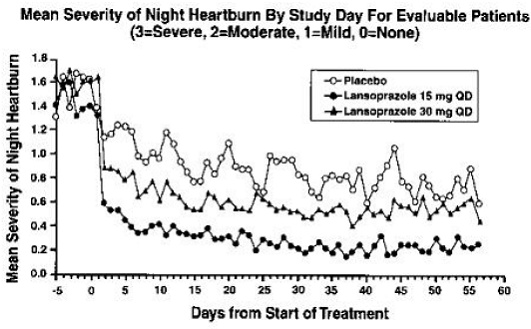
to amerikanske, multisenter dobbeltblinde, ranitidinkontrollerte studier av totalt 925 pasienter med hyppige GERD-symptomer, men ingen esophageal erosjoner ved endoskopi, var lansoprazol 15 mg bedre enn ranitidin 150 mg (to ganger daglig) når det gjaldt å redusere frekvensen og alvorlighetsgraden av dagen. og natt halsbrann assosiert med GERD i den åtte ukers behandlingsperioden. Ingen signifikant ytterligere fordel av lansoprazol 30 mg én gang daglig ble observert [se INDIKASJONER OG BRUK ].
Erosiv øsofagitt
I en amerikansk, multisenter, dobbeltblind, placebokontrollert studie av 269 pasienter som kommer inn med en endoskopisk diagnose av øsofagitt med slimhinnegradering på to eller flere og grad tre og fire som indikerer erosiv sykdom, er prosentandelen av pasienter med helbredelse presentert i tabell 18:
denne studien rapporterte alle PREVACID-gruppene signifikant større lindring av halsbrann og mindre magesmerter dag og natt sammen med færre dager med syrenøytraliserende bruk og færre syrenøytraliserende tabletter tatt per dag enn placebogruppen. Selv om alle doser var effektive, antyder den tidligere helbredelsen i de to høyere dosene 30 mg daglig som anbefalt dose.
PREVACID ble også sammenlignet i en amerikansk, multisenter, dobbeltblind studie med en lav dose ranitidin hos 242 pasienter med erosiv refluksøsofagitt. PREVACID i en dose på 30 mg var signifikant mer effektivt enn ranitidin 150 mg to ganger daglig som vist nedenfor (tabell 19).
I tillegg rapporterte pasienter behandlet med PREVACID 30 mg mindre halsbrann dag og natt og tok mindre syrenøytraliserende tabletter i færre dager enn pasienter som tok ranitidin 150 mg to ganger daglig.
Selv om denne studien viser effektiviteten til PREVACID 15 mg for å helbrede erosiv øsofagitt, representerer den ikke en tilstrekkelig sammenligning med ranitidin fordi den anbefalte ranitidindosen for øsofagitt er 150 mg fire ganger daglig, to ganger dosen brukt i denne studien.
I de to beskrevne studiene og i flere mindre studier som involverte pasienter med moderat til alvorlig erosiv øsofagitt, ga PREVACID tilhelingshastigheter tilsvarende de som er vist ovenfor.
en amerikansk, multisenter, dobbeltblind, aktiv-kontrollert studie ble 30 mg PREVACID 30 mg sammenlignet med ranitidin 150 mg to ganger daglig hos 151 pasienter med erosiv refluksøsofagitt som var dårlig respons på minimum 12 ukers behandling med minst 12 uker. én H2-reseptorantagonist gitt i dosen indisert for symptomlindring eller høyere, nemlig cimetidin 800 mg/dag, ranitidin 300 mg/dag, famotidin 40 mg/dag eller nizatidin 300 mg/dag. PREVACID 30 mg var mer effektivt enn ranitidin 150 mg to ganger daglig for å helbrede refluksøsofagitt, og prosentandelen av pasienter med helbredelse var som følger. Denne studien utgjør ikke en sammenligning av effektiviteten til histamin H2-reseptorantagonister med PREVACID 30 mg, ettersom alle pasienter hadde vist manglende respons på behandlingsmetoden for histamin H2-reseptorantagonister. Det indikerer imidlertid at PREVACID 30 mg kan være nyttig hos pasienter som svikter på en histamin H2-reseptorantagonist (tabell 20) [se INDIKASJONER OG BRUK ].
Vedlikehold av helbredelse av erosiv øsofagitt
To uavhengige, dobbeltblinde, multisenter, kontrollerte studier ble utført på pasienter med endoskopisk bekreftet helbredet øsofagitt. Pasientene forble i remisjon betydelig lenger og antallet tilbakefall av erosiv øsofagitt var signifikant mindre hos pasienter behandlet med PREVACID 30 mg enn hos pasienter behandlet med placebo over en 12 måneders periode (tabell 21).
Uavhengig av initial grad av erosiv øsofagitt, var PREVACID 15 og 30 mg like i å opprettholde remisjon.
en amerikansk, randomisert, dobbeltblind studie ble PREVACID 15 mg daglig (n=100) sammenlignet med ranitidin 150 mg to ganger daglig (n=106), ved anbefalt dosering, hos pasienter med endoskopisk bevist helbredet erosiv øsofagitt over en 12 måneders periode. Behandling med PREVACID 15 mg resulterte i at pasienter forble helbredet (grad 0 lesjoner) av erosiv øsofagitt i betydelig lengre tidsperioder enn de som ble behandlet med ranitidin (p INDIKASJONER OG BRUK ].
Patologiske hypersekretoriske tilstander inkludert Zollinger-Ellison syndrom
åpne studier av 57 pasienter med patologiske hypersekretoriske tilstander, som Zollinger-Ellison syndrom (ZES) med eller uten multiple endokrine adenomer, hemmet PREVACID 15 mg signifikant magesyresekresjon og kontrollerte assosierte symptomer på diaré, anoreksi og smerte. Doser fra 15 mg annenhver dag til 180 mg per dag opprettholdt basalsyresekresjonen under 10 mEq/time hos pasienter uten tidligere gastrisk kirurgi og under 5 mEq/time hos pasienter med tidligere gastrisk kirurgi.
Startdoser ble titrert til den enkelte pasients behov, og justeringer var nødvendig over tid hos noen pasienter [se DOSERING OG ADMINISTRASJON ]. PREVACID ble godt tolerert ved disse høye dosenivåene i lengre perioder (mer enn fire år hos noen pasienter). Hos de fleste ZES-pasienter ble ikke serumgastrinnivåene modifisert av PREVACID. Hos noen pasienter økte imidlertid serumgastrin til nivåer som var høyere enn de som var tilstede før oppstart av lansoprazolbehandling [se INDIKASJONER OG BRUK ].
PASIENTINFORMASJON
FORORD (prev-a-sid) (lansoprazol) kapsler med forsinket frigjøring, for oral bruk og
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazol) oralt desintegrerende tabletter med forsinket frigivelse
Hva er den viktigste informasjonen jeg bør vite om PREVACID og PREVACID 15mg SoluTab?
Du bør ta PREVACID og PREVACID 15 mg SoluTab nøyaktig som foreskrevet, med lavest mulig dose og i kortest mulig tid.
PREVACID og PREVACID SoluTab kan hjelpe dine syrerelaterte symptomer, men du kan fortsatt ha alvorlige mageproblemer.
Snakk med legen din. PREVACID 30mg og PREVACID 30mg SoluTab kan forårsake alvorlige bivirkninger, inkludert:
- . En type nyreproblem (akutt tubulointerstitiell nefritt). Noen personer som tar medisiner med protonpumpehemmere (PPI), inkludert PREVACID 30mg og PREVACID 15mg SoluTab, kan utvikle et nyreproblem kalt akutt tubulointerstitiell nefritt som kan oppstå når som helst under behandling med PPI-medisiner inkludert PREVACID og PREVACID SoluTab. Ring legen din med en gang hvis du har en reduksjon i mengden du tisser eller hvis du har blod i urinen. . Diaré forårsaket av en infeksjon (Clostridium difficile) i tarmene dine. Ring legen din med en gang hvis du har vannaktig avføring eller magesmerter som ikke går over. Du har kanskje feber eller ikke. . Benbrudd (hofte, håndledd eller ryggrad). Benbrudd i hoften, håndleddet eller ryggraden kan forekomme hos personer som tar flere daglige doser av PPI-medisiner og over en lengre periode (et år eller lenger). Fortell legen din dersom du har et beinbrudd, spesielt i hoften, håndleddet eller ryggraden. . Visse typer lupus erythematosus. Lupus erythematosus er en autoimmun lidelse (kroppens immunceller angriper andre celler eller organer i kroppen). Noen mennesker som tar PPI-medisiner, inkludert PREVACID 15mg og PREVACID 30mg SoluTab, kan utvikle visse typer lupus erythematosus eller ha forverring av lupus de allerede har. Ring legen din med en gang hvis du har nye eller forverrede leddsmerter eller utslett på kinnene eller armene som blir verre i solen.
Snakk med legen din om risikoen for disse alvorlige bivirkningene.
PREVACID 15mg og PREVACID SoluTab kan ha andre alvorlige bivirkninger. Se "Hva er de mulige bivirkningene av PREVACID og PREVACID SoluTab?".
Hva er PREVACID og PREVACID 30mg SoluTab?
Et reseptbelagt legemiddel kalt en protonpumpehemmer (PPI) som brukes til å redusere mengden syre i magen.
Hos voksne, PREVACID 15mg og PREVACID SoluTab brukes til:
- . 4 uker for helbredelse og symptomlindring av duodenalsår. . 10 til 14 dager med visse antibiotika for å behandle en infeksjon forårsaket av bakterier kalt H. pylori. . opprettholde tilheling av duodenalsår. PREVACID 30mg har ikke blitt studert utover 12 måneder for dette formålet. . opptil 8 uker for helbredelse og symptomlindring av magesår. . opptil 8 uker for tilheling av magesår hos personer som tar smertestillende legemidler kalt ikke-steroide antiinflammatoriske legemidler (NSAIDs). PREVACID 30mg har ikke blitt studert utover 8 uker for dette formålet. . redusere risikoen for magesår hos personer som har risiko for å utvikle magesår med NSAIDs. PREVACID har ikke blitt studert utover 12 uker for dette formålet. . opptil 8 uker for å behandle halsbrann og andre symptomer som oppstår med gastroøsofageal reflukssykdom (GERD). GERD skjer når syre i magen din rygger opp i røret (øsofagus) som forbinder munnen din med magen. Dette kan forårsake en brennende følelse i brystet eller halsen, sur smak eller raping. . opptil 8 uker for helbredelse og symptomlindring av syrerelatert skade på slimhinnen i spiserøret (kalt erosiv øsofagitt eller EE). Legen din kan foreskrive ytterligere 8 til 16 uker med PREVACID eller PREVACID 15 mg SoluTab til pasienter hvis EE ikke blir bedre eller hvis symptomer kommer tilbake. . opprettholde helbredelse av EE. PREVACID har ikke blitt undersøkt utover 12 måneder for dette formålet. . langtidsbehandling av tilstander der magen lager for mye syre. Dette inkluderer en sjelden tilstand kalt Zollinger-Ellisons syndrom.
Barn: Gi PREVACID 30mg og PREVACID 30mg SoluTab nøyaktig som foreskrevet av barnets lege. Ikke øk dosen av PREVACID og PREVACID SoluTab eller gi barnet ditt PREVACID 15mg og PREVACID 15mg SoluTab lenger enn tiden legen din har fortalt deg.
Hos barn i alderen 1 til 11 år, PREVACID 15mg og PREVACID 15mg SoluTab brukes til:
- . opptil 12 uker for å behandle halsbrann og andre symptomer som kan skje med GERD. . opptil 12 uker for helbredelse og symptomlindring av EE.
Hos barn 12 til 17 år, PREVACID og PREVACID SoluTab brukes til:
- . opptil 8 uker for å behandle halsbrann og andre symptomer som kan skje med GERD. . opptil 8 uker for helbredelse og symptomlindring av EE.
PREVACID 30mg og PREVACID SoluTab anbefales ikke for behandling av symptomene på GERD hos barn under 1 år og kan skade dem.
Ikke ta PREVACID eller PREVACID 15mg SoluTab hvis du er:
- . allergisk mot lansoprazol, andre PPI-medisiner eller noen av ingrediensene i PREVACID 15mg eller PREVACID 30mg SoluTab. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser i PREVACID og PREVACID 30mg SoluTab. . tar et legemiddel som inneholder rilpivirin (EDURANT, COMPLERA, ODEFSEY, JULUCA) som brukes til å behandle HIV-1 (humant immunsviktvirus).
Før du tar PREVACID 15mg eller PREVACID SoluTab, fortell legen din om alle dine medisinske tilstander, inkludert hvis du:
- . har lave nivåer av magnesium, kalsium, kalium eller natrium i blodet eller du tar et vanndrivende middel. . har leverproblemer. . har fenylketonuri. PREVACID SoluTab inneholder aspartam. . er gravid, tror du kan være gravid eller planlegger å bli gravid. PREVACID eller PREVACID SoluTab kan skade det ufødte barnet ditt. Snakk med legen din om mulige risikoer for et ufødt barn hvis PREVACID 30 mg eller PREVACID 15 mg SoluTab tas under graviditet. . ammer eller planlegger å amme. Det er ikke kjent om PREVACID eller PREVACID 30mg SoluTab går over i morsmelk. Snakk med legen din om den beste måten å mate babyen din på hvis du tar PREVACID eller PREVACID SoluTab.
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Fortell legen din spesielt hvis du tar metotreksat (OTREXUP, RASUVO, TREXALL, REDITREX, XATMEP).
Hvordan bør jeg ta PREVACID 15mg og PREVACID 30mg SoluTab?
- . Ta PREVACID 30mg eller PREVACID SoluTab nøyaktig som foreskrevet av legen din. . Ikke endre dosen eller slutt å ta PREVACID 30mg eller PREVACID SoluTab uten å snakke med legen din. . Ta PREVACID 30mg eller PREVACID 15mg SoluTab før måltider.
PREVACID 15mg kapsler:
- .
- . Svelg PREVACID 30 mg kapsler hele. . Ikke knus eller tygg PREVACID kapsler. . Hvis du har problemer med å svelge en hel kapsel, kan du åpne kapselen og ta innholdet sammen med visse matvarer eller juice. Se "Bruksanvisning" på slutten av denne medisinveiledningen for instruksjoner om hvordan du tar PREVACID 30 mg kapsler sammen med visse matvarer eller juice. . Se "Bruksanvisning" på slutten av denne medisinveiledningen for instruksjoner om hvordan du blander og gir PREVACID 30 mg kapsler gjennom en nasogastrisk sonde (NG-slange).
PREVACID SoluTab:
- .
- . PREVACID 30mg SoluTab er en tablett som smelter i munnen med eller uten vann. . Ikke knekk, kutt, knus eller tygg tablettene. . Se "Bruksanvisning" på slutten av denne medisinveiledningen for instruksjoner om hvordan du blander og gir PREVACID SoluTab gjennom en sprøyte og NG-rør.
Hva er de mulige bivirkningene av PREVACID og PREVACID SoluTab?
PREVACID og PREVACID SoluTab kan forårsake alvorlige bivirkninger, inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om PREVACID 30mg og PREVACID SoluTab?". . Lavt nivå av vitamin B12 kroppen kan skje hos personer som har tatt PREVACID 30mg eller PREVACID SoluTab i lang tid (mer enn 3 år). Fortell legen din dersom du har symptomer på lave vitamin B12-nivåer, inkludert kortpustethet, svimmelhet, uregelmessig hjerterytme, muskelsvakhet, blek hud, trøtthetsfølelse, humørsvingninger og prikking eller nummenhet i armer og ben. . Magevekster (fundiske kjertelpolypper). Personer som bruker PPI-medisiner over lang tid har økt risiko for å utvikle en viss type magevekst kalt fundic gland polypper, spesielt etter å ha tatt PPI-medisiner i mer enn 1 år. . Lavt magnesiumnivå i kroppen kan skje hos personer som har tatt PREVACID i minst 3 måneder. Fortell legen din med en gang hvis du har symptomer på lave magnesiumnivåer, inkludert anfall, svimmelhet, uregelmessig hjerterytme, nervøsitet, muskelsmerter eller -svakhet, og spasmer i hender, føtter eller stemme. . Alvorlige hudreaksjoner. PREVACID 15mg kan forårsake sjeldne, men alvorlige hudreaksjoner som kan påvirke hvilken som helst del av kroppen din. Disse alvorlige hudreaksjonene må kanskje behandles på sykehus og kan være livstruende:
- . Hudutslett som kan ha blemmer, avskalling eller blødning på noen del av huden din (inkludert leppene, øynene, munnen, nesen, kjønnsorganene, hendene eller føttene). . Du kan også ha feber, frysninger, kroppssmerter, kortpustethet eller forstørrede lymfeknuter.
Slutt å ta PREVACID og ring legen din umiddelbart. Disse symptomene kan være det første tegn på en alvorlig hudreaksjon.
De vanligste bivirkningene av PREVACID og PREVACID SoluTab inkluderer: diaré, smerter i mageområdet (mage), kvalme og forstoppelse.
Dette er ikke alle mulige bivirkninger av PREVACID 30mg og PREVACID 30mg SoluTab.
Ring legen din for medisinsk råd om bivirkninger.
Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare PREVACID og PREVACID 30mg SoluTab?
Oppbevar PREVACID ved romtemperatur mellom 68°F til 77°F (20°C til 25°C).
Oppbevar PREVACID 15mg og PREVACID SoluTab og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av PREVACID 15mg og PREVACID SoluTab.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk PREVACID eller PREVACID 30mg SoluTab for tilstander som det ikke er foreskrevet for. Ikke gi PREVACID 30mg eller PREVACID SoluTab til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem. Du kan spørre legen din eller apoteket om informasjon om PREVACID 30mg og PREVACID 15mg SoluTab som er skrevet for helsepersonell.
Hva er ingrediensene i PREVACID og PREVACID SoluTab?
Aktiv ingrediens: lansoprazol.
Inaktive ingredienser i PREVACID 30mg kapsler: sukkerkule, sukrose, metakrylsyrekopolymer, lavsubstituert hydroksypropylcellulose, stivelse, magnesiumkarbonat, talkum, polyetylenglykol, titandioksid, polysorbat 80, hydroksypropylcellulose, kolloidalt silisiumdioksid, D&C Red No. 28, FD&C Blue No. 1, og FD&C Rød nr. 40.
Kun PREVACID 15 mg kapsel: FD&C Grønn nr. 3.
Inaktive ingredienser i PREVACID 15mg SoluTab: mannitol, metakrylsyre, hydroksypropylcellulose, laktosemonohydrat-mikrokrystallinsk cellulosesfære, trietylsitrat, krospovidon, polyakrylat, magnesiumkarbonat, aspartam, glycerylmonostearat, hypromellose, magnesiumstearat, sitronsyre, titandioksyd, kunstig smaksstoff, polyglycen, talkum, jordbær polysorbat 80 og jernoksid.
PREVACID SoluTab inneholder 2,5 mg fenylalanin i hver 15 mg tablett og 5,1 mg fenylalanin i hver 30 mg tablett.
INSTRUKSJONER FOR BRUK
FORORD (prev-a-sid) (lansoprazol) kapsler med forsinket frigjøring, for oral bruk og
PREVACID SoluTab (prev-a-sid sol-u-tab) (lansoprazol) oralt desintegrerende tabletter med forsinket frigivelse
Viktig:
- . Ta PREVACID 15mg eller PREVACID 15mg SoluTab før måltider. . Ikke knus eller tygg PREVACID 15mg kapsler eller PREVACID 30mg SoluTab. . PREVACID eller PREVACID 15mg SoluTab skal kun brukes sammen med matvarene og juicene som er oppført nedenfor.
PREVACID kapsler med forsinket frigivelse (PREVACID 30mg kapsler)
Inntak av PREVACID 15 mg kapsler sammen med visse matvarer:
Du kan kun bruke eplemos, ENSURE pudding, cottage cheese, yoghurt eller silte pærer.
. Åpne kapselen. . Dryss granulene på 1 ss eplemos, FORSIKRE pudding, cottage cheese, yoghurt eller silte pærer. . Svelg med en gang.Inntak av PREVACID kapsler med visse juicer:
Du kan bare bruke eplejuice, appelsinjuice eller tomatjuice.
. Åpne kapselen. . Dryss granulene i 60 ml (ca. ¼ kopp) eplejuice, appelsinjuice eller tomatjuice. . Røre. . Svelg med en gang. . For å være sikker på at hele dosen er tatt, tilsett ½ kopp eller mer juice i glasset, rør og svelg med en gang.Å gi PREVACID kapsler gjennom en nasogastrisk sonde (NG-slange) størrelse 16 French eller større:
Du kan bare bruke eplejuice.
. Ha 40 ml eplejuice i en ren beholder. . Åpne kapselen og tøm granulatene i beholderen med eplejuice. . Bruk en sprøyte med kateterspiss til å trekke opp eplejuice- og granulatblandingen. . Bland forsiktig kateterspissen for å forhindre at granulatene setter seg. . Fest kateterspisssprøyten til NG-røret. . Gi blandingen med en gang gjennom NG-røret som går inn i magen. Ikke oppbevar eplejuice- og granulatblandingen til senere bruk. . Fyll kateterspisssprøyten med 40 ml eplejuice og bland forsiktig. Skyll NG-røret med eplejuice.PREVACID 15mg SoluTab oralt desintegrerende tabletter med forsinket frigivelse (PREVACID SoluTab)
. Ikke tygge, knuse, kutte eller knekke tablettene. . Legg tabletten på tungen og la den løse seg opp, med eller uten vann. . Svelg etter at tabletten er oppløst. . Tabletten løses vanligvis opp på mindre enn 1 minutt.For pasienter som har problemer med å svelge tabletter, kan PREVACID SoluTab gis som følger:
Å gi PREVACID SoluTab med vann med en oral sprøyte:
. Sett en 15 mg tablett i en oral sprøyte og trekk opp 4 mL vann i oralsprøyten, eller legg en 30 mg tablett i en oral sprøyte og trekk opp 10 mL vann i oralsprøyten. . Rist den orale sprøyten forsiktig for å blande tabletten og vannet. . Etter at tabletten er blandet i vannet, plasser spissen av oral sprøyte i munnen. Gi medisinen innen 15 minutter etter blanding. Ikke oppbevar tabletten og vannblandingen for senere bruk. . Fyll den orale sprøyten på nytt med ca. 2 mL vann for 15 mg tabletten eller 5 mL vann for 30 mg tabletten, og rist forsiktig. Plasser spissen av oral sprøyte i munnen og gi medisinen som er igjen i sprøyten.Å gi PREVACID 15 mg SoluTab med vann gjennom en nasogastrisk sonde (NG-slange) størrelse 8 fransk eller større:
. Sett en 15 mg tablett i en kateterspisssprøyte og trekk opp 4 mL vann, eller legg en 30 mg tablett i en kateterspisssprøyte og trekk opp 10 mL vann. . Rist forsiktig kateterspissen for å blande tabletten og vannet. . Koble kateterspisssprøyten til NG-røret. . Gi blandingen med en gang gjennom NG-røret som går inn i magen. Gi medisinen innen 15 minutter etter blanding. Ikke lagre granulatet og vannblandingen for senere bruk. . Fyll igjen kateterspisssprøyten med ca. 5 ml vann og rist forsiktig. Skyll NG-røret med vannet.Hvordan bør jeg oppbevare PREVACID og PREVACID 30mg SoluTab?
- . Oppbevar PREVACID-kapsler og PREVACID 15mg SoluTab ved romtemperatur mellom 20°C til 25°C (68°F til 77°F).
Oppbevar PREVACID og PREVACID 30mg SoluTab og alle legemidler utilgjengelig for barn.
Denne bruksanvisningen er godkjent av US Food and Drug Administration.
