Pentasa 400mg Mesalamine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Pentasa og hvordan brukes det?
Pentasa er et reseptbelagt legemiddel som brukes til å behandle symptomene på ulcerøs kolitt. Pentasa 400mg kan brukes alene eller sammen med andre medisiner.
Pentasa tilhører en klasse legemidler som kalles 5-aminosalisylsyrederivater.
Det er ikke kjent om Pentasa er trygt og effektivt hos barn eldre enn 5 år.
Hva er de mulige bivirkningene av Pentasa?
Pentasa kan forårsake alvorlige bivirkninger inkludert:
- . sterke magesmerter, . magekramper, . blodig diaré, . feber, . hodepine, . hudutslett, . blodig eller tjæreaktig avføring, . hoster opp blod, . oppkast som ser ut som kaffegrut, . lite eller ingen vannlating, . smertefull eller vanskelig vannlating, . hevelse i føttene eller anklene, . føler seg trett eller kortpustet, . tap av Appetit, . smerter i øvre mage, . tretthet, . lett blåmerker eller blødninger, . mørk urin, . leirefarget avføring, og . gulfarging av hud eller øyne
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Pentasa 400mg inkluderer:
- . kvalme, . oppkast, . magesmerter, . diaré, . fordøyelsesbesvær, . gass, . hodepine, . utslett, og . unormale leverfunksjonstester
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Pentasa. Spør legen din eller apoteket for mer informasjon.
BESKRIVELSE
PENTASA (mesalamin) for oral administrering er en formulering med kontrollert frigjøring av mesalamin, et antiinflammatorisk aminosalicylatmiddel for gastrointestinal bruk.
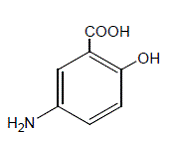
Kjemisk er mesalamin 5-amino-2-hydroksybenzosyre. Den har en molekylvekt på 153,14.
Strukturformelen er:
Hver 250 mg kapsel inneholder 250 mg mesalamin. Den inneholder også følgende inaktive ingredienser: acetylert monoglyserid, lakserolje, kolloidalt silisiumdioksid, etylcellulose, hydroksypropylmetylcellulose, stivelse, stearinsyre, sukker, talkum og hvit voks. Kapselskallet inneholder D&C Yellow #10, FD&C Blue #1, FD&C Green #3, gelatin, titandioksid og andre ingredienser.
Hver 500 mg kapsel inneholder 500 mg mesalamin. Den inneholder også følgende inaktive ingredienser: acetylert monoglyserid, lakserolje, kolloidalt silisiumdioksid, etylcellulose, hydroksypropylmetylcellulose, stivelse, stearinsyre, sukker, talkum og hvit voks. Kapselskallet inneholder FD&C Blue #1, gelatin, titandioksid og andre ingredienser.
INDIKASJONER
PENTASA 400mg er indisert for induksjon av remisjon og for behandling av voksne pasienter med mild til moderat aktiv ulcerøs kolitt.
DOSERING OG ADMINISTRASJON
Den anbefalte dosen for induksjon av remisjon og symptomatisk behandling av mild til moderat aktiv ulcerøs kolitt hos voksne er 1 g (4 PENTASA 250 mg kapsler eller 2 PENTASA 500 mg kapsler) 4 ganger daglig for en total daglig dose på 4 g. Behandlingsvarigheten i kontrollerte studier var opptil 8 uker.
PENTASA-kapsler kan svelges hele, eller alternativt kan kapselen åpnes og hele innholdet drysses på eplemos eller yoghurt. Hele innholdet bør konsumeres umiddelbart. Kapslene og kapselinnholdet må ikke knuses eller tygges.
Drikk tilstrekkelig mengde væske.
Sikkerhet og effekt av PENTASA 400mg hos pediatriske pasienter er ikke fastslått.
HVORDAN LEVERES
PENTASA utvidet utgivelse 250 mg kapsler leveres i flasker med 240 kapsler ( NDC 54092-189-81). Hver grønn og blå kapsel inneholder 250 mg mesalamin i perler med forlenget frigivelse. PENTASA-kapsler med utvidet utløsning er identifisert med en femkantet stjerneutbruddslogo og nummeret 2010 på den grønne delen og S429 250 mg på den blå delen av kapslene.
PENTASA utvidet utgivelse 500 mg kapsler leveres i flasker med 120 kapsler ( NDC 54092-191-12). Hver blå kapsel inneholder 500 mg mesalamin i perler med forlenget frigivelse. PENTASA 400 mg kapsler med utvidet frigivelse er identifisert med en femkantet stjerneutbruddslogo og S429 500 mg på kapslene.
Oppbevares ved 25°C (77°F); ekskursjoner tillatt til 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur].
For å rapportere MISTENTE BIVIRKNINGER, kontakt Takeda Pharmaceuticals på 1800-828-2088 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
Distribuert av: Takeda Pharmaceuticals America, Inc. Lexington, MA 02421, USA. Revidert: november 2021
BIVIRKNINGER
I kombinerte innenlandske og utenlandske kliniske studier fikk mer enn 2100 pasienter med ulcerøs kolitt eller Crohns sykdom PENTASA-behandling. Generelt ble PENTASA-terapi godt tolerert. De vanligste hendelsene (dvs. større enn eller lik 1 %) var diaré (3,4 %), hodepine (2,0 %), kvalme (1,8 %), magesmerter (1,7 %), dyspepsi (1,6 %), oppkast (1,5 %). %) og utslett (1,0 %).
to innenlandske placebokontrollerte studier som involverte over 600 pasienter med ulcerøs kolitt, var bivirkninger færre hos PENTASA (mesalamin)-behandlede pasienter enn i placebogruppen (PENTASA 14 % vs. placebo 18 %) og var ikke doserelaterte. Hendelser som inntreffer hos mer enn 1 % er vist i tabellen nedenfor. Av disse var det bare kvalme og oppkast som var hyppigere i PENTASA-gruppen. Seponering fra behandling på grunn av bivirkninger var mer vanlig på placebo enn PENTASA (7 % vs 4 %).
Kliniske laboratoriemålinger viste ingen signifikante unormale trender for noen test, inkludert måling av hematologisk funksjon, lever- og nyrefunksjon.
Følgende uønskede hendelser, presentert av kroppens system, ble rapportert sjelden (dvs. mindre enn 1 %) under huslig ulcerøs kolitt og Crohns sykdom-studier. I mange tilfeller er forholdet til PENTASA ikke etablert.
Gastrointestinale: abdominal oppblåsthet, anoreksi, forstoppelse, duodenalsår, dysfagi, eruktasjon, esophageal ulcus, fekal inkontinens, GGTP-økning, GI-blødninger, økt alkalisk fosfatase, LDH-økning, munnsår, oral moniliasis, pankreatitt, SG SG-økning, SGOT-økning, avføringsavvik (farge- eller teksturendring), tørste
Dermatologisk: akne, alopecia, tørr hud, eksem, erythema nodosum, neglelidelse, lysfølsomhet, kløe, svette, urticaria
Nervesystemet: depresjon, svimmelhet, søvnløshet, somnolens, parestesi
Kardiovaskulær: hjertebank, perikarditt, vasodilatasjon
Annen: albuminuri, amenoré, amylaseøkning, artralgi, asteni, brystsmerter, konjunktivitt, ekkymose, ødem, feber, hematuri, hypomenoré, Kawasaki-lignende syndrom, leggkramper, lichen planus, lipaseøkning, ubehag, menorgiragi, mymongiroragi, , trombocytemi, trombocytopeni, urinfrekvens
En uke etter fullføring av en 8-ukers ulcerøs kolitt-studie utviklet en 72 år gammel mann, uten tidligere lungeproblemer, dyspné. Pasienten ble deretter diagnostisert med interstitiell lungefibrose uten eosinofili av en lege og bronchiolitis obliterans med organiserende pneumonitt av en annen lege. En årsakssammenheng mellom denne hendelsen og mesalaminbehandling er ikke fastslått.
Publiserte kasusrapporter og/eller spontan overvåking etter markedsføring har beskrevet sjeldne tilfeller av perikarditt, fatal myokarditt, brystsmerter og T-bølgeabnormiteter, overfølsomhetspneumonitt, pankreatitt, nefrotisk syndrom, interstitiell nefritis, hepatitt, aplastisk anemi, pneumoni, pneumoni, pneumoni, pneumoni og granulat. anemi mens du får mesalaminbehandling. Anemi kan være en del av den kliniske presentasjonen av inflammatorisk tarmsykdom. Allergiske reaksjoner, som kan involvere eosinofili, kan sees i forbindelse med PENTASA 400 mg-behandling.
Postmarketing-rapporter
Følgende hendelser har blitt identifisert under bruk etter godkjenning av PENTASA-merket av mesalamin i klinisk praksis. Fordi de rapporteres frivillig fra en populasjon av ukjent størrelse, kan det ikke gjøres estimater for frekvens. Disse hendelsene er valgt for inkludering på grunn av en kombinasjon av alvorlighetsgrad, rapporteringsfrekvens eller potensiell årsakssammenheng til mesalamin:
Gastrointestinale: Rapporter om levertoksisitet, inkludert forhøyede leverenzymer (SGOT/AST, SGPT/ALT, GGT, LDH, alkalisk fosfatase, bilirubin), hepatitt, gulsott, kolestatisk gulsott, cirrhose og mulig hepatocellulær skade inkludert levernekrose og leversvikt. Noen av disse tilfellene var dødelige. Ett tilfelle av Kawasaki-lignende syndrom som inkluderte leverfunksjonsendringer ble også rapportert.
Annen: anafylaktisk reaksjon, SJS/TEN, DRESS, AGEP, pleuritt/pleuritt, lungebetennelse, granulocytopeni, systemisk lupus erythematosus, lupuslignende syndrom, akutt nyresvikt, interstitiell lungesykdom, hypersensitivitetspneumonitt (inkludert interstitiell lungebetennelse, pneumonolitt), kronisk nyresvikt, nefrogen diabetes insipidus, nefrolithiasis, intrakraniell hypertensjon, angioødem og oligospermi (reversibel).
NARKOTIKAHANDEL
Ingen undersøkelser av interaksjoner mellom PENTASA 400mg og andre legemidler er utført; Imidlertid er følgende legemiddelinteraksjoner rapportert for produkter som inneholder mesalamin:
Nefrotoksiske midler, inkludert ikke-steroide antiinflammatoriske legemidler
Samtidig bruk av mesalamin og kjente nefrotoksiske midler, inkludert ikke-steroide antiinflammatoriske legemidler (NSAIDs), kan øke risikoen for nefrotoksisitet. Overvåk pasienter som tar nefrotoksiske legemidler for endringer i nyrefunksjon og mesalaminrelaterte bivirkninger.

Azatioprin eller 6-merkaptopurin
Samtidig bruk av mesalamin med azatioprin eller 6-merkaptopurin og/eller andre legemidler som er kjent for å forårsake myelotoksisitet kan øke risikoen for blodsykdommer, benmargssvikt og tilhørende komplikasjoner. Hvis samtidig bruk av PENTASA og azatioprin eller 6-merkaptopurin ikke kan unngås, overvåk blodprøver, inkludert fullstendig blodcelletall og blodplatetall.
ADVARSLER
Ingen informasjon gitt
FORHOLDSREGLER
Nedsatt nyrefunksjon
Nedsatt nyrefunksjon, inkludert minimal endringssykdom, akutt og kronisk interstitiell nefritis, og nyresvikt er rapportert hos pasienter som har fått PENTASA eller andre produkter som inneholder mesalamin eller er konvertert til mesalamin.
Mesalamin er kjent for å utskilles i stor grad av nyrene, og risikoen for bivirkninger kan være større hos pasienter med nedsatt nyrefunksjon. Evaluer nyrefunksjonen hos alle pasienter før oppstart og med jevne mellomrom under behandling med PENTASA. Vurder risikoen og fordelene ved bruk av PENTASA hos pasienter med kjent nedsatt nyrefunksjon eller en historie med nyresykdom eller samtidig bruk av nefrotoksiske legemidler.
Mesalamin-indusert akutt intoleransesyndrom
Mesalamin har vært assosiert med et akutt intoleransesyndrom som kan være vanskelig å skille fra en oppblomstring av inflammatorisk tarmsykdom. Symptomer inkluderer kramper, akutte magesmerter, blodig diaré, og noen ganger feber, hodepine og utslett. Overvåk pasienter for forverring av disse symptomene under behandling. Ved mistanke om akutt intoleransesyndrom, avbryt behandlingen med PENTASA umiddelbart.
Overfølsomhetsreaksjoner
Overfølsomhetsreaksjoner er rapportert hos pasienter som tar sulfasalazin. Noen pasienter kan ha en lignende reaksjon på PENTASA eller på andre forbindelser som inneholder eller omdannes til mesalamin.
Som med sulfasalazin, kan mesalamin-induserte overfølsomhetsreaksjoner presentere seg som indre organpåvirkning, inkludert myokarditt, perikarditt, nefritt, hepatitt, pneumonitt og hematologiske abnormiteter. Evaluer pasienter umiddelbart hvis tegn eller symptomer på en overfølsomhetsreaksjon er tilstede. Seponer PENTASA hvis en alternativ etiologi for tegn og symptomer ikke kan fastslås.
Leversvikt
Det har vært rapporter om leversvikt hos pasienter med eksisterende leversykdom som har fått andre produkter som inneholder mesalamin. Vurder risikoene og fordelene ved å bruke PENTASA 400mg hos pasienter med kjent nedsatt leverfunksjon.
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, som Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), medikamentreaksjoner med eosinofili og systemiske symptomer (DRESS), og akutt generalisert eksantematøs pustulose (AGEP) er rapportert ved bruk av mesalamin (se BIVIRKNINGER ). Seponer PENTASA ved de første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhet og vurder videre evaluering.
Fotosensitivitet
Pasienter med eksisterende hudsykdommer som atopisk dermatitt og atopisk eksem har rapportert om mer alvorlige lysfølsomhetsreaksjoner. Råd pasientene til å unngå soleksponering, bruk verneklær og bruk en bredspektret solkrem når de er utendørs.
Nefrolitiasis
Tilfeller av nefrolithiasis er rapportert ved bruk av mesalamin, inkludert steiner med 100 % mesalamininnhold. Mesalaminholdige steiner er radiotransparente og ikke detekterbare ved standard radiografi eller computertomografi (CT). Sørg for tilstrekkelig hydrering under behandlingen.
Interferens med laboratorietester
Bruk av mesalamin kan føre til falske forhøyede testresultater ved måling av urinnormetanefrin ved væskekromatografi med elektrokjemisk deteksjon på grunn av likheten i kromatogrammene til normetanefrin og mesalamins hovedmetabolitt, N-acetyl-5-aminosalisylsyre (N-Ac-5-ASA) ). Vurder en alternativ, selektiv analyse for normetanefrin.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
I en 104-ukers diettkarsinogenitetsstudie av mesalamin ble CD-1-mus behandlet med doser opp til 2500 mg/kg/dag, og de var ikke tumorogene. For en person på 50 kg med gjennomsnittlig høyde (1,46 m2 kroppsoverflate), representerer dette 2,5 ganger den anbefalte dosen for mennesker på basis av kroppsoverflate (2960 mg/m2/dag). I en 104-ukers diettkarsinogenitetsstudie på Wistar-rotter var mesalamin opp til en dose på 800 mg/kg/dag ikke tumorfremkallende. Denne dosen representerer 1,5 ganger den anbefalte dosen for mennesker på basis av kroppsoverflate.
Ingen tegn på mutagenitet ble observert i en in vitro Ames-test og i en in vivo-mikronukleustest hos mus.
Ingen effekter på fertilitet eller reproduksjonsevne ble observert hos hann- eller hunnrotter ved orale doser av mesalamin på opptil 400 mg/kg/dag (0,8 ganger anbefalt human dose basert på kroppsoverflate).
Sædavvik og infertilitet hos menn, som er rapportert i forbindelse med sulfasalazin, har ikke blitt sett med PENTASA 400 mg kapsler under kontrollerte kliniske studier.
Svangerskap
Teratogene effekter
Publiserte data fra metaanalyser, kohortstudier og kasusserier om bruk av mesalamin under graviditet har ikke pålitelig informert om en sammenheng med mesalamin og store fødselsskader, spontanabort eller ugunstige utfall hos mor eller foster. Det er ingen klare bevis for at mesalamineksponering tidlig i svangerskapet er assosiert med økt risiko for alvorlige medfødte misdannelser, inkludert hjertemisdannelser. Publiserte epidemiologiske studier har viktige metodologiske begrensninger som hindrer tolkning av dataene, inkludert manglende evne til å kontrollere for konfoundere, slik som underliggende morssykdom, mors bruk av samtidige medisiner, og manglende informasjon om dose og varighet av bruk for mesalaminprodukter. PENTASA skal kun brukes under graviditet hvis fordelene oppveier risikoen.
reproduksjonsstudier på dyr avslørte oral administrering av mesalamin under organogenese til gravide rotter i doser opptil 1000 mg/kg/dag (5900 mg/m²) og kaniner ved doser på 800 mg/kg/dag (6856 mg/m²) ingen bevis. av teratogene effekter eller skade på fosteret på grunn av mesalamin.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for de angitte populasjonene er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanaborter i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Ikke-ratatogene effekter
Publiserte data tyder på at økt sykdomsaktivitet er assosiert med risikoen for å utvikle uønskede graviditetsutfall hos kvinner med ulcerøs kolitt. Uønskede graviditetsutfall inkluderer prematur fødsel (før 37 uker med svangerskap), lav fødselsvekt (mindre enn 2500 g) spedbarn og små for svangerskapsalderen ved fødselen.
Ammende mødre
Data fra publisert litteratur rapporterer tilstedeværelsen av mesalamin og dets metabolitt, N-acetyl-5-aminosalisylsyre, i morsmelk i små mengder med relative spedbarnsdoser (RID) på 0,1 % eller mindre for mesalamin. Den kliniske betydningen av dette er ikke fastslått og det er begrenset erfaring med ammende kvinner som bruker mesalamin.
Det er rapportert om diaré hos spedbarn som ammes utsatt for mesalamin. Effekten av PENTASA 400mg på melkeproduksjonen er ukjent. Vær forsiktig hvis PENTASA 400mg gis til en ammende kvinne og overvåk ammende spedbarn for diaré.
publiserte laktasjonsstudier varierte maternelle mesalamindoser fra ulike orale og rektale formuleringer og produkter fra 500 mg til 4,8 g daglig. Gjennomsnittlig konsentrasjon av mesalamin i melk varierte fra ikke-påviselig til 0,5 mg/L. Gjennomsnittlig konsentrasjon av N-acetyl-5-aminosalisylsyre i melk varierte fra 0,2 til 9,3 mg/L. Basert på disse konsentrasjonene er estimerte daglige doser for spedbarn for et spedbarn som kun ammes 0 til 0,075 mg/kg/dag mesalamin (RID 0% til 0,1%) og 0,03 til 1,4 mg/kg/dag N-acetyl-5-aminosalisylsyre. syre.
Pediatrisk bruk
Sikkerhet og effekt av PENTASA hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Kliniske studier av PENTASA 400 mg inkluderte ikke tilstrekkelig antall pasienter i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre pasienter. Rapporter fra ukontrollerte kliniske studier og rapporteringssystemer etter markedsføring antydet en høyere forekomst av bloddyskrasier (dvs. agranulocytose, nøytropeni og pancytopeni) hos pasienter som fikk mesalaminholdige produkter som PENTASA 400 mg som var 65 år eller eldre sammenlignet med yngre pasienter. Overvåk fullstendig blodcelletall og blodplatetall hos eldre pasienter under behandling med PENTASA.
Generelt bør du vurdere den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling hos eldre pasienter når du forskriver PENTASA.
OVERDOSE
PENTASA 400mg er et aminosalisylat, og symptomer på salisylattoksisitet kan være mulig, slik som: kvalme, oppkast, magesmerter, takypné, hyperpné, tinnitus og nevrologiske symptomer (hodepine, svimmelhet, forvirring, anfall). Alvorlig forgiftning med salisylater kan føre til elektrolytt- og pH-ubalanse i blodet og potensielt til skade på andre organer (f.eks. nyre og lever).
Behandling av overdosering
Det finnes ingen spesifikk motgift for overdosering av mesalamin; konvensjonell terapi for salisylattoksisitet kan imidlertid være fordelaktig ved akutt overdosering og kan inkludere gastrointestinal kanalen dekontaminering for å forhindre ytterligere absorpsjon. Korriger væske- og elektrolyttubalanse ved å administrere passende intravenøs terapi og opprettholde tilstrekkelig nyrefunksjon.
KONTRAINDIKASJONER
PENTASA er kontraindisert hos pasienter med kjent eller mistenkt overfølsomhet overfor salisylater, aminosalisylater eller andre komponenter i denne medisinen.
KLINISK FARMAKOLOGI
Sulfasalazin deles ved bakteriell virkning i tykktarmen til sulfapyridin (SP) og mesalamin (5-ASA). Den vanlige orale dosen av sulfasalazin for aktiv ulcerøs kolitt hos voksne er 2 til 4 g per dag i delte doser. Fire gram sulfasalazin gir 1,6 g fri mesalamin til tykktarmen.
Virkningsmekanismen til mesalamin (og sulfasalazin) er ikke fullt ut forstått, men det ser ut til å være en aktuell anti-inflammatorisk effekt på epitelceller i tykktarmen. Slimhinneproduksjonen av arakidonsyre (AA)-metabolitter, både gjennom cyklooksygenase-veiene (dvs. prostanoider) og gjennom lipoksygenase-veiene (dvs. leukotriener (LT-er) og hydroksyeikosatetraensyrer (HETE-er), økes hos pasienter med ulcerøs kolitt, og det er mulig at mesalamin reduserer betennelse ved å blokkere cyklooksygenase og hemme prostaglandin (PG) produksjon i tykktarmen.
Menneskelig farmakokinetikk og metabolisme
Absorpsjon
PENTASA er en etylcellulosebelagt formulering med forlenget frigjøring av mesalamin designet for å frigjøre terapeutiske mengder mesalamin i hele mage-tarmkanalen. Basert på urinutskillelsesdata absorberes 20 % til 30 % av mesalaminet i PENTASA. I motsetning til dette, når mesalamin administreres oralt som en uformulert 1-g vandig suspensjon, absorberes mesalamin omtrent 80 %.
Plasmamesalaminkonsentrasjonen nådde en topp på omtrent 1 mcg/ml 3 timer etter en 1-g PENTASA-dose og avtok på en bifasisk måte. Litteraturen beskriver en gjennomsnittlig terminal halveringstid på 42 minutter for mesalamin etter intravenøs administrering. På grunn av kontinuerlig frigjøring og absorpsjon av mesalamin fra PENTASA gjennom mage-tarmkanalen, kan den sanne eliminasjonshalveringstiden ikke bestemmes etter oral administrering. N-acetyl-5-aminosalisylsyre, hovedmetabolitten til mesalamin (5-aminosalisylsyre), nådde en topp ved ca. 3 timer ved 1,8 mcg/ml, og konsentrasjonen fulgte en bifasisk nedgang. Farmakologisk aktivitet av N-acetyl-5-aminosalisylsyre er ukjent, og andre metabolitter er ikke identifisert.
Oral mesalamin-farmakokinetikk var ikke-lineær når PENTASA-kapsler ble dosert fra 250 mg til 1 g fire ganger daglig, med steady-state mesalamin-plasmakonsentrasjoner som økte omtrent ni ganger, fra 0,14 mcg/mL til 1,21 mcg/ml, noe som tyder på mettbar førstepassasjemetabolisme. N-acetyl-5-aminosalisylsyre-farmakokinetikken var lineær.
Eliminering
Omtrent 130 mg fritt mesalamin ble gjenvunnet i avføringen etter en enkelt 1-g PENTASA 400 mg dose, som var sammenlignbar med de 140 mg mesalamin som ble gjenvunnet fra den molare ekvivalente sulfasalazin-tablettdosen på 2,5 g. Eliminering av fritt mesalamin og salisylater i feces økte proporsjonalt med PENTASA-dosen. N-acetyl-5-aminosalisylsyre var den primære forbindelsen som ble utskilt i urinen (19 % til 30 %) etter PENTASA 400 mg dosering.
Kliniske studier
to randomiserte, dobbeltblinde, placebokontrollerte, dose-respons-studier (UC-1 og UC-2) med 625 pasienter med aktiv mild til moderat ulcerøs kolitt, PENTASA 400 mg, ved en oral dose på 4 g/dag gitt 1 g fire ganger daglig, ga konsekvent forbedring i prospektivt identifiserte primære effektparametere, PGA, Tx F og SI som vist i tabellen nedenfor.
4-g-dosen av PENTASA ga også konsekvent forbedring i sekundære effektparametere, nemlig hyppigheten av toalettturer, konsistens av avføringen, rektal blødning, mage/rektal smerte og haster. 4-g dosen av PENTASA induserte remisjon, vurdert ved endoskopiske og symptomatiske endepunkter.
Hos noen pasienter ble 2-g-dosen av PENTASA 400 mg observert for å forbedre målte effektparametere. Imidlertid ga 2-g-dosen inkonsistente resultater i primære effektparametere på tvers av de to tilstrekkelige og godt kontrollerte studiene.
PASIENTINFORMASJON
Ingen informasjon gitt. Vennligst referer til FORHOLDSREGLER seksjon.
