Prilosec 40mg, 10mg, 20mg Omeprazole Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Prilosec 40mg og hvordan brukes det?
Prilosec 40mg er et reseptbelagt og reseptfritt legemiddel som brukes til å behandle symptomene på gastroøsofageal reflukssykdom (GERD), magesår og andre tilstander forårsaket av for mye magesyre. Prilosec 10mg kan brukes alene eller sammen med andre medisiner.
Prilosec tilhører en klasse legemidler som kalles protonpumpehemmere.
Det er ikke kjent om Prilosec 40mg er trygt og effektivt hos barn yngre enn 1 måned.
Hva er de mulige bivirkningene av Prilosec 10mg?
Prilosec kan forårsake alvorlige bivirkninger, inkludert:
- . sterke magesmerter, . diaré som er vannaktig eller blodig, . nye eller uvanlige smerter i håndledd, lår, hofte eller rygg, . anfall (kramper), . lite eller ingen vannlating, . blod i urinen, . opphovning, . rask vektøkning, . svimmelhet, . uregelmessige hjerteslag, . føler seg nervøs, . muskel kramper, . muskelspasmer, . hoste, . kvelende følelse, . leddsmerter, og . hudutslett på kinnene eller armene som forverres med sollys
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Prilosec inkluderer:
- . magesmerter, . gass, . kvalme, . oppkast, . diaré, og . hodepine
BESKRIVELSE
Den aktive ingrediensen i PRILOSEC (omeprazol) kapsler med forsinket frigjøring er en substituert benzimidazol, 5-metoksy-2-[[(4-metoksy-3, 5-dimetyl-2-pyridinyl) metyl] sulfinyl]-1H-benzimidazol, en forbindelse som hemmer magesyresekresjonen. Dens empiriske formel er C17H19N3O3S, med en molekylvekt på 345,42. Strukturformelen er:
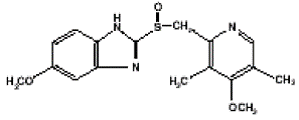
Omeprazol er et hvitt til off-white krystallinsk pulver som smelter ved nedbrytning ved ca. 155°C. Det er en svak base, fritt løselig i etanol og metanol, og lett løselig i aceton og isopropanol og svært lite løselig i vann. Stabiliteten til omeprazol er en funksjon av pH; det brytes raskt ned i sure medier, men har akseptabel stabilitet under alkaliske forhold.
Den aktive ingrediensen i PRILOSEC (omeprazolmagnesium) for oral suspensjon med forsinket frigjøring, er 5-metoksy-2-[[(4-metoksy-3,5-dimetyl-2-pyridinyl)metyl]sulfinyl]-1H-benzimidazol, magnesium salt (2:1)
Omeprazolmagnesium er et hvitt til offwhite pulver med smeltepunkt ved nedbrytning ved 200°C. Saltet er lett løselig (0,25 mg/ml) i vann ved 25°C, og det er løselig i metanol. Halveringstiden er svært pH-avhengig.
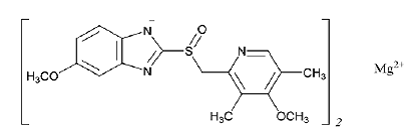
Den empiriske formelen for omeprazolmagnesium er (C17H18N3O3S)2 Mg, molekylvekten er 713,12 og strukturformelen er:
PRILOSEC leveres som kapsler med forsinket frigjøring for oral administrering. Hver kapsel med forsinket frigjøring inneholder enten 10 mg, 20 mg eller 40 mg omeprazol i form av enterisk belagte granuler med følgende inaktive ingredienser: cellulose, dinatriumhydrogenfosfat, hydroksypropylcellulose, hypromellose, laktose, mannitol, natriumlaurylsulfat og andre ingredienser. Kapselskallene har følgende inaktive ingredienser: gelatin-NF, FD&C Blue #1, FD&C Red #40, D&C Red #28, titandioksid, syntetisk svart jernoksid, isopropanol, butylalkohol, FD&C Blue #2, D&C Red #7 Calcium Lake, og i tillegg inneholder kapselskallene på 10 mg og 40 mg også D&C Yellow #10.
Hver pakke med PRILOSEC For Delayed-Release Oral Suspension inneholder enten 2,8 mg eller 11,2 mg omeprazolmagnesium (tilsvarer 2,5 mg eller 10 mg omeprazol), i form av enterisk belagte granuler med følgende inaktive ingredienser: glyseylmonostearat, hydroksypropylmonostearat cellulose, hypromellose, magnesiumstearat, metakrylsyrekopolymer C, polysorbat, sukkerkuler, talkum og trietylsitrat, og også inaktive granuler. De inaktive granulatene er sammensatt av følgende ingredienser: sitronsyre, krospovidon, dekstrose, hydroksypropylcellulose, jernoksid og xanthamgummi. Omeprazolgranulene og inaktive granuler er sammensatt med vann for å danne en suspensjon og gis ved oral, nasogastrisk eller direkte gastrisk administrering.
INDIKASJONER
Behandling av aktivt duodenalsår
PRILOSEC 20 mg er indisert for korttidsbehandling av aktivt duodenalsår hos voksne. De fleste pasienter helbreder innen fire uker. Noen pasienter kan trenge ytterligere fire ukers behandling.
Helicobacter pylori utryddelse for å redusere risikoen for tilbakefall av duodenalsår
Utryddelse av H. pylori har vist seg å redusere risikoen for tilbakefall av duodenalsår.
Trippel terapi
PRILOSEC 40 mg i kombinasjon med klaritromycin og amoksicillin er indisert for behandling av pasienter med H. pylori-infeksjon og duodenalsår (aktiv eller opptil 1 års historie) for å utrydde H. pylori hos voksne.
Dobbel terapi
PRILOSEC i kombinasjon med klaritromycin er indisert for behandling av pasienter med H. pylori-infeksjon og duodenalsårsykdom for å utrydde H. pylori hos voksne.
Blant pasienter som mislykkes i behandlingen, er det mer sannsynlig at PRILOSEC med klaritromycin er assosiert med utvikling av klaritromycinresistens sammenlignet med trippelbehandling. Hos pasienter som mislykkes i behandlingen, bør følsomhetstesting utføres. Hvis resistens mot klaritromycin er påvist eller følsomhetstesting ikke er mulig, bør alternativ antimikrobiell behandling settes i gang [se KLINISK FARMAKOLOGI og klaritromycinforskrivningsinformasjon, mikrobiologiseksjonen].
Behandling av aktivt godartet magesår
PRILOSEC er indisert for korttidsbehandling (4 til 8 uker) av aktivt godartet magesår hos voksne.
Behandling av symptomatisk gastroøsofageal reflukssykdom (GERD)
PRILOSEC er indisert for behandling av halsbrann og andre symptomer assosiert med GERD i opptil 4 uker hos pasienter 1 år og eldre.
Behandling av erosiv øsofagitt (EE) på grunn av syremediert GERD
Pediatriske pasienter 1 år til voksne
PRILOSEC 20 mg er indisert for korttidsbehandling (4 til 8 uker) av EE på grunn av syremediert GERD som er diagnostisert ved endoskopi hos pasienter 1 år og eldre.
Effekten av PRILOSEC 10 mg brukt i mer enn 8 uker hos pasienter med EE er ikke fastslått. Hvis en pasient ikke responderer på 8 ukers behandling, kan det gis ytterligere 4 ukers behandling. Hvis det er tilbakefall av EE- eller GERD-symptomer (f.eks. halsbrann), kan ytterligere 4 til 8 ukers kurs med PRILOSEC vurderes.
Pediatriske pasienter fra 1 måned til under 1 år
PRILOSEC er indisert for korttidsbehandling (opptil 6 uker) av EE på grunn av syremediert GERD hos pediatriske pasienter fra 1 måned til under 1 år.
Vedlikehold av helbredelse av EE på grunn av syremediert GERD
PRILOSEC 40mg er indisert for vedlikeholdsheling av EE på grunn av syremediert GERD hos pasienter 1 år og eldre.
Kontrollerte studier strekker seg ikke utover 12 måneder.
Patologiske hypersekretoriske tilstander
PRILOSEC 40 mg er indisert for langtidsbehandling av patologiske hypersekretoriske tilstander (f.eks. Zollinger-Ellisons syndrom, multiple endokrine adenomer og systemisk mastocytose) hos voksne.
DOSERING OG ADMINISTRASJON
Anbefalt doseringsregime for voksne etter indikasjon
Tabell 1 viser anbefalt dosering av PRILOSEC 40 mg til voksne pasienter etter indikasjon.
Anbefalt pediatrisk doseringsregime etter indikasjon
Tabell 2 viser anbefalt dosering av PRILOSEC hos pediatriske pasienter etter indikasjon.
Administrasjonsinstruksjoner
- . PRILOSEC 40mg er ment å tilberedes i vann og administreres oralt eller via en nasogastrisk (NG) eller gastrisk sonde. . Ta PRILOSEC 40 mg før måltider. . Antacida kan brukes samtidig med PRILOSEC. . Glemte doser: Hvis en dose glemmes, gis så snart som mulig. Imidlertid, hvis neste planlagte dose er ventet, ikke ta den glemte dosen, og ta neste dose i tide. Ikke ta to doser på en gang for å gjøre opp for en glemt dose.
Oral administrering i vann
. Tøm innholdet i en 2,5 mg pakke i en beholder som inneholder 5 mL vann. . Tøm innholdet i en 10 mg pakke i en beholder som inneholder 15 mL vann. . Røre. . La 2 til 3 minutter tykne. . Rør og drikk innen 30 minutter. . Hvis noe materiale gjenstår etter å ha drukket, tilsett mer vann, rør om og drikk umiddelbart.Administrering med vann via en NG eller gastrisk sonde (størrelse 6 eller større)
. Tilsett 5 mL vann til en sprøyte med kateterspiss og tilsett deretter innholdet i en 2,5 mg-pakke (eller 15 mL vann for 10 mg-pakken). Det er viktig å kun bruke en sprøyte med kateterspiss ved administrering gjennom en nasogastrisk sonde eller gastrisk sonde. . Rist sprøyten umiddelbart og la den tykne i 2 til 3 minutter. . Rist sprøyten og injiser gjennom den nasogastriske sonden eller magesonden inn i magen innen 30 minutter. . Fyll sprøyten med like mye vann. . Rist og skyll eventuelt gjenværende innhold fra nasogastrisk- eller magesonden ned i magen.HVORDAN LEVERES
Doseringsformer og styrker
PRILOSEC for oral suspensjon med forsinket frigjøring: 2,5 mg og 10 mg omeprazol i enhetsdosepakker som inneholder et fint gult pulver, bestående av hvite til brunlige omeprazolmagnesiumgranulat og blekgule inaktive granuler.
Oppbevaring og håndtering
PRILOSEC (omeprazolmagnesium) for oral suspensjon med forsinket frigivelse, 2,5 mg eller 10 mg omeprazol, leveres som en enhetsdosepakke som inneholder et fint gult pulver, bestående av hvite til brunlige omeprazolmagnesiumgranuler og blekgule inaktive granuler. PRILOSEC enhetsdosepakker leveres som følger:
NDC 70515-625–01 enhetsdosepakninger på 30: 2,5 mg pakker NDC 70515-610–01 enhetsdosepakninger på 30: 10 mg pakker
Oppbevaring
Oppbevar PRILOSEC for mikstur med forsinket frigivelse ved 25°C (77°F); utflukter tillatt til 15 – 30 °C (59 – 86 °F). [Se USP kontrollert romtemperatur .]
Produsert for: Covis Pharma, Zug, 6300 Sveits. Revidert: mars 2022
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i merkingen:
- . Akutt Tubulointerstitiell nefritis [se ADVARSLER OG FORHOLDSREGLER ] . Clostridium difficile-assosiert diaré [se ADVARSLER OG FORHOLDSREGLER ] . Benbrudd [se ADVARSLER OG FORHOLDSREGLER ] . Alvorlige kutane bivirkninger [se ADVARSLER OG FORHOLDSREGLER ] . Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ] . Cyanokobalamin (vitamin B-12) mangel [se ADVARSLER OG FORHOLDSREGLER ] . Hypomagnesemi og mineralmetabolisme [se ADVARSLER OG FORHOLDSREGLER ] . Fundic kjertelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske studier med PRILOSEC
Monoterapi
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Sikkerhetsdataene beskrevet nedenfor gjenspeiler eksponering for omeprazolmagnesium kapsler med forsinket frigjøring hos 3096 pasienter fra verdensomspennende kliniske studier (465 pasienter fra amerikanske studier og 2631 pasienter fra internasjonale studier). Indikasjoner som er klinisk studert i amerikanske studier inkluderte duodenalsår, resistent sår og Zollinger-Ellisons syndrom. De internasjonale kliniske studiene var dobbeltblinde og åpent i design. De vanligste bivirkningene rapportert (dvs. med en insidensrate ≥2 %) fra PRILOSEC-behandlede pasienter inkludert i disse studiene inkluderte hodepine (7 %), magesmerter (5 %), kvalme (4 %), diaré (4 %). ), oppkast (3 %) og flatulens (3 %).
Ytterligere bivirkninger som ble rapportert med en insidens ≥1 % inkluderte sure oppstøt (2 %), øvre luftveisinfeksjon (2 %), forstoppelse (2 %), svimmelhet (2 %), utslett (2 %), asteni (1 % ), ryggsmerter (1 %) og hoste (1 %).
Sikkerhetsprofilen i kliniske studier hos pasienter over 65 år var lik den hos pasienter 65 år eller yngre.
Sikkerhetsprofilen i kliniske studier hos pediatriske pasienter som fikk omeprazol-magnesium-kapsler med forsinket frigivelse var lik den hos voksne pasienter. Unikt for den pediatriske populasjonen ble imidlertid bivirkninger av luftveiene ofte rapportert i aldersgruppen 1 måned til Bruk i spesifikke populasjoner ].
Erfaring med kliniske studier med PRILOSEC 20 mg i kombinasjonsterapi for utryddelse av H. pylori
kliniske studier med enten dobbeltbehandling med omeprazolmagnesium forsinket frigjøringskapsler og klaritromycin, eller trippelbehandling med omeprazolmagnesiumforsinket frigjøringskapsler, klaritromycin og amoksicillin, ble det ikke observert noen bivirkninger unike for disse legemiddelkombinasjonene. De observerte bivirkningene var begrenset til de som tidligere er rapportert med omeprazol, klaritromycin eller amoksicillin alene.
Dobbel terapi (omeprazol magnesium kapsler med forsinket frigjøring/klaritromycin)
Bivirkninger observert i kontrollerte kliniske studier med kombinasjonsbehandling med omeprazol magnesium forsinket frigjøringskapsler og klaritromycin (n = 346) som skilte seg fra de tidligere beskrevet for omeprazol magnesium forsinket frigjøringskapsler alene, var smaksforstyrrelser (15 %), misfarging av tungen (2) %), rhinitt (2 %), faryngitt (1 %) og influensasyndrom (1 %). (For mer informasjon om klaritromycin, se forskrivningsinformasjonen for klaritromycin, avsnittet Bivirkninger.)
Trippelterapi (omeprazol magnesium kapsler med forsinket frigjøring/klaritromycin/amoxicillin)
De hyppigste bivirkningene observert i kliniske studier med kombinasjonsbehandling med omeprazol-magnesium-kapsler med forsinket frigivelse, klaritromycin og amoksicillin (n = 274) var diaré (14 %), smaksforstyrrelser (10 %) og hodepine (7 %). Ingen av disse forekom med en høyere frekvens enn det som ble rapportert av pasienter som tok antimikrobielle midler alene. (For mer informasjon om klaritromycin eller amoxicillin, se den respektive forskrivningsinformasjonen, avsnittet Bivirkninger.)
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av omeprazol etter godkjenning. Fordi disse reaksjonene er frivillig rapportert fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere deres faktiske frekvens eller etablere en årsakssammenheng med legemiddeleksponering.
Kroppen som helhet: Overfølsomhetsreaksjoner inkludert anafylaksi, anafylaktisk sjokk, angioødem, bronkospasme, interstitiell nefritt, urticaria (se også Hud nedenfor); feber; smerte; utmattelse; ubehag; systemisk lupus erythematosus
Kardiovaskulær: Brystsmerter eller angina, takykardi, bradykardi, hjertebank, forhøyet blodtrykk, perifert ødem
Endokrine: Gynekomasti
Gastrointestinale: Pankreatitt (noen dødelig), anoreksi, irritabel tykktarm, fekal misfarging, esophageal candidiasis, slimhinneatrofi i tungen, stomatitt, hevelse i magen, munntørrhet, mikroskopisk kolitt, fundic kjertelpolypper.
Gastroduodenale karsinoider er rapportert hos pasienter med ZE-syndrom på langtidsbehandling med omeprazol. Dette funnet antas å være en manifestasjon av den underliggende tilstanden, som er kjent for å være assosiert med slike svulster.
Hepatisk: Leversykdom inkludert leversvikt (noen dødelig), levernekrose (noen dødelig), hepatisk encefalopati hepatocellulær sykdom, kolestatisk sykdom, blandet hepatitt, gulsott og forhøyede leverfunksjonstester [ALT, AST, GGT, alkalisk fosfatase og bilirubin]
Infeksjoner og angrep: Clostridium difficile-assosiert diaré
Metabolisme og ernæringsforstyrrelser: Hypomagnesemi, hypokalsemi, hypokalemi [Advarsler og forholdsregler 5.9], hyponatremi, hypoglykemi, vektøkning
Muskuloskeletal: Muskelsvakhet, myalgi, muskelkramper, leddsmerter, bensmerter, benbrudd
Nervesystem/psykiatrisk: Psykiatriske forstyrrelser og søvnforstyrrelser inkludert depresjon, agitasjon, aggresjon, hallusinasjoner, forvirring, søvnløshet, nervøsitet, apati, somnolens, angst og drømmeavvik; skjelvinger, parestesi; svimmelhet
Luftveiene: Neseblødning, svelgsmerter
Hud: Alvorlige generaliserte hudreaksjoner inkludert giftig SJS/TEN (noen dødelig), DRESS, AGEP, kutan lupus erythematosus og erythema multiforme; lysfølsomhet; urticaria; utslett; hudbetennelse; kløe; petekkier; purpura; alopecia; tørr hud; hyperhidrose
Spesielle sanser: Tinnitus, smaksperversjon
Okulært: Optisk atrofi, fremre iskemisk optisk nevropati, optisk nevritt, tørre øyne syndrom, øyeirritasjon, tåkesyn, dobbeltsyn
Urogenital: Interstitiell nefritt, hematuri, proteinuri, forhøyet serumkreatinin, mikroskopisk pyuri, urinveisinfeksjon, glykosuri, urinfrekvens, testikkelsmerter
Hematologisk: Agranulocytose (noen dødelig), hemolytisk anemi, pancytopeni, nøytropeni, anemi, trombocytopeni, leukopeni, leukocytose
NARKOTIKAHANDEL
Tabell 3 og 4 inkluderer legemidler med klinisk viktige legemiddelinteraksjoner og interaksjon med diagnostikk når de administreres samtidig med omeprazol og instruksjoner for å forebygge eller håndtere dem.
Se merkingen av legemidler som brukes samtidig for å få mer informasjon om interaksjoner med PPI.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Tilstedeværelse av gastrisk malignitet
Hos voksne utelukker ikke symptomatisk respons på behandling med PRILOSEC tilstedeværelse av gastrisk malignitet. Vurder ytterligere oppfølging og diagnostisk testing hos voksne pasienter som har en suboptimal respons eller et tidlig symptomatisk tilbakefall etter fullført behandling med PPI. Vurder også en endoskopi hos eldre pasienter.
Akutt Tubulointerstitiell nefritis
Akutt tubulointerstitiell nefritt (TIN) er observert hos pasienter som tar PPI og kan forekomme når som helst under PPI-behandling. Pasienter kan ha forskjellige tegn og symptomer fra symptomatiske overfølsomhetsreaksjoner til uspesifikke symptomer på nedsatt nyrefunksjon (f.eks. ubehag, kvalme, anoreksi). I rapporterte kasusserier ble noen pasienter diagnostisert på biopsi og i fravær av ekstrarenale manifestasjoner (f.eks. feber, utslett eller artralgi). Seponer PRILOSEC 40 mg og evaluer pasienter med mistanke om akutt TIN [se KONTRAINDIKASJONER ].
Clostridium Difficile-assosiert diaré
Publiserte observasjonsstudier tyder på at PPI-behandling som PRILOSEC kan være assosiert med økt risiko for Clostridium difficile-assosiert diaré, spesielt hos innlagte pasienter. Denne diagnosen bør vurderes for diaré som ikke forbedres [se BIVIRKNINGER ].
Pasienter bør bruke den laveste dosen og korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles.
Clostridium difficile-assosiert diaré (CDAD) er rapportert ved bruk av nesten alle antibakterielle midler. For mer informasjon spesifikt for antibakterielle midler (klaritromycin og amoksicillin) indisert for bruk i kombinasjon med PRILOSEC, se avsnittene Advarsler og forsiktighetsregler i den tilsvarende forskrivningsinformasjonen.
Benbrudd
Flere publiserte observasjonsstudier tyder på at behandling med protonpumpehemmer (PPI) kan være assosiert med økt risiko for osteoporose-relaterte frakturer i hofte, håndledd eller ryggrad. Risikoen for brudd var økt hos pasienter som fikk høye doser, definert som flere daglige doser, og langvarig PPI-behandling (ett år eller lenger). Pasienter bør bruke den laveste dosen og korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles. Pasienter med risiko for osteoporose-relaterte frakturer bør behandles i henhold til etablerte behandlingsretningslinjer [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER ].
Alvorlige kutane bivirkninger
Alvorlige kutane bivirkninger, inkludert Stevens-Johnsons syndrom (SJS) og toksisk epidermal nekrolyse (TEN), medikamentreaksjoner med eosinofili og systemiske symptomer (DRESS), og akutt generalisert eksantematøs pustulose (AGEP) er rapportert i forbindelse med bruk av PPI. [se BIVIRKNINGER ]. Seponer PRILOSEC ved de første tegn eller symptomer på alvorlige kutane bivirkninger eller andre tegn på overfølsomhet og vurder videre evaluering.
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er rapportert hos pasienter som tar PPI, inkludert omeprazol. Disse hendelsene har oppstått både som ny debut og en forverring av eksisterende autoimmun sykdom. Flertallet av PPI-induserte lupus erythematosus-tilfeller var CLE.
Den vanligste formen for CLE rapportert hos pasienter behandlet med PPI var subakutt CLE (SCLE) og oppstod innen uker til år etter kontinuerlig medikamentell behandling hos pasienter fra spedbarn til eldre. Generelt ble histologiske funn observert uten organinvolvering.
Systemisk lupus erythematosus (SLE) er sjeldnere rapportert enn CLE hos pasienter som får PPI. PPI-assosiert SLE er vanligvis mildere enn ikke-medikamentindusert SLE. Utbruddet av SLE oppstod vanligvis innen dager til år etter behandlingsstart, hovedsakelig hos pasienter fra unge voksne til eldre. Flertallet av pasientene hadde utslett; artralgi og cytopeni ble imidlertid også rapportert.
Unngå administrasjon av PPI lenger enn medisinsk indisert. Hvis det observeres tegn eller symptomer som samsvarer med CLE eller SLE hos pasienter som får PRILOSEC 10 mg, seponer legemidlet og henvis pasienten til riktig spesialist for evaluering. De fleste pasienter blir bedre ved seponering av PPI alene i løpet av 4 til 12 uker. Serologisk testing (f.eks. ANA) kan være positiv og forhøyede serologiske testresultater kan ta lengre tid å løse enn kliniske manifestasjoner.
Interaksjon med klopidogrel
Unngå samtidig bruk av PRILOSEC 10 mg og klopidogrel. Klopidogrel er et prodrug. Hemming av blodplateaggregering av klopidogrel skyldes utelukkende en aktiv metabolitt. Metabolismen av klopidogrel til dens aktive metabolitt kan svekkes ved bruk med samtidig medisinering, som omeprazol, som hemmer CYP2C19-aktivitet. Samtidig bruk av klopidogrel og 80 mg omeprazol reduserer den farmakologiske aktiviteten til klopidogrel, selv når det administreres med 12 timers mellomrom.
Ved bruk av PRILOSEC, vurder alternativ anti-blodplatebehandling [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
Cyanokobalamin (vitamin B-12) mangel
Daglig behandling med syredempende medisiner over lang tid (f.eks. lengre enn 3 år) kan føre til malabsorpsjon av cyanokobalamin (vitamin B-12) forårsaket av hypo- eller aklorhydri. Sjeldne rapporter om cyanokobalaminmangel som oppstår ved syredempende behandling er rapportert i litteraturen. Denne diagnosen bør vurderes dersom det observeres kliniske symptomer forenlig med cyanokobalaminmangel hos pasienter behandlet med PRILOSEC.
Hypomagnesemi og mineralmetabolisme
Hypomagnesemi, symptomatisk og asymptomatisk, er sjelden rapportert hos pasienter behandlet med PPI i minst tre måneder, i de fleste tilfeller etter et års behandling. Alvorlige bivirkninger inkluderer tetany, arytmier og anfall. Hypomagnesemi kan føre til hypokalsemi og/eller hypokalemi og kan forverre underliggende hypokalsemi hos risikopasienter. Hos de fleste pasienter krevde behandling av hypomagnesemi magnesiumerstatning og seponering av PPI.
For pasienter som forventes å være på langvarig behandling eller som tar PPI sammen med medisiner som digoksin eller legemidler som kan forårsake hypomagnesemi (f.eks. diuretika), kan helsepersonell vurdere å overvåke magnesiumnivåer før oppstart av PPI-behandling og med jevne mellomrom [se BIVIRKNINGER ].
Vurder å overvåke magnesium- og kalsiumnivåer før oppstart av PRILOSEC og med jevne mellomrom under behandling hos pasienter med en eksisterende risiko for hypokalsemi (f.eks. hypoparatyreoidisme). Suppler med magnesium og/eller kalsium etter behov. Hvis hypokalsemi er motstandsdyktig mot behandling, bør du vurdere å seponere PPI.
Interaksjon med johannesurt eller rifampin
Legemidler som induserer CYP2C19 eller CYP3A4 (som johannesurt eller rifampin) kan redusere omeprazolkonsentrasjonen betydelig [se NARKOTIKAHANDEL ]. Unngå samtidig bruk av PRILOSEC og johannesurt eller rifampin.
Interaksjoner med diagnostiske undersøkelser for nevroendokrine svulster
Serumkromogranin A (CgA) nivåer øker sekundært til medikamentinduserte reduksjoner i magesyre. Det økte CgA-nivået kan forårsake falske positive resultater i diagnostiske undersøkelser for nevroendokrine svulster. Helsepersonell bør midlertidig stoppe behandlingen med PRILOSEC 20 mg minst 14 dager før de vurderer CgA-nivåer og vurdere å gjenta testen hvis initiale CgA-nivåer er høye. Hvis det utføres serielle tester (f.eks. for overvåking), bør det samme kommersielle laboratoriet brukes for testing, da referanseområder mellom tester kan variere [se NARKOTIKAHANDEL ].
Interaksjon med metotreksat
Litteratur tyder på at samtidig bruk av PPI med metotreksat (primært ved høye doser) kan øke og forlenge serumnivåer av metotreksat og/eller dets metabolitt, noe som muligens kan føre til metotreksat toksisitet. Ved administrering av høydose metotreksat kan en midlertidig seponering av PPI vurderes hos noen pasienter [se NARKOTIKAHANDEL ].
Fundic kjertelpolypper
PPI-bruk er assosiert med økt risiko for fundiske kjertelpolypper som øker ved langvarig bruk, spesielt utover ett år. De fleste PPI-brukere som utviklet fundiske kjertelpolypper var asymptomatiske og fundiske kjertelpolypper ble identifisert ved endoskopi. Bruk den korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning og bruksanvisning ).
Akutt Tubulointerstitiell nefritis
Råd pasienten eller omsorgspersonen til å ringe pasientens helsepersonell umiddelbart hvis de opplever tegn og/eller symptomer assosiert med akutt tubulointerstitiell nefritt [se ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-assosiert diaré
Råd pasienten eller omsorgspersonen til umiddelbart å ringe pasientens helsepersonell dersom de opplever diaré som ikke blir bedre [se ADVARSLER OG FORHOLDSREGLER ].
Benbrudd
Råd pasienten eller omsorgspersonen til å rapportere eventuelle brudd, spesielt i hoften, håndleddet eller ryggraden, til pasientens helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Alvorlige kutane bivirkninger
Råd pasienten eller omsorgspersonen til å seponere PRILOSEC 40 mg og rapportere til helsepersonell ved første gang en alvorlig kutan bivirkning eller andre tegn på overfølsomhet vises [se ADVARSLER OG FORHOLDSREGLER ].
Kutan og systemisk lupus erythematosus
Råd pasienten eller omsorgspersonen til umiddelbart å ringe pasientens helsepersonell for nye eller forverrede symptomer assosiert med kutan eller systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ]
Cyanokobalamin (vitamin B-12) mangel
Råd pasienten eller omsorgspersonen til å rapportere alle kliniske symptomer som kan være assosiert med cyanokobalaminmangel til pasientens helsepersonell hvis de har fått PRILOSEC i mer enn 3 år [se ADVARSLER OG FORHOLDSREGLER ].
Hypomagnesemi og mineralmetabolisme
Råd pasienten eller omsorgspersonen til å rapportere alle kliniske symptomer som kan være assosiert med hypomagnesemi, hypokalsemi og/eller hypokalemi, til pasientens helsepersonell, hvis de har fått PRILOSEC i minst 3 måneder [se ADVARSLER OG FORHOLDSREGLER ].
Narkotikahandel
Råd pasienter til å rapportere til helsepersonell dersom de starter behandling med produkter som inneholder rilpivirin, klopidogrel, johannesurt eller rifampin; eller, hvis de tar høydose metotreksat [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER ].
Administrasjon
- . PRILOSEC er ment å tilberedes i vann og administreres oralt eller via en nasogastrisk (NG) eller gastrisk sonde, som beskrevet i Medisineringsveiledningen. . Ta PRILOSEC før måltider. . Antacida kan brukes samtidig med PRILOSEC. . Glemte doser: Hvis en dose glemmes, gis så snart som mulig. Imidlertid, hvis neste planlagte dose er ventet, ikke ta den glemte dosen, og ta neste dose i tide. Ikke ta to doser på en gang for å gjøre opp for en glemt dose.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
to 24-måneders karsinogenitetsstudier på rotter, omeprazol i daglige doser på 1,7, 3,4, 13,8, 44,0 og 140,8 mg/kg/dag (omtrent 0,4 til 34 ganger en human dose på 40 mg/dag, uttrykt på en kroppsoverflate arealbasis) produserte gastriske ECL-cellekarsinoider på en doserelatert måte i både hann- og hunnrotter; forekomsten av denne effekten var markant høyere hos hunnrotter, som hadde høyere blodnivåer av omeprazol. Magekarsinoider forekommer sjelden hos ubehandlet rotte. I tillegg var ECL-cellehyperplasi til stede i alle behandlede grupper av begge kjønn. I en av disse studiene ble hunnrotter behandlet med 13,8 mg omeprazol/kg/dag (ca. 3,4 ganger en human dose på 40 mg/dag, basert på kroppsoverflate) i ett år, og deretter fulgt i ytterligere et år uten legemiddel. Ingen karsinoider ble sett hos disse rottene. En økt forekomst av behandlingsrelatert ECL-cellehyperplasi ble observert ved slutten av ett år (94 % behandlet vs. 10 % kontroller). Ved det andre året var forskjellen mellom behandlede og kontrollrotter mye mindre (46 % vs. 26 %), men viste fortsatt mer hyperplasi i den behandlede gruppen. Gastrisk adenokarsinom ble sett hos en rotte (2%). Ingen lignende svulst ble sett hos hann- eller hunnrotter behandlet i to år. For denne rottestammen har ingen lignende svulst blitt notert historisk, men et funn som involverer bare én svulst er vanskelig å tolke. I en 52-ukers toksisitetsstudie på Sprague-Dawley-rotter, ble hjerneastrocytomer funnet hos et lite antall hanner som fikk omeprazol i dosenivåer på 0,4, 2 og 16 mg/kg/dag (omtrent 0,1 til 3,9 ganger human dose på 40 mg/dag, basert på kroppsoverflatebasis). Ingen astrocytomer ble observert hos hunnrotter i denne studien. I en 2-årig karsinogenitetsstudie på Sprague-Dawley-rotter ble det ikke funnet astrocytomer hos hanner eller hunner med den høye dosen på 140,8 mg/kg/dag (omtrent 34 ganger den menneskelige dosen på 40 mg/dag på basis av kroppsoverflate) . En 78-ukers musekarsinogenitetsstudie av omeprazol viste ikke økt tumorforekomst, men studien var ikke konklusjon. En 26-ukers p53 (+/-) transgen mus karsinogenitetsstudie var ikke positiv.
Omeprazol var positiv for klastogene effekter i en in vitro human lymfocytt kromosomavviksanalyse, i en av to in vivo mus mikronucleus tester, og i en in vivo benmargscelle kromosomavviksanalyse. Omeprazol var negativ i in vitro Ames-testen, en in vitro muselymfomcelle-forovermutasjonsanalyse og en in vivo-test av lever-DNA-skade hos rotter.
Omeprazol i orale doser opptil 138 mg/kg/dag hos rotter (ca. 34 ganger en oral human dose på 40 mg på basis av kroppsoverflate) ble funnet å ikke ha noen effekt på fertilitet og reproduksjonsevne.
I 24-måneders karsinogenitetsstudier hos rotter ble det observert en doserelatert signifikant økning i gastriske karsinoidsvulster og ECL-cellehyperplasi hos både hann- og hunndyr [se ADVARSLER OG FORHOLDSREGLER ]. Karsinoide svulster er også observert hos rotter som har blitt utsatt for fundektomi eller langtidsbehandling med andre protonpumpehemmere eller høye doser av H2-reseptorantagonister.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Det er ingen tilstrekkelige og godt kontrollerte studier med omeprazol hos gravide kvinner. Tilgjengelige epidemiologiske data viser ikke økt risiko for alvorlige medfødte misdannelser eller andre uønskede graviditetsutfall ved bruk av omeprazol i første trimester. Reproduksjonsstudier på rotter og kaniner resulterte i doseavhengig embryodødelighet ved omeprazoldoser som var omtrent 3,4 til 34 ganger en oral human dose på 40 mg (basert på et kroppsoverflateareal for en person på 60 kg).
Teratogenisitet ble ikke observert i reproduksjonsstudier på dyr med administrering av oral esomeprazol (en enantiomer av omeprazol) magnesium hos rotter og kaniner under organogenese med doser henholdsvis ca. 68 ganger og 42 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol basert på kroppsoverflate for en person på 60 kg).
Endringer i benmorfologi ble observert hos avkom av rotter som ble doseret gjennom det meste av drektighet og amming ved doser lik eller større enn ca. 34 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol. Når mors administrering var begrenset til kun svangerskap, var det ingen effekter på beinfysisk morfologi hos avkommet i noen alder [se Data ].
Den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Data
Menneskelige data
Fire publiserte epidemiologiske studier sammenlignet frekvensen av medfødte abnormiteter blant spedbarn født av kvinner som brukte omeprazol under svangerskapet med frekvensen av abnormiteter blant spedbarn av kvinner eksponert for H2-reseptorantagonister eller andre kontroller.
En populasjonsbasert retrospektiv kohort epidemiologisk studie fra det svenske medisinske fødselsregisteret, som dekker omtrent 99 % av svangerskapene, fra 1995 til 99, rapporterte om 955 spedbarn (824 eksponert i løpet av første trimester med 39 av disse eksponert utover første trimester, og 131 eksponert etter første trimester) hvis mødre brukte omeprazol under graviditet. Antallet spedbarn eksponert in utero for omeprazol som hadde misdannelser, lav fødselsvekt, lav Apgar-score eller sykehusinnleggelse var lik antallet observert i denne populasjonen. Antallet spedbarn født med ventrikkelseptumdefekter og antall dødfødte spedbarn var litt høyere hos omeprazol-eksponerte spedbarn enn forventet antall i denne populasjonen.
En populasjonsbasert retrospektiv kohortstudie som dekker alle levendefødte i Danmark fra 1996 til 2009, rapporterte om 1800 levendefødte med mødre som brukte omeprazol i første trimester av svangerskapet og 837 317 levendefødte fødsler hvis mødre ikke brukte noen protonpumpehemmer. Den totale frekvensen av fødselsdefekter hos spedbarn født av mødre med eksponering for omeprazol i første trimester var 2,9 % og 2,6 % hos spedbarn født av mødre som ikke ble eksponert for noen protonpumpehemmer i løpet av første trimester.
En retrospektiv kohortstudie rapporterte om 689 gravide kvinner som ble eksponert for enten H2-blokkere eller omeprazol i første trimester (134 eksponert for omeprazol) og 1572 gravide kvinner som ikke ble eksponert for noen av disse i løpet av første trimester. Den totale misdannelsesraten hos avkom født av mødre med første trimestereksponering for omeprazol, en H2-blokker, eller var ueksponert, var henholdsvis 3,6 %, 5,5 % og 4,1 %.
En liten prospektiv observasjonskohortstudie fulgte 113 kvinner eksponert for omeprazol under graviditet (89 % med eksponering i første trimester). Den rapporterte frekvensen av alvorlige medfødte misdannelser var 4 % i omeprazolgruppen, 2 % i kontroller eksponert for ikke-teratogener, og 2,8 % i sykdomsparede kontroller. Hyppigheten av spontane og elektive aborter, premature fødsel, svangerskapsalder ved fødsel og gjennomsnittlig fødselsvekt var lik blant gruppene.
Flere studier har ikke rapportert noen tilsynelatende uønskede korttidseffekter på spedbarnet når enkeltdose oral eller intravenøs omeprazol ble administrert til over 200 gravide kvinner som premedisinering for keisersnitt under generell anestesi.
Dyredata
Omeprazol
Reproduksjonsstudier utført med omeprazol på rotter ved orale doser opptil 138 mg/kg/dag (ca. 34 ganger en oral human dose på 40 mg på basis av kroppsoverflate) og på kaniner ved doser opptil 69,1 mg/kg/dag ( ca. 34 ganger en oral human dose på 40 mg på basis av kroppsoverflate) under organogenese avslørte ingen bevis for et teratogent potensial for omeprazol. Hos kaniner ga omeprazol i et doseområde på 6,9 til 69,1 mg/kg/dag (ca. 3,4 til 34 ganger en oral human dose på 40 mg på kroppsoverflatebasis) administrert under organogenese doserelaterte økninger i embryodødelighet, fosterresorpsjoner og svangerskapsforstyrrelser. Hos rotter ble doserelatert embryo/føtal toksisitet og postnatal utviklingstoksisitet observert hos avkom som følge av foreldre behandlet med omeprazol ved 13,8 til 138,0 mg/kg/dag (ca. 3,4 til 34 ganger en oral human dose på 40 mg på en kroppsoverflate arealbasis), administrert før paring gjennom laktasjonsperioden.
Esomeprazol
Dataene beskrevet nedenfor ble generert fra studier med esomeprazol, en enantiomer av omeprazol. Dyre-til-menneske-dosemultipler er basert på antakelsen om lik systemisk eksponering for esomeprazol hos mennesker etter oral administrering av enten 40 mg esomeprazol eller 40 mg omeprazol.
Ingen effekter på embryo-føtal utvikling ble observert i reproduksjonsstudier med esomeprazolmagnesium hos rotter ved orale doser opptil 280 mg/kg/dag (omtrent 68 ganger en oral human dose på 40 mg på basis av kroppsoverflate) eller hos kaniner kl. orale doser opptil 86 mg/kg/dag (ca. 42 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate) administrert under organogenese.
En pre- og postnatal utviklingstoksisitetsstudie på rotter med ytterligere endepunkter for å evaluere benutvikling ble utført med esomeprazolmagnesium i orale doser på 14 til 280 mg/kg/dag (ca. 3,4 til 68 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate). Neonatal/tidlig postnatal (fødsel til avvenning) overlevelse ble redusert ved doser lik eller større enn 138 mg/kg/dag (omtrent 34 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate). Kroppsvekt og kroppsvektøkning ble redusert, og nevroatferdsmessige eller generelle utviklingsforsinkelser i tidsrammen umiddelbart etter avvenning var tydelig ved doser lik eller større enn 69 mg/kg/dag (omtrent 17 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate). I tillegg ble redusert lårbenslengde, bredde og tykkelse på kortikalt ben, redusert tykkelse på tibial vekstplate og minimal til mild benmargshypocellularitet observert ved doser lik eller større enn 14 mg/kg/dag (ca. 3,4 ganger et oralt menneske) dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate). Fysisk dysplasi i lårbenet ble observert hos avkom av rotter behandlet med orale doser av esomeprazolmagnesium i doser lik eller større enn 138 mg/kg/dag (omtrent 34 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på en kropp overflatebasis).
Effekter på maternal bein ble observert hos drektige og ammende rotter i den pre- og postnatale toksisitetsstudien når esomeprazolmagnesium ble administrert i orale doser på 14 til 280 mg/kg/dag (ca. 3,4 til 68 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate). Når rotter ble doseret fra svangerskapsdag 7 til avvenning på postnatal dag 21, ble det observert en statistisk signifikant reduksjon i maternal femurvekt på opptil 14 % (sammenliknet med placebobehandling) ved doser lik eller større enn 138 mg/kg/dag (omtrent 34 ganger en oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate).
En pre- og postnatal utviklingsstudie på rotter med esomeprazol strontium (ved bruk av ekvimolare doser sammenlignet med esomeprazolmagnesiumstudie) ga lignende resultater hos mor og unger som beskrevet ovenfor.
En oppfølgingsstudie av utviklingstoksisitet hos rotter med ytterligere tidpunkter for å evaluere ungbeinutvikling fra postnatal dag 2 til voksen alder ble utført med esomeprazolmagnesium i orale doser på 280 mg/kg/dag (ca. 68 ganger en oral human dose på 40 mg på basert på kroppsoverflate) hvor esomeprazol-administrasjonen var fra enten svangerskapsdag 7 eller svangerskapsdag 16 til fødsel. Når mors administrering var begrenset til kun svangerskap, var det ingen effekter på beinfysisk morfologi hos avkommet uansett alder.
Amming
Risikosammendrag
Begrensede data tyder på at omeprazol kan være tilstede i morsmelk. Det er ingen kliniske data på effekten av omeprazol på spedbarn som ammes eller på melkeproduksjon. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for PRILOSEC 40mg og eventuelle potensielle bivirkninger på det ammede spedbarnet fra PRILOSEC 20mg eller fra den underliggende morens tilstand.
Pediatrisk bruk
Sikkerheten og effektiviteten til PRILOSEC 40 mg er etablert hos pediatriske pasienter 1 til 16 år for behandling av symptomatisk GERD, behandling av EE på grunn av syremediert GERD og vedlikehold av helbredelse av EE på grunn av syremediert GERD. Bruk av PRILOSEC 10mg i denne aldersgruppen støttes av tilstrekkelige og godt kontrollerte studier hos voksne og ukontrollerte sikkerhet, effekt og farmakokinetiske studier utført hos pediatriske og ungdomspasienter [se KLINISK FARMAKOLOGI , Kliniske studier ].
Sikkerheten og effektiviteten til PRILOSEC 10 mg er fastslått hos pediatriske pasienter fra 1 måned til under 1 år for behandling av EE på grunn av syremediert GERD og støttes av tilstrekkelige og godt kontrollerte studier hos voksne og sikkerhet, farmakokinetisk, og farmakodynamiske studier utført hos pediatriske pasienter [se KLINISK FARMAKOLOGI ].
I den pediatriske populasjonen ble det hyppig rapportert bivirkninger av luftveiene i hele aldersgruppen (1 måned til 16 år). Mellomørebetennelse ble hyppig rapportert i aldersgruppen 1 måned til BIVIRKNINGER ].
Sikkerheten og effektiviteten til PRILOSEC er ikke fastslått i:
- . pasienter under 1 år for:
- . Behandling av symptomatisk GERD . Vedlikehold av helbredelse av EE på grunn av syremediert GERD
- . Behandling av aktivt duodenalsår . H. pylori utryddelse for å redusere risikoen for tilbakefall av duodenalsår . Behandling av aktivt godartet magesår . Patologiske hypersekretoriske tilstander
Data for unge dyr
Esomeprazol, en enantiomer av omeprazol, ble vist å redusere kroppsvekt, kroppsvektøkning, femurvekt, femurlengde og generell vekst ved orale doser omtrent 34 til 68 ganger en daglig dose på 40 mg esomeprazol eller 40 mg omeprazol basert på kropp. overflateareal i en toksisitetsstudie for unge rotter. Dyre-til-menneske-dosemultipler er basert på antakelsen om lik systemisk eksponering for esomeprazol hos mennesker etter oral administrering av enten 40 mg esomeprazol eller 40 mg omeprazol.
En 28-dagers toksisitetsstudie med en 14-dagers restitusjonsfase ble utført på unge rotter med esomeprazolmagnesium i doser på 70 til 280 mg/kg/dag (ca. 17 til 68 ganger en daglig oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate). En økning i antall dødsfall ved den høye dosen på 280 mg/kg/dag ble observert når juvenile rotter ble administrert esomeprazolmagnesium fra postnatal dag 7 til postnatal dag 35. I tillegg doser lik eller større enn 140 mg/kg/ dag (ca. 34 ganger en daglig oral human dose på 40 mg esomeprazol eller 40 mg omeprazol på basis av kroppsoverflate), ga behandlingsrelaterte reduksjoner i kroppsvekt (omtrent 14 %) og kroppsvektøkning, reduksjoner i femurvekt og femur lengde, og påvirket den generelle veksten. Sammenlignbare funn beskrevet ovenfor er også observert i denne studien med et annet esomeprazolsalt, esomeprazol strontium, ved ekvimolare doser av esomeprazol.
Geriatrisk bruk
Omeprazol ble administrert til over 2000 eldre personer (≥ 65 år) i kliniske studier i USA og Europa. Det var ingen forskjeller i sikkerhet og effektivitet mellom eldre og yngre personer. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre personer, men større sensitivitet hos noen eldre individer kan ikke utelukkes.
Farmakokinetiske studier har vist at eliminasjonshastigheten var noe redusert hos eldre og biotilgjengeligheten økte. Plasmaclearance for omeprazol var 250 ml/min (omtrent halvparten av unge frivillige) og plasmahalveringstiden var i gjennomsnitt én time, omtrent det dobbelte av unge friske frivillige. Det er imidlertid ikke nødvendig med dosejustering hos eldre [se KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Hos pasienter med nedsatt leverfunksjon (Child-Pugh klasse A, B eller C) økte eksponeringen for omeprazol betydelig sammenlignet med friske personer. Dosereduksjon av PRILOSEC 10 mg til 10 mg én gang daglig anbefales for pasienter med nedsatt leverfunksjon for å opprettholde tilheling av EE [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ].
Asiatisk befolkning
I studier av friske personer hadde asiater omtrent fire ganger høyere eksponering enn kaukasiere. Dosereduksjon av PRILOSEC 20 mg til 10 mg én gang daglig anbefales for asiatiske pasienter for vedlikehold av helbredelse av EE [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ].
OVERDOSE
Det er mottatt rapporter om overdosering med omeprazol hos mennesker. Dosene varierte opp til 2400 mg (120 ganger den vanlige anbefalte kliniske dosen). Manifestasjonene var varierende, men inkluderte forvirring, døsighet, tåkesyn, takykardi, kvalme, oppkast, diaforese, rødme, hodepine, munntørrhet og andre bivirkninger som ligner på de som er sett i normal klinisk erfaring [se BIVIRKNINGER ]. Symptomene var forbigående, og ingen alvorlige kliniske utfall er rapportert når PRILOSEC 20 mg ble tatt alene. Ingen spesifikk motgift for overdosering av omeprazol er kjent.
Omeprazol er mye proteinbundet og er derfor ikke lett dialyserbart. Ved overdosering bør behandlingen være symptomatisk og støttende.
Hvis overeksponering oppstår, ring ditt giftkontrollsenter på 1-800-222-1222 for oppdatert informasjon om håndtering av forgiftning eller overdosering.
KONTRAINDIKASJONER
- . PRILOSEC er kontraindisert hos pasienter med kjent overfølsomhet overfor substituerte benzimidazoler eller noen komponent i formuleringen. Overfølsomhetsreaksjoner kan omfatte anafylaksi, anafylaktisk sjokk, angioødem, bronkospasme, akutt tubulointerstitiell nefritt og urticaria [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ]. . Protonpumpehemmere (PPI), inkludert PRILOSEC 10 mg, er kontraindisert hos pasienter som får produkter som inneholder rilpivirin [se NARKOTIKAHANDEL ]. . For informasjon om kontraindikasjoner for antibakterielle midler (klaritromycin og amoxicillin) indisert i kombinasjon med PRILOSEC 40 mg, se KONTRAINDIKASJONER-delen i pakningsvedlegget.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Omeprazol tilhører en klasse av antisekretoriske forbindelser, de substituerte benzimidazolene, som undertrykker magesyresekresjon ved spesifikk inhibering av H+/K+ ATPase-enzymsystemet ved den sekretoriske overflaten av den gastriske parietalcellen. Fordi dette enzymsystemet blir sett på som syrepumpen (proton) i mageslimhinnen, har omeprazol blitt karakterisert som en magesyrepumpehemmer, ved at det blokkerer det siste trinnet i syreproduksjonen. Denne effekten er doserelatert og fører til hemming av både basal og stimulert syresekresjon uavhengig av stimulus.
Farmakodynamikk
Antisekretorisk aktivitet
Etter oral administrering inntrer den antisekretoriske effekten av omeprazol innen en time, med maksimal effekt innen to timer. Hemming av sekresjon er ca. 50 % av maksimum etter 24 timer og varigheten av inhibering varer opptil 72 timer. Den antisekretoriske effekten varer dermed langt lenger enn det som forventes ut fra den svært korte (mindre enn én time) plasmahalveringstiden, tilsynelatende på grunn av forlenget binding til parietal H+/K+ ATPase-enzymet. Når stoffet seponeres, kommer sekretorisk aktivitet tilbake gradvis, over 3 til 5 dager. Den hemmende effekten av sekresjon av omeprazolonsyre øker ved gjentatt dosering én gang daglig, og når et platå etter fire dager.
Resultater fra en rekke studier av den antisekretoriske effekten av flere doser på 20 mg og 40 mg omeprazol hos friske personer og pasienter er vist nedenfor. "maks"-verdien representerer bestemmelser på et tidspunkt med maksimal effekt (2 til 6 timer etter dosering), mens "min"-verdier er de 24 timer etter siste dose omeprazol.
Enkelte daglige orale doser av omeprazol fra en dose på 10 mg til 40 mg har gitt 100 % hemming av 24-timers intragastrisk surhet hos noen pasienter.
Serum Gastrin Effekter
studier som involverte mer enn 200 pasienter, økte serumgastrinnivået i løpet av de første 1 til 2 ukene av administrering én gang daglig av terapeutiske doser av omeprazol parallelt med hemming av syresekresjon. Ingen ytterligere økning i serumgastrin skjedde ved fortsatt behandling. Sammenlignet med histamin H2-reseptorantagonister, var medianøkningen produsert av 20 mg doser omeprazol høyere (1,3 til 3,6 ganger vs. 1,1 til 1,8 ganger økning). Gastrinverdiene gikk tilbake til nivåene før behandling, vanligvis innen 1 til 2 uker etter seponering av behandlingen.
Økt gastrin forårsaker enterokromaffinlignende cellehyperplasi og økte serumnivåer av kromogranin A (CgA). De økte CgA-nivåene kan forårsake falske positive resultater i diagnostiske undersøkelser for nevroendokrine svulster [se ADVARSLER OG FORHOLDSREGLER ].
Enterokromaffin-lignende (ECL) celleeffekter
Human gastriske biopsiprøver er tatt fra mer enn 3000 pasienter (både barn og voksne) behandlet med omeprazol i langtids kliniske studier. Forekomsten av ECL-cellehyperplasi i disse studiene økte med tiden; Det er imidlertid ikke funnet noen tilfeller av ECL-cellekarsinoider, dysplasi eller neoplasi hos disse pasientene. Imidlertid er disse studiene av utilstrekkelig varighet og størrelse til å utelukke mulig påvirkning av langtidsadministrasjon av omeprazol på utviklingen av premaligne eller ondartede tilstander.
Andre effekter
Systemiske effekter av omeprazol i CNS, kardiovaskulære og respiratoriske systemer er til dags dato ikke funnet. Omeprazol, gitt i orale doser på 30 eller 40 mg i 2 til 4 uker, hadde ingen effekt på skjoldbruskkjertelfunksjonen, karbohydratmetabolismen eller sirkulerende nivåer av paratyreoideahormon, kortisol, østradiol, testosteron, prolaktin, kolecystokinin eller sekretin.
Ingen effekt på gastrisk tømming av de faste og flytende komponentene i et testmåltid ble påvist etter en enkeltdose omeprazol 90 mg. Hos friske forsøkspersoner hadde en enkelt intravenøs dose omeprazol (0,35 mg/kg) ingen effekt på sekresjon av indre faktor. Det er ikke observert noen systematisk doseavhengig effekt på basal eller stimulert pepsinproduksjon hos mennesker.
Imidlertid, når intragastrisk pH holdes på 4,0 eller høyere, er basal pepsinproduksjon lav, og pepsinaktiviteten reduseres.
I likhet med andre midler som øker den intragastriske pH, ga omeprazol administrert i 14 dager hos friske personer en betydelig økning i de intragastriske konsentrasjonene av levedyktige bakterier. Mønsteret til bakteriearten var uendret fra det som vanligvis finnes i spytt. Alle endringer forsvant innen tre dager etter avsluttet behandling.
Forløpet av Barretts spiserør hos 106 pasienter ble evaluert i en amerikansk dobbeltblind kontrollert studie med PRILOSEC 40 mg to ganger daglig i 12 måneder etterfulgt av 20 mg to ganger daglig i 12 måneder eller ranitidin 300 mg to ganger daglig i 24 måneder. Ingen klinisk signifikant innvirkning på Barretts slimhinne ved antisekretorisk terapi ble observert. Selv om neosquamøst epitel utviklet seg under antisekretorisk terapi, ble fullstendig eliminering av Barretts slimhinne ikke oppnådd. Ingen signifikant forskjell ble observert mellom behandlingsgruppene i utvikling av dysplasi i Barretts slimhinne, og ingen pasient utviklet spiserørskarsinom under behandlingen. Ingen signifikante forskjeller mellom behandlingsgruppene ble observert i utvikling av ECL-cellehyperplasi, corpus atrofisk gastritt, corpus intestinal metaplasi eller kolonpolypper med en diameter på over 3 mm.
Farmakokinetikk
Absorpsjon
PRILOSEC 20 mg for mikstur med forsinket frigivelse inneholder omeprazolmagnesiumgranulat og inaktive granulat som skal administreres i vann. Absorpsjon av omeprazol begynner først etter at de gastroresistente granulatene forlater magen. Farmakokinetikken til omeprazol er tidsavhengig, med høyere plasmakonsentrasjoner ved steady state sammenlignet med etter en enkelt dose. Den systemiske eksponeringen (AUC og Cmax) for omeprazol etter en gang daglig dosering av 20 mg mikstur med forsinket frigivelse i 5 dager er henholdsvis 51 % og 58 % høyere enn etter den første dosen. Maksimal plasmakonsentrasjon av omeprazol etter gjentatte doser av mikstur med forsinket frigjøring oppstår innen 1,5 til 2 timer. Hos friske personer er plasmahalveringstiden 0,5 til 1 time.
Fordeling
Proteinbindingen er omtrent 95 %.
Eliminering
Metabolisme
Omeprazol metaboliseres i stor grad av cytokrom P450 (CYP) enzymsystemet. Hoveddelen av metabolismen er avhengig av polymorfisk uttrykt CYP2C19, ansvarlig for dannelsen av hydroksyomeprazol, hovedmetabolitten i plasma. Den resterende delen er avhengig av en annen spesifikk isoform, CYP3A4, som er ansvarlig for dannelsen av omeprazolsulfon.
Utskillelse
Etter oral enkeltdose av en bufret løsning av omeprazol ble lite eller noe uforandret medikament utskilt i urinen. Størstedelen av dosen (ca. 77 %) ble eliminert i urinen som minst seks metabolitter. To ble identifisert som hydroksyomeprazol og den tilsvarende karboksylsyren. Resten av dosen kunne gjenvinnes i avføring. Dette innebærer en betydelig biliær utskillelse av metabolittene til omeprazol. Tre metabolitter er identifisert i plasma, sulfid- og sulfonderivatene av omeprazol og hydroksyomeprazol. Disse metabolittene har svært liten eller ingen antisekretorisk aktivitet.
Kombinasjonsterapi med antimikrobielle midler
Omeprazol 40 mg daglig ble gitt i kombinasjon med klaritromycin 500 mg hver 8. time til friske voksne menn. Steady state plasmakonsentrasjoner av omeprazol ble økt (Cmax, AUC0-24 og T½ økning på henholdsvis 30 %, 89 % og 34 %) ved samtidig administrering av klaritromycin. De observerte økningene i plasmakonsentrasjonen av omeprazol var assosiert med følgende farmakologiske effekter. Den gjennomsnittlige 24-timers pH-verdien i magen var når omeprazol ble administrert alene og 5,7 når det ble administrert sammen med klaritromycin.
Plasmakonsentrasjonene av klaritromycin og 14-hydroksy-klaritromycin ble økt ved samtidig administrering av omeprazol. For klaritromycin var gjennomsnittlig Cmax 10 % høyere, gjennomsnittlig Cmin var 27 % høyere, og gjennomsnittlig AUC0-8 var 15 % høyere når klaritromycin ble administrert sammen med omeprazol enn når klaritromycin ble administrert alene. Lignende resultater ble sett for 14-hydroksy-klaritromycin, gjennomsnittlig Cmax var 45 % høyere, gjennomsnittlig Cmin var 57 % høyere og gjennomsnittlig AUC0-8 var 45 % høyere. Klaritromycinkonsentrasjoner i magevev og slim ble også økt ved samtidig administrering av omeprazol.
Spesifikke populasjoner
Geriatriske pasienter
Eliminasjonshastigheten av omeprazol ble noe redusert hos eldre, og biotilgjengeligheten ble økt. Omeprazol var 76 % biotilgjengelig når en enkelt 40 mg oral dose omeprazol (bufret løsning) ble administrert til friske eldre frivillige, mot 58 % hos unge frivillige som fikk samme dose. Nesten 70 % av dosen ble gjenfunnet i urinen som metabolitter av omeprazol, og ingen uforandret medikament ble påvist. Plasmaclearance for omeprazol var 250 ml/min (omtrent halvparten av unge frivillige) og plasmahalveringstiden var i gjennomsnitt én time, omtrent det dobbelte av unge friske frivillige.
Pediatriske pasienter
2 til 16 år
Farmakokinetikken til omeprazol har blitt undersøkt hos pediatriske pasienter i alderen 2 til 16 år:
Etter sammenlignbare mg/kg doser av omeprazol, har yngre barn (2 til 5 år) lavere AUC enn barn 6 til 16 år eller voksne; AUC for de to sistnevnte gruppene var ikke forskjellige [se DOSERING OG ADMINISTRASJON ].
1 til 11 måneders alder
En populasjonsfarmakokinetikkmodell ble brukt for å bestemme passende doser av PRILOSEC 40 mg hos pediatriske pasienter
1 måned til under 1 år for behandling (opptil 6 uker) av erosiv øsofagitt på grunn av syremediert GERD. Modellen var basert på data fra 64 barn i alderen 0,5 måned til 16 år. Kun begrensede data var tilgjengelig for barn yngre enn 1 år. Omeprazol ble administrert til pediatriske pasienter i disse studiene som en oral suspensjon laget av kapslene med forsinket frigjøring. Pediatriske doser ble simulert i aldersgruppen 1 til 11 måneder for å oppnå sammenlignbare omeprazoleksponeringer med voksne etter behandling med 20 mg én gang daglig [se DOSERING OG ADMINISTRASJON ].
Rase- eller etniske grupper
[Se KLINISK FARMAKOLOGI ].
Pasienter med nedsatt nyrefunksjon
Hos pasienter med kronisk nedsatt nyrefunksjon (kreatininclearance mellom 10 og 62 ml/min/1,73 m²), var disponeringen av omeprazol svært lik den hos friske personer, selv om det var en svak økning i biotilgjengelighet. Fordi urinutskillelse er en primær utskillelsesvei av omeprazolmetabolitter, ble deres eliminering redusert proporsjonalt med redusert kreatininclearance. Denne økningen i biotilgjengelighet anses ikke å være klinisk meningsfull.
Pasienter med nedsatt leverfunksjon
Hos pasienter med kronisk leversykdom klassifisert som Child-Pugh klasse A (n=3), B (n=4) og C (n=1), økte biotilgjengeligheten til omtrent 100 % sammenlignet med friske forsøkspersoner, noe som gjenspeiler redusert førstepassasje. effekt, og plasmahalveringstiden til legemidlet økte til nesten 3 timer sammenlignet med halveringstiden hos friske personer på 0,5 til 1 time. Plasmaclearance var i gjennomsnitt 70 ml/min, sammenlignet med en verdi på 500 til 600 ml/min hos friske personer [se DOSERING OG ADMINISTRASJON , Bruk i spesifikke populasjoner ].
Legemiddelinteraksjonsstudier
Effekt av omeprazol på andre legemidler
Omeprazol er en tidsavhengig hemmer av CYP2C19 og kan øke den systemiske eksponeringen av samtidig administrerte legemidler som er CYP2C19-substrater. I tillegg øker administrering av omeprazol intragastrisk pH og kan endre den systemiske eksponeringen av visse legemidler som viser pH-avhengig løselighet.
Antiretrovirale midler
For noen antiretrovirale legemidler, slik som rilpivirin, atazanavir og nelfinavir, er reduserte serumkonsentrasjoner rapportert når de gis sammen med omeprazol [se NARKOTIKAHANDEL ].
Rilpivirin: Etter gjentatte doser av rilpivirin (150 mg, daglig) og omeprazol (20 mg, daglig), ble AUC redusert med 40 %, Cmax med 40 % og Cmin med 33 % for rilpivirin.
Nelfinavir: Etter gjentatte doser av nelfinavir (1250 mg, to ganger daglig) og omeprazol (40 mg daglig), ble AUC redusert med 36 % og 92 %, Cmax med 37 % og 89 % og Cmin med henholdsvis 39 % og 75 % for nelfinavir og M8 .
Atazanavir: Etter gjentatte doser av atazanavir (400 mg, daglig) og omeprazol (40 mg, daglig, 2 timer før atazanavir), ble AUC redusert med 94 %, Cmax med 96 % og Cmin med 95 %.
Saquinavir: Etter gjentatt dosering av sakinavir/ritonavir (1000/100 mg) to ganger daglig i 15 dager med omeprazol 40 mg daglig administrert samtidig dag 11 til 15.
AUC ble økt med 82 %, Cmax med 75 % og Cmin med 106 %. Mekanismen bak denne interaksjonen er ikke fullstendig belyst.
Klopidogrel
I en klinisk crossover-studie ble 72 friske forsøkspersoner administrert klopidogrel (300 mg startdose etterfulgt av 75 mg per dag) alene og med omeprazol (80 mg samtidig som klopidogrel) i 5 dager. Eksponeringen for den aktive metabolitten til klopidogrel ble redusert med 46 % (dag 1) og 42 % (dag 5) når klopidogrel og omeprazol ble administrert sammen.
Resultater fra en annen crossover-studie med friske personer viste en lignende farmakokinetisk interaksjon mellom klopidogrel (300 mg startdose/75 mg daglig vedlikeholdsdose) og omeprazol 80 mg daglig når det ble administrert samtidig i 30 dager. Eksponering for den aktive metabolitten til klopidogrel ble redusert med 41 % til 46 % i løpet av denne tidsperioden.
I en annen studie ble 72 friske forsøkspersoner gitt de samme dosene klopidogrel og 80 mg omeprazol, men legemidlene ble administrert med 12 timers mellomrom; resultatene var like, noe som indikerer at administrering av klopidogrel og omeprazol til forskjellige tider ikke forhindrer deres interaksjon [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL ].
Mykofenolatmofetil
Administrering av omeprazol 20 mg to ganger daglig i 4 dager og en enkelt 1000 mg dose MMF omtrent en time etter siste dose omeprazol til 12 friske forsøkspersoner i en cross-over-studie resulterte i en 52 % reduksjon i Cmax og 23 % reduksjon. i AUC for MPA [se NARKOTIKAHANDEL ].
Cilostazol
Omeprazol virker som en hemmer av CYP2C19. Omeprazol, gitt i doser på 40 mg daglig i én uke til 20 friske personer i cross-over-studien, økte Cmax og AUC for cilostazol med henholdsvis 18 % og 26 %. Cmax og AUC for en av de aktive metabolittene, 3,4-dihydro-cilostazol, som har 4-7 ganger aktiviteten til cilostazol, ble økt med henholdsvis 29 % og 69 %. Samtidig administrering av cilostazol og omeprazol forventes å øke konsentrasjonene av cilostazol og den ovenfor nevnte aktive metabolitten [se NARKOTIKAHANDEL ].
Diazepam
Samtidig administrering av omeprazol 20 mg én gang daglig og diazepam 0,1 mg/kg gitt intravenøst resulterte i 27 % reduksjon i clearance og 36 % økning i diazepams halveringstid [se NARKOTIKAHANDEL ].
Digoksin
Samtidig administrering av omeprazol 20 mg én gang daglig og digoksin hos friske personer økte biotilgjengeligheten av digoksin med 10 % (30 % hos to personer) [se NARKOTIKAHANDEL ].
Effekten av andre stoffer på omeprazol
Vorikonazol
Samtidig administrering av omeprazol og vorikonazol (en kombinert hemmer av CYP2C19 og CYP3A4) resulterte i mer enn en dobling av omeprazoleksponeringen. Når vorikonazol (400 mg hver 12. time i én dag, etterfulgt av 200 mg én gang daglig i 6 dager) ble gitt sammen med omeprazol (40 mg én gang daglig i 7 dager) til friske forsøkspersoner, var steady-state Cmax og AUC0-24 for omeprazol. signifikant økt: gjennomsnittlig henholdsvis 2 ganger (90 % KI: 1,8, 2,6) og 4 ganger (90 % KI: 3,3, 4,4), sammenlignet med når omeprazol ble gitt uten vorikonazol [se NARKOTIKAHANDEL ].
Mikrobiologi
Omeprazol og klaritromycin dobbel terapi og omeprazol, klaritromycin og amoxicillin trippelbehandling har vist seg å være aktive mot de fleste stammer av Helicobacter pylori in vitro og ved kliniske infeksjoner [se INDIKASJONER OG BRUK , Kliniske studier ].
Helicobacter pylori
Følsomhetstesting av H. pylori-isolater ble utført for amoxicillin og klaritromycin ved bruk av agarfortynningsmetodikk1, og minimumshemmende konsentrasjoner (MICs) ble bestemt.
Standardiserte følsomhetstestprosedyrer krever bruk av laboratoriekontrollmikroorganismer for å kontrollere de tekniske aspektene ved laboratorieprosedyrene.
Forbehandlingsmotstand
Resistensrater for klaritromycin før behandling var 3,5 % (4/113) i omeprazol/klaritromycin dobbeltterapistudiene (4 og 5) og 9,3 % (41/439) i trippelterapistudiene omeprazol/klaritromycin/amoksicillin (1, 2 og 3).
Amoxicillin-mottakelige isolater (≤ 0,25 μg/ml) ble funnet hos 99,3 % (436/439) av pasientene i trippelterapistudiene omeprazol/klaritromycin/amoxicillin (1, 2 og 3). Amoksicillin forbehandlingsminste hemmende konsentrasjoner (MIC) > 0,25 μg/ml forekom hos 0,7 % (3/439) av pasientene, som alle var i klaritromycin- og amoksicillinstudiegruppen. En pasient hadde en ubekreftet minimumshemmende konsentrasjon (MIC) for amoxicillin før behandling på > 256 μg/ml av Etest®.
Pasienter som ikke er utryddet av H. pylori etter omeprazol/klaritromycin/amoxicillin trippelbehandling eller omeprazol/klaritromycin dobbeltbehandling vil sannsynligvis ha klaritromycinresistente H. pylori-isolater. Derfor bør klaritromycin-følsomhetstesting utføres, hvis mulig. Pasienter med klaritromycinresistent H. pylori bør ikke behandles med noen av følgende: omeprazol/klaritromycin dobbeltbehandling, omeprazol/klaritromycin/amoksicillin trippelbehandling eller andre regimer som inkluderer klaritromycin som eneste antimikrobielle middel.
Amoxicillin-følsomhetstestresultater og kliniske/bakteriologiske resultater
de kliniske studiene med trippelterapi ble 84,9 % (157/185) av pasientene i omeprazol/klaritromycin/amoxicillin-behandlingsgruppen som hadde amoxicillin-følsomme MIC-er før behandling (≤ 0,25 μg/ml) utryddet av H. pylori og 285 % (185 μg/ml). /185) mislykket terapi. Av de 28 pasientene som mislyktes med trippelterapi, hadde 11 ingen resultater av følsomhetstest etter behandling og 17 hadde H. pylori-isolater etter behandling med amoxicillin-følsomme MICs. Elleve av pasientene som mislyktes med trippelterapi hadde også H. pylori-isolater etter behandling med klaritromycinresistente MIC.
Følsomhetstest for Helicobacter pylori
For informasjon om følsomhetstesting om Helicobacter pylori, se avsnittet Mikrobiologi i forskrivningsinformasjon for klaritromycin og amoksicillin.
Effekter på gastrointestinal mikrobiell økologi
Redusert surhet i magen på grunn av noen midler, inkludert protonpumpehemmere, øker magetellingen av bakterier som normalt finnes i mage-tarmkanalen. Behandling med protonpumpehemmere kan føre til lett økt risiko for gastrointestinale infeksjoner som Salmonella og Campylobacter og, hos innlagte pasienter, muligens også Clostridium difficile.
Farmakogenomikk
CYP2C19, et polymorft enzym, er involvert i metabolismen av omeprazol. CYP2C19*1-allelen er fullt funksjonell mens CYP2C19*2- og *3-allelene er ikke-funksjonelle. Det er andre alleler assosiert med ingen eller redusert enzymatisk funksjon. Pasienter som bærer to fullt funksjonelle alleler er omfattende metabolisatorer og de som bærer to alleler med tap av funksjon er dårlige metabolisatorer. Hos omfattende metabolisatorer metaboliseres omeprazol primært av CYP2C19.
Den systemiske eksponeringen for omeprazol varierer med pasientens metabolismestatus: dårlige metabolisatorer > middels metabolisatorer > omfattende metabolisatorer. Omtrent 3 % av kaukasiere og 15 til 20 % av asiater er CYP2C19-fattige metaboliserere.
I en farmakokinetisk studie med en enkeltdose på 20 mg omeprazol, var AUC for omeprazol hos asiatiske personer omtrent fire ganger det hos kaukasiere [se DOSERING OG ADMINISTRASJON , Bruk i spesifikke populasjoner ].
Kliniske studier
Aktivt duodenalsår
en multisenter, dobbeltblind, placebokontrollert studie av 147 pasienter med endoskopisk dokumentert sår på tolvfingertarmen, var prosentandelen av pasienter helbredet (i henhold til protokoll) ved 2 og 4 uker signifikant høyere med omeprazol-magnesium-kapsler med forsinket frigjøring 20 mg én gang daglig enn med placebo (p ≤ 0,01).
Behandling av aktivt duodenalsår % av pasienter helbredet
Fullstendig smertelindring på dagtid og natt forekom signifikant raskere (p ≤ 0,01) hos pasienter behandlet med omeprazol-magnesium-kapsler med forsinket frigjøring 20 mg enn hos pasienter behandlet med placebo. Ved slutten av studien hadde signifikant flere pasienter som hadde fått omeprazolmagnesium forsinket frigjøringskapsler fullstendig lindring av smerte på dagtid (p ≤ 0,05) og nattesmerte (p ≤ 0,01).
en multisenter, dobbeltblind studie av 293 pasienter med endoskopisk dokumentert sår på tolvfingertarmen, var prosentandelen av pasienter helbredet (i henhold til protokoll) ved 4 uker signifikant høyere med omeprazol magnesium forsinket frigjøringskapsler 20 mg én gang daglig enn med ranitidin 150 mg to ganger daglig ( p
Behandling av aktivt duodenalsår % av pasienter helbredet
Tilheling skjedde signifikant raskere hos pasienter behandlet med omeprazolmagnesium-kapsler med forsinket frigivelse enn hos de behandlet med ranitidin 150 mg to ganger daglig (p
I en utenlandsk multinasjonal randomisert, dobbeltblind studie av 105 pasienter med endoskopisk dokumentert duodenalsår, ble 20 mg og 40 mg omeprazolmagnesium forsinket frigjøringskapsler sammenlignet med 150 mg to ganger daglig ranitidin ved 2, 4 og 8 uker. Etter 2 og 4 uker var begge dosene av PRILOSEC 10 mg statistisk overlegne (i henhold til protokoll) ranitidin, men 40 mg var ikke bedre enn 20 mg omeprazol-magnesium kapsler med forsinket frigjøring, og etter 8 uker var det ingen signifikant forskjell mellom noen av aktive stoffer.
Behandling av aktivt duodenalsår % av pasienter helbredet
H. pylori-utryddelse hos pasienter med duodenalsårsykdom
Trippelterapi (omeprazol magnesium kapsler med forsinket frigjøring/klaritromycin/amoxicillin)
Tre amerikanske, randomiserte, dobbeltblinde kliniske studier hos pasienter med H. pylori-infeksjon og tolvfingertarmsårsykdom (n = 558) sammenlignet omeprazolmagnesium kapsler med forsinket frigjøring pluss klaritromycin pluss amoksicillin med klaritromycin pluss amoksicillin. To studier (1 og 2) ble utført på pasienter med et aktivt sår på tolvfingertarmen, og den andre studien (3) ble utført på pasienter med en historie med sår på tolvfingertarmen i løpet av de siste 5 årene, men uten et sår tilstede på tidspunktet for registrering. . Doseregimet i studiene var omeprazolmagnesium kapsler med forsinket frigivelse 20 mg to ganger daglig pluss klaritromycin 500 mg to ganger daglig pluss amoksicillin 1 g to ganger daglig i 10 dager; eller klaritromycin 500 mg to ganger daglig pluss amoxicillin 1 g to ganger daglig i 10 dager. I studie 1 og 2 fikk pasienter som tok omeprazol-kuren også ytterligere 18 dager med omeprazol-magnesium-kapsler med forsinket frigivelse 20 mg én gang daglig. Endepunkter som ble studert var utryddelse av H. pylori og heling av duodenalsår (kun studie 1 og 2). H. pylori-status ble bestemt av CLOtest®, histologi og kultur i alle tre studiene. For en gitt pasient ble H. pylori ansett som utryddet hvis minst to av disse testene var negative, og ingen var positive.
Kombinasjonen av omeprazol pluss klaritromycin pluss amoksicillin var effektiv for å utrydde H. pylori.
Dobbel terapi (omeprazol magnesium kapsler med forsinket frigjøring/klaritromycin)
Fire randomiserte, dobbeltblindede multisenterstudier (4, 5, 6 og 7) evaluerte omeprazolmagnesium forsinket frigjøringskapsler 40 mg én gang daglig pluss klaritromycin 500 mg tre ganger daglig i 14 dager, etterfulgt av omeprazolmagnesium forsinket frigjøring kapsler 20 mg én gang daglig (studie 4, 5 og 7) eller med omeprazol magnesium kapsler med forsinket frigivelse 40 mg én gang daglig (studie 6) i ytterligere 14 dager hos pasienter med aktivt duodenalsår assosiert med H. pylori. Studie 4 og 5 ble utført i USA og Canada og inkluderte henholdsvis 242 og 256 pasienter. H. pylori-infeksjon og duodenalsår ble bekreftet hos 219 pasienter i studie 4 og 228 pasienter i studie 5. Disse studiene sammenlignet kombinasjonsregimet med omeprazol-magnesium-kapsler med forsinket frigjøring og klaritromycin-monoterapi. Studie 6 og 7 ble utført i Europa og inkluderte henholdsvis 154 og 215 pasienter. H. pylori-infeksjon og duodenalsår ble bekreftet hos 148 pasienter i studie 6 og 208 pasienter i studie 7. Disse studiene sammenlignet kombinasjonsregimet med omeprazol monoterapi. Resultatene for effektanalysene for disse studiene er beskrevet nedenfor. H. pylori-utryddelse ble definert som ingen positiv test (kultur eller histologi) 4 uker etter avsluttet behandling, og to negative tester ble påkrevd for å bli vurdert som utryddet av H. pylori. I per-protokollanalysen ble følgende pasienter ekskludert: frafall, pasienter med manglende H. pylori-tester etter behandling, og pasienter som ikke ble vurdert for utryddelse av H. pylori fordi de ble funnet å ha et sår ved slutten av behandlingen .
Kombinasjonen av omeprazol og klaritromycin var effektiv for å utrydde H. pylori.
Sårheling var ikke signifikant forskjellig når klaritromycin ble lagt til omeprazolbehandling sammenlignet med omeprazolbehandling alene.
Kombinasjonen av omeprazol og klaritromycin var effektiv for å utrydde H. pylori og reduserte tilbakefall av duodenalsår.
Aktivt benignt magesår
I en amerikansk multisenter, dobbeltblind studie av omeprazol 40 mg én gang daglig, 20 mg én gang daglig og placebo hos 520 pasienter med endoskopisk diagnostisert magesår, ble følgende resultater oppnådd.
Behandling av magesår % av pasienter helbredet (alle pasienter behandlet)
For de stratifiserte gruppene av pasienter med sårstørrelse mindre enn eller lik 1 cm, ble det ikke påvist noen forskjell i tilhelingshastigheter mellom 40 mg og 20 mg etter hverken 4 eller 8 uker. For pasienter med sårstørrelse større enn 1 cm, var 40 mg signifikant mer effektivt enn 20 mg etter 8 uker.
en utenlandsk, multinasjonal, dobbeltblind studie av 602 pasienter med endoskopisk diagnostisert magesår, ble omeprazol 40 mg én gang daglig, 20 mg én gang daglig og ranitidin 150 mg to ganger daglig evaluert.
Behandling av magesår % av pasienter helbredet (alle pasienter behandlet)
Symptomatisk GERD
En placebokontrollert studie ble utført i Skandinavia for å sammenligne effekten av omeprazol 20 mg eller 10 mg én gang daglig i opptil 4 uker ved behandling av halsbrann og andre symptomer hos GERD-pasienter uten EE. Resultatene vises nedenfor.
% Vellykket symptomatisk utfall1
EE på grunn av syremediert GERD
I en amerikansk multisenter dobbeltblind placebokontrollert studie av 20 mg eller 40 mg omeprazol magnesium kapsler med forsinket frigjøring hos pasienter med symptomer på GERD og endoskopisk diagnostisert EE av grad 2 eller høyere, var den prosentvise helingsraten (per protokoll) som følger :
denne studien var 40 mg-dosen ikke overlegen 20 mg-dosen av omeprazol-magnesium-kapsler med forsinket frigjøring i prosentvis tilhelingshastighet. Andre kontrollerte kliniske studier har også vist at omeprazolmagnesium kapsler med forsinket frigjøring er effektive ved alvorlig GERD. Sammenlignet med histamin H2-reseptorantagonister hos pasienter med EE, grad 2 eller høyere, var omeprazolmagnesium forsinket frigjøringskapsler i en dose på 20 mg signifikant mer effektive enn de aktive kontrollene. Fullstendig lindring av halsbrann på dagtid og natt forekom signifikant raskere (p
I denne og fem andre kontrollerte GERD-studier rapporterte signifikant flere pasienter som tok 20 mg omeprazol (84 %) fullstendig lindring av GERD-symptomer enn pasienter som fikk placebo (12 %).
Vedlikehold av helbredelse av EE på grunn av syremediert GERD
en amerikansk dobbeltblind, randomisert, multisenter, placebokontrollert studie ble to doseregimer med omeprazolmagnesium kapsler med forsinket frigjøring studert hos pasienter med endoskopisk bekreftet helbredet øsofagitt. Resultater for å bestemme vedlikehold av helbredelse av EE er vist nedenfor.
Livstabellanalyse
I en internasjonal multisenter dobbeltblind studie ble omeprazolmagnesium forsinket frigjøringskapsler 20 mg daglig og 10 mg daglig sammenlignet med ranitidin 150 mg to ganger daglig hos pasienter med endoskopisk bekreftet helbredet øsofagitt. Tabellen nedenfor viser resultatene av denne studien for vedlikehold av helbredelse av EE.
Livstabellanalyse
Hos pasienter som opprinnelig hadde grad 3 eller 4 erosiv øsofagitt, var 20 mg daglig med omeprazol-magnesium forsinket frigjøringskapsler effektiv for vedlikehold etter tilheling, mens 10 mg ikke viste effekt.
Patologiske hypersekretoriske tilstander
åpne studier av 136 pasienter med patologiske hypersekretoriske tilstander, som Zollinger-Ellison (ZE) syndrom med eller uten multiple endokrine adenomer, hemmet omeprazolmagnesium forsinket frigjøringskapsler signifikant magesyresekresjonen og kontrollerte assosierte symptomer på diaré, anoreksi og smerte. Doser fra 20 mg annenhver dag til 360 mg per dag opprettholdt basalsyresekresjonen under 10 mEq/time hos pasienter uten tidligere gastrisk kirurgi, og under 5 mEq/time hos pasienter med tidligere gastrisk kirurgi.
Startdoser ble titrert til den enkelte pasients behov, og justeringer var nødvendig over tid hos noen pasienter [se DOSERING OG ADMINISTRASJON ]. Omeprazol magnesium kapsler med forsinket frigivelse ble godt tolerert ved disse høye dosenivåene i lengre perioder (> 5 år hos noen pasienter). Hos de fleste ZE-pasienter ble ikke serumgastrinnivåene modifisert av omeprazol-magnesium-kapsler med forsinket frigjøring. Hos noen pasienter økte imidlertid serumgastrin til nivåer høyere enn de som var tilstede før oppstart av omeprazolbehandling. Minst 11 pasienter med ZE-syndrom på langtidsbehandling med omeprazol-magnesium-kapsler med forsinket frigivelse utviklet magekarsinoider. Disse funnene antas å være en manifestasjon av den underliggende tilstanden, som er kjent for å være assosiert med slike svulster, snarere enn resultatet av administrering av omeprazol-magnesium-kapsler med forsinket frigjøring [se BIVIRKNINGER ].
Pediatriske studier for behandling av symptomatisk GERD, behandling av EE på grunn av syremediert GERD, og vedlikehold av helbredelse av EE på grunn av syremediert GERD
Behandling av symptomatisk GERD
Effektiviteten av omeprazolmagnesium kapsler med forsinket frigjøring for behandling av symptomatisk GERD hos pediatriske pasienter i alderen 1 til 16 år er delvis basert på data innhentet fra 125 pediatriske pasienter i to ukontrollerte kliniske studier.
Den første studien inkluderte 12 pediatriske pasienter i alderen 1 til 2 år med en historie med klinisk diagnostisert GERD. Pasientene ble administrert en enkeltdose omeprazol (0,5 mg/kg, 1 mg/kg eller 1,5 mg/kg) i 8 uker som en åpen kapsel i 8,4 % natriumbikarbonatløsning. Syttifem prosent (9/12) av pasientene hadde oppkast/oppstøt-episoder redusert fra baseline med minst 50 %.
Den andre studien inkluderte 113 pediatriske pasienter i alderen 2 til 16 år med en historie med symptomer som tyder på symptomatisk GERD. Pasientene ble administrert en enkelt dose omeprazol (10 mg eller 20 mg, basert på kroppsvekt) i 4 uker, enten som en intakt kapsel eller som en åpen kapsel i eplemos. Vellykket respons ble definert som ingen moderate eller alvorlige episoder av verken smerterelaterte symptomer eller oppkast/oppstøt i løpet av de siste 4 dagene av behandlingen. Resultatene viste suksessrater på henholdsvis 60 % (9/15; 10 mg omeprazol) og 59 % (58/98; 20 mg omeprazol).
Behandling av EE på grunn av syremediert GERD
en ukontrollert, åpen dosetitreringsstudie, for behandling av EE hos pediatriske pasienter i alderen 1 til 16 år, krevde doser som varierte fra 0,7 til 3,5 mg/kg/dag (80 mg/dag). Doser ble startet med 0,7 mg/kg/dag. Dosene ble økt i trinn på 0,7 mg/kg/dag (hvis intraøsofageal pH viste en pH på
Vedlikehold av helbredelse av EE på grunn av syremediert GERD
en ukontrollert, åpen studie av vedlikehold av tilheling av EE hos 46 pediatriske pasienter i alderen 1 til 16 år, trengte 54 % av pasientene halvparten av helbredelsesdosen. De resterende pasientene økte tilhelingsdosen (0,7 til maksimalt 2,8 mg/kg/dag) enten i hele vedlikeholdsperioden, eller gikk tilbake til halve dosen før fullføring. Av de 46 pasientene som gikk inn i vedlikeholdsfasen, hadde 19 (41 %) ingen tilbakefall under oppfølgingen (spredning 4 til 25 måneder). I tillegg resulterte vedlikeholdsbehandling hos EE-pasienter i at 63 % av pasientene ikke hadde noen generelle symptomer.
REFERANSER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder for fortynning Antimikrobielle mottakelighetstester for bakterier som vokser aerobt; Godkjent standard - tiende utgave. CLSI Document M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania, 19087, USA 2015.
PASIENTINFORMASJON
PRILOSEC® (pry-lo-sec) (omeprazol magnesium) for mikstur med forsinket frigivelse
Hva er den viktigste informasjonen jeg bør vite om PRILOSEC?
PRILOSEC 10mg kan hjelpe dine syrerelaterte symptomer, men du kan fortsatt ha alvorlige mageproblemer. Snakk med legen din.
PRILOSEC kan forårsake alvorlige bivirkninger, inkludert:
- . En type nyreproblem (akutt tubulointerstitiell nefritt). Noen personer som tar protonpumpehemmere (PPI), inkludert PRILOSEC, kan utvikle et nyreproblem kalt akutt tubulointerstitiell nefritt som kan oppstå når som helst under behandling med PRILOSEC. Ring legen din med en gang hvis du har en reduksjon i mengden du tisser eller hvis du har blod i urinen. . Diaré forårsaket av en infeksjon (Clostridium difficile) i tarmene dine. Ring legen din med en gang hvis du har vannaktig avføring eller magesmerter som ikke går over. Du har kanskje feber eller ikke. . Benbrudd (hofte, håndledd eller ryggrad). Benbrudd i hoften, håndleddet eller ryggraden kan forekomme hos personer som tar flere daglige doser av PPI-medisiner og over en lengre periode (et år eller lenger). Fortell legen din dersom du har beinbrudd, spesielt i hoften, håndleddet eller ryggraden. . Visse typer lupus erythematosus. Lupus erythematosus er en autoimmun lidelse (kroppens immunceller angriper andre celler eller organer i kroppen). Noen mennesker som tar PPI-medisiner, inkludert PRILOSEC 10mg, kan utvikle visse typer lupus erythematosus eller ha forverring av lupus de allerede har. Ring legen din med en gang hvis du har nye eller forverrede leddsmerter eller utslett på kinnene eller armene som blir verre i solen.
Snakk med legen din om risikoen for disse alvorlige bivirkningene. PRILOSEC 10mg kan ha andre alvorlige bivirkninger. Se "Hva er de mulige bivirkningene av PRILOSEC 20mg?"
Hva er PRILOSEC 20mg?
Et reseptbelagt legemiddel kalt en protonpumpehemmer (PPI) som brukes til å redusere mengden syre i magen.
Hos voksne, PRILOSEC 20mg brukes til:
- . opptil 8 uker for helbredelse av duodenalsår. . 10 til 14 dager med visse antibiotika for å behandle en infeksjon forårsaket av bakterier kalt H. pylori. Om nødvendig kan legen forskrive ytterligere 14 til 18 dager med PRILOSEC etter behandling med antibiotika. . opptil 8 uker for å helbrede magesår. . opptil 4 uker for å behandle halsbrann og andre symptomer som oppstår med gastroøsofageal reflukssykdom (GERD). . opptil 8 uker for helbredelse og symptomlindring av syrerelatert skade på slimhinnen i spiserøret (kalt erosiv øsofagitt eller EE). Legen din kan forskrive ytterligere 4 uker med PRILOSEC 20 mg til pasienter hvis EE ikke gror. . opprettholde helbredelse av EE og bidra til å forhindre tilbakekomst av halsbrannsymptomer forårsaket av GERD. Det er ikke kjent om PRILOSEC er trygt og effektivt når det brukes i mer enn 12 måneder for dette formålet. . langtidsbehandling av tilstander der magen lager for mye syre. Dette inkluderer en sjelden tilstand kalt Zollinger-Ellisons syndrom.
Hos barn 1 til 16 år, PRILOSEC 20mg brukes til:
- . opptil 4 uker for å behandle halsbrann og andre symptomer som oppstår med GERD. . opptil 8 uker for å behandle GERD med EE. . opprettholde helbredelse av EE og bidra til å forhindre tilbakekomst av halsbrannsymptomer forårsaket av GERD. Det er ikke kjent om PRILOSEC er trygt og effektivt når det brukes i mer enn 12 måneder til dette formålet.
Hos barn fra 1 måned til under 12 måneder, PRILOSEC 10mg brukes til:
- . opptil 6 uker for å behandle GERD med EE. Det er ikke kjent om PRILOSEC er trygt og effektivt for annen bruk hos barn fra 1 måned til under 12 måneder, eller hos barn under 1 måned.
Ikke ta PRILOSEC hvis du er:
- . allergisk mot omeprazol, andre PPI-medisiner eller noen av ingrediensene i PRILOSEC. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser. . tar et legemiddel som inneholder rilpivirin (EDURANT, COMPLERA, ODEFSEY) som brukes til å behandle HIV-1 (humant immunsviktvirus).
Før du tar PRILOSEC 20mg, fortell legen din om alle dine medisinske tilstander, inkludert hvis du:
- . har lave magnesiumnivåer, lave kalsiumnivåer og lave kaliumnivåer i blodet. . er gravid eller planlegger å bli gravid. Det er ikke kjent om PRILOSEC 10 mg vil skade det ufødte barnet ditt. . ammer eller planlegger å amme. PRILOSEC 40 mg kan gå over i morsmelk. Snakk med legen din om den beste måten å mate babyen din på hvis du tar PRILOSEC. . Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie legemidler, vitaminer og urtetilskudd. Fortell spesielt legen din hvis du tar et legemiddel som inneholder klaritromycin eller amoxicillin, klopidogrel (Plavix), metotreksat (Otrxup, Rasuvo, Trexall, XATMEP), digoksin (LANOXIN), en vannpille (vanndrivende), johannesurt (Hypericum perforatum) eller rifampin (Rimactane, Rifater, Rifamate).
Hvordan skal jeg ta PRILOSEC 20mg?
- . Ta PRILOSEC 20mg nøyaktig som foreskrevet av legen din. . Ikke endre dosen eller slutt med PRILOSEC 40 mg uten å snakke med legen din. . PRILOSEC tas vanligvis 1 gang hver dag. . Ta PRILOSEC 20 mg før et måltid. . Antacida kan tas sammen med PRILOSEC. . PRILOSEC blandes med vann og kan tas gjennom munnen, eller gis gjennom en nasogastrisk sonde (NG) eller gastrisk sonde. . Se "Instruksjoner for bruk" på slutten av denne medisinveiledningen for instruksjoner om hvordan du blander og tar PRILOSEC 10mg gjennom munnen i vann eller hvordan du blander og gir PRILOSEC gjennom et NG-rør eller magesonde blandet i vann. . Hvis du glemmer en dose PRILOSEC, ta den så snart du husker det. Hvis det nesten er tid for neste dose, ikke ta den glemte dosen. Ta neste dose til vanlig tid. Ikke ta 2 doser samtidig. . Hvis du tar for mye PRILOSEC, ring legen din eller giftkontrollsenteret på 1-800-222-1222 med en gang eller gå til nærmeste legevakt.
Hva er de mulige bivirkningene av PRILOSEC 40mg?
PRILOSEC kan forårsake alvorlige bivirkninger, inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om PRILOSEC 40mg?" . Lave nivåer av vitamin B-12 kroppen din kan skje hos personer som har tatt PRILOSEC 40 mg i lang tid (mer enn 3 år). Fortell legen din dersom du har symptomer på lave vitamin B-12-nivåer, inkludert kortpustethet, svimmelhet, uregelmessig hjerterytme, muskelsvakhet, blek hud, tretthetsfølelse, humørsvingninger og prikking eller nummenhet i armer og ben. . Lavt magnesiumnivå og mineralmetabolisme i kroppen din kan forekomme hos personer som har tatt PRILOSEC i minst 3 måneder. Fortell legen din dersom du har symptomer på lave magnesiumnivåer, inkludert anfall, svimmelhet, uregelmessig hjerterytme, nervøsitet, muskelsmerter eller svakhet, og spasmer i hender, føtter eller stemme. . Magevekster (fundiske kjertelpolypper). Personer som bruker PPI-medisiner i lang tid har økt risiko for å utvikle en viss type magevekster som kalles fundic gland polypper, spesielt etter å ha tatt PPI-medisiner i mer enn 1 år. . Alvorlige hudreaksjoner. PRILOSEC kan forårsake sjeldne, men alvorlige hudreaksjoner som kan påvirke hvilken som helst del av kroppen din. Disse alvorlige hudreaksjonene må kanskje behandles på sykehus og kan være livstruende:
- . Hudutslett som kan ha blemmer, avskalling eller blødning på noen del av huden din (inkludert leppene, øynene, munnen, nesen, kjønnsorganene, hendene eller føttene). . Du kan også ha feber, frysninger, kroppssmerter, kortpustethet eller forstørrede lymfeknuter.
Slutt å ta PRILOSEC 20 mg og ring legen din umiddelbart. Disse symptomene kan være det første tegn på en alvorlig hudreaksjon.
De vanligste bivirkningene av PRILOSEC 40 mg hos voksne inkluderer: hodepine, magesmerter (mage), kvalme, diaré, oppkast og gass.
De vanligste bivirkningene av PRILOSEC hos barn i alderen 1 til 16 år inkluderer: øvre luftveisinfeksjon, feber, hodepine, magesmerter (mage), kvalme, diaré, oppkast og gass. Dette er ikke alle mulige bivirkninger av PRILOSEC. Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare PRILOSEC 40mg?
Oppbevar PRILOSEC ved romtemperatur mellom 68 °F til 77 °F (20 °C til 25 °C).
Oppbevar PRILOSEC 20mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av PRILOSEC.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk PRILOSEC for en tilstand det ikke er foreskrevet for. Ikke gi PRILOSEC 40 mg til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem. Du kan spørre legen din eller apoteket om informasjon om PRILOSEC 20mg som er skrevet for helsepersonell.
Hva er ingrediensene i PRILOSEC?
Aktiv ingrediens: omeprazol magnesium
Inaktive ingredienser: glycerylmonostearat, hydroksypropylcellulose, hypromellose, magnesiumstearat, metakrylsyrekopolymer C, polysorbat, sukkerkuler, talkum og trietylsitrat, og også inaktive granuler. De inaktive granulene er sammensatt av sitronsyre, krospovidon, dekstrose, hydroksypropylcellulose, jernoksid og xantangummi.
INSTRUKSJONER FOR BRUK
PRILOSEC® (pry-lo-sec) (omeprazol magnesium) for mikstur med forsinket frigivelse
Inntak av PRILOSEC 40 mg i vann:
. PRILOSEC 40mg kommer i pakker som inneholder 2,5 mg og 10 mg PRILOSEC. . Bruk en oral sprøyte for å trekke opp mengden vann som trengs for å blande dosen. Spør apoteket om en oral sprøyte. . Hvis dosen din av PRILOSEC 20 mg er 2,5 mg, tilsett 5 ml vann i en ren beholder. Tøm innholdet i 2,5 mg-pakken i beholderen med vann. . Hvis dosen din av PRILOSEC 10 mg er 10 mg, tilsett 15 ml vann i en ren beholder. Tøm innholdet i 10 mg-pakken i beholderen med vann. . Hvis du eller barnet ditt blir bedt om å bruke mer enn 1 pakke for din dose av PRILOSEC 10mg, følg blandingsinstruksjonene gitt av apoteket eller legen din. . Røre. . La blandingen stå i 2 til 3 minutter for å tykne. . Rør og drikk blandingen innen 30 minutter. Hvis den ikke brukes innen 30 minutter, kast denne dosen og bland en ny dose. . Hvis det er medisin igjen etter å ha drukket, tilsett mer vann, rør om og drikk med en gang.Å gi PRILOSEC med vann gjennom en nasogastrisk sonde eller gastrisk sonde:
For personer som har en NG-sonde eller magesonde som er størrelse 6 eller større, kan PRILOSEC gis som følger:
. PRILOSEC 20mg kommer i pakker som inneholder 2,5 mg og 10 mg PRILOSEC. . Bruk kun en sprøyte med kateterspiss for å gi PRILOSEC 20 mg gjennom en NG-slange eller mageslange som er størrelse 6 eller større. . Hvis dosen din av PRILOSEC er 2,5 mg, tilsett 5 ml vann til en sprøyte med kateterspiss. Legg innholdet i 2,5 mg-pakken til sprøyten. . Hvis dosen din av PRILOSEC 40 mg er 10 mg, tilsett 15 ml vann til en sprøyte med kateterspiss. Legg innholdet i 10 mg-pakken til sprøyten. . Rist sprøyten med en gang og la blandingen stå i 2 til 3 minutter for å tykne. . Rist sprøyten og injiser gjennom NG-slangen eller mageslangen inn i magen innen 30 minutter. . Fyll sprøyten med samme mengde vann som du brukte til å tilberede dosen av PRILOSEC (5 mL eller 15 mL vann avhengig av dosen). . Rist sprøyten og skyll eventuell gjenværende medisin fra NG-slangen eller magesonden ned i magen.Denne medisinveiledningen er godkjent av US Food and Drug Administration
