Protonix 20mg, 40mg Pantoprazole Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Protonix 40mg og hvordan brukes det?
Protonix 40mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på øsofagitt forårsaket av magesyre på grunn av gastroøsofageal reflukssykdom eller GERD og Zollinger-Ellisons syndrom eller andre tilstander som forårsaker for mye magesyre. Protonix 40mg kan brukes alene eller sammen med andre medisiner.
Protonix tilhører en klasse medikamenter som kalles protonpumpehemmere (PPI).
Det er ikke kjent om Protonix er trygt og effektivt hos barn under 5 år.
Hva er de mulige bivirkningene av Protonix?
Protonix kan forårsake alvorlige bivirkninger, inkludert:
- . sterke magesmerter, . diaré som er vannaktig eller har blod i seg, . plutselig smerte eller problemer med å bevege hoften, håndleddet eller ryggen, . blåmerker eller hevelse på injeksjonsstedet, . lite eller ingen vannlating, . blod i urinen, . opphovning, . rask vektøkning, . svimmelhet, . rask eller uregelmessig hjerterytme, . skjelvinger (risting) eller rykkende bevegelser, . føler seg nervøs, . muskelkramper eller spasmer i hender eller føtter, . hoste, . kvelende følelse, . leddsmerter, og . hudutslett på kinnene eller armene som forverres om natten
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Protonix inkluderer:
- . hodepine, . svimmelhet, . magesmerter, . gass, . kvalme, . oppkast, . diaré, . leddsmerter, . feber, . utslett, og . forkjølelsessymptomer (mest vanlig hos barn)
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Prometrium. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Den aktive ingrediensen i PROTONIX (pantoprazolnatrium) for oral suspensjon med forsinket frigjøring og PROTONIX (pantoprazolnatrium) tabletter med forsinket frigjøring, en PPI, er en substituert benzimidazol, natrium 5-(difluormetoksy)-2-[[(3,4-) dimetoksy-2-pyridinyl)metyl]sulfinyl]-1H-benzimidazol-sesquihydrat, en forbindelse som hemmer magesyresekresjon. Dens empiriske formel er C16H14F2N3NaO4S x 1,5 H2O, med en molekylvekt på 432,4. Strukturformelen er:
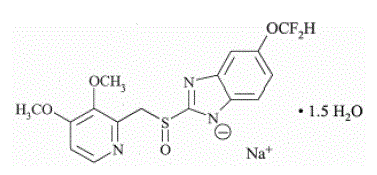
Pantoprazolnatriumseskvihydrat er et hvitt til off-white krystallinsk pulver og er racemisk. Pantoprazol har svakt basiske og sure egenskaper. Pantoprazolnatriumseskvihydrat er fritt løselig i vann, svært lite løselig i fosfatbuffer ved pH 7,4, og praktisk talt uløselig i n-heksan.
Stabiliteten til forbindelsen i vandig løsning er pH-avhengig. Nedbrytningshastigheten øker med synkende pH. Ved omgivelsestemperatur er nedbrytningshalveringstiden ca. 2,8 timer ved pH 5 og ca. 220 timer ved pH 7,8.
PROTONIX 40 mg leveres som oral suspensjon for forsinket frigjøring i enhetsdosepakninger, tilgjengelig i én styrke (40 mg) pantoprazol, (tilsvarer 45,1 mg pantoprazolnatrium), og som en tablett med forsinket frigjøring, tilgjengelig i to styrker 20 mg pantoprazol (tilsvarer 22,56 mg pantoprazolnatrium) og 40 mg pantoprazol (tilsvarer 45,1 mg pantoprazolnatrium).
PROTONIX tabletter med forsinket frigjøring inneholder følgende inaktive ingredienser: kalsiumstearat, krospovidon, hypromellose, jernoksid, mannitol, metakrylsyrekopolymer, polysorbat 80, povidon, propylenglykol, natriumkarbonat, natriumlaurylsulfat, titandioksyd, og. PROTONIX tabletter med forsinket frigjøring (40 mg og 20 mg) samsvarer med USP-oppløsningstest 2.
PROTONIX 40 mg oral suspensjon med forsinket frigivelse inneholder følgende inaktive ingredienser: krospovidon, hypromellose, metakrylsyrekopolymer, mikrokrystallinsk cellulose, polysorbat 80, povidon, natriumkarbonat, natriumlaurylsulfat, talkum, titandioksyd, trietylferrisitratoksyd, trietylferrisitratoksyd.
INDIKASJONER
PROTONIX for oral suspensjon med forsinket frigjøring og PROTONIX 40 mg tabletter med forsinket frigjøring er indisert for:
Kortvarig behandling av erosiv øsofagitt assosiert med gastroøsofageal reflukssykdom (GERD)
PROTONIX 20 mg er indisert hos voksne og pediatriske pasienter fra fem år og eldre for korttidsbehandling (opptil 8 uker) for helbredelse og symptomatisk lindring av erosiv øsofagitt (EE). For de voksne pasientene som ikke har helbredet etter 8 ukers behandling, kan en ytterligere 8-ukers kur med PROTONIX vurderes. Sikkerhet ved behandling utover 8 uker hos pediatriske pasienter er ikke fastslått.
Vedlikehold av helbredelse av erosiv øsofagitt
PROTONIX er indisert for vedlikehold av helbredelse av EE og reduksjon i tilbakefallsrater av halsbrannsymptomer på dagtid og natt hos voksne pasienter med GERD. Kontrollerte studier strakk seg ikke utover 12 måneder.
Patologiske hypersekretoriske tilstander inkludert Zollinger-Ellison syndrom
PROTONIX 20 mg er indisert for langtidsbehandling av patologiske hypersekretoriske tilstander, inkludert Zollinger-Ellison (ZE) syndrom.
DOSERING OG ADMINISTRASJON
Anbefalt doseringsskjema
PROTONIX leveres som granulat med forsinket frigjøring i pakker for tilberedning av orale suspensjoner eller som tabletter med forsinket frigjøring. De anbefalte dosene er skissert i tabell 1.
Administrasjonsinstruksjoner
Instruksjoner for administrasjonsmåte for hver doseringsform er presentert i tabell 2.
Ta en glemt dose så snart som mulig. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og ta neste dose til vanlig planlagt tid. Ikke ta 2 doser samtidig.
PROTONIX tabletter med forsinket utgivelse
Svelg PROTONIX tabletter med forsinket frigjøring hele, med eller uten mat i magen. For pasienter som ikke kan svelge en 40 mg tablett, kan to 20 mg tabletter tas. Samtidig administrering av antacida påvirker ikke absorpsjonen av PROTONIX tabletter med forsinket frigjøring.
PROTONIX For oral suspensjon med forsinket frigjøring
Administrer PROTONIX for oral suspensjon med forsinket frigjøring ca. 30 minutter før et måltid via oral administrering i eplejuice eller eplemos eller nasogastrisk sonde i eplejuice. Fordi riktig pH er nødvendig for stabilitet, ikke administrer PROTONIX 20mg For Delayed-Release oral Suspension i andre væsker enn eplejuice, eller andre matvarer enn eplemos.
Ikke del 40 mg PROTONIX 20 mg for oral suspensjon med forsinket frigjøring for å lage en 20 mg dose for pediatriske pasienter som ikke kan ta tablettformuleringen.
PROTONIX for oral suspensjon med forsinket frigjøring - Oral administrering i eplemos
- . Åpne pakken. . Dryss granulat på en teskje eplemos. IKKE BRUK ANNEN MAT ELLER KNUS ELLER TYGG GRANULENE. . Ta innen 10 minutter etter forberedelse. . Ta slurker med vann for å forsikre deg om at granulatet skylles ned i magen. Gjenta vannsluker etter behov.
PROTONIX for oral suspensjon med forsinket frigjøring - Oral administrering i eplejuice
- . Åpne pakken. . Tøm granulat i en liten kopp eller teskje som inneholder en teskje eplejuice. . Rør i 5 sekunder (granulat løses ikke opp) og svelg umiddelbart. . For å være sikker på at hele dosen er tatt, skyll beholderen en eller to ganger med eplejuice for å fjerne gjenværende granulat. Svelg umiddelbart.
PROTONIX 40 mg for oral suspensjon med forsinket frigjøring - administrasjon av nasogastrisk (NG) sonde eller gastrostomi
For pasienter som har en nasogastrisk sonde eller gastrostomisonde på plass, kan PROTONIX 40 mg for oral suspensjon med forsinket frigivelse gis som følger:
- . Fjern stempelet fra sylinderen til en 2 unse (60 ml) kateterspisssprøyte. Kast stempelet. . Koble katetertuppen på sprøyten til et 16 French (eller større) rør. . Hold sprøyten festet til slangen så høyt som mulig mens du gir PROTONIX For Delayed-Release oral suspensjon for å forhindre at slangen bøyer seg. . Tøm innholdet i pakken i sylinderen til sprøyten. . Tilsett 10 mL (2 teskjeer) eplejuice og bank forsiktig og/eller rist sprøytens sylinder for å skylle sprøyten og slangen. Gjenta minst to ganger til med samme mengde eplejuice (10 ml eller 2 teskjeer) hver gang. Ingen granulat skal være igjen i sprøyten.
HVORDAN LEVERES
Doseringsformer og styrker
Tabletter med forsinket utgivelse:
- . 40 mg pantoprazol, gule ovale bikonvekse tabletter merket med PROTONIX (brunt blekk) på den ene siden . 20 mg pantoprazol, gule ovale bikonvekse tabletter merket med P20 (brunt blekk) på den ene siden
For oral suspensjon med forsinket frigjøring:
- . 40 mg pantoprazol, blek gulaktig til mørk brunaktig, enterisk belagte granulat i en enhetsdosepakke
Oppbevaring og håndtering
PROTONIX (pantoprazolnatrium) tabletter med forsinket frigjøring leveres som gule, ovale bikonvekse tabletter med forsinket frigjøring merket med PROTONIX (brunt blekk) på den ene siden som inneholder 40 mg pantoprazol og er tilgjengelig som følger:
NDC 0008-0841-81, flasker à 90 stk
PROTONIX (pantoprazolnatrium) tabletter med forsinket frigjøring leveres som gule ovale bikonvekse tabletter med forsinket frigjøring merket med P20 (brunt blekk) på den ene siden som inneholder 20 mg pantoprazol og er tilgjengelig som følger:
NDC 0008-0843-81, flasker à 90 stk
PROTONIX (pantoprazolnatrium) For oral suspensjon med forsinket frigjøring leveres som blek gulaktig til mørk brunaktig, enterisk belagt granulat som inneholder 40 mg pantoprazol i en enhetsdosepakke og er tilgjengelig som følger:
NDC 0008-0844-02, enhetsdosekartong med 30 stk
Oppbevaring
Oppbevar PROTONIX 40 mg for oral suspensjon med forsinket frigjøring og PROTONIX 20 mg tabletter med forsinket frigjøring ved 20° til 25°C (68° til 77°F); utflukter tillatt til 15° til 30°C (59° til 86°F) [se USP kontrollert romtemperatur ].
Distribuert av: Wyeth Pharmaceuticals LLC, et datterselskap av Pfizer Inc., Philadelphia, PA 19101. Revidert: nov 2020
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i merkingen:
- . Akutt Tubulointerstitiell nefritis [se ADVARSLER OG FORHOLDSREGLER ] . Clostridium difficile-assosiert diaré [se ADVARSLER OG FORHOLDSREGLER ] . Benbrudd [se ADVARSLER OG FORHOLDSREGLER ] . Kutan og systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ] . Cyanokobalamin (vitamin B-12) mangel [se ADVARSLER OG FORHOLDSREGLER ] . Hypomagnesemi [se ADVARSLER OG FORHOLDSREGLER ] . Fundic kjertelpolypper [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Bivirkningsprofilene for PROTONIX (pantoprazolnatrium) for oral suspensjon med forsinket frigivelse og PROTONIX (pantoprazolnatrium) tabletter med forsinket frigjøring er like.
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
Voksne
Sikkerhet i ni randomiserte sammenlignende amerikanske kliniske studier hos pasienter med GERD inkluderte 1 473 pasienter på oral PROTONIX (20 mg eller 40 mg), 299 pasienter på en H2-reseptorantagonist, 46 pasienter på en annen PPI og 82 pasienter på placebo. De hyppigst forekommende bivirkningene er oppført i tabell 3.
Ytterligere bivirkninger som ble rapportert for PROTONIX 20 mg i kliniske studier med en frekvens på ≤2 %, er oppført nedenfor etter kroppssystem:
Kroppen som helhet: allergisk reaksjon, pyreksi, lysfølsomhetsreaksjon, ansiktsødem
Gastrointestinale: forstoppelse, munntørrhet, hepatitt
Hematologisk: leukopeni, trombocytopeni
Metabolsk/ernæringsmessig: forhøyet CK (kreatinkinase), generalisert ødem, forhøyede triglyserider, forhøyede leverenzymer
Muskuloskeletal: myalgi
Nervøs: depresjon, svimmelhet
Hud og vedheng: urticaria, utslett, kløe
Spesielle sanser: tåkesyn
Pediatriske pasienter
Sikkerheten til PROTONIX ved behandling av EE assosiert med GERD ble evaluert hos pediatriske pasienter i alderen 1 år til 16 år i tre kliniske studier. Sikkerhetsstudier involverte pediatriske pasienter med EE; Men siden EE er uvanlig i den pediatriske populasjonen, ble 249 pediatriske pasienter med endoskopisk påvist eller symptomatisk GERD også evaluert. Alle voksne bivirkninger av PROTONIX 20 mg anses som relevante for pediatriske pasienter. Hos pasienter i alderen 1 år til 16 år inkluderer de vanligst rapporterte (>4 %) bivirkningene: URI, hodepine, feber, diaré, oppkast, utslett og magesmerter.
For sikkerhetsinformasjon for pasienter under 1 år se Bruk i spesifikke populasjoner .
Ytterligere bivirkninger som ble rapportert for PROTONIX 20 mg hos pediatriske pasienter i kliniske studier med en frekvens på ≤4 %, er oppført nedenfor etter kroppssystem:
Kroppen som helhet: allergisk reaksjon, ansiktsødem
Gastrointestinale: forstoppelse, flatulens, kvalme
Metabolsk/ernæringsmessig: forhøyede triglyserider, forhøyede leverenzymer, forhøyet CK (kreatinkinase)
Muskuloskeletal: artralgi, myalgi
Nervøs: svimmelhet, svimmelhet
Hud og vedheng: urticaria
Følgende bivirkninger sett hos voksne i kliniske studier ble ikke rapportert hos pediatriske pasienter i kliniske studier, men anses som relevante for pediatriske pasienter: lysfølsomhetsreaksjon, munntørrhet, hepatitt, trombocytopeni, generalisert ødem, depresjon, pruritus, leukopeni og tåkesyn. .
Zollinger-Ellison (ZE) syndrom
I kliniske studier av ZE-syndrom var bivirkninger rapportert hos 35 pasienter som tok PROTONIX 80 mg/dag til 240 mg/dag i opptil 2 år, lik de som ble rapportert hos voksne pasienter med GERD.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av PROTONIX etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Disse bivirkningene er oppført nedenfor etter kroppssystem:
Gastrointestinale lidelser: fundic kjertel polypper
Generelle lidelser og administrasjonsbetingelser: asteni, tretthet, ubehag
Hematologisk: pancytopeni, agranulocytose
Lever og gallesykdommer: hepatocellulær skade som fører til gulsott og leversvikt
Forstyrrelser i immunsystemet: anafylaksi (inkludert anafylaktisk sjokk), systemisk lupus erythematosus
Infeksjoner og angrep: Clostridium difficile assosiert diaré
Undersøkelser: vektendringer
Metabolisme og ernæringsforstyrrelser: hyponatremi, hypomagnesemi
Muskel- og skjelettlidelser: rabdomyolyse, benbrudd
Nervøs: alderdom, dysgeusi
Psykiatriske lidelser: hallusinasjoner, forvirring, søvnløshet, somnolens
Nyre- og urinveislidelser: akutt tubulointerstitiell nefritt
Hud- og subkutane vevslidelser: alvorlige dermatologiske reaksjoner (noen dødelig), inkludert erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse (TEN, noen dødelig), angioødem (Quinckes ødem) og kutan lupus erythematosus
NARKOTIKAHANDEL
Tabell 4 inkluderer legemidler med klinisk viktige legemiddelinteraksjoner og interaksjon med diagnostikk når de administreres samtidig med PROTONIX og instruksjoner for å forebygge eller håndtere dem.
Se merkingen av legemidler som brukes samtidig for å få mer informasjon om interaksjoner med PPI.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Tilstedeværelse av gastrisk malignitet
Hos voksne utelukker ikke symptomatisk respons på behandling med PROTONIX tilstedeværelse av gastrisk malignitet. Vurder ytterligere oppfølging og diagnostisk testing hos voksne pasienter som har en suboptimal respons eller et tidlig symptomatisk tilbakefall etter fullført behandling med PPI. Vurder også en endoskopi hos eldre pasienter.
Akutt Tubulointerstitiell nefritis
Akutt tubulointerstitiell nefritt (TIN) er observert hos pasienter som tar PPI og kan forekomme når som helst under PPI-behandling. Pasienter kan ha forskjellige tegn og symptomer fra symptomatiske overfølsomhetsreaksjoner til uspesifikke symptomer på nedsatt nyrefunksjon (f.eks. ubehag, kvalme, anoreksi). I rapporterte kasusserier ble noen pasienter diagnostisert på biopsi og i fravær av ekstrarenale manifestasjoner (f.eks. feber, utslett eller artralgi). Seponer PROTONIX 20 mg og evaluer pasienter med mistanke om akutt TIN [se KONTRAINDIKASJONER ].
Clostridium difficile-assosiert diaré
Publiserte observasjonsstudier tyder på at PPI-behandling som PROTONIX 20 mg kan være assosiert med økt risiko for Clostridium difficile assosiert diaré, spesielt hos pasienter som er innlagt på sykehus. Denne diagnosen bør vurderes for diaré som ikke forbedres [se BIVIRKNINGER ].
Pasienter bør bruke den laveste dosen og korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles.
Benbrudd
Flere publiserte observasjonsstudier tyder på at PPI-behandling kan være assosiert med økt risiko for osteoporose-relaterte frakturer i hofte, håndledd eller ryggrad. Risikoen for brudd var økt hos pasienter som fikk høye doser, definert som flere daglige doser, og langvarig PPI-behandling (ett år eller lenger). Pasienter bør bruke den laveste dosen og korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles. Pasienter med risiko for osteoporose-relaterte frakturer bør behandles i henhold til etablerte behandlingsretningslinjer [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER ].
Kutan og systemisk lupus erythematosus
Kutan lupus erythematosus (CLE) og systemisk lupus erythematosus (SLE) er rapportert hos pasienter som tar PPI, inkludert pantoprazolnatrium. Disse hendelsene har oppstått både som ny debut og en forverring av eksisterende autoimmun sykdom. Flertallet av PPI-induserte lupus erytematøse tilfeller var CLE.
Den vanligste formen for CLE rapportert hos pasienter behandlet med PPI var subakutt CLE (SCLE) og oppstod innen uker til år etter kontinuerlig medikamentell behandling hos pasienter fra spedbarn til eldre. Generelt ble histologiske funn observert uten organinvolvering.
Systemisk lupus erythematosus (SLE) er sjeldnere rapportert enn CLE hos pasienter som får PPI. PPI-assosiert SLE er vanligvis mildere enn ikke-medikamentindusert SLE. Utbruddet av SLE oppstod vanligvis innen dager til år etter behandlingsstart, hovedsakelig hos pasienter fra unge voksne til eldre. Flertallet av pasientene hadde utslett; artralgi og cytopeni ble imidlertid også rapportert.
Unngå administrasjon av PPI lenger enn medisinsk indisert. Hvis det observeres tegn eller symptomer som samsvarer med CLE eller SLE hos pasienter som får PROTONIX 40 mg, seponer legemidlet og henvis pasienten til riktig spesialist for evaluering. De fleste pasienter blir bedre ved seponering av PPI alene i løpet av 4 til 12 uker. Serologisk testing (f.eks. ANA) kan være positiv og forhøyede serologiske testresultater kan ta lengre tid å løse enn kliniske manifestasjoner.
Cyanokobalamin (vitamin B-12) mangel
Vanligvis kan daglig behandling med syredempende medisiner over lang tid (f.eks. lengre enn 3 år) føre til malabsorpsjon av cyanokobalamin (vitamin B-12) forårsaket av hypo- eller aklorhydri. Sjeldne rapporter om cyanokobalaminmangel som oppstår ved syredempende behandling er rapportert i litteraturen. Denne diagnosen bør vurderes hvis det observeres kliniske symptomer forenlig med cyanokobalaminmangel.
Hypomagnesemi
Hypomagnesemi, symptomatisk og asymptomatisk, er sjelden rapportert hos pasienter behandlet med PPI i minst tre måneder, og i de fleste tilfeller etter et års behandling. Alvorlige bivirkninger inkluderer tetany, arytmier og anfall. Hos de fleste pasienter krevde behandling av hypomagnesemi magnesiumerstatning og seponering av PPI.
For pasienter som forventes å være på langvarig behandling eller som tar PPI sammen med medisiner som digoksin eller legemidler som kan forårsake hypomagnesemi (f.eks. diuretika), kan helsepersonell vurdere å overvåke magnesiumnivåer før oppstart av PPI-behandling og med jevne mellomrom [se BIVIRKNINGER ].
Tumorogenisitet
På grunn av den kroniske karakteren av GERD, kan det være et potensial for forlenget administrering av PROTONIX. I langtidsstudier med gnager var pantoprazol kreftfremkallende og forårsaket sjeldne typer gastrointestinale svulster. Relevansen av disse funnene for tumorutvikling hos mennesker er ukjent [se Ikke-klinisk toksikologi ].
Fundic kjertelpolypper
PPI-bruk er assosiert med økt risiko for fundiske kjertelpolypper som øker ved langvarig bruk, spesielt utover ett år. De fleste PPI-brukere som utviklet fundiske kjertelpolypper var asymptomatiske og fundiske kjertelpolypper ble identifisert ved endoskopi. Bruk den korteste varigheten av PPI-behandlingen som passer til tilstanden som behandles.
Interferens med undersøkelser for nevroendokrine svulster
Serumkromogranin A (CgA) nivåer øker sekundært til medikamentinduserte reduksjoner i magesyre. Det økte CgA-nivået kan forårsake falske positive resultater i diagnostiske undersøkelser for nevroendokrine svulster. Helsepersonell bør midlertidig stoppe behandlingen med PROTONIX 20 mg minst 14 dager før de vurderer CgA-nivåer og vurdere å gjenta testen hvis initiale CgA-nivåer er høye. Hvis det utføres serielle tester (f.eks. for overvåking), bør det samme kommersielle laboratoriet brukes for testing, da referanseområder mellom tester kan variere [se KLINISK FARMAKOLOGI ].
Interferens med urinskjerm for THC
Det har vært rapporter om falske positive urinscreeningstester for tetrahydrocannabinol (THC) hos pasienter som får PPI, inkludert PROTONIX [se NARKOTIKAHANDEL ].
Samtidig bruk av PROTONIX med metotreksat
Litteratur tyder på at samtidig bruk av PPI med metotreksat (primært i høye doser; se forskrivningsinformasjon om metotreksat) kan øke og forlenge serumnivået av metotreksat og/eller dets metabolitt, noe som muligens kan føre til metotreksat toksisitet. Ved administrering av høydose metotreksat kan en midlertidig seponering av PPI vurderes hos noen pasienter [se NARKOTIKAHANDEL ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning og bruksanvisning ).
Mage malignitet
Råd pasientene til å gå tilbake til helsepersonell dersom de har en suboptimal respons eller et tidlig symptomatisk tilbakefall [se ADVARSLER OG FORHOLDSREGLER ].
Akutt Tubulointerstitiell nefritis
Råd pasienter til å ringe helsepersonell umiddelbart hvis de opplever tegn og/eller symptomer assosiert med akutt tubulointerstitiell nefritt [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER ].
Clostridium Difficile-assosiert diaré
Råd pasienter til umiddelbart å ringe helsepersonell dersom de opplever diaré som ikke blir bedre [se ADVARSLER OG FORHOLDSREGLER ].
Benbrudd
Råd pasientene til å rapportere eventuelle brudd, spesielt i hoften, håndleddet eller ryggraden, til helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Kutan og systemisk lupus erythematosus
Råd pasienter til umiddelbart å ringe helsepersonell for nye eller forverrede symptomer assosiert med kutan eller systemisk lupus erythematosus [se ADVARSLER OG FORHOLDSREGLER ].
Cyanokobalamin (vitamin B-12) mangel
Råd pasientene til å rapportere alle kliniske symptomer som kan være assosiert med cyankobalaminmangel til helsepersonell dersom de har fått PROTONIX 40 mg i mer enn 3 år [se ADVARSLER OG FORHOLDSREGLER ].
Hypomagnesemi
Råd pasientene til å rapportere alle kliniske symptomer som kan være assosiert med hypomagnesemi til helsepersonell dersom de har fått PROTONIX 40 mg i minst 3 måneder [se ADVARSLER OG FORHOLDSREGLER ].
Narkotikahandel
Instruer pasienter om å informere helsepersonell om eventuelle andre medisiner de tar, inkludert produkter som inneholder rilpivirin [se KONTRAINDIKASJONER ] digoksin [se ADVARSLER OG FORHOLDSREGLER ] og høydose metotreksat [se ADVARSLER OG FORHOLDSREGLER ].
Svangerskap
Informer en gravid kvinne om den potensielle risikoen for et foster. Gi kvinner med reproduksjonspotensial råd om å informere helsepersonell om kjent eller mistenkt graviditet [se Bruk i spesifikke populasjoner ].
Administrasjon
- . Ikke del, knus eller tygg PROTONIX for oral suspensjon med forsinket frigjøring og PROTONIX 20 mg tabletter med forsinket frigjøring. . PROTONIX mikstur, suspensjonspakke er en fast dose og kan ikke deles for å lage en mindre dose. . Svelg PROTONIX 20 mg tabletter med forsinket frigjøring hele, med eller uten mat i magen. . Samtidig administrering av antacida påvirker ikke absorpsjonen av PROTONIX tabletter med forsinket frigjøring. . Ta PROTONIX 20 mg for oral suspensjon med forsinket frigivelse ca. 30 minutter før et måltid. . Administrer PROTONIX for oral suspensjon med forsinket frigjøring i eplejuice eller eplemos, som beskrevet i bruksanvisningen. Ikke administrer i vann, andre væsker eller matvarer. . For pasienter med nasogastrisk (NG) eller gastrostomisonde kan PROTONIX For Delayed-Release Oral Suspension administreres med eplejuice, som beskrevet i bruksanvisningen. . Ta en glemt dose så snart som mulig. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og ta neste dose til vanlig planlagt tid. Ikke ta 2 doser samtidig.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
en 24-måneders karsinogenitetsstudie ble Sprague-Dawley-rotter behandlet oralt med pantoprazoldoser på 0,5 til 200 mg/kg/dag, omtrent 0,1 til 40 ganger eksponeringen på kroppsoverflatebasis for en person på 50 kg dosert med 40 mg /dag. I gastrisk fundus ga behandling med 0,5 til 200 mg/kg/dag enterokromaffin-lignende (ECL) cellehyperplasi og benigne og ondartede nevroendokrine celletumorer på en doserelatert måte. I formagen ga behandling med 50 og 200 mg/kg/dag (ca. 10 og 40 ganger den anbefalte humane dosen på basis av kroppsoverflate) godartede plateepitelpapillomer og ondartede plateepitelkarsinomer. Sjeldne gastrointestinale svulster assosiert med pantoprazolbehandling inkluderte et adenokarsinom i tolvfingertarmen med 50 mg/kg/dag og benigne polypper og adenokarsinomer i magefundus med 200 mg/kg/dag. I leveren ga behandling med 0,5 til 200 mg/kg/dag doserelaterte økninger i forekomsten av hepatocellulære adenomer og karsinomer. I skjoldbruskkjertelen ga behandling med 200 mg/kg/dag økt forekomst av follikulære celleadenomer og karsinomer for både hann- og hunnrotter.
en 24-måneders karsinogenitetsstudie ble Fischer 344-rotter behandlet oralt med doser på 5 til 50 mg/kg/dag av pantoprazol, omtrent 1 til 10 ganger den anbefalte dosen til mennesker basert på kroppsoverflate. I gastrisk fundus ga behandling med 5 til 50 mg/kg/dag enterokromaffin-lignende (ECL) cellehyperplasi og godartede og ondartede nevroendokrine celletumorer. Dosevalg for denne studien har kanskje ikke vært tilstrekkelig til å evaluere det karsinogene potensialet til pantoprazol.
I en 24-måneders karsinogenitetsstudie ble B6C3F1-mus behandlet oralt med doser på 5 til 150 mg/kg/dag av pantoprazol, 0,5 til 15 ganger anbefalt human dose basert på kroppsoverflateareal. I leveren ga behandling med 150 mg/kg/dag økt forekomst av hepatocellulære adenomer og karsinomer hos hunnmus. Behandling med 5 til 150 mg/kg/dag ga også gastrisk-fundisk ECL-cellehyperplasi.
En 26-ukers p53 +/-transgen mus karsinogenitetsstudie var ikke positiv.
Pantoprazol var positiv i in vitro humane lymfocyttkromosomavviksanalyser, i en av to mus mikronukleus tester for klastogene effekter, og i in vitro kinesisk hamster ovariecelle/HGPRT forovermutasjonsanalyse for mutagene effekter. Tvetydige resultater ble observert i in vivo rottelever DNA kovalent bindingsanalyse. Pantoprazol var negativ i in vitro Ames mutasjonsanalysen, in vitro unscheduled DNA-syntese (UDS)-analysen med rottehepatocytter, in vitro AS52/GPT pattedyrcelle-forward-genmutasjonsanalysen, in vitro tymidinkinase-mutasjonstesten med muselymfom L5178Y celler, og in vivo rottebenmargscelle-kromosomavviksanalysen.
Det var ingen effekter på fertilitet eller reproduksjonsevne når pantoprazol ble gitt i orale doser opptil 500 mg/kg/dag hos hannrotter (98 ganger anbefalt human dose basert på kroppsoverflate) og 450 mg/kg/dag hos hunnrotter. (88 ganger anbefalt human dose basert på kroppsoverflate).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Tilgjengelige data fra publiserte observasjonsstudier viste ikke en sammenheng mellom alvorlige misdannelser eller andre uønskede graviditetsutfall med pantoprazol.
I reproduksjonsstudier på dyr ble det ikke sett noen tegn på uønskede utviklingsresultater med pantoprazol. Reproduksjonsstudier er utført på rotter ved orale doser opptil 450 mg/kg/dag (ca. 88 ganger anbefalt human dose) og kaniner ved orale doser opptil 40 mg/kg/dag (ca. 16 ganger anbefalt human dose) med administrering av pantoprazol under organogenese hos drektige dyr og har ikke avdekket bevis for skade på fosteret på grunn av pantoprazol i denne studien (se Data ).
En pre- og postnatal utviklingstoksisitetsstudie på rotter med ytterligere endepunkter for å evaluere effekten på beinutvikling ble utført med pantoprazolnatrium. Orale pantoprazoldoser på 5, 15 og 30 mg/kg/dag (omtrent 1, 3 og 6 ganger den humane dosen på 40 mg/dag) ble administrert til gravide kvinner fra svangerskapsdag (GD) 6 til ammingsdag (LD). ) 21. Endringer i benmorfologi ble observert hos unger eksponert for pantoprazol in utero og gjennom melk i løpet av dieperioden, samt ved oral dosering fra postnatal dag (PND) 4 til PND 21 [se Bruk i spesifikke populasjoner ]. Det var ingen narkotikarelaterte funn hos mors dyr. Informer gravide kvinner om den potensielle risikoen for fosterskader.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i de klinisk anerkjente svangerskapene henholdsvis 2 til 4 % og 15 til 20 %.
Data
Menneskelige data
Tilgjengelige data fra publiserte observasjonsstudier klarte ikke å vise en sammenheng mellom uønskede graviditetsrelaterte utfall og bruk av pantoprazol. Metodiske begrensninger av disse observasjonsstudiene kan ikke definitivt fastslå eller utelukke noen medikamentrelatert risiko under graviditet. I en prospektiv studie av European Network of Teratology Information Services ble resultater fra en gruppe på 53 gravide kvinner administrert median daglige doser på 40 mg pantoprazol sammenlignet med en kontrollgruppe på 868 gravide kvinner som ikke tok noen protonpumpehemmere (PPI) . Det var ingen forskjell i frekvensen av store misdannelser mellom kvinner eksponert for PPI og kontrollgruppen, tilsvarende en relativ risiko (RR)=0,55, [95 % konfidensintervall (KI) 0,08-3,95]. I en populasjonsbasert retrospektiv kohortstudie som dekker alle levendefødte i Danmark fra 1996 til 2008, var det ingen signifikant økning i store fødselsskader under analyse av første trimestereksponering for pantoprazol hos 549 levendefødte. En metaanalyse som sammenlignet 1 530 gravide kvinner eksponert for PPI i minst første trimester med 133 410 ueksponerte gravide kvinner, viste ingen signifikant økning i risiko for medfødte misdannelser eller spontan abort med eksponering for PPI (for store misdannelser OR=1,12 ([95 %) KI 0,86-1,45] og for spontanaborter OR=1,29 [95 % KI 0,84-1,97]).
Dyredata
Reproduksjonsstudier er utført på rotter ved orale pantoprazoldoser på opptil 450 mg/kg/dag (ca. 88 ganger anbefalt dose basert på kroppsoverflate) og på kaniner ved orale doser opptil 40 mg/kg/dag (ca. ganger anbefalt human dose basert på kroppsoverflate) med administrering av pantoprazolnatrium under organogenese hos drektige dyr. Studiene har ikke avdekket bevis for nedsatt fertilitet eller skade på fosteret på grunn av pantoprazol.
En pre- og postnatal utviklingstoksisitetsstudie på rotter med ytterligere endepunkter for å evaluere effekten på beinutvikling ble utført med pantoprazolnatrium. Orale pantoprazoldoser på 5, 15 og 30 mg/kg/dag (omtrent 1, 3 og 6 ganger den humane dosen på 40 mg/dag på kroppsoverflatebasis) ble administrert til gravide kvinner fra svangerskapsdagen (GD) 6 til og med laktasjonsdag (LD) 21. På postnatal dag (PND 4) til og med PND 21 ble ungene administrert orale doser på 5, 15 og 30 mg/kg/dag (omtrent 1, 2,3 og 3,2 ganger eksponeringen (ca. AUC) hos mennesker i en dose på 40 mg). Det var ingen narkotikarelaterte funn hos mors dyr. Under doseringsfasen før avvenning (PND 4 til 21) av valpene, var det økt dødelighet og/eller moribunditet og redusert kroppsvekt og kroppsvektøkning ved 5 mg/kg/dag (omtrent lik eksponering (AUC) hos mennesker som fikk de 40 mg dose) og høyere doser. På PND 21 ble redusert gjennomsnittlig femurlengde og vekt og endringer i femurbenmasse og geometri observert hos avkommet ved 5 mg/kg/dag (omtrent lik eksponering (AUC) hos mennesker ved 40 mg dose) og høyere doser. Femurfunnene inkluderte lavere totalareal, benmineralinnhold og -densitet, periosteal og endosteal omkrets, og tverrsnitts treghetsmoment. Det var ingen mikroskopiske endringer i distale femur, proksimale tibia eller kveledd. Endringer i benparametere var delvis reversible etter en restitusjonsperiode, med funn på PND 70 begrenset til lavere femurmetafyse kortikal/subkortikal beinmineraltetthet hos hunnunger ved 5 mg/kg/dag (omtrent lik eksponering (AUC) hos mennesker ved 40 mg dose) og høyere doser.
Amming
Risikosammendrag
Pantoprazol er påvist i morsmelk hos en ammende mor etter en enkelt oral dose på 40 mg pantoprazol. Det var ingen effekter på det ammede spedbarnet (se Data ). Det er ingen data om pantoprazols effekter på melkeproduksjonen.

De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for PROTONIX 40mg og eventuelle potensielle bivirkninger på det ammede barnet fra pantoprazol eller fra den underliggende morstilstanden.
Data
Morsmelk til en 42 år gammel kvinne som fikk 40 mg oral pantoprazol, 10 måneder etter fødselen, ble studert i 24 timer for å vise lave nivåer av pantoprazol i morsmelk. Pantoprazol var påviselig i melk kun 2 og 4 timer etter dosen med melkenivåer på henholdsvis ca. 36 mcg/l og 24 mcg/l. Et melk-til-plasma-forhold på 0,022 ble observert 2 timer etter medikamentadministrering. Pantoprazol var ikke påviselig (
Pediatrisk bruk
Sikkerheten og effektiviteten til PROTONIX for korttidsbehandling (opptil åtte uker) av EE assosiert med GERD er fastslått hos pediatriske pasienter i alderen 1 år til 16 år. Effektivitet for EE er ikke vist hos pasienter under 1 år. I tillegg, for pasienter under 5 år, er det ingen passende doseringsstyrke i en alderstilpasset formulering tilgjengelig. Derfor er PROTONIX indisert for korttidsbehandling av EE assosiert med GERD for pasienter 5 år og eldre. Sikkerheten og effektiviteten til PROTONIX for andre barn enn EE er ikke fastslått.
1 år til 16 år
Bruk av PROTONIX hos pediatriske pasienter i alderen 1 år til 16 år for korttidsbehandling (opptil åtte uker) av EE assosiert med GERD støttes av: a) ekstrapolering av resultater fra tilstrekkelige og godt kontrollerte studier som støttet godkjenning av PROTONIX for behandling av EE assosiert med GERD hos voksne, og b) sikkerhet, effektivitet og farmakokinetiske studier utført hos pediatriske pasienter [se Kliniske studier , KLINISK FARMAKOLOGI ].
Sikkerheten til PROTONIX 40 mg i behandling av EE assosiert med GERD hos pediatriske pasienter i alderen 1 til 16 år ble evaluert i tre multisenter, randomiserte, dobbeltblinde, parallelle behandlingsstudier, som involverte 249 pediatriske pasienter, inkludert 8 med EE (4 pasienter) i alderen 1 år til 5 år og 4 pasienter 5 år til 11 år). Barna i alderen 1 år til 5 år med endoskopisk diagnostisert EE (definert som en endoskopisk Hetzel-Dent-score ≥2) ble behandlet en gang daglig i 8 uker med ett av to dosenivåer av PROTONIX (omtrent 0,6 mg/kg eller 1,2 mg/kg). ). Alle 4 av disse pasientene med EE ble helbredet (Hetzel-Dent-score på 0 eller 1) etter 8 uker. Fordi EE er uvanlig i den pediatriske populasjonen, ble overveiende pediatriske pasienter med endoskopisk påvist eller symptomatisk GERD også inkludert i disse studiene. Pasientene ble behandlet med en rekke doser av PROTONIX 20 mg én gang daglig i 8 uker. For sikkerhetsfunn se BIVIRKNINGER Fordi disse pediatriske studiene ikke hadde placebo, aktiv komparator eller bevis på en doserespons, var studiene usikre på den kliniske fordelen av PROTONIX 20 mg for symptomatisk GERD i den pediatriske populasjonen. Effektiviteten av PROTONIX 40 mg for behandling av symptomatisk GERD hos pediatriske pasienter er ikke fastslått.
Selv om data fra de kliniske studiene støtter bruk av PROTONIX for korttidsbehandling av EE assosiert med GERD hos pediatriske pasienter 1 år til 5 år, er det ingen kommersielt tilgjengelig doseringsformulering egnet for pasienter under 5 år [se DOSERING OG ADMINISTRASJON ].
en farmakokinetisk populasjonsanalyse hadde clearanceverdier hos barn 1 til 5 år med endoskopisk påvist GERD en medianverdi på 2,4 l/t. Etter en ekvivalent dose på 1,2 mg/kg (15 mg for ≤12,5 kg og 20 mg for >12,5 til
Nyfødte til mindre enn ett år
PROTONIX 20 mg ble ikke funnet å være effektivt i en multisenter, randomisert, dobbeltblind, placebokontrollert, behandlingsavbruddsstudie av 129 pediatriske pasienter i alderen 1 til 11 måneder. Pasienter ble registrert hvis de hadde symptomatisk GERD basert på medisinsk historie og ikke hadde respondert på ikke-farmakologiske intervensjoner for GERD på to uker. Pasientene fikk PROTONIX daglig i fire uker i en åpen fase, deretter ble pasientene randomisert i lik andel for å motta PROTONIX 40 mg behandling eller placebo i de påfølgende fire ukene på en dobbeltblind måte. Effekten ble vurdert ved å observere tiden fra randomisering til studieseponering på grunn av symptomforverring i løpet av den fire uker lange behandlingen-seponeringsfasen. Det var ingen statistisk signifikant forskjell mellom PROTONIX 20 mg og placebo i seponeringshastigheten.
denne studien var bivirkningene som ble rapportert mer vanlig (forskjell på ≥4%) i den behandlede populasjonen sammenlignet med placebopopulasjonen forhøyet CK, mellomørebetennelse, rhinitt og laryngitt.
I en populasjonsfarmakokinetisk analyse var den systemiske eksponeringen høyere hos pasienter under 1 år med GERD sammenlignet med voksne som fikk en enkeltdose på 40 mg (geometrisk gjennomsnittlig AUC var 103 % høyere hos premature spedbarn og nyfødte som fikk enkeltdose på 2,5 mg av PROTONIX, og 23 % høyere hos spedbarn i alderen 1 til 11 måneder som får en enkeltdose på omtrent 1,2 mg/kg). Hos disse pasientene økte den tilsynelatende clearance (CL/F) med alderen (median clearance: 0,6 l/time, område: 0,03 til 3,2 l/time).
Disse dosene resulterte i farmakodynamiske effekter på mage, men ikke esophageal pH. Etter en gang daglig dosering av 2,5 mg PROTONIX 20 mg til premature spedbarn og nyfødte, var det en økning i gjennomsnittlig mage-pH (fra 4,3 ved baseline til 5,2 ved steady-state) og i gjennomsnittlig %-tid for mage-pH var > 4 ( fra 60 % ved baseline til 80 % ved steady-state). Etter dosering én gang daglig på ca. 1,2 mg/kg PROTONIX 20 mg hos spedbarn i alderen 1 til 11 måneder, var det en økning i gjennomsnittlig mage-pH (fra 3,1 ved baseline til 4,2 ved steady-state) og i gjennomsnittlig % tid som mage-pH var > 4 (fra 32 % ved baseline til 60 % ved steady-state). Det ble imidlertid ikke observert noen signifikante endringer i gjennomsnittlig intraøsofageal pH eller % tid som esophageal pH var
Fordi PROTONIX 20 mg ikke ble vist å være effektivt i den randomiserte, placebokontrollerte studien i denne aldersgruppen, er ikke bruk av PROTONIX til behandling av symptomatisk GERD hos spedbarn under 1 år indisert.
Toksisitetsdata for dyr
I en pre- og postnatal utviklingsstudie på rotter ble ungene administrert orale doser av pantoprazol på 5, 15 og 30 mg/kg/dag (omtrent 1, 2,3 og 3,2 ganger eksponeringen (AUC) hos barn i alderen 6 til 11 år ved en dose på 40 mg) på postnatal dag (PND 4) til og med PND 21, i tillegg til ammingseksponering gjennom melk. På PND 21 ble redusert gjennomsnittlig lårbenslengde og vekt og endringer i lårbenets benmasse og geometri observert hos avkommet ved 5 mg/kg/dag (omtrent lik eksponering (AUC) hos barn i alderen 6 til 11 år ved 40 mg dose) og høyere doser. Endringer i benparametere var delvis reversible etter en restitusjonsperiode.
Hos nyfødte/juvenile dyr (rotter og hunder) var toksisiteten lik den som ble observert hos voksne dyr, inkludert gastriske endringer, reduksjon i røde blodlegemer, økning i lipider, enzyminduksjon og hepatocellulær hypertrofi. En økt forekomst av eosinofile hovedceller hos voksne og neonatale/ungdomsrotter, og atrofi av hovedceller hos voksne rotter og hos nyfødte/juvenile hunder, ble observert i mageslimhinnen i mageslimhinnen i studier med gjentatte doser. Full til delvis gjenoppretting av disse effektene ble observert hos dyr i begge aldersgrupper etter en restitusjonsperiode.
Geriatrisk bruk
I kortsiktige amerikanske kliniske studier var EE-helbredelsen hos de 107 eldre pasientene (≥65 år) behandlet med PROTONIX lik de som ble funnet hos pasienter under 65 år. Forekomsten av bivirkninger og laboratorieavvik hos pasienter i alderen 65 år og eldre var lik de assosiert med pasienter yngre enn 65 år.
OVERDOSE
Erfaring fra pasienter som tar svært høye doser PROTONIX (større enn 240 mg) er begrenset. Spontane rapporter om overdosering etter markedsføring er generelt innenfor den kjente sikkerhetsprofilen til PROTONIX.
Pantoprazol fjernes ikke ved hemodialyse. Ved overdosering bør behandlingen være symptomatisk og støttende.
Enkeltdoser av pantoprazol på 709 mg/kg, 798 mg/kg og 887 mg/kg var dødelige for henholdsvis mus, rotter og hunder. Symptomene på akutt toksisitet var hypoaktivitet, ataksi, bøyd sitting, lemmerspredning, sidestilling, segregering, fravær av ørerefleks og skjelving.
Hvis det oppstår overeksponering for PROTONIX 20 mg, ring ditt giftkontrollsenter på 1-800-222-1222 for oppdatert informasjon om håndtering av forgiftning eller overdosering.
KONTRAINDIKASJONER
- . PROTONIX er kontraindisert hos pasienter med kjent overfølsomhet overfor noen komponent i formuleringen eller substituert benzimidazol. Overfølsomhetsreaksjoner kan omfatte anafylaksi, anafylaktisk sjokk, angioødem, bronkospasme, akutt tubulointerstitiell nefritt og urticaria [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER ]. . Protonpumpehemmere (PPI), inkludert PROTONIX, er kontraindisert hos pasienter som får produkter som inneholder rilpivirin [se NARKOTIKAHANDEL ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Pantoprazol er en PPI som undertrykker det siste trinnet i magesyreproduksjonen ved kovalent binding til (H+, K+)-ATPase-enzymsystemet ved den sekretoriske overflaten av mageparietalcellen. Denne effekten fører til hemming av både basal og stimulert magesyresekresjon, uavhengig av stimulus. Bindingen til (H+, K+)-ATPasen resulterer i en varighet av antisekretorisk effekt som varer lenger enn 24 timer for alle testede doser (20 mg til 120 mg).
Farmakodynamikk
PROTONIX 20 mg for oral suspensjon med forsinket frigjøring, 40 mg har vist seg å være sammenlignbar med PROTONIX tabletter med forsinket frigjøring ved å undertrykke pentagastrinstimulert MAO hos pasienter (n = 49) med GERD og en historie med EE. I denne multisenter, farmakodynamiske crossover-studien ble en 40 mg oral dose av PROTONIX for forsinket oral suspensjon administrert i en teskje eplemos sammenlignet med en 40 mg oral dose av PROTONIX tabletter med forsinket frigjøring etter administrering av hver formulering én gang daglig i 7 dager. Begge medisinene ble administrert tretti minutter før frokost. Pentagastrin-stimulert (MAO) ble vurdert fra time 23 til 24 ved steady state.
Antisekretorisk aktivitet
Under maksimale syrestimulerende forhold ved bruk av pentagastrin, oppstår en doseavhengig reduksjon i magesyreproduksjonen etter en enkelt dose oral (20-80 mg) eller en enkelt dose intravenøs (20-120 mg) pantoprazol hos friske personer. Pantoprazol gitt én gang daglig resulterer i økende hemming av magesyresekresjonen. Etter den orale initialdosen på 40 mg pantoprazol, ble en gjennomsnittlig hemming på 51 % oppnådd etter 2,5 timer. Ved dosering én gang daglig i 7 dager ble gjennomsnittlig hemming økt til 85 %. Pantoprazol undertrykte syresekresjon i overkant av 95 % hos halvparten av forsøkspersonene. Syresekresjonen hadde normalisert seg innen en uke etter siste dose pantoprazol; det var ingen tegn på rebound-hypersekresjon.
en serie dose-respons-studier forårsaket pantoprazol, ved orale doser fra 20 til 120 mg, doserelaterte økninger i median basal gastrisk pH og i prosent av tiden gastrisk pH var >3 og >4. Behandling med 40 mg pantoprazol ga signifikant større økninger i mage-pH enn dosen på 20 mg. Doser høyere enn 40 mg (60, 80, 120 mg) resulterte ikke i ytterligere signifikant økning i median gastrisk pH. Effektene av pantoprazol på median pH fra en dobbeltblind crossover-studie er vist i tabell 5.
Serum Gastrin Effekter
Fastende gastrinnivåer i serum ble vurdert i to dobbeltblinde studier av akutt helbredelse av EE der 682 pasienter med gastroøsofageal reflukssykdom (GERD) fikk 10, 20 eller 40 mg PROTONIX 20 mg i opptil 8 uker. Ved 4 ukers behandling var det en økning i gjennomsnittlige gastrinnivåer på 7 %, 35 % og 72 % over forbehandlingsverdiene i henholdsvis 10, 20 og 40 mg behandlingsgruppene. En lignende økning i serumgastrinnivåer ble notert ved det 8-ukers besøket med gjennomsnittlige økninger på 3 %, 26 % og 84 % for de tre pantoprazoldosegruppene. Median serumgastrinnivå holdt seg innenfor normale grenser under vedlikeholdsbehandling med PROTONIX tabletter med forsinket frigjøring.
internasjonale langtidsstudier som involverte over 800 pasienter, ble det observert en 2- til 3 ganger gjennomsnittlig økning fra gastrinnivået i fastende serum før behandling i de første månedene av behandling med pantoprazol i doser på 40 mg per dag under GERD-vedlikeholdsstudier og 40 mg eller høyere per dag hos pasienter med refraktær GERD. Fastende gastrinnivåer i serum holdt seg vanligvis på omtrent 2 til 3 ganger baseline i opptil 4 år med periodisk oppfølging i kliniske studier.
Etter korttidsbehandling med PROTONIX 20 mg vil forhøyede gastrinnivåer normaliseres etter minst 3 måneder.
Enterokromaffinlignende (ECL) celleeffekter
Hos 39 pasienter behandlet med oral pantoprazol 40 mg til 240 mg daglig (majoriteten fikk 40 mg til 80 mg) i opptil 5 år, var det en moderat økning i ECL-celletettheten, som startet etter det første året med bruk, som så ut til å platå etter 4 år.
en ikke-klinisk studie på Sprague-Dawley-rotter resulterte livstidseksponering (24 måneder) for pantoprazol ved doser på 0,5 til 200 mg/kg/dag i doserelaterte økninger i gastrisk ECL-celleproliferasjon og gastriske nevroendokrine (NE)-celletumorer . Gastriske NE-celletumorer hos rotter kan skyldes kronisk forhøyelse av serumgastrinkonsentrasjoner. Den høye tettheten av ECL-celler i rottemagen gjør denne arten svært mottakelig for de proliferative effektene av forhøyede gastrinkonsentrasjoner produsert av PPI. Det ble imidlertid ikke observert økninger i serumgastrin etter administrering av pantoprazol i en dose på 0,5 mg/kg/dag. I en separat studie ble en gastrisk NE-celletumor uten samtidige ECL-celle-proliferative endringer observert hos 1 hunnrotte etter 12 måneders dosering med pantoprazol med 5 mg/kg/dag og 9 måneders restitusjon uten dose [se Ikke-klinisk toksikologi ].
Endokrine effekter
en klinisk farmakologisk studie hadde PROTONIX 40 mg gitt én gang daglig i 2 uker ingen effekt på nivåene av følgende hormoner: kortisol, testosteron, trijodtyronin (T3), tyroksin (T4), tyreoideastimulerende hormon (TSH), tyronin- bindende protein, parathyreoideahormon, insulin, glukagon, renin, aldosteron, follikkelstimulerende hormon, luteiniserende hormon, prolaktin og veksthormon.
I en 1-årig studie av GERD-pasienter behandlet med PROTONIX 40 mg eller 20 mg, var det ingen endringer fra baseline i de totale nivåene av T3, T4 og TSH.
Farmakokinetikk
PROTONIX 40 mg tabletter med forsinket frigjøring tilberedes som enterisk drasjerte tabletter slik at absorpsjonen av pantoprazol begynner først etter at tabletten forlater magen. Maksimal serumkonsentrasjon (Cmax) og arealet under serumkonsentrasjonstidskurven (AUC) øker proporsjonalt med orale og intravenøse doser fra 10 mg til 80 mg. Pantoprazol akkumuleres ikke, og dets farmakokinetikk er uendret ved flere daglige doser. Etter oral eller intravenøs administrering synker serumkonsentrasjonen av pantoprazol bieksponentielt, med en terminal halveringstid på ca. en time.
Hos omfattende metabolisatorer med normal leverfunksjon som får en oral dose av den enterisk belagte 40 mg pantoprazoltabletten, er den maksimale konsentrasjonen (Cmax) 2,5 μg/ml; tiden for å nå toppkonsentrasjonen (tmax) er 2,5 timer, og gjennomsnittlig totalareal under kurven for plasmakonsentrasjon versus tid (AUC) er 4,8 μg•t/mL (område 1,4 til 13,3 μg•t/mL). Etter intravenøs administrering av pantoprazol til omfattende metabolisatorer, er dets totale clearance 7,6-14,0 l/time, og dets tilsynelatende distribusjonsvolum er 11,0-23,6 l.
En enkelt oral dose av PROTONIX For Delayed-Release Oral Suspension, 40 mg, ble vist å være bioekvivalent når administrert til friske forsøkspersoner (N = 22) som granulat drysset over en teskje eplemos, som granulat blandet med eplejuice, eller blandet med eplejuice etterfulgt av administrering gjennom en nasogastrisk sonde. De farmakokinetiske plasmaparametrene fra en crossover-studie hos friske personer er oppsummert i tabell 6.
Absorpsjon
Etter administrering av en enkelt eller flere orale 40 mg doser av PROTONIX 20 mg tabletter med forsinket frigivelse, ble maksimal plasmakonsentrasjon av pantoprazol oppnådd i løpet av ca. 2,5 timer, og Cmax var 2,5 μg/ml. Pantoprazol gjennomgår lite first-pass metabolisme, noe som resulterer i en absolutt biotilgjengelighet på ca. 77 %. Pantoprazolabsorpsjon påvirkes ikke ved samtidig administrering av antacida.
Administrering av PROTONIX tabletter med forsinket frigjøring sammen med mat kan forsinke absorpsjonen i opptil 2 timer eller lenger; Cmax og omfanget av pantoprazolabsorpsjon (AUC) endres imidlertid ikke. Derfor kan PROTONIX 40 mg tabletter med forsinket frigjøring tas uten hensyn til tidspunkt for måltider.
Administrering av pantoprazolgranulat, 40 mg, sammen med et fettrikt måltid forsinket mediantiden til maksimal plasmakonsentrasjon med 2 timer. Med et samtidig fettrikt måltid reduserte Cmax og AUC for pantoprazolgranulat, 40 mg, drysset på eplemos med henholdsvis 51 % og 29 %. Derfor bør PROTONIX 20 mg oral suspensjon med forsinket frigivelse tas ca. 30 minutter før et måltid.
Fordeling
Det tilsynelatende distribusjonsvolumet av pantoprazol er omtrent 11 til 23,6 L, fordelt hovedsakelig i ekstracellulær væske. Serumproteinbindingen til pantoprazol er omtrent 98 %, primært til albumin.
Eliminering
Metabolisme
Pantoprazol metaboliseres i stor grad i leveren gjennom cytokrom P450 (CYP) systemet. Pantoprazolmetabolisme er uavhengig av administrasjonsmåten (intravenøs eller oral). Den viktigste metabolske veien er demetylering, ved CYP2C19, med påfølgende sulfatering; andre metabolske veier inkluderer oksidasjon av CYP3A4. Det er ingen bevis for at noen av pantoprazolmetabolittene har signifikant farmakologisk aktivitet.
Utskillelse
Etter en enkelt oral eller intravenøs dose av 14C-merket pantoprazol til friske personer med normal metabolisering, ble omtrent 71 % av dosen utskilt i urinen, med 18 % utskilt i feces gjennom galleutskillelse. Det var ingen nyreutskillelse av uendret pantoprazol.
Spesifikke populasjoner
Geriatriske pasienter
Bare små til moderate økninger i AUC (43 %) og Cmax (26 %) for pantoprazol ble funnet hos eldre personer (64 til 76 år) etter gjentatt oral administrering, sammenlignet med yngre personer [se Bruk i spesifikke populasjoner ].
Pediatriske pasienter
Farmakokinetikken til pantoprazol ble studert hos barn under 16 år i fire randomiserte, åpne kliniske studier hos pediatriske pasienter med antatt/påvist GERD. En pediatrisk granulatformulering ble studert hos barn til og med 5 år, og PROTONIX 40 mg tabletter med forsinket frigivelse ble studert hos barn eldre enn 5 år.
I en populasjons-PK-analyse økte total clearance med økende kroppsvekt på en ikke-lineær måte. Den totale clearance økte også med økende alder kun hos barn under 3 år.
Nyfødt gjennom 5 år
[se Bruk i spesifikke populasjoner ]
Barn og ungdom i alderen 6 til 16 år
Farmakokinetikken til PROTONIX tabletter med forsinket frigivelse ble evaluert hos barn i alderen 6 til 16 år med en klinisk diagnose av GERD. PK-parametrene etter en enkelt oral dose på 20 mg eller 40 mg PROTONIX 40 mg tabletter hos barn i alderen 6 til 16 år var svært varierende (%CV varierer 40 til 80%). Den geometriske gjennomsnittlige AUC estimert fra populasjons-PK-analyse etter en 40 mg PROTONIX 40 mg tablett hos pediatriske pasienter var henholdsvis omtrent 39 % og 10 % høyere hos 6 til 11 og 12 til 16 år gamle barn, sammenlignet med voksne (tabell 7). .
Mannlige og kvinnelige pasienter
Det er en beskjeden økning i AUC og Cmax for pantoprazol hos kvinner sammenlignet med menn. Vektnormaliserte clearance-verdier er imidlertid like hos kvinner og menn.
Hos pediatriske pasienter i alderen 1 til 16 år var det ingen klinisk relevante effekter av kjønn på clearance av pantoprazol, som vist ved populasjonsfarmakokinetisk analyse.
Pasienter med nedsatt nyrefunksjon
Hos pasienter med alvorlig nedsatt nyrefunksjon var farmakokinetiske parametere for pantoprazol lik de for friske personer.
Pasienter med nedsatt leverfunksjon
Hos pasienter med mild til alvorlig nedsatt leverfunksjon (Child-Pugh A til C cirrhose), økte maksimale pantoprazolkonsentrasjoner bare litt (1,5 ganger) i forhold til friske personer. Selv om serumhalveringstiden økte til 7-9 timer og AUC-verdiene økte med 5 til 7 ganger hos pasienter med nedsatt leverfunksjon, var disse økningene ikke større enn de som ble observert hos CYP2C19-fattige metabolisatorer, der ingen dosejustering er berettiget. Disse farmakokinetiske endringene hos pasienter med nedsatt leverfunksjon resulterer i minimal legemiddelakkumulering etter administrering én gang daglig, flere doser. Doser høyere enn 40 mg/dag er ikke studert hos pasienter med nedsatt leverfunksjon.
Legemiddelinteraksjonsstudier
Effekten av andre stoffer på pantoprazol
Pantoprazol metaboliseres hovedsakelig av CYP2C19 og i mindre grad av CYP 3A4, 2D6 og 2C9. I in vivo legemiddelinteraksjonsstudier med CYP2C19-substrater (diazepam [også et CYP3A4-substrat] og fenytoin [også en CYP3A4-induktor] og klopidogrel), nifedipin, midazolam og klaritromycin (CYP3A4-substrater), substrat-CYP2D6a-substrat, metoproldicen (lofacen) , naproksen og piroksikam (CYP2C9-substrater) og teofyllin (et CYP1A2-substrat) hos friske forsøkspersoner, ble farmakokinetikken til pantoprazol ikke signifikant endret.
Effekt av pantoprazol på andre legemidler
Klopidogrel
Klopidogrel metaboliseres til sin aktive metabolitt delvis av CYP2C19. I en klinisk crossover-studie ble 66 friske forsøkspersoner administrert klopidogrel (300 mg startdose etterfulgt av 75 mg per dag) alene og sammen med pantoprazol (80 mg samtidig som klopidogrel) i 5 dager. På dag 5 ble gjennomsnittlig AUC for den aktive metabolitten til klopidogrel redusert med ca. 14 % (geometrisk gjennomsnittsforhold var 86 %, med 90 % KI på 79 til 93 %) når pantoprazol ble administrert samtidig med klopidogrel sammenlignet med klopidogrel administrert alene. Farmakodynamiske parametere ble også målt og viste at endringen i hemming av blodplateaggregering (indusert av 5 μM ADP) var korrelert med endringen i eksponeringen for klopidogrel aktiv metabolitt. Den kliniske betydningen av dette funnet er ikke klart.
Mykofenolatmofetil (MMF)
Administrering av pantoprazol 40 mg to ganger daglig i 4 dager og en enkeltdose på 1000 mg MMF omtrent en time etter siste dose pantoprazol til 12 friske forsøkspersoner i en cross-over-studie resulterte i en 57 % reduksjon i Cmax og 27 % reduksjon. i AUC for MPA. Transplantasjonspasienter som fikk omtrent 2000 mg MMF per dag (n=12) ble sammenlignet med transplanterte pasienter som fikk omtrent samme dose MMF og pantoprazol 40 mg per dag (n=21). Det var en 78 % reduksjon i Cmax og en 45 % reduksjon i AUC for MPA hos pasienter som fikk både pantoprazol og MMF [se NARKOTIKAHANDEL ].
Andre stoffer
In vivo-studier tyder også på at pantoprazol ikke signifikant påvirker kinetikken til følgende legemidler (cisaprid, teofyllin, diazepam [og dets aktive metabolitt, desmetyldiazepam], fenytoin, metoprolol, nifedipin, karbamazepin, midazolam, klaritromycin, diklofenak, naproksen, og orale prevensjonsmidler [levonorgestrel/etinyløstradiol]). I andre in vivo-studier hadde digoksin, etanol, glyburid, antipyrin, koffein, metronidazol og amoxicillin ingen klinisk relevante interaksjoner med pantoprazol.
Selv om det ikke er observert noen signifikante legemiddelinteraksjoner i kliniske studier, er potensialet for signifikante legemiddelinteraksjoner ved dosering mer enn én gang daglig med høye doser pantoprazol ikke studert hos personer med dårlig metabolisme eller personer med nedsatt leverfunksjon.
Antacida
Det var heller ingen interaksjon med samtidig administrerte antacida.
Farmakogenomikk
CYP2C19 viser en kjent genetisk polymorfisme på grunn av dens mangel i noen underpopulasjoner (f.eks. er omtrent 3 % av kaukasiere og afroamerikanere og 17 % til 23 % av asiater dårlige metaboliserere). Selv om disse subpopulasjonene av pantoprazol-fattige metabolisatorer har eliminasjonshalveringstidsverdier på 3,5 til 10 timer hos voksne, har de fortsatt minimal akkumulering (23 % eller mindre) ved dosering én gang daglig. For voksne pasienter som metaboliserer dårlig CYP2C19, er det ikke nødvendig med dosejustering.
I likhet med voksne, viste pediatriske pasienter som har den dårlige metabolisatorgenotypen av CYP2C19 (CYP2C19 *2/*2) mer enn en 6 ganger økning i AUC sammenlignet med pediatrisk omfattende (CYP2C19 *1/*1) og middels (CYP2C19 *1) /*x) metaboliserere. Dårlige metabolisatorer viste omtrent 10 ganger lavere tilsynelatende oral clearance sammenlignet med omfattende metabolisatorer.
For kjente pediatrisk dårlige metabolisatorer bør en dosereduksjon vurderes.
Kliniske studier
PROTONIX 20 mg tabletter med forsinket frigivelse ble brukt i følgende kliniske studier.
Erosiv øsofagitt (EE) assosiert med gastroøsofageal reflukssykdom (GERD)
Voksne pasienter
En amerikansk multisenter, dobbeltblind, placebokontrollert studie av PROTONIX 10 mg, 20 mg eller 40 mg én gang daglig ble utført på 603 pasienter med reflukssymptomer og endoskopisk diagnostisert EE av grad 2 eller høyere (Hetzel-Dent-skala). I denne studien hadde omtrent 25 % av de registrerte pasientene alvorlig EE av grad 3, og 10 % hadde grad 4. Prosentandelen av pasienter som ble helbredet (per protokoll, n = 541) i denne studien er vist i tabell 8.
I denne studien hadde alle PROTONIX-behandlingsgruppene signifikant høyere tilhelingshastighet enn placebogruppen. Dette var sant uavhengig av H. pylori-status for 40 mg og 20 mg PROTONIX 40 mg behandlingsgruppene. 40 mg dosen av PROTONIX 20 mg resulterte i tilhelingshastigheter betydelig høyere enn de som ble funnet med enten 20 mg eller 10 mg dose.
En betydelig større andel av pasientene som tok PROTONIX 40 mg opplevde fullstendig lindring av halsbrann dag- og nattetid og fravær av oppstøt, fra første behandlingsdag, sammenlignet med placebo. Pasienter som tok PROTONIX konsumerte betydelig færre syrenøytraliserende tabletter per dag enn de som tok placebo.
PROTONIX 40 mg og 20 mg én gang daglig ble også sammenlignet med nizatidin 150 mg to ganger daglig i en amerikansk multisenter, dobbeltblind studie av 243 pasienter med reflukssymptomer og endoskopisk diagnostisert EE av grad 2 eller høyere. Prosentandelen av pasienter som er helbredet (per protokoll, n = 212) er vist i tabell 9.
En gang daglig behandling med PROTONIX 40 mg eller 20 mg resulterte i signifikant overlegen grad av tilheling ved både 4 og 8 uker sammenlignet med behandling to ganger daglig med 150 mg nizatidin. For 40 mg-behandlingsgruppen ble det oppnådd signifikant høyere tilhelingshastigheter sammenlignet med nizatidin uavhengig av H. pylori-status.
En betydelig større andel av pasientene i PROTONIX-behandlingsgruppene opplevde fullstendig lindring av halsbrann om natten og oppstøt, med start den første dagen og halsbrann på dagtid den andre dagen, sammenlignet med de som tok nizatidin 150 mg to ganger daglig. Pasienter som tok PROTONIX konsumerte betydelig færre syrenøytraliserende tabletter per dag enn de som tok nizatidin.
Pediatriske pasienter i alderen 5 år til 16 år
Effekten av PROTONIX ved behandling av EE assosiert med GERD hos pediatriske pasienter i alderen 5 år til og med 16 år er ekstrapolert fra tilstrekkelige og godt utførte studier hos voksne, da patofysiologien antas å være den samme. Fire pediatriske pasienter med endoskopisk diagnostisert EE ble studert i multisenter, randomiserte, dobbeltblinde, parallelle behandlingsstudier. Barn med endoskopisk diagnostisert EE (definert som en endoskopisk Hetzel-Dent-score ≥2) ble behandlet én gang daglig i 8 uker med ett av to dosenivåer av PROTONIX (20 mg eller 40 mg). Alle 4 pasientene med EE ble helbredet (Hetzel-Dent-score på 0 eller 1) etter 8 uker.
Langsiktig vedlikehold av helbredelse av erosiv øsofagitt
To uavhengige, multisenter, randomiserte, dobbeltblinde, komparatorkontrollerte studier med identisk design ble utført på voksne GERD-pasienter med endoskopisk bekreftet helbredet EE for å demonstrere effektiviteten av PROTONIX i langsiktig vedlikehold av helbredelse. De to amerikanske studiene inkluderte henholdsvis 386 og 404 pasienter for å motta enten 10 mg, 20 mg eller 40 mg PROTONIX 40 mg tabletter med forsinket frigivelse én gang daglig eller 150 mg ranitidin to ganger daglig. Som vist i tabell 10 var PROTONIX 40 mg og 20 mg signifikant bedre enn ranitidin på hvert tidspunkt med hensyn til opprettholdelse av helbredelse. I tillegg var PROTONIX 40 mg overlegen alle andre studerte behandlinger.
PROTONIX 40 mg var overlegen ranitidin ved å redusere antall episoder med halsbrann på dagtid og natt fra den første til og med den tolvte måneden av behandlingen. PROTONIX 20 mg, administrert én gang daglig, var også effektivt for å redusere episoder med halsbrann på dagtid og nattetid i en studie, som presentert i tabell 11.
Patologiske hypersekretoriske tilstander inkludert Zollinger-Ellison syndrom
en multisenter, åpen studie med 35 pasienter med patologiske hypersekretoriske tilstander, som Zollinger-Ellisons syndrom, med eller uten multippel endokrin neoplasi type I, kontrollerte PROTONIX magesyresekresjonen vellykket. Doser fra 80 mg daglig til 240 mg daglig holdt magesyreproduksjonen under 10 mEq/t hos pasienter uten tidligere syreduserende kirurgi og under 5 mEq/time hos pasienter med tidligere syreduserende kirurgi.
Doser ble initialt titrert til individuelle pasientbehov, og justert hos noen pasienter basert på klinisk respons over tid [se DOSERING OG ADMINISTRASJON ]. PROTONIX 40 mg ble godt tolerert ved disse dosenivåene i lengre perioder (mer enn 2 år hos noen pasienter).
PASIENTINFORMASJON
PROTONIX (pro-TAH-nix)(pantoprazolnatrium) tabletter med forsinket frigivelse og PROTONIX (pro-TAH-nix) (pantoprazolnatrium) for oral suspensjon med forsinket frigivelse
Hva er den viktigste informasjonen jeg bør vite om PROTONIX?
Du bør ta PROTONIX 20 mg nøyaktig som foreskrevet, med lavest mulig dose og i kortest mulig tid.
PROTONIX kan hjelpe dine syrerelaterte symptomer, men du kan fortsatt ha alvorlige mageproblemer. Snakk med legen din.
PROTONIX kan forårsake alvorlige bivirkninger, inkludert:
- . En type nyreproblem (akutt tubulointerstitiell nefritt). Noen personer som tar medisiner med protonpumpehemmere (PPI), inkludert PROTONIX 40 mg, kan utvikle et nyreproblem kalt akutt tubulointerstitiell nefritt som kan oppstå når som helst under behandling med PROTONIX. Ring legen din med en gang hvis du har en reduksjon i mengden du tisser eller hvis du har blod i urinen. . Diaré forårsaket av en infeksjon (Clostridium difficile) i tarmene dine. Ring legen din med en gang hvis du har vannaktig avføring eller magesmerter som ikke går over. Du har kanskje feber eller ikke. . Benbrudd (hofte, håndledd eller ryggrad). Benbrudd i hoften, håndleddet eller ryggraden kan forekomme hos personer som tar flere daglige doser av PPI-medisiner og over en lengre periode (et år eller lenger). Fortell legen din dersom du har et beinbrudd, spesielt i hoften, håndleddet eller ryggraden. . Visse typer lupus erythematosus. Lupus erythematosus er en autoimmun lidelse (kroppens immunceller angriper andre celler eller organer i kroppen). Noen mennesker som tar PPI-medisiner, inkludert PROTONIX 40mg, kan utvikle visse typer lupus erythematosus eller ha forverring av lupus de allerede har. Ring legen din med en gang hvis du har nye eller forverrede leddsmerter eller utslett på kinnene eller armene som blir verre i solen.
Snakk med legen din om risikoen for disse alvorlige bivirkningene.
PROTONIX kan ha andre alvorlige bivirkninger. Se "Hva er de mulige bivirkningene av PROTONIX?"
Hva er PROTONIX 20mg?
Et reseptbelagt legemiddel kalt en protonpumpehemmer (PPI) som brukes til å redusere mengden syre i magen.
Hos voksne, PROTONIX brukes til:
- . opptil 8 uker for helbredelse og symptomlindring av syrerelatert skade på slimhinnen i spiserøret (kalt erosiv øsofagitt eller EE). Legen din kan forskrive ytterligere 8 uker med PROTONIX 20 mg til pasienter hvis EE ikke gror. . opprettholde helbredelse av EE og bidra til å forhindre tilbakekomst av halsbrannsymptomer forårsaket av GERD. Det er ikke kjent om PROTONIX 40mg er trygt og effektivt når det brukes i mer enn 12 måneder for dette formålet. . langtidsbehandling av tilstander der magen lager for mye syre. Dette inkluderer en sjelden tilstand kalt Zollinger-Ellisons syndrom.
Hos barn 5 år og eldre, PROTONIX brukes til:
- . opptil 8 uker for helbredelse og symptomlindring av EE. Det er ikke kjent om PROTONIX 20 mg er trygt ved bruk i mer enn 8 uker hos barn.
PROTONIX 20mg er ikke til bruk hos barn under 5 år. Det er ikke kjent om PROTONIX 40mg er trygt og effektivt hos barn for annen behandling enn EE.
Ikke ta PROTONIX 20 mg hvis du er:
- . allergisk overfor pantoprazolnatrium, andre PPI-medisiner eller noen av innholdsstoffene i PROTONIX. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser. . tar et legemiddel som inneholder rilpivirin (EDURANT, COMPLERA, ODEFSEY, JULUCA) som brukes til å behandle HIV-1 (humant immunsviktvirus).
Før du tar PROTONIX, fortell legen din om alle dine medisinske tilstander, inkludert hvis du:
- . har lave magnesiumnivåer i blodet. . er gravid eller planlegger å bli gravid. PROTONIX 40 mg kan skade det ufødte barnet ditt. Fortell legen din dersom du blir gravid eller tror du kan være gravid under behandling med PROTONIX. . ammer eller planlegger å amme. PROTONIX kan gå over i morsmelk. Snakk med legen din om den beste måten å mate babyen din på hvis du tar PROTONIX.
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie legemidler, vitaminer og urtetilskudd. Fortell spesielt legen din hvis du tar metotreksat (Otrexup, Rasuvo, Trexall, XATMEP), digoksin (LANOXIN), eller en vannpille (vanndrivende).
Hvordan skal jeg ta PROTONIX 20mg?
- . Ta PROTONIX 40 mg nøyaktig som foreskrevet av legen din.
PROTONIX tabletter med forsinket frigivelse (PROTONIX 20 mg tabletter):
- .
- . Ikke del, tygg eller knus PROTONIX 40 mg tabletter. . Svelg PROTONIX 20 mg tabletter hele, med eller uten mat. . Fortell legen din dersom du ikke klarer å svelge din PROTONIX 20 mg tablett. . Du kan bruke antacida mens du tar PROTONIX 40 mg tabletter.
PROTONIX 40 mg for mikstur, suspensjon med forsinket frigivelse (PROTONIX for mikstur):
- .
- . Ikke del, tygg eller knus PROTONIX 20mg til mikstur. . Ta PROTONIX 40 mg til mikstur, suspensjon ca. 30 minutter før et måltid. . PROTONIX til mikstur, suspensjon skal kun gis gjennom munnen blandet i eplejuice eller eplemos eller gjennom et nasogastrisk (NG) sonde eller gastrostomirør blandet i eplejuice. Ikke bland PROTONIX til oral suspensjon i andre væsker enn eplejuice eller andre matvarer enn eplemos. . Ikke del en pakke med PROTONIX 20 mg til mikstur for å lage en mindre dose. . Se "Instruksjoner for bruk" på slutten av denne medisinveiledningen for instruksjoner om hvordan du blander og tar PROTONIX 40mg til oral suspensjon gjennom munnen i eplemos eller eplejuice eller hvordan du blander og gir suspensjonen gjennom et NG-rør eller gastrostomirør blandet i eplejuice.
Hva er de mulige bivirkningene av PROTONIX 40mg?
PROTONIX 20mg kan forårsake alvorlige bivirkninger, inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om PROTONIX?" . Lave vitamin B-12 nivåer i kroppen din kan skje hos personer som har tatt PROTONIX 40 mg i lang tid (mer enn 3 år). Fortell legen din dersom du har symptomer på lave vitamin B-12-nivåer, inkludert kortpustethet, svimmelhet, uregelmessig hjerterytme, muskelsvakhet, blek hud, tretthetsfølelse, humørsvingninger og prikking eller nummenhet i armer og ben. . Lavt magnesiumnivå i kroppen din kan forekomme hos personer som har tatt PROTONIX i minst 3 måneder. Fortell legen din dersom du har symptomer på lave magnesiumnivåer, inkludert anfall, svimmelhet, uregelmessig hjerterytme, nervøsitet, muskelsmerter eller svakhet, og spasmer i hender, føtter eller stemme. . Magevekster (fundiske kjertelpolypper). Personer som bruker PPI-medisiner over lengre tid har økt risiko for å utvikle en viss type magevekster som kalles fundic gland polypper, spesielt etter å ha tatt PPI-medisiner i mer enn 1 år.
De vanligste bivirkningene av PROTONIX 40 mg hos voksne inkluderer: hodepine, diaré, kvalme, smerter i mageområdet (mage), oppkast, gass, svimmelhet og leddsmerter.
De vanligste bivirkningene av PROTONIX 40 mg hos barn inkluderer: øvre luftveisinfeksjon, hodepine, feber, diaré, oppkast, utslett og magesmerter. Dette er ikke alle mulige bivirkninger av PROTONIX. Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare PROTONIX 40mg?
Oppbevar PROTONIX 20mg ved romtemperatur mellom 68°F til 77°F (20°C til 25°C).
Oppbevar PROTONIX og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av PROTONIX.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk PROTONIX for en tilstand som det ikke er foreskrevet for. Ikke gi PROTONIX 20 mg til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem. Du kan spørre legen din eller apoteket om informasjon om PROTONIX 20mg som er skrevet for helsepersonell.
Hva er ingrediensene i PROTONIX?
Aktiv ingrediens: pantoprazol natrium seskvihydrat
Inaktive ingredienser i PROTONIX tabletter med forsinket frigivelse: kalsiumstearat, krospovidon, hypromellose, jernoksid, mannitol, metakrylsyrekopolymer, polysorbat 80, povidon, propylenglykol, natriumkarbonat, natriumlaurylsulfat, titandioksid og trietylsitrat.
Inaktive ingredienser i PROTONIX 40 mg for mikstur med forsinket frigivelse: krospovidon, hypromellose, metakrylsyrekopolymer, mikrokrystallinsk cellulose, polysorbat 80, povidon, natriumkarbonat, natriumlaurylsulfat, talkum, titandioksid, trietylsitrat og gult jernoksid.
Instruksjoner for bruk
PROTONIX (pro-TAH-nix) (pantoprazolnatrium) for oral suspensjon med forsinket frigivelse
PROTONIX 40 mg for forsinket frigjøring mikstur, suspensjon (PROTONIX 40 mg for mikstur):
Viktig informasjon:
- . Ikke del, tygg eller knus PROTONIX til mikstur. . Ta PROTONIX til mikstur ca. 30 minutter før et måltid. . PROTONIX til mikstur, suspensjon:
- . bør bare tas med eplemos eller eplejuice. . bør ikke blandes i vann eller andre væsker eller andre matvarer. . pakken bør ikke deles for å lage en mindre dose.
Inntak av PROTONIX 20 mg til oral suspensjon med eplemos:
. Åpne pakken med PROTONIX for mikstur, suspensjon. . Dryss alle granulene i pakken på 1 ts eplemos. . Svelg granulatet og eplemosen innen 10 minutter å legge granulene på teskjeen med eplemos. . Ta slurker med vann for å være sikker på at granulatet blir vasket ned i magen. Ta flere slurker med vann etter behov.Inntak av PROTONIX 40 mg til oral suspensjon med eplejuice:
. Åpne pakken med PROTONIX 40 mg for oral suspensjon. . Tøm alle granulene i pakken i en liten kopp som inneholder 1 teskje eplejuice. . Rør granulat-eplejuiceblandingen i 5 sekunder. Granulene vil ikke bryte opp. . Svelg blandingen med en gang. . For å være sikker på at hele dosen blir tatt, tilsett mer eplejuice i koppen, rør og svelg eplejuicen med en gang. . Gjenta trinn 5 hvis det er granulat igjen i koppen.Gi PROTONIX 40 mg til oral suspensjon gjennom en nasogastrisk sonde eller gastrostomisonde:
- . PROTONIX til mikstur kan gis gjennom et NG-rør eller gastrostomirør størrelse 16 fransk eller større. Ikke gi PROTONIX 20 mg til oral suspensjon gjennom et NG-rør eller gastrostomirør som er mindre enn størrelse 16 French. . Blande PROTONIX 20 mg til mikstur, suspensjon kun i eplejuice når du gir gjennom en NG-sonde eller gastrostomisonde.
Hvordan bør jeg oppbevare PROTONIX 20mg?
Oppbevar PROTONIX 20mg ved romtemperatur mellom 68°F til 77°F (20°C til 25°C).
Oppbevar PROTONIX 40 mg og alle legemidler utilgjengelig for barn.
Denne medisinveiledningen og bruksanvisningen er godkjent av US Food and Drug Administration.
