Pepcid 20mg, 40mg Famotidine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Pepcid og hvordan brukes det?
Pepcid (famotidin) brukes til å behandle halsbrann, GERD og Zollinger-Ellisons syndrom. Den er tilgjengelig over-the-counter. Pepcid 20mg er tilgjengelig som generisk.
Hva er mulige bivirkninger ved bruk av Pepcid?
Bivirkninger er uvanlige, men kan omfatte:
- . utmattelse, . oppkast, . kvalme, . ubehag i magen, . anoreksi, . tørr i munnen, . utslett, og . muskel kramper
BESKRIVELSE
Den aktive ingrediensen i PEPCID® (famotidin) er en histamin H2-reseptorantagonist. Famotidin er N'(aminosulfonyl)-3-[[[2-[(diaminometylen)amino]-4-tiazolyl]metyl]tio]propanimidamid. Den empiriske formelen til famotidin er C8H15N7O2S3 og dens molekylvekt er 337,43. Dens strukturformel er:
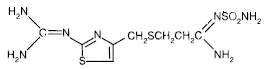
Famotidin er en hvit til blekgul krystallinsk forbindelse som er fritt løselig i iseddik, lett løselig i metanol, svært lite løselig i vann og praktisk talt uløselig i etanol.
Hver tablett for oral administrering inneholder enten 20 mg eller 40 mg famotidin og følgende inaktive ingredienser: hydroksypropylcellulose, hypromellose, jernoksider, magnesiumstearat, mikrokrystallinsk cellulose, maisstivelse, talkum, titandioksid og karnaubavoks.
INDIKASJONER
PEPCID 40mg er indisert i:
. Korttidsbehandling av aktivt duodenalsår. De fleste voksne pasienter helbreder innen 4 uker; det er sjelden grunn til å bruke PEPCID i full dose i mer enn 6 til 8 uker. Studier har ikke vurdert sikkerheten til famotidin ved ukomplisert aktivt duodenalsår i perioder på mer enn åtte uker. . Vedlikeholdsbehandling for pasienter med duodenalsår ved redusert dosering etter tilheling av et aktivt sår. Kontrollerte studier på voksne har ikke forlenget seg utover ett år. . Korttidsbehandling av aktivt godartet magesår. De fleste voksne pasienter helbreder innen 6 uker. Studier har ikke vurdert sikkerheten eller effekten av famotidin ved ukomplisert aktivt benignt magesår i perioder på mer enn 8 uker. . Korttidsbehandling av gastroøsofageal reflukssykdom (GERD). PEPCID er indisert for korttidsbehandling av pasienter med symptomer på GERD (se KLINISK FARMAKOLOGI hos voksne , Kliniske studier ). PEPCID 20mg er også indisert for korttidsbehandling av øsofagitt på grunn av GERD inkludert erosiv eller ulcerøs sykdom diagnostisert ved endoskopi (se KLINISK FARMAKOLOGI hos voksne , Kliniske studier ). . Behandling av patologiske hypersekretoriske tilstander (f.eks. Zollinger-Ellison syndrom, multiple endokrine adenomer) (se KLINISK FARMAKOLOGI hos voksne , Kliniske studier ).DOSERING OG ADMINISTRASJON
Duodenalsår
Akutt terapi: Den anbefalte orale dosen for voksne for aktivt duodenalsår er 40 mg én gang daglig ved sengetid. De fleste pasienter helbreder innen 4 uker; det er sjelden grunn til å bruke PEPCID i full dose i mer enn 6 til 8 uker. Et kur på 20 mg to ganger daglig er også effektivt.
Vedlikeholdsterapi: Den anbefalte orale dosen for voksne er 20 mg én gang daglig ved sengetid.
Godartet magesår
Akutt terapi: Den anbefalte orale dosen for voksne for aktivt godartet magesår er 40 mg én gang daglig ved sengetid.
Gastroøsofageal reflukssykdom (GERD)
Den anbefalte orale dosen for behandling av voksne pasienter med symptomer på GERD er 20 mg to ganger daglig i opptil 6 uker. Den anbefalte orale dosen for behandling av voksne pasienter med øsofagitt inkludert erosjoner og sårdannelser og medfølgende symptomer på grunn av GERD er 20 eller 40 mg to ganger daglig i opptil 12 uker (se KLINISK FARMAKOLOGI hos voksne , Kliniske studier ).
Dosering for pediatriske pasienter
Se FORHOLDSREGLER , Pediatriske pasienter
Studiene beskrevet i FORHOLDSREGLER, pediatriske pasienter
Dosering for pediatriske pasienter i alderen 1-16 år
Se FORHOLDSREGLER , Pediatriske pasienter 1-16 år.
Studiene beskrevet i FORHOLDSREGLER, pediatriske pasienter 1-16 år antyder følgende startdoser hos pediatriske pasienter 1-16 år:
magesår - 0,5 mg/kg/dag po ved sengetid eller delt bud opp til 40 mg/dag.
Gastroøsofageal reflukssykdom med eller uten øsofagitt inkludert erosjoner og sårdannelser - 1,0 mg/kg/dag po delt bud opp til 40 mg bid
Mens publiserte ukontrollerte studier tyder på effektiviteten av famotidin i behandlingen av gastroøsofageal reflukssykdom og magesår, er data fra pediatriske pasienter utilstrekkelige til å fastslå prosentvis respons med dose og behandlingsvarighet. Derfor bør behandlingsvarighet (i utgangspunktet basert på anbefaling av varighet for voksne) og dose individualiseres basert på klinisk respons og/eller pH-bestemmelse (gastrisk eller esophageal) og endoskopi. Publiserte ukontrollerte kliniske studier hos pediatriske pasienter i alderen 1-16 år har brukt doser opptil 1 mg/kg/dag for magesår og 2 mg/kg/dag for GERD med eller uten øsofagitt inkludert erosjoner og sårdannelser.
Patologiske hypersekretoriske tilstander (f.eks. Zollinger-Ellison syndrom, multiple endokrine adenomer)
Doseringen av PEPCID hos pasienter med patologiske hypersekretoriske tilstander varierer med den enkelte pasient. Den anbefalte orale startdosen for voksne for patologiske hypersekretoriske tilstander er 20 mg q 6 timer. Hos noen pasienter kan en høyere startdose være nødvendig. Doser bør justeres til individuelle pasientbehov og bør fortsette så lenge det er klinisk indisert. Doser opp til 160 mg q 6 timer har blitt administrert til noen voksne pasienter med alvorlig Zollinger-Ellison syndrom.
Samtidig bruk av antacida
Antacida kan gis samtidig ved behov.
Dosejustering for pasienter med moderat eller alvorlig nyresvikt
Hos voksne pasienter med moderat (kreatininclearance
Basert på sammenligning av farmakokinetiske parametere for PEPCID hos voksne og pediatriske pasienter, bør dosejustering hos pediatriske pasienter med moderat eller alvorlig nyresvikt vurderes.
HVORDAN LEVERES
PEPCID 40mg tabletter 20 mg, er beigefargede, avrundede firkantede, filmdrasjerte tabletter merket med MSD på den ene siden og vanlige på den andre. De leveres som følger:
NDC 42998-639-09 bruksenhetsflasker med 30 stk NDC 42998-639-98 bruksenhetsflasker med 100 stk.
PEPCID 40 mg tabletter, 40 mg, er brune, avrundede firkantede, filmdrasjerte tabletter merket med MSD på den ene siden og ensfarget på den andre. De leveres som følger:
NDC 42998-649-09 bruksenhetsflasker med 30 stk NDC 42998-649-98 bruksenhet flasker á 100. Oppbevaring
Oppbevares ved kontrollert romtemperatur.
PEPCID® (famotidin) tabletter 20 mg og tabletter 40 mg er produsert for: Marathon Pharmaceuticals, LLC, Northbrook, IL 60062, USA. Utgitt februar 2014.
BIVIRKNINGER
Bivirkningene som er oppført nedenfor er rapportert under nasjonale og internasjonale kliniske studier hos ca. 2500 pasienter. I de kontrollerte kliniske studiene der PEPCID 40 mg tabletter ble sammenlignet med placebo, var forekomsten av bivirkninger i gruppen som fikk PEPCID tabletter, 40 mg ved sengetid, lik den i placebogruppen.
Følgende bivirkninger er rapportert å forekomme hos mer enn 1 % av pasientene som behandles med PEPCID i kontrollerte kliniske studier, og kan være årsaksrelatert til stoffet: hodepine (4,7 %), svimmelhet (1,3 %), forstoppelse (1,2 %). ) og diaré (1,7%).
Følgende andre bivirkninger er rapportert sjelden i kliniske studier eller siden legemidlet ble markedsført. Forholdet til behandling med PEPCID 20 mg har vært uklart i mange tilfeller. Innenfor hver kategori er bivirkningene oppført i rekkefølge etter avtagende alvorlighetsgrad:
Kroppen som helhet: feber, asteni, tretthet
Kardiovaskulær: arytmi, AV-blokkering, hjertebank. Forlenget QT-intervall hos pasienter med nedsatt nyrefunksjon er rapportert i svært sjeldne tilfeller.
Gastrointestinale: kolestatisk gulsott, hepatitt, leverenzymavvik, oppkast, kvalme, ubehag i magen, anoreksi, munntørrhet
Hematologisk: sjeldne tilfeller av agranulocytose, pancytopeni, leukopeni, trombocytopeni
Overfølsomhet: anafylaksi, angioødem, orbital- eller ansiktsødem, urticaria, utslett, konjunktival injeksjon
Muskuloskeletal: rabdomyolyse, muskel-skjelettsmerter inkludert muskelkramper, artralgi
Nervesystem/psykiatrisk: grand mal anfall; psykiske forstyrrelser, som var reversible i tilfeller der oppfølging ble oppnådd, inkludert hallusinasjoner, forvirring, agitasjon, depresjon, angst, redusert libido; parestesi; søvnløshet; somnolens. Kramper, hos pasienter med nedsatt nyrefunksjon, er rapportert svært sjelden.
Luftveiene: bronkospasme, interstitiell lungebetennelse
Hud: toksisk epidermal nekrolyse/Stevens-Johnsons syndrom (svært sjelden), alopecia, akne, kløe, tørr hud, rødme
Spesielle sanser: tinnitus, smaksforstyrrelse
Annen: sjeldne tilfeller av impotens og sjeldne tilfeller av gynekomasti er rapportert; I kontrollerte kliniske studier var imidlertid forekomsten ikke høyere enn de som ble sett med placebo.
Bivirkningene rapportert for PEPCID-tabletter kan også forekomme med PEPCID 20 mg for oral suspensjon.
Pediatriske pasienter
I en klinisk studie med 35 pediatriske pasienter
NARKOTIKAHANDEL
Ingen legemiddelinteraksjoner er identifisert. Studier med famotidin hos mennesker, i dyremodeller og in vitro har ikke vist noen signifikant interferens med disposisjonen av forbindelser metabolisert av de hepatiske mikrosomale enzymer, f.eks. cytokrom P450-systemet. Forbindelser testet hos mennesker inkluderer warfarin, teofyllin, fenytoin, diazepam, aminopyrin og antipyrin. Indocyaningrønn som en indeks for utvinning av legemidler i leveren har blitt testet og ingen signifikante effekter er funnet.
ADVARSLER
Ingen informasjon gitt
FORHOLDSREGLER
Generell
Symptomatisk respons på behandling med PEPCID utelukker ikke tilstedeværelse av gastrisk malignitet.
Pasienter med moderat eller alvorlig nyresvikt
Siden CNS-bivirkninger er rapportert hos pasienter med moderat og alvorlig nyresvikt, kan det være nødvendig å bruke lengre intervaller mellom doser eller lavere doser hos pasienter med moderat (kreatininclearance KLINISK FARMAKOLOGI hos voksne og DOSERING OG ADMINISTRASJON ). Forlenget QT-intervall er rapportert i svært sjeldne tilfeller hos pasienter med nedsatt nyrefunksjon hvis dose/doseringsintervall av famotidin kanskje ikke er riktig justert.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
I en 106-ukers studie på rotter og en 92-ukers studie på mus som ble gitt orale doser på opptil 2000 mg/kg/dag (omtrent 2500 ganger den anbefalte dosen for mennesker for aktivt duodenalsår), var det ingen tegn på kreftfremkallende potensial for PEPCID.
Famotidin var negativt i den mikrobielle mutagentesten (Ames-testen) ved bruk av Salmonella typhimurium og Escherichia coli med eller uten aktivering av rotteleverenzym ved konsentrasjoner opp til 10 000 mcg/plate. I in vivo-studier på mus, med en mikronukleustest og en kromosomavvikstest, ble det ikke observert tegn på en mutagen effekt.
I studier med rotter gitt orale doser på opptil 2000 mg/kg/dag eller intravenøse doser på opptil 200 mg/kg/dag, ble ikke fertilitet og reproduksjonsevne påvirket.

Svangerskap
Graviditetskategori B
Reproduksjonsstudier er utført på rotter og kaniner ved orale doser på henholdsvis opptil 2000 og 500 mg/kg/dag, og i begge arter ved IV-doser på opptil 200 mg/kg/dag, og har ikke avdekket signifikante bevis for nedsatt fertilitet eller skade på fosteret på grunn av PEPCID. Selv om det ikke er observert noen direkte føtotoksiske effekter, ble sporadiske aborter som bare forekommer hos mødre som viser markert redusert matinntak sett hos noen kaniner ved orale doser på 200 mg/kg/dag (250 ganger vanlig human dose) eller høyere. Det er imidlertid ingen tilstrekkelige eller godt kontrollerte studier på gravide kvinner. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for menneskelig respons, bør dette legemidlet kun brukes under graviditet hvis det er klart nødvendig.
Ammende mødre
Studier utført på diegivende rotter har vist at famotidin skilles ut i morsmelk. Forbigående vekstdepresjon ble observert hos unge rotter som dier fra mødre behandlet med maternotoksiske doser på minst 600 ganger vanlig human dose. Famotidin kan påvises i morsmelk. På grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn fra PEPCID, bør det tas en beslutning om å avbryte ammingen eller seponere medikamentet, tatt i betraktning stoffets betydning for moren.
Pediatriske pasienter
Bruk av PEPCID 20 mg hos pediatriske pasienter
To farmakokinetiske studier hos pediatriske pasienter 3 måneder til 1 år er lik det som sees hos eldre pediatriske pasienter (1-15 år) og voksne . Derimot hadde pediatriske pasienter i alderen 0-3 måneder famotidinclearance-verdier som var 2-4 ganger lavere enn hos eldre pediatriske pasienter og voksne. Disse studiene viser også at gjennomsnittlig biotilgjengelighet hos pediatriske pasienter KLINISK FARMAKOLOGI hos pediatriske pasienter , Farmakokinetikk og farmakodynamikk .)
en dobbeltblind, randomisert behandlingsavbruddsstudie ble 35 pediatriske pasienter BIVIRKNINGER , Pediatriske pasienter ).
Disse studiene tyder på at en startdose på 0,5 mg/kg/dose av famotidin oral suspensjon kan være nyttig for behandling av GERD i opptil 4 uker én gang daglig hos pasienter
Pediatriske pasienter 1-16 år
Bruk av PEPCID 40 mg hos pediatriske pasienter i alderen 1-16 år støttes av bevis fra tilstrekkelige og godt kontrollerte studier av PEPCID hos voksne, og av følgende studier hos pediatriske pasienter: I publiserte studier med et lite antall pediatriske pasienter 1-15 år gammel, var clearance av famotidin lik det som ble sett hos voksne. Hos pediatriske pasienter i alderen 11-15 år var orale doser på 0,5 mg/kg assosiert med et gjennomsnittlig areal under kurven (AUC) tilsvarende det som sees hos voksne behandlet oralt med 40 mg. Tilsvarende var intravenøse doser på 0,5 mg/kg hos pediatriske pasienter 1-15 år assosiert med en gjennomsnittlig AUC tilsvarende den som ble sett hos voksne behandlet intravenøst med 40 mg. Begrensede publiserte studier tyder også på at forholdet mellom serumkonsentrasjon og syresuppresjon er lik hos pediatriske pasienter 1-15 år sammenlignet med voksne. Disse studiene foreslår en startdose for pediatriske pasienter i alderen 1-16 år som følger:
Magesår - 0,5 mg/kg/dag po Ved leggetid eller delt bud Opptil 40 mg/dag.
Gastroøsofageal reflukssykdom med eller uten øsofagitt inkludert erosjoner og sårdannelser - 1,0 mg/kg/dag po delt bud opp til 40 mg bid
Mens publiserte ukontrollerte studier tyder på effektiviteten av famotidin i behandlingen av gastroøsofageal reflukssykdom og magesår, er data fra pediatriske pasienter utilstrekkelige til å fastslå prosentvis respons med dose og behandlingsvarighet. Derfor bør behandlingsvarighet (i utgangspunktet basert på anbefaling av varighet for voksne) og dose individualiseres basert på klinisk respons og/eller pH-bestemmelse (gastrisk eller esophageal) og endoskopi. Publiserte ukontrollerte kliniske studier hos pediatriske pasienter har brukt doser opptil 1 mg/kg/dag for magesår og 2 mg/kg/dag for GERD med eller uten øsofagitt inkludert erosjoner og sårdannelser.
Geriatrisk bruk
Av de 4 966 pasientene i kliniske studier som ble behandlet med famotidin, var 488 personer (9,8 %) 65 år og eldre, og 88 personer (1,7 %) var eldre enn 75 år. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre forsøkspersoner. Større sensitivitet hos enkelte eldre individer kan imidlertid ikke utelukkes.
Ingen dosejustering er nødvendig basert på alder (se KLINISK FARMAKOLOGI hos voksne , Farmakokinetikk ). Dette legemidlet er kjent for å utskilles i stor grad av nyrene, og risikoen for toksiske reaksjoner på dette legemidlet kan være større hos pasienter med nedsatt nyrefunksjon. Fordi eldre pasienter har større sannsynlighet for å ha nedsatt nyrefunksjon, bør det utvises forsiktighet ved dosevalg, og det kan være nyttig å overvåke nyrefunksjonen. Dosejustering ved moderat eller alvorlig nedsatt nyrefunksjon er nødvendig (se FORHOLDSREGLER , Pasienter med moderat eller alvorlig nyresvikt og DOSERING OG ADMINISTRASJON , Dosejustering for pasienter med moderat eller alvorlig nyresvikt ).
OVERDOSE
Bivirkningene ved overdosetilfeller er lik bivirkningene som oppstår i normal klinisk erfaring (se BIVIRKNINGER ). Orale doser på opptil 640 mg/dag er gitt til voksne pasienter med patologiske hypersekretoriske tilstander uten alvorlige bivirkninger. Ved overdosering bør behandlingen være symptomatisk og støttende. Uabsorbert materiale bør fjernes fra mage-tarmkanalen, pasienten bør overvåkes, og støttebehandling bør benyttes.
Den orale LD50 av famotidin hos hann- og hunnrotter og -mus var større enn 3000 mg/kg og den minste dødelige akutte orale dosen hos hunder oversteg 2000 mg/kg. Famotidin ga ikke åpenbare effekter ved høye orale doser hos mus, rotter, katter og hunder, men induserte signifikant anoreksi og vekstdepresjon hos kaniner som startet med 200 mg/kg/dag oralt. Den intravenøse LD50-verdien av famotidin for mus og rotter varierte fra 254-563 mg/kg, og den minste dødelige enkelt IV-dose hos hunder var omtrent 300 mg/kg. Tegn på akutt forgiftning hos IV-behandlede hunder var brekninger, rastløshet, blekhet på slimhinner eller rødhet i munn og ører, hypotensjon, takykardi og kollaps.
KONTRAINDIKASJONER
Overfølsomhet overfor noen komponent i disse produktene. Kryssfølsomhet i denne klassen av forbindelser er observert. Derfor bør ikke PEPCID 40 mg gis til pasienter med en historie med overfølsomhet overfor andre H2-reseptorantagonister.
KLINISK FARMAKOLOGI
Klinisk farmakologi hos voksne
GI-effekter
PEPCID er en konkurrerende hemmer av histamin H2-reseptorer. Den primære klinisk viktige farmakologiske aktiviteten til PEPCID 40mg er hemming av gastrisk sekresjon. Både syrekonsentrasjonen og volumet av gastrisk sekresjon undertrykkes av PEPCID, mens endringer i pepsinsekresjon er proporsjonal med volumutskillelse.
Hos normale frivillige og hypersekretorer hemmet PEPCID 20mg basal og nattlig gastrisk sekresjon, samt sekresjon stimulert av mat og pentagastrin. Etter oral administrering inntraff den antisekretoriske effekten innen en time; den maksimale effekten var doseavhengig og inntraff innen én til tre timer. Varigheten av hemming av sekresjon ved doser på 20 og 40 mg var 10 til 12 timer.
Engangs orale doser på 20 og 40 mg på kvelden hemmet basal og nattlig syresekresjon hos alle forsøkspersoner; gjennomsnittlig nattlig magesyresekresjon ble hemmet med henholdsvis 86 % og 94 % i en periode på minst 10 timer. De samme dosene gitt om morgenen undertrykte matstimulert syresekresjon hos alle forsøkspersoner. Gjennomsnittlig suppresjon var henholdsvis 76 % og 84 %, 3 til 5 timer etter administrering, og henholdsvis 25 % og 30 % 8 til 10 timer etter administrering. Hos noen forsøkspersoner som fikk 20 mg dosen, ble den antisekretoriske effekten imidlertid forsvunnet innen 6-8 timer. Det var ingen kumulativ effekt ved gjentatte doser. Den nattlige intragastriske pH ble hevet med kveldsdoser på 20 og 40 mg PEPCID til gjennomsnittsverdier på henholdsvis 5,0 og 6,4. Når PEPCID 40mg ble gitt etter frokost, ble den basale dagtid interfordøyelses-pH ved 3 og 8 timer etter 20 eller 40 mg PEPCID 40mg hevet til ca. 5.
PEPCID 40 mg hadde liten eller ingen effekt på fastende eller postprandiale serumgastrinnivåer. Gastrisk tømming og eksokrin pankreasfunksjon ble ikke påvirket av PEPCID.
Andre effekter
Systemiske effekter av PEPCID i CNS, kardiovaskulære, respiratoriske eller endokrine systemer ble ikke observert i kliniske farmakologiske studier. Det ble heller ikke observert noen antiandrogene effekter. (Se BIVIRKNINGER .) Serumhormonnivåer, inkludert prolaktin, kortisol, tyroksin (T4) og testosteron, ble ikke endret etter behandling med PEPCID.
Farmakokinetikk
PEPCID 20 mg absorberes ufullstendig. Biotilgjengeligheten til orale doser er 40-45 %. Biotilgjengeligheten kan økes litt med mat, eller svakt redusert av syrenøytraliserende midler; disse effektene har imidlertid ingen klinisk konsekvens. PEPCID gjennomgår minimal first-pass metabolisme. Etter orale doser oppstår maksimale plasmanivåer etter 1-3 timer. Plasmanivåer etter flere doser er lik de etter enkeltdoser. Femten til 20 % av PEPCID 20 mg i plasma er proteinbundet. PEPCID har en eliminasjonshalveringstid på 2,5-3,5 timer. PEPCID elimineres via nyre (65-70 %) og metabolske (30-35 %) ruter. Renal clearance er 250-450 ml/min, noe som indikerer en viss tubulær utskillelse. 25 til 30 % av en oral dose og 65-70 % av en intravenøs dose gjenvinnes i urinen som uendret forbindelse. Den eneste metabolitten som er identifisert hos mennesker er S-oksidet.
Det er en nær sammenheng mellom kreatininclearance-verdier og eliminasjonshalveringstiden for PEPCID. Hos pasienter med alvorlig nyresvikt, dvs. kreatininclearance mindre enn 10 ml/min, kan eliminasjonshalveringstiden for PEPCID overstige 20 timer og justering av dose eller doseringsintervaller ved moderat og alvorlig nyreinsuffisiens kan være nødvendig (se FORHOLDSREGLER , DOSERING OG ADMINISTRASJON ).
Hos eldre pasienter er det ingen klinisk signifikante aldersrelaterte endringer i farmakokinetikken til PEPCID. Hos eldre pasienter med nedsatt nyrefunksjon kan imidlertid clearance av legemidlet være redusert (se FORHOLDSREGLER , Geriatrisk bruk ).
Kliniske studier
Duodenalsår
I en amerikansk multisenter, dobbeltblind studie hos polikliniske pasienter med endoskopisk bekreftet duodenalsår, ble oralt administrert PEPCID sammenlignet med placebo. Som vist i tabell 1 ble 70 % av pasientene behandlet med PEPCID 40 mg t helbredet innen uke 4.
Pasienter som ikke ble helbredet innen uke 4 ble fortsatt i studien. Ved uke 8 hadde 83 % av pasientene behandlet med PEPCID helbredet mot 45 % av pasientene behandlet med placebo. Forekomsten av sårheling med PEPCID var signifikant høyere enn med placebo på hvert tidspunkt basert på andelen endoskopisk bekreftet tilhelet sår.
I denne studien var tiden til lindring av dag- og nattsmerte signifikant kortere for pasienter som fikk PEPCID enn for pasienter som fikk placebo; pasienter som fikk PEPCID tok også mindre syrenøytraliserende midler enn pasientene som fikk placebo.
Langsiktig vedlikeholdsbehandling av duodenalsår
PEPCID 40 mg, 20 mg pohs, ble sammenlignet med placebo-hs som vedlikeholdsbehandling i to dobbeltblindede, multisenterstudier av pasienter med endoskopisk bekreftet helbredet duodenalsår. I den amerikanske studien var den observerte sårforekomsten innen 12 måneder hos pasienter behandlet med placebo 2,4 ganger høyere enn hos pasientene behandlet med PEPCID. De 89 pasientene behandlet med PEPCID hadde en kumulativ observert sårforekomst på 23,4 % sammenlignet med en observert sårforekomst på 56,6 % hos de 89 pasientene som fikk placebo (p
Magesår
både en amerikansk og en internasjonal multisenter ble dobbeltblind studie på pasienter med endoskopisk bekreftet aktivt benign magesår, oralt administrert PEPCID 20 mg, 40 mg t, sammenlignet med placebo hs Antacida ble tillatt under studiene, men forbruket var ikke signifikant forskjellig mellom PEPCID- og placebogruppene. Som vist i tabell 2 var forekomsten av sårheling (frafall regnet som uhelbredt) med PEPCID 20 mg statistisk signifikant bedre enn placebo ved uke 6 og 8 i den amerikanske studien, og ved uke 4, 6 og 8 i den internasjonale studien, basert på på antall sår som grodde, bekreftet ved endoskopi.
Tiden til fullstendig lindring av smerte på dagtid og natt var statistisk signifikant kortere for pasienter som fikk PEPCID 20 mg enn for pasienter som fikk placebo; I ingen av studiene var det imidlertid en statistisk signifikant forskjell i andelen pasienter hvis smerte var lindret ved slutten av studien (uke 8).
Gastroøsofageal reflukssykdom (GERD)
Oralt administrert PEPCID ble sammenlignet med placebo i en amerikansk studie som inkluderte pasienter med symptomer på GERD og uten endoskopiske tegn på erosjon eller sårdannelse i spiserøret. PEPCID 20 mg to ganger daglig var statistisk signifikant bedre enn 40 mg t og placebo når det gjaldt å gi et vellykket symptomatisk resultat, definert som moderat eller utmerket forbedring av symptomene (tabell 3).
Etter to ukers behandling ble symptomatisk suksess observert hos en større prosentandel av pasientene som tok PEPCID 20 mg to ganger daglig sammenlignet med placebo (p ≤ 0,01).
Symptomatisk forbedring og helbredelse av endoskopisk verifisert erosjon og sårdannelse ble studert i ytterligere to studier. Tilheling ble definert som fullstendig oppløsning av alle erosjoner eller sårdannelser som er synlige med endoskopi. Den amerikanske studien som sammenlignet PEPCID 40 mg pobid med placebo og PEPCID 20 mg pobid viste en signifikant høyere prosentandel av helbredelse for PEPCID 40 mg to ganger i uke 6 og 12 (tabell 4).
Sammenlignet med placebo hadde pasienter som fikk PEPCID raskere lindring av halsbrann på dagtid og natt, og en større prosentandel av pasientene opplevde fullstendig lindring av halsbrann om natten. Disse forskjellene var statistisk signifikante.
I den internasjonale studien, da PEPCID 40 mg pobid ble sammenlignet med ranitidin 150 mg pobid, ble det observert en statistisk signifikant høyere prosentandel av tilheling med PEPCID 40 mg to ganger i uke 12 (tabell 5). Det var imidlertid ingen signifikant forskjell mellom behandlinger i symptomlindring.
Patologiske hypersekretoriske tilstander (f.eks. Zollinger-Ellison syndrom, multiple endokrine adenomer)
I studier av pasienter med patologiske hypersekretoriske tilstander som Zollinger-Ellisons syndrom med eller uten multiple endokrine adenomer, hemmet PEPCID signifikant magesyresekresjon og kontrollerte assosierte symptomer. Oralt administrerte doser fra 20 til 160 mg q 6 timer holdt basalsyresekresjonen under 10 mEq/time; startdoser ble titrert til den enkelte pasients behov og påfølgende justeringer var nødvendig med tiden hos noen pasienter. PEPCID 40 mg ble godt tolerert ved disse høye dosenivåene i lengre perioder (mer enn 12 måneder) hos åtte pasienter, og det ble ikke rapportert noen tilfeller av gynekomasti, økte prolaktinnivåer eller impotens som ble ansett for å skyldes stoffet.
Klinisk farmakologi hos pediatriske pasienter
Farmakokinetikk
Tabell 6 viser farmakokinetiske data fra kliniske studier og en publisert studie på pediatriske pasienter (
Plasmaclearance er redusert og eliminasjonshalveringstiden forlenges hos pediatriske pasienter i alderen 0-3 måneder sammenlignet med eldre pediatriske pasienter. De farmakokinetiske parametrene for pediatriske pasienter i alderen > 3 måneder-15 år er sammenlignbare med de som oppnås for voksne.
Biotilgjengelighetsstudier av 8 pediatriske pasienter (11-15 år) viste en gjennomsnittlig oral biotilgjengelighet på 0,5 sammenlignet med voksne verdier på 0,42 til 0,49. Orale doser på 0,5 mg/kg oppnådde AUC på 645 ± 249 ng-t/mL og 580 ± 60 ng-t/mL hos pediatriske pasienter
Farmakodynamikk
Farmakodynamikken til famotidin ble evaluert hos 5 pediatriske pasienter i alderen 2-13 år ved bruk av sigmoid Emax-modellen. Disse dataene tyder på at forholdet mellom serumkonsentrasjon av famotidin og magesyresuppresjon er lik det som ble observert i en studie av voksne (tabell 7).
Fem publiserte studier (tabell 8) undersøkte effekten av famotidin på mage-pH og varighet av syresuppresjon hos pediatriske pasienter. Mens hver studie hadde et annet design, er syreundertrykkelsesdata over tid oppsummert som følger:
Varigheten av effekten av famotidin IV 0,5 mg/kg på mage-pH og syresuppresjon ble vist i en studie å være lengre hos pediatriske pasienter
PASIENTINFORMASJON
Ingen informasjon gitt. Vennligst referer til FORHOLDSREGLER seksjon.
