Micardis 20mg, 40mg, 80mg Telmisartan Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Micardis 40mg og hvordan brukes det?
Micardis er et reseptbelagt legemiddel som brukes til å behandle symptomene på høyt blodtrykk (hypertensjon) og for å redusere risikoen for hjerte- og karsykdommer som hjerneslag og hjerteinfarkt. Micardis 20mg kan brukes alene eller sammen med andre medisiner.
Micardis 80mg tilhører en klasse legemidler som kalles ARB.
Det er ikke kjent om Micardis er trygt og effektivt hos barn under 18 år.
Hva er de mulige bivirkningene av Micardis?
Micardis 80mg kan forårsake alvorlige bivirkninger, inkludert:
- . svimmelhet, . opphovning, . rask vektøkning, . kvalme, . svakhet, . prikkende følelse, . brystsmerter, . uregelmessige hjerteslag, og . tap av bevegelse
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Micardis inkluderer:
- . tett nese, . bihulesmerter, . ryggsmerter, og . diaré
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Micardis. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
- . Når graviditet oppdages, seponer MICARDIS 40mg så snart som mulig [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ]. . Legemidler som virker direkte på renin-angiotensin-systemet kan forårsake skade og død for det utviklende fosteret [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
BESKRIVELSE
MICARDIS 40mg er anon-peptid angiotensin II reseptor (type AT1) antagonist.
Telmisartan er kjemisk beskrevet som 4'-[(1,4'-dimethyl-2'-propyl [2,6'-bi-1H-benzimidazol]-1'-yl)methyl ]-[1,1'-bifenyl]-2-karboksylsyre. Dens empiriske formel er C33H30N4O2, dens molekylvekt er 514,63, og dens strukturformel er:
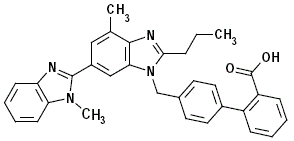
Telmisartan er et hvitt til svakt gulaktig faststoff. Det er praktisk talt uløselig i vann og i pH-området 3 til 9, lite løselig i sterk syre (unntatt uløselig i saltsyre), og løselig i sterk base.
MICARDIS 20 mg er tilgjengelig som tabletter for oral administrering, som inneholder 20 mg, 40 mg eller 80 mg telmisartan. Tablettene inneholder følgende inaktive ingredienser: natriumhydroksid, meglumin, povidon, sorbitol og magnesiumstearat. MICARDIS tabletter er hygroskopiske og krever beskyttelse mot fuktighet.
INDIKASJONER
MICARDIS HCT (telmisartan og hydroklortiazid) er indisert for behandling av hypertensjon for å senke blodtrykket. Senking av blodtrykket reduserer risikoen for dødelige og ikke-dødelige kardiovaskulære hendelser, først og fremst hjerneslag og hjerteinfarkt. Disse fordelene har blitt sett i kontrollerte studier av antihypertensiva fra en lang rekke farmakologiske klasser, inkludert klassene som dette legemidlet hovedsakelig tilhører. Det er ingen kontrollerte studier som viser risikoreduksjon med MICARDIS HCT.
Kontroll av høyt blodtrykk bør være en del av omfattende kardiovaskulær risikostyring, inkludert, etter behov, lipidkontroll, diabetesbehandling, antitrombotisk terapi, røykeslutt, trening og begrenset natriuminntak. Mange pasienter vil kreve mer enn ett medikament for å oppnå blodtrykksmål. For spesifikke råd om mål og ledelse, se publiserte retningslinjer, for eksempel de fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Tallrike antihypertensiva, fra en rekke farmakologiske klasser og med forskjellige virkningsmekanismer, har i randomiserte kontrollerte studier vist seg å redusere kardiovaskulær sykelighet og dødelighet, og det kan konkluderes med at det er blodtrykksreduksjon, og ikke noen annen farmakologisk egenskap av stoffene, som i stor grad er ansvarlig for disse fordelene. Den største og mest konsistente fordelen for kardiovaskulær utfall har vært en reduksjon i risikoen for hjerneslag, men reduksjoner i hjerteinfarkt og kardiovaskulær dødelighet har også blitt sett regelmessig.
Forhøyet systolisk eller diastolisk trykk forårsaker økt kardiovaskulær risiko, og den absolutte risikoøkningen per mmHg er større ved høyere blodtrykk, slik at selv beskjedne reduksjoner av alvorlig hypertensjon kan gi betydelig fordel. Relativ risikoreduksjon fra blodtrykksreduksjon er lik på tvers av populasjoner med varierende absolutt risiko, så den absolutte fordelen er større hos pasienter som har høyere risiko uavhengig av deres hypertensjon (for eksempel pasienter med diabetes eller hyperlipidemi), og slike pasienter kan forventes å dra nytte av mer aggressiv behandling til et lavere blodtrykksmål.
Noen antihypertensiva har mindre blodtrykkseffekter (som monoterapi) hos svarte pasienter, og mange antihypertensiva har ytterligere godkjente indikasjoner og effekter (f.eks. på angina, hjertesvikt eller diabetisk nyresykdom). Disse hensynene kan lede valg av terapi [se Kliniske studier ].
MICARDIS 40mg HCT er ikke indisert for initial behandling for behandling av hypertensjon [se DOSERING OG ADMINISTRASJON ].
MICARDIS HCT kan brukes alene eller i kombinasjon med andre antihypertensiva.
DOSERING OG ADMINISTRASJON
Doseringsinformasjon
Start en pasient hvis blodtrykk ikke er tilstrekkelig kontrollert med telmisartan monoterapi 80 mg på MICARDIS 40 mg HCT, 80 mg/12,5 mg én gang daglig. Dosen kan titreres opp til 160 mg/25 mg etter 2 til 4 uker, om nødvendig.
Start en pasient hvis blodtrykk ikke er tilstrekkelig kontrollert med 25 mg hydroklortiazid én gang daglig, eller er kontrollert, men som opplever hypokalemi, med dette regimet på MICARDIS HCT 80 mg/12,5 mg én gang daglig. Dosen kan titreres opp til 160 mg/25 mg etter 2 til 4 uker, om nødvendig.
Pasienter titrert til de individuelle komponentene (telmisartan og hydroklortiazid) kan i stedet få den tilsvarende dosen MICARDIS 20 mg HCT.
MICARDIS 20mg HCT kan gis sammen med andre antihypertensiva.
Dosejustering for nedsatt leverfunksjon
Initier pasienter med biliær obstruktive lidelser eller leversvikt under nøye medisinsk tilsyn med kombinasjonen 40 mg/12,5 mg. MICARDIS 40mg HCT tabletter anbefales ikke til pasienter med alvorlig nedsatt leverfunksjon [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
Viktige administrasjonsinstruksjoner
MICARDIS HCT tabletter skal ikke fjernes fra blisterpakninger før rett før administrering.
HVORDAN LEVERES
Doseringsformer og styrker
- . 40 mg/12,5 mg, røde og hvite tabletter merket med Boehringer Ingelheim-logoen og H4 . 80 mg/12,5 mg, røde og hvite tabletter merket med Boehringer Ingelheim-logoen og H8 . 80 mg/25 mg, gule og hvite tabletter merket med Boehringer Ingelheim-logoen og H9
Oppbevaring og håndtering
MICARDIS 20mg HCT er tilgjengelig i tre styrker som bikonvekse tolags, avlange, ubelagte tabletter som inneholder telmisartan og hydroklortiazid:
- . 40 mg/12,5 mg tablett: rødt og hvitt (kan inneholde røde flekker) merket med Boehringer Ingelheim-selskapssymbolet og H4; individuelt blisterforseglet i kartonger med 30 tabletter som 3 x 10 kort ( NDC 0597-0043-37) . 80 mg/12,5 mg tablett: rødt og hvitt (kan inneholde røde flekker) merket med Boehringer Ingelheim-selskapssymbolet og H8; individuelt blisterforseglet i kartonger med 30 tabletter som 3 x 10 kort ( NDC 0597-0044-37) . 80 mg/25 mg tablett: gult og hvitt (kan inneholde gule flekker) merket med Boehringer Ingelheim-selskapssymbolet og H9; individuelt blisterforseglet i kartonger med 30 tabletter som 3 x 10 kort ( NDC 0597-0042-37)
Oppbevaring
Oppbevares ved 25°C (77°F); utflukter tillatt til 15°C-30°C (59°F-86°F) [se USP-kontrollert romtemperatur]. Tabletter bør ikke fjernes fra blisterpakninger før umiddelbart før administrering.
Distribuert av: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Revidert: oktober 2018
BIVIRKNINGER
Følgende bivirkninger er omtalt andre steder i merkingen:
- . Hypotensjon [se ADVARSLER OG FORHOLDSREGLER ] . Nedsatt nyrefunksjon [se ADVARSLER OG FORHOLDSREGLER ] . Elektrolytter og metabolske forstyrrelser [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
MICARDIS HCT har blitt evaluert for sikkerhet hos mer enn 1700 pasienter, inkludert 716 behandlet for hypertensjon i mer enn 6 måneder og 420 i mer enn 1 år. Bivirkninger har vært begrenset til de som tidligere er rapportert med telmisartan og/eller hydroklortiazid.
Bivirkninger som oppstår med en forekomst på ≥2 % hos pasienter behandlet med telmisartan/hydroklortiazid og med en høyere hastighet enn hos pasienter behandlet med placebo, er presentert i tabell 1 [se Kliniske studier ].
Andre bivirkninger observert for telmisartan/hydroklortiazid var: smerte (inkludert rygg og abdominal), dyspepsi, erytem, oppkast, bronkitt og faryngitt.
Bivirkninger forekom med omtrent samme hyppighet hos menn og kvinner, eldre og yngre pasienter og svarte og ikke-svarte pasienter.
Telmisartan
Andre bivirkninger som er rapportert med telmisartan er listet opp nedenfor:
Autonome nervesystem: impotens, økt svetting, rødming
Kroppen som helhet: allergi, feber, bensmerter, brystsmerter
Kardiovaskulær: hjertebank, angina pectoris, unormalt EKG, hypertensjon, perifert ødem
Sentralnervesystemet: søvnløshet, somnolens, migrene, parestesi, ufrivillige muskelsammentrekninger, hypoestesi
Gastrointestinale: flatulens, forstoppelse, gastritt, munntørrhet, hemoroider, gastroøsofageal refluks, tannpine
Hepato-galleveier: økning av leverenzymer eller serumbilirubin
Metabolsk: gikt, hyperkolesterolemi, diabetes mellitus
Muskuloskeletal: leddgikt, artralgi, leggkramper, myalgi
Psykiatrisk: angst, depresjon, nervøsitet
Motstandsmekanisme: infeksjon, abscess, mellomørebetennelse
Luftveiene: astma, rhinitt, dyspné, neseblødning
Hud: dermatitt, eksem, kløe
Urin: vannlatingsfrekvens, blærebetennelse
Vaskulær: cerebrovaskulær lidelse
Spesielle sanser: unormalt syn, konjunktivitt, tinnitus, øreverk
Hydroklortiazid
Andre bivirkninger som er rapportert med hydroklortiazid er listet opp nedenfor:
Kroppen som helhet: svakhet
Fordøyelsessystemet: pankreatitt, gulsott (intrahepatisk kolestatisk gulsott), sialadenitt, kramper, gastrisk irritasjon
Hematologisk: aplastisk anemi, agranulocytose, leukopeni, hemolytisk anemi, trombocytopeni
Overfølsomhet: purpura, lysfølsomhet, urticaria, nekrotiserende angiitt (vaskulitt og kutan vaskulitt), feber, pustebesvær inkludert pneumonitt og lungeødem, anafylaktiske reaksjoner
Metabolsk: hyperglykemi, glykosuri
Muskuloskeletal: muskelspasme
Nervesystem/psykiatrisk: rastløshet
Nyre: interstitiell nefritt
Hud: erythema multiforme inkludert Stevens-Johnsons syndrom, eksfoliativ dermatitt inkludert toksisk epidermal nekrolyse
Spesielle sanser: forbigående tåkesyn, xantopsi
Kliniske laboratoriefunn
Kreatinin, blodurea nitrogen (BUN)
Økning i BUN (≥11,2 mg/dL) og serumkreatinin (≥0,5 mg/dL) ble observert hos henholdsvis 2,8 % og 1,4 % av pasientene med essensiell hypertensjon behandlet med MICARDIS 80 mg HCT-tabletter i kontrollerte studier. Ingen pasienter avbrøt behandlingen med MICARDIS 80 mg HCT-tabletter på grunn av en økning i BUN eller kreatinin [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av MICARDIS HCT etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å estimere frekvensen pålitelig eller etablere en årsakssammenheng med legemiddeleksponering.
Blod og lymfesystem lidelser: eosinofili
Hjertelidelser: atrieflimmer, kongestiv hjertesvikt, hjerteinfarkt, takykardi, bradykardi
Øre- og labyrintlidelser: svimmelhet
Generelle lidelser og administrasjonsbetingelser: asteni, ødem
Hepato-galleveier: Unormal leverfunksjon/leversykdom
Forstyrrelser i immunsystemet: anafylaktisk reaksjon
Infeksjoner og angrep: urinveisinfeksjon
Undersøkelser: økt CPK
Metabolisme og ernæringsforstyrrelser: hypoglykemi (hos diabetespasienter)
Muskel- og bindevevslidelser: senesmerter (inkludert senebetennelse, tenosynovitt), rabdomyolyse
Forstyrrelser i nervesystemet: synkope, hodepine
Nyre- og urinveislidelser: nyresvikt, nedsatt nyrefunksjon inkludert akutt nyresvikt
Reproduktive system og brystsykdommer: erektil dysfunksjon
Respiratoriske, thorax- og mediastinumsykdommer: hoste
Hud- og subkutane vevslidelser: legemiddelutbrudd (toksisk hudutbrudd hovedsakelig rapportert som toksikoderma, utslett og urticaria), angioødem (med dødelig utgang)
Vaskulær lidelse: ortostatisk hypotensjon
NARKOTIKAHANDEL
Midler som øker serumkalium
Samtidig administrering av telmisartan med andre legemidler som øker serumkaliumnivået kan føre til hyperkalemi. Overvåk serumkalium hos slike pasienter.
Litium
Økning i serumlitiumkonsentrasjoner og litiumtoksisitet er rapportert ved samtidig bruk av tiaziddiuretika eller angiotensin II-reseptorantagonister, inkludert telmisartan. Overvåk litiumnivåer hos pasienter som får MICARDIS 80mg HCT og litium.
Ikke-steroide antiinflammatoriske midler, inkludert selektive cyclooxygenas E-2-hemmere
Telmisartan
Ikke-steroide antiinflammatoriske midler inkludert selektive cyklooksygenase-2-hemmere (COX-2-hemmere): Hos eldre pasienter, volummangel (inkludert de som er på diuretikabehandling), eller med nedsatt nyrefunksjon, samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med ARB, inkludert telmisartan, kan føre til forverring av nyrefunksjonen, inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Den antihypertensive effekten av ARB kan svekkes av NSAIDs. Overvåk derfor nyrefunksjon og blodtrykk regelmessig hos pasienter som får MICARDIS 40 mg HCT og NSAIDs.
Hydroklortiazid
Administrering av et ikke-steroidt antiinflammatorisk middel, inkludert en selektiv COX2-hemmer, kan redusere de vanndrivende, natriuretiske og antihypertensive effektene av diuretika. Derfor, når MICARDIS HCT og ikke-steroide antiinflammatoriske midler inkludert selektive COX2-hemmere brukes samtidig, observer nøye for å avgjøre om den ønskede effekten av diuretikaet oppnås.
Dobbel blokade av Renin-Angiotens In-Aldosteron-systemet og endringer i nyrefunksjonen
Dobbel blokkering av renin-angiotensin-aldosteron-systemet (RAS) med angiotensinblokkere, ACE-hemmere eller aliskiren er assosiert med økt risiko for hypotensjon, hyperkalemi og nedsatt nyrefunksjon. ONTARGET-studien inkluderte 25 620 pasienter ≥55 år gamle med aterosklerotisk sykdom eller diabetes med endeorganskade, randomiserte dem til kun telmisartan (ARB), kun ramipril (ACE-hemmer) eller kombinasjonen, og fulgte dem i en median på 56 måneder . Pasienter som fikk kombinasjonen av ARB og ACE-hemmer oppnådde ingen ytterligere fordel (ingen ytterligere reduksjon av risiko for kardiovaskulær død, hjerteinfarkt, hjerneslag eller sykehusinnleggelse fra hjertesvikt) sammenlignet med ARB monoterapi eller ACE-hemmer monoterapi, men opplevde en økt forekomst av nyresvikt (f.eks. akutt nyresvikt) sammenlignet med monoterapigrupper.
Generelt, unngå kombinert bruk av RAS-hemmere. Overvåk blodtrykk, nyrefunksjon og elektrolytter nøye hos pasienter på MICARDIS 40 mg HCT og andre midler som påvirker RAS.
Ikke gi aliskiren samtidig med MICARDIS HCT hos pasienter med diabetes. Unngå samtidig bruk av aliskiren og MICARDIS HCT hos pasienter med nedsatt nyrefunksjon (GFR
Digoksin
Når telmisartan ble administrert samtidig med digoksin, ble median økning i maksimal plasmakonsentrasjon av digoksin (49 %) og bunnkonsentrasjon (20 %) observert. Overvåk digoksinnivåer hos pasienter som samtidig tar MICARDIS 40 mg HCT og digoksin.
Antidiabetiske legemidler (orale midler og insulin)
Dosejustering av antidiabetika kan være nødvendig når de administreres samtidig med hydroklortiazid.
Kolestyramin og kolestipolharpikser
Absorpsjon av hydroklortiazid er svekket i nærvær av anionbytterharpikser. Fordel doseringen av hydroklortiazid og harpiksen slik at hydroklortiazid administreres minst 4 timer før eller 4 til 6 timer etter administrering av harpiksen.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Fostertoksisitet
Telmisartan
Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer MICARDIS HCT så snart som mulig.
Hydroklortiazid
Tiazider krysser placentabarrieren og vises i navlestrengsblod. Bivirkninger inkluderer føtal eller neonatal gulsott og trombocytopeni [se Bruk i spesifikke populasjoner ].
Hypotensjon hos pasienter med volum-eller saltfattige
Hos pasienter med et aktivert renin-angiotensin-system, som pasienter med volum- eller saltfattige (f.eks. de som behandles med høye doser diuretika), kan symptomatisk hypotensjon oppstå etter initialisering av behandling med MICARDIS HCT. Korriger volum eller saltmangel før administrering av MICARDIS 80 mg HCT.
Nedsatt nyrefunksjon
Endringer i nyrefunksjonen inkludert akutt nyresvikt kan være forårsaket av legemidler som hemmer reninangiotensinsystemet og av diuretika. Pasienter hvis nyrefunksjon delvis kan avhenge av aktiviteten til renin-angiotensin-systemet (f.eks. pasienter med nyrearteriestenose, kronisk nyresykdom, alvorlig kongestiv hjertesvikt eller volumdeplesjon) kan ha særlig risiko for å utvikle oliguri, progressiv azotemi , eller akutt nyresvikt på MICARDIS HCT. Overvåk nyrefunksjonen med jevne mellomrom hos disse pasientene. Vurder å holde tilbake eller avbryte behandlingen hos pasienter som utvikler en klinisk signifikant reduksjon i nyrefunksjonen på MICARDIS HCT.
Elektrolytter og metabolske forstyrrelser
Legemidler, inkludert telmisartan, som hemmer renin-angiotensin-systemet kan forårsake hyperkalemi, spesielt hos pasienter med nyresvikt, diabetes, eller kombinasjonsbruk med andre angiotensinreseptorblokkere eller ACE-hemmere og samtidig bruk av andre legemidler som øker serumkaliumnivået [se NARKOTIKAHANDEL ].
Hydroklortiazid kan forårsake hypokalemi og hyponatremi. Tiazider har vist seg å øke urinutskillelsen av magnesium; dette kan føre til hypomagnesemi. Hypomagnesemi kan resultere i hypokalemi som kan være vanskelig å behandle til tross for kaliumreplesjon. Overvåk serumelektrolytter med jevne mellomrom.
I kontrollerte studier med kombinasjonsbehandlingen telmisartan/hydroklortiazid, opplevde ingen pasienter administrert 40 mg/12,5 mg, 80 mg/12,5 mg eller 80 mg/25 mg en reduksjon i kalium ≥1,4 mekv/l, og ingen pasienter opplevde hyperkalemi.
Hydroklortiazid reduserer kalsiumutskillelsen i urinen og kan forårsake forhøyede serumkalsium.
Hydroklortiazid kan endre glukosetoleransen og øke serumnivået av kolesterol og triglyserider.
Hyperurikemi kan forekomme eller åpen gikt kan utløses hos enkelte pasienter som får tiazidbehandling. Fordi telmisartan reduserer urinsyre, demper telmisartan i kombinasjon med hydroklortiazid den diuretika-induserte hyperurikemien.
Overfølsomhetsreaksjon
Hydroklortiazid
Overfølsomhetsreaksjoner overfor hydroklortiazid kan forekomme hos pasienter med eller uten en historie med allergi eller bronkial astma, men er mer sannsynlig hos pasienter med en slik historie [se KONTRAINDIKASJONER ].
Akutt nærsynthet og sekundær vinkel-lukkende glaukom
Hydroklortiazid, et sulfonamid, kan forårsake en idiosynkratisk reaksjon, som resulterer i akutt forbigående nærsynthet og akutt vinkel-lukkende glaukom. Symptomer inkluderer akutt innsettende nedsatt synsskarphet eller øyesmerter og oppstår vanligvis innen timer til uker etter medikamentstart. Ubehandlet akutt vinkel-lukkende glaukom kan føre til permanent synstap. Den primære behandlingen er å seponere hydroklortiazid så raskt som mulig. Raske medisinske eller kirurgiske behandlinger må kanskje vurderes hvis det intraokulære trykket forblir ukontrollert. Risikofaktorer for å utvikle akutt vinkelglaukom kan inkludere en historie med sulfonamid- eller penicillinallergi.
Systemisk lupus erythematosus
Tiaziddiuretika er rapportert å forårsake forverring eller aktivering av systemisk lupus erythematosus.
Postsympathectomy pasienter
Den antihypertensive effekten av hydroklortiazid kan forsterkes hos pasienter etter sympatektomi.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Svangerskap
Informer kvinnelige pasienter i fertil alder om konsekvensene av eksponering for MICARDIS 40mg HCT under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Be pasienter rapportere graviditeter til legen så snart som mulig [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Amming
Råd ammende kvinner til ikke å amme under behandling med MICARDIS HCT [se Bruk i spesifikke populasjoner ].
Symptomatisk hypotensjon og synkope
Gi pasienter beskjed om at svimmelhet kan oppstå, spesielt i løpet av de første dagene av behandlingen, og rapporter det til helsepersonell. Informer pasienter om at utilstrekkelig væskeinntak, overdreven svette, diaré eller oppkast kan føre til et for høyt blodtrykksfall, med de samme konsekvensene av svimmelhet og mulig synkope. Råd pasienter til å kontakte helsepersonell dersom synkope oppstår [se ADVARSLER OG FORHOLDSREGLER ].
Kaliumtilskudd
Råd pasienter om å ikke bruke kaliumtilskudd eller salterstatninger som inneholder kalium uten å konsultere den forskrivende helsepersonell [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ].
Akutt nærsynthet og sekundær vinkel-lukkende glaukom
Råd pasientene til å seponere MICARDIS 80mg HCT og søke øyeblikkelig legehjelp hvis de opplever symptomer på akutt nærsynthet eller sekundær vinkelglaukom [se ADVARSLER OG FORHOLDSREGLER ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Telmisartan og hydroklortiazid
Ingen karsinogenitet, mutagenitet eller fertilitetsstudier er utført med kombinasjonen telmisartan og hydroklortiazid.
Telmisartan
Det var ingen tegn på karsinogenitet når telmisartan ble administrert i dietten til mus og rotter i opptil 2 år. De høyeste dosene gitt til mus (1000 mg/kg/dag) og rotter (100 mg/kg/dag) er, på mg/m2-basis, henholdsvis ca. 59 og 13 ganger den maksimale anbefalte humane dosen (MRHD) av telmisartan. De samme dosene har vist seg å gi gjennomsnittlig systemisk eksponering for telmisartan >100 ganger og >25 ganger, henholdsvis den systemiske eksponeringen hos mennesker som får MRHD av telmisartan (80 mg/dag).
Genotoksisitetsanalyser avslørte ingen telmisartan-relaterte effekter verken på gen- eller kromosomnivå. Disse testene inkluderte bakterielle mutagenitetstester med Salmonella og E. coli (Ames), en genmutasjonstest med V79-celler fra kinesisk hamster, en cytogenetisk test med humane lymfocytter og en mikronukleustest hos mus.
Ingen medikamentrelaterte effekter på reproduksjonsevnen til hann- og hunnrotter ble observert ved 100 mg/kg/dag (den høyeste administrerte dosen), omtrent 13 ganger, på mg/m2-basis, MRHD for telmisartan. Denne dosen hos rotter resulterte i en gjennomsnittlig systemisk eksponering (telmisartan AUC som bestemt på dag 6 av svangerskapet) minst 50 ganger den gjennomsnittlige systemiske eksponeringen hos mennesker ved MRHD (80 mg/dag).
Hydroklortiazid
To-årige fôringsstudier på mus og rotter utført i regi av National Toxicology Program (NTP) avdekket ingen bevis på et kreftfremkallende potensial for hydroklortiazid hos hunnmus (ved doser på opptil ca. 600 mg/kg/dag) eller hos hanner. og hunnrotter (ved doser på opptil ca. 100 mg/kg/dag). NTP fant imidlertid tvetydige bevis for hepatokarsinogenitet hos hannmus.
Hydroklortiazid var ikke genotoksisk in vitro i Ames-mutagenisitetsanalysen av Salmonella typhimurium-stammer TA 98, TA 100, TA 1535, TA 1537 og TA 1538 og i Chinese Hamster Ovary (CHO)-testen for kromosomavvik ved bruk av vibrasjoner, eller musekimcellekromosomer, benmargskromosomer fra kinesisk hamster og det kjønnsbundne recessive dødelige trekkgenet Drosophila. Positive testresultater ble oppnådd i in vitro CHO Sister Chromatid Exchange (klastogenesitet)-analysen, i muselymfomcelle-analysen (mutagenisitet) og i Aspergillus nidulans non-disjunction-analysen.
Hydroklortiazid hadde ingen bivirkninger på fertiliteten til mus og rotter av begge kjønn i studier der disse artene ble eksponert, via kostholdet, for doser på henholdsvis opptil 100 og 4 mg/kg før paring og gjennom hele svangerskapet.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
MICARDIS HCT kan forårsake fosterskader når det gis til en gravid kvinne. Bruk av legemidler som virker på renin-angiotensin-systemet i andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død (se Kliniske betraktninger ). De fleste epidemiologiske studier som undersøker føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester har ikke skilt medisiner som påvirker renin-angiotensin-systemet fra andre antihypertensiva. Studier på rotter og kaniner med telmisartan viste føtotoksisitet kun ved maternal toksiske doser (se Data ). Når graviditet oppdages, seponer MICARDIS HCT så snart som mulig.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Sykdomsrelatert risiko for mor og/eller embryo/foster
Hypertensjon i svangerskapet øker mors risiko for svangerskapsforgiftning, svangerskapsdiabetes, for tidlig fødsel og fødselskomplikasjoner (f.eks. behov for keisersnitt og blødning etter fødsel). Hypertensjon øker fosterets risiko for intrauterin vekstbegrensning og intrauterin død. Gravide kvinner med hypertensjon bør overvåkes nøye og behandles deretter.
Fetale/neonatale bivirkninger
Telmisartan
Bruk av legemidler som virker på RAS i andre og tredje trimester av svangerskapet kan resultere i følgende: oligohydramnios, redusert føtal nyrefunksjon som fører til anuri og nyresvikt, føtal lungehypoplasi, skjelettdeformasjoner, inkludert hodeskallehypoplasi, hypotensjon og død . I det uvanlige tilfellet at det ikke er noe passende alternativ til behandling med legemidler som påvirker renin-angiotensin-systemet for en bestemt pasient, informere moren om den potensielle risikoen for fosteret.
Hos pasienter som tar MICARDIS HCT under graviditet, utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Fostertesting kan være aktuelt, basert på svangerskapsuken. Hvis oligohydramnios observeres, seponer MICARDIS HCT, med mindre det anses som livreddende for moren. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade.
Følg nøye med spedbarn med historie om in utero eksponering for MICARDIS 20mg HCT for hypotensjon, oliguri og hyperkalemi. Hvis oliguri eller hypotensjon oppstår, støtte blodtrykk og nyreperfusjon. Utvekslingstransfusjoner eller dialyse kan være nødvendig som et middel for å reversere hypotensjon og erstatte nyrefunksjonen [se Bruk i spesifikke populasjoner ].
Hydroklortiazid
Tiazider krysser placenta, og bruk av tiazider under graviditet er assosiert med risiko for føtal eller neonatal gulsott, trombocytopeni og mulige andre bivirkninger som har oppstått hos voksne.
Data
Dyredata
MICARDIS 40mg HCT
En utviklingstoksisitetsstudie ble utført på rotter med telmisartan/hydroklortiaziddoser på 3,2/1,0, 15/4,7, 50/15,6 og 0/15,6 mg/kg/dag. Selv om de to høyere dosekombinasjonene så ut til å være mer toksiske (betydelig reduksjon i kroppsvektøkning) for mørne enn begge medikamentene alene, så det ikke ut til å være en økning i toksisitet for de utviklende embryoene.
Telmisartan
Ingen teratogene effekter ble observert når telmisartan ble administrert til drektige rotter i orale doser på opptil 50 mg/kg/dag og til drektige kaniner ved orale doser på opptil 45 mg/kg/dag. Hos kaniner ble embryodødelighet assosiert med maternell toksisitet (redusert kroppsvektøkning og matforbruk) observert ved 45 mg/kg/dag (omtrent 12 ganger maksimal anbefalt human dose [MRHD] på 80 mg på mg/m2 basis). Hos rotter ble det observert at maternalt toksiske (redusert kroppsvektøkning og matforbruk) telmisartandoser på 15 mg/kg/dag (omtrent 1,9 ganger MRHD på mg/m2-basis), administrert sent i svangerskapet og amming, ga uønskede effekter. hos nyfødte, inkludert redusert levedyktighet, lav fødselsvekt, forsinket modning og redusert vektøkning. De ikke-observerte effektdosene for utviklingstoksisitet hos rotter og kaniner, henholdsvis 5 og 15 mg/kg/dag, er henholdsvis omtrent 0,64 og 3,7 ganger, på mg/m2-basis, MRHD for telmisartan (80 mg/dag) ).
Hydroklortiazid
Studier der hydroklortiazid ble administrert til gravide mus og rotter i deres respektive perioder med større organogenese i doser opp til henholdsvis 3000 og 1000 mg/kg/dag (omtrent 600 og 400 ganger MRHD), ga ingen bevis for skade på fosteret .
Tiazider kan krysse placenta, og konsentrasjoner som nås i navlestrengen nærmer seg de i mors plasma. Hydroklortiazid, som andre diuretika, kan forårsake placenta hypoperfusjon. Det akkumuleres i fostervannet, med rapporterte konsentrasjoner opptil 19 ganger høyere enn i plasma i navlestrengen. Bruk av tiazider under graviditet er forbundet med en risiko for føtal eller neonatal gulsott eller trombocytopeni. Siden de ikke forhindrer eller endrer forløpet av EPH (Ødem, Proteinuri, Hypertensjon) gestose (preeklampsi), bør disse legemidlene ikke brukes til å behandle hypertensjon hos gravide kvinner. Bruk av hydroklortiazid for andre indikasjoner (f.eks. hjertesykdom) under graviditet bør unngås.
Amming
Risikosammendrag
Det er ingen informasjon om tilstedeværelsen av MICARDIS 20 mg HCT eller telmisartan i morsmelk, effekten på spedbarnet som ammes eller effekten på melkeproduksjonen. Begrensede publiserte studier rapporterer at hydroklortiazid finnes i morsmelk. Det er imidlertid utilstrekkelig informasjon til å fastslå effekten av hydroklortiazid på det ammede spedbarnet eller effekten av hydroklortiazid på melkeproduksjonen. Telmisartan finnes i melken til diegivende rotter. (se Data ). På grunn av potensialet for alvorlige bivirkninger hos spedbarn som ammes, inkludert hypotensjon, hyperkalemi og nedsatt nyrefunksjon, bør en ammende kvinne rådes til ikke å amme under behandling med MICARDIS HCT.
Data
Telmisartan var til stede i melken til diegivende rotter i konsentrasjoner 1,5 til 2 ganger de som ble funnet i plasma fra 4 til 8 timer etter administrering.
Pediatrisk bruk
Sikkerhet og effektivitet av MICARDIS HCT hos pediatriske pasienter er ikke fastslått.
Nyfødte med en historie med in utero eksponering for MICARDIS HCT
Hvis oliguri eller hypotensjon oppstår, støtte blodtrykk og nyreperfusjon. Utvekslingstransfusjoner eller dialyse kan være nødvendig for å reversere hypotensjon og/eller erstatte forstyrret nyrefunksjon.
Geriatrisk bruk
de kontrollerte kliniske studiene (n=1017) var omtrent 20 % av pasientene behandlet med telmisartan/hydroklortiazid 65 år eller eldre, og 5 % var 75 år eller eldre. Ingen generelle forskjeller i effektivitet og sikkerhet av telmisartan/hydroklortiazid ble observert hos disse pasientene sammenlignet med yngre pasienter. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes. Generelt bør dosevalg for en eldre pasient være forsiktig, vanligvis med start i den lave enden av doseringsområdet, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon og samtidige sykdommer eller annen medikamentell behandling.
Bruk hos pasienter med nedsatt leverfunksjon
Pasienter med biliær obstruktive lidelser eller leverinsuffisiens bør starte behandling under nøye medisinsk tilsyn med kombinasjonen 40 mg/12,5 mg.
Telmisartan
Siden mesteparten av telmisartan elimineres ved galleutskillelse, kan pasienter med biliær obstruktive lidelser eller leverinsuffisiens forventes å ha redusert clearance og høyere blodnivåer.
Hydroklortiazid
Mindre endringer i væske- og elektrolyttbalansen kan utløse leverkoma hos pasienter med nedsatt leverfunksjon eller progressiv leversykdom.
Bruk hos pasienter med nedsatt nyrefunksjon
Sikkerhet og effektivitet av MICARDIS 40 mg HCT hos pasienter med alvorlig nedsatt nyrefunksjon (CrCl ≤30 ml/min) er ikke fastslått. Hos pasienter med alvorlig nedsatt nyrefunksjon anbefales ikke MICARDIS 80 mg HCT-tabletter. Ingen dosejustering er nødvendig hos pasienter med lett (CrCl 60 til 90 ml/min) eller moderat (CrCl 30 til 60 ml/min) nedsatt nyrefunksjon.
OVERDOSE
Telmisartan
Begrensede data er tilgjengelige med hensyn til overdosering av telmisartan hos mennesker. De mest sannsynlige manifestasjonene av overdosering med telmisartan er hypotensjon, svimmelhet og takykardi; bradykardi kan oppstå fra parasympatisk (vagal) stimulering. Hvis symptomatisk hypotensjon skulle oppstå, bør støttende behandling settes i gang. Telmisartan fjernes ikke ved hemodialyse.
Hydroklortiazid
De vanligste tegnene og symptomene som er observert hos pasienter med en overdose av hydroklortiazid er de forårsaket av elektrolyttmangel (hypokalemi, hypokloremi, hyponatremi) og dehydrering som følge av overdreven diurese. Hvis digitalis også har blitt administrert, kan hypokalemi fremheve hjertearytmier. I hvilken grad hydroklortiazid fjernes ved hemodialyse er ikke fastslått. Den orale LD av hydroklortiazid er større enn 10 g/kg hos både mus og rotter.
KONTRAINDIKASJONER
MICARDIS HCT er kontraindisert:
- . Hos pasienter som er overfølsomme overfor noen komponent i dette produktet [se ADVARSLER OG FORHOLDSREGLER ]. . Hos pasienter med anuri. . For samtidig administrering med aliskiren hos pasienter med diabetes [se NARKOTIKAHANDEL ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
MICARDIS 40mg HCT
MICARDIS 20mg HCT er en kombinasjon av to legemidler med antihypertensive egenskaper: et tiaziddiuretikum, hydroklortiazid og en angiotensin II-reseptorblokker (ARB), telmisartan.
Telmisartan
Angiotensin II dannes fra angiotensin I i en reaksjon katalysert av angiotensin-konverterende enzym (ACE, kininase II). Angiotensin II er det viktigste pressormiddelet i renin-angiotensin-systemet, med effekter som inkluderer vasokonstriksjon, stimulering av syntese og frigjøring av aldosteron, hjertestimulering og nyreabsorpsjon av natrium. Telmisartan blokkerer de vasokonstriktor- og aldosteronutskillende effektene av angiotensin II ved selektivt å blokkere bindingen av angiotensin II til AT1-reseptoren i mange vev, slik som vaskulær glatt muskulatur og binyrene. Virkningen er derfor uavhengig av veiene for angiotensin II-syntese.
Det er også en AT2-reseptor funnet i mange vev, men AT2 er ikke kjent for å være assosiert med kardiovaskulær homeostase. Telmisartan har mye større affinitet (>3000 ganger) for AT1-reseptoren enn for AT2-reseptoren.
Telmisartan hemmer ikke ACE (kininase II) og binder heller ikke til eller blokkerer andre hormonreseptorer eller ionekanaler som er kjent for å være viktige for kardiovaskulær regulering.
Blokkering av angiotensin II-reseptoren hemmer den negative regulatoriske tilbakemeldingen av angiotensin II på reninsekresjon, men den resulterende økte plasmareninaktiviteten og angiotensin II sirkulerende nivåer overvinner ikke effekten av telmisartan på blodtrykket.
Hydroklortiazid
Hydroklortiazid er et tiaziddiuretikum. Tiazider påvirker de renale tubulære mekanismene for elektrolyttreabsorpsjon, og øker direkte utskillelsen av natriumsalt og klorid i omtrent tilsvarende mengder. Indirekte reduserer den diuretiske virkningen av hydroklortiazid plasmavolum, med påfølgende økning i plasmareninaktivitet, økning i aldosteronsekresjon, økning i urintap av kalium og reduksjon i serumkalium. Renin-aldosteron-koblingen er mediert av angiotensin II, så samtidig administrering av en ARB har en tendens til å reversere kaliumtapet forbundet med disse diuretika. Mekanismen for den antihypertensive effekten av tiazider er ikke fullt ut forstått.
Farmakodynamikk
Telmisartan
Hos normale frivillige hemmet en dose telmisartan 80 mg pressorresponsen på en intravenøs infusjon av angiotensin II med ca. 90 % ved maksimale plasmakonsentrasjoner med ca. 40 % inhibering vedvarende i 24 timer.
Plasmakonsentrasjonen av angiotensin II og plasmareninaktiviteten økte på en doseavhengig måte etter enkel administrering av telmisartan til friske personer og gjentatt administrering til hypertensive pasienter. Administrering én gang daglig av opptil 80 mg telmisartan til friske personer påvirket ikke plasmaaldosteronkonsentrasjonen. I flerdosestudier med hypertensive pasienter var det ingen klinisk signifikante endringer i elektrolytter (serumkalium eller natrium) eller i metabolsk funksjon (inkludert serumnivåer av kolesterol, triglyserider, HDL, LDL, glukose eller urinsyre).
Den antihypertensive effekten av telmisartan har blitt studert i seks placebokontrollerte kliniske studier inkludert totalt 1773 pasienter med mild til moderat hypertensjon (diastolisk blodtrykk på 95 til 114 mmHg), hvorav 1031 ble behandlet med telmisartan. Etter administrering én gang daglig av telmisartan, var størrelsen på blodtrykksreduksjonen fra baseline etter placebo-subtraksjon omtrent (SBP/DBP) 6-8/6 mmHg for 20 mg, 9-13/6-8 mmHg for 40 mg og 12 -13/7-8 mmHg for 80 mg. Større doser (opptil 160 mg) så ikke ut til å forårsake ytterligere reduksjon i blodtrykket.
Utbruddet av antihypertensiv aktivitet skjer innen 3 timer, med en maksimal reduksjon på ca. 4 uker. Ved doser på 20, 40 og 80 mg ble den antihypertensive effekten ved administrering av telmisartan én gang daglig opprettholdt i hele 24-timers doseintervallet.
Hos 30 hypertensive pasienter med normal nyrefunksjon behandlet i 8 uker med telmisartan 80 mg eller telmisartan 80 mg i kombinasjon med hydroklortiazid 12,5 mg, var det ingen klinisk signifikante endringer fra baseline i renal blodstrøm, glomerulær filtrasjonshastighet, filtrasjonsfraksjon, renovaskulær motstand, eller kreatininclearance.
Hydroklortiazid
Etter oral administrering av hydroklortiazid begynner diuresen innen 2 timer, topper etter ca. 4 timer og varer ca. 6 til 12 timer.
Narkotikahandel
Hydroklortiazid
Alkohol, barbiturater eller narkotika
Potensering av ortostatisk hypotensjon kan forekomme.
Skjelettmuskelavslappende midler
Mulig økt respons på muskelavslappende midler som curare-derivater.
Kortikosteroider, ACTH
Forsterket elektrolyttmangel, spesielt hypokalemi.
Pressoraminer (f.eks. noradrenalin)
Mulig redusert respons på pressoraminer, men ikke tilstrekkelig til å utelukke bruken av dem.
Farmakokinetikk
Telmisartan
Absorpsjon:
Etter oral administrering oppnås maksimale konsentrasjoner (Cmax ) av telmisartan 0,5 til 1 time etter dosering. Mat reduserer biotilgjengeligheten til telmisartan noe, med en reduksjon i arealet under plasmakonsentrasjon-tid-kurven (AUC) på ca. 6 % med 40 mg og ca. 20 % etter en dose på 160 mg. MICARDIS 20mg HCT kan administreres med eller uten mat. Den absolutte biotilgjengeligheten til telmisartan er doseavhengig. Ved 40 og 160 mg var biotilgjengeligheten henholdsvis 42 % og 58 %. Farmakokinetikken til telmisartan med oralt administrert MICARDIS 20 mg er ikke-lineær over doseområdet 20 til 160 mg, med større enn proporsjonale økninger av plasmakonsentrasjoner (Cmax og AUC) med økende doser. Telmisartan viser bi-eksponentiell forfallskinetikk med en terminal eliminasjonshalveringstid på ca. 24 timer. Lavplasmakonsentrasjoner av telmisartan med dosering én gang daglig er omtrent 10 % til 25 % av maksimale plasmakonsentrasjoner. Telmisartan har en akkumuleringsindeks i plasma på 1,5 til 2,0 ved gjentatt dosering én gang daglig.
Fordeling:
Telmisartan er sterkt bundet til plasmaproteiner (>99,5%), hovedsakelig albumin og α1-syreglykoprotein. Plasmaproteinbinding er konstant over konsentrasjonsområdet som oppnås med anbefalte doser. Distribusjonsvolumet for telmisartan er omtrent 500 liter, noe som indikerer ytterligere vevsbinding.
Metabolisme:
Telmisartan metaboliseres ved konjugering for å danne et farmakologisk inaktivt acylglukuronid; glukuronid av moderforbindelsen er den eneste metabolitten som er identifisert i humant plasma og urin. Etter en enkelt dose representerer glukuronidet omtrent 11 % av den målte radioaktiviteten i plasma. Cytokrom P450 isoenzymene er ikke involvert i metabolismen av telmisartan.
Eliminering:
Etter enten intravenøs eller oral administrering av 14C-merket telmisartan, ble det meste av den administrerte dosen (>97 %) eliminert uendret i feces via galleutskillelse; det ble kun funnet små mengder i urinen (henholdsvis 0,91 % og 0,49 % av total radioaktivitet).
Total plasmaclearance for telmisartan er >800 ml/min. Terminal halveringstid og total clearance ser ut til å være uavhengig av dose.
Hydroklortiazid
Hydroklortiazid metaboliseres ikke, men elimineres raskt av nyrene. Når plasmanivåene er fulgt i minst 24 timer, har plasmahalveringstiden blitt observert å variere mellom 5,6 og 14,8 timer. Minst 61 % av den orale dosen elimineres uendret innen 24 timer.
Hydroklortiazid krysser placenta, men ikke blod-hjerne-barrieren og skilles ut i morsmelk.
Spesifikke populasjoner
Telmisartan
Nyreinsuffisiens
Telmisartan fjernes ikke fra blod ved hemofiltrering [se ADVARSLER OG FORHOLDSREGLER , og Bruk i spesifikke populasjoner ].
Leverinsuffisiens
Hos pasienter med leverinsuffisiens øker plasmakonsentrasjonen av telmisartan, og absolutt biotilgjengelighet nærmer seg 100 % [se Bruk i spesifikke populasjoner ].
Kjønn
Plasmakonsentrasjoner av telmisartan er vanligvis 2 til 3 ganger høyere hos kvinner enn hos menn. I kliniske studier ble det imidlertid ikke funnet noen signifikant økning i blodtrykksrespons eller forekomst av ortostatisk hypotensjon hos kvinner. Ingen dosejustering er nødvendig.
Geriatriske pasienter
Farmakokinetikken til telmisartan er ikke forskjellig mellom eldre og de yngre enn 65 år.
Legemiddelinteraksjonsstudier
Telmisartan
Ramipril
Samtidig administrering av telmisartan 80 mg én gang daglig og ramipril 10 mg én gang daglig til friske personer øker steady-state Cmax og AUC for ramipril henholdsvis 2,3 og 2,1 ganger, og Cmax og AUC for ramiprilat henholdsvis 2,4 og 1,5 ganger. . Derimot reduseres Cmax og AUC for telmisartan med henholdsvis 31 % og 16 %. Ved samtidig administrering av telmisartan og ramipril kan responsen være større på grunn av de mulige additive farmakodynamiske effektene av de kombinerte legemidlene, og også på grunn av økt eksponering for ramipril og ramiprilat i nærvær av telmisartan.
Andre stoffer
Samtidig administrering av telmisartan resulterte ikke i en klinisk signifikant interaksjon med acetaminofen, amlodipin, glyburid, simvastatin, hydroklortiazid, warfarin eller ibuprofen. Telmisartan metaboliseres ikke av cytokrom P450-systemet og hadde ingen effekter in vitro på cytokrom P450-enzymer, bortsett fra en viss hemming av CYP2C19. Telmisartan forventes ikke å interagere med legemidler som hemmer cytokrom P450-enzymer; det forventes heller ikke å interagere med legemidler metabolisert av cytokrom P450-enzymer, bortsett fra mulig hemming av metabolismen til legemidler metabolisert av CYP2C19.
Kliniske studier
Telmisartan og hydroklortiazid
kontrollerte kliniske studier med mer enn 2500 hypertensive pasienter, ble 1017 pasienter eksponert for telmisartan (20 mg til 160 mg) og samtidig hydroklortiazid (6,25 mg til 25 mg). Disse studiene inkluderte én faktoriell studie (studie 1) med kombinasjoner av telmisartan (20 mg, 40 mg, 80 mg, 160 mg eller placebo) og hydroklortiazid (6,25 mg, 12,5 mg, 25 mg og placebo). Den faktorielle studien randomiserte 818 pasienter, inkludert 493 (60 %) menn; 596 (73 %) ikke-svarte og 222 (27 %) svarte; og 143 (18%) ≥65 år (median alder var 53 år). Gjennomsnittlig liggende blodtrykk ved baseline for den totale populasjonen var 154/101 mmHg.
Kombinasjonen av telmisartan og hydroklortiazid resulterte i additiv placebojustert reduksjon i systolisk og diastolisk blodtrykk ved bunnfall på 16-21/9-11 mmHg for doser mellom 40 mg/12,5 mg og 80 mg/25 mg, sammenlignet med 9-13 /7-8 mmHg for telmisartan 40 mg til 80 mg monoterapi og 4/4 mmHg for hydroklortiazid 12,5 mg monoterapi. Den antihypertensive effekten var uavhengig av alder eller kjønn. Det var i hovedsak ingen endring i hjertefrekvens hos pasienter behandlet med kombinasjonen telmisartan og hydroklortiazid i den placebokontrollerte studien.
Fire andre studier av hypertensive pasienter med minst seks måneders varighet tillot tillegg av hydroklortiazid for pasienter som enten ikke var tilstrekkelig kontrollert med den randomiserte telmisartan-monoterapidosen eller ikke hadde oppnådd adekvat blodtrykksrespons etter fullført opptitrering av telmisartan. I aktivt kontrollerte studier reduserte tillegg av 12,5 mg hydroklortiazid til titrerte doser telmisartan hos pasienter som ikke oppnådde eller opprettholdt tilstrekkelig respons med telmisartan monoterapi systolisk og diastolisk blodtrykk ytterligere.
PASIENTINFORMASJON
MICARDIS® HCT (my-CAR-dis HCT) (telmis artan og hydroklortiazid) Tabletter
Les denne pasientinformasjonen før du begynner å ta MICARDIS HCT-tabletter og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med legen din om din medisinske tilstand eller din behandling.
Hva er den viktigste informasjonen jeg bør vite om MICARDIS 20mg HCT-tabletter?
MICARDIS HCT kan forårsake skade eller død for et ufødt barn. Snakk med legen din om andre måter å senke blodtrykket på hvis du planlegger å bli gravid. Hvis du blir gravid mens du tar MICARDIS 20mg HCT, fortell legen din umiddelbart.
Hva er MICARDIS HCT?
MICARDIS 40mg HCT er et reseptbelagt legemiddel som brukes til å behandle høyt blodtrykk (hypertensjon).
MICARDIS 40mg HCT inneholder:
- . telmisartan, en angiotensinreseptorblokker (ARB) . hydroklortiazid, en vannpille eller vanndrivende middel
Legen din kan forskrive andre medisiner som du kan ta sammen med MICARDIS 80 mg HCT for å behandle høyt blodtrykk.
Det er ikke kjent om MICARDIS 40mg HCT er trygt og effektivt hos barn.
Ikke ta MICARDIS 20mg HCT tabletter hvis du:
- . har lav eller ingen urinproduksjon . er allergisk (overfølsom) overfor virkestoffene (telmisartan eller hydroklortiazid) eller noen av de andre innholdsstoffene som er oppført på slutten av dette pakningsvedlegget
Hva bør jeg fortelle legen min før jeg bruker MICARDIS 40mg HCT-tabletter?
Før du tar MICARDIS 20mg HCT tabletter, fortell legen din dersom du:
- . er gravid eller planlegger å bli gravid. Se "Hva er den viktigste informasjonen jeg bør vite om MICARDIS 20mg HCT-tabletter?" . ammer eller planlegger å amme. MICARDIS 80mg HCT kan gå over i morsmelk og kan skade babyen din. Du og legen din bør bestemme om du vil ta MICARDIS HCT eller amme. Du bør ikke gjøre begge deler. Snakk med legen din om den beste måten å mate babyen din på hvis du tar MICARDIS HCT-tabletter. . har blitt fortalt at du har unormale nivåer av kroppssalt (elektrolytter) i blodet . har leverproblemer . har astma eller historie med astma . har lupus . har diabetes . har nyreproblemer . har andre medisinske tilstander
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Fortell også legen din dersom du drikker alkohol.
MICARDIS 20mg HCT kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan MICARDIS 20mg HCT virker. Fortell legen din spesielt hvis du tar:
- . aliskiren . digoksin (Lanoxin®) . litium (Lithobid®, litiumkarbonat, litiumsitrat) . andre legemidler som brukes til å behandle høyt blodtrykk eller hjerteproblemer . vannpiller (vanndrivende) . aspirin eller andre ikke-steroide antiinflammatoriske legemidler (NSAIDs) . kaliumtilskudd eller en salterstatning som inneholder kalium . medisin som brukes til å behandle diabetes, inkludert insulin . narkotiske smertestillende medisiner . sovepiller . steroidmedisin eller adrenokortikotrofisk hormon (ACTH) . barbiturater . visse kolesterolsenkende medisiner (harpikser som brukes til kolesterolreduksjon, f.eks. kolestyramin og kolestipolharpikser)
Spør legen din hvis du ikke er sikker på om du tar en av legemidlene som er oppført ovenfor.
Kjenn til medisinene du tar. Hold en liste over dem og vis den til legen din eller apoteket når du får en ny medisin.
Hvordan skal jeg ta MICARDIS HCT tabletter?
- . Ta MICARDIS 40mg HCT tabletter nøyaktig slik legen din forteller deg å ta den. . Legen din vil fortelle deg hvor mye MICARDIS HCT du skal ta og når du skal ta det. . Ikke endre dosen med mindre legen din ber deg om det. . Ta MICARDIS HCT én gang hver dag. . Ta MICARDIS 20 mg HCT tabletter med eller uten mat. . Hvis du tar for mye MICARDIS HCT, ring legen din eller gå til nærmeste legevakt umiddelbart. . Les "Hvordan åpne blemmen" på slutten av dette pakningsvedlegget før du bruker MICARDIS 20mg HCT. Snakk med legen din hvis du ikke forstår instruksjonene.
Hva er de mulige bivirkningene av MICARDIS 80mg HCT-tabletter?
MICARDIS 20mg HCT-tabletter kan forårsake alvorlige bivirkninger, inkludert:
- . Skade eller død på ditt ufødte barn. Se "Hva er den viktigste informasjonen jeg bør vite om MICARDIS HCT-tabletter?" . Lavt blodtrykk (hypotenser ion) er mest sannsynlig hvis du også:
- . ta vannpiller (diuretika) . er på en diett med lite salt . få dialysebehandlinger . har hjerteproblemer . bli syk med oppkast eller diaré . ikke drikk nok væske . svette mye
Hvis du føler deg svak eller svimmel, legg deg ned og ring legen din med en gang.
. Nyreproblemer, som kan bli verre hvis du allerede har en nyresykdom. Du kan ha endringer i nyretestresultatene, og du kan trenge en lavere dose av MICARDIS 40mg HCT-tabletter. Ring legen din hvis du får:- . hevelse i føttene, anklene eller hendene . uforklarlig vektøkning
Ring legen din umiddelbart hvis du får noen av symptomene nevnt ovenfor.
. Leverproblemer, som kan bli verre hos personer som allerede har leverproblemer og tar MICARDIS 40mg HCT. . Øyeproblemer. Et av legemidlene i MICARDIS HCT kan forårsake øyeproblemer som kan føre til synstap. Symptomer på øyeproblemer kan oppstå innen timer til uker etter oppstart av MICARDISHCT. Fortell legen din umiddelbart hvis du har:
- . nedgang i synet . øyesmerter
- . hevelse i ansikt, tunge, svelg . pustevansker . Verre enden av lupus. Fortell legen din dersom lupus blir verre eller aktiv mens du tar MICARDIS 20mg HCT.
- . tørr i munnen . tørst . tretthet . søvnighet . rastløshet . forvirring . anfall . raske hjerteslag . svakhet . muskelsmerter eller kramper . svært lav urinproduksjon . kvalme eller oppkast
De vanligste bivirkningene av MICARDIS 80mg HCT-tabletter inkluderer:
- . øvre luftveisinfeksjoner, inkludert bihulesmerter/opphopning og sår hals . svimmelhet . føler seg sliten . influensalignende symptomer . ryggsmerte . diaré . kvalme
Dette er ikke alle mulige bivirkninger med MICARDIS 20mg HCT-tabletter. Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over. Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare MICARDIS 80mg HCT-tabletter?
- . Oppbevar MICARDIS HCT-tabletter ved romtemperatur 68 °F til 77 °F (20 °C til 25 °C). . Ikke fjern MICARDIS 40mg HCT tabletter fra blisterpakninger før rett før du tar dem.
Oppbevar MICARDIS 80mg HCT-tabletter og alle legemidler utilgjengelig for barn.
Generell informasjon om MICARDIS 40mg HCT tabletter:
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i et pasientinformasjonshefte. Ikke bruk MICARDIS HCT tabletter for en tilstand det ikke er foreskrevet for. Ikke gi MICARDIS 20 mg HCT-tabletter til andre mennesker, selv om de har samme tilstand som du har. Det kan skade dem.
Dette pasientinformasjonsheftet oppsummerer den viktigste informasjonen om MICARDIS HCT-tabletter. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre apoteket eller legen om informasjon om MICARDIS 20mg HCT-tabletter som er skrevet for helsepersonell.
For gjeldende forskrivningsinformasjon, skann koden nedenfor eller ring Boehringer Ingelheim Pharmaceuticals, Inc. på 1-800-542-6257 eller (TTY) 1-800-459-9906.
Hva er ingrediensene i MICARDIS 20mg HCT tabletter?
Aktive ingredienser: telmisartan og hydroklortiazid
Inaktive ingredienser: natriumhydroksid, meglumin, povidon, sorbitol, magnesiumstearat, laktosemonohydrat, mikrokrystallinsk cellulose, maisstivelse og natriumstivelsesglykolat
40 mg/12,5 mg og 80 mg/12,5 mg tablettene inneholder også: rødt jernoksid.
80 mg/25 mg tablettene inneholder også: gul jernoksid.
Hva er høyt blodtrykk (hypertensjon)?
Blodtrykket er kraften i blodårene når hjertet slår og når hjertet hviler. Du har høyt blodtrykk når kraften er for stor. Medisiner som senker blodtrykket reduserer sjansen for å få hjerneslag eller hjerteinfarkt.
Høyt blodtrykk gjør at hjertet jobber hardere for å pumpe blod gjennom kroppen og forårsaker skade på blodårene. MICARDIS 80mg HCT-tabletter kan hjelpe blodårene til å slappe av slik at blodtrykket blir lavere.
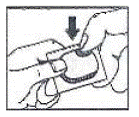
Slik åpner du blemmen:
. Riv (Du kan også bruke saks for å rive blemmen fra hverandre) 
Denne pasientinformasjonen er godkjent av US Food and Drug Administration.
