Nimotop 30mg Nimodipine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Nimotop 30mg og hvordan brukes det?
Nimotop er et reseptbelagt legemiddel som brukes til å behandle symptomene på aneurisme (subaraknoidalblødning). Nimotop kan brukes alene eller sammen med andre medisiner.
Nimotop tilhører en klasse legemidler som kalles kalsiumkanalblokkere; Nevrologi, Annet; Kalsiumkanalblokkere, dihydrofyridin.
Det er ikke kjent om Nimotop 30mg er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Nimotop?
Nimotop kan forårsake alvorlige bivirkninger, inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . svimmelhet, . rask eller langsom puls, og . hevelse eller anklene eller føttene
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Nimotop inkluderer:
- . lavt blodtrykk (føler seg ør i hodet), . kvalme, . urolig mage, . sakte hjerteslag, og . Muskelsmerte
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Nimotop. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
IKKE ADMINISTRER NIMOTOP (nimodipin) INTRAVENØST ELLER VIA ANDRE PARENTERALE RUTER. DØDSFALD OG ALVORLIGE, LIVSTRUENDE BIVIRKNINGER HAR OPPTÅTT NÅR INNHOLDET AV NIMOTOP (nimodipin) KAPSLER ER INJJERT PARENTERALT (se ADVARSLER og DOSERING OG ADMINISTRASJON).
BESKRIVELSE
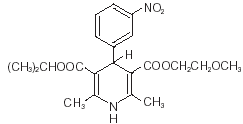
Nimotop® (nimodipin) tilhører klassen av farmakologiske midler kjent som kalsiumkanalblokkere. Nimodipin er isopropyl-2-metoksyetyl-1,4-dihydro-2,6-dimetyl-4-(m-nitrofenyl)-3,5-pyridindikarboksylat. Den har en molekylvekt på 418,5 og en molekylformel på C21H26N2O7. Strukturformelen er:
Nimodipin er et gult krystallinsk stoff, praktisk talt uløselig i vann.
NIMOTOP® (nimodipin) kapsler er formulert som myke gelatinkapsler for oral administrering. Hver væskefylt kapsel inneholder 30 mg nimodipin i en bærer av glyserin, peppermynteolje, renset vann og polyetylenglykol 400. Det myke gelatinkapselskallet inneholder gelatin, glyserin, renset vann og titandioksid.
INDIKASJONER
Nimotop® (nimodipin) er indisert for å forbedre det nevrologiske resultatet ved å redusere forekomsten og alvorlighetsgraden av iskemiske underskudd hos pasienter med subaraknoidal blødning fra rupturerte intrakranielle bæraneurismer uavhengig av deres post-ictus nevrologiske tilstand (dvs. Hunt og Hess grad IV).
DOSERING OG ADMINISTRASJON
IKKE ADMINISTRER NIMOTOP (nimodipin) KAPSLER INTRAVENØST ELLER VIA ANDRE PARENTERALE RUTER (se ADVARSLER). Hvis Nimotop (nimodipin) utilsiktet administreres intravenøst, kan klinisk signifikant hypotensjon kreve kardiovaskulær støtte med pressormidler. Spesifikke behandlinger for overdose av kalsiumkanalblokkere bør også gis umiddelbart.
Nimotop (nimodipin) gis oralt i form av elfenbensfarget, myk gelatin 30 mg kapsler for subaraknoidal blødning.
Den orale dosen er 60 mg (to 30 mg kapsler) hver 4. time i 21 påfølgende dager, helst ikke mindre enn én time før eller to timer etter måltider. Oral Nimotop® (nimodipin)-behandling bør starte innen 96 timer etter subaraknoidalblødningen.
Hvis kapselen ikke kan svelges, f.eks. ved operasjonen, eller hvis pasienten er bevisstløs, bør det lages et hull i begge ender av kapselen med en 18 gauge kanyle, og innholdet i kapselen trekkes ut i en sprøyte. En parenteral sprøyte kan brukes til å trekke ut væsken inne i kapselen, men væsken skal alltid overføres til en sprøyte som ikke kan ta imot en nål og som er designet for oral administrering eller via en naso-gastrisk sonde eller PEG. For å bidra til å minimere administrasjonsfeil, anbefales det at sprøyten som brukes til administrasjonen er merket "Ikke til IV-bruk". Innholdet skal deretter tømmes over i pasientens in situnaso-gastriske sonde og vaskes ned i sonden med 30 ml vanlig saltvann (0,9%). Effekten og sikkerheten til denne administrasjonsmåten har ikke blitt vist i kliniske studier.
Pasienter med levercirrhose har betydelig redusert clearance og omtrent doblet Cmax. Dosen bør reduseres til 30 mg hver 4. time, med nøye overvåking av blodtrykk og hjertefrekvens.
HVORDAN LEVERES
Hver elfenbensfarget, myk gelatin NIMOTOP® (nimodipin) kapsel er merket med ordet Nimotop 30 mg og inneholder 30 mg nimodipin. 30 mg kapslene er pakket i enhetsdose folieposer og leveres i kartonger som inneholder 100 kapsler. Produktet er også tilgjengelig i barnesikre enhetsdose sikkerhetspak folieposer som inneholder 30 kapsler per kartong. Kapslene skal oppbevares i produsentens originale foliepakke ved 25°C (77°F), utflukter tillatt til 15-30°C (59-86°F) [Se USP-kontrollert romtemperatur.]
Kapsler bør beskyttes mot lys og frysing.
Distribuert av: Bayer Pharmaceuticals Corporation, 400 Morgan Lane, West Haven, CT 06516. Produsert av: Catalent Pharma Solutions St. Petersburg, FL 33716. FDA revisjonsdato: 20.1.2006
BIVIRKNINGER
Bivirkninger ble rapportert av 92 av 823 pasienter med subaraknoidal blødning (11,2 %) som fikk nimodipin. Den hyppigst rapporterte bivirkningen var redusert blodtrykk hos 4,4 % av disse pasientene. 29 av 479 (6,1 %) placebobehandlede pasienter rapporterte også bivirkninger. Hendelsene rapportert med en frekvens på over 1 % vises nedenfor etter dose.
DOSE q4h Antall pasienter (%) Nimodipin
Det var ingen andre uønskede opplevelser rapportert av pasientene som fikk 0,35 mg/kg q4t, 30 mg q4h eller 120 mg q4h. Bivirkninger med en insidensrate på mindre enn 1 % i 60 mg q4t-dosegruppen var: hepatitt; kløe; gastrointestinal blødning; trombocytopeni; anemi; hjertebank; oppkast; rødming; diaforese; hvesing; fenytoin toksisitet; svimmelhet; svimmelhet; rebound vasospasme; gulsott; hypertensjon; hematom.
Bivirkninger med en forekomst på mindre enn 1 % i 90 mg q4t-dosegruppen var: kløe, gastrointestinal blødning; trombocytopeni; nevrologisk forverring; oppkast; diaforese; kongestiv hjertesvikt; hyponatremi; redusert antall blodplater; disseminert intravaskulær koagulasjon; dyp venetrombose.
Som det fremgår av tabellen, inkluderte bivirkninger som vises relatert til nimodipinbruk basert på økt forekomst med høyere dose eller høyere rate sammenlignet med placebokontroll redusert blodtrykk, ødem og hodepine som er kjente farmakologiske virkninger av kalsiumkanalblokkere. Det må imidlertid bemerkes at SAH ofte er ledsaget av endringer i bevisstheten som fører til underrapportering av uønskede opplevelser. Pasienter som fikk nimodipin i kliniske studier for andre indikasjoner rapporterte rødme (2,1 %), hodepine (4,1 %) og væskeretensjon (0,3 %), typisk respons på kalsiumkanalblokkere. Som en kalsiumkanalblokker kan nimodipin ha potensial til å forverre hjertesvikt hos følsomme pasienter eller forstyrre AV-ledning, men disse hendelsene ble ikke observert.
Ingen klinisk signifikante effekter på hematologiske faktorer, nyre- eller leverfunksjon eller karbohydratmetabolisme er kausalt assosiert med oral nimodipin. Isolerte tilfeller av ikke-fastende forhøyede serumglukosenivåer (0,8 %), forhøyede LDH-nivåer (0,4 %), reduserte blodplatetall (0,3 %), forhøyede nivåer av alkalisk fosfatase (0,2 %) og forhøyede SGPT-nivåer (0,2 %) er rapportert. sjelden.

Narkotikamisbruk og avhengighet
Det har ikke vært rapportert tilfeller av narkotikamisbruk eller avhengighet med Nimotop® (nimodipin).
NARKOTIKAHANDEL
Det er mulig at den kardiovaskulære virkningen til andre kalsiumkanalblokkere kan forsterkes ved tilsetning av Nimotop® (nimodipin).
I Europa ble det observert at Nimotop® (nimodipin) av og til forsterker effekten av antihypertensive forbindelser tatt samtidig av pasienter som lider av hypertensjon; dette fenomenet ble ikke observert i nordamerikanske kliniske studier.
En studie med åtte friske frivillige har vist en 50 % økning i gjennomsnittlig maksimal nimodipin plasmakonsentrasjon og en 90 % økning i gjennomsnittlig areal under kurven, etter en ukes kur med cimetidin med 1000 mg/dag og nimodipin med 90 mg/dag . Denne effekten kan formidles av den kjente hemmingen av hepatisk cytokrom P-450 av cimetidin, som kan redusere first-pass metabolisme av nimodipin.
ADVARSLER
DØDSFORHOLD PÅ UTILSIKTET INTRAVENØS ADMINISTRASJON: IKKE ADMINISTRER NIMOTOP (nimodipin) INTRAVENØST ELLER VIA ANDRE PARENTERALE RUTER. DØDSFALL OG ALVORLIGE, LIVSTRUENDE Uønskede HENDELSER, INKLUDERT HJERTESTANS, HJERTE-KLAPS, HYPOTENSJON OG BRADYKARDI, HAR OPPTÅTT NÅR INNHOLDET I NIMOTOP (nimodipin) KAPSELER HAR DET INN I DMINOSJEKTER (OG DET HAR DET).
FORHOLDSREGLER
Generell: Blodtrykk: Nimodipin har de hemodynamiske effektene som forventes av en kalsiumkanalblokker, selv om de vanligvis ikke er markerte. Imidlertid har intravenøs administrering av innholdet i Nimotop (nimodipin) kapsler resultert i alvorlige bivirkninger, inkludert død, hjertestans, kardiovaskulær kollaps, hypotensjon og bradykardi. Hos pasienter med subaraknoidalblødning som ble gitt Nimotop® (nimodipin) i kliniske studier, ble ca. 5 % rapportert å ha hatt blodtrykksenking og ca. 1 % forlot studien på grunn av dette (ikke alle kunne tilskrives nimodipin). Likevel bør blodtrykket overvåkes nøye under behandling med Nimotop® (nimodipin) basert på dets kjente farmakologi og kjente effekter av kalsiumkanalblokkere. (se ADVARSLER og DOSERING OG ADMINISTRASJON )
Leversykdom: Metabolismen av Nimotop® (nimodipin) er redusert hos pasienter med nedsatt leverfunksjon. Slike pasienter bør få blodtrykk og puls overvåket nøye og bør gis en lavere dose (se DOSERING OG ADMINISTRASJON ).
Intestinal pseudo-obstruksjon og ileus er rapportert i sjeldne tilfeller hos pasienter behandlet med nimodipin. En årsakssammenheng er ikke fastslått. Tilstanden har reagert på konservativ ledelse.
Laboratorietestinteraksjoner: Ingen kjente.
Karsinogenese, mutagenese, svekkelse av fruktbarhet: en toårig studie ble det observert høyere forekomst av adenokarsinom i livmoren og Leydig-celle adenom i testiklene hos rotter som fikk en diett som inneholder 1800 ppm nimodipin (tilsvarer 91 til 121 mg/kg/dag nimodipin) enn hos placebokontroller. . Forskjellene var imidlertid ikke statistisk signifikante, og de høyere ratene var godt innenfor historisk kontrollområde for disse svulstene i Wistar-stammen.
Nimodipin ble funnet å ikke være kreftfremkallende i en 91-ukers musestudie, men den høye dosen på 1800 ppm nimodipin-i-fôr (546 til 774 mg/kg/dag) forkortet levetiden til dyrene. Mutagenitetsstudier, inkludert Ames, mikronucleus og dominant letale tester var negative. Nimodipin svekket ikke fertiliteten og den generelle reproduksjonsevnen til Wistar hann- og hunnrotter etter orale doser på opptil 30 mg/kg/dag når det ble administrert daglig i mer enn 10 uker hos hannene og 3 uker hos hunnene før paring og fortsatte. til dag 7 av svangerskapet. Denne dosen hos en rotte er ca. 4 ganger den ekvivalente kliniske dosen på 60 mg q4t hos en pasient på 50 kg.
Svangerskap: Graviditetskategori C. Nimodipin har vist seg å ha en teratogene effekt hos Himalaya-kaniner. Forekomsten av misdannelser og forkrøplede fostre økte ved orale doser på 1 og 10 mg/kg/dag administrert (ved sonde) fra dag 6 til og med dag 18 av svangerskapet, men ikke ved 3,0 mg/kg/dag i en av to identiske kaninstudier. I den andre studien ble det sett en økt forekomst av forkrøplede fostre ved 1,0 mg/kg/dag, men ikke ved høyere doser. Nimodipin var embryotoksisk, og forårsaket resorpsjon og hemmet vekst av fostre, hos Long Evans-rotter ved 100 mg/kg/dag administrert ved sonde fra dag 6 til og med dag 15 av svangerskapet. I to andre rottestudier var doser på 30 mg/kg/dag nimodipin administrert med sonde fra dag 16 av svangerskapet og fortsatte til avliving (dag 20 av svangerskapet eller dag 21 post partum) assosiert med høyere forekomst av skjelettvariasjon, forkrøplede fostre og dødfødsler, men ingen misdannelser. Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner for å direkte vurdere effekten på menneskelige fostre. Nimodipin bør kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Ammende mødre: Nimodipin og/eller dets metabolitter har vist seg å vises i rottemelk ved konsentrasjoner som er mye høyere enn i mors plasma. Det er ikke kjent om legemidlet skilles ut i morsmelk. Fordi mange legemidler skilles ut i morsmelk, anbefales ammende mødre å ikke amme babyene sine når de tar legemidlet.
Pediatrisk bruk: Sikkerhet og effektivitet hos barn er ikke fastslått.
Geriatrisk bruk: Kliniske studier av nimodipin inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Generelt bør dosering hos eldre pasienter være forsiktig, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling.
OVERDOSE
Det har ikke vært rapportert om overdosering fra oral administrering av Nimotop® (nimodipin). Symptomer på overdosering forventes å være relatert til kardiovaskulære effekter som overdreven perifer vasodilatasjon med markert systemisk hypotensjon. Klinisk signifikant hypotensjon på grunn av overdosering av Nimotop® (nimodipin) kan kreve aktiv kardiovaskulær støtte med pressormidler. Spesifikke behandlinger for overdose av kalsiumkanalblokkere bør også gis umiddelbart. Siden Nimotop® (nimodipin) er sterkt proteinbundet, er det ikke sannsynlig at dialyse vil være fordelaktig.
KONTRAINDIKASJONER
Ingen kjente.
KLINISK FARMAKOLOGI
Virkningsmekanismen: Nimodipin er en kalsiumkanalblokker. De kontraktile prosessene til glatte muskelceller er avhengig av kalsiumioner, som kommer inn i disse cellene under depolarisering som langsomme ioniske transmembrane strømmer. Nimodipin hemmer kalsiumionoverføring til disse cellene og hemmer dermed sammentrekninger av vaskulær glatt muskulatur. I dyreforsøk hadde nimodipin større effekt på cerebrale arterier enn på arterier andre steder i kroppen, kanskje fordi det er svært lipofilt, slik at det kan krysse blod-hjerne-barrieren; konsentrasjoner av nimodipin så høye som 12,5 ng/ml er påvist i cerebrospinalvæsken til nimodipin-behandlede subaraknoidal blødning (SAH) pasienter. Den nøyaktige virkningsmekanismen til nimodipin hos mennesker er ukjent. Selv om de kliniske studiene beskrevet nedenfor viser en gunstig effekt av nimodipin på alvorlighetsgraden av nevrologiske defekter forårsaket av cerebral vasospasme etter SAH, er det ingen arteriografiske bevis på at stoffet verken forhindrer eller lindrer spasmen i disse arteriene. Hvorvidt den arteriografiske metodikken som ble brukt var tilstrekkelig til å oppdage en klinisk meningsfull effekt, om noen, på vasospasme er imidlertid ukjent.
Farmakokinetikk og metabolisme: Hos mennesker absorberes nimodipin raskt etter oral administrering, og maksimale konsentrasjoner oppnås vanligvis innen én time. Den terminale eliminasjonshalveringstiden er ca. 8 til 9 timer, men tidligere eliminasjonshastigheter er mye raskere, tilsvarende en halveringstid på 1-2 timer; en konsekvens er behovet for hyppig (hver 4. time) dosering. Det var ingen tegn til akkumulering når nimodipin ble gitt tre ganger daglig i syv dager. Nimodipin er over 95 % bundet til plasmaproteiner. Bindingen var konsentrasjonsuavhengig over området 10 ng/ml til 10 µg/ml. Nimodipin elimineres nesten utelukkende i form av metabolitter og mindre enn 1 % gjenfinnes i urinen som uendret legemiddel. Tallrike metabolitter, som alle er enten inaktive eller betydelig mindre aktive enn moderforbindelsen, er identifisert. På grunn av høy first-pass metabolisme er biotilgjengeligheten av nimodipin gjennomsnittlig 13 % etter oral administrering. Biotilgjengeligheten er betydelig økt hos pasienter med levercirrhose, med Cmax omtrent det dobbelte av det for normale pasienter, noe som gjør det nødvendig å redusere dosen hos denne pasientgruppen (se DOSERING OG ADMINISTRASJON ). I en studie av 24 friske mannlige frivillige, resulterte administrering av nimodipinkapsler etter en standard frokost i en 68 % lavere maksimal plasmakonsentrasjon og 38 % lavere biotilgjengelighet i forhold til dosering under fastende forhold.
I en enkelt parallellgruppestudie som involverte 24 eldre forsøkspersoner (59-79 år) og 24 yngre forsøkspersoner (i alderen 22-40), var den observerte AUC og Cmax for nimodipin omtrent 2 ganger høyere i den eldre populasjonen sammenlignet med den yngre studien personer etter oral administrering (gitt som en enkeltdose på 30 mg og doseret til steady-state med 30 mg tid i 6 dager). Den kliniske responsen på disse aldersrelaterte farmakokinetiske forskjellene ble imidlertid ikke ansett som signifikant. (Se FORHOLDSREGLER : Geriatrisk bruk.)
Kliniske studier: Nimodipin har vist seg, i 4 randomiserte, dobbeltblinde, placebokontrollerte studier, å redusere alvorlighetsgraden av nevrologiske mangler som følge av vasospasme hos pasienter som nylig har hatt en subaraknoidal blødning (SAH). Forsøkene brukte doser fra 20-30 mg til 90 mg hver 4. time, med legemiddel gitt i 21 dager i 3 studier, og i minst 18 dager i den andre. Tre av de fire studiene fulgte pasienter i 3-6 måneder. Tre av studiene studerte relativt godt pasienter, med alle eller de fleste pasienter i Hunt og Hess grad I - III (i hovedsak fri for fokale underskudd etter den første blødningen) den fjerde studerte mye sykere pasienter, Hunt og Hess grad III - V. To studier , en amerikansk, en fransk, var like i design, med relativt uhemmede SAH-pasienter randomisert til nimodipin eller placebo. I hver ble det tatt en vurdering av om et eventuelt sent utviklende underskudd skyldtes spasmer eller andre årsaker, og underskuddene ble gradert. Begge studiene viste signifikant færre alvorlige underskudd på grunn av spasmer i nimodipingruppen; den andre (franske) studien viste færre spasme-relaterte underskudd av alle alvorlighetsgrader. Ingen effekt ble sett på underskudd som ikke var relatert til spasmer.
En tredje, stor studie ble utført i Storbritannia på SAH-pasienter med alle alvorlighetsgrader (men 89 % var i grad I-III). Nimodipin ble dosert 60 mg hver 4. time. Utfall ble ikke definert som spasmerelatert eller ikke, men det var en signifikant reduksjon i den totale frekvensen av infarkt og alvorlig invalidiserende nevrologisk utfall etter 3 måneder:
En kanadisk studie gikk inn på mye sykere pasienter (Hunt og Hess Grade III-V), som hadde en høy rate av død og funksjonshemming, og brukte en dose på 90 mg hver 4. time, men var ellers lik de to første studiene. Analyse av forsinkede iskemiske underskudd, hvorav mange skyldes spasmer, viste en betydelig reduksjon i spasme-relaterte underskudd. Blant analyserte pasienter (72 nimodipin, 82 placebo) var det følgende utfall.
Når data ble kombinert for de kanadiske og britiske studiene, var behandlingsforskjellen på suksessrate (dvs. god utvinning) på Glasgow Outcome Scale 25,3 % (nimodipin) mot 10,9 % (placebo) for Hunt og Hess grad IV eller V. Tabellen nedenfor viser at nimodipin har en tendens til å forbedre god utvinning av SAH-pasienter med dårlig nevrologisk status post-ictus, samtidig som det reduserer antallet med alvorlig funksjonshemming og vegetativ overlevelse.
En studie med doseintervall som sammenlignet doser på 30, 60 og 90 mg fant en generelt lav forekomst av spasme-relaterte nevrologiske mangler, men ingen doseresponsforhold.
PASIENTINFORMASJON
Ingen informasjon gitt. Vennligst referer til ADVARSLER og FORHOLDSREGLER seksjoner.
