Pulmicort 100mcg, 200mcg Budesonide Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Pulmicort 100mcg Turbuhaler og hvordan brukes det?
Pulmicort 100mcg Turbuhaler er et reseptbelagt legemiddel som brukes til å behandle symptomene på astma. Pulmicort 100mcg Turbuhaler kan brukes alene eller sammen med andre medisiner.
Pulmicort Turbuhaler tilhører en klasse legemidler som kalles kortikosteroider, inhalasjonsmidler.
Det er ikke kjent om Pulmicort Turbuhaler er trygt og effektivt hos barn yngre enn 1 år.
Hva er de mulige bivirkningene av Pulmicort 200mcg Turbuhaler?
Pulmicort 100mcg Turbuhaler kan forårsake alvorlige bivirkninger inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . uvanlig tretthet, . synsproblemer, . lett blåmerker eller blødninger, . oppblåst ansikt, . uvanlig hårvekst, . humørsvingninger, . depresjon, . humørsvingninger, . opphisselse, . muskelsvakhet eller smerte, . tynn hud, . langsom sårtilheling, og . økt tørste eller vannlating
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Pulmicort 100mcg Turbuhaler inkluderer:
- . tørr, irritert eller sår hals, . heshet, . stemmeendringer, . dårlig smak i munnen, . rennende eller tett nese, og . neseblod
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Pulmicort Turbuhaler. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Kun for oral innånding.
BESKRIVELSE
Budesonid, den aktive komponenten i PULMICORT TURBUHALER (budesonid) 200 mcg, er et kortikosteroid kjemisk betegnet som (RS)-11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion syklisk 16,17 acetal med butyraldehyd. Budesonid leveres som en blanding av to epimerer (22R og 22S). Den empiriske formelen til budesonid er C25H34O6 og dens molekylvekt er 430,5. Dens strukturformel er:
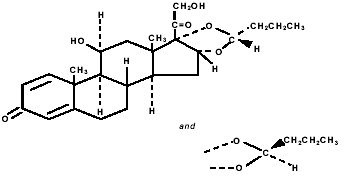
Budesonid er et hvitt til off-white, smakløst, luktfritt pulver som er praktisk talt uløselig i vann og heptan, lite løselig i etanol og fritt løselig i kloroform. Dens fordelingskoeffisient mellom oktanol og vann ved pH 7,4 er 1,6 x 103.
PULMICORT 100mcg TURBUHALER (budesonid) er en inhalasjonsdrevet flerdose tørrpulverinhalator som kun inneholder mikronisert budesonid. Hver aktivering av PULMICORT 100 mcg TURBUHALER gir 200 mcg budesonid per oppmålt dose, som leverer ca. 160 mcg budesonid fra munnstykket (basert på in vitro-testing ved 60 l/min i 2 sek).
In vitro-testing har vist at dosetilførselen for PULMICORT 100mcg TURBUHALER (budesonid) er vesentlig avhengig av luftstrømmen gjennom enheten. Pasientfaktorer som inspiratoriske strømningshastigheter vil også påvirke dosen som leveres til lungene til pasienter i faktisk bruk (se Pasientens bruksanvisning ). Hos voksne pasienter med astma (gjennomsnittlig FEV1 2,9 L [0,8 - 5,1 L]) var gjennomsnittlig maksimal inspirasjonsstrøm (PIF) gjennom PULMICORT TURBUHALER (budesonid) 78 (40-111) L/min. Lignende resultater (gjennomsnittlig PIF 82 [43-125] L/min) ble oppnådd hos astmatiske barn (6 til 15 år, gjennomsnittlig FEV1 2,1 L [0,9 - 5,4 L]). Pasienter bør instrueres nøye om bruken av dette legemiddelet for å sikre optimal dosetilførsel.
INDIKASJONER
PULMICORT TURBUHALER (budesonid) er indisert for vedlikeholdsbehandling av astma som profylaktisk terapi hos voksne og pediatriske pasienter seks år eller eldre. Det er også indisert for pasienter som trenger oral kortikosteroidbehandling for astma. Mange av disse pasientene kan være i stand til å redusere eller eliminere behovet for orale kortikosteroider over tid.
PULMICORT 100mcg TURBUHALER (budesonid) er IKKE indisert for lindring av akutt bronkospasme.
DOSERING OG ADMINISTRASJON
PULMICORT 200mcg TURBUHALER (budesonid) bør administreres oralt til astmatiske pasienter fra 6 år og eldre. Individuelle pasienter vil oppleve en variabel debut og grad av symptomlindring. Generelt sett har PULMICORT TURBUHALER (budesonid) en relativt rask virkningsstart for et inhalert kortikosteroid. Forbedring av astmakontroll etter inhalert administrering av PULMICORT 200mcg TURBUHALER (budesonid) kan oppstå innen 24 timer etter behandlingsstart, selv om maksimal fordel kanskje ikke oppnås før 1 til 2 uker, eller lenger. Sikkerhet og effekt av PULMICORT TURBUHALER (budesonid) ved administrering i overkant av anbefalte doser er ikke fastslått.
Den anbefalte startdosen og den høyeste anbefalte dosen av PULMICORT TURBUHALER (budesonid), basert på tidligere astmabehandling, er oppført i følgende tabell.
*Hos pasienter med mild til moderat astma som er godt kontrollert på inhalerte kortikosteroider, kan dosering med PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg eller 400 mcg en gang daglig vurderes. PULMICORT 200mcg TURBUHALER (budesonid) kan administreres en gang daglig enten om morgenen eller om kvelden.
Hvis behandling én gang daglig med PULMICORT 200mcg TURBUHALER (budesonid) ikke gir tilstrekkelig kontroll av astmasymptomer, bør den totale daglige dosen økes og/eller administreres som en delt dose.
Pasienter som opprettholdes på kroniske orale kortikosteroider
Til å begynne med skal PULMICORT TURBUHALER (budesonid) brukes samtidig med pasientens vanlige vedlikeholdsdose av systemisk kortikosteroid. Etter omtrent en uke startes gradvis seponering av det systemiske kortikosteroidet ved å redusere den daglige eller alternative daglige dosen. Den neste reduksjonen gjøres etter et intervall på en eller to uker, avhengig av responsen til pasienten. Generelt bør disse reduksjonene ikke overstige 2,5 mg prednison eller tilsvarende. En langsom uttakshastighet anbefales sterkt. Under reduksjon av orale kortikosteroider bør pasienter overvåkes nøye for astma-ustabilitet, inkludert objektive mål på luftveisfunksjon, og for binyrebarksvikt (se ADVARSLER ). Under seponering kan noen pasienter oppleve symptomer på systemisk kortikosteroidabstinens, f.eks. ledd- og/eller muskelsmerter, slapphet og depresjon, til tross for vedlikehold eller til og med forbedring av lungefunksjonen. Slike pasienter bør oppmuntres til å fortsette med PULMICORT TURBUHALER (budesonid), men bør overvåkes for objektive tegn på binyrebarksvikt. Hvis tegn på binyrebarksvikt oppstår, bør de systemiske kortikosteroiddosene økes midlertidig og deretter seponeringen fortsette saktere. I perioder med stress eller et alvorlig astmaanfall kan overføringspasienter trenge tilleggsbehandling med systemiske kortikosteroider.
MERK: Hos alle pasienter er det ønskelig å titrere til laveste effektive dose når astmastabilitet er oppnådd.
Bruksanvisning
Illustrerte pasientinstruksjoner til bruk følger med hver pakke med PULMICORT 200mcg TURBUHALER (budesonid).
Pasienter bør instrueres om å prime PULMICORT TURBUHALER (budesonid) før første gangs bruk, og instrueres om å inhalere dypt og kraftig hver gang enheten brukes. Det anbefales også å skylle munnen etter innånding.
HVORDAN LEVERES
PULMICORT TURBUHALER (budesonid) består av en rekke sammensatte plastdetaljer, hvor hoveddelene er doseringsmekanismen, oppbevaringsenheten for legemiddelstoffet og munnstykket. Inhalatoren er beskyttet av et hvitt ytre rørformet deksel skrudd på inhalatoren. Kroppen på inhalatoren er hvit og dreiehåndtaket er brunt. Følgende ordlyd er trykt på grepet med hevet skrift, "Pulmicort™ 200 mcg". TURBUHALER-inhalatoren kan ikke etterfylles og bør kasseres når den er tom.
PULMICORT TURBUHALER (budesonid) er tilgjengelig som 200 mcg/dose, 200 doser (NDC 0186-0915-42) og har en målvekt på 104 mg.
Når det er 20 doser igjen i PULMICORT 200mcg TURBUHALER (budesonid), vil et rødt merke vises i indikatorvinduet. Hvis enheten brukes utenfor punktet der det røde merket vises nederst i vinduet, kan det hende at den riktige mengden medikamenter ikke oppnås. Enheten bør kasseres.
Oppbevares med dekselet strammet på et tørt sted ved kontrollert romtemperatur 20-25°C (68-77°F) [se USP]. Oppbevares utilgjengelig for barn.
Alle varemerker er eiendommen til AstraZeneca-gruppen av selskaper. ©AstraZeneca 2001, 2006. Produsert for: AstraZeneca LP, Wilmington, DE 19850 Av: AstraZeneca AB, Södertalje, Sverige 33020-00. Rev. 10/06. FDA revisjonsdato: 20.8.2007
BIVIRKNINGER
Følgende bivirkninger ble rapportert hos pasienter behandlet med PULMICORT 100mcg TURBUHALER (budesonid).
Forekomsten av vanlige bivirkninger er basert på dobbeltblindede, placebokontrollerte amerikanske kliniske studier der 1116 voksne og pediatriske pasienter i alderen 6-70 år (472 kvinner og 644 menn) ble behandlet med PULMICORT TURBUHALER (budesonid) (200 til 800). mcg to ganger daglig i 12 til 20 uker) eller placebo.
Tabellen nedenfor viser forekomsten av bivirkninger hos pasienter som tidligere har fått bronkodilatatorer og/eller inhalerte kortikosteroider i kontrollerte kliniske studier i USA. Denne populasjonen inkluderte 232 mannlige og 62 kvinnelige pediatriske pasienter (alder 6 til 17 år) og 332 mannlige og 331 kvinnelige voksne pasienter (alder 18 år og eldre).
Bivirkninger med ≥ 3 % forekomst rapportert av pasienter på PULMICORT 100mcg TURBUHALER (budesonid)
Tabellen ovenfor inkluderer alle hendelser (enten de anses medikamentrelaterte eller ikke-medikamentrelaterte av etterforskerne) som skjedde med en hastighet på ≥3 % i en hvilken som helst PULMICORT TURBUHALER (budesonid) gruppe og var mer vanlige enn i placebogruppen. Når disse dataene vurderes, bør den økte gjennomsnittlige eksponeringsvarigheten for pasienter med PULMICORT 200mcg TURBUHALER (budesonid) tas i betraktning.
Følgende andre bivirkninger forekom i disse kliniske studiene med PULMICORT 100mcg TURBUHALER (budesonid) med en forekomst på 1 til 3 % og var mer vanlige på PULMICORT 200mcg TURBUHALER (budesonid) enn på placebo.
Kroppen som helhet: nakkesmerter
Kardiovaskulær: synkope
Fordøyelsessystemet: magesmerter, munntørrhet, oppkast
Metabolsk og ernæringsmessig: vektøkning
Muskuloskeletal: brudd, myalgi
Nervøs: hypertoni, migrene
Blodplater, blødninger og koagulering: ekkymose
Psykiatrisk: søvnløshet
Motstandsmekanismer: infeksjon
Spesielle sanser: smaksperversjon
en 20-ukers studie med voksne astmatikere som tidligere trengte orale kortikosteroider, ble effekten av PULMICORT TURBUHALER (budesonid) 400 mcg to ganger daglig (N=53) og 800 mcg to ganger daglig (N=53) sammenlignet med placebo (N=53) ) om hyppigheten av rapporterte bivirkninger. Bivirkninger, enten de anses medikamentrelaterte eller ikke-medikamentrelaterte av etterforskerne, rapportert hos mer enn fem pasienter i PULMICORT 200mcg TURBUHALER (budesonid)-gruppen og som forekom hyppigere med PULMICORT TURBUHALER (budesonid) enn placebo er vist nedenfor ( % PULMICORT TURBUHALER (budesonid) og % placebo). Ved å vurdere disse dataene bør den økte gjennomsnittlige eksponeringsvarigheten for pasienter med PULMICORT 200 mcg TURBUHALER (budesonid) (78 dager for PULMICORT TURBUHALER (budesonid) vs. 41 dager for placebo) tas i betraktning.
Pasienter som får PULMICORT TURBUHALER (budesonid) én gang daglig
Bivirkningsprofilen ved administrering én gang daglig av PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg og 400 mcg, og placebo, ble evaluert hos 309 voksne astmatiske pasienter i en 18-ukers studie. Studiepopulasjonen inkluderte både pasienter tidligere behandlet med inhalerte kortikosteroider, og pasienter som ikke tidligere har fått kortikosteroidbehandling. Det var ingen klinisk relevant forskjell i mønsteret av bivirkninger etter administrering én gang daglig av PULMICORT 200 mcg TURBUHALER (budesonid) sammenlignet med dosering to ganger daglig.
Pediatriske studier: en 12-ukers placebokontrollert studie med 404 pediatriske pasienter i alderen 6 til 18 år som tidligere ble holdt på inhalerte kortikosteroider, var frekvensen av bivirkninger for hver alderskategori (6 til 12 år, 13 til 18 år) sammenlignbar for PULMICORT TURBUHALER (budesonid) (ved 100, 200 og 400 mcg to ganger daglig) og placebo. Det var ingen klinisk relevante forskjeller i mønsteret eller alvorlighetsgraden av bivirkninger hos barn sammenlignet med de som ble rapportert hos voksne.
Rapporter om uønskede hendelser fra andre kilder: Sjeldne bivirkninger rapportert i publisert litteratur eller fra verdensomspennende markedsføringserfaring med en formulering av inhalert budesonid inkluderer: umiddelbare og forsinkede overfølsomhetsreaksjoner inkludert utslett, kontaktdermatitt, urticaria, angioødem og bronkospasme; symptomer på hypokortisisme og hyperkortisisme; glaukom, grå stær; psykiatriske symptomer inkludert depresjon, aggressive reaksjoner, irritabilitet, angst og psykose.
NARKOTIKAHANDEL
kliniske studier har samtidig administrering av budesonid og andre legemidler som vanligvis brukes i behandling av astma ikke resultert i økt frekvens av bivirkninger. Hovedmetabolismen av budesonid, så vel som andre kortikosteroider, er via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4). Etter oral administrering av ketokonazol, en potent hemmer av CYP3A4, økte gjennomsnittlig plasmakonsentrasjon av oralt administrert budesonid. Samtidig administrering av andre kjente hemmere av CYP3A4 (f.eks. itrakonazol, klaritromycin, erytromycin, etc.) kan hemme metabolismen av og øke den systemiske eksponeringen for budesonid. Forsiktighet bør utvises når budesonid gis samtidig med langtidsholdig ketokonazol og andre kjente CYP3A4-hemmere.
ADVARSLER
Spesiell forsiktighet er nødvendig for pasienter som er overført fra systemisk aktive kortikosteroider til PULMICORT 200mcg TURBUHALER (budesonid) fordi dødsfall på grunn av binyrebarksvikt har forekommet hos astmatiske pasienter under og etter overgang fra systemiske kortikosteroider til mindre systemisk tilgjengelige inhalerte kortikosteroider. Etter seponering fra systemiske kortikosteroider er det nødvendig med et antall måneder for å gjenopprette funksjonen av hypothalamus-hypofyse-binyrene (HPA).
Pasienter som tidligere har blitt holdt på 20 mg eller mer per dag med prednison (eller tilsvarende) kan være mest utsatt, spesielt når deres systemiske kortikosteroider er nesten fullstendig seponert. I løpet av denne perioden med HPA-undertrykkelse kan pasienter vise tegn og symptomer på binyrebarksvikt når de utsettes for traumer, kirurgi eller infeksjon (spesielt gastroenteritt) eller andre tilstander assosiert med alvorlig elektrolytttap. Selv om PULMICORT TURBUHALER (budesonid) kan gi kontroll over astmasymptomer under disse episodene, tilfører den i anbefalte doser mindre enn normale fysiologiske mengder glukokortikoid systemisk og gir IKKE den mineralokortikoidaktiviteten som er nødvendig for å takle disse nødsituasjonene.
perioder med stress eller et alvorlig astmaanfall, bør pasienter som har blitt seponert fra systemiske kortikosteroider instrueres om å gjenoppta orale kortikosteroider (i store doser) umiddelbart og kontakte lege for videre instruksjon. Disse pasientene bør også instrueres om å bære et medisinsk identifikasjonskort som indikerer at de kan trenge supplerende systemiske kortikosteroider i perioder med stress eller et alvorlig astmaanfall.
Pasienter som trenger orale kortikosteroider bør avvennes sakte fra systemisk kortikosteroidbruk etter overgang til PULMICORT 100mcg TURBUHALER (budesonid). Lungefunksjon (FEV1 eller AM PEF), bruk av beta-agonister og astmasymptomer bør overvåkes nøye under seponering av orale kortikosteroider. I tillegg til å overvåke astmategn og symptomer, bør pasienter observeres for tegn og symptomer på binyrebarksvikt som tretthet, slapphet, svakhet, kvalme og oppkast og hypotensjon.
Overføring av pasienter fra systemisk kortikosteroidbehandling til PULMICORT 200mcg TURBUHALER (budesonid) kan avdekke allergiske tilstander som tidligere er undertrykt av systemisk kortikosteroidbehandling, f.eks. rhinitt, konjunktivitt, leddgikt, eosinofile tilstander og eksem (se DOSERING OG ADMINISTRASJON ).
Pasienter som bruker legemidler som undertrykker immunsystemet er mer utsatt for infeksjon enn friske individer. Vannkopper og meslinger, for eksempel, kan ha et mer alvorlig eller til og med dødelig forløp hos mottakelige pediatriske pasienter eller voksne på immunsuppressive doser av kortikosteroider. Hos pediatriske eller voksne pasienter som ikke har hatt disse sykdommene, bør det utvises spesiell forsiktighet for å unngå eksponering. Hvordan dosen, ruten og varigheten av kortikosteroidadministrasjon påvirker risikoen for å utvikle en spredt infeksjon er ikke kjent. Bidraget fra den underliggende sykdommen og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kjent. Ved eksponering kan behandling med varicella zoster immunglobulin (VZIG) eller sammenslått intravenøst immunglobulin (IVIG), etter behov, være indisert. Ved eksponering for meslinger kan profylakse med sammenslått intramuskulært immunglobulin (IG) være indisert. (Se de respektive pakningsvedleggene for fullstendig forskrivningsinformasjon for VZIG og IG.) Hvis det utvikler seg vannkopper, kan behandling med antivirale midler vurderes.
PULMICORT 200mcg TURBUHALER (budesonid) er ikke en bronkodilatator og er ikke indisert for rask lindring av bronkospasme eller andre akutte episoder av astma.
Som med andre inhalerte astmamedisiner, kan bronkospasme, med en umiddelbar økning i hvesing, oppstå etter dosering. Hvis bronkospasme oppstår etter dosering med PULMICORT TURBUHALER (budesonid), bør den behandles umiddelbart med en hurtigvirkende inhalert bronkodilatator. Behandling med PULMICORT TURBUHALER (budesonid) bør seponeres og alternativ behandling igangsettes.
Pasienter bør instrueres om å kontakte legen sin umiddelbart når astmaepisoder som ikke reagerer på deres vanlige doser av bronkodilatatorer oppstår under behandling med PULMICORT TURBUHALER (budesonid). Under slike episoder kan pasienter trenge behandling med orale kortikosteroider.
FORHOLDSREGLER
Generell
Under seponering fra orale kortikosteroider kan noen pasienter oppleve symptomer på systemisk aktiv kortikosteroidabstinens, f.eks. ledd- og/eller muskelsmerter, slapphet og depresjon, til tross for vedlikehold eller til og med forbedring av respirasjonsfunksjonen (se DOSERING OG ADMINISTRASJON ).
Hos responsive pasienter kan PULMICORT TURBUHALER (budesonid) tillate kontroll av astmasymptomer med mindre undertrykkelse av HPA-aksefunksjonen enn terapeutisk ekvivalente orale doser av prednison. Siden budesonid absorberes i sirkulasjonen og kan være systemisk aktivt, kan de gunstige effektene av PULMICORT 100mcg TURBUHALER (budesonid) for å minimere HPA-dysfunksjon kun forventes når anbefalte doser ikke overskrides og individuelle pasienter titreres til laveste effektive dose. Siden individuell følsomhet for effekter på kortisolproduksjon eksisterer, bør leger vurdere denne informasjonen når de foreskriver PULMICORT 100mcg TURBUHALER (budesonid).
På grunn av muligheten for systemisk absorpsjon av inhalerte kortikosteroider, bør pasienter behandlet med PULMICORT 200mcg TURBUHALER (budesonid) observeres nøye for tegn på systemiske kortikosteroideffekter. Spesiell forsiktighet bør utvises ved observasjon av pasienter postoperativt eller i perioder med stress for tegn på utilstrekkelig binyrerespons.
Det er mulig at systemiske kortikosteroideffekter som hyperkortisisme, redusert bentetthet og binyresuppresjon kan forekomme hos et lite antall pasienter, spesielt ved høyere doser. Hvis slike endringer oppstår, bør PULMICORT 100mcg TURBUHALER (budesonid) reduseres sakte, i samsvar med aksepterte prosedyrer for behandling av astmasymptomer og for nedtrapping av systemiske steroider.
Oralt inhalerte kortikosteroider, inkludert budesonid, kan forårsake en reduksjon i veksthastigheten når de gis til pediatriske pasienter. En reduksjon i veksthastighet kan oppstå som et resultat av utilstrekkelig kontroll av astma eller ved bruk av kortikosteroider til behandling. De potensielle effektene av langvarig behandling på veksthastigheten bør veies opp mot de kliniske fordelene som oppnås og risikoen forbundet med alternative behandlinger. For å minimere de systemiske effektene av oralt inhalerte kortikosteroider, inkludert PULMICORT 200mcg TURBUHALER (budesonid), bør hver pasient titreres til sin laveste effektive dose (se FORHOLDSREGLER, Pediatrisk bruk ).
Selv om pasienter i kliniske studier har fått PULMICORT TURBUHALER (budesonid) på kontinuerlig basis i perioder på 1 til 2 år, er de langsiktige lokale og systemiske effektene av PULMICORT 200mcg TURBUHALER (budesonid) hos mennesker ikke fullstendig kjent. Spesielt er effektene som følge av kronisk bruk av PULMICORT TURBUHALER (budesonid) på utviklings- eller immunologiske prosesser i munn, svelg, luftrør og lunge ukjent.
I kliniske studier med PULMICORT TURBUHALER (budesonid) forekom lokaliserte infeksjoner med Candida albicans i munnen og svelget hos noen pasienter. Disse infeksjonene kan kreve behandling med passende soppdrepende terapi og/eller seponering av behandling med PULMICORT TURBUHALER (budesonid).
Inhalerte kortikosteroider bør brukes med forsiktighet, hvis i det hele tatt, hos pasienter med aktiv eller stillestående tuberkuloseinfeksjon i luftveiene, ubehandlede systemiske soppinfeksjoner, bakterielle, virale eller parasittiske infeksjoner eller okulær herpes simplex.
Sjeldne tilfeller av glaukom, økt intraokulært trykk og grå stær er rapportert etter inhalert administrering av kortikosteroider.
Informasjon til pasienter
Pasienter som behandles med PULMICORT TURBUHALER (budesonid) bør motta følgende informasjon og instruksjoner. Denne informasjonen er ment å hjelpe pasienten med sikker og effektiv bruk av medisinen. Det er ikke en avsløring av alle mulige negative eller tiltenkte effekter. For riktig bruk av PULMICORT 200mcg TURBUHALER (budesonid) og for å oppnå maksimal forbedring, bør pasienten lese og følge den medfølgende Pasientens instruksjoner for forsiktig bruk.
- . Pasienter bør bruke PULMICORT 200mcg TURBUHALER (budesonid) med jevne mellomrom som anvist siden effektiviteten avhenger av regelmessig bruk. Pasienten bør ikke endre den foreskrevne dosen med mindre legen har bedt om det. . Pasienter bør informeres om at PULMICORT 100mcg TURBUHALER (budesonid) ikke er en bronkodilatator og ikke er beregnet på å behandle akutte eller livstruende astmaepisoder. . Pasienter bør informeres om at effektiviteten av PULMICORT 100mcg TURBUHALER (budesonid) avhenger av riktig bruk av enheten og inhalasjonsadministreringsteknikk:
- . 1. PULMICORT TURBUHALER (budesonid) må være i oppreist stilling (munnstykket på toppen) under lasting for å gi riktig dose. . 2. PULMICORT 100mcg TURBUHALER (budesonid) må primes når enheten brukes for første gang. For å prime enheten må den holdes i oppreist stilling og det brune grepet dreies helt til høyre og deretter helt til venstre til det klikker. Gjenta. . 3. For å fylle den første dosen, må grepet dreies helt til høyre og helt til venstre til det klikker. . 4. Etter den første dosen er det ikke nødvendig å prime enheten. Den må imidlertid lastes i oppreist stilling umiddelbart før bruk som beskrevet ovenfor. . 5. Pasienter bør rådes til ikke å riste inhalatoren.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Langtidsstudier ble utført på rotter og mus ved bruk av oral administrering for å evaluere det karsinogene potensialet til budesonid.
en 104-ukers oral studie på Sprague-Dawley-rotter ble det observert en statistisk signifikant økning i forekomsten av gliomer hos hannrotter som fikk en oral dose på 50 mcg/kg/dag (mindre enn den maksimale anbefalte daglige inhalasjonsdosen hos voksne og barn på mcg/m2 basis). Ingen tumorgenisitet ble sett hos hann- og hunnrotter ved respektive orale doser opptil 25 og 50 mcg/kg (mindre enn den maksimale anbefalte daglige inhalasjonsdosen hos voksne og barn på en mcg/m2-basis). I ytterligere to toårige studier med Fischer- og Sprague-Dawley-hannrotter forårsaket budesonid ingen gliomer ved en oral dose på 50 mcg/kg (mindre enn den maksimale anbefalte daglige inhalasjonsdosen hos voksne og barn på mcg/m2-basis). Hos Sprague-Dawley hannrotter forårsaket imidlertid budesonid en statistisk signifikant økning i forekomsten av hepatocellulære svulster ved en oral dose på 50 mcg/kg (mindre enn den maksimale anbefalte daglige inhalasjonsdosen hos voksne og barn på en mcg/m2 basis ). De samtidige referansekortikosteroidene (prednison og triamcinolonacetonid) i disse to studiene viste lignende funn.
Det var ingen tegn på en karsinogen effekt når budesonid ble administrert oralt i 91 uker til mus i doser på opptil 200 mcg/kg/dag (mindre enn den maksimale anbefalte daglige inhalasjonsdosen til voksne og barn på en mcg/m2 basis).
Budesonid var ikke mutagent eller klastogent i seks forskjellige testsystemer: Ames Salmonella/mikrosomplatetest, musemikronukleustest, muselymfomtest, kromosomavvikstest i humane lymfocytter, kjønnsbundet recessiv letal test i Drosophila melanogaster og DNA-reparasjonsanalyse hos rotte hepatocyttkultur.
Hos rotter hadde budesonid ingen effekt på fertiliteten ved subkutane doser opptil 80 mcg/kg (mindre enn den maksimale anbefalte daglige inhalasjonsdosen for mennesker på mcg/m2-basis).
Ved 20 mcg/kg/dag (mindre enn den maksimale anbefalte daglige inhalasjonsdosen for mennesker på mcg/m2-basis) ble det observert reduksjoner i mors kroppsvekt, prenatal levedyktighet og levedyktighet til ungene ved fødsel og under amming. Ingen slike effekter ble observert ved 5 mcg/kg (mindre enn den maksimale anbefalte daglige inhalasjonsdosen hos voksne på en mcg/m2-basis).
Graviditet: Teratogene effekter
Graviditetskategori B: Som med andre glukokortikoider, ga budesonid fostertap, redusert ungvekt og skjelettavvik ved subkutane doser på 25 mcg/kg/dag hos kaniner (mindre enn den maksimale anbefalte daglige inhalasjonsdosen for mennesker på en mcg/m2-basis) og 500 mcg/kg/dag hos rotter (ca. 3 ganger den maksimale anbefalte daglige inhalasjonsdosen for mennesker på mcg/m2-basis).
Ingen teratogene eller embryocidale effekter ble observert hos rotter når budesonid ble administrert ved inhalasjon i doser opptil 250 mcg/kg/dag (tilsvarer den maksimale anbefalte daglige inhalasjonsdosen for mennesker på en mcg/m2-basis).
Erfaring med orale kortikosteroider siden deres introduksjon i farmakologiske i motsetning til fysiologiske doser tyder på at gnagere er mer utsatt for teratogene effekter fra kortikosteroider enn mennesker.
Studier av gravide kvinner har imidlertid ikke vist at PULMICORT TURBUHALER (budesonid) øker risikoen for abnormiteter når det administreres under graviditet. Resultatene fra en stor populasjonsbasert prospektiv kohort epidemiologisk studie som gjennomgikk data fra tre svenske registre som dekker omtrent 99 % av svangerskapene fra 1995-1997 (dvs. det svenske medisinske fødselsregisteret; Register over medfødte misdannelser; Barnkardiologisk register) indikerer ingen økt risiko for medfødte misdannelser ved bruk av inhalert budesonid tidlig i svangerskapet. Medfødte misdannelser ble studert hos 2014 spedbarn født av mødre som rapporterte bruk av inhalert budesonid for astma tidlig i svangerskapet (vanligvis 10-12 uker etter siste menstruasjon), perioden da de fleste større organmisdannelser oppstår. Frekvensen av registrerte medfødte misdannelser var lik sammenlignet med den generelle befolkningen (henholdsvis 3,8 % vs. 3,5 %). I tillegg, etter eksponering for inhalert budesonid, var antallet spedbarn født med orofaciale spalter likt det forventede antallet i normalpopulasjonen (henholdsvis 4 barn vs. 3,3).
De samme dataene ble brukt i en andre studie som brakte totalt til 2534 spedbarn hvis mødre ble utsatt for inhalert budesonid. I denne studien var frekvensen av medfødte misdannelser blant spedbarn hvis mødre ble eksponert for inhalert budesonid tidlig i svangerskapet ikke forskjellig fra frekvensen for alle nyfødte babyer i samme periode (3,6 %).
Til tross for dyrefunnene ser det ut til at muligheten for fosterskader er liten dersom stoffet brukes under graviditet. Likevel, fordi studiene på mennesker ikke kan utelukke muligheten for skade, bør PULMICORT TURBUHALER (budesonid) kun brukes under graviditet hvis det er klart nødvendig.

Ikke-ratatogene effekter
Hypoadrenalisme kan forekomme hos spedbarn født av mødre som får kortikosteroider under graviditet. Slike spedbarn bør observeres nøye.
Ammende mødre
Kortikosteroider skilles ut i morsmelk. På grunn av potensialet for bivirkninger hos ammende spedbarn fra ethvert kortikosteroid, bør det tas en beslutning om å avbryte ammingen eller seponere medikamentet, tatt i betraktning stoffets betydning for moren. Faktiske data for budesonid mangler.
Pediatrisk bruk
Sikkerhet og effektivitet av PULMICORT 100mcg TURBUHALER (budesonid) hos pediatriske pasienter under 6 år har ikke blitt fastslått.
Hos pediatriske astmapasienter var frekvensen av bivirkninger observert med PULMICORT 100mcg TURBUHALER (budesonid) lik mellom 6- til 12-årsgruppen (N=172) sammenlignet med 13- til 17-årsgruppen (N=124) .
Kontrollerte kliniske studier har vist at oralt inhalerte kortikosteroider kan forårsake en reduksjon i veksthastighet hos pediatriske pasienter. Denne effekten har blitt observert i fravær av laboratoriebevis på undertrykkelse av hypothalamus-hypofyse-binyrene (HPA) akse, noe som tyder på at veksthastighet er en mer følsom indikator på systemisk kortikosteroideksponering hos pediatriske pasienter enn noen vanlig brukte tester av HPA-aksefunksjon. De langsiktige effektene av denne reduksjonen i veksthastighet assosiert med oralt inhalerte kortikosteroider, inkludert virkningen på den endelige voksenhøyden, er ukjent. Potensialet for "innhenting" etter seponering av behandling med oralt inhalerte kortikosteroider er ikke tilstrekkelig studert.
en studie av astmatiske barn 5-12 år hadde de som ble behandlet med PULMICORT 200 mcg TURBUHALER (budesonid) 200 mcg to ganger daglig (n=311) en reduksjon i vekst på 1,1 centimeter sammenlignet med de som fikk placebo (n=418) kl. slutten av ett år; forskjellen mellom disse to behandlingsgruppene økte ikke ytterligere over tre år med tilleggsbehandling. Ved slutten av fire år hadde barn behandlet med PULMICORT TURBUHALER (budesonid) og barn behandlet med placebo lignende veksthastigheter. Konklusjoner fra denne studien kan forvirres av ulik bruk av kortikosteroider i behandlingsgruppene og inkludering av data fra pasienter som oppnår pubertet i løpet av studien.
Veksten hos pediatriske pasienter som får oralt inhalerte kortikosteroider, inkludert PULMICORT TURBUHALER (budesonid), bør overvåkes rutinemessig (f.eks. via stadiometri). Potensielle veksteffekter av langvarig behandling bør veies opp mot kliniske fordeler og risikoer og fordeler forbundet med alternative behandlinger. For å minimere de systemiske effektene av inhalerte kortikosteroider, inkludert PULMICORT 100mcg TURBUHALER (budesonid), bør hver pasient titreres til sin laveste effektive dose.
Geriatrisk bruk
Ett hundre pasienter 65 år eller eldre ble inkludert i amerikanske og ikke-amerikanske kontrollerte kliniske studier av PULMICORT 100mcg TURBUHALER (budesonid). Det var ingen forskjeller i sikkerhet og effekt av legemidlet sammenlignet med de som ble sett hos yngre pasienter.
Generelt bør dosevalg for en eldre pasient være forsiktig, vanligvis fra den lave enden av doseringsområdet, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling.
OVERDOSE
Potensialet for akutte toksiske effekter etter overdosering av PULMICORT 100mcg TURBUHALER (budesonid) er lavt. Hvis det brukes i høye doser over lengre perioder, kan systemiske kortikosteroideffekter som hyperkortisisme oppstå (se FORHOLDSREGLER ). PULMICORT TURBUHALER ved to ganger den høyeste anbefalte dosen (3200 mcg daglig) administrert i 6 uker forårsaket en signifikant reduksjon (27 %) i plasmakortisolresponsen på en 6-timers infusjon av ACTH sammenlignet med placebo (+1 %). Den tilsvarende effekten av 10 mg prednison daglig var en 35 % reduksjon i plasmakortisolresponsen på ACTH.
Den minimale dødelige inhalasjonsdosen hos mus var 100 mg/kg (omtrent 320 ganger maksimal anbefalt daglig inhalasjonsdose hos voksne og omtrent 380 ganger maksimal anbefalt daglig inhalasjonsdose hos barn på mcg/m2 basis). Det var ingen dødsfall etter administrering av en inhalasjonsdose på 68 mg/kg hos rotter (omtrent 430 ganger den maksimale anbefalte daglige inhalasjonsdosen hos voksne og omtrent 510 ganger den maksimale anbefalte daglige inhalasjonsdosen hos barn på en mcg/m2 basis). Den minimale orale dødelige dosen var 200 mg/kg hos mus (omtrent 630 ganger maksimal anbefalt daglig inhalasjonsdose hos voksne og omtrent 750 ganger maksimal anbefalt daglig inhalasjonsdose hos barn på mcg/m2 basis) og mindre enn 100 mg/kg hos rotter (omtrent 630 ganger maksimal anbefalt daglig inhalasjonsdose hos voksne og ca. 750 ganger maksimal anbefalt daglig inhalasjonsdose hos barn basert på mcg/m2 basis).
Erfaring etter markedsføring viste at pasienter som opplevde akutt overdose av inhalert budesonid vanligvis forble asymptomatiske. Bruk av for høye doser (opptil 6400 mcg daglig) i lengre perioder viste systemiske kortikosteroideffekter som hyperkortisisme.
KONTRAINDIKASJONER
PULMICORT TURBUHALER (budesonid) er kontraindisert ved primærbehandling av status asthmaticus eller andre akutte astmaepisoder hvor intensive tiltak er nødvendig.
Overfølsomhet overfor budesonid kontraindiserer bruk av PULMICORT TURBUHALER (budesonid).
KLINISK FARMAKOLOGI
Virkningsmekanismen
Budesonid er et anti-inflammatorisk kortikosteroid som viser kraftig glukokortikoid aktivitet og svak mineralokortikoid aktivitet. I standard in vitro- og dyremodeller har budesonid omtrent 200 ganger høyere affinitet for glukokortikoidreseptoren og en 1000 ganger høyere topisk antiinflammatorisk styrke enn kortisol (rottekrotonolje øreødemanalyse). Som et mål på systemisk aktivitet er budesonid 40 ganger kraftigere enn kortisol når det administreres subkutant og 25 ganger kraftigere når det administreres oralt i rottethymus-involusjonsanalysen.
Aktiviteten til PULMICORT 100mcg TURBUHALER skyldes hovedstoffet budesonid. I glukokortikoidreseptoraffinitetsstudier var 22R-formen to ganger så aktiv som 22S-epimeren. In vitro-studier indikerte at de to formene for budesonid ikke konverterer hverandre.
Den nøyaktige mekanismen for kortikosteroidvirkninger på betennelse ved astma er ikke kjent. Betennelse er en viktig komponent i patogenesen av astma. Kortikosteroider har vist seg å ha et bredt spekter av hemmende aktiviteter mot flere celletyper (f.eks. mastceller, eosinofiler, nøytrofiler, makrofager og lymfocytter) og mediatorer (f.eks. histamin, eikosanoider, leukotriener og cytokiner) involvert i allergiske og ikke -allergisk-mediert betennelse. Disse antiinflammatoriske virkningene til kortikosteroider kan bidra til deres effekt ved astma.
Studier på astmatiske pasienter har vist et gunstig forhold mellom lokal antiinflammatorisk aktivitet og systemiske kortikosteroideffekter over et bredt spekter av doser fra PULMICORT 200mcg TURBUHALER (budesonid). Dette forklares av en kombinasjon av en relativt høy lokal anti-inflammatorisk effekt, omfattende førstegangslevernedbrytning av oralt absorbert legemiddel (85-95%) og lav styrke av dannede metabolitter (se nedenfor).
Farmakokinetikk
Absorpsjon:
Etter oral administrering av budesonid ble maksimal plasmakonsentrasjon oppnådd i løpet av 1 til 2 timer og den absolutte systemiske tilgjengeligheten var 6-13 %. Derimot absorberes det meste av budesonid som leveres til lungene systemisk. Hos friske forsøkspersoner ble 34 % av den målte dosen avsatt i lungene (vurdert ved plasmakonsentrasjonsmetoden) med en absolutt systemisk tilgjengelighet på 39 % av den målte dosen. Farmakokinetikken til budesonid er ikke signifikant forskjellig hos friske frivillige og astmatiske pasienter. Maksimal plasmakonsentrasjon av budesonid oppstod innen 30 minutter etter inhalering fra PULMICORT 200mcg TURBUHALER.Hos astmatiske pasienter viste budesonid en lineær økning i AUC og Cmax med økende dose etter både en enkeltdose og gjentatt dosering fra PULMICORT 200mcg TURBUHALER (budesonid).
Fordeling:
Distribusjonsvolumet av budesonid var ca. 3 l/kg. Det var 85-90 % bundet til plasmaproteiner. Proteinbindingen var konstant over konsentrasjonsområdet (1-100 nmol/L) oppnådd med, og overskredet, anbefalte doser av PULMICORT TURBUHALER. Budesonid viste liten eller ingen binding til kortikosteroidbindende globulin. Budesonid kom raskt i likevekt med røde blodceller på en konsentrasjonsuavhengig måte med et blod/plasma-forhold på ca. 0,8.Metabolisme:
In vitro-studier med humane leverhomogenater har vist at budesonid metaboliseres raskt og omfattende. To hovedmetabolitter dannet via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4) katalysert biotransformasjon har blitt isolert og identifisert som 16α-hydroksyprednisolon og 6β-hydroksybudesonid. Kortikosteroidaktiviteten til hver av disse to metabolittene er mindre enn 1 % av den til moderforbindelsen. Ingen kvalitative forskjeller mellom in vitro og in vivo metabolske mønstre er påvist. Ubetydelig metabolsk inaktivering ble observert i humane lunge- og serumpreparater.Utskillelse/eliminering:
22R-formen av budesonid ble fortrinnsvis eliminert av leveren med systemisk clearance på 1,4 l/min vs. 1,0 l/min for 22S-formen. Den terminale halveringstiden, 2 til 3 timer, var den samme for begge epimerene og var uavhengig av dose. Budesonid ble skilt ut i urin og avføring i form av metabolitter. Omtrent 60 % av en intravenøs radiomerket dose ble gjenfunnet i urinen. Det ble ikke påvist uforandret budesonid i urinen.Spesielle populasjoner:
Ingen farmakokinetiske forskjeller er identifisert på grunn av rase, kjønn eller høy alder.Pediatrisk:
Etter intravenøs dosering hos pediatriske pasienter i alderen 10-14 år var plasmahalveringstiden kortere enn hos voksne (1,5 timer vs. 2,0 timer hos voksne). I samme populasjon etter inhalasjon av budesonid via en trykksatt doseinhalator, var den absolutte systemiske tilgjengeligheten lik den hos voksne.Leverinsuffisiens:
Redusert leverfunksjon kan påvirke eliminasjonen av kortikosteroider. Farmakokinetikken til budesonid ble påvirket av kompromittert leverfunksjon, noe som fremgår av en doblet systemisk tilgjengelighet etter oralt inntak. Den intravenøse farmakokinetikken til budesonid var imidlertid lik hos cirrhotiske pasienter og hos friske personer.Legemiddel-legemiddelinteraksjoner:
Ketokonazol, en potent hemmer av cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4), det viktigste metabolske enzymet for kortikosteroider, økte plasmanivåene av oralt inntatt budesonid. Ved anbefalte doser hadde cimetidin en liten, men klinisk ubetydelig effekt på farmakokinetikken til oral budesonid.Farmakodynamikk
For å bekrefte at systemisk absorpsjon ikke er en signifikant faktor i den kliniske effekten av inhalert budesonid, ble det utført en klinisk studie på pasienter med astma som sammenlignet 400 mcg budesonid administrert via en trykksatt doseinhalator med et røravstandsstykke med 1400 mcg oralt budesonid og placebo. Studien viste effekten av inhalert budesonid, men ikke oralt inntatt budesonid til tross for sammenlignbare systemiske nivåer. Således er den terapeutiske effekten av konvensjonelle doser av oralt inhalert budesonid i stor grad forklart av dens direkte virkning på luftveiene.
Generelt sett har PULMICORT TURBUHALER (budesonid) en relativt rask virkningsstart for et inhalert kortikosteroid. Forbedring av astmakontroll etter inhalasjon av PULMICORT TURBUHALER (budesonid) kan forekomme innen 24 timer etter behandlingsstart, selv om maksimal fordel kanskje ikke oppnås før 1 til 2 uker, eller lenger.
PULMICORT TURBUHALER (budesonid) har vist seg å redusere luftveisreaktivitet i ulike utfordringsmodeller, inkludert histamin, metakolin, natriummetabisulfitt og adenosinmonofosfat hos pasienter med hyperreaktive luftveier. Den kliniske relevansen til disse modellene er ikke sikker.
Forbehandling med PULMICORT 200 mcg TURBUHALER (budesonid) 1600 mcg daglig (800 mcg to ganger daglig) i 2 uker reduserte den akutte (tidlige fasereaksjonen) og forsinkede (senfasereaksjonen) reduksjonen i FEV1 etter inhalert allergenutfordring.
Effekten av PULMICORT 200mcg TURBUHALER (budesonid) på hypothalamus-hypofyse-binyre-aksen (HPA) ble studert hos 905 voksne og 404 pediatriske pasienter med astma. For de fleste pasienter forble evnen til å øke kortisolproduksjonen som respons på stress, vurdert ved cosyntropin (ACTH) stimuleringstest, intakt med PULMICORT TURBUHALER (budesonid) behandling ved anbefalte doser. For voksne pasienter behandlet med 100, 200, 400 eller 800 mcg to ganger daglig i 12 uker, hadde henholdsvis 4 %, 2 %, 6 % og 13 % en unormal stimulert kortisolrespons (toppkortisol
Administrering av budesonid via PULMICORT 200 mcg TURBUHALER (budesonid) i doser opptil 800 mcg/dag (gjennomsnittlig daglig dose 445 mcg/dag) eller via en trykksatt avmålt dose-inhalator i doser opp til 1200 mcg/dag (gjennomsnittlig daglig dose 620 mcg. /dag) til 216 pediatriske pasienter (alder 3 til 11 år) i 2 til 6 år hadde ingen signifikant effekt på statural vekst sammenlignet med ikke-kortikosteroidbehandling hos 62 matchede kontrollpasienter. Imidlertid er langtidseffekten av PULMICORT TURBUHALER (budesonid) på vekst ikke fullt kjent.
Kliniske spor
Den terapeutiske effekten av PULMICORT 100mcg TURBUHALER (budesonid) har blitt evaluert i kontrollerte kliniske studier med mer enn 1300 pasienter (6 år og eldre) med astma av varierende sykdomsvarighet (20 år) og alvorlighetsgrad.
Dobbeltblinde, parallelle, placebokontrollerte kliniske studier av 12 ukers varighet og lengre har vist at sammenlignet med placebo, forbedret PULMICORT TURBUHALER (budesonid) lungefunksjonen (målt ved PEF og FEV1), signifikant redusert morgen- og kveldssymptomer på astma , og reduserte betydelig behovet for bruk av inhalert β2-agonist etter behov ved doser på 400 mcg til 1600 mcg per dag (200 mcg til 800 mcg to ganger daglig) hos voksne og 400 mcg til 800 mcg per dag (200 mcg til 400 mcg til 400 mcg to ganger daglig) hos pediatriske pasienter 6 år og eldre.
Forbedret lungefunksjon (morgen-PEF) ble observert innen 24 timer etter behandlingsstart hos både voksne og pediatriske pasienter 6 år og eldre, selv om maksimal fordel ikke ble oppnådd før 1 til 2 uker, eller lenger, etter behandlingsstart. Forbedret lungefunksjon ble opprettholdt gjennom de 12 ukene av den dobbeltblinde delen av forsøkene.
Pasienter som ikke får kortikosteroidbehandling
en 12-ukers klinisk studie med 273 pasienter med mild til moderat astma (gjennomsnittlig baseline FEV1 2,27 L) som ikke var godt kontrollert av bronkodilatatorer alene, ble PULMICORT 200 mcg TURBUHALER (budesonid) evaluert ved doser på 200 mcg kvist to ganger daglig og 400 mcg. daglig versus placebo. FEV1-resultatene fra denne studien er vist i figuren nedenfor. Lungefunksjonen ble signifikant forbedret på begge doser av PULMICORT 100mcg TURBUHALER (budesonid) sammenlignet med placebo.
En 12-ukers prøveperiode med pasienter som ikke tar kortikosteroidterapi før studiestart
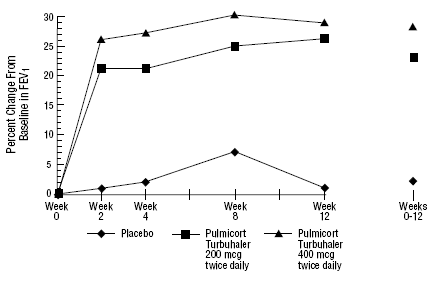
I en 12-måneders kontrollert studie med 75 pasienter som ikke tidligere har fått kortikosteroider, resulterte PULMICORT TURBUHALER (budesonid) ved 200 mcg to ganger daglig i forbedret lungefunksjon (målt ved PEF) og redusert bronkial hyperreaktivitet sammenlignet med placebo.
Pasienter som tidligere ble vedlikeholdt på inhalerte kortikosteroider
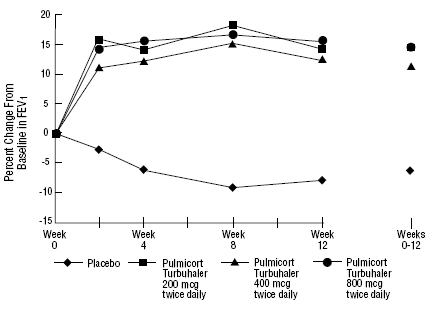
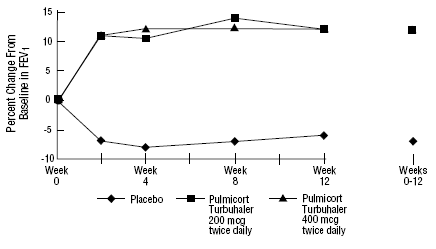
Sikkerheten og effekten av PULMICORT 200 mcg TURBUHALER (budesonid) ble også evaluert hos voksne og pediatriske pasienter (alder 6 til 18 år) som tidligere ble holdt på inhalerte kortikosteroider (voksne: N=473, gjennomsnittlig baseline FEV1 2,04 L, baselinedoser av be-2-6-dipropionatason. -1008 mcg/dag; pediatri: N=404, gjennomsnittlig baseline FEV1 2,09 L, baselinedoser av beklometasondipropionat 126-672 mcg/dag eller triamcinolonacetonid 300-1800 mcg/dag). FEV1-resultatene fra disse to forsøkene, begge 12 ukers varighet, er presentert i følgende figurer. Lungefunksjonen ble signifikant forbedret med alle doser av PULMICORT TURBUHALER (budesonid) sammenlignet med placebo i begge studiene.
Voksne pasienter tidligere vedlikeholdt på inhalerte kortikosteroider
Pediatriske pasienter i alderen 6 til 18 år tidligere vedlikeholdt på inhalerte kortikosteroider
Pasienter som får PULMICORT TURBUHALER (budesonid) én gang daglig
Effekten og sikkerheten ved administrering én gang daglig av PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg og 400 mcg og placebo ble også evaluert hos 309 voksne astmatiske pasienter (gjennomsnittlig baseline FEV1 2,7 l) i en 18-ukers studie. Sammenlignet med placebo, viste pasienter som fikk Pulmicort 200 eller 400 mikrogram én gang daglig signifikant bedre astmastabilitet vurdert ved PEF og FEV1 over en innledende 6-ukers behandlingsperiode, som ble opprettholdt med en daglig dose på 200 mikrogram over de påfølgende 12 ukene. Selv om studiepopulasjonen inkluderte både pasienter som tidligere ble behandlet med inhalerte kortikosteroider, så vel som pasienter som ikke tidligere har mottatt kortikosteroidbehandling, viste resultatene at dosering én gang daglig var tydeligst effektiv for de pasientene som tidligere ble holdt på oralt inhalerte kortikosteroider (se DOSERING OG ADMINISTRASJON ).
Pasienter tidligere vedlikeholdt på orale kortikosteroider
en klinisk studie med 159 alvorlige astmatiske pasienter som trengte kronisk peroral prednisonbehandling (gjennomsnittlig baseline prednisondose 19,3 mg/dag) ble PULMICORT TURBUHALER (budesonid) i doser på 400 mcg to ganger daglig og 800 mcg to ganger daglig sammenlignet med 20-ukers placebo. periode. Omtrent to tredjedeler (68 % på 400 mcg to ganger daglig og 64 % på 800 mcg to ganger daglig) av PULMICORT TURBUHALER (budesonid)-behandlede pasienter var i stand til å oppnå vedvarende (minst 2 uker) oral kortikosteroidseponering (sammenlignet med 8 % av placebo-behandlede pasienter) og forbedret astmakontroll. Den gjennomsnittlige orale kortikosteroiddosen ble redusert med 83 % på 400 mcg to ganger daglig og 79 % på 800 mcg to ganger daglig for PULMICORT TURBUHALER (budesonid)-behandlede pasienter vs. 27 % for placebo. I tillegg forble 58 av 64 pasienter (91%) som fullstendig eliminerte orale kortikosteroider under den dobbeltblinde fasen av studien uten orale kortikosteroider i ytterligere 12 måneder mens de fikk PULMICORT 200mcg TURBUHALER (budesonid).
PASIENTINFORMASJON
Pasientens bruksanvisning
Les dette pakningsvedlegget nøye før du begynner å ta medisinen. Den gir et sammendrag av informasjon om medisinen din. Å følge disse instruksjonene bidrar til å sikre at du inhalerer medisinen riktig.
FOR YTTERLIGERE INFORMASJON SPØR DIN LEGE ELLER Apoteker.
HVA DU BØR VITE OM PULMICORT TURBUHALER (budesonid)
Legen din har foreskrevet PULMICORT TURBUHALER 200 mcg. Den inneholder et medikament kalt budesonid, som er et syntetisk kortikosteroid. Kortikosteroider er naturlige stoffer som finnes i kroppen som bidrar til å bekjempe betennelse. De brukes til å behandle astma fordi de reduserer hevelsen og irritasjonen i veggene til de små luftpassasjene i lungene og letter pusteproblemer. Ved regelmessig inhalering bidrar kortikosteroider også til å forhindre astmaanfall.
PULMICORT TURBUHALER (budesonid) behandler betennelsen – den "stille delen" av astma som du ikke kan høre, se eller føle. Når betennelse forblir ubehandlet, kan astmasymptomene og angrepene øke. PULMICORT 200mcg TURBUHALER (budesonid) virker for å forebygge og redusere astmasymptomer og -anfall.
VIKTIGE PUNKTER Å HUSK OM PULMICORT TURBUHALER (budesonid)
PASS PÅ at dette legemidlet er egnet for deg (se "FØR DU BRUKER PULMICORT TURBUHALER (budesonid)").
Det er viktig at du inhalerer hver dose slik legen din har anbefalt.
Bruk din Turbuhaler som anvist av legen din. IKKE SLUTT BEHANDLING ELLER REDUSER DOSSEN SELV OM DU FØLER DU BEDRE, med mindre legen din får beskjed om det.
IKKE inhaler flere doser eller bruk Turbuhaler oftere enn legen din har instruert.
Denne medisinen er IKKE ment å gi rask lindring av dine pustevansker under et astmaanfall. Det må tas med jevne mellomrom som anbefalt av legen din, og ikke som et nødstiltak.
Legen din kan foreskrive ytterligere medisiner (som bronkodilatatorer) for nødhjelp hvis det er akutt . et astmaanfall reagerer ikke på tilleggsmedisinen, . du trenger mer av tilleggsmedisinen enn vanlig.
Hvis du også bruker et annet legemiddel ved inhalasjon, bør du konsultere legen din for instruksjoner om når du skal bruke den i forhold til bruk av din PULMICORT 100mcg TURBUHALER (budesonid).
FØR DU BRUKER PULMICORT TURBUHALER (budesonid)
FORTELL DIN LEGEN FØR DU BEGYNNER Å BRUKE DENNE MEDISINEN HVIS DU:
- . er gravid (eller har tenkt å bli gravid), . ammer en baby, . er allergisk mot budesonid eller andre oralt inhalerte kortikosteroider, . har noen infeksjoner, . har eller hatt tuberkulose, . har osteoporose, . har nylig vært rundt noen med vannkopper eller meslinger, . planlegger å operere, . har tatt et oralt kortikosteroidmedisin som prednison. Du må kanskje følge spesifikke instruksjoner for å unngå helserisiko forbundet med å slutte å bruke denne typen medisiner.
I noen tilfeller kan dette legemidlet ikke være egnet, og legen din vil kanskje skrive ut et annet legemiddel. Sørg for at legen din vet hvilke andre medisiner du tar, inkludert reseptbelagte og reseptfrie medisiner, samt eventuelle vitaminer eller kosttilskudd og urtetilskudd.
HVA ER DE MULIGE BIVIRKNINGENE AV PULMICORT TURBUHALER (budesonid)?
Som med alle inhalerte kortikosteroider, bør du være oppmerksom på følgende bivirkninger:
- . Økt hvesing rett etter inntak av PULMICORT 100mcg TURBUHALER (budesonid). Ha alltid med deg et korttidsvirkende bronkodilaterende legemiddel for å behandle plutselig hvesing. Korttidsvirkende bronkodilatatorer bidrar til å slappe av musklene rundt luftveiene i lungene. Piping oppstår når musklene rundt luftveiene strammer seg. Dette gjør det vanskelig å puste. I alvorlige tilfeller kan hvesing stoppe pusten og forårsake død hvis den ikke behandles med en gang. . Immunsystemeffekter og større sjanse for infeksjoner. . Øyeproblemer inkludert glaukom og grå stær. Øyeundersøkelser bør vurderes mens du bruker PULMICORT TURBUHALER (budesonid). . Et barns vekst bør kontrolleres regelmessig mens du tar PULMICOR TURBUHALER på grunn av muligheten for redusert vekst.
Basert på kliniske studier er de vanligste bivirkningene rapportert av pasienter som bruker PULMICORT 100mcg TURBUHALER (budesonid):
- . luftveisinfeksjon . hodepine . influensasymptomer . sår hals . bihulebetennelse
Dette er ikke alle de mulige bivirkningene av PULMICORT TURBUHALER (budesonid). For mer informasjon, spør legen din, helsepersonell eller apotek.
BRUKE DIN PULMICORT TURBUHALER (budesonid)
- . Følg instruksjonene vist i avsnittet "HVORDAN BRUKE PULMICORT 200mcg TURBUHALER". Hvis du har problemer, fortell legen din eller apoteket. . Det er viktig at du inhalerer hver dose som anvist av legen din. Apotekets etikett vil vanligvis fortelle deg hvilken dose du skal ta og hvor ofte. Hvis det ikke gjør det, eller du er usikker, spør legen din eller apoteket.
DOSERING
- . Bruk som anvist av legen din. . Det er VELDIG VIKTIG at du følger legens instruksjoner om hvor mange inhalasjoner du skal ta og hvor ofte du skal bruke PULMICORT TURBUHALER (budesonid). . IKKE inhaler flere doser eller bruk PULMICORT TURBUHALER (budesonid) oftere enn legen din anbefaler. . Det kan ta 1 til 2 uker eller lenger før du føler maksimal forbedring, så DET ER VELDIG VIKTIG AT DU BRUKER PULMICORT 100mcg TURBUHALER (budesonid) REGELMESSIG. IKKE SLUTT BEHANDLING ELLER REDUSER DOSSEN SELV OM DU FØLER DU BEDRE, med mindre legen din får beskjed om det. . Hvis du går glipp av en dose, bare ta den faste neste dosen når den skal. IKKE DOBBEL dosen.
HVORDAN DU BRUKER DIN PULMICORT TURBUHALER (budesonid)
Les hele instruksjonene nøye og bruk kun som anvist.
PRIMEINSTRUKSJONER:
Før du bruker en ny PULMICORT 200mcg TURBUHALER (budesonid) for første gang, bør du grunne den. For å gjøre dette, snu dekselet og løft av. Hold PULMICORT TURBUHALER (budesonid) oppreist (med munnstykket opp), vri deretter det brune grepet helt til høyre og tilbake igjen til venstre. Gjenta. Nå er du klar til å ta din første dose (se instruksjonene for "TA EN DOSSE"). Du trenger ikke prime den noen annen gang etter dette, selv om du legger den til side i en lengre periode.
TA EN DOSE:
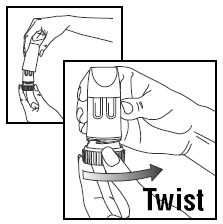
LASTING AV EN DOSE
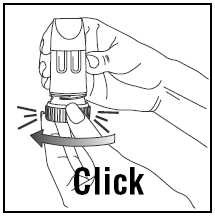
- . Vri dekselet og løft av. . For å gi riktig dose, PULMICORT TURBUHALER (budesonid) må holdes i oppreist stilling (munnstykket opp) hver gang en dose med medisin fylles. . Vri det brune grepet helt til høyre så langt det går. Vri den helt tilbake igjen til venstre. . Du vil høre et klikk.
INNÅNDING AV DOSEN
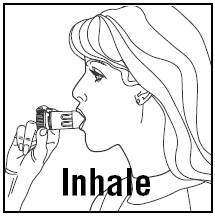
- . Når du inhalerer, må PULMICORT 200mcg TURBUHALER (budesonid) holdes i oppreist (munnstykket opp) eller horisontal stilling. . Snu hodet bort fra inhalatoren og pust ut. Ikke rist inhalatoren etter at den er lastet inn. . Plasser munnstykket mellom leppene og inhaler dypt og kraftig. Du kan ikke smake eller føle medisinen. . Ikke tygg eller bit på munnstykket. . Fjern inhalatoren fra munnen og pust ut. Ikke blås eller pust inn i munnstykket. . Hvis mer enn én dose er nødvendig, gjenta bare trinnene ovenfor. . Når du er ferdig, sett dekselet tilbake på inhalatoren og vri igjen. Skyll munnen med vann. Ikke svelg. . Hold PULMICORT TURBUHALER (budesonid) ren og tørr til enhver tid. . Ikke bruk PULMICORT TURBUHALER (budesonid) hvis den har blitt skadet eller hvis munnstykket har løsnet.
OPPBEVARING AV PULMICORT TURBUHALER (budesonid)
- . Etter hver bruk, sett det hvite dekselet på igjen og vri det godt på plass. . Oppbevar PULMICORT TURBUHALER (budesonid) på et tørt sted ved kontrollert romtemperatur, 68-77°F (20-25°C). . Oppbevar PULMICORT TURBUHALER (budesonid) på et sikkert sted utenfor rekkevidde for små barn. . IKKE bruk etter datoen som er angitt på kroppen av Turbuhaler.
HVORDAN DU VET NÅR DIN PULMICORT TURBUHALER (budesonid) ER TOM
Etiketten på esken eller dekselet vil fortelle deg hvor mange doser det er i PULMICORT TURBUHALER. Din PULMICORT TURBUHALER (budesonid) har et praktisk doseindikatorvindu rett under munnstykket.
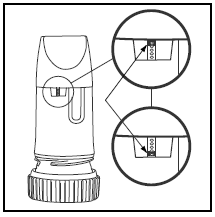
- . Når et rødt merke vises øverst i vinduet, er det 20 doser medisin igjen. Nå er tiden inne for å få din neste PULMICORT 100mcg TURBUHALER (budesonid). . Når det røde merket når bunnen av vinduet, bør inhalatoren din kastes, da den kanskje ikke lenger gir riktig mengde medisiner. (Du kan fortsatt høre en lyd hvis du rister den – denne lyden er ikke medisinen. Denne lyden produseres av tørkemidlet inne i Turbuhaleren.) . Husk at du får en ny inhalator hver gang du fyller på resepten. . Ikke senk den i vann for å finne ut om den er tom. Bare sjekk doseindikatorvinduet.
YTTERLIGERE INFORMASJON OM PULMICORT TURBUHALER (budesonid)
- . PULMICORT 200mcg TURBUHALER (budesonid) leverer medisinen din som et veldig fint pulver. På grunn av dette kan du ikke smake, lukte eller føle medisiner som kommer inn i lungene når du inhalerer fra PULMICORT TURBUHALER (budesonid) Dette betyr ikke at du ikke får medisinen. . PULMICORT 100mcg TURBUHALER (budesonid) skal ikke brukes med et avstandsstykke. . PULMICORT 100mcg TURBUHALER inneholder kun budesonid og inneholder ingen inaktive ingredienser. . PULMICORT TURBUHALER (budesonid) er spesialdesignet for å gi kun én dose om gangen, uansett hvor ofte du klikker på det brune grepet. Hvis du ved et uhell blåser inn i inhalatoren etter å ha lastet en dose, følg ganske enkelt instruksjonene for å fylle en ny dose.
Dette pakningsvedlegget inneholder ikke fullstendig informasjon om medisinen din. Hvis du har spørsmål, eller er usikker på noe, bør du spørre legen din eller apoteket.
Det kan være lurt å lese denne brosjyren på nytt. IKKE KASTE DET før du er ferdig med medisinen.
HUSK: Dette legemidlet er skrevet ut til deg av legen din. IKKE gi denne medisinen til noen andre.
BRUK DETTE PRODUKTET SOM ANVISNINGEN, MED MINDRE LEGEN DIN har fått beskjed om å gjøre noe annet.
Hvis du har flere spørsmål om bruken av PULMICORT 100mcg TURBUHALER (budesonid), ring: 1-800-236-9933.
