Spiriva 9mcg Tiotropium Bromide Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Spiriva 9mcg HandiHaler og hvordan brukes det?
Spiriva HandiHaler (tiotropiumbromid) Inhalasjonspulver er et antikolinergisk legemiddel som brukes for å forhindre bronkospasme (innsnevring av luftveiene i lungene) hos personer med bronkitt, emfysem eller KOLS (kronisk obstruktiv lungesykdom).
Hva er bivirkningene av Spiriva 9mcg HandiHaler?
Vanlige bivirkninger av Spiriva 9mcg HandiHaler inkluderer:
- . tørr i munnen, . forstoppelse, . urolig mage, . oppkast, . forkjølelsessymptomer (tett nese, nysing, sår hals), . neseblod, eller . Muskelsmerte.
Fortell legen din dersom du har noen alvorlige bivirkninger av Spiriva 9mcg HandiHaler, inkludert:
- . vanskelig eller smertefull vannlating, eller . rask hjerterytme.
BESKRIVELSE
SPIRIVA 9mcg HANDIHALER består av SPIRIVA-kapsler og en HANDIHALER-enhet. Hver lysegrønn, hard gelatin SPIRIVA 9 mcg kapsel inneholder et tørt pulver bestående av 18 mcg tiotropium (tilsvarer 22,5 mcg tiotropiumbromidmonohydrat) blandet med laktosemonohydrat (som kan inneholde melkeproteiner).
Innholdet i SPIRIVA-kapslene er kun beregnet for oral inhalasjon, og er kun beregnet for administrering med HANDIHALER-enheten.
Den aktive komponenten i SPIRIVA HANDIHALER er tiotropium. Legemiddelstoffet, tiotropiumbromidmonohydrat, er et antikolinergika med spesifisitet for muskarine reseptorer. Det er kjemisk beskrevet som (1α, 2β, 4β, 5α, 7β)-7-[(hydroksydi-2-tienylacetyl)oksy]-9,9-dimetyl-3-oksa-9-azoniatricyklo[3.3.1.02,4] nonanbromidmonohydrat. Det er en syntetisk, ikke-kiral, kvaternær ammoniumforbindelse. Tiotropiumbromid er et hvitt eller gulaktig hvitt pulver. Det er lite løselig i vann og løselig i metanol.
Strukturformelen er:
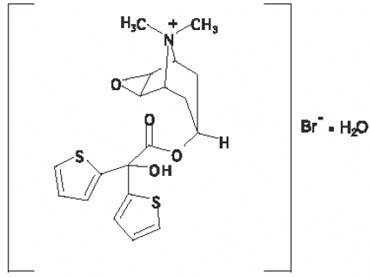
Tiotropiumbromid (monohydrat) har en molekylmasse på 490,4 og en molekylformel på C19H22NO4S2Br • H2O.
HANDIHALER-enheten er en inhalasjonsenhet som brukes til å inhalere det tørre pulveret i SPIRIVA 9mcg-kapselen. Det tørre pulveret leveres fra HANDIHALER-enheten med strømningshastigheter så lave som 20 l/min. Under standardisert in vitro-testing leverer HANDIHALER-enheten et gjennomsnitt på 10,4 mcg tiotropium når den testes ved en strømningshastighet på 39 l/min i 3,1 sekunder (totalt 2 l). I en studie av 26 voksne pasienter med KOLS og alvorlig kompromittert lungefunksjon [gjennomsnittlig FEV1 1,02 L (område 0,45 til 2,24 L); 37,6 % av forutsagt (område 16 % til 65 %)], median peak inspiratory flow (PIF) gjennom HANDIHALER-enheten var 30,0 L/min (område 20,4 til 45,6 L/min). Mengden medikament som leveres til lungene vil variere avhengig av pasientfaktorer som inspiratorisk flow og topp inspiratorisk flow gjennom HANDIHALER-enheten, som kan variere fra pasient til pasient, og kan variere med eksponeringstiden til SPIRIVA 9mcg-kapselen utenfor blisterpakningen. pakke.
INDIKASJONER
SPIRIVA HANDIHALER (tiotropiumbromid inhalasjonspulver) er indisert for langsiktig vedlikeholdsbehandling én gang daglig av bronkospasme assosiert med kronisk obstruktiv lungesykdom (KOLS), inkludert kronisk bronkitt og emfysem. SPIRIVA 9mcg HANDIHALER er indisert for å redusere eksaserbasjoner hos KOLS-pasienter.
DOSERING OG ADMINISTRASJON
Kun for oral inhalasjon. Ikke svelg SPIRIVA 9mcg kapsler, da den tiltenkte effekten på lungene ikke vil oppnås. Innholdet i SPIRIVA-kapslene skal kun brukes med HANDIHALER-enheten [se OVERDOSE ].
Den anbefalte dosen av SPIRIVA HANDIHALER er to inhalasjoner av pulverinnholdet i én SPIRIVA-kapsel, én gang daglig, med HANDIHALER-enheten [se PASIENTINFORMASJON ]. Ikke ta mer enn én dose i løpet av 24 timer.
For administrering av SPIRIVA HANDIHALER, plasseres en SPIRIVA 9mcg kapsel i midtkammeret på HANDIHALER-enheten. SPIRIVA 9mcg-kapselen gjennombores ved å trykke og slippe den grønne piercingsknappen på siden av HANDIHALER-enheten. Tiotropium-formuleringen dispergeres i luftstrømmen når pasienten inhalerer gjennom munnstykket [se PASIENTINFORMASJON ].
Ingen dosejustering er nødvendig for geriatriske, nedsatt lever- eller nyresvikt. Pasienter med moderat til alvorlig nedsatt nyrefunksjon som får SPIRIVA 9mcg HANDIHALER bør imidlertid overvåkes nøye for antikolinerge effekter [se ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner , og KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
Inhalasjonspulver
SPIRIVA 9mcg HANDIHALER består av SPIRIVA-kapsler som inneholder tiotropiumpulver for oral inhalering og en HANDIHALER-enhet. SPIRIVA 9 mcg kapsler inneholder 18 mcg tiotropium i en lysegrønn, hard gelatinkapsel med TI 01 trykt på den ene siden og Boehringer Ingelheim firmalogo på den andre siden. HANDIHALER-enheten er kun beregnet for bruk med SPIRIVA-kapslene.
Oppbevaring og håndtering
SPIRIVA HANDIHALER består av SPIRIVA 9mcg kapsler og HANDIHALER-enheten. SPIRIVA 9 mcg kapsler inneholder 18 mcg tiotropium og er lysegrønne, med Boehringer Ingelheims firmalogo på SPIRIVA kapselhetten og TI 01 på SPIRIVA kapselkroppen, eller omvendt.
HANDIHALER-enheten er grå med en grønn piercingknapp. Den er påtrykt SPIRIVA HANDIHALER (tiotropiumbromid inhalasjonspulver), Boehringer Ingelheims firmalogo. Det er også påtrykt for å indikere at SPIRIVA-kapsler ikke skal oppbevares i HANDIHALER-enheten og at HANDIHALER-enheten kun skal brukes med SPIRIVA 9mcg-kapsler.
SPIRIVA 9mcg kapsler er pakket i et blisterkort av aluminium/aluminium og sammenføyd langs en perforert linje. SPIRIVA 9mcg kapsler skal alltid oppbevares i blisterpakningen og kun fjernes umiddelbart før bruk. Legemidlet skal brukes umiddelbart etter at pakningen over en individuell SPIRIVA-kapsel er åpnet.
Følgende pakker er tilgjengelige:
- . kartong som inneholder 5 SPIRIVA 9 mcg kapsler (1 enhetsdose blisterkort) og 1 HANDIHALER inhalasjonsenhet ( NDC 0597-0075-75) (institusjonspakke) . kartong som inneholder 30 SPIRIVA 9mcg kapsler (3 enhetsdose blisterkort) og 1 HANDIHALER inhalasjonsenhet ( NDC 0597-0075-41) . kartong som inneholder 90 SPIRIVA kapsler (9 enhetsdose blisterkort) og 1 HANDIHALER inhalasjonsenhet ( NDC 0597-0075-47)
Oppbevares utilgjengelig for barn. Ikke få pulver i øynene.
Oppbevaring
Oppbevares ved 25°C (77°F); utflukter tillatt til 15° til 30°C (59° til 86°F) [se USP kontrollert romtemperatur].
SPIRIVA-kapslene bør ikke utsettes for ekstreme temperaturer eller fuktighet. Ikke oppbevar SPIRIVA 9mcg kapsler i HANDIHALER-enheten.
Distribuert av: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Revidert: februar 2018
BIVIRKNINGER
Følgende bivirkninger er beskrevet, eller beskrevet mer detaljert, i andre avsnitt:
- . Umiddelbare overfølsomhetsreaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Paradoksal bronkospasme [se ADVARSLER OG FORHOLDSREGLER ] . Forverring av trangvinklet glaukom [se ADVARSLER OG FORHOLDSREGLER ] . Forverring av urinretensjon [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan forekomsten av bivirkninger observert i de kliniske utprøvingene av et legemiddel ikke sammenlignes direkte med forekomsten i de kliniske utprøvingene av et annet legemiddel, og gjenspeiler kanskje ikke forekomsten observert i praksis.
Prøver på 6 måneder til 1 år
Dataene beskrevet nedenfor gjenspeiler eksponering for SPIRIVA 9mcg HANDIHALER hos 2663 pasienter. SPIRIVA 9mcg HANDIHALER ble studert i to 1-årige placebokontrollerte studier, to 1-årige aktivt kontrollerte studier og to 6-måneders placebokontrollerte studier på pasienter med KOLS. I disse studiene ble 1308 pasienter behandlet med SPIRIVA HANDIHALER ved anbefalt dose på 18 mikrogram én gang daglig. Befolkningen hadde en alder fra 39 til 87 år med 65 % til 85 % menn, 95 % kaukasiske, og hadde KOLS med et gjennomsnittlig pre-bronkodilatator tvungen ekspirasjonsvolum på ett sekund (FEV1) prosent spådd på 39 % til 43 %. Pasienter med trangvinklet glaukom eller symptomatisk prostatahypertrofi eller obstruksjon av blæreutløp ble ekskludert fra disse studiene. En ytterligere 6-måneders prøve utført i en Veteran's Affairs-innstilling er ikke inkludert i denne sikkerhetsdatabasen fordi det kun ble samlet inn alvorlige uønskede hendelser.
Den vanligste rapporterte bivirkningen var munntørrhet. Munntørrhet var vanligvis mild og forsvant ofte under fortsatt behandling. Andre reaksjoner rapportert hos individuelle pasienter og forenlig med mulige antikolinerge effekter inkluderte forstoppelse, takykardi, tåkesyn, glaukom (nyoppstått eller forverret), dysuri og urinretensjon.
Fire multisenter, 1-årige, placebokontrollerte og aktivkontrollerte studier evaluerte SPIRIVA HANDIHALER hos pasienter med KOLS. Tabell 1 viser alle bivirkninger som oppsto med en frekvens på ≥3 % i SPIRIVA 9mcg HANDIHALER-gruppen i de 1-årige placebokontrollerte studiene der frekvensen i SPIRIVA HANDIHALER-gruppen oversteg placebo med ≥1 %. Frekvensen av tilsvarende reaksjoner i de ipratropium-kontrollerte studiene er inkludert for sammenligning.
Leddgikt, hoste og influensalignende symptomer forekom med en hastighet på ≥3 % i SPIRIVA 9mcg HANDIHALER-behandlingsgruppen, men var
Andre reaksjoner som oppstod i SPIRIVA HANDIHALER-gruppen med en frekvens på 1 % til 3 % i de placebokontrollerte studiene der frekvensen oversteg frekvensen i placebogruppen inkluderer:
Kroppen som helhet: allergisk reaksjon, bensmerter;
Sentral- og perifert nervesystem: dysfoni, parestesi;
Forstyrrelser i mage-tarmsystemet: gastrointestinal lidelse ikke spesifisert på annen måte (NOS), gastroøsofageal refluks, stomatitt (inkludert ulcerøs stomatitt);
Metabolske og ernæringsforstyrrelser: hyperkolesterolemi, hyperglykemi;
Sykdommer i muskel- og skjelettsystemet: skjelettsmerter;
Hjertehendelser: angina pectoris (inkludert forverret angina pectoris);
Psykiatrisk lidelse: depresjon; Infeksjoner: herpes zoster;
Sykdom i luftveiene (øvre): laryngitt;
Synsforstyrrelse: grå stær.
I tillegg var atrieflimmer, supraventrikulær takykardi, angioødem og urinretensjon blant bivirkningene observert i de kliniske studiene med en insidens på
de 1-årige forsøkene økte forekomsten av munntørrhet, forstoppelse og urinveisinfeksjon med alderen [se Bruk i spesifikke populasjoner ].
To multisenter, 6-måneders, kontrollerte studier evaluerte SPIRIVA 9mcg HANDIHALER hos pasienter med KOLS. Bivirkningene og forekomsten var lik de som ble sett i de 1-årige kontrollerte studiene.
4-års prøveperiode
Dataene beskrevet nedenfor gjenspeiler eksponering for SPIRIVA 9mcg HANDIHALER hos 5992 KOLS-pasienter i en 4-årig placebokontrollert studie. I denne studien ble 2986 pasienter behandlet med SPIRIVA 9 mcg HANDIHALER ved anbefalt dose på 18 mcg en gang daglig. Befolkningen hadde et aldersspenn fra 40 til 88 år, var 75 % menn, 90 % kaukasiske og hadde KOLS med en gjennomsnittlig pre-bronkodilatator FEV1 prosent spådd på 40 %. Pasienter med trangvinklet glaukom eller symptomatisk prostatahypertrofi eller obstruksjon av blæreutløp ble ekskludert fra disse studiene. Når bivirkningene ble analysert med en frekvens på ≥3 % i SPIRIVA 9mcg HANDIHALER-gruppen der ratene i SPIRIVA 9mcg HANDIHALER-gruppen oversteg placebo med ≥1 %, inkluderte bivirkninger (SPIRIVA 9mcg HANDIHALER, placebo): 12. , 10,8 %), bihulebetennelse (6,5 %, 5,3 %), hodepine (5,7 %, 4,5 %), forstoppelse (5,1 %, 3,7 %), munntørrhet (5,1 %, 2,7 %), depresjon (4,4 %, 3,3 %) , søvnløshet (4,4 %, 3,0 %) og artralgi (4,2 %, 3,1 %).
Ytterligere bivirkninger
Andre bivirkninger som ikke tidligere er oppført og som ble rapportert hyppigere hos KOLS-pasienter behandlet med SPIRIVA 9mcg HANDIHALER enn placebo inkluderer: dehydrering, hudsår, stomatitt, gingivitt, orofaryngeal candidiasis, tørr hud, hudinfeksjon og leddhevelse.
Postmarketing-erfaring
Bivirkninger er identifisert under verdensomspennende bruk av SPIRIVA HANDIHALER etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering. Disse bivirkningene er: Irritasjon på påføringsstedet (glossitt, munnsår og smerter i svelget), svimmelhet, dysfagi, heshet, intestinal obstruksjon inkludert paralytisk ileus, økt intraokulært trykk, oral candidiasis, hjertebank, pruritus, takykardi, halsirritasjon og halsirritasjon.
NARKOTIKAHANDEL
Sympatomimetika, metylxantiner, steroider
SPIRIVA 9mcg HANDIHALER har blitt brukt samtidig med kort- og langtidsvirkende sympatomimetiske (beta-agonister) bronkodilatatorer, metylxantiner og orale og inhalerte steroider uten økning i bivirkninger.
Antikolinergika
Det er potensial for en additiv interaksjon med samtidig brukte antikolinerge medisiner. Unngå derfor samtidig administrering av SPIRIVA 9mcg HANDIHALER med andre legemidler som inneholder antikolinergika, da dette kan føre til en økning i antikolinerge bivirkninger [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Ikke for akutt bruk
SPIRIVA 9mcg HANDIHALER er ment som en vedlikeholdsbehandling én gang daglig for KOLS og skal ikke brukes til lindring av akutte symptomer, dvs. som redningsbehandling for behandling av akutte episoder med bronkospasme.
Umiddelbare overfølsomhetsreaksjoner
Umiddelbare overfølsomhetsreaksjoner, inkludert urticaria, angioødem (inkludert hevelse av lepper, tunge eller svelg), utslett, bronkospasme, anafylaksi eller kløe, kan oppstå etter administrering av SPIRIVA 9mcg HANDIHALER. Hvis en slik reaksjon oppstår, bør behandlingen med SPIRIVA 9mcg HANDIHALER avbrytes umiddelbart og alternativ behandling bør vurderes. Gitt den strukturelle formelen av atropin som ligner på tiotropium, bør pasienter med tidligere overfølsomhetsreaksjoner overfor atropin eller dets derivater overvåkes nøye for lignende overfølsomhetsreaksjoner som SPIRIVA HANDIHALER. I tillegg bør SPIRIVA HANDIHALER brukes med forsiktighet hos pasienter med alvorlig overfølsomhet overfor melkeproteiner.
Paradoksal bronkospasme
Inhalasjonsmedisiner, inkludert SPIRIVA HANDIHALER, kan forårsake paradoksal bronkospasme. Hvis dette skjer, bør det behandles umiddelbart med en inhalert korttidsvirkende beta2-agonist som albuterol. Behandling med SPIRIVA HANDIHALER bør avbrytes og annen behandling vurderes.
Forverring av trangvinklet glaukom
SPIRIVA 9mcg HANDIHALER bør brukes med forsiktighet hos pasienter med trangvinklet glaukom. Forskrivere og pasienter bør være oppmerksomme på tegn og symptomer på akutt trangvinklet glaukom (f.eks. øyesmerter eller ubehag, tåkesyn, visuelle glorier eller fargede bilder i forbindelse med røde øyne fra konjunktival kongestion og hornhinneødem). Instruer pasienter om å oppsøke lege umiddelbart dersom noen av disse tegnene eller symptomene skulle utvikle seg.
Forverring av urinretensjon
SPIRIVA HANDIHALER bør brukes med forsiktighet hos pasienter med urinretensjon. Forskrivere og pasienter bør være oppmerksomme på tegn og symptomer på urinretensjon (f.eks. problemer med å tisse, smertefull vannlating), spesielt hos pasienter med prostatahyperplasi eller blærehalsobstruksjon. Instruer pasienter om å oppsøke lege umiddelbart dersom noen av disse tegnene eller symptomene skulle utvikle seg.
Nedsatt nyrefunksjon
Som et legemiddel som hovedsakelig utskilles gjennom nyrene, bør pasienter med moderat til alvorlig nedsatt nyrefunksjon (kreatininclearance KLINISK FARMAKOLOGI ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON og bruksanvisning ).
Ikke for akutt bruk
Instruer pasienter om at SPIRIVA HANDIHALER er en bronkodilatator for vedlikehold én gang daglig og ikke skal brukes til umiddelbar lindring av pusteproblemer (dvs. som et redningsmedisin).
Umiddelbare overfølsomhetsreaksjoner
Informer pasienter om at anafylaksi, angioødem (inkludert hevelse av lepper, tunge eller svelg), urticaria, utslett, bronkospasme eller kløe, kan oppstå etter administrering av SPIRIVA 9mcg HANDIHALER. Råd pasienten til umiddelbart å avbryte behandlingen og oppsøke lege dersom noen av disse tegnene eller symptomene oppstår.
Paradoksal bronkospasme
Informer pasienter om at SPIRIVA HANDIHALER kan gi paradoksal bronkospasme. Gi pasienter beskjed om at hvis paradoksal bronkospasme oppstår, bør pasientene seponere SPIRIVA HANDIHALER.
Forverring av trangvinklet glaukom
Instruer pasienter om å være på vakt for tegn og symptomer på trangvinklet glaukom (f.eks. øyesmerter eller ubehag, tåkesyn, visuelle glorier eller fargede bilder i forbindelse med røde øyne fra konjunktival kongestion og hornhinneødem). Instruer pasienter om å oppsøke lege umiddelbart dersom noen av disse tegnene og symptomene utvikler seg.
Informer pasientene om at det må utvises forsiktighet for ikke å la pulveret komme inn i øynene, da dette kan føre til tåkesyn og pupillutvidelse.
Siden svimmelhet og tåkesyn kan oppstå ved bruk av SPIRIVA HANDIHALER, må pasienter være forsiktige med å delta i aktiviteter som å kjøre bil eller betjene apparater eller maskiner.
Forverring av urinretensjon
Instruer pasientene om å være oppmerksomme på tegn og symptomer på urinretensjon (f.eks. problemer med å tisse, smertefull vannlating). Instruer pasienter om å oppsøke lege umiddelbart dersom noen av disse tegnene eller symptomene skulle utvikle seg.
Instruksjoner for administrering av SPIRIVA HANDIHALER
Instruer pasienter om hvordan de skal administrere SPIRIVA 9mcg kapsler riktig ved å bruke HANDIHALER-enheten [se PASIENTINFORMASJON ]. Instruer pasienter om at SPIRIVA 9mcg kapsler kun skal administreres via HANDIHALER-enheten og HANDIHALER-enheten ikke skal brukes til å administrere andre medisiner. Minn pasientene på at innholdet i SPIRIVA 9mcg kapsler kun er til oral inhalasjon og ikke må svelges.
Instruer pasienter om å alltid oppbevare SPIRIVA 9mcg kapsler i forseglede blisterpakninger og å fjerne kun én SPIRIVA kapsel rett før bruk, ellers kan effektiviteten reduseres. Instruer pasienter om å kaste ubrukte ekstra SPIRIVA-kapsler som er eksponert for luft (dvs. ikke beregnet for umiddelbar bruk).
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Ingen tegn på tumorigenisitet ble observert i en 104-ukers inhalasjonsstudie på rotter ved tiotropiumdoser på opptil 59 mcg/kg/dag, i en 83-ukers inhalasjonsstudie på hunnmus ved doser opp til 145 mcg/kg/dag, og i en 101-ukers inhalasjonsstudie på hannmus ved doser opptil 2 mcg/kg/dag. Disse dosene tilsvarer henholdsvis ca. 30, 40 og 0,5 ganger den anbefalte humane daglige inhalasjonsdosen (MRHDID) på mcg/m2-basis.
Tiotropiumbromid viste ingen tegn på mutagenisitet eller klastogenisitet i følgende analyser: bakteriell genmutasjonsanalyse, V79 kinesisk hamstercellemutageneseanalyse, kromosomavviksanalyse i humane lymfocytter in vitro og musemikronukleusdannelse in vivo, og den ikke-planlagte DNA-syntesen primære rottehepatocytter in vitro-analyse.
Hos rotter ble reduksjoner i antall corpora lutea og prosentandelen av implantater observert ved inhalasjonsdoser på tiotropium på 78 mcg/kg/dag eller mer (omtrent 40 ganger MRHDID på en mcg/m2 basis). Ingen slike effekter ble observert ved 9 mcg/kg/dag (omtrent 5 ganger MRHDID på mcg/m2-basis). Fertilitetsindeksen ble imidlertid ikke påvirket ved inhalasjonsdoser opp til 1689 mcg/kg/dag (omtrent 910 ganger MRHDID på en mcg/m2 basis).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
De begrensede menneskelige dataene ved bruk av SPIRIVA 9mcg HANDIHALER under graviditet er utilstrekkelige til å informere om en legemiddelrelatert risiko for uønskede graviditetsrelaterte utfall. Basert på reproduksjonsstudier på dyr ble det ikke observert strukturelle abnormiteter når tiotropium ble administrert ved inhalasjon til drektige rotter og kaniner i løpet av organogeneseperioden i doser på henholdsvis 790 og 8 ganger den maksimale anbefalte daglige inhalasjonsdosen for mennesker (MRHDID). Økt post-implantasjonstap ble observert hos rotter og kaniner som ble administrert tiotropium ved maternal toksiske doser henholdsvis 430 ganger og 40 ganger MRHDID [se Data ].
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Data
Dyredata
2 separate embryo-føtale utviklingsstudier mottok drektige rotter og kaniner tiotropium i løpet av organogeneseperioden i doser opp til henholdsvis ca. 790 og 8 ganger MRHDID (på mcg/m2 basis ved inhalasjonsdoser på 1471 og 7 mcg/kg /dag hos henholdsvis rotter og kaniner). Ingen tegn på strukturelle abnormiteter ble observert hos rotter eller kaniner. Hos rotter forårsaket imidlertid tiotropium føtal resorpsjon, kulltap, reduksjon i antall levende unger ved fødselen og gjennomsnittlig ungvekt, og en forsinkelse i kjønnsmodning av unger ved tiotropiumdoser på omtrent 40 ganger MRHDID (på en mcg/m2) basis ved en inhalasjonsdose for mor på 78 mcg/kg/dag). Hos kaniner forårsaket tiotropium en økning i post-implantasjonstap ved en tiotropiumdose på omtrent 430 ganger MRHDID (på en mcg/m2 basis ved en inhalasjonsdose for mor på 400 mcg/kg/dag). Slike effekter ble ikke observert ved henholdsvis ca. 5 og 95 ganger MRHDID (på mcg/m2 basis ved inhalasjonsdoser på 9 og 88 mcg/kg/dag hos henholdsvis rotter og kaniner).
Amming
Risikosammendrag
Det er ingen data på tilstedeværelsen av tiotropium i morsmelk, effekten på spedbarnet som ammes, eller effekten på melkeproduksjonen. Tiotropium finnes i melk fra diegivende rotter; Men på grunn av artsspesifikke forskjeller i ammingsfysiologi, er den kliniske relevansen av disse dataene ikke klar [se Data ]. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for SPIRIVA 9mcg HANDIHALER og eventuelle skadelige effekter på det ammede barnet fra SPIRIVA HANDIHALER eller fra den underliggende morstilstanden.
Data
Fordelingen av tiotropiumbromid i melk ble undersøkt etter en enkelt intravenøs administrering av 10 mg/kg til diegivende rotter. Tiotropium og/eller dets metabolitter er tilstede i melken til diegivende rotter i konsentrasjoner over plasmakonsentrasjonene.
Pediatrisk bruk
SPIRIVA HANDIHALER er ikke indisert for bruk hos barn. Sikkerheten og effektiviteten til SPIRIVA 9mcg HANDIHALER hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Basert på tilgjengelige data er ingen justering av SPIRIVA HANDIHALER-dosen til geriatriske pasienter nødvendig [se KLINISK FARMAKOLOGI ].
Av det totale antallet pasienter som fikk SPIRIVA 9mcg HANDIHALER i de 1-årige kliniske studiene, var 426
Nedsatt nyrefunksjon
Pasienter med moderat til alvorlig nedsatt nyrefunksjon (kreatininclearance DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Effekten av nedsatt leverfunksjon på farmakokinetikken til tiotropium ble ikke studert.
OVERDOSE
Høye doser tiotropium kan føre til antikolinerge tegn og symptomer. Det var imidlertid ingen systemiske antikolinerge bivirkninger etter en enkelt inhalert dose på opptil 282 mikrogram tiotropium hos 6 friske frivillige. I en studie med 12 friske frivillige ble bilateral konjunktivitt og munntørrhet sett etter gjentatt inhalasjon én gang daglig av 141 mikrogram tiotropium.
Behandling av overdosering består av seponering av SPIRIVA HANDIHALER sammen med oppstart av passende symptomatisk og/eller støttende behandling.
Utilsiktet svelging
Akutt forgiftning ved utilsiktet oralt inntak av SPIRIVA-kapsler er usannsynlig siden det ikke absorberes godt systemisk.
Et tilfelle av overdose er rapportert etter markedsføring. En kvinnelig pasient ble rapportert å ha inhalert 30 kapsler over en 2,5 dagers periode, og utviklet endret mental status, skjelvinger, magesmerter og alvorlig forstoppelse. Pasienten ble innlagt på sykehus, SPIRIVA HANDIHALER ble seponert, og forstoppelsen ble behandlet med klyster. Pasienten ble frisk og ble skrevet ut samme dag.
KONTRAINDIKASJONER
SPIRIVA 9mcg HANDIHALER er kontraindisert hos pasienter med overfølsomhet overfor tiotropium, ipratropium eller noen komponenter i dette produktet [se ADVARSLER OG FORHOLDSREGLER ]. I kliniske studier og erfaring etter markedsføring med SPIRIVA 9mcg HANDIHALER, har umiddelbare overfølsomhetsreaksjoner, inkludert angioødem (inkludert hevelse av lepper, tunge eller svelg), kløe eller utslett blitt rapportert [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Tiotropium er et langtidsvirkende, antimuskarin middel, som ofte omtales som et antikolinergika. Den har lignende affinitet til undertypene av muskarine reseptorer, M1 til M5. I luftveiene viser det farmakologiske effekter gjennom hemming av M3-reseptorer ved glattmuskulaturen som fører til bronkodilatasjon. Den konkurrerende og reversible naturen til antagonisme ble vist med reseptorer fra mennesker og dyr og isolerte organpreparater. I prekliniske in vitro- så vel som in vivo-studier var forebygging av metakolininduserte bronkokonstriksjonseffekter doseavhengig og varte i mer enn 24 timer. Bronkodilatasjonen etter inhalasjon av tiotropium er hovedsakelig en stedsspesifikk effekt.
Farmakodynamikk
Hjerteelektrofysiologi
en multisenter, randomisert, dobbeltblind studie med tiotropium tørt pulver til inhalasjon som inkluderte 198 pasienter med KOLS, var antallet personer med endringer fra baseline-korrigert QT-intervall på 30 til 60 msek høyere i SPIRIVA 9mcg HANDIHALER-gruppen sammenlignet med med placebo. Denne forskjellen var tydelig ved bruk av både Bazett (QTcB) [20 (20 %) pasienter vs. 12 (12 %) pasienter] og Fredericia (QTcF) [16 (16 %) pasienter vs. 1 (1 %) pasient] korreksjoner av QT for hjertefrekvens. Ingen pasienter i noen av gruppene hadde verken QTcB eller QTcF på >500 msek. Andre kliniske studier med SPIRIVA HANDIHALER påviste ingen effekt av legemidlet på QTc-intervaller.
Effekten av tiotropium tørt pulver for inhalasjon på QT-intervallet ble også evaluert i en randomisert, placebo- og positiv-kontrollert crossover-studie med 53 friske frivillige. Forsøkspersonene fikk tiotropium tørt pulver for inhalering 18 mcg, 54 mcg (3 ganger anbefalt dose) eller placebo i 12 dager. EKG-vurderinger ble utført ved baseline og gjennom hele doseringsintervallet etter første og siste dose med studiemedisin. I forhold til placebo var den maksimale gjennomsnittlige endringen fra baseline i studiespesifikke QTc-intervall 3,2 msek og 0,8 msek for tiotropium tørt pulver for inhalasjon, henholdsvis 18 mcg og 54 mcg. Ingen forsøkspersoner viste en ny start av QTc >500 msek eller QTc-endringer fra baseline på ≥60 msek.
Farmakokinetikk
Tiotropium administreres ved inhalasjon av tørt pulver. Noen av de farmakokinetiske dataene beskrevet nedenfor ble oppnådd med høyere doser enn anbefalt for terapi. En dedikert farmakokinetisk studie hos pasienter med KOLS som evaluerte tiotropium én gang daglig levert fra RESPIMAT-inhalatoren (5 mcg) og som inhalasjonspulver (18 mcg) fra HANDIHALER-enheten, resulterte i en lignende systemisk eksponering mellom de to produktene.
Absorpsjon
Etter innånding av tørt pulver av unge friske frivillige, antyder den absolutte biotilgjengeligheten på 19,5 % at fraksjonen som når lungen er svært biotilgjengelig. Orale oppløsninger av tiotropium har en absolutt biotilgjengelighet på 2-3 %. Mat forventes ikke å påvirke absorpsjonen av tiotropium. Maksimal plasmakonsentrasjon av tiotropium ble observert 7 minutter etter inhalasjon.
Fordeling
Tiotropium er 72 % bundet til plasmaprotein og hadde et distribusjonsvolum på 32 l/kg etter intravenøs administrering til unge friske frivillige. Lokale konsentrasjoner i lungen er ikke kjent, men administreringsmåten antyder vesentlig høyere konsentrasjoner i lungen. Studier på rotter har vist at tiotropium ikke lett trenger inn i blod-hjerne-barrieren.
Eliminering
Den terminale halveringstiden for tiotropium hos KOLS-pasienter etter en gang daglig inhalasjon av 5 mikrogram tiotropium var ca. 25 timer. Total clearance var 880 ml/min etter intravenøs administrering hos unge friske frivillige. Etter kronisk tørrpulverinhalasjon én gang daglig av KOLS-pasienter, ble farmakokinetisk steady state nådd på dag 7 uten akkumulering deretter.
Metabolisme
Omfanget av stoffskiftet er lite. Dette er tydelig fra en urinutskillelse på 74 % av uendret substans etter en intravenøs dose til unge friske frivillige. Tiotropium, en ester, spaltes ikke-enzymatisk til alkoholen N-metylskopin og ditienylglykolsyre, og ingen av disse binder seg til muskarine reseptorer.
In vitro-eksperimenter med humane levermikrosomer og humane hepatocytter tyder på at en brøkdel av den administrerte dosen (74 % av en intravenøs dose skilles ut uendret i urinen, og etterlater 25 % for metabolisme) metaboliseres av cytokrom P450-avhengig oksidasjon og påfølgende glutationkonjugering til en rekke fase II-metabolitter. Denne enzymatiske veien kan hemmes av CYP450 2D6- og 3A4-hemmere, slik som kinidin, ketokonazol og gestoden. Dermed er CYP450 2D6 og 3A4 involvert i den metabolske veien som er ansvarlig for eliminering av en liten del av den administrerte dosen. In vitro-studier med humane levermikrosomer viste at tiotropium i supraterapeutiske konsentrasjoner ikke hemmet CYP450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 eller 3A4.
Utskillelse
Intravenøst administrert tiotropiumbromid skilles hovedsakelig ut uendret i urinen (74 %). Etter inhalasjon av tørt pulver til KOLS-pasienter ved steady state, var urinutskillelsen 7 % (1,3 mcg) av den uendrede dosen over 24 timer. Renal clearance av tiotropium overstiger kreatininclearance, noe som indikerer sekresjon i urinen.
Spesifikke populasjoner
Geriatriske pasienter
Som forventet for alle legemidler som hovedsakelig utskilles gjennom nyrene, var høy alder assosiert med en reduksjon i renal clearance av tiotropium (365 ml/min hos KOLS-pasienter
Nedsatt nyrefunksjon
Etter 4-ukers SPIRIVA 9mcg HANDIHALER eller SPIRIVA 9mcg RESPIMAT en gang daglig dosering hos pasienter med KOLS, resulterte lett nedsatt nyrefunksjon (kreatininclearance 60-
Nedsatt leverfunksjon
Effekten av nedsatt leverfunksjon på farmakokinetikken til tiotropium ble ikke studert.
Narkotikahandel
En interaksjonsstudie med tiotropium (14,4 mcg intravenøs infusjon over 15 minutter) og cimetidin 400 mg tre ganger daglig eller ranitidin 300 mg én gang daglig ble utført. Samtidig administrering av cimetidin og tiotropium resulterte i en 20 % økning i AUC0-4t, en 28 % reduksjon i renal clearance av tiotropium og ingen signifikant endring i Cmax og mengde utskilt i urin over 96 timer. Samtidig administrering av tiotropium og ranitidin påvirket ikke farmakokinetikken til tiotropium.
Vanlige samtidige medisiner (langtidsvirkende beta2-adrenerge agonister (LABA), inhalerte kortikosteroider (ICS)) brukt av pasienter med KOLS ble ikke funnet å endre eksponeringen for tiotropium.
Kliniske studier
Det kliniske utviklingsprogrammet SPIRIVA 9mcg HANDIHALER (tiotropiumbromid inhalasjonspulver) besto av seks fase 3-studier med 2663 pasienter med KOLS (1308 som fikk SPIRIVA 9mcg HANDIHALER): to 1-årige, placebokontrollerte studier, to 6-måneders, placebokontrollerte studier studier og to 1-årige, ipratropium-kontrollerte studier. Disse studiene inkluderte pasienter som hadde en klinisk diagnose av KOLS, var 40 år eller eldre, hadde en historie med røyking i mer enn 10 pakningsår, hadde et tvungen ekspirasjonsvolum på ett sekund (FEV1) mindre enn eller lik 60 % eller 65 % av forutsagt, og et forhold mellom FEV1/FVC på mindre enn eller lik 0,7.
I disse studiene ga SPIRIVA HANDIHALER, administrert én gang daglig om morgenen, forbedring av lungefunksjonen (FEV1), med maksimal effekt innen 3 timer etter den første dosen.
To ytterligere studier evaluerte forverringer: en 6-måneders, randomisert, dobbeltblind, placebokontrollert, multisenter klinisk studie av 1829 KOLS-pasienter i en US Veterans Affairs-innstilling og en 4-årig, randomisert, dobbeltblind, placebokontrollert, multisenter, klinisk studie av 5992 KOLS-pasienter. Langtidseffekter på lungefunksjon og andre utfall ble også evaluert i den 4-årige multisenterstudien.
6-måneders til 1-års effekter på lungefunksjonen
de 1-årige, placebokontrollerte studiene var gjennomsnittlig forbedring i FEV1 etter 30 minutter 0,13 liter (13 %) med en toppforbedring på 0,24 liter (24 %) i forhold til baseline etter første dose (dag 1). Ytterligere forbedringer i FEV1 og forsert vitalkapasitet (FVC) ble observert med farmakodynamisk steady state nådd på dag 8 med behandling én gang daglig. Den gjennomsnittlige maksimale forbedringen i FEV1, i forhold til baseline, var 0,28 til 0,31 liter (28 % til 31 %), etter 1 uke (dag 8) med behandling én gang daglig. Forbedring av lungefunksjonen ble opprettholdt i 24 timer etter en enkeltdose og konsekvent opprettholdt over den 1-årige behandlingsperioden uten tegn på toleranse.
de to 6-måneders, placebokontrollerte studiene ble det utført seriemessige spirometriske evalueringer gjennom dagtimer i forsøk A (12 timer) og begrenset til 3 timer i forsøk B. De serielle FEV1-verdiene over 12 timer (forsøk A) vises i Figur 1. Disse forsøkene støtter ytterligere forbedringen i lungefunksjon (FEV1) med SPIRIVA 9mcg HANDIHALER, som vedvarte over den spirometriske observasjonsperioden. Effektiviteten ble opprettholdt i 24 timer etter administrering over den 6-måneders behandlingsperioden.
Figur 1: Gjennomsnittlig FEV1 over tid (før og etter administrering av studiemedikament) på dag 1 og 169 for forsøk A (en seks måneders placebokontrollert studie)* 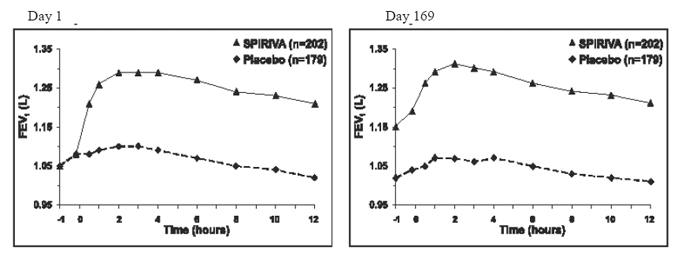
*Betyr justert for senter-, behandlings- og baselineeffekt. På dag 169 fullførte totalt 183 og 149 pasienter i henholdsvis SPIRIVA HANDIHALER- og placebogruppene forsøket. Dataene for de resterende pasientene ble imputert ved å bruke den siste observasjonen eller minst gunstige observasjonen som ble videreført.
Resultatene fra hver av de 1-årige ipratropium-kontrollerte studiene var lik resultatene fra de 1-årige placebo-kontrollerte studiene. Resultatene av en av disse forsøkene er vist i figur 2.
Figur 2: Gjennomsnittlig FEV1 over tid (0 til 6 timer etter dose) på henholdsvis dag 1 og 92 for en av de to Ipratropium-kontrollerte studiene* 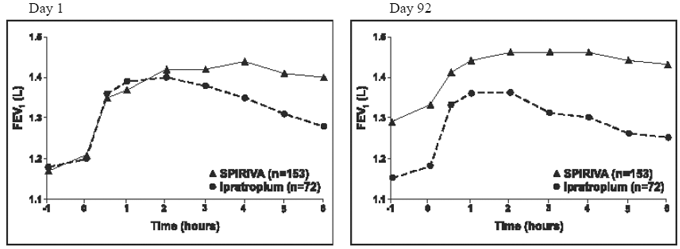
*Betyr justert for senter-, behandlings- og baselineeffekt. På dag 92 (primært endepunkt) fullførte totalt 151 og 69 pasienter i henholdsvis SPIRIVA HANDIHALER- og ipratropium-gruppene gjennom 3 måneders observasjon. Dataene for de resterende pasientene ble imputert ved å bruke den siste observasjonen eller minst gunstige observasjonen som ble videreført.
En randomisert, placebokontrollert klinisk studie med 105 pasienter med KOLS viste at bronkodilatasjon ble opprettholdt gjennom hele 24-timers doseringsintervallet sammenlignet med placebo, uavhengig av om SPIRIVA 9mcg HANDIHALER ble administrert om morgenen eller om kvelden.
Gjennom hver uke av den 1-årige behandlingsperioden i de to placebokontrollerte studiene, hadde pasienter som tok SPIRIVA 9mcg HANDIHALER et redusert behov for bruk av rednings-korttidsvirkende beta2-agonister. Reduksjon i bruk av korttidsvirkende beta2-agonister sammenlignet med placebo ble påvist i en av de to 6-måneders studiene.
4-års effekter på lungefunksjonen
En 4-årig, randomisert, dobbeltblind, placebokontrollert, multisenter klinisk studie med 5992 KOLS-pasienter ble utført for å evaluere langtidseffektene av SPIRIVA HANDIHALER på sykdomsprogresjon (nedgang i FEV1). Pasientene fikk bruke alle luftveismedisiner (inkludert kort- og langtidsvirkende beta-agonister, inhalerte og systemiske steroider og teofylliner) bortsett fra inhalerte antikolinergika. Pasientene var i alderen 40 til 88 år, 75 % menn og 90 % kaukasiske med en diagnose av KOLS og en gjennomsnittlig pre-bronkodilatator FEV1 på 39 % forutsagt (område = 9 % til 76 %) ved studiestart. Det var ingen forskjell mellom gruppene i noen av de co-primære effektendepunktene, årlig nedgang i pre- og post-bronkodilatator FEV1, som demonstrert av lignende fall av FEV1-nedgang over tid (figur 3).
SPIRIVA HANDIHALER opprettholdt forbedringer i bunn (før dose) FEV1 (justert gjennomsnitt over tid: 87 til 103 ml) gjennom de 4 årene av studien (figur 3).
Figur 3: Gjennomsnittsverdier for FEV1 (førdose) ved hvert tidspunkt 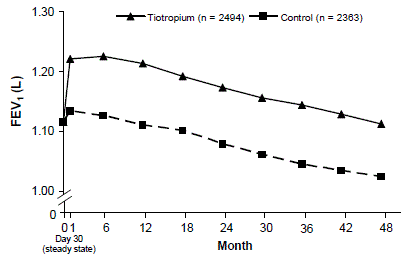
Gjentatt mål ANOVA ble brukt for å estimere gjennomsnitt. Midler er justert for grunnlinjemålinger. Baseline bunn FEV1 (observert gjennomsnitt) = 1,12. Pasienter med ≥3 akseptable lungefunksjonstester etter dag 30 og ikke-manglende baselineverdi ble inkludert i analysen.
Eksacerbasjoner
Effekten av SPIRIVA 9mcg HANDIHALER på KOLS-eksaserbasjoner ble evaluert i to kliniske studier: en 4-årig klinisk studie beskrevet ovenfor og en 6-måneders klinisk studie med 1829 KOLS-pasienter i en Veterans Affair-setting. I den 6-måneders studien ble KOLS-eksaserbasjoner definert som et kompleks av luftveissymptomer (økning eller ny debut) av mer enn ett av følgende: hoste, oppspytt, hvesing, dyspné eller tetthet i brystet med en varighet på minst 3 dager som krever behandling med antibiotika, systemiske steroider eller sykehusinnleggelse. Befolkningen hadde en alder fra 40 til 90 år med 99 % menn, 91 % kaukasiske, og hadde KOLS med en gjennomsnittlig prebronkodilator FEV1 prosent spådd på 36 % (område = 8 % til 93 %). Pasienter ble tillatt å bruke luftveismedisiner (inkludert kort- og langtidsvirkende beta-agonister, inhalerte og systemiske steroider og teofylliner) annet enn inhalerte antikolinergika. I den 6-måneders studien var de co-primære endepunktene andelen pasienter med KOLS-eksaserbasjon og andelen pasienter med sykehusinnleggelse på grunn av KOLS-eksaserbasjonen. SPIRIVA 9mcg HANDIHALER reduserte signifikant andelen KOLS-pasienter som opplevde eksacerbasjoner sammenlignet med placebo (henholdsvis 27,9 % vs. 32,3 %; Odds Ratio (OR) (tiotropium/placebo) = 0,81; 95 % KI = 0,606, p = 0,93; ). Andelen pasienter med sykehusinnleggelse på grunn av KOLS-eksaserbasjoner hos pasienter som brukte SPIRIVA 9mcg HANDIHALER sammenlignet med placebo var henholdsvis 7,0 % vs. 9,5 %; ELLER = 0,72; 95% CI = 0,51, 1,01; p = 0,056.
Eksacerbasjoner ble evaluert som et sekundært resultat i den 4-årige multisenterstudien. I denne studien ble KOLS-eksaserbasjoner definert som en økning eller ny debut av mer enn ett av følgende luftveissymptomer (hoste, sputum, sputumpurulens, hvesing, dyspné) med en varighet på tre eller flere dager som krever behandling med antibiotika og/eller systemiske (orale, intramuskulære eller intravenøse) steroider. SPIRIVA HANDIHALER reduserte risikoen for en eksacerbasjon signifikant med 14 % (Hazard Ratio (HR) = 0,86; 95 % KI = 0,81, 0,91; p

Dødelighet av alle årsaker
den 4-årige placebokontrollerte lungefunksjonsstudien beskrevet ovenfor, ble dødelighet av alle årsaker sammenlignet med placebo vurdert. Det var ingen signifikante forskjeller i dødelighet av alle årsaker mellom SPIRIVA 9mcg HANDIHALER og placebo.
Dødelighet av alle årsaker til SPIRIVA HANDIHALER ble også sammenlignet med tiotropium inhalasjonsspray 5 mcg (SPIRIVA RESPIMAT 5 mcg) i en ekstra langsiktig, randomisert, dobbeltblind, dobbelt-dummy aktiv-kontrollert studie med en observasjonsperiode på opptil 3 år. Dødelighet av alle årsaker var lik mellom SPIRIVA 9mcg HANDIHALER og SPIRIVA RESPIMAT.
PASIENTINFORMASJON
SPIRIVA 9mcgR® (speh REE vah) HANDIHALER® (tiotropiumbromid) Inhalasjonspulver, for oral inhalasjonsbruk
IKKE svelg SPIRIVA kapsler.
Viktig informasjon: Ikke svelg SPIRIVA kapsler. SPIRIVA 9mcg kapsler skal kun brukes med HANDIHALER-enheten og inhaleres gjennom munnen (oral inhalasjon).
Les informasjonen som følger med SPIRIVA HANDIHALER før du begynner å bruke den og hver gang du fyller på resepten. Det kan komme ny informasjon. Dette pakningsvedlegget erstatter ikke å snakke med legen din om din medisinske tilstand eller din behandling.
Hva er SPIRIVA HANDIHALER?
- . SPIRIVA HANDIHALER er et reseptbelagt legemiddel som brukes hver dag (et vedlikeholdsmedisin) for å kontrollere symptomer på kronisk obstruktiv lungesykdom (KOLS), inkludert kronisk bronkitt og emfysem. . SPIRIVA HANDIHALER hjelper til med å få lungene til å fungere bedre i 24 timer. SPIRIVA 9mcg HANDIHALER slapper av luftveiene og hjelper til med å holde dem åpne. Du kan begynne å føle at det er lettere å puste den første dagen, men det kan ta lengre tid før du kjenner den fulle effekten av medisinen. SPIRIVA HANDIHALER fungerer best og kan bidra til å gjøre det lettere å puste når du bruker den hver dag. . SPIRIVA 9mcg HANDIHALER reduserer sannsynligheten for oppblussing og forverring av KOLS-symptomer (KOLS-eksaserbasjoner). En KOLS-forverring er definert som en økning eller ny debut av mer enn ett KOLS-symptom som hoste, slim, kortpustethet og hvesing som krever medisin utover din redningsmedisin.
SPIRIVA 9mcg HANDIHALER er ikke en redningsmedisin og bør ikke brukes til å behandle plutselige pusteproblemer. Legen din kan gi deg annen medisin du kan bruke for plutselige pusteproblemer.
Det er ikke kjent om SPIRIVA 9mcg HANDIHALER er trygt og effektivt hos barn.
Hvem bør ikke ta SPIRIVA 9mcg HANDIHALER?
Ikke bruk SPIRIVA 9mcg HANDIHALER hvis du:
- . er allergisk mot tiotropium, ipratropium (Atrovent®), eller noen av ingrediensene i SPIRIVA 9mcg HANDIHALER. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i SPIRIVA 9mcg HANDIHALER.
Symptomer på en alvorlig allergisk reaksjon på SPIRIVA 9mcg HANDIHALER kan omfatte:
- . hevede røde flekker på huden din (elveblest) . kløe . utslett . hevelse i ansikt, lepper, tunge og svelg som kan forårsake problemer med å puste eller svelge
Hvis du har disse symptomene på en allergisk reaksjon, slutt å ta SPIRIVA HANDIHALER og ring legen din umiddelbart eller gå til nærmeste legevakt.
Hva bør jeg fortelle legen min før jeg bruker SPIRIVA HANDIHALER?
Før du tar SPIRIVA HANDIHALER, fortell legen din om alle dine medisinske tilstander, inkludert hvis du:
- . har nyreproblemer. . har glaukom. SPIRIVA HANDIHALER kan gjøre glaukom verre. . har en forstørret prostata, problemer med å tisse eller en blokkering i blæren. SPIRIVA 9mcg HANDIHALER kan gjøre disse problemene verre. . er gravid eller planlegger å bli gravid. Det er ikke kjent om SPIRIVA HANDIHALER kan skade det ufødte barnet. . ammer eller planlegger å amme. Det er ikke kjent om SPIRIVA HANDIHALER går over i morsmelk. Du og legen din vil avgjøre om SPIRIVA 9mcg HANDIHALER er riktig for deg mens du ammer. . har en alvorlig allergi mot melkeproteiner. Spør legen din hvis du er usikker.
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner og øyedråper, vitaminer og urtetilskudd. Noen av dine andre legemidler eller kosttilskudd kan påvirke måten SPIRIVA HANDIHALER virker på. SPIRIVA 9mcg HANDIHALER er en antikolinerg medisin. Du bør ikke ta andre antikolinerge legemidler mens du bruker SPIRIVA 9mcg HANDIHALER, inkludert ipratropium. Spør legen din eller apoteket hvis du er usikker på om en av medisinene dine er et antikolinergika.
Kjenn til medisinene du tar. Ha en liste over medisinene dine med deg for å vise legen din og apoteket når du får en ny medisin.
Hvordan skal jeg ta SPIRIVA 9mcg HANDIHALER?
- . Bruk SPIRIVA 9mcg HANDIHALER nøyaktig som foreskrevet. Bruk SPIRIVA HANDIHALER én gang hver dag. . Les "Bruksanvisning" på slutten av dette pakningsvedlegget før du bruker SPIRIVA HANDIHALER. Snakk med legen din hvis du ikke forstår instruksjonene. . Ikke svelg SPIRIVA 9mcg kapsler. . Bruk kun SPIRIVA 9mcg kapsler med HANDIHALER-enheten. . Ikke bruk HANDIHALER-enheten til å ta noen annen medisin. . SPIRIVA 9mcg HANDIHALER kommer som et pulver i en SPIRIVA 9mcg kapsel som passer til HANDIHALER-enheten. Hver SPIRIVA-kapsel, som inneholder kun en liten mengde SPIRIVA-pulver, er én full dose medisin. . Skille en blister fra blisterkortet. Ta deretter ut en av SPIRIVA 9mcg kapslene fra blisterpakningen rett før du bruker den. . Etter at kapselen er gjennomboret, ta en fullstendig dose SPIRIVA HANDIHALER ved å puste inn pulveret gjennom munnen to ganger ved å bruke HANDIHALER-enheten (ta 2 inhalasjoner fra én SPIRIVA-kapsel). Se "Instruksjoner for bruk" på slutten av dette pakningsvedlegget. . Kast enhver SPIRIVA-kapsel som ikke er brukt umiddelbart etter at den er tatt ut av blisterpakningen. Ikke la SPIRIVA-kapslene være åpne for luft; de fungerer kanskje ikke like bra. . Hvis du glemmer en dose, ta den så snart du husker det. Ikke bruk SPIRIVA HANDIHALER mer enn én gang hver 24. time. ? Hvis du bruker mer enn den foreskrevne dosen av SPIRIVA HANDIHALER, ring legen din eller et giftkontrollsenter.
Hva bør jeg unngå når jeg bruker SPIRIVA 9mcg HANDIHALER?
- . Ikke la pulveret fra SPIRIVA-kapselen komme inn i øynene. Synet ditt kan bli uskarpt og pupillen i øyet kan bli større (utvide seg). Hvis dette skjer, ring legen din. . SPIRIVA 9mcg HANDIHALER kan forårsake svimmelhet og tåkesyn. Skulle du oppleve disse symptomene bør du være forsiktig når du deltar i aktiviteter som å kjøre bil eller bruke apparater eller andre maskiner.
Hva er de mulige bivirkningene av SPIRIVA HANDIHALER?
SPIRIVA 9mcg HANDIHALER kan forårsake alvorlige bivirkninger, inkludert: Allergisk reaksjon. Symptomer kan omfatte:
- . hevede røde flekker på huden din (elveblest) . kløe . utslett . hevelse i lepper, tunge eller svelg som kan forårsake problemer med å puste eller svelge
Hvis du har disse symptomene på en allergisk reaksjon, slutt å ta SPIRIVA HANDIHALER og ring legen din umiddelbart eller gå til nærmeste legevakt.
- . Plutselig innsnevring og blokkering av luftveiene inn i lungene (bronkospasmer) . Pusten din blir plutselig verre.
Hvis du har disse symptomene på bronkospasme, slutt å ta SPIRIVA 9mcg HANDIHALER og ring legen din med en gang eller gå til nærmeste legevakt.
- . Nytt eller forverret økt trykk i øynene (akutt trangvinklet glaukom). Symptomer på akutt trangvinklet glaukom kan omfatte:
- . øyesmerter . tåkesyn . se glorier (visuelle glorier) eller fargede bilder sammen med røde øyne
Bruk av kun øyedråper for å behandle disse symptomene fungerer kanskje ikke. Hvis du har disse symptomene, slutt å ta SPIRIVA HANDIHALER og ring legen din umiddelbart.
- . Ny eller forverret urinretensjon. Symptomer på blokkering i blæren og/eller forstørret prostata kan omfatte: problemer med å tisse, smertefull vannlating.
Hvis du har disse symptomene på urinretensjon, slutt å ta SPIRIVA HANDIHALER og ring legen din umiddelbart.
Andre bivirkninger med SPIRIVA 9mcg HANDIHALER inkluderer:
- . øvre luftveisinfeksjon . tørr i munnen . bihulebetennelse . sår hals . ikke-spesifikke brystsmerter . urinveisinfeksjon . fordøyelsesbesvær . rennende nese . forstoppelse . økt hjertefrekvens . tåkesyn
Dette er ikke alle mulige bivirkninger med SPIRIVA HANDIHALER. Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan oppbevarer jeg SPIRIVA HANDIHALER?
- . Ikke oppbevar SPIRIVA-kapsler i HANDIHALER-enheten. . Oppbevar SPIRIVA-kapslene i den forseglede blisterpakningen ved romtemperatur 68°F til 77°F (20°C til 25°C). . Hold SPIRIVA-kapsler unna varme og kulde (må ikke fryses). . Oppbevar SPIRIVA 9mcg kapsler på et tørt sted. Kast eventuelle ubrukte SPIRIVA 9mcg kapsler som har vært åpne for luft.
Spør legen din eller apoteket hvis du har spørsmål om oppbevaring av SPIRIVA 9mcg kapsler.
Oppbevar SPIRIVA HANDIHALER, SPIRIVA 9mcg kapsler og alle medisiner utilgjengelig for barn.
Generell informasjon om SPIRIVA HANDIHALER
Medisiner foreskrives noen ganger til andre formål enn de som er oppført i Pasientinformasjonsbrosjyrer. Ikke bruk SPIRIVA 9mcg HANDIHALER til formål det ikke er foreskrevet for. Ikke gi SPIRIVA HANDIHALER til andre selv om de har de samme symptomene som du har. Det kan skade dem.
For mer informasjon om SPIRIVA HANDIHALER, snakk med legen din. Du kan spørre legen din eller apoteket om informasjon om SPIRIVA 9mcg HANDIHALER som er skrevet for helsepersonell.
For mer informasjon om SPIRIVA 9mcg HANDIHALER, gå til www.SPIRIVA.com, eller skann koden nedenfor, eller ring Boehringer Ingelheim Pharmaceuticals, Inc. på 1-800-542-6257 eller (TTY) 1-800-459-9906.
Hva er ingrediensene i SPIRIVA 9mcg HANDIHALER?
Aktiv ingrediens: tiotropium
Inaktiv ingrediens: laktosemonohydrat
Hva er KOLS (kronisk obstruktiv lungesykdom)?
KOLS er en alvorlig lungesykdom som inkluderer kronisk bronkitt, emfysem eller begge deler. De fleste KOLS er forårsaket av røyking. Når du har KOLS, blir luftveiene trange. Så luft beveger seg saktere ut av lungene dine. Dette gjør det vanskelig å puste.
Denne pasientinformasjonen er godkjent av US Food and Drug Administration.
INSTRUKSJONER FOR BRUKSPIRIVA® (speh REE vah) HANDIHALER® (tiotropiumbromid) inhalasjonspulver, for oral inhalasjonsbruk
Ikke svelg SPIRIVA kapsler.
Viktig informasjon om bruk av SPIRIVA HANDIHALER
- . Ikke svelg SPIRIVA 9mcg kapsler. . SPIRIVA-kapsler skal kun brukes med HANDIHALER-enheten og inhaleres gjennom munnen (oral inhalasjon). . Ikke bruk HANDIHALER-enheten til å ta noen annen medisin.
Les først pasientinformasjonen, les deretter denne bruksanvisningen før du begynner å bruke SPIRIVA HANDIHALER og hver gang du fyller på resepten. Det kan komme ny informasjon.
Bli kjent med HANDIHALER-enheten og SPIRIVA-kapslene:
Din SPIRIVA HANDIHALER leveres med SPIRIVA 9mcg kapsler i blisterpakning og en HANDIHALER-enhet. Bruk den nye HANDIHALER-enheten som følger med medisinen.
Delene til HANDIHALER-enheten inkluderer:
(Se figur A)
. støvhette (lokk) . munnstykke . munnstykkerygg . utgangspunkt . grønn piercingknapp . midtkammer . luftinntaksventiler 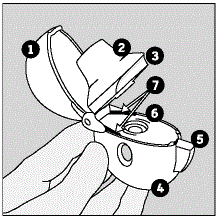
Figur A
Hver SPIRIVA 9mcg kapsel er pakket i en blisterpakning. (Se figur B)
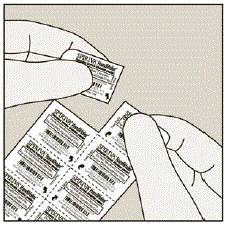
Figur B
- . Hver SPIRIVA-kapsel inneholder kun en liten mengde pulver. (Se figur C) Dette er 1 full dose. . Ikke åpne SPIRIVA 9mcg-kapselen eller det fungerer kanskje ikke.

Figur C
Å ta din fulle daglige dose med medisin krever 4 hovedtrinn.
Trinn 1. Åpne HANDIHALER-enheten:
Etter at du har fjernet HANDIHALER-enheten fra posen:
- . Åpne støvhetten (lokket) ved å trykke på den grønne piercingknappen. (Se figur D)
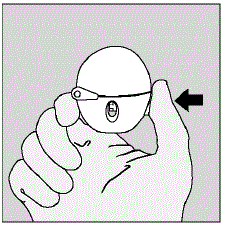
Figur D
- . Trekk støvhetten (lokket) oppover vekk fra basen for å avdekke munnstykket. (Se figur E)
Figur E
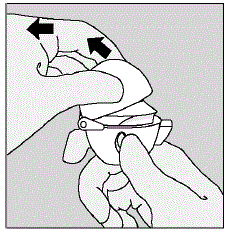
- . Åpne munnstykket ved å trekke munnstykkeryggen opp og bort fra basen slik at midtkammeret vises. (Se figur F)

Figur F
Trinn 2. Sette inn SPIRIVA 9mcg-kapselen i HANDIHALER-enheten:
Hver dag, skille kun 1 av blemmene fra blisterkortet ved å rive langs den perforerte linjen. (Se figur G)
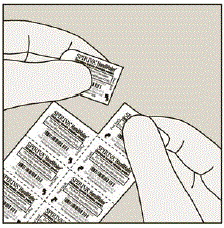
Figur G
Fjern SPIRIVA-kapselen fra blisterpakningen:
- . Ikke kutt folien eller bruk skarpe instrumenter for å ta ut SPIRIVA-kapselen fra blisterpakningen. . Bøy 1 av blisterhjørnene med en pil og separer aluminiumsfolielagene. . Trekk av den trykte folien til du ser hele SPIRIVA-kapselen. (Se figur H) . Hvis du har åpnet mer enn 1 blisterpakning i luften, skal den ekstra SPIRIVA 9mcg kapselen ikke brukes og skal kastes.
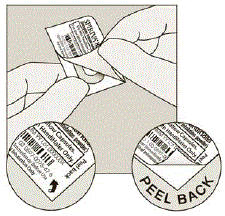
Figur H
Plasser SPIRIVA 9mcg-kapselen i midtkammeret på HANDIHALER-enheten. (Se figur I)
Figur I
Lukk munnstykket godt mot den grå basen til du hører et klikk. La støvhetten (lokket) stå åpen. (Se figur J)
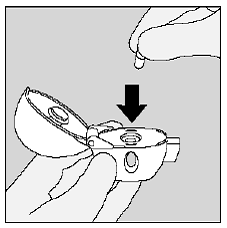
Figur J
Trinn 3. Piercing av SPIRIVA 9mcg-kapselen:
- . Hold HANDIHALER-enheten med munnstykket pekt opp. (Se figur K) . Trykk på den grønne piercingsknappen én gang til den er flat (flukt) mot basen, og slipp deretter. Slik lager du hull i SPIRIVA-kapselen slik at du får i deg medisinen når du puster inn. . Ikke trykk på den grønne knappen mer enn én gang. . Ikke rist HANDIHALER-enheten. . Piercingen av SPIRIVA 9mcg kapselen kan produsere små gelatinbiter. Noen av disse små bitene kan passere gjennom skjermen på HANDIHALER-enheten og inn i munnen eller halsen når du puster inn medisinen. Dette er normalt. De små gelatinbitene skal ikke skade deg.
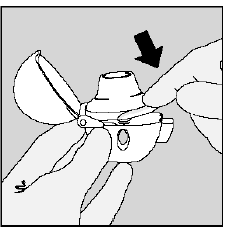
Figur K
Trinn 4. Ta din fulle daglige dose (2 inhalasjoner fra samme SPIRIVA 9mcg kapsel):
Pust helt ut i 1 pust, tømme lungene for luft. (Se figur L)
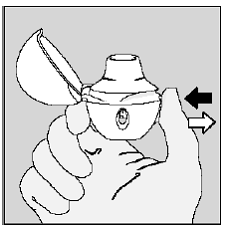
Figur L
Viktig: Ikke gjør det puste inn i HANDIHALER-enheten.
Med neste pust, ta medisinen din:
- . Hold hodet i oppreist stilling mens du ser rett frem. (Se figur M) . Løft HANDIHALER-enheten til munnen i horisontal posisjon. Ikke blokker luftinntaksventilene. . Lukk leppene godt rundt munnstykket. . Pust dypt inn til lungene dine er fulle. Du burde høre eller kjenne SPIRIVA-kapselen vibrere (skrangle). (Se figur M) . Hold pusten i noen sekunder og ta samtidig HANDIHALER-enheten ut av munnen. . Pust normalt igjen.
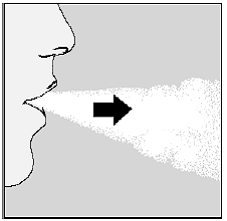
Figur M
Ranglen forteller deg at du pustet inn riktig. Hvis du ikke hører eller føler en rangling, se avsnittet "Hvis du ikke hører eller føler at SPIRIVA-kapselen rasler mens du puster inn medisinen."
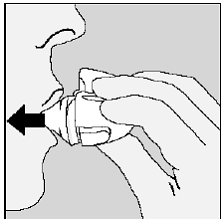
Figur N
For å få den fulle daglige dosen må du igjen puste helt ut (se figur N) og for andre gang puste inn (se figur O) fra samme SPIRIVA-kapsel.
Viktig: Ikke gjør det trykk på den grønne piercingknappen igjen.
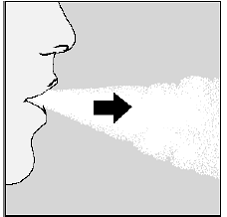
Figur O
Huske: For å få full medisindose hver dag, må du puste inn 2 ganger fra samme SPIRIVA 9mcg kapsel. Pass på at du puster helt ut hver gang før du puster inn fra HANDIHALER-enheten.
Ta vare på og oppbevare din SPIRIVA HANDIHALER:
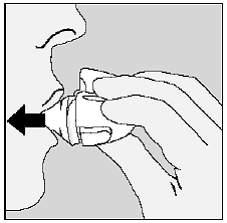
Figur P
- . Etter å ha tatt den daglige dosen, åpne munnstykket og vipp ut den brukte SPIRIVA 9mcg kapselen i søppelbøtten din, uten å berøre den. . Fjern eventuelle SPIRIVA 9mcg kapselbiter eller SPIRIVA 9mcg pulver ved å snu HANDIHALER enheten opp ned og banke forsiktig, men bestemt på den. (Se figur P) Lukk deretter munnstykket og støvhetten for oppbevaring. . Ikke oppbevar HANDIHALER-enheten og SPIRIVA 9mcg-kapsler (blister) på et fuktig fuktig sted. Oppbevar alltid SPIRIVA-kapslene i forseglede blisterpakninger.
Hvis du ikke hører eller føler at SPIRIVA 9mcg kapselen rasler mens du puster inn medisinen:
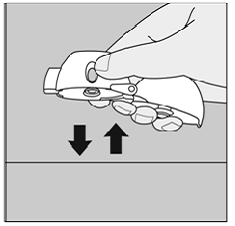
Figur Q
Ikke trykk på den grønne piercingknappen igjen.
Hold HANDIHALER-enheten med munnstykket pekt opp og bank HANDIHALER-enheten forsiktig på et bord. (Se figur Q)
Sjekk at munnstykket er helt lukket. Pust helt ut før du puster dypt inn igjen med munnstykket i munnen. (Se figur O)
Hvis du fortsatt ikke hører eller føler at SPIRIVA-kapselen rasler etter å ha gjentatt trinnene ovenfor:
- . Kast SPIRIVA-kapselen. . Åpne basen ved å løfte den grønne piercingsknappen og sjekk det midterste kammeret for deler av SPIRIVA 9mcg-kapselen. SPIRIVA 9mcg kapselbiter i midtkammeret kan føre til at en SPIRIVA 9mcg kapsel ikke rasler. . Snu HANDIHALER-enheten opp ned og trykk forsiktig, men bestemt for å fjerne SPIRIVA-kapselbitene. Ring legen din for instruksjoner.
Rengjøring av HANDIHALER-enheten:
Rengjør HANDIHALER-enheten etter behov. (Se figur R)
- . Det tar 24 timer å lufttørke HANDIHALER-enheten etter at du har rengjort den. . Ikke bruk rengjøringsmidler eller vaskemidler. . Ikke plasser HANDIHALER-enheten i oppvaskmaskinen for rengjøring.
Rengjøringstrinn:
- . Åpne støvhetten og munnstykket. . Åpne basen ved å løfte den grønne piercingknappen. . Se i midtkammeret etter SPIRIVA 9mcg kapselbiter eller pulveroppbygging. Hvis du ser det, trykk ut. . Skyll HANDIHALER-enheten med varmt vann, trykk på den grønne piercingknappen noen ganger slik at midtkammeret og piercingnålen er under rennende vann. Sjekk at eventuell pulveroppsamling eller SPIRIVA-kapselbiter er fjernet. . Tørk HANDIHALER-enheten godt ved å helle overflødig vann ut på et papirhåndkle. Lufttørk etterpå, la støvhetten, munnstykket og basen stå åpne ved å spre det helt ut slik at det tørker helt. . Ikke bruk en hårføner til å tørke HANDIHALER-enheten. . Ikke bruk HANDIHALER-enheten når den er våt. Om nødvendig kan du rengjøre utsiden av munnstykket med en ren fuktig klut.
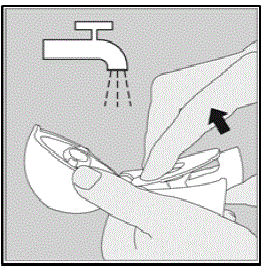
Figur R
Nyttige tips for å sikre at du tar den fulle daglige dosen av SPIRIVA 9mcg HANDIHALER på riktig måte:
- . trykk den grønne piercingknappen gang; Pust inn 2 ganger; Pust helt ut før hver av de 2 inhalasjonene. . Bruk alltid den nye HANDIHALER-enheten som følger med medisinen. . Hold HANDIHALER-enheten med munnstykket pekt opp når du trykker på den grønne piercingknappen. . Trykk på den grønne piercingknappen én gang for å stikke hull i SPIRIVA-kapselen. . Ikke pust ut i HANDIHALER-enheten. . Hold HANDIHALER-enheten i horisontal posisjon og hold hodet oppreist, se rett frem når du puster inn. . Sjekk det midtre kammeret på HANDIHALER-enheten for SPIRIVA 9mcg kapselbiter eller pulveroppbygging. Hvis du ser biter eller pulver, bank ut før bruk. . Rengjør HANDIHALER etter behov og tørk grundig.
For mer informasjon, spør legen din eller apoteket, eller gå til www.spiriva.com, eller skann koden nedenfor, eller ring 1-800-542-6257 eller (TTY) 1-800-459-9906.
Denne bruksanvisningen er godkjent av US Food and Drug Administration.
