Singulair 10mg, 4mg, 5mg Montelukast Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Singulair og hvordan brukes det?
Singulair 5mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på astma, anstrengelsesutløst bronkospasme og allergisk eller helårs (perennial) rhinitt. Singulair kan brukes alene eller sammen med andre medisiner.
- . Singulair tilhører en klasse medikamenter som kalles Leukotriene-reseptorantagonister. . Det er ikke kjent om Singulair er trygt og effektivt hos barn yngre enn 1 år.
Hva er de mulige bivirkningene av Singulair?
Singulair kan forårsake alvorlige bivirkninger, inkludert:
- . uvanlige endringer i humør eller atferd, . hudutslett, . blåmerker, . kraftig prikking, . nummenhet, . smerte, . muskel svakhet, . øresmerter, . opphovning, . varme, . feber, . sår hals, . hevelse i ansiktet eller tungen, . brenner i øynene, og . hudsmerter, etterfulgt av et rødt eller lilla utslett som sprer seg til overkroppen og forårsaker blemmer og avskalling
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Singulair inkluderer:
- . magesmerter, . diaré, . feber, . influensasymptomer, . forkjølelsessymptomer (tett nese, bihulesmerter, hoste, sår hals), . hodepine, og . sengevæting eller tap av blærekontroll hos barn
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Singulair. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Montelukastnatrium, den aktive ingrediensen i SINGULAIR 4mg, er en selektiv og oralt aktiv leukotrienreseptorantagonist som hemmer cysteinylleukotrien CysLT1-reseptoren.
Montelukastnatrium er kjemisk beskrevet som [R-(E)]-1-[[[1-[3-[2-(7-klor-2-kinolinyl)etenyl]fenyl]-3-[2-(1-hydroksy] -1-metyletyl)fenyl]propyl]tio]metyl]cyklopropaneddiksyre, mononatriumsalt.
Den empiriske formelen er C35H35ClNNaO3S, og dens molekylvekt er 608,18. Strukturformelen er:
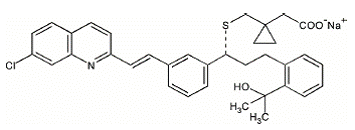
Montelukastnatrium er et hygroskopisk, optisk aktivt, hvitt til off-white pulver. Montelukastnatrium er fritt løselig i etanol, metanol og vann og praktisk talt uløselig i acetonitril.
Hver 10 mg filmdrasjerte SINGULAIR-tablett inneholder 10,4 mg montelukastnatrium, som tilsvarer 10 mg montelukast, og følgende inaktive ingredienser: mikrokrystallinsk cellulose, laktosemonohydrat, kroskarmellosenatrium, hydroksypropylcellulose og magnesiumstearat. Filmbelegget består av hydroksypropylmetylcellulose, hydroksypropylcellulose, titandioksid, rødt jernoksid, gult jernoksid og karnaubavoks.
Hver 4-mg og 5-mg tyggbare SINGULAIR-tablett inneholder henholdsvis 4,2 og 5,2 mg montelukastnatrium, som tilsvarer henholdsvis 4 og 5 mg montelukast. Begge tyggetablettene inneholder følgende inaktive ingredienser: mannitol, mikrokrystallinsk cellulose, hydroksypropylcellulose, rødt jernoksid, kroskarmellosenatrium, kirsebærsmak, aspartam og magnesiumstearat.
Hver pakke med SINGULAIR 4 mg orale granulat inneholder 4,2 mg montelukastnatrium, som tilsvarer 4 mg montelukast. Den orale granulatformuleringen inneholder følgende inaktive ingredienser: mannitol, hydroksypropylcellulose og magnesiumstearat.
INDIKASJONER
Astma
SINGULAIR® er indisert for profylakse og kronisk behandling av astma hos voksne og pediatriske pasienter 12 måneder og eldre.
Anstrengelsesutløst bronkokonstriksjon (EIB)
SINGULAIR er indisert for forebygging av anstrengelsesutløst bronkokonstriksjon (EIB) hos pasienter 6 år og eldre.
Allergisk rhinitt
SINGULAIR 10mg er indisert for lindring av symptomer på sesongmessig allergisk rhinitt hos pasienter 2 år og eldre og flerårig allergisk rhinitt hos pasienter 6 måneder og eldre. Fordi fordelene med SINGULAIR 4mg kanskje ikke oppveier risikoen for nevropsykiatriske symptomer hos pasienter med allergisk rhinitt [se ADVARSLER OG FORHOLDSREGLER ], reservebruk for pasienter som har utilstrekkelig respons eller intoleranse for alternative behandlinger.
Bruksbegrensninger
SINGULAIR er ikke indisert for behandling av et akutt astmaanfall.
DOSERING OG ADMINISTRASJON
Astma
For astma, administrer SINGULAIR oralt en gang daglig om kvelden, med eller uten mat. Det har ikke vært noen kliniske studier hos pasienter med astma for å evaluere den relative effekten av dosering morgen versus kveld.
Følgende doser anbefales:
Pasienter som glemmer en dose bør ta neste dose til vanlig tid og bør ikke ta 2 doser samtidig.
Anstrengelsesutløst bronkokonstriksjon (EIB)
For å forebygge EIB, administrer en enkeltdose SINGULAIR 10 mg oralt minst 2 timer før trening. Følgende doser anbefales:
En ekstra dose av SINGULAIR bør ikke tas innen 24 timer etter en tidligere dose. Pasienter som allerede tar SINGULAIR daglig for en annen indikasjon (inkludert kronisk astma), bør ikke ta en ekstra dose for å forhindre EIB. Alle pasienter bør ha en korttidsvirkende β-agonist tilgjengelig for redning.
Daglig administrering av SINGULAIR for kronisk behandling av astma er ikke etablert for å forhindre akutte episoder av EIB.
Allergisk rhinitt
For allergisk rhinitt, administrer SINGULAIR 5 mg oralt én gang daglig uten hensyn til tidspunktet for matinntak. Administrasjonstidspunkt hos pasienter med allergisk rhinitt kan individualiseres for å passe pasientens behov.
Følgende doser for behandling av symptomer på sesongmessig allergisk rhinitt anbefales:
Tabell 3: Anbefalt dosering ved sesongmessig allergisk rhinitt
Pasienter som glemmer en dose bør ta neste dose til vanlig tid og bør ikke ta 2 doser samtidig.
Astma og allergisk rhinitt
For pasienter med både astma og allergisk rhinitt, administrer kun én SINGULAIR-dose oralt én gang daglig om kvelden.
Pasienter som glemmer en dose bør ta neste dose til vanlig tid og bør ikke ta 2 doser samtidig.
Instruksjoner for administrering av orale granulat
SINGULAIR 4-mg orale granulat kan administreres enten direkte i munnen, oppløses i 1 teskje (5 ml) kald eller romtemperatur babyerstatning eller morsmelk, eller blandes med en skje med kald eller romtemperatur myk mat; basert på stabilitetsstudier bør kun eplemos, gulrøtter, ris eller iskrem brukes. Pakken skal ikke åpnes før den er klar til bruk. Etter åpning av pakken må hele dosen (med eller uten blanding med morsmelkerstatning, morsmelk eller mat) administreres innen 15 minutter. Hvis det blandes med morsmelkerstatning, morsmelk eller mat, må SINGULAIR 4 mg orale granulat ikke oppbevares for fremtidig bruk. Kast ubrukt del. SINGULAIR orale granulat er ikke ment å løses opp i annen væske enn morsmelkerstatning eller morsmelk for administrering. Væsker kan imidlertid tas etter administrering. SINGULAIR orale granulat kan administreres uten hensyn til tidspunktet for måltidene.
HVORDAN LEVERES
Doseringsformer og styrker
Nettbrett
10 mg, beige, avrundede firkantede, filmdrasjerte tabletter, med kode MSD 117 på den ene siden og SINGULAIR 4mg på den andre.
Tyggetabletter
5 mg, rosa, rund, bi-konveks formet, med kode MSD 275 på den ene siden og SINGULAIR på den andre.
Tyggetabletter
4 mg, rosa, oval, bi-konveks formet, med kode MSD 711 på den ene siden og SINGULAIR på den andre.
Orale granulat
4 mg, hvite granulat med 500 mg nettovekt, pakket i en barnesikker foliepakke.
Oppbevaring og håndtering
SINGULAIR 4 mg orale granulat : hvite granuler med 500 mg nettovekt, pakket i en barnesikker foliepakke.
NDC 0006-3841-30 bruksenhetskartong med 30 pakker.
SINGULAIR 4 mg tabletter : rosa, ovale, bi-konvekse tyggetabletter, med kode MSD 711 på den ene siden og SINGULAIR 10mg på den andre.
NDC 0006-1711-31 bruksenhet med høy tetthet polyetylen (HDPE) flasker på 30 med en barnesikker hette av polypropylen, en induksjonsforsegling av aluminiumsfolie og silikagel-tørkemiddel.
SINGULAIR 5 mg tabletter rosa, runde, bi-konvekse tyggetabletter, med kode MSD 275 på den ene siden og SINGULAIR på den andre.
NDC 0006-9275-31 bruksenhet med høy tetthet polyetylen (HDPE) flasker på 30 med en barnesikker hette av polypropylen, en induksjonsforsegling av aluminiumsfolie og silikagel-tørkemiddel.
SINGULAIR 10 mg tabletter : beige, avrundede firkantede, filmdrasjerte tabletter, med kode MSD 117 på den ene siden og SINGULAIR 4mg på den andre.
NDC 0006-9117-31 bruksenhet høydensitets polyetylen (HDPE) flasker på 30 med en barnesikker hette av polypropylen, en induksjonsforsegling av aluminiumsfolie og silikagel tørkemiddel
NDC 0006-9117-54 bruksenhet høydensitets polyetylen (HDPE) flasker på 90 med en barnesikker hette av polypropylen, en induksjonsforsegling av aluminiumsfolie og silikagel-tørkemiddel.
Oppbevaring
Oppbevar SINGULAIR 4-mg orale granulat, 4-mg tyggetabletter, 5-mg tyggetabletter og 10-mg filmdrasjerte tabletter ved 20°C til 25°C (68°F til 77°F), turer tillatt til 15° C til 30 °C (59 °F til 86 °F) [se USP kontrollert romtemperatur]. Beskytt mot fuktighet og lys. Oppbevares i originalpakning.
Distribuert av: Merck Sharp & Dohme Corp., et datterselskap av MERCK & CO., INC., Whitehouse Station, USA. Revidert: februar 2021
BIVIRKNINGER
Følgende klinisk signifikante bivirkninger er beskrevet andre steder i merkingen:
- . Nevropsykiatriske hendelser [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke ratene observert i klinisk praksis. I den følgende beskrivelsen av erfaring fra kliniske studier er bivirkninger listet opp uavhengig av årsaksvurdering.
De vanligste bivirkningene (forekomst ≥5 % og høyere enn placebo; oppført i synkende frekvensrekkefølge) i kontrollerte kliniske studier var: øvre luftveisinfeksjon, feber, hodepine, faryngitt, hoste, magesmerter, diaré, mellomørebetennelse, influensa, rhinoré, bihulebetennelse, otitis.
Voksne og ungdom 15 år og eldre med astma
SINGULAIR 10mg har blitt evaluert for sikkerhet hos ca. 2950 voksne og unge pasienter 15 år og eldre i kliniske studier. I placebokontrollerte kliniske studier forekom følgende bivirkninger rapportert med SINGULAIR 4mg hos mer enn eller lik 1 % av pasientene og med en insidens høyere enn hos pasienter behandlet med placebo:
Frekvensen av mindre vanlige bivirkninger var sammenlignbar mellom SINGULAIR og placebo.
Sikkerhetsprofilen til SINGULAIR 10mg, når den ble administrert som en enkeltdose for forebygging av EIB hos voksne og unge pasienter 15 år og eldre, var i samsvar med sikkerhetsprofilen som tidligere er beskrevet for SINGULAIR.
Kumulativt ble 569 pasienter behandlet med SINGULAIR 10 mg i minst 6 måneder, 480 i ett år og 49 i to år i kliniske studier. Ved langvarig behandling endret ikke bivirkningsprofilen seg signifikant.
Pediatriske pasienter i alderen 6 til 14 år med astma
SINGULAIR 10mg har blitt evaluert for sikkerhet hos 476 pediatriske pasienter i alderen 6 til 14 år. Kumulativt ble 289 pediatriske pasienter behandlet med SINGULAIR 10 mg i minst 6 måneder, og 241 i ett år eller lenger i kliniske studier. Sikkerhetsprofilen til SINGULAIR i den 8-ukers, dobbeltblinde, pediatriske effektstudien var generelt lik sikkerhetsprofilen for voksne. Hos pediatriske pasienter i alderen 6 til 14 år som fikk SINGULAIR 5 mg, forekom følgende reaksjoner med en frekvens ≥2 % og hyppigere enn hos pediatriske pasienter som fikk placebo: faryngitt, influensa, feber, bihulebetennelse, kvalme, diaré, dyspepsi, otitt. virusinfeksjon og laryngitt. Frekvensen av mindre vanlige bivirkninger var sammenlignbar mellom SINGULAIR 4 mg og placebo. Ved langvarig behandling endret ikke bivirkningsprofilen seg signifikant.
Sikkerhetsprofilen til SINGULAIR 4mg, når den ble administrert som en enkeltdose for forebygging av EIB hos pediatriske pasienter 6 år og eldre, var i samsvar med sikkerhetsprofilen beskrevet tidligere for SINGULAIR.
I studier som evaluerte vekstrate, var sikkerhetsprofilen hos disse pediatriske pasientene i samsvar med sikkerhetsprofilen beskrevet tidligere for SINGULAIR. I en 56 ukers, dobbeltblind studie som evaluerte veksthastigheten hos pediatriske pasienter i alderen 6 til 8 år som fikk SINGULAIR, oppstod følgende reaksjoner som ikke tidligere er observert ved bruk av SINGULAIR i denne aldersgruppen med en frekvens ≥2 % og hyppigere enn hos pediatriske pasienter som fikk placebo: hodepine, rhinitt (infeksjon), varicella, gastroenteritt, atopisk dermatitt, akutt bronkitt, tanninfeksjon, hudinfeksjon og nærsynthet.
Pediatriske pasienter i alderen 2 til 5 år med astma
SINGULAIR har blitt evaluert for sikkerhet hos 573 pediatriske pasienter i alderen 2 til 5 år i enkelt- og flerdosestudier. Kumulativt ble 426 pediatriske pasienter i alderen 2 til 5 år behandlet med SINGULAIR 10 mg i minst 3 måneder, 230 i 6 måneder eller lenger, og 63 pasienter i ett år eller lenger i kliniske studier. Hos pediatriske pasienter i alderen 2 til 5 år som fikk SINGULAIR, forekom følgende reaksjoner med en frekvens ≥2 % og hyppigere enn hos pediatriske pasienter som fikk placebo: feber, hoste, magesmerter, diaré, hodepine, rhinoré, bihulebetennelse, otitt, influensa, utslett, øresmerter, gastroenteritt, eksem, urticaria, varicella, lungebetennelse, dermatitt og konjunktivitt.
Pediatriske pasienter i alderen 6 til 23 måneder med astma
Sikkerhet og effektivitet hos pediatriske pasienter yngre enn 12 måneder med astma er ikke fastslått.
SINGULAIR 4mg har blitt evaluert for sikkerhet hos 175 pediatriske pasienter i alderen 6 til 23 måneder. Sikkerhetsprofilen til SINGULAIR i en 6-ukers, dobbeltblind, placebokontrollert klinisk studie var generelt lik sikkerhetsprofilen hos voksne og pediatriske pasienter i alderen 2 til 14 år. Hos pediatriske pasienter i alderen 6 til 23 måneder som fikk SINGULAIR 5 mg, forekom følgende reaksjoner med en frekvens ≥2 % og hyppigere enn hos pediatriske pasienter som fikk placebo: øvre luftveisinfeksjon, hvesing; mellomørebetennelse; faryngitt, betennelse i mandlene, hoste; og rhinitt. Frekvensen av mindre vanlige bivirkninger var sammenlignbar mellom SINGULAIR og placebo.
Voksne og ungdom 15 år og eldre med sesongbetont allergisk rhinitt
SINGULAIR har blitt evaluert for sikkerhet hos 2199 voksne og unge pasienter 15 år og eldre i kliniske studier. SINGULAIR 10 mg administrert én gang daglig om morgenen eller om kvelden hadde en sikkerhetsprofil som ligner på placebo. I placebokontrollerte kliniske studier ble følgende reaksjon rapportert med SINGULAIR 5 mg med en frekvens ≥1 % og med en insidens høyere enn placebo: øvre luftveisinfeksjon, 1,9 % av pasientene som fikk SINGULAIR 4 mg vs. 1,5 % av pasientene som fikk placebo. I en 4-ukers, placebokontrollert klinisk studie var sikkerhetsprofilen i samsvar med den som ble observert i 2-ukers studier. Forekomsten av somnolens var lik forekomsten av placebo i alle studiene.
Pediatriske pasienter i alderen 2 til 14 år med sesongmessig allergisk rhinitt
SINGULAIR 5mg har blitt evaluert hos 280 pediatriske pasienter i alderen 2 til 14 år i en 2-ukers, multisenter, dobbeltblind, placebokontrollert sikkerhetsstudie med parallelle grupper. SINGULAIR administrert én gang daglig om kvelden hadde en sikkerhetsprofil som ligner på placebo. I denne studien forekom følgende reaksjoner med en frekvens ≥2 % og med en insidens høyere enn placebo: hodepine, mellomørebetennelse, faryngitt og øvre luftveisinfeksjon.
Voksne og ungdom 15 år og eldre med flerårig allergisk rhinitt
SINGULAIR har blitt evaluert for sikkerhet hos 3357 voksne og unge pasienter 15 år og eldre med perennial allergisk rhinitt, hvorav 1632 fikk SINGULAIR i to, 6-ukers, kliniske studier. SINGULAIR 10 mg administrert én gang daglig hadde en sikkerhetsprofil i samsvar med den som ble observert hos pasienter med sesongmessig allergisk rhinitt og lik den for placebo. I disse to studiene ble følgende reaksjoner rapportert med SINGULAIR med en frekvens ≥1 % og med en insidens høyere enn placebo: bihulebetennelse, øvre luftveisinfeksjon, bihulehodepine, hoste, neseblødning og økt ALAT. Forekomsten av somnolens var lik forekomsten av placebo.
Pediatriske pasienter i alderen 6 måneder til 14 år med flerårig allergisk rhinitt
Sikkerheten hos pasienter i alderen 2 til 14 år med flerårig allergisk rhinitt støttes av sikkerheten hos pasienter i alderen 2 til 14 år med sesongmessig allergisk rhinitt. Sikkerheten hos pasienter i alderen 6 til 23 måneder støttes av data fra farmakokinetiske og sikkerhets- og effektstudier ved astma i denne pediatriske populasjonen og fra farmakokinetiske studier hos voksne.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av SINGULAIR etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Forstyrrelser i blodet og lymfesystemet økt blødningstendens, trombocytopeni
Forstyrrelser i immunsystemet overfølsomhetsreaksjoner inkludert anafylaksi, hepatisk eosinofil infiltrasjon
Psykiatriske lidelser inkludert, men ikke begrenset til, agitasjon, aggressiv oppførsel eller fiendtlighet, angst, depresjon, desorientering, forstyrrelse i oppmerksomhet, drømmeabnormiteter, dysfemi (stamming), hallusinasjoner, søvnløshet, irritabilitet, hukommelsessvikt, tvangssymptomer, rastløshet, somnambulisme, suicidal tenkning og atferd (inkludert selvmord), tic og skjelving [se ADVARSEL i boks , ADVARSLER OG FORHOLDSREGLER ]
Forstyrrelser i nervesystemet døsighet, parestesi/hypoestesi, anfall
Hjertelidelser hjertebank
Respiratoriske, thorax- og mediastinumsykdommer neseblødning, pulmonal eosinofili
Gastrointestinale lidelser diaré, dyspepsi, kvalme, pankreatitt, oppkast
Lever og galleveier Tilfeller av kolestatisk hepatitt, hepatocellulær leverskade og blandet leverskade er rapportert hos pasienter behandlet med SINGULAIR. De fleste av disse skjedde i kombinasjon med andre forstyrrende faktorer, som bruk av andre medisiner, eller når SINGULAIR ble administrert til pasienter som hadde underliggende potensiale for leversykdom som alkoholbruk eller andre former for hepatitt.
Hud- og subkutane vevssykdommer angioødem, blåmerker, erythema multiforme, erythema nodosum, pruritus, Stevens-Johnsons syndrom/toksisk epidermal nekrolyse, urticaria
Muskel- og bindevevslidelser artralgi, myalgi inkludert muskelkramper
Nyre- og urinveislidelser enuresis hos barn
Generelle lidelser og tilstander på administrasjonsstedet ødem
Pasienter med astma i behandling med SINGULAIR kan ha systemisk eosinofili, noen ganger med kliniske trekk ved vaskulitt forenlig med Churg-Strauss syndrom, en tilstand som ofte behandles med systemisk kortikosteroidbehandling. Disse reaksjonene har noen ganger vært assosiert med reduksjon av oral kortikosteroidbehandling. Leger bør være oppmerksomme på eosinofili, vaskulittisk utslett, forverrede lungesymptomer, hjertekomplikasjoner og/eller nevropati hos pasientene [se ADVARSLER OG FORHOLDSREGLER ].
NARKOTIKAHANDEL
Ingen dosejustering er nødvendig når SINGULAIR 5mg gis samtidig med teofyllin, prednison, prednisolon, orale prevensjonsmidler, fexofenadin, digoksin, warfarin, gemfibrozil, itrakonazol, skjoldbruskhormoner, beroligende hypnotika, ikke-steroide antiinflammatoriske midler, benzodiazepiner, og Cytokrom P450 (CYP) enzyminduktorer [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Nevropsykiatriske hendelser
Alvorlige nevropsykiatriske (NP) hendelser er rapportert ved bruk av SINGULAIR. Disse postmarkedsføringsrapportene har vært svært varierende og inkludert, men var ikke begrenset til, agitasjon, aggressiv oppførsel eller fiendtlighet, angst, depresjon, desorientering, oppmerksomhetsforstyrrelser, drømmeavvik, dysfemi (stamming), hallusinasjoner, søvnløshet, irritabilitet, hukommelsessvikt, tvangssymptomer, rastløshet, somnambulisme, selvmordstanker og -adferd (inkludert selvmord), tic og skjelving. NP-hendelser er rapportert hos voksne, ungdom og pediatriske pasienter med og uten tidligere psykiatrisk lidelse. NP-hendelser er hovedsakelig rapportert under behandling med SINGULAIR 10 mg, men noen ble rapportert etter seponering av SINGULAIR 5 mg. Dyrestudier viste at montelukast fordeler seg i hjernen hos rotter [se KLINISK FARMAKOLOGI ]; Imidlertid er mekanismene som ligger til grunn for SINGULAIR-assosierte NP-hendelser foreløpig ikke godt forstått. Basert på tilgjengelige data er det vanskelig å identifisere risikofaktorer for eller kvantifisere risikoen for NP-hendelser ved bruk av SINGULAIR 10 mg.
På grunn av risikoen for NP-hendelser, er det ikke sikkert at fordelene med SINGULAIR oppveier risikoen hos noen pasienter, spesielt når symptomene på sykdommen kan være milde og tilstrekkelig behandlet med alternative behandlinger. Reservebruk av SINGULAIR 4mg for pasienter med allergisk rhinitt som har utilstrekkelig respons eller intoleranse på alternative behandlinger [se INDIKASJONER ]. Hos pasienter med astma eller anstrengelsesutløst bronkokonstriksjon, vurder fordelene og risikoene før du forskriver SINGULAIR.
Diskuter fordelene og risikoene ved bruk av SINGULAIR 10 mg med pasienter og omsorgspersoner når du forskriver SINGULAIR. Råd pasienter og/eller omsorgspersoner til å være på vakt for endringer i atferd eller for nye NP-symptomer når de tar SINGULAIR. Hvis endringer i atferd blir observert, eller hvis nye NP-symptomer eller selvmordstanker og/eller atferd oppstår, råd pasientene til å seponere SINGULAIR 10 mg og kontakte helsepersonell umiddelbart. I mange tilfeller forsvant symptomene etter avsluttet SINGULAIR-behandling; i noen tilfeller vedvarte imidlertid symptomene etter seponering av SINGULAIR. Fortsett derfor å overvåke og gi støttende behandling til symptomene forsvinner. Revurder fordelene og risikoene ved å starte behandlingen med SINGULAIR 10 mg på nytt hvis slike hendelser oppstår.
Akutt astma
SINGULAIR er ikke indisert for bruk ved reversering av bronkospasme ved akutte astmaanfall, inkludert status asthmaticus. Pasienter bør rådes til å ha passende redningsmedisiner tilgjengelig. Behandling med SINGULAIR 4mg kan fortsettes under akutte forverringer av astma. Pasienter som har forverring av astma etter trening bør ha en korttidsvirkende inhalert β-agonist tilgjengelig for redning.
Samtidig bruk av kortikosteroider
Mens dosen av inhalert kortikosteroid kan reduseres gradvis under medisinsk tilsyn, bør SINGULAIR ikke brått erstattes med inhalerte eller orale kortikosteroider.
Aspirinfølsomhet
Pasienter med kjent aspirinfølsomhet bør fortsette å unngå aspirin eller ikke-steroide antiinflammatoriske midler mens de tar SINGULAIR. Selv om SINGULAIR er effektiv for å forbedre luftveisfunksjonen hos astmatikere med dokumentert aspirinfølsomhet, har det ikke vist seg å avkorte bronkokonstriktorresponsen på aspirin og andre ikke-steroide antiinflammatoriske legemidler hos aspirinsensitive astmatiske pasienter [se Kliniske studier ].
Eosinofile tilstander
Pasienter med astma i behandling med SINGULAIR kan ha systemisk eosinofili, noen ganger med kliniske trekk ved vaskulitt forenlig med Churg-Strauss syndrom, en tilstand som ofte behandles med systemisk kortikosteroidbehandling. Disse hendelsene har noen ganger vært assosiert med reduksjon av oral kortikosteroidbehandling. Leger bør være oppmerksomme på eosinofili, vaskulittisk utslett, forverrede lungesymptomer, hjertekomplikasjoner og/eller nevropati hos pasientene. En årsakssammenheng mellom SINGULAIR 10 mg og disse underliggende tilstandene er ikke fastslått [se BIVIRKNINGER ].
Risiko hos pasienter med fenylketonuri
SINGULAIR 4mg inneholder aspartam, en kilde til fenylalanin. Fenylalanin kan være skadelig for pasienter med fenylketonuri (PKU). Hver 4 mg og 5 mg tyggetablett inneholder henholdsvis 0,674 mg og 0,842 mg fenylalanin. Før du foreskriver SINGULAIR til en pasient med PKU, bør du vurdere den kombinerte daglige mengden fenylalanin fra alle kilder, inkludert SINGULAIR.
Informasjon om pasientveiledning
For tabletter og tyggetabletter, råd pasienten og/eller omsorgspersonen til å lese den FDA-godkjente pasientetiketten ( Medisinveiledning ).
For orale granuler, råd pasienten og/eller omsorgspersonen til å lese den FDA-godkjente pasientetiketten ( Medisinveiledning og bruksanvisning ).
- . Gi pasienter råd om den potensielle risikoen for alvorlige nevropsykiatriske symptomer og atferdsendringer ved bruk av SINGULAIR [se ADVARSLER OG FORHOLDSREGLER ]. . Diskuter fordelene og risikoene ved SINGULAIR med pasienter når de forskriver eller fortsetter behandlingen med SINGULAIR [se ADVARSLER OG FORHOLDSREGLER ]. . Råd pasientene til å overvåke for endringer i atferd eller nevropsykiatriske symptomer hos pasienter som tar SINGULAIR [se ADVARSLER OG FORHOLDSREGLER ]. . Instruer pasienter om å seponere SINGULAIR og kontakte helsepersonell umiddelbart hvis det oppstår endringer i atferd eller tenkning som ikke er typisk for pasienten, eller hvis pasienten utvikler selvmordstanker eller selvmordsatferd [se ADVARSLER OG FORHOLDSREGLER ]. . Råd pasientene til å ta SINGULAIR daglig som foreskrevet, selv når de er asymptomatiske, så vel som i perioder med forverret astma, og kontakte legen dersom astmaen ikke er godt kontrollert. . Informer pasienter om at oral SINGULAIR ikke er for behandling av akutte astmaanfall. De bør ha passende korttidsvirkende inhalerte β-agonistmedisiner tilgjengelig for å behandle astmaeksaserbasjoner. Pasienter som har forverring av astma etter trening bør instrueres om å ha en korttidsvirkende inhalert β-agonist tilgjengelig for redning. Daglig administrering av SINGULAIR for kronisk behandling av astma er ikke etablert for å forhindre akutte episoder av EIB [se ADVARSLER OG FORHOLDSREGLER ]. . Råd pasienter til å søke lege dersom korttidsvirkende inhalerte bronkodilatatorer er nødvendig oftere enn vanlig, eller hvis det er behov for mer enn maksimalt antall inhalasjoner av korttidsvirkende bronkodilatatorbehandling foreskrevet for en 24-timers periode. . Instruer pasienter om å fortsette med andre anti-astmamedisiner som foreskrevet med mindre lege er instruert. . Instruer pasienter med kjent aspirinfølsomhet om å fortsette å unngå aspirin eller ikke-steroide antiinflammatoriske midler mens de tar SINGULAIR [se ADVARSLER OG FORHOLDSREGLER ]. . Informer fenylketonuriske pasienter om at 4 mg og 5 mg tyggetablettene inneholder fenylalanin (en kilde til aspartam) [se ADVARSLER OG FORHOLDSREGLER ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Ingen tegn på tumorigenisitet ble sett i karsinogenitetsstudier på verken 2 år hos Sprague-Dawley-rotter eller 92 uker hos mus ved orale sonde-doser opp til henholdsvis 200 mg/kg/dag eller 100 mg/kg/dag. Estimert eksponering hos rotter var omtrent 120 og 75 ganger AUC for henholdsvis voksne og barn, ved maksimal anbefalt daglig oral dose. Estimert eksponering hos mus var ca. 45 og 25 ganger AUC for henholdsvis voksne og barn, ved maksimal anbefalt daglig oral dose.
Montelukast viste ingen tegn på mutagen eller klastogen aktivitet i følgende analyser: den mikrobielle mutageneseanalysen, V-79 pattedyrcellemutageneseanalysen, den alkaliske elueringsanalysen i rottehepatocytter, kromosomavviksanalysen i eggstokkceller fra kinesisk hamster, og i vivo musebenmargskromosomavviksanalyse.
fertilitetsstudier på hunnrotter ga montelukast reduksjoner i fertilitets- og fruktbarhetsindekser ved en oral dose på 200 mg/kg (estimert eksponering var omtrent 70 ganger AUC for voksne ved maksimal anbefalt daglig oral dose). Ingen effekter på kvinnelig fertilitet eller fruktbarhet ble observert ved en oral dose på 100 mg/kg (estimert eksponering var omtrent 20 ganger AUC for voksne ved maksimal anbefalt daglig oral dose). Montelukast hadde ingen effekt på fertilitet hos hannrotter ved orale doser opptil 800 mg/kg (estimert eksponering var omtrent 160 ganger AUC for voksne ved maksimal anbefalt daglig oral dose).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Tilgjengelige data fra publiserte prospektive og retrospektive kohortstudier over flere tiår med bruk av montelukast hos gravide kvinner har ikke etablert en medikamentassosiert risiko for alvorlige fødselsskader [se Data ]. I reproduksjonsstudier på dyr ble det ikke observert uønskede utviklingseffekter ved oral administrering av montelukast til gravide rotter og kaniner under organogenese ved doser på henholdsvis omtrent 100 og 110 ganger den maksimale anbefalte daglige orale dosen for mennesker (MRHDOD) basert på AUC [se Data ].
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I
USAs generelle befolkning, estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap er henholdsvis 2-4 % og 15-20 %.
Kliniske betraktninger
Sykdomsrelatert mors- og/eller embryo-/fosterrisiko
Dårlig eller moderat kontrollert astma i svangerskapet øker mors risiko for perinatale uønskede utfall som svangerskapsforgiftning og prematuritet hos spedbarn, lav fødselsvekt og liten for svangerskapsalderen.
Data
Menneskelige data
Publiserte data fra prospektive og retrospektive kohortstudier har ikke identifisert en sammenheng med bruk av SINGULAIR under graviditet og store fødselsskader. Tilgjengelige studier har metodiske begrensninger, inkludert liten utvalgsstørrelse, i noen tilfeller retrospektiv datainnsamling og inkonsistente komparatorgrupper.
Dyredata
I embryo-føtale utviklingsstudier forårsaket ikke montelukast administrert til gravide rotter og kaniner under organogenese (drektighetsdager 6 til 17 hos rotter og 6 til 18 hos kaniner) noen uønskede utviklingseffekter ved orale doser opp til 400 og 300 mg/kg hos mor. /dag hos henholdsvis rotter og kaniner (henholdsvis ca. 100 og 110 ganger AUC hos mennesker ved MRHDOD).
Amming
Risikosammendrag
En publisert klinisk ammingsstudie rapporterer tilstedeværelsen av montelukast i morsmelk. Data tilgjengelig om effekten av stoffet på spedbarn, enten direkte [se Pediatrisk bruk eller gjennom morsmelk, antyder ikke en signifikant risiko for bivirkninger ved eksponering for SINGULAIR. Effekten av stoffet på melkeproduksjonen er ukjent. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for SINGULAIR 5mg og eventuelle bivirkninger på det ammede spedbarnet fra SINGULAIR 10mg eller fra den underliggende morens tilstand.
Pediatrisk bruk
Sikkerhet og effektivitet av SINGULAIR for astma er etablert hos pediatriske pasienter i alderen 6 til 14 år. Bruk av SINGULAIR 4mg for denne indikasjonen støttes av bevis fra godt kontrollerte studier. Sikkerhets- og effektdata i denne aldersgruppen er lik de som er sett hos voksne [se BIVIRKNINGER , KLINISK FARMAKOLOGI , Spesifikke populasjoner , og Kliniske studier ].
Effektiviteten til SINGULAIR for behandling av sesongmessig allergisk rhinitt hos pediatriske pasienter i alderen 2 til 14 år og for behandling av flerårig allergisk rhinitt hos pediatriske pasienter i alderen 6 måneder til 14 år er fastslått og støttes av ekstrapolering fra den påviste effekten. hos pasienter 15 år og eldre med allergisk rhinitt samt antakelsen om at sykdomsforløpet, patofysiologien og stoffets effekt er vesentlig lik blant disse populasjonene.
Sikkerheten til SINGULAIR 4-mg tyggetabletter hos pediatriske pasienter i alderen 2 til 5 år med astma har blitt vist med tilstrekkelige og godt kontrollerte data [se BIVIRKNINGER ]. Effektiviteten av SINGULAIR 5mg i denne aldersgruppen er ekstrapolert fra den påviste effekten hos pasienter 6 år og eldre med astma og er basert på lignende farmakokinetiske data, samt antakelsen om at sykdomsforløpet, patofysiologien og legemidlets effekt er vesentlig like blant disse populasjonene. Effektiviteten i denne aldersgruppen støttes av utforskende effektvurderinger fra en stor, godt kontrollert sikkerhetsstudie utført på pasienter i alderen 2 til 5 år.

Sikkerheten til SINGULAIR 4-mg orale granulat hos pediatriske pasienter i alderen 12 til 23 måneder med astma er vist i en analyse av 172 pediatriske pasienter, hvorav 124 ble behandlet med SINGULAIR, i en 6-ukers, dobbeltblind placebo -kontrollert studie [se BIVIRKNINGER ]. Effektiviteten av SINGULAIR i denne aldersgruppen er ekstrapolert fra den påviste effekten hos pasienter 6 år og eldre med astma basert på tilsvarende gjennomsnittlig systemisk eksponering (AUC), og at sykdomsforløpet, patofysiologien og stoffets effekt er vesentlig lik blant disse populasjonene , støttet av effektdata fra en sikkerhetsstudie der effekten var en utforskende vurdering.
Sikkerheten til SINGULAIR 4-mg og 5-mg tyggetabletter hos pediatriske pasienter i alderen 2 til 14 år med allergisk rhinitt støttes av data fra studier utført på pediatriske pasienter i alderen 2 til 14 år med astma. En sikkerhetsstudie hos pediatriske pasienter i alderen 2 til 14 år med sesongmessig allergisk rhinitt viste en lignende sikkerhetsprofil [se BIVIRKNINGER ]. Sikkerheten til SINGULAIR 4-mg orale granulat hos pediatriske pasienter så unge som 6 måneder med perennial allergisk rhinitt støttes av ekstrapolering fra sikkerhetsdata hentet fra studier utført på pediatriske pasienter i alderen 6 måneder til 23 måneder med astma og fra farmakokinetiske data sammenligne systemisk eksponering hos pasienter i alderen 6 måneder til 23 måneder med systemisk eksponering hos voksne.
Sikkerhet og effektivitet hos pediatriske pasienter under 12 måneder med astma, 6 måneder med perennial allergisk rhinitt og 6 år med anstrengelsesutløst bronkokonstriksjon er ikke fastslått.
Veksthastighet hos pediatriske pasienter
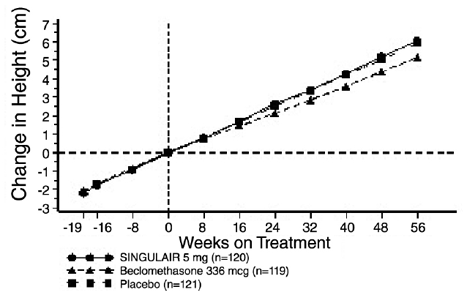
En 56-ukers, multisenter, dobbeltblind, randomisert, aktiv- og placebokontrollert parallellgruppestudie ble utført for å vurdere effekten av SINGULAIR 4 mg på veksthastigheten hos 360 pasienter med mild astma i alderen 6 til 8 år. Behandlingsgruppene inkluderte SINGULAIR 5 mg én gang daglig, placebo og beklometasondipropionat administrert som 168 mcg to ganger daglig med en spacer-enhet. For hvert individ ble en veksthastighet definert som helningen til en lineær regresjonslinje tilpasset høydemålingene over 56 uker. Den primære sammenligningen var forskjellen i vekstrater mellom SINGULAIR- og placebogruppene. Veksthastigheter, uttrykt som minste kvadraters (LS) gjennomsnitt (95 % KI) i cm/år, for behandlingsgruppene SINGULAIR, placebo og beklometason var 5,67 (5,46, 5,88), 5,64 (5,42, 5,86) og 4,86 ( 4,64, 5,08), henholdsvis. Forskjellene i veksthastigheter, uttrykt som minste kvadraters (LS) gjennomsnitt (95 % KI) i cm/år, for behandlingsgruppene SINGULAIR 5 mg minus placebo, beklometason minus placebo og SINGULAIR 5 mg minus beklometason var 0,03 (-0,26, 0,31) , -0,78 (-1,06, -0,49); og henholdsvis 0,81 (0,53, 1,09). Veksthastighet (uttrykt som gjennomsnittlig høydeendring over tid) for hver behandlingsgruppe er vist i FIGUR 1.
Figur 1: Endring i høyde (cm) fra randomiseringsbesøk etter planlagt uke (Behandlingsgruppegjennomsnitt ± standardfeil* av gjennomsnittet)
Geriatrisk bruk
Av det totale antallet forsøkspersoner i kliniske studier med montelukast var 3,5 % 65 år eller eldre, og 0,4 % var 75 år eller eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre personer, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes. Den farmakokinetiske profilen og den orale biotilgjengeligheten til en enkelt 10 mg oral dose montelukast er lik hos eldre og yngre voksne. Plasmahalveringstiden til montelukast er noe lengre hos eldre. Ingen dosejustering hos eldre er nødvendig.
Nedsatt leverfunksjon
Ingen dosejustering anbefales hos pasienter med mild til moderat leversvikt [se KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
Ingen dosejustering anbefales hos pasienter med nyresvikt [se KLINISK FARMAKOLOGI ].
OVERDOSE
Ingen spesifikk informasjon er tilgjengelig om behandling av overdosering med SINGULAIR. Ved overdosering er det rimelig å bruke de vanlige støttetiltakene; fjern f.eks. uabsorbert materiale fra mage-tarmkanalen, bruk klinisk overvåking og iverksett støttende terapi om nødvendig. Det er ikke kjent om montelukast fjernes ved peritonealdialyse eller hemodialyse.
KONTRAINDIKASJONER
SINGULAIR er kontraindisert hos pasienter med overfølsomhet overfor noen av komponentene.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Cysteinylleukotrienene (LTC4, LTD4, LTE4) er produkter av arakidonsyremetabolisme og frigjøres fra forskjellige celler, inkludert mastceller og eosinofiler. Disse eikosanoidene binder seg til cysteinylleukotrien (CysLT) reseptorer. CysLT type-1 (CysLT1) reseptoren finnes i menneskelige luftveier (inkludert glatte muskelceller i luftveiene og luftveismakrofager) og på andre pro-inflammatoriske celler (inkludert eosinofiler og visse myeloide stamceller). CysLTs har blitt korrelert med patofysiologien til astma og allergisk rhinitt. Ved astma inkluderer leukotrien-medierte effekter luftveisødem, sammentrekning av glatt muskulatur og endret cellulær aktivitet assosiert med den inflammatoriske prosessen. Ved allergisk rhinitt frigjøres CysLT fra neseslimhinnen etter allergeneksponering under både tidlig- og senfasereaksjoner og er assosiert med symptomer på allergisk rhinitt.
Montelukast er en oralt aktiv forbindelse som binder seg med høy affinitet og selektivitet til CysLT1-reseptoren (fremfor andre farmakologisk viktige luftveisreseptorer, slik som prostanoid-, kolinerge- eller β-adrenerge reseptorer). Montelukast hemmer fysiologiske virkninger av LTD4 ved CysLT1-reseptoren uten agonistaktivitet.
Farmakodynamikk
Montelukast forårsaker hemming av cysteinylleukotrienreseptorer i luftveiene, som demonstrert av evnen til å hemme bronkokonstriksjon på grunn av inhalert LTD4 hos astmatikere. Doser så lave som 5 mg forårsaker betydelig blokkering av LTD4-indusert bronkokonstriksjon. I en placebokontrollert, crossover-studie (n=12), hemmet SINGULAIR 4mg tidlig- og senfase bronkokonstriksjon på grunn av antigenutfordring med henholdsvis 75 % og 57 %.
Effekten av SINGULAIR 5mg på eosinofiler i det perifere blodet ble undersøkt i kliniske studier. Hos pasienter med astma i alderen 2 år og eldre som fikk SINGULAIR 10 mg, ble det observert en reduksjon i gjennomsnittlig perifert blod eosinofiltall fra 9 % til 15 %, sammenlignet med placebo, over de dobbeltblindede behandlingsperiodene. Hos pasienter med sesongmessig allergisk rhinitt i alderen 15 år og eldre som fikk SINGULAIR 4 mg, ble det observert en gjennomsnittlig økning på 0,2 % i perifert blod eosinofiltall, sammenlignet med en gjennomsnittlig økning på 12,5 % hos placebobehandlede pasienter, i forhold til den dobbeltblinde behandlingen. perioder; dette reflekterer en gjennomsnittlig forskjell på 12,3 % til fordel for SINGULAIR. Sammenhengen mellom disse observasjonene og de kliniske fordelene med montelukast notert i de kliniske studiene er ikke kjent [se Kliniske studier ].
Farmakokinetikk
Absorpsjon
Montelukast absorberes raskt etter oral administrering. Etter administrering av den 10 mg filmdrasjerte tabletten til fastende voksne, oppnås gjennomsnittlig maksimal plasmakonsentrasjon av montelukast (Cmax) etter 3 til 4 timer (Tmax). Gjennomsnittlig oral biotilgjengelighet er 64 %. Den orale biotilgjengeligheten og Cmax påvirkes ikke av et standardmåltid om morgenen.
For 5-mg tyggetabletten oppnås gjennomsnittlig Cmax i løpet av 2 til 2,5 timer etter administrering til voksne i fastende tilstand. Gjennomsnittlig oral biotilgjengelighet er 73 % i fastende tilstand mot 63 % når det administreres sammen med et standardmåltid om morgenen.
For 4 mg tyggetabletten oppnås gjennomsnittlig Cmax 2 timer etter administrering hos pediatriske pasienter i alderen 2 til 5 år i fastende tilstand.
Den orale granulatformuleringen på 4 mg er bioekvivalent med 4 mg tyggetabletten når den administreres til voksne i fastende tilstand. Samtidig administrering av den orale granulatformuleringen med eplemos hadde ingen klinisk signifikant effekt på farmakokinetikken til montelukast. Et fettrikt måltid om morgenen påvirket ikke AUC for orale montelukastgranulat; måltidet reduserte imidlertid Cmax med 35 % og forlenget Tmax fra 2,3 ± 1,0 timer til 6,4 ± 2,9 timer.
Sikkerheten og effektiviteten til SINGULAIR hos pasienter med astma ble demonstrert i kliniske studier der 10 mg filmdrasjerte tabletter og 5 mg tyggetabletter ble administrert om kvelden uten hensyn til tidspunktet for matinntak. Sikkerheten til SINGULAIR 4 mg hos pasienter med astma ble også demonstrert i kliniske studier der formuleringen av 4 mg tyggetablett og 4 mg oral granulat ble administrert om kvelden uten hensyn til tidspunktet for matinntak. Sikkerheten og effektiviteten til SINGULAIR hos pasienter med sesongmessig allergisk rhinitt ble vist i kliniske studier der 10 mg filmdrasjerte tabletten ble administrert om morgenen eller kvelden uten hensyn til tidspunktet for matinntak.
Den sammenlignende farmakokinetikken til montelukast administrert som to 5 mg tyggetabletter versus én 10 mg filmdrasjerte tablett er ikke evaluert.
Fordeling
Montelukast er mer enn 99 % bundet til plasmaproteiner. Distribusjonsvolumet ved steady state av montelukast er i gjennomsnitt 8 til 11 liter. Oralt administrert montelukast fordeler seg i hjernen hos rotter.
Eliminering
Plasmaclearance av montelukast er gjennomsnittlig 45 ml/min hos friske voksne. Etter en oral dose av radiomerket montelukast ble 86 % av radioaktiviteten gjenfunnet i 5-dagers fekal samlinger og
I flere studier varierte gjennomsnittlig plasmahalveringstid for montelukast fra 2,7 til 5,5 timer hos friske unge voksne. Farmakokinetikken til montelukast er nesten lineær for orale doser opptil 50 mg. Ved dosering én gang daglig med 10 mg montelukast er det liten akkumulering av moderlegemidlet i plasma (14 %).
Metabolisme
Montelukast metaboliseres i stor grad. I studier med terapeutiske doser er plasmakonsentrasjoner av metabolitter av montelukast ikke påviselige ved steady state hos voksne og pediatriske pasienter.
In vitro-studier med humane levermikrosomer indikerer at CYP3A4, 2C8 og 2C9 er involvert i metabolismen av montelukast. Ved klinisk relevante konsentrasjoner ser 2C8 ut til å spille en viktig rolle i metabolismen av montelukast.
Spesifikke populasjoner
Pasienter med nedsatt leverfunksjon
Pasienter med mild til moderat leverinsuffisiens og kliniske tegn på skrumplever hadde tegn på redusert metabolisme av montelukast som resulterte i 41 % (90 % KI=7 %, 85 %) høyere gjennomsnittlig AUC for montelukast etter en enkeltdose på 10 mg. Eliminasjonen av montelukast var litt forlenget sammenlignet med hos friske personer (gjennomsnittlig halveringstid, 7,4 timer). Ingen dosejustering er nødvendig hos pasienter med mild til moderat leversvikt. Farmakokinetikken til SINGULAIR hos pasienter med mer alvorlig nedsatt leverfunksjon eller med hepatitt er ikke evaluert.
Pasienter med nedsatt nyrefunksjon
Siden montelukast og dets metabolitter ikke skilles ut i urinen, ble farmakokinetikken til montelukast ikke evaluert hos pasienter med nyresvikt. Ingen dosejustering anbefales hos disse pasientene.
Mannlige og kvinnelige pasienter
Farmakokinetikken til montelukast er lik hos menn og kvinner.
Rasegrupper
Farmakokinetiske forskjeller på grunn av rase er ikke studert.
Ungdom og pediatriske pasienter
Farmakokinetiske studier evaluerte systemisk eksponering av 4 mg oral granulatformulering hos pediatriske pasienter i alderen 6 til 23 måneder, 4 mg tyggetabletter hos pediatriske pasienter i alderen 2 til 5 år, 5 mg tyggetabletter hos pediatriske pasienter 6 til 14 år, og 10 mg filmdrasjerte tabletter til unge voksne og ungdom ≥15 år.
Plasmakonsentrasjonsprofilen til montelukast etter administrering av den 10 mg filmdrasjerte tabletten er lik hos ungdom ≥15 år og unge voksne. Den 10 mg filmdrasjerte tabletten anbefales til pasienter ≥15 år.
Gjennomsnittlig systemisk eksponering av 4 mg tyggetabletten hos pediatriske pasienter i alderen 2 til 5 år og 5 mg tyggetablettene hos pediatriske pasienter i alderen 6 til 14 år er lik den gjennomsnittlige systemiske eksponeringen for 10 mg film- belagt tablett hos voksne. 5 mg tyggetabletten skal brukes til pediatriske pasienter i alderen 6 til 14 år og 4 mg tyggetablettene skal brukes til pediatriske pasienter i alderen 2 til 5 år.
Hos barn i alderen 6 til 11 måneder var den systemiske eksponeringen for montelukast og variasjonen i plasmakonsentrasjonen av montelukast høyere enn de som ble observert hos voksne. Basert på populasjonsanalyser var gjennomsnittlig AUC (4296 ng•t/mL [område 1200 til 7153]) 60 % høyere og gjennomsnittlig Cmax (667 ng/ml [område 201 til 1058]) var 89 % høyere enn de som ble observert i voksne (gjennomsnittlig AUC 2689 ng•time/mL [område 1521 til 4595]) og gjennomsnittlig Cmax (353 ng/ml [område 180 til 548]). Den systemiske eksponeringen hos barn i alderen 12 til 23 måneder var mindre variabel, men var fortsatt høyere enn den som ble observert hos voksne. Gjennomsnittlig AUC (3574 ng•time/mL [område 2229 til 5408]) var 33 % høyere og gjennomsnittlig Cmax (562 ng/ml [område 296 til 814]) var 60 % høyere enn de som ble observert hos voksne. Sikkerhet og tolerabilitet av montelukast i en enkeltdose farmakokinetisk studie hos 26 barn i alderen 6 til 23 måneder var lik den for pasienter to år og eldre [se BIVIRKNINGER ]. Den orale granulatformuleringen på 4 mg skal brukes til pediatriske pasienter i alderen 12 til 23 måneder for behandling av astma, eller til pediatriske pasienter i alderen 6 til 23 måneder for behandling av flerårig allergisk rhinitt. Siden 4 mg oral granulatformulering er bioekvivalent med 4 mg tyggetabletten, kan den også brukes som en alternativ formulering til 4 mg tyggetabletten hos pediatriske pasienter i alderen 2 til 5 år.
Legemiddelinteraksjonsstudier
Teofyllin, Prednison og Prednisolon
SINGULAIR har blitt administrert sammen med andre terapier som rutinemessig brukes i profylakse og kronisk behandling av astma uten tilsynelatende økning i bivirkninger. I legemiddelinteraksjonsstudier hadde ikke den anbefalte kliniske dosen av montelukast klinisk viktig effekt på farmakokinetikken til følgende legemidler: teofyllin, prednison og prednisolon.
Montelukast i en dose på 10 mg én gang daglig dosert til farmakokinetisk steady state, forårsaket ikke klinisk signifikante endringer i kinetikken til en enkelt intravenøs dose teofyllin [hovedsakelig et cytokrom P450 (CYP) 1A2-substrat]. Montelukast ved doser på ≥100 mg daglig doseret til farmakokinetisk steady state, forårsaket ingen klinisk signifikant endring i plasmaprofiler for prednison eller prednisolon etter administrering av enten oral prednison eller intravenøs prednisolon.
Orale prevensjonsmidler, Fexofenadine, Digoxin og Warfarin
legemiddelinteraksjonsstudier hadde den anbefalte kliniske dosen av montelukast ikke klinisk viktig effekt på farmakokinetikken til følgende legemidler: orale prevensjonsmidler (noretindron 1 mg/etinyløstradiol 35 mcg), digoksin og warfarin. Montelukast ved doser på ≥100 mg daglig doseret til farmakokinetisk steady state endret ikke signifikant plasmakonsentrasjonen av noen av komponentene i et oralt prevensjonsmiddel inneholdende noretindron 1 mg/etinyløstradiol 35 mcg. Montelukast i en dose på 10 mg én gang daglig dosert til farmakokinetisk steady state endret ikke plasmakonsentrasjonsprofilen til fexofenadin, endret ikke den farmakokinetiske profilen eller urinutskillelsen av immunreaktivt digoksin; endret ikke den farmakokinetiske profilen til warfarin (primært et substrat av CYP2C9, 3A4 og 1A2) eller påvirket effekten av en enkelt 30 mg oral dose warfarin på protrombintid eller International Normalized Ratio (INR).
Skjoldbruskkjertelhormoner, beroligende hypnotika, ikke-steroide antiinflammatoriske midler, benzodiazepiner og dekongestanter
Selv om ytterligere spesifikke interaksjonsstudier ikke ble utført, ble SINGULAIR brukt samtidig med et bredt spekter av vanlig forskrevne legemidler i kliniske studier uten bevis for kliniske uønskede interaksjoner. Disse medisinene inkluderte skjoldbruskhormoner, beroligende hypnotika, ikke-steroide antiinflammatoriske midler, benzodiazepiner og dekongestanter.
Cytokrom P450 (CYP) enzymindusere
Fenobarbital, som induserer levermetabolisme, reduserte arealet under plasmakonsentrasjonskurven (AUC) til montelukast med omtrent 40 % etter en enkeltdose på 10 mg montelukast. Ingen dosejustering for SINGULAIR anbefales. Det er rimelig å bruke passende klinisk overvåking når potente CYP-enzymindusere, slik som fenobarbital eller rifampin, administreres samtidig med SINGULAIR.
Effekt av Montelukast på cytokrom P450 (CYP) enzymer
Montelukast er en potent hemmer av CYP2C8 in vitro. Data fra en klinisk legemiddelinteraksjonsstudie som involverte montelukast og rosiglitazon (et probesubstrat som er representativt for legemidler som primært metaboliseres av CYP2C8) hos 12 friske individer viste imidlertid at farmakokinetikken til rosiglitazon ikke endres når legemidlene administreres samtidig, noe som indikerer at montelukast gjør ikke hemmer CYP2C8 in vivo. Derfor forventes ikke montelukast å endre metabolismen til legemidler som metaboliseres av dette enzymet (f.eks. paklitaksel, rosiglitazon og repaglinid). Basert på ytterligere in vitro-resultater i humane levermikrosomer, hemmer ikke terapeutiske plasmakonsentrasjoner av montelukast CYP 3A4, 2C9, 1A2, 2A6, 2C19 eller 2D6.
Cytokrom P450 (CYP) enzymhemmere
In vitro-studier har vist at montelukast er et substrat for CYP 2C8, 2C9 og 3A4. Samtidig administrering av montelukast og itrakonazol, en sterk CYP 3A4-hemmer, resulterte ikke i noen signifikant økning i systemisk eksponering av montelukast. Data fra en klinisk legemiddelinteraksjonsstudie som involverte montelukast og gemfibrozil (en hemmer av både CYP 2C8 og 2C9) viste at gemfibrozil, ved en terapeutisk dose, økte den systemiske eksponeringen av montelukast med 4,4 ganger. Samtidig administrering av itrakonazol, gemfibrozil og montelukast økte ikke den systemiske eksponeringen av montelukast ytterligere. Basert på tilgjengelig klinisk erfaring er ingen dosejustering av montelukast nødvendig ved samtidig administrering med gemfibrozil [se OVERDOSE ].
Kliniske studier
Astma
Voksne og ungdom 15 år og eldre med astma
Kliniske studier hos voksne og ungdom 15 år og eldre viste at det ikke er noen ytterligere klinisk fordel med doser over 10 mg montelukast én gang daglig.
Effekten av SINGULAIR for kronisk behandling av astma hos voksne og ungdom 15 år og eldre ble vist i to (USA og multinasjonale) lignende utformede, randomiserte, 12-ukers, dobbeltblinde, placebokontrollerte studier med 1576 pasienter ( 795 behandlet med SINGULAIR, 530 behandlet med placebo og 251 behandlet med aktiv kontroll). Medianalderen var 33 år (spredning 15 til 85); 56,8% var kvinner og 43,2% var menn. Den etniske/rasefordelingen i disse studiene var 71,6 % kaukasiske, 17,7 % latinamerikanske, 7,2 % annen opprinnelse og 3,5 % svarte. Pasientene hadde mild eller moderat astma og var ikke-røykere som trengte ca. 5 drag med inhalert β-agonist per dag på "etter behov". Pasientene hadde en gjennomsnittlig baseline-prosent av predikert tvungen ekspiratorisk volum i løpet av 1 sekund (FEV1) på 66 % (omtrent område, 40 til 90 %). De ko-primære endepunktene i disse studiene var FEV1 og astmasymptomer på dagtid. I begge studiene etter 12 uker ble en tilfeldig undergruppe av pasienter som fikk SINGULAIR 5 mg byttet til placebo i ytterligere 3 uker med dobbeltblind behandling for å evaluere mulige rebound-effekter.
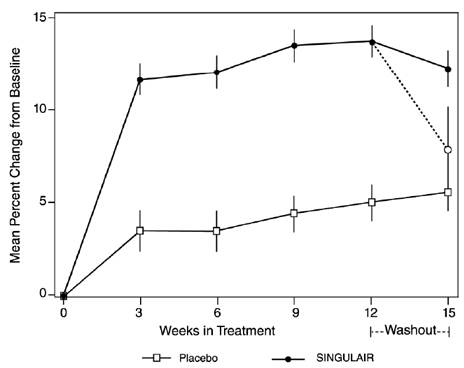
Resultatene av den amerikanske studien på det primære endepunktet, morgen FEV1, uttrykt som gjennomsnittlig prosentvis endring fra baseline i gjennomsnitt over den 12-ukers behandlingsperioden, er vist i FIGUR 2. Sammenlignet med placebo, behandling med én SINGULAIR 10 mg tablett daglig i kvelden resulterte i en statistisk signifikant økning i FEV1 prosent endring fra baseline (13,0 % endring i gruppen behandlet med SINGULAIR 4 mg vs. 4,2 % endring i placebogruppen, p
Figur 2: FEV1 gjennomsnittlig prosentvis endring fra baseline (USA-prøve: SINGULAIR 5mg N=406; Placebo N=270) (ANOVA-modell)
Effekten av SINGULAIR 5mg på andre primære og sekundære endepunkter, representert ved den multinasjonale studien, er vist i tabell 6. Resultatene på disse endepunktene var like i den amerikanske studien.
Begge studiene evaluerte effekten av SINGULAIR 4mg på sekundære utfall, inkludert astmaanfall (utnyttelse av helsevesenets ressurser som et uplanlagt besøk på legekontoret, legevakten eller sykehuset; eller behandling med oral, intravenøs eller intramuskulært kortikosteroid), og bruk av orale kortikosteroider for astmaredning. I den multinasjonale studien opplevde signifikant færre pasienter (15,6 % av pasientene) på SINGULAIR astmaanfall sammenlignet med pasienter på placebo (27,3 %, p
Inntreden av handling og vedlikehold av effekter
I hver placebokontrollert studie hos voksne ble behandlingseffekten av SINGULAIR 4 mg, målt ved daglige dagbokkortparametere, inkludert symptomscore, "etter behov" bruk av β-agonist og PEFR-målinger, oppnådd etter den første dosen og ble opprettholdt gjennom hele doseringsintervallet (24 timer). Ingen signifikant endring i behandlingseffekt ble observert under kontinuerlig administrering én gang daglig kveld i ikke-placebokontrollerte forlengelsesstudier i opptil ett år. Seponering av SINGULAIR 4mg hos astmatiske pasienter etter 12 ukers kontinuerlig bruk forårsaket ikke rebound-forverring av astma.
Pediatriske pasienter i alderen 6 til 14 år med astma
Effekten av SINGULAIR 5 mg hos pediatriske pasienter i alderen 6 til 14 år ble vist i en 8-ukers, dobbeltblind, placebokontrollert studie med 336 pasienter (201 behandlet med SINGULAIR og 135 behandlet med placebo) ved bruk av en inhalert β-agonist på "etter behov". Pasientene hadde en gjennomsnittlig baseline prosent forutsagt FEV1 på 72 % (omtrent område, 45 til 90 %) og et gjennomsnittlig daglig behov for inhalert β-agonist på 3,4 drag albuterol. Omtrent 36 % av pasientene gikk på inhalerte kortikosteroider. Medianalderen var 11 år (spredning 6 til 15); 35,4% var kvinner og 64,6% var menn. Den etniske/rasefordelingen i denne studien var 80,1 % kaukasiske, 12,8 % svarte, 4,5 % latinamerikanske og 2,7 % annen opprinnelse.
Sammenlignet med placebo, resulterte behandling med én 5 mg SINGULAIR 4 mg tyggetablett daglig i en signifikant forbedring i gjennomsnittlig morgen FEV1 prosent endring fra baseline (8,7 % i gruppen behandlet med SINGULAIR 4 mg vs. 4,2 % endring fra baseline i placebogruppen, p
likhet med voksenstudiene ble ingen signifikant endring i behandlingseffekten observert under kontinuerlig administrering én gang daglig i en åpen utvidet studie uten samtidig placebogruppe i opptil 6 måneder.
Pediatriske pasienter i alderen 2 til 5 år med astma
Effekten av SINGULAIR for kronisk behandling av astma hos pediatriske pasienter i alderen 2 til 5 år ble undersøkt i en 12 ukers, placebokontrollert sikkerhets- og tolerabilitetsstudie hos 689 pasienter, hvorav 461 ble behandlet med SINGULAIR. Medianalderen var 4 år (spredning 2 til 6); 41,5% var kvinner og 58,5% var menn. Den etniske/rasefordelingen i denne studien var 56,5 % kaukasiske, 20,9 % latinamerikanske, 14,4 % annen opprinnelse og 8,3 % svarte.
Mens hovedmålet var å bestemme sikkerheten og toleransen til SINGULAIR 10 mg i denne aldersgruppen, inkluderte studien utforskende effektevalueringer, inkludert astmasymptomer på dagtid og over natten, bruk av β-agonister, oral kortikosteroidredning og legens globale evaluering. Funnene fra disse eksplorative effektevalueringene, sammen med farmakokinetikk og ekstrapolering av effektdata fra eldre pasienter, støtter den generelle konklusjonen om at SINGULAIR er effektivt i vedlikeholdsbehandling av astma hos pasienter i alderen 2 til 5 år.
Effekter hos pasienter på samtidige inhalerte kortikosteroider
Separate studier hos voksne evaluerte evnen til SINGULAIR 10 mg til å øke den kliniske effekten av inhalerte kortikosteroider og tillate nedtrapping av inhalerte kortikosteroider ved samtidig bruk.
En randomisert, placebokontrollert, parallell-gruppe studie (n=226) inkluderte voksne med stabil astma med en gjennomsnittlig FEV1 på ca. 84 % av forventet som tidligere ble opprettholdt på forskjellige inhalerte kortikosteroider (levert med aerosol- eller tørrpulverinhalatorer med oppmålte doser). ). Medianalderen var 41,5 år (spredning 16 til 70); 52,2% var kvinner og 47,8% var menn. Den etniske/rasefordelingen i denne studien var 92,0 % kaukasiske, 3,5 % svarte, 2,2 % latinamerikanske og 2,2 % asiatiske. Typene av inhalerte kortikosteroider og deres gjennomsnittlige baselinebehov inkluderte beklometasondipropionat (gjennomsnittlig dose, 1203 mcg/dag), triamcinolonacetonid (gjennomsnittlig dose, 2004 mcg/dag), flunisolid (gjennomsnittlig dose, 1971 mcg/dag), flutikasonpropionat ( dose, 1083 mcg/dag), eller budesonid (gjennomsnittlig dose, 1192 mcg/dag). Noen av disse inhalerte kortikosteroidene var ikke-amerikansk-godkjente formuleringer, og uttrykte doser er kanskje ikke eksaktuator. Kravet til inhalert kortikosteroid før studien ble redusert med omtrent 37 % i løpet av en 5- til 7-ukers placebo-innkjøringsperiode designet for å titrere pasienter mot deres laveste effektive inhalerte kortikosteroiddose. Behandling med SINGULAIR 4mg resulterte i ytterligere 47 % reduksjon i gjennomsnittlig inhalert kortikosteroiddose sammenlignet med en gjennomsnittlig reduksjon på 30 % i placebogruppen over den 12-ukers aktive behandlingsperioden (p≤0,05). Det er ikke kjent om resultatene av denne studien kan generaliseres til pasienter med astma som trenger høyere doser av inhalerte kortikosteroider eller systemiske kortikosteroider.
en annen randomisert, placebokontrollert, parallellgruppestudie (n=642) i en lignende populasjon av voksne pasienter som tidligere ble opprettholdt, men ikke tilstrekkelig kontrollert, på inhalerte kortikosteroider (beklometason 336 mcg/dag), resulterte tillegg av SINGULAIR til beklometason i statistisk signifikante forbedringer i FEV1 sammenlignet med de pasientene som ble fortsatt på beklometason alene eller de pasientene som ble seponert fra beklometason og behandlet med montelukast eller placebo alene i løpet av de siste 10 ukene av den 16-ukers blindede behandlingsperioden. Pasienter som ble randomisert til behandlingsarmer som inneholdt beklometason hadde statistisk signifikant bedre astmakontroll enn de pasientene som ble randomisert til SINGULAIR alene eller placebo alene som indikert av FEV1, astmasymptomer på dagtid, PEFR, nattlige oppvåkninger på grunn av astma og "etter behov" β- agonistkrav.
Hos voksne pasienter med astma med dokumentert aspirinsensitivitet, hvorav nesten alle fikk samtidig inhalerte og/eller orale kortikosteroider, viste en 4-ukers, randomisert, parallellgruppestudie (n=80) at SINGULAIR 10mg, sammenlignet med placebo, resulterte i betydelig forbedring i parametere for astmakontroll. Effektstørrelsen av SINGULAIR 4 mg hos aspirinsensitive pasienter var lik effekten som ble observert i den generelle populasjonen av astmapasienter som ble studert. Effekten av SINGULAIR på bronkokonstriktorresponsen på aspirin eller andre ikke-steroide antiinflammatoriske legemidler hos aspirinsensitive astmatiske pasienter har ikke blitt evaluert [se ADVARSLER OG FORHOLDSREGLER ].
Anstrengelsesutløst bronkokonstriksjon (EIB)
Anstrengelsesutløst bronkokonstriksjon (voksne, ungdommer og pediatriske pasienter 6 år og eldre)
Effekten av SINGULAIR 5 mg, 10 mg, gitt som en enkeltdose 2 timer før trening for forebygging av EIB ble undersøkt i tre (US og multinasjonale), randomiserte, dobbeltblinde, placebokontrollerte crossover-studier som inkluderte totalt 160 voksne og ungdomspasienter 15 år og eldre med EIB. Anstrengelsestesting ble utført 2 timer, 8,5 eller 12 timer og 24 timer etter administrering av en enkelt dose av studiemedikamentet (SINGULAIR 10 mg eller placebo). Det primære endepunktet var gjennomsnittlig maksimalt prosentvis fall i FEV1 etter 2 timers treningsutfordring etter dose i alle tre studiene (studie A, studie B og studie C). I studie A viste en enkeltdose med SINGULAIR 10 mg en statistisk signifikant beskyttende fordel mot EIB når den ble tatt 2 timer før trening. Noen pasienter ble beskyttet mot EIB 8,5 og 24 timer etter administrering; noen pasienter var imidlertid ikke det. Resultatene for gjennomsnittlig maksimal prosentfall ved hvert tidspunkt i studie A er vist i tabell 7 og er representative for resultatene fra de to andre studiene.
Effekten av SINGULAIR 5-mg tyggetabletter, gitt som en enkeltdose 2 timer før trening for forebygging av EIB, ble undersøkt i en multinasjonal, randomisert, dobbeltblind, placebokontrollert crossover-studie som inkluderte totalt 64 pediatriske pasienter 6 til 14 år med EIB. Anstrengelsestesting ble utført 2 timer og 24 timer etter administrering av en enkeltdose studiemedisin (SINGULAIR 5 mg eller placebo). Det primære endepunktet var gjennomsnittlig maksimal prosentvis fall i FEV1 etter 2 timers treningsutfordring etter dose. En enkeltdose med SINGULAIR 5 mg viste en statistisk signifikant beskyttende fordel mot EIB når den ble tatt 2 timer før trening (TABELL 8). Lignende resultater ble vist 24 timer etter dosering (et sekundært endepunkt). Noen pasienter ble beskyttet mot EIB 24 timer etter administrering; noen pasienter var imidlertid ikke det. Ingen tidspunkter ble vurdert mellom 2 og 24 timer etter dosering.
Effekten av SINGULAIR 5mg for forebygging av EIB hos pasienter under 6 år er ikke fastslått.
Daglig administrering av SINGULAIR 4mg for kronisk behandling av astma er ikke etablert for å forhindre akutte episoder av EIB.
en 12-ukers, randomisert, dobbeltblind, parallell gruppestudie av 110 voksne og unge astmatikere 15 år og eldre, med en gjennomsnittlig baseline FEV1 prosent av predikert på 83 % og med dokumentert treningsindusert forverring av astma, behandling med SINGULAIR, 10 mg, en gang daglig om kvelden, resulterte i en statistisk signifikant reduksjon i gjennomsnittlig maksimal prosentvis fall i FEV1 og gjennomsnittlig tid til restitusjon til innenfor 5 % av FEV1 før trening. Treningsutfordring ble utført ved slutten av doseringsintervallet (dvs. 20 til 24 timer etter den foregående dosen). Denne effekten ble opprettholdt gjennom den 12 uker lange behandlingsperioden, noe som indikerer at toleranse ikke oppsto. SINGULAIR 4mg forhindret imidlertid ikke klinisk signifikant forverring av maksimalt prosentvis fall i FEV1 etter trening (dvs. ≥20 % reduksjon fra baseline før trening) hos 52 % av pasientene som ble studert. I en separat crossover-studie hos voksne ble en lignende effekt observert etter to doser på 10 mg SINGULAIR én gang daglig.
Hos pediatriske pasienter i alderen 6 til 14 år, ved bruk av 5 mg tyggetabletten, viste en 2-dagers crossover-studie effekter som ligner på de som ble observert hos voksne når treningsutfordring ble utført ved slutten av doseringsintervallet (dvs. 20 til 24). timer etter forrige dose).
Allergisk rhinitt (sesongbetinget og flerårig)
Sesongbetinget allergisk rhinitt
Effekten av SINGULAIR tabletter for behandling av sesongmessig allergisk rhinitt ble undersøkt i 5 lignende utformede, randomiserte, dobbeltblinde, parallellgruppe, placebo- og aktivkontrollerte (loratadin) studier utført i Nord-Amerika. De 5 studiene inkluderte totalt 5029 pasienter, hvorav 1799 ble behandlet med SINGULAIR-tabletter. Pasientene var i alderen 15 til 82 år med en historie med sesongmessig allergisk rhinitt, en positiv hudtest for minst ett relevant sesongallergen og aktive symptomer på sesongbetont allergisk rhinitt ved studiestart.
Perioden med randomisert behandling var 2 uker i 4 studier og 4 uker i en studie. Den primære utfallsvariabelen var gjennomsnittlig endring fra baseline i score for nesesymptomer på dagtid (gjennomsnittet av individuelle skårer for nesetetthet, rhinoré, nasal kløe, nysing) vurdert av pasienter på en kategorisk skala fra 0-3.
Fire av de fem studiene viste en signifikant reduksjon i score for nasale symptomer på dagtid med SINGULAIR 10 mg tabletter sammenlignet med placebo. Resultatene av ett forsøk er vist nedenfor. Medianalderen i denne studien var 35,0 år (område 15 til 81); 65,4% var kvinner og 34,6% var menn. Den etniske/rasefordelingen i denne studien var 83,1 % kaukasiske, 6,4 % annen opprinnelse, 5,8 % svarte og 4,8 % latinamerikanske. Gjennomsnittlige endringer fra baseline i score for nasale symptomer på dagtid i behandlingsgruppene som fikk SINGULAIR 4 mg tabletter, loratadin og placebo er vist i tabell 9. De resterende tre studiene som viste effekt viste lignende resultater. Effekt ble vist for sesongbetont allergisk rhinitt når montelukast ble administrert om morgenen eller kvelden.
Flerårig allergisk rhinitt
Effekten av SINGULAIR 5 mg tabletter for behandling av flerårig allergisk rhinitt ble undersøkt i 2 randomiserte, dobbeltblindede, placebokontrollerte studier utført i Nord-Amerika og Europa. De to studiene inkluderte totalt 3357 pasienter, hvorav 1632 fikk SINGULAIR 10 mg tabletter. Pasienter i alderen 15 til 82 år med flerårig allergisk rhinitt som bekreftet av anamnese og en positiv hudtest for minst ett relevant flerårig allergen (støvmidd, dyreflass og/eller muggsporer), som hadde aktive symptomer på studietidspunktet oppføring, ble påmeldt.
studien hvor effekt ble demonstrert, var medianalderen 35 år (område 15 til 81); 64,1% var kvinner og 35,9% var menn. Den etniske/rasefordelingen i denne studien var 83,2 % kaukasiske, 8,1 % svarte, 5,4 % latinamerikanske, 2,3 % asiatiske og 1,0 % annen opprinnelse. SINGULAIR 10 mg tabletter én gang daglig ble vist å redusere symptomene på flerårig allergisk rhinitt signifikant over en 6-ukers behandlingsperiode (TABELL 10); i denne studien var den primære utfallsvariabelen gjennomsnittlig endring fra baseline i score for nesesymptomer på dagtid (gjennomsnittet av individuelle skårer for nesetetthet, rhinoré og nysing).
Den andre 6-ukers studien evaluerte SINGULAIR 10 mg (n=626), placebo (n=609) og en aktiv kontroll (cetirizin 10 mg; n=120). Primæranalysen sammenlignet gjennomsnittlig endring fra baseline i score for nasale symptomer på dagtid for SINGULAIR vs. placebo i løpet av de første 4 ukene av behandlingen; studien var ikke designet for statistisk sammenligning mellom SINGULAIR og den aktive kontrollen. Den primære utfallsvariabelen inkluderte nesekløe i tillegg til nesetetthet, rhinoré og nysing. Den estimerte forskjellen mellom SINGULAIR og placebo var -0,04 med en 95 % KI på (-0,09, 0,01). Den estimerte forskjellen mellom aktiv kontroll og placebo var -0,10 med en 95 % KI på (-0,19, -0,01).
PASIENTINFORMASJON
SINGULAIR® (SING-u-lair)(montelukastnatrium) tyggetabletter
Hva er den viktigste informasjonen jeg bør vite om SINGULAIR 4mg?Alvorlige psykiske problemer har oppstått hos personer som tar SINGULAIR eller til og med etter at behandlingen har stoppet.
Dette kan skje hos personer med eller uten en historie med psykiske problemer. Slutt å ta SINGULAIR og fortell helsepersonell umiddelbart hvis du eller barnet ditt har noen uvanlige endringer i atferd eller tenkning, inkludert noen av disse symptomene:
- . agitasjon, inkludert aggressiv oppførsel eller fiendtlighet . oppmerksomhetsproblemer . dårlige eller livlige drømmer . depresjon . desorientering (forvirring) . føler seg engstelig . irritabilitet . hallusinasjoner (å se eller høre ting som egentlig ikke er der) . hukommelsesproblemer . obsessiv-kompulsive symptomer . rastløshet . sove gange . stamming . selvmordstanker og -handlinger (inkludert selvmord) . skjelving . problemer med å sove . ukontrollerte muskelbevegelser
Hva er SINGULAIR 10mg?
SINGULAIR 4mg er et reseptbelagt legemiddel som blokkerer stoffer i kroppen som kalles leukotriener. Dette kan bidra til å forbedre symptomer på astma og betennelse i neseslimhinnen (allergisk rhinitt). SINGULAIR inneholder ikke et steroid. SINGULAIR brukes til:
. Forhindre astmaanfall og for langtidsbehandling av astma hos voksne og barn i alderen 12 måneder og eldre. Ikke ta SINGULAIR hvis du trenger lindring umiddelbart for et plutselig astmaanfall. Hvis du har et astmaanfall, bør du følge instruksjonene som helsepersonell ga deg for behandling av astmaanfall. . Forhindre anstrengelsesutløst astma hos personer 6 år og eldre. . Bidra til å kontrollere symptomene på allergisk rhinitt som nysing, tett nese, rennende nese og kløe i nesen. SINGULAIR 5mg brukes til å behandle følgende hos personer som allerede har tatt andre legemidler som ikke virket godt nok, eller hos personer som ikke tålte andre legemidler:- . utendørs allergier som oppstår deler av året (sesongbetinget allergisk rhinitt) hos voksne og barn i alderen 2 år og eldre, og . innendørs allergier som forekommer hele året (perennial allergisk rhinitt) hos voksne og barn i alderen 6 måneder og eldre.
Ikke ta SINGULAIR hvis du er allergisk mot noen av ingrediensene. Se slutten av denne medisinveiledningen for en fullstendig liste over ingrediensene i SINGULAIR.
Før du tar SINGULAIR 4mg, fortell helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
- . er allergisk mot aspirin. . har fenylketonuri. SINGULAIR tyggetabletter inneholder aspartam, en kilde til fenylalanin. . har eller har hatt psykiske problemer. . er gravid eller planlegger å bli gravid. Snakk med helsepersonell hvis du er gravid eller planlegger å bli gravid, SINGULAIR 4mg er kanskje ikke riktig for deg. . ammer eller planlegger å amme. Det er ikke kjent om SINGULAIR går over i morsmelk. Snakk med helsepersonell om den beste måten å mate babyen på mens du tar SINGULAIR.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Noen legemidler kan påvirke hvordan SINGULAIR virker, eller SINGULAIR 4mg kan påvirke hvordan andre legemidler virker.
Hvordan bør jeg ta SINGULAIR 10mg?
Til hvem som helst hvem tar SINGULAIR:
- . Les det detaljerte Instruksjoner for bruk som kommer med SINGULAIR orale granulat. . Ta SINGULAIR 4mg nøyaktig som foreskrevet av helsepersonell. Helsepersonell vil fortelle deg hvor mye SINGULAIR du skal ta, og når du skal ta det. . Slutt å ta SINGULAIR 5mg og fortell helsepersonell med en gang hvis du eller barnet ditt har uvanlige endringer i atferd eller tenkning. . Du kan ta SINGULAIR 5mg med mat eller uten mat. Se avsnittet "Hvordan kan jeg gi SINGULAIR orale granulat til barnet mitt?" i Instruksjoner for bruk for informasjon om hvilke matvarer og væsker som kan tas med SINGULAIR 10mg orale granulat. . Hvis du eller barnet ditt glemmer en dose SINGULAIR, ta bare neste dose til vanlig tid. Ikke ta 2 doser samtidig. . Hvis du tar for mye SINGULAIR, ring legen din med en gang.
For voksne og barn 12 måneder og eldre med astma:
- . Ta SINGULAIR 1 gang hver dag, om kvelden. Fortsett å ta SINGULAIR 5mg hver dag så lenge helsepersonell foreskriver det, selv om du ikke har noen astmasymptomer. . Fortell helsepersonell med en gang hvis astmasymptomene dine blir verre, eller hvis du trenger å bruke redningsinhalatormedisinen oftere for astmaanfall. . Ha alltid redningsinhalatormedisinen med deg for astmaanfall. . Fortsett å ta dine andre astmamedisiner som foreskrevet med mindre helsepersonell ber deg endre hvordan du tar disse medisinene.
For personer 6 år og eldre for forebygging av anstrengelsesutløst astma:
- . Ta SINGULAIR minst 2 timer før trening. . Ha alltid redningsinhalatormedisinen med deg for astmaanfall. . Hvis du tar SINGULAIR 10 mg hver dag for kronisk astma eller allergisk rhinitt, ikke ta en ny dose for å forhindre anstrengelsesutløst astma. Snakk med helsepersonell om behandlingen din for anstrengelsesutløst astma. . Ikke ta 2 doser SINGULAIR 5 mg innen 24 timer (1 dag).
For alle 2 år og eldre med sesongmessig allergisk rhinitt, eller for alle 6 måneder og eldre med flerårig allergisk rhinitt:
- . Ta SINGULAIR 1 gang hver dag, til omtrent samme tid hver dag.
Hva bør jeg unngå mens jeg tar SINGULAIR 10mg?
Hvis du har astma og aspirin gjør astmasymptomene verre, fortsett å unngå å ta aspirin eller andre medisiner som kalles ikke-steroide antiinflammatoriske legemidler (NSAIDs) mens du tar SINGULAIR.
Hva er de mulige bivirkningene av SINGULAIR?
SINGULAIR kan forårsake alvorlige bivirkninger, inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om SINGULAIR 4mg?" . Økning i visse hvite blodceller (eosinofiler) og mulig betente blodårer i hele kroppen (systemisk vaskulitt). I sjeldne tilfeller kan dette skje hos personer med astma som tar SINGULAIR. Dette skjer noen ganger hos personer som også tar en steroidmedisin gjennom munnen som stoppes eller dosen senkes.
Fortell helsepersonell med en gang hvis du får ett eller flere av disse symptomene:
- . en følelse av nåler eller nummenhet i armer eller ben . en influensalignende sykdom . utslett . alvorlig betennelse (smerte og hevelse) i bihulene (bihulebetennelse)
De vanligste bivirkningene av SINGULAIR inkluderer:
- . øvre luftveisinfeksjon . feber . hodepine . sår hals . hoste . magesmerter . diaré . øreverk eller ørebetennelse . influensa . rennende nese . bihulebetennelse
Dette er ikke alle mulige bivirkninger av SINGULAIR. Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare SINGULAIR?
- . Oppbevar SINGULAIR 10mg ved romtemperatur mellom 68°F til 77°F (20°C til 25°C). . Oppbevar SINGULAIR 4mg i pakken den kommer i. . Oppbevar SINGULAIR 4mg på et tørt sted og hold det vekk fra lys. . Oppbevar SINGULAIR og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av SINGULAIR.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk SINGULAIR for en tilstand det ikke er foreskrevet for. Ikke gi SINGULAIR til andre selv om de har de samme symptomene som du har. Det kan skade dem.
Du kan spørre apoteket eller helsepersonell om informasjon om SINGULAIR 10mg som er skrevet for helsepersonell.
Hva er ingrediensene i SINGULAIR?
Aktiv ingrediens: montelukastnatrium
Inaktive ingredienser:
- . 4 mg orale granulat: mannitol, hydroksypropylcellulose og magnesiumstearat. . 4 mg og 5 mg tyggetabletter: mannitol, mikrokrystallinsk cellulose, hydroksypropylcellulose, rødt jernoksid, kroskarmellosenatrium, kirsebærsmak, aspartam og magnesiumstearat. . Personer med fenylketonuri: SINGULAIR 4 mg tyggetabletter inneholder 0,674 mg fenylalanin og SINGULAIR 5 mg tyggetabletter inneholder 0,842 mg fenylalanin. . 10 mg tablett: mikrokrystallinsk cellulose, laktosemonohydrat, kroskarmellosenatrium, hydroksypropylcellulose og magnesiumstearat. Filmbelegget inneholder: hydroksypropylmetylcellulose, hydroksypropylcellulose, titandioksid, rødt jernoksid, gult jernoksid og karnaubavoks.
Instruksjoner for bruk
SINGULAIR® (SING-u-lair)(montelukastnatrium) orale granulat
Denne bruksanvisningen inneholder informasjon om hvordan du bruker SINGULAIR 10 mg orale granulat.
Viktig informasjon:
- . Før du gir en dose SINGULAIR orale granulat, les denne bruksanvisningen for å være sikker på at du forbereder og gir oralt granulat riktig. . Gi SINGULAIR orale granulat til barnet ditt nøyaktig som instruert av helsepersonell. . Slutt å gi SINGULAIR 5 mg og fortell helsepersonell med en gang hvis barnet ditt har noen uvanlige endringer i atferd eller tenkning. . Fortsett å gi barnet ditt astmamedisiner som foreskrevet, med mindre helsepersonell ber deg endre måten du gir disse medisinene. . Du kan gi SINGULAIR 5 mg orale granulat med mat eller uten mat.
Hvordan kan jeg gi SINGULAIR 4 mg orale granulat til barnet mitt?
- . Ikke åpne pakken til den skal brukes. . Det er forskjellige måter du kan gi SINGULAIR 4 mg orale granulat. Du bør velge den beste metoden for barnet ditt:
- . rett inn i munnen . oppløst i 1 teskje (5 ml) kald eller romtemperatur babyerstatning eller morsmelk . blandet med 1 skje av en av følgende myke matvarer ved kald eller romtemperatur: eplemos, mosede gulrøtter, ris eller iskrem.
Hvordan bør jeg oppbevare SINGULAIR 5mg?
- . Oppbevar SINGULAIR 4mg ved romtemperatur mellom 68°F til 77°F (20°C til 25°C). . Behold SINGULAIR i pakken den kommer i. . Oppbevar SINGULAIR 5mg på et tørt sted og hold det vekk fra lys. . Oppbevar SINGULAIR og alle legemidler utilgjengelig for barn.
Denne bruksanvisningen er godkjent av US Food and Drug Administration
