Symbicort 160/4.5mcg Budesonide Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Symbicort 4,5mcg og hvordan brukes det?
Symbicort 4,5mcg er et reseptbelagt legemiddel som brukes til å behandle symptomene på astma og kronisk obstruktiv lungesykdom. Symbicort kan brukes alene eller sammen med andre medisiner.
Symbicort tilhører en klasse legemidler som kalles Respiratory Inhalant Combos.
Det er ikke kjent om Symbicort 4,5mcg er trygt og effektivt hos barn under 6 år.
Hva er de mulige bivirkningene av Symbicort 4,5mcg?
Symbicort kan forårsake alvorlige bivirkninger, inkludert:
- . forverrede pusteproblemer, . sår eller hvite flekker i munnen eller halsen, . smerte ved svelging, . skjelvinger, . nervøsitet, . brystsmerter, . raske eller bankende hjerteslag, . hoste med slim, . føler kortpustethet, . hvesing, . kveles, . andre pusteproblemer, . tåkesyn, . tunnelsyn, . øyesmerter eller rødhet, . ser glorier rundt lys, . feber, . frysninger, . Smerter i kroppen, . uvanlig tretthet, . økt tørst, . økt vannlating, . tørr i munnen, . lukt av fruktig pust, . kramper i benet, . forstoppelse, . uregelmessige hjerteslag, . flagrende i brystet, . nummenhet eller prikking, . muskel svakhet, . slapp følelse, . tretthet, . svakhet, . svimmelhet, . kvalme, og . oppkast
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Symbicort inkluderer:
- . halssmerter eller irritasjon, . hvite flekker i munnen eller halsen, . ubehag i magen, . oppkast, . ryggsmerte, . hodepine, . influensasymptomer, og . forkjølelsessymptomer (tett eller rennende nese, nysing, bihulesmerter eller sår hals)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Symbicort. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
SYMBICORT 80/4.5 og SYMBICORT 160/4.5 inneholder hver mikronisert budesonid og mikronisert formoterolfumaratdihydrat kun for oral inhalasjon.
Hver SYMBICORT 80/4.5 og SYMBICORT 160/4.5 beholder er formulert som en hydrofluoralkan (HFA 227; 1,1,1,2,3,3,3,3-heptafluorpropan)-drevet trykksatt doseinhalator som inneholder enten 60 eller 120 aktiveringer [se Doseringsformer og styrker og HVORDAN LEVERES / Oppbevaring og håndtering ]. Etter priming måler hver aktivering enten 91/5,1 mcg eller 181/5,1 mcg fra ventilen og leverer enten 80/4,5 mcg eller 160/4,5 mcg (budesonidmikronisert/formoterolfumaratdihydratmikronisert) fra aktuatoren. Den faktiske mengden medikament som leveres til lungen kan avhenge av pasientfaktorer, slik som koordineringen mellom aktivering av enheten og inspirasjon gjennom leveringssystemet. SYMBICORT 160mg inneholder også povidon K25 USP som suspensjonsmiddel og polyetylenglykol 1000 NF som smøremiddel.
SYMBICORT 160mg bør grunnes før bruk for første gang ved å slippe to testsprayer ut i luften vekk fra ansiktet, riste godt i 5 sekunder før hver spray. I tilfeller der inhalatoren ikke har vært brukt på mer enn 7 dager eller når den har blitt droppet, primer inhalatoren igjen ved å riste godt i 5 sekunder før hver spray og slippe to testsprayer ut i luften vekk fra ansiktet.
En aktiv komponent i SYMBICORT 4,5mcg er budesonid, et kortikosteroid kjemisk betegnet som (RS)11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion syklisk 16,17-acetal med butyraldehyd. Budesonid leveres som en blanding av to epimerer (22R og 22S). Den empiriske formelen til budesonid er C25H34O6 og dens molekylvekt er 430,5. Dens strukturformel er:
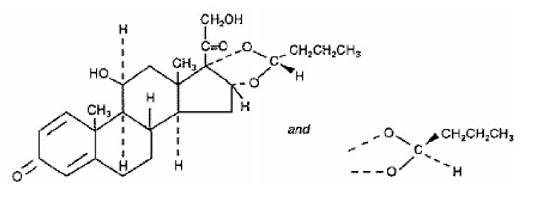
Budesonid er et hvitt til off-white, smakløst, luktfritt pulver som er praktisk talt uløselig i vann og heptan, lite løselig i etanol og fritt løselig i kloroform. Dens fordelingskoeffisient mellom oktanol og vann ved pH 7,4 er 1,6 x 103.
Den andre aktive komponenten i SYMBICORT 160mg er formoterolfumaratdihydrat, en selektiv beta2-agonist kjemisk betegnet som (R*,R*)-(±)-N-[2-hydroksy-5-[1-hydroksy-2-[[ 2-(4-metoksyfenyl)-1-metyletyl]amino]etyl]fenyl]formamid, (E)-2-butendioat(2:1), dihydrat. Den empiriske formelen til formoterol er C42H56N4O14 og dens molekylvekt er 840,9. Dens strukturformel er:
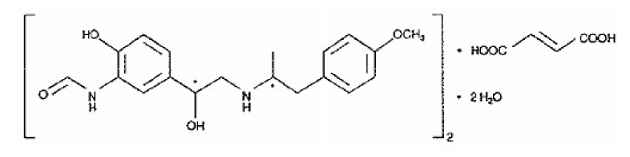
Formoterolfumaratdihydrat er et pulver som er lett løselig i vann. Dens oktanol-vann fordelingskoeffisient ved pH 7,4 er 2,6. pKa for formoterolfumaratdihydrat ved 25°C er 7,9 for fenolgruppen og 9,2 for aminogruppen.
INDIKASJONER
Behandling av astma
SYMBICORT 4,5mcg er indisert for behandling av astma hos pasienter 6 år og eldre.
SYMBICORT skal brukes til pasienter som ikke er tilstrekkelig kontrollert på langtidsmedisiner for astmakontroll som et inhalert kortikosteroid (ICS) eller hvis sykdom krever oppstart av behandling med både et inhalert kortikosteroid og langtidsvirkende beta2-adrenerg agonist (LABA).
Viktige bruksbegrensninger
- . SYMBICORT er IKKE indisert for lindring av akutt bronkospasme.
Vedlikeholdsbehandling av kronisk obstruktiv lungesykdom
SYMBICORT 160/4.5 er indisert for vedlikeholdsbehandling av luftstrømsobstruksjon hos pasienter med kronisk obstruktiv lungesykdom (KOLS) inkludert kronisk bronkitt og/eller emfysem. SYMBICORT 160/4.5 er også indisert for å redusere eksacerbasjoner av KOLS. SYMBICORT 160/4.5 er den eneste styrken som er indisert for behandling av KOLS.
Viktige bruksbegrensninger
- . SYMBICORT 4,5 mcg er IKKE indisert for lindring av akutt bronkospasme.
DOSERING OG ADMINISTRASJON
Administrasjonsinformasjon
SYMBICORT 160 mg skal administreres som 2 inhalasjoner to ganger daglig (morgen og kveld, med ca. 12 timers mellomrom), hver dag kun ved oral inhalasjon. Etter inhalasjon skal pasienten skylle munnen med vann uten å svelge.
Prime SYMBICORT 4,5mcg før bruk for første gang ved å slippe to testsprayer ut i luften vekk fra ansiktet, rist godt i 5 sekunder før hver spray. I tilfeller der inhalatoren ikke har vært brukt på mer enn 7 dager eller når den har blitt droppet, primer inhalatoren igjen ved å riste godt før hver spray og slippe ut to testsprayer i luften vekk fra ansiktet.
Hyppigere administrering eller et høyere antall inhalasjoner (mer enn 2 inhalasjoner to ganger daglig) av den foreskrevne styrken av SYMBICORT anbefales ikke, da noen pasienter har større sannsynlighet for å oppleve bivirkninger med høyere doser formoterol. Pasienter som bruker SYMBICORT bør ikke bruke ekstra LABA av noen grunn [se ADVARSLER OG FORHOLDSREGLER ].
Astma
Hvis astmasymptomer oppstår i perioden mellom dosene, bør en inhalert, korttidsvirkende beta2-agonist tas for umiddelbar lindring.
Voksne og ungdomspasienter 12 år og eldre
For pasienter 12 år og eldre er doseringen 2 inhalasjoner av SYMBICORT 80/4.5 eller SYMBICORT 160/4.5 to ganger daglig.
De anbefalte startdosene for SYMBICORT for pasienter 12 år og eldre er basert på pasientens alvorlighetsgrad av astma eller nivå av kontroll over astmasymptomer, og risiko for eksacerbasjoner med aktuelle inhalerte kortikosteroider.
Maksimal anbefalt dose hos voksne og ungdom pasienter 12 år og eldre er SYMBICORT 160/4.5, to inhalasjoner to ganger daglig.
Forbedring i astmakontroll etter inhalasjonsadministrering av SYMBICORT kan oppstå innen 15 minutter etter behandlingsstart, selv om maksimal fordel kanskje ikke oppnås før 2 uker eller lenger etter behandlingsstart. Individuelle pasienter vil oppleve varierende tid til debut og grad av symptomlindring.
For pasienter som ikke responderer tilstrekkelig på startdosen etter 1-2 ukers behandling med SYMBICORT 80/4.5, kan erstatning med SYMBICORT 160/4.5 gi ytterligere astmakontroll.
Hvis et tidligere effektivt doseringsregime av SYMBICORT 4,5 mcg ikke gir tilstrekkelig kontroll av astma, bør det terapeutiske regimet revurderes og ytterligere terapeutiske alternativer, (f.eks. erstatte den lavere styrken av SYMBICORT 4,5 mcg med den høyere styrken, legge til ytterligere inhalert kortikosteroid, eller initiering av orale kortikosteroider) bør vurderes.
Pediatriske pasienter i alderen 6 til under 12 år
For pasienter 6 til under 12 år er dosen 2 inhalasjoner av SYMBICORT 80/4,5 to ganger daglig.
Kronisk obstruktiv lungesykdom
For pasienter med KOLS er anbefalt dose SYMBICORT 160/4.5, to inhalasjoner to ganger daglig.
Hvis kortpustethet oppstår i perioden mellom dosene, bør en inhalert, korttidsvirkende beta2-agonist tas for umiddelbar lindring.
HVORDAN LEVERES
Doseringsformer og styrker
SYMBICORT er tilgjengelig som en doseinhalator som inneholder en kombinasjon av budesonid (80 eller 160 mcg) og formoterol (4,5 mcg) som en inhalasjonsaerosol i følgende to styrker: 80/4,5 og 160/4,5. Hver doseringsstyrke inneholder 60 eller 120 aktiveringer per beholder. Hver styrke på SYMBICORT 160mg leveres med en rød plastaktuator med en grå støvhette.
Oppbevaring og håndtering
SYMBICORT er tilgjengelig i to styrker og leveres i følgende pakkestørrelser:
Doseringsformer og styrker
Hver styrke leveres som en trykksatt aluminiumsbeholder med en vedlagt telleanordning, en rød aktuatorkropp av plast med et hvitt munnstykke og påsatt grå støvhette. Hver 120 inhalasjonsbeholder har en netto fyllvekt på 10,2 gram og hver 60 inhalasjonsbeholder har en netto fyllvekt på 6,9 gram (SYMBICORT 80/4,5) eller 6 gram (SYMBICORT 160/4,5). Hver beholder er pakket i en foliepose med tørkemiddelpose og plassert i en kartong. Hver kartong inneholder én beholder og et pasientinformasjonshefte.
SYMBICORT 4,5 mcg-beholderen skal kun brukes med SYMBICORT 4,5 mcg-aktuatoren, og SYMBICORT-aktuatoren skal ikke brukes sammen med andre inhalasjonsmedikamenter.
Riktig mengde medikamenter i hver inhalasjon kan ikke sikres etter at det merkede antallet inhalasjoner fra beholderen er brukt, selv om inhalatoren kanskje ikke føles helt tom og kan fortsette å fungere. Inhalatoren skal kasseres når det merkede antallet inhalasjoner er brukt eller innen 3 måneder etter fjerning fra folieposen. Senk aldri beholderen i vann for å bestemme mengden som er igjen i beholderen ("flyttest").
Oppbevares ved kontrollert romtemperatur 20°C til 25°C (68°F til 77°F) [se USP]. Oppbevar inhalatoren med munnstykket nede.
For best resultat bør beholderen være i romtemperatur før bruk. Rist godt i 5 sekunder før bruk.
Oppbevares utilgjengelig for barn. Unngå spraying i øynene.
INNHOLD UNDER TRYKK.
Ikke punkter eller brenn. Ikke oppbevar nær varme eller åpen ild. Eksponering for temperaturer over 120°F kan forårsake sprengning. Kast aldri beholderen i ild eller forbrenningsovn.
Produsert for: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 av: AstraZeneca Dunkerque Production, Dunkerque, Frankrike. Revidert: desember 2017
BIVIRKNINGER
Bruk av LABA kan resultere i følgende:
- . Alvorlige astma-relaterte hendelser – sykehusinnleggelser, intubasjoner, død [se ADVARSLER OG FORHOLDSREGLER ]. . Kardiovaskulære og sentralnervesystemets effekter [se ADVARSLER OG FORHOLDSREGLER ].
Systemisk og inhalert kortikosteroidbruk kan føre til følgende:
- . Candida albicans infeksjon [se ADVARSLER OG FORHOLDSREGLER ] . Lungebetennelse eller nedre luftveisinfeksjoner hos pasienter med KOLS [se ADVARSLER OG FORHOLDSREGLER ] . Immunsuppresjon [se ADVARSLER OG FORHOLDSREGLER ] . Hyperkortisisme og binyresuppresjon [se ADVARSLER OG FORHOLDSREGLER ] . Veksteffekter hos pediatriske pasienter [se ADVARSLER OG FORHOLDSREGLER ] . Grønn stær og grå stær [se ADVARSLER OG FORHOLDSREGLER ]
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Erfaring fra kliniske studier ved astma
Voksne og ungdomspasienter 12 år og eldre
De samlede sikkerhetsdataene for voksne og ungdom er basert på 10 aktive og placebokontrollerte kliniske studier der 3393 pasienter i alderen 12 år og eldre (2052 kvinner og 1341 menn) med astma av varierende alvorlighetsgrad ble behandlet med SYMBICORT 80/4,5 eller 160 /4,5 tatt 2 inhalasjoner en eller to ganger daglig i 12 til 52 uker. I disse studiene hadde pasientene på SYMBICORT en gjennomsnittsalder på 38 år og var hovedsakelig kaukasiske (82 %).
Forekomsten av vanlige bivirkninger i tabell 2 nedenfor er basert på sammenslåtte data fra tre 12-ukers, dobbeltblindede, placebokontrollerte kliniske studier der 401 voksne og ungdom (148 menn og 253 kvinner) i alderen 12 år og eldre ble behandlet med 2 inhalasjoner av SYMBICORT 80/4.5 eller SYMBICORT 160/4.5 to ganger daglig. SYMBICORT-gruppen var hovedsakelig sammensatt av kaukasiske (84 %) pasienter med en gjennomsnittsalder på 38 år, og en gjennomsnittlig prosent spådde FEV1 ved baseline på 76 og 68 for henholdsvis 80/4,5 mcg og 160/4,5 mcg behandlingsgruppene. Kontrollarmer for sammenligning inkluderte 2 inhalasjoner av budesonid HFA inhalator (MDI) 80 eller 160 mcg, formoterol tørrpulverinhalator (DPI) 4,5 mcg, eller placebo (MDI og DPI) to ganger daglig. Tabell 2 inkluderer alle uønskede hendelser som oppstod med en insidens på >3 % i en SYMBICORT-gruppe og mer vanlig enn i placebogruppen med dosering to ganger daglig. Ved å vurdere disse dataene bør den økte gjennomsnittlige varigheten av pasienteksponeringen for SYMBICORT-pasienter tas i betraktning, siden forekomsten ikke justeres for ubalanse i behandlingsvarigheten.
Langsiktig sikkerhet - Kliniske astmaforsøk hos pasienter 12 år og eldre
Langsiktige sikkerhetsstudier hos ungdom og voksne pasienter 12 år og eldre, behandlet i opptil 1 år med doser opptil 1280/36 mikrogram/dag (640/18 mikrogram to ganger daglig), avslørte ingen av klinisk viktige endringer i forekomsten heller ikke nye typer uønskede hendelser som dukker opp etter lengre behandlingsperioder. På samme måte ble ingen signifikante eller uventede mønstre av abnormiteter observert i opptil 1 år i sikkerhetstiltak inkludert kjemi, hematologi, EKG, Holter-monitor og HPA-aksevurderinger.
Pediatriske pasienter fra 6 til under 12 år
Sikkerhetsdata for pediatriske pasienter i alderen 6 til under 12 år er basert på 1 studie med 12 ukers behandlingsvarighet. Pasienter (79 kvinner og 105 menn) som fikk inhalert kortikosteroid ved start av forsøk ble randomisert til SYMBICORT 80/4,5 (n=92) eller budesonid pMDI 80 mcg (n=92), 2 inhalasjoner to ganger daglig. Den generelle sikkerhetsprofilen til disse pasientene var lik den som ble observert hos pasienter 12 år og eldre som fikk SYMBICORT 80/4,5 to ganger daglig i studier med lignende design. Vanlige bivirkninger som oppsto hos pasienter behandlet med SYMBICORT 80/4,5 med en frekvens på ≥3 % og hyppigere enn pasienter behandlet kun med budesonid pMDI 80 mcg inkluderte øvre luftveisinfeksjon, faryngitt, hodepine og rhinitt.
Erfaring fra kliniske studier ved kronisk obstruktiv lungesykdom
Sikkerhetsdataene beskrevet nedenfor gjenspeiler eksponering for SYMBICORT 160/4.5 hos 1783 pasienter. SYMBICORT 160/4.5 ble studert i to placebokontrollerte lungefunksjonsstudier (6 og 12 måneder i varighet), og to aktivt kontrollerte eksacerbasjonsstudier (6 og 12 måneder i varighet) hos pasienter med KOLS.
Forekomsten av vanlige bivirkninger i tabell 3 nedenfor er basert på sammenslåtte data fra to dobbeltblinde, placebokontrollerte lungefunksjonsstudier (6 og 12 måneder i varighet) der 771 voksne KOLS-pasienter (496 menn og 275 kvinner) 40 år og eldre ble behandlet med SYMBICORT 160/4.5, to inhalasjoner to ganger daglig. Av disse pasientene ble 651 behandlet i 6 måneder og 366 ble behandlet i 12 måneder. SYMBICORT-gruppen var hovedsakelig sammensatt av kaukasiske (93 %) pasienter med en gjennomsnittsalder på 63 år, og en gjennomsnittlig prosent spådde FEV1 ved baseline på 33 %. Kontrollarmer for sammenligning inkluderte 2 inhalasjoner av budesonid HFA (MDI) 160 mcg, formoterol (DPI) 4,5 mcg eller placebo (MDI og DPI) to ganger daglig. Tabell 3 inkluderer alle uønskede hendelser som oppstod med en insidens på ≥3 % i SYMBICORT-gruppen og mer vanlig enn i placebogruppen. Ved å vurdere disse dataene bør den økte gjennomsnittlige varigheten av pasienteksponering for SYMBICORT 4,5 mikrogram tas i betraktning, siden forekomsten ikke justeres for ubalanse i behandlingsvarigheten.
Andre lungeinfeksjoner enn lungebetennelse (for det meste bronkitt) forekom hos en større prosentandel av pasientene behandlet med SYMBICORT 160/4,5 sammenlignet med placebo (henholdsvis 7,9 % vs. 5,1 %). Det var ingen klinisk viktige eller uventede mønstre av abnormiteter observert i opptil 1 år i kjemi, hematologi, EKG, EKG (Holter) overvåking, HPA-akse, bentetthet og oftalmologiske vurderinger.
Sikkerhetsfunnene fra de to dobbeltblinde, aktivt kontrollerte eksaserbasjonsstudiene (6 og 12 måneder i varighet) der 1012 voksne KOLS-pasienter (616 menn og 396 kvinner) 40 år og eldre ble behandlet med SYMBICORT 160/4.5, to inhalasjoner to ganger daglig var i samsvar med lungefunksjonsstudiene.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av SYMBICORT etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering. Noen av disse bivirkningene kan også ha blitt observert i kliniske studier med SYMBICORT.
Hjertesykdommer: angina pectoris, takykardi, atrie- og ventrikulære takyarytmier, atrieflimmer, ekstrasystoler, hjertebank
Endokrine lidelser: hyperkortisisme, reduksjon av veksthastighet hos pediatriske pasienter
Øyelidelser: grå stær, glaukom, økt intraokulært trykk
Gastrointestinale lidelser: orofaryngeal candidiasis, kvalme
Forstyrrelser i immunsystemet: umiddelbare og forsinkede overfølsomhetsreaksjoner, som anafylaktisk reaksjon, angioødem, bronkospasme, urticaria, eksantem, dermatitt, pruritus
Metabolske og ernæringsforstyrrelser: hyperglykemi, hypokalemi
Sykdommer i muskel- og skjelett, bindevev og bein: muskel kramper
Forstyrrelser i nervesystemet: skjelving, svimmelhet
Psykiatriske lidelser: adferdsforstyrrelser, søvnforstyrrelser, nervøsitet, agitasjon, depresjon, rastløshet
Sykdommer i luftveiene, thorax og mediastinum: dysfoni, hoste, irritasjon i halsen
Hud- og subkutane vevssykdommer: blåmerker i huden
Vaskulære lidelser: hypotensjon, hypertensjon
NARKOTIKAHANDEL
I kliniske studier har samtidig administrering av SYMBICORT og andre legemidler, som korttidsvirkende beta2-agonister, intranasale kortikosteroider og antihistaminer/dekongestanter, ikke resultert i økt frekvens av bivirkninger. Ingen formelle legemiddelinteraksjonsstudier er utført med SYMBICORT.
Hemmere av cytokrom P4503A4
Hovedmetabolismen for kortikosteroider, inkludert budesonid, en komponent i SYMBICORT, er via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4). Etter oral administrering av ketokonazol, en sterk hemmer av CYP3A4, økte gjennomsnittlig plasmakonsentrasjon av oralt administrert budesonid. Samtidig administrering av CYP3A4 kan hemme metabolismen av og øke den systemiske eksponeringen for budesonid. Forsiktighet bør utvises når man vurderer samtidig administrering av SYMBICORT 4,5 mcg med langvarig ketokonazol og andre kjente sterke CYP3A4-hemmere (f.eks. ritonavir, atazanavir, klaritromycin, indinavir, itrakonazol, nefazodon, nelfinavir, sakinavir), [teli ADVARSLER OG FORHOLDSREGLER ].
Monoaminoksidasehemmere og trisykliske antidepressiva
SYMBICORT bør administreres med forsiktighet til pasienter som behandles med monoaminoksidasehemmere eller trisykliske antidepressiva, eller innen 2 uker etter seponering av slike midler, fordi virkningen av formoterol, en komponent av SYMBICORT 160 mg, på karsystemet kan potenseres av disse midlene. . I kliniske studier med SYMBICORT fikk et begrenset antall KOLS- og astmapasienter trisykliske antidepressiva, og derfor kan ingen klinisk meningsfulle konklusjoner om bivirkninger trekkes.
Beta-adrenerge reseptorblokkerende midler
Betablokkere (inkludert øyedråper) kan ikke bare blokkere lungeeffekten av beta-agonister, slik som formoterol, en komponent av SYMBICORT, men kan gi alvorlig bronkospasme hos pasienter med astma. Pasienter med astma bør derfor normalt ikke behandles med betablokkere. Imidlertid kan det under visse omstendigheter ikke være akseptable alternativer til bruk av beta-adrenerge blokkere hos pasienter med astma. I denne innstillingen kan kardioselektive betablokkere vurderes, selv om de bør administreres med forsiktighet.
Diuretika
EKG-endringene og/eller hypokalemien som kan oppstå ved administrering av ikke-kaliumsparende diuretika (som loop- eller tiaziddiuretika) kan bli akutt forverret av beta-agonister, spesielt når den anbefalte dosen av beta-agonisten overskrides. Selv om den kliniske betydningen av disse effektene ikke er kjent, anbefales forsiktighet ved samtidig administrering av SYMBICORT og ikke-kaliumsparende diuretika.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Alvorlige astma-relaterte hendelser – sykehusinnleggelser, intubasjoner og død
Bruk av LABA som monoterapi (uten ICS) for astma er assosiert med økt risiko for astma-relatert død [se Salmeterol Multicenter Asthma Research Trial (SMART)]. Tilgjengelige data fra kontrollerte kliniske studier tyder også på at bruk av LABA som monoterapi øker risikoen for astma-relatert sykehusinnleggelse hos pediatriske og ungdomspasienter. Disse funnene anses som en klasseeffekt av LABA. Når LABA brukes i fastdosekombinasjoner med ICS, viser ikke data fra store kliniske studier en signifikant økning i risikoen for alvorlige astma-relaterte hendelser (sykehusinnleggelser, intubasjoner, død) sammenlignet med ICS alene (se alvorlige astma-relaterte hendelser). med ICS/LABA).
Alvorlige astma-relaterte hendelser med ICS/LABA
Fire store, 26-ukers, randomiserte, blindede, aktivt kontrollerte kliniske sikkerhetsstudier ble utført for å evaluere risikoen for alvorlige astma-relaterte hendelser når LABA ble brukt i fastdosekombinasjon med ICS sammenlignet med ICS alene hos pasienter med astma. Tre studier inkluderte voksne og unge pasienter i alderen ≥12 år: en studie sammenlignet budesonid/formoterol (SYMBICORT) med budesonid [se Kliniske studier ]; ett forsøk sammenlignet flutikasonpropionat/salmeterol inhalasjonspulver med flutikasonpropionat inhalasjonspulver; og en studie sammenlignet mometasonfuroat/formoterol med mometasonfuroat. Den fjerde studien inkluderte pediatriske pasienter i alderen 4 til 11 år og sammenlignet flutikasonpropionat/salmeterol inhalasjonspulver med flutikasonpropionat inhalasjonspulver. Det primære sikkerhetsendepunktet for alle fire studiene var alvorlige astma-relaterte hendelser (sykehusinnleggelser, intubasjoner og død). En blindet bedømmelseskomité avgjorde om hendelsene var astma-relaterte.
De tre voksen- og ungdomsstudiene ble designet for å utelukke en risikomargin på 2,0, og den pediatriske studien ble designet for å utelukke en risiko på 2,7. Hver enkelt studie oppfylte sitt forhåndsspesifiserte mål og viste at ICS/LABA ikke var mindreverdig enn ICS alene. En metaanalyse av de tre voksen- og ungdomsstudiene viste ikke en signifikant økning i risiko for en alvorlig astma-relatert hendelse med ICS/LABA fastdosekombinasjon sammenlignet med ICS alene (tabell 1). Disse studiene var ikke designet for å utelukke all risiko for alvorlige astma-relaterte hendelser med ICS/LABA sammenlignet med ICS.
Den pediatriske sikkerhetsstudien inkluderte 6208 pediatriske pasienter i alderen 4 til 11 år som fikk ICS/LABA (flutikasonpropionat/salmeterol inhalasjonspulver) eller ICS (flutikasonpropionat inhalasjonspulver). I denne studien opplevde 27/3107 (0,9 %) pasienter randomisert til ICS/LABA og 21/3101 (0,7 %) pasienter randomisert til ICS en alvorlig astma-relatert hendelse. Det var ingen astma-relaterte dødsfall eller intubasjoner. ICS/LABA viste ikke en signifikant økt risiko for en alvorlig astma-relatert hendelse sammenlignet med ICS basert på den forhåndsspesifiserte risikomarginen (2,7), med et estimert fareforhold for tid til første hendelse på 1,29 (95 % KI: 0,73) 2,27).
Salmeterol Multicenter Astma Research Trial (SMART)
En 28-ukers, placebokontrollert amerikansk studie som sammenlignet sikkerheten til salmeterol med placebo, hver lagt til vanlig astmabehandling, viste en økning i astma-relaterte dødsfall hos pasienter som fikk salmeterol (13/13 176 hos pasienter behandlet med salmeterol vs. 3) /13 179 hos pasienter behandlet med placebo; relativ risiko: 4,37 [95 % KI 1,25, 15,34]). Bruk av bakgrunns-ICS var ikke påkrevd i SMART. Den økte risikoen for astma-relatert død regnes som en klasseeffekt av LABA monoterapi.
Formoterol monoterapi studier
Kliniske studier med formoterol brukt som monoterapi antydet en høyere forekomst av alvorlig astmaforverring hos pasienter som fikk formoterol enn hos de som fikk placebo. Størrelsen på disse studiene var ikke tilstrekkelige til å nøyaktig kvantifisere forskjellen i alvorlige astmaforverringer mellom behandlingsgruppene.
Forverring av sykdom og akutte episoder
SYMBICORT 4,5 mcg bør ikke initieres hos pasienter under raskt forverrede eller potensielt livstruende episoder med astma eller KOLS. SYMBICORT er ikke studert hos pasienter med akutt forverret astma eller KOLS. Starten av SYMBICORT 4,5mcg i denne innstillingen er ikke hensiktsmessig.
Økende bruk av inhalerte, korttidsvirkende beta2-agonister er en markør for forverret astma. I denne situasjonen krever pasienten umiddelbar re-evaluering med revurdering av behandlingsregimet, spesielt med tanke på det mulige behovet for å erstatte den nåværende styrken til SYMBICORT med en høyere styrke, legge til ytterligere inhalerte kortikosteroider eller starte systemiske kortikosteroider. Pasienter bør ikke bruke mer enn 2 inhalasjoner to ganger daglig (morgen og kveld) av SYMBICORT.
SYMBICORT 160mg skal ikke brukes til lindring av akutte symptomer, dvs. som redningsterapi for behandling av akutte episoder med bronkospasme. En inhalert, korttidsvirkende beta2-agonist, ikke SYMBICORT, bør brukes for å lindre akutte symptomer som kortpustethet.
Ved oppstart av behandling med SYMBICORT 4,5 mcg, bør pasienter som har tatt orale eller inhalerte, korttidsvirkende beta2-agonister på regelmessig basis (f.eks. 4 ganger daglig) instrueres om å avbryte regelmessig bruk av disse legemidlene.
Overdreven bruk av SYMBICORT 4,5mcg og bruk sammen med andre langtidsvirkende beta2-agonister
Som med andre inhalasjonsmedisiner som inneholder beta2-adrenerge midler, bør SYMBICORT 4,5 mcg ikke brukes oftere enn anbefalt, i høyere doser enn anbefalt, eller sammen med andre medisiner som inneholder LABA, da en overdose kan føre til. Klinisk signifikante kardiovaskulære effekter og dødsfall er rapportert i forbindelse med overdreven bruk av inhalerte sympatomimetika. Pasienter som bruker SYMBICORT bør ikke bruke en ekstra LABA (f.eks. salmeterol, formoterolfumarat, arformoteroltartrat) uansett grunn, inkludert forebygging av anstrengelsesutløst bronkospasme (EIB) eller behandling av astma eller KOLS.
Lokale effekter
kliniske studier har utvikling av lokaliserte infeksjoner i munn og svelg med Candida albicans forekommet hos pasienter behandlet med SYMBICORT. Når en slik infeksjon utvikler seg, bør den behandles med passende lokal eller systemisk (dvs. oral antifungal) behandling mens behandlingen med SYMBICORT 160 mg fortsetter, men til tider kan det være nødvendig å avbryte behandlingen med SYMBICORT 4,5 mcg. Råd pasienten til å skylle munnen med vann uten å svelge etter inhalasjon for å redusere risikoen for orofaryngeal candidiasis.
Lungebetennelse og andre nedre luftveisinfeksjoner
Leger bør være årvåkne for mulig utvikling av lungebetennelse hos pasienter med KOLS, da de kliniske trekkene ved lungebetennelse og eksaserbasjoner ofte overlapper hverandre. Nedre luftveisinfeksjoner, inkludert lungebetennelse, er rapportert etter inhalert administrering av kortikosteroider.
en 6-måneders lungefunksjonsstudie av 1704 pasienter med KOLS, var det en høyere forekomst av andre lungeinfeksjoner enn lungebetennelse (f.eks. bronkitt, virale nedre luftveisinfeksjoner osv.) hos pasienter som fikk SYMBICORT 160/4.5 (7,6 %) enn hos de som fikk SYMBICORT 80/4,5 (3,2 %), formoterol 4,5 mcg (4,6 %) eller placebo (3,3 %). Lungebetennelse forekom ikke med høyere forekomst i SYMBICORT 160/4,5-gruppen (1,1 %) sammenlignet med placebo (1,3 %). I en 12-måneders lungefunksjonsstudie av 1964 pasienter med KOLS, var det også en høyere forekomst av andre lungeinfeksjoner enn lungebetennelse hos pasienter som fikk SYMBICORT 160/4,5 (8,1 %) enn hos de som fikk SYMBICORT 80/4,5 (6,9 %). formoterol 4,5 mcg (7,1 %) eller placebo (6,2 %). I likhet med 6-måneders studien forekom ikke lungebetennelse med større forekomst i SYMBICORT 160/4,5-gruppen (4,0 %) sammenlignet med placebo (5,0 %).
Immunsuppresjon
Pasienter som bruker legemidler som undertrykker immunsystemet er mer utsatt for infeksjon enn friske individer. Vannkopper og meslinger, for eksempel, kan ha et mer alvorlig eller til og med dødelig forløp hos mottakelige barn eller voksne som bruker kortikosteroider. Hos slike barn eller voksne som ikke har hatt disse sykdommene eller blitt skikkelig immunisert, bør det utvises spesiell forsiktighet for å unngå eksponering. Hvordan dosen, ruten og varigheten av kortikosteroidadministrasjon påvirker risikoen for å utvikle en spredt infeksjon er ikke kjent. Bidraget fra den underliggende sykdommen og/eller tidligere kortikosteroidbehandling til risikoen er heller ikke kjent. Ved eksponering kan behandling med varicella zoster immunglobulin (VZIG) eller sammenslått intravenøst immunglobulin (IVIG), etter behov, være indisert. Ved eksponering for meslinger kan profylakse med sammenslått intramuskulært immunglobulin (IG) være indisert (se de respektive pakningsvedleggene for fullstendig VZIG- og IG-forskrivningsinformasjon). Hvis det utvikler seg vannkopper, kan behandling med antivirale midler vurderes. Immunresponsen mot varicellavaksine ble evaluert hos pediatriske pasienter med astma i alderen 12 måneder til 8 år med budesonid inhalasjonssuspensjon.
En åpen, ikke-randomisert klinisk studie undersøkte immunresponsen overfor varicella-vaksine hos 243 astmapasienter i alderen 12 måneder til 8 år som ble behandlet med budesonid-inhalasjonssuspensjon 0,25 mg til 1 mg daglig (n=151) eller ikke-kortikosteroid astmabehandling (n) =92) (dvs. beta2-agonister, leukotrienreseptorantagonister, kromoner). Prosentandelen av pasienter som utviklet en seroprotektiv antistofftiter på >5,0 (gpELISA-verdi) som respons på vaksinasjonen var lik hos pasienter behandlet med budesonid-inhalasjonssuspensjon (85 %), sammenlignet med pasienter behandlet med ikke-kortikosteroid astmabehandling (90 %). Ingen pasienter behandlet med budesonid-inhalasjonssuspensjon utviklet vannkopper som et resultat av vaksinasjon.
Inhalerte kortikosteroider bør brukes med forsiktighet, hvis i det hele tatt, hos pasienter med aktive eller hvilende tuberkuloseinfeksjoner i luftveiene; ubehandlede systemiske sopp-, bakterie-, virus- eller parasittiske infeksjoner; eller okulær herpes simplex.
Overføring av pasienter fra systemisk kortikosteroidterapi
Spesiell forsiktighet er nødvendig for pasienter som har blitt overført fra systemisk aktive kortikosteroider til inhalerte kortikosteroider fordi dødsfall på grunn av binyrebarksvikt har forekommet hos pasienter med astma under og etter overgang fra systemiske kortikosteroider til mindre systemisk tilgjengelige inhalerte kortikosteroider. Etter seponering fra systemiske kortikosteroider er det nødvendig med et antall måneder for å gjenopprette funksjonen av hypothalamus-hypofyse-binyrene (HPA).
Pasienter som tidligere har blitt holdt på 20 mg eller mer per dag med prednison (eller tilsvarende) kan være mest utsatt, spesielt når deres systemiske kortikosteroider er nesten fullstendig seponert. I løpet av denne perioden med HPA-undertrykkelse kan pasienter vise tegn og symptomer på binyrebarksvikt når de utsettes for traumer, kirurgi eller infeksjon (spesielt gastroenteritt) eller andre tilstander assosiert med alvorlig elektrolytttap. Selv om SYMBICORT kan gi kontroll over astmasymptomer under disse episodene, tilfører det i anbefalte doser mindre enn normale fysiologiske mengder glukokortikoid systemisk og gir IKKE den mineralokortikoidaktiviteten som er nødvendig for å takle disse nødsituasjonene.
perioder med stress, et alvorlig astmaanfall eller en alvorlig KOLS-eksaserbasjon, bør pasienter som har blitt seponert fra systemiske kortikosteroider instrueres om å gjenoppta orale kortikosteroider (i store doser) umiddelbart og kontakte lege for videre instruksjon. Disse pasientene bør også instrueres om å bære et advarselskort som indikerer at de kan trenge supplerende systemiske kortikosteroider i perioder med stress, et alvorlig astmaanfall eller en alvorlig KOLS-eksaserbasjon.
Pasienter som trenger orale kortikosteroider bør avvennes sakte fra systemisk kortikosteroidbruk etter overgang til SYMBICORT. Prednisonreduksjon kan oppnås ved å redusere den daglige prednisondosen med 2,5 mg på ukentlig basis under behandling med SYMBICORT. Lungefunksjon (gjennomsnittlig tvunget ekspirasjonsvolum i 1 sekund [FEV1] eller toppekspiratorisk flow om morgenen [PEF]), bruk av beta-agonister og astma- eller KOLS-symptomer bør overvåkes nøye under seponering av orale kortikosteroider. I tillegg bør pasienter observeres for tegn og symptomer på binyrebarksvikt, som tretthet, slapphet, svakhet, kvalme og oppkast og hypotensjon.
Overføring av pasienter fra systemisk kortikosteroidbehandling til inhalerte kortikosteroider eller SYMBICORT kan avsløre tilstander som tidligere er undertrykt av systemisk kortikosteroidbehandling (f.eks. rhinitt, konjunktivitt, eksem, leddgikt, eosinofile tilstander). Noen pasienter kan oppleve symptomer på systemisk aktiv kortikosteroidabstinens (f.eks. ledd- og/eller muskelsmerter, slapphet, depresjon) til tross for vedlikehold eller til og med forbedring av respirasjonsfunksjonen.
Hyperkortisisme og binyresuppresjon
Budesonid, en komponent i SYMBICORT, vil ofte bidra til å kontrollere astma- og KOLS-symptomer med mindre undertrykkelse av HPA-funksjonen enn terapeutisk ekvivalente orale doser av prednison. Siden budesonid absorberes i sirkulasjonen og kan være systemisk aktivt ved høyere doser, kan de gunstige effektene av SYMBICORT for å minimere HPA-dysfunksjon forventes kun når anbefalte doser ikke overskrides og individuelle pasienter titreres til laveste effektive dose.
På grunn av muligheten for systemisk absorpsjon av inhalerte kortikosteroider, bør pasienter behandlet med SYMBICORT 160mg observeres nøye for tegn på systemiske kortikosteroideffekter. Spesiell forsiktighet bør utvises ved observasjon av pasienter postoperativt eller i perioder med stress for tegn på utilstrekkelig binyrerespons.
Det er mulig at systemiske kortikosteroideffekter som hyperkortisisme og binyresuppresjon (inkludert binyrekrise) kan forekomme hos et lite antall pasienter, spesielt når budesonid administreres i høyere doser enn anbefalt over lengre tidsperioder. Hvis slike effekter oppstår, bør dosen av SYMBICORT reduseres sakte, i samsvar med aksepterte prosedyrer for å redusere systemiske kortikosteroider og for behandling av astmasymptomer.
Legemiddelinteraksjoner med sterke cytokrom P450 3A4-hemmere
Forsiktighet bør utvises når man vurderer samtidig administrering av SYMBICORT 4,5 mcg med ketokonazol, og andre kjente sterke CYP3A4-hemmere (f.eks. ritonavir, atazanavir, klaritromycin, indinavir, itrakonazol, nefazodon, nelfinavir, sakinavir, sakinavir, økt eksponering for telitromycin) på grunn av økt systemeksponering. til budesonid kan forekomme [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
Paradoksal bronkospasme og øvre luftveissymptomer
Som med andre inhalasjonsmedisiner, kan SYMBICORT 160mg produsere paradoksal bronkospasme, som kan være livstruende. Hvis paradoksal bronkospasme oppstår etter dosering med SYMBICORT 160 mg, bør den behandles umiddelbart med en inhalert, korttidsvirkende bronkodilatator, SYMBICORT bør seponeres umiddelbart, og alternativ behandling bør settes i gang.
Umiddelbare overfølsomhetsreaksjoner
Umiddelbare overfølsomhetsreaksjoner kan oppstå etter administrering av SYMBICORT 160 mg, som vist ved tilfeller av urtikaria, angioødem, utslett og bronkospasme.
Kardiovaskulære og sentralnervesystemets effekter
Overdreven beta-adrenerg stimulering har vært assosiert med anfall, angina, hypertensjon eller hypotensjon, takykardi med hastigheter på opptil 200 slag/min, arytmier, nervøsitet, hodepine, skjelving, hjertebank, kvalme, svimmelhet, tretthet, ubehag og søvnløshet [se OVERDOSERING ]. Derfor bør SYMBICORT 160mg, som alle produkter som inneholder sympatomimetiske aminer, brukes med forsiktighet hos pasienter med kardiovaskulære lidelser, spesielt koronar insuffisiens, hjertearytmier og hypertensjon.
Formoterol, en komponent i SYMBICORT, kan gi en klinisk signifikant kardiovaskulær effekt hos noen pasienter målt ved puls, blodtrykk og/eller symptomer. Selv om slike effekter er uvanlige etter administrering av formoterol i anbefalte doser, kan det hende at legemidlet må seponeres hvis de oppstår. I tillegg er det rapportert at beta-agonister produserer EKG-endringer, som utflating av T-bølgen, forlengelse av QTc-intervallet og ST-segmentdepresjon. Den kliniske betydningen av disse funnene er ukjent. Dødsfall er rapportert i forbindelse med overdreven bruk av inhalerte sympatomimetika.
Reduksjon i beinmineraltetthet
Nedgang i beinmineraltetthet (BMD) er observert ved langtidsadministrasjon av produkter som inneholder inhalerte kortikosteroider. Den kliniske betydningen av små endringer i BMD med hensyn til langsiktige konsekvenser som fraktur er ukjent. Pasienter med store risikofaktorer for redusert benmineralinnhold, slik som langvarig immobilisering, familiehistorie med osteoporose, postmenopausal status, tobakksbruk, høy alder, dårlig ernæring eller kronisk bruk av legemidler som kan redusere benmassen (f.eks. antikonvulsiva, orale kortikosteroider ) bør overvåkes og behandles med etablerte standarder for omsorg. Siden pasienter med KOLS ofte har flere risikofaktorer for redusert BMD, anbefales vurdering av BMD før oppstart av SYMBICORT 160 mg og periodisk deretter. Hvis det sees betydelige reduksjoner i BMD og SYMBICORT fortsatt anses som medisinsk viktig for den pasientens KOLS-behandling, bør bruk av medisiner for å behandle eller forebygge osteoporose vurderes sterkt.
Effekter av behandling med SYMBICORT 160/4.5, SYMBICORT 80/4.5, formoterol 4.5 mcg eller placebo på BMD ble evaluert i en undergruppe av 326 pasienter (kvinner og menn 41 til 88 år) med KOLS i 12-måneders lungefunksjon studere. BMD-evalueringer av hofte- og lumbale ryggradsregioner ble utført ved baseline og 52 uker ved bruk av dual energy x-ray absorptiometri (DEXA) skanninger. Gjennomsnittlige endringer i BMD fra baseline til behandlingsslutt var små (gjennomsnittlige endringer varierte fra -0,01 -0,01 g/cm²). ANCOVA-resultater for total ryggrad og total hofte-BMD basert på slutten av behandlingstidspunktet viste at alle geometriske LS-midlere forhold for de parvise behandlingsgruppesammenlikningene var nær 1, noe som indikerer at totalt sett BMD for total hofte- og ryggradsregioner for de 12 -månedstiden var stabil over hele behandlingsperioden.
Effekt på vekst
Oralt inhalerte kortikosteroider kan forårsake reduksjon i veksthastigheten når de administreres til pediatriske pasienter. Overvåk veksten til pediatriske pasienter som får SYMBICORT rutinemessig (f.eks. via stadiometri). For å minimere de systemiske effektene av oralt inhalerte kortikosteroider, inkludert SYMBICORT, titreres hver pasients dose til den laveste dosen som effektivt kontrollerer hans/hennes symptomer [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Grønn stær og grå stær
Glaukom, økt intraokulært trykk og grå stær er rapportert hos pasienter med astma og KOLS etter langvarig administrering av inhalerte kortikosteroider, inkludert budesonid, en komponent i SYMBICORT. Derfor er nøye overvåking nødvendig hos pasienter med endret syn eller med tidligere økt intraokulært trykk, glaukom og/eller grå stær.
Effekter av behandling med SYMBICORT 160/4.5, SYMBICORT 80/4.5, formoterol 4.5 mcg eller placebo på utvikling av grå stær eller glaukom ble evaluert i en undergruppe av 461 pasienter med KOLS i den 12-måneders lungefunksjonsstudien. Oftalmiske undersøkelser ble utført ved baseline, 24 uker og 52 uker. Det var 26 forsøkspersoner (6 %) med en økning i posterior subkapsulær skåre fra baseline til maksimal verdi (>0,7) i løpet av den randomiserte behandlingsperioden. Endringer i posterior subkapsulære skårer på >0,7 fra baseline til maksimal behandling forekom hos 11 pasienter (9,0 %) i SYMBICORT 160/4,5-gruppen, 4 pasienter (3,8 %) i SYMBICORT 80/4,5-gruppen, 5 pasienter (4,2 %) i formoterolgruppen, og 6 pasienter (5,2%) i placebogruppen.
Eosinofile tilstander og Churg-Strauss syndrom
sjeldne tilfeller kan pasienter på inhalerte kortikosteroider ha systemiske eosinofile tilstander. Noen av disse pasientene har kliniske trekk ved vaskulitt i samsvar med Churg-Strauss syndrom, en tilstand som ofte behandles med systemisk kortikosteroidbehandling. Disse hendelsene har vanligvis, men ikke alltid, vært assosiert med reduksjon og/eller seponering av oral kortikosteroidbehandling etter introduksjon av inhalerte kortikosteroider. Leger bør være oppmerksomme på eosinofili, vaskulittisk utslett, forverrede lungesymptomer, hjertekomplikasjoner og/eller nevropati hos pasientene. En årsakssammenheng mellom budesonid og disse underliggende tilstandene er ikke fastslått.
Sameksisterende forhold
SYMBICORT 4,5mcg, som alle medisiner som inneholder sympatomimetiske aminer, bør brukes med forsiktighet hos pasienter med krampesykdommer eller tyreotoksikose og hos de som er uvanlig responsive på sympatomimetiske aminer. Doser av den relaterte beta2-adrenoceptoragonisten albuterol, når administrert intravenøst, er rapportert å forverre eksisterende diabetes mellitus og ketoacidose.
Hypokalemi og hyperglykemi
Beta-adrenerge agonistmedisiner kan gi betydelig hypokalemi hos noen pasienter, muligens gjennom intracellulær shunting, som har potensial til å gi uønskede kardiovaskulære effekter [se KLINISK FARMAKOLOGI ]. Nedgangen i serumkalium er vanligvis forbigående og krever ikke tilskudd. Klinisk signifikante endringer i blodsukker og/eller serumkalium ble sett i sjeldne tilfeller under kliniske studier med SYMBICORT ved anbefalte doser.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON og bruksanvisning ).
Alvorlige astma-relaterte hendelser
Informer pasienter med astma om at LABA når det brukes alene øker risikoen for astma-relatert sykehusinnleggelse eller astma-relatert død. Tilgjengelige data viser at når ICS og LABA brukes sammen, slik som med SYMBICORT, er det ikke en signifikant økning i risiko for disse hendelsene.
Ikke for akutte symptomer
Informer pasienter om at SYMBICORT 160mg ikke er ment å lindre akutte symptomer på astma eller KOLS og ekstra doser bør ikke brukes til det formålet. Råd pasienter til å behandle akutte symptomer med en inhalert, korttidsvirkende beta2-agonist som albuterol. Gi pasientene slike medisiner og instruer pasienten i hvordan den skal brukes.
Instruer pasienter om å oppsøke lege umiddelbart hvis de opplever noe av følgende:
- . Reduserende effektivitet av inhalerte, korttidsvirkende beta2-agonister . Behov for flere inhalasjoner enn vanlig av inhalerte, korttidsvirkende beta2-agonister . Betydelig reduksjon i lungefunksjon som beskrevet av legen
Fortell pasientene at de ikke skal stoppe behandlingen med SYMBICORT uten veiledning fra lege/leverandør, siden symptomene kan gjenta seg etter seponering.
Ikke bruk ekstra langtidsvirkende beta2-agonister
Instruer pasienter om ikke å bruke annen LABA for astma og KOLS.
Lokale effekter
Informer pasienter om at lokaliserte infeksjoner med Candida albicans oppstod i munn og svelg hos noen pasienter. Hvis orofaryngeal candidiasis utvikler seg, bør den behandles med passende lokal eller systemisk (dvs. oral) antifungal behandling mens behandlingen med SYMBICORT 4,5 mcg fortsatt fortsettes, men til tider kan det være nødvendig å avbryte behandlingen med SYMBICORT midlertidig under nøye medisinsk tilsyn. Det anbefales å skylle munnen med vann uten å svelge etter innånding for å redusere risikoen for trøst.
Lungebetennelse
Pasienter med KOLS har høyere risiko for lungebetennelse; instruere dem om å kontakte helsepersonell dersom de utvikler symptomer på lungebetennelse.
Immunsuppresjon
Advar pasienter som er på immunsuppressive doser av kortikosteroider for å unngå eksponering for vannkopper eller meslinger og, hvis de blir utsatt, konsultere legen sin uten forsinkelse. Informer pasienter om potensiell forverring av eksisterende tuberkulose, sopp-, bakterie-, virus- eller parasittiske infeksjoner eller okulær herpes simplex.
Hyperkortisisme og binyresuppresjon
Informer pasienter om at SYMBICORT kan forårsake systemiske kortikosteroideffekter av hyperkortisisme og binyresuppresjon. Informer i tillegg pasienter om at dødsfall på grunn av binyrebarksvikt har oppstått under og etter overgang fra systemiske kortikosteroider. Pasienter bør trappe ned sakte fra systemiske kortikosteroider ved overgang til SYMBICORT.
Reduksjon i beinmineraltetthet
Informer pasienter som har økt risiko for redusert BMD at bruk av kortikosteroider kan utgjøre en ekstra risiko.
Redusert veksthastighet
Informer pasienter om at oralt inhalerte kortikosteroider, en komponent i SYMBICORT, kan forårsake reduksjon i veksthastighet når de gis til pediatriske pasienter. Leger bør følge nøye med på veksten til barn og ungdom som tar kortikosteroider uansett vei.
Okulære effekter
Langvarig bruk av inhalerte kortikosteroider kan øke risikoen for enkelte øyeproblemer (grå stær eller glaukom); vurdere regelmessige øyeundersøkelser.
Risikoer forbundet med beta-agonistterapi
Informer pasienter om bivirkninger forbundet med beta2-agonister, som hjertebank, brystsmerter, rask hjertefrekvens, skjelving eller nervøsitet.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Budesonid
Langtidsstudier ble utført på rotter og mus ved bruk av oral administrering for å evaluere det karsinogene potensialet til budesonid.
en 2-årig studie på Sprague-Dawley-rotter forårsaket budesonid en statistisk signifikant økning i forekomsten av gliomer hos hannrotter ved en oral dose på 50 mcg/kg (omtrent tilsvarende MRHDID hos voksne og barn på en mcg/m²) basis). Ingen tumorgenisitet ble sett hos hann- og hunnrotter ved respektive orale doser opptil 25 og 50 mcg/kg (omtrent ekvivalent med MRHDID hos voksne og barn på en mcg/m²-basis). I ytterligere to 2-årige studier med Fischer- og Sprague-Dawley-hannrotter forårsaket budesonid ingen gliomer ved en oral dose på 50 mcg/kg (omtrent tilsvarende MRHDID hos voksne og barn på mcg/m²-basis). Hos Sprague-Dawley-hannrottene forårsaket imidlertid budesonid en statistisk signifikant økning i forekomsten av hepatocellulære svulster ved en oral dose på 50 mcg/kg (omtrent tilsvarende MRHDID hos voksne og barn på en mcg/m²-basis). De samtidige referansekortikosteroidene (prednisolon og triamcinolonacetonid) i disse to studiene viste lignende funn.
en 91-ukers studie på mus forårsaket budesonid ingen behandlingsrelatert karsinogenitet ved orale doser opp til 200 mcg/kg (ca. 2 ganger MRHDID hos voksne og barn på en mcg/m²-basis).
Budesonid var ikke mutagent eller klastogent i seks forskjellige testsystemer: Ames Salmonella/mikrosomplatetest, musemikronukleustest, muselymfomtest, kromosomavvikstest i humane lymfocytter, kjønnsbundet recessiv letal test i Drosophila melanogaster og DNA-reparasjonsanalyse hos rotte hepatocyttkultur.
Fertilitet og reproduksjonsevne var upåvirket hos rotter ved subkutane doser opptil 80 mcg/kg (omtrent lik MRHDID på mcg/m²-basis). Imidlertid forårsaket det en reduksjon i prenatal levedyktighet og levedyktighet hos ungene ved fødsel og under diegivning, sammen med en reduksjon i mors kroppsvektsøkning, ved subkutane doser på 20 mcg/kg og over (mindre enn MRHDID på en mcg/m² basis ). Ingen slike effekter ble notert ved 5 mcg/kg (mindre enn MRHDID på mcg/m² basis).
Formoterol
Langtidsstudier ble utført på mus som brukte oral administrering og rotter ved bruk av inhalasjonsadministrering for å evaluere det karsinogene potensialet til formoterolfumarat.
I en 24-måneders karsinogenitetsstudie på CD-1-mus forårsaket formoterol ved orale doser på 100 mcg/kg og over (omtrent 30 og 15 ganger MRHDID hos henholdsvis voksne og barn, på mcg/m²-basis) en dose- relatert økning i forekomsten av uterine leiomyomer.
I en 24-måneders karsinogenitetsstudie på Sprague-Dawley-rotter ble det observert en økt forekomst av mesovarian leiomyom og uterin leiomyosarcoma ved inhalert dose på 130 mcg/kg (ca. 70 og 35 ganger MRHDID hos voksne og barn, hhv. mcg/m² basis). Ingen svulster ble sett ved 22 mcg/kg (omtrent 12 og 6 ganger MRHDID hos henholdsvis voksne og barn, på mcg/m²-basis).
Andre beta-agonistmedisiner har på lignende måte vist økning i leiomyomer i kjønnsorganene hos kvinnelige gnagere. Relevansen av disse funnene for menneskelig bruk er ukjent.
Formoterol var ikke mutagent eller klastogent i Ames Salmonella/mikrosomplatetest, muselymfomtest, kromosomavvikstest i humane lymfocytter og mikronukleustest hos rotter.
En reduksjon i fertilitet og/eller reproduksjonsevne ble identifisert hos hannrotter behandlet med formoterol ved en oral dose på 15 000 mcg/kg (omtrent 2200 ganger MRHDID på AUC-basis). Ingen slik effekt ble sett ved 3000 mcg/kg (omtrent 1600 ganger MRHDID på en mcg/m²-basis). I en separat studie med hannrotter behandlet med en oral dose på 15 000 mcg/kg (omtrent 8000 ganger MRHDID på en mcg/m²-basis), var det funn av testikkeltubulær atrofi og spermatisk avfall i testiklene og oligospermi i epididymidene. Ingen effekt på fertilitet ble påvist hos hunnrotter ved doser opp til 15 000 mcg/kg (ca. 1100 ganger MRHDID på AUC-basis).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Det er ingen tilstrekkelige og godt kontrollerte studier av SYMBICORT 160 mg eller en av dets individuelle komponenter, formoterolfumarat, hos gravide kvinner; Det er imidlertid studier tilgjengelig for den andre komponenten budesonid. I reproduksjonsstudier på dyr var SYMBICORT 4,5 mcg, administrert via inhalasjonsveien, teratogent, embryocidal og redusert fostervekt hos rotter ved mindre enn den maksimale anbefalte daglige inhalasjonsdosen for mennesker (MRHDID) på en mcg/m²-basis. Budesonid alene, administrert subkutant, var teratogent, embryocidal og reduserte fostervekter hos rotter og kaniner ved mindre enn MRHDID, men disse effektene ble ikke sett hos rotter som fikk inhalerte doser opptil 4 ganger MRHDID. Studier av gravide kvinner har ikke vist at inhalert budesonid alene øker risikoen for abnormiteter når det administreres under graviditet. Erfaring med orale kortikosteroider tyder på at gnagere er mer utsatt for teratogene effekter fra kortikosteroideksponering enn mennesker. Formoterolfumarat alene, administrert oralt, var teratogent hos rotter og kaniner ved henholdsvis 1600 og 65 000 ganger MRHDID. Formoterolfumarat var også embryocidal, økte tap av valper ved fødsel og under amming, og reduserte valpevekt hos rotter ved 110 ganger MRHDID. Disse bivirkningene oppstod vanligvis ved store multipler av MRHDID når formoterolfumarat ble administrert oralt for å oppnå høy systemisk eksponering. Ingen teratogene, embryocidale eller utviklingsmessige effekter ble sett hos rotter som fikk inhalasjonsdoser på opptil 375 ganger MRHDID.
Den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort hos de angitte populasjonene er ukjent. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-/fosterrisiko
Hos kvinner med dårlig eller moderat kontrollert astma er det økt risiko for flere perinatale uønskede utfall som svangerskapsforgiftning hos mor og prematuritet, lav fødselsvekt og liten for svangerskapsalderen hos nyfødt. Gravide kvinner med astma bør overvåkes nøye og medisinen justeres etter behov for å opprettholde optimal astmakontroll.
Arbeid eller levering
Det er ingen godt kontrollerte studier på mennesker som har undersøkt effekten av SYMBICORT 4,5mcg under fødsel og fødsel. På grunn av potensialet for beta-agonistinterferens med uterin kontraktilitet, bør bruk av SYMBICORT 4,5 mcg under fødsel begrenses til de pasientene hvor fordelene klart oppveier risikoen.
Data
Menneskelige data
Studier av gravide kvinner har ikke vist at inhalert budesonid øker risikoen for abnormiteter når det administreres under graviditet. Resultatene fra en stor populasjonsbasert prospektiv kohort epidemiologisk studie som gjennomgikk data fra tre svenske registre som dekker omtrent 99 % av svangerskapene fra 1995-1997 (dvs. det svenske medisinske fødselsregisteret; Register over medfødte misdannelser; Barnkardiologisk register) indikerer ingen økt risiko for medfødte misdannelser ved bruk av inhalert budesonid tidlig i svangerskapet. Medfødte misdannelser ble studert i 2014 spedbarn født av mødre som rapporterte bruk av inhalert budesonid for astma tidlig i svangerskapet (vanligvis 10-12 uker etter siste menstruasjon), perioden da de fleste større organmisdannelser oppstår. Frekvensen av registrerte medfødte misdannelser var lik sammenlignet med den generelle befolkningen (henholdsvis 3,8 % vs. 3,5 %). I tillegg, etter eksponering for inhalert budesonid, var antallet spedbarn født med orofaciale spalter likt det forventede antallet i normalpopulasjonen (henholdsvis 4 barn vs. 3,3).
De samme dataene ble brukt i en andre studie som brakte totalt til 2534 spedbarn hvis mødre ble utsatt for inhalert budesonid. I denne studien var frekvensen av medfødte misdannelser blant spedbarn hvis mødre ble eksponert for inhalert budesonid tidlig i svangerskapet ikke forskjellig fra frekvensen for alle nyfødte babyer i samme periode (3,6 %).
Dyredata
SYMBICORT
I en embryo-føtal utviklingsstudie på drektige rotter dosert i løpet av organogeneseperioden fra drektighetsdagene 6-16, ga SYMBICORT 160 mg navlebrokk hos fostre ved doser mindre enn MRHDID (på en mcg/m² basis ved inhalasjonsdoser på 12/ 0,66 mcg/kg/dag og over). Fostervekten ble redusert med henholdsvis ca. 5 og 3 ganger MRHDID (på AUC-basis ved en inhalert dose på 80/4,4 mcg/kg (budesonid/formoterol) hos mor). Ingen teratogene eller embryocidale effekter ble påvist ved doser lavere enn MRHDID (på en mcg/m² basis ved en inhalert dose på 2,5/0,14 mcg/kg/dag hos mor).
Budesonid
en fertilitets- og reproduksjonsstudie ble hannrotter administrert subkutant i 9 uker og hunner i 2 uker før paring og gjennom hele paringsperioden. Hunnene ble dosert frem til avvenningen av avkommet. Budesonid forårsaket en reduksjon i prenatal levedyktighet og levedyktighet hos valpene ved fødsel og under diegivning, sammen med en reduksjon i maternell kroppsvektsøkning, ved doser mindre enn MRHDID (på en mcg/m² basis ved maternal subkutane doser på 20 mcg/ kg/dag og over). Ingen slike effekter ble observert ved en dose mindre enn MRHDID (på en mcg/m² basis ved en maternal subkutan dose på 5 mcg/kg/dag).
en embryo-føtal utviklingsstudie på drektige kaniner doseret i løpet av organogeneseperioden fra drektighetsdagene 6-18, ga budesonid fostertap, redusert fostervekt og skjelettavvik ved doser mindre enn MRHDID (på en mcg/m² basis ved en mors subkutan dose på 25 mcg/kg/dag). I en embryo-føtal utviklingsstudie på drektige rotter doseret i løpet av organogeneseperioden fra drektighetsdagene 6-15, ga budesonid lignende uønskede fostereffekter ved doser omtrent 8 ganger MRHDID (på en mcg/m² basis ved en maternal subkutan dose på 500 mcg/kg/dag). I en annen embryo-føtal utviklingsstudie på drektige rotter ble det ikke sett teratogene eller embryocidale effekter ved doser opptil 4 ganger MRHDID (på en mcg/m² basis ved inhalasjonsdoser opp til 250 mcg/kg/dag hos mor).
en peri- og postnatal utviklingsstudie, rotter dosert fra drektighetsdag 15 til postpartum dag 21, hadde budesonid ingen effekter på fødselen, men hadde en effekt på vekst og utvikling av avkom. Avkoms overlevelse ble redusert og overlevende avkom hadde redusert gjennomsnittlig kroppsvekt ved fødsel og under amming ved doser mindre enn MRHDID og høyere (på en mcg/m² basis ved maternale subkutane doser på 20 mcg/kg/dag og høyere). Disse funnene skjedde i nærvær av maternell toksisitet.
Formoterol
en fertilitets- og reproduksjonsstudie ble hannrotter doseret oralt i 9 uker og hunner i 2 uker før paring og gjennom hele paringsperioden. Hunnene ble enten doseret frem til drektighetsdag 19 eller frem til avvenning av avkommet. Hannene ble doseret opp til 25 uker. Navlebrokk ble observert hos rottefostre ved orale doser 1600 ganger og høyere enn MRHDID (på en mcg/m²-basis ved maternelle orale doser på 3000 mcg/kg/dag og høyere). Brachygnatia ble observert hos rottefostre ved en dose på 8000 ganger MRHDID (på en mcg/m² basis ved en mors oral dose på 15 000 mcg/kg/dag). Graviditeten ble forlenget med en dose på 8000 ganger MRHDID (på en mcg/m² basis ved en mors oral dose på 15 000 mcg/kg/dag). Foster- og valpedødsfall skjedde ved doser omtrent 1600 ganger MRHDID og høyere (på en mcg/m²-basis ved orale doser på 3000 mcg/kg/dag og høyere) under svangerskapet.
en embryo-føtal utviklingsstudie på drektige rotter dosert i løpet av organogeneseperioden fra drektighetsdagene 6-15, ble det ikke sett teratogene, embryocidale eller utviklingsmessige effekter ved doser opp til 375 ganger MRHDID (på en mcg/m²-basis med maternell inhalasjon doser opptil 690 mcg/kg/dag).
I en embryo-føtal utviklingsstudie på drektige kaniner dosert i løpet av organogeneseperioden fra drektighetsdagene 6-18, ble subkapsulære cyster på leveren observert hos fostrene i en dose på 65 000 ganger MRHDID (på en mcg/m²-basis med en maternell oral dose på 60 000 mcg/kg/dag). Ingen teratogene effekter ble observert ved doser opptil 3800 ganger MRHDID (på en mcg/m² basis ved orale doser opp til 3500 mcg/kg/dag hos mor).
en pre- og postnatal utviklingsstudie fikk gravide hunnrotter formoterol i orale doser på 0, 210, 840 og 3400 mcg/kg/dag fra drektighetsdag 6 til ammingsperioden. Valpenes overlevelse ble redusert fra fødsel til postpartum dag 26 ved doser 110 ganger MRHDID og høyere (på en mcg/m² basis ved maternale orale doser på 210 mcg/kg/dag og høyere), selv om det ikke var bevis for en dose-respons forhold. Det var ingen behandlingsrelaterte effekter på den fysiske, funksjonelle og atferdsmessige utviklingen til rotteunger.
Amming
Risikosammendrag
Det er ingen tilgjengelige data på effekten av SYMBICORT 4,5mcg, budesonid eller formoterolfumarat på det ammende barnet eller på melkeproduksjonen. Budesonid, som andre inhalerte kortikosteroider, finnes i morsmelk [se Data ]. Det er ingen tilgjengelige data på tilstedeværelsen av formoterolfumarat i morsmelk. Formoterolfumarat finnes i rottemelk [se Data ]. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for SYMBICORT 4,5mcg og eventuelle potensielle bivirkninger på det ammede spedbarnet fra SYMBICORT 160mg eller fra den underliggende mors tilstand.
Data
Humane data med budesonid levert via tørrpulverinhalator indikerer at den totale daglige orale dosen av budesonid tilgjengelig i morsmelk til spedbarnet er omtrent 0,3 % til 1 % av dosen inhalert av moren [se KLINISK FARMAKOLOGI ]. For SYMBICORT 4,5 mcg, forventes dosen av budesonid som er tilgjengelig for spedbarnet i morsmelk, som en prosentandel av mors dose, å være lik.
I fertilitets- og reproduksjonsstudien på rotter ble plasmanivåer av formoterol målt i unger på post-natal dag 15 [se Bruk i spesifikke populasjoner ]. Det ble anslått at den maksimale plasmakonsentrasjonen som ungene fikk fra morsdyret, ved den høyeste dosen på 15 mg/kg, etter amming var 4,4 % (0,24 nmol/L for et kull vs. 5,5 nmol/L for moren) .
Pediatrisk bruk
Sikkerhet og effektivitet av SYMBICORT hos astmapasienter 12 år og eldre har blitt fastslått i studier på opptil 12 måneder. I de to 12-ukers, dobbeltblinde, placebokontrollerte amerikanske pivotale studiene ble 25 pasienter i alderen 12 til 17 år behandlet med SYMBICORT to ganger daglig [se Kliniske studier ]. Effektresultatene i denne aldersgruppen var lik de som ble observert hos pasienter 18 år og eldre. Det var ingen åpenbare forskjeller i type eller frekvens av bivirkninger rapportert i denne aldersgruppen sammenlignet med pasienter 18 år og eldre.
Sikkerheten og effektiviteten til SYMBICORT 80/4.5 hos astmapasienter 6 til under 12 år har blitt fastslått i studier av opptil 12 ukers varighet [se Kliniske studier ]. Sikkerhetsprofilen hos disse pasientene var konsistent med den som ble observert hos pasienter 12 år og eldre som også fikk SYMBICORT [se BIVIRKNINGER ].
Sikkerheten og effektiviteten til SYMBICORT 160mg hos astmapasienter under 6 år er ikke fastslått.
Kontrollerte kliniske studier har vist at oralt inhalerte kortikosteroider inkludert budesonid, en komponent i SYMBICORT, kan forårsake en reduksjon i veksthastighet hos pediatriske pasienter. Denne effekten har blitt observert i fravær av laboratoriebevis for HPA-akseundertrykkelse, noe som tyder på at veksthastighet er en mer sensitiv indikator på systemisk kortikosteroideksponering hos pediatriske pasienter enn noen vanlig brukte tester av HPA-aksefunksjon. Den langsiktige effekten av denne reduksjonen i veksthastighet assosiert med oralt inhalerte kortikosteroider, inkludert innvirkningen på slutthøyden er ukjent. Potensialet for "catch-up" vekst etter seponering av behandling med oralt inhalerte kortikosteroider er ikke tilstrekkelig studert.
en studie av astmatiske barn i alderen 5 til 12 år hadde de som ble behandlet med budesonid DPI 200 mcg to ganger daglig (n=311) en 1,1 centimeter reduksjon i vekst sammenlignet med de som fikk placebo (n=418) ved slutten av ett år ; forskjellen mellom disse to behandlingsgruppene økte ikke ytterligere over tre år med tilleggsbehandling. Ved slutten av 4 år hadde barn behandlet med budesonid DPI og barn behandlet med placebo lignende veksthastigheter. Konklusjoner fra denne studien kan forvirres av ulik bruk av kortikosteroider i behandlingsgruppene og inkludering av data fra pasienter som oppnår pubertet i løpet av studien.
Veksten hos pediatriske pasienter som får oralt inhalerte kortikosteroider, inkludert SYMBICORT, bør overvåkes. Hvis et barn eller en ungdom på et kortikosteroid ser ut til å ha veksthemming, bør muligheten for at han/hun er spesielt følsom for denne effekten vurderes. De potensielle veksteffektene av langvarig behandling bør veies opp mot de kliniske fordelene som oppnås. For å minimere de systemiske effektene av orale inhalerte kortikosteroider, inkludert SYMBICORT, bør hver pasient titreres til den laveste styrken som effektivt kontrollerer astmaen hans/hennes [se DOSERING OG ADMINISTRASJON ].
Geriatrisk bruk
Av det totale antallet astmapasienter som ble behandlet med SYMBICORT 160 mg to ganger daglig i to 12-ukers studier og en 26-ukers studie etter markedsføring, var 791 65 år eller eldre, hvorav 141 var 75 år eller eldre.
KOLS-studiene av 6 til 12 måneders varighet var 810 pasienter behandlet med SYMBICORT 160/4.5, to inhalasjoner to ganger daglig, 65 år og eldre, og av disse var 177 pasienter 75 år eller eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse pasientene og yngre pasienter, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter.
Som med andre produkter som inneholder beta2-agonister, bør det utvises spesiell forsiktighet ved bruk av SYMBICORT hos geriatriske pasienter som har samtidig kardiovaskulær sykdom som kan påvirkes negativt av beta2-agonister.
Basert på tilgjengelige data for SYMBICORT eller dets aktive komponenter, er ingen justering av dosen av SYMBICORT 4,5mcg til geriatriske pasienter berettiget.
Nedsatt leverfunksjon
Formelle farmakokinetiske studier med SYMBICORT har ikke blitt utført hos pasienter med nedsatt leverfunksjon. Siden både budesonid og formoterolfumarat hovedsakelig elimineres av levermetabolisme, kan imidlertid nedsatt leverfunksjon føre til akkumulering av budesonid og formoterolfumarat i plasma. Pasienter med leversykdom bør derfor overvåkes nøye.
Nedsatt nyrefunksjon
Formelle farmakokinetiske studier med SYMBICORT har ikke blitt utført hos pasienter med nedsatt nyrefunksjon.
OVERDOSE
SYMBICORT
SYMBICORT inneholder både budesonid og formoterol; derfor gjelder risikoen forbundet med overdosering for de individuelle komponentene beskrevet nedenfor for SYMBICORT. I farmakokinetiske studier ble enkeltdoser på 960/54 mcg (12 aktiveringer av SYMBICORT 80/4,5) og 1280/36 mcg (8 aktiveringer på 160/4,5) administrert til pasienter med KOLS. Totalt 1920/54 mcg (12 aktiveringer av SYMBICORT 160/4,5) ble administrert som en enkeltdose til både friske forsøkspersoner og pasienter med astma. I en langsiktig aktiv-kontrollert sikkerhetsstudie hos ungdom og voksne astmapasienter 12 år og eldre, ble SYMBICORT 160/4.5 administrert i opptil 12 måneder i doser opptil to ganger den høyeste anbefalte daglige dosen. Det ble ikke observert noen klinisk signifikante bivirkninger i noen av disse studiene.
Budesonid
Potensialet for akutte toksiske effekter etter overdosering av budesonid er lavt. Ved bruk i for høye doser over lengre perioder, kan systemiske kortikosteroideffekter som hyperkortisisme oppstå [se ADVARSLER OG FORHOLDSREGLER ]. Budesonid ved fem ganger den høyeste anbefalte dosen (3200 mcg daglig) administrert til mennesker i 6 uker forårsaket en signifikant reduksjon (27 %) i plasmakortisolresponsen på en 6-timers infusjon av ACTH sammenlignet med placebo (+1 %). Den tilsvarende effekten av 10 mg prednison daglig var en 35 % reduksjon i plasmakortisolresponsen på ACTH.
Formoterol
En overdose av formoterol vil sannsynligvis føre til en overdrivelse av effekter som er typiske for beta2-agonister: anfall, angina, hypertensjon, hypotensjon, takykardi, atrielle og ventrikulære takykardier, nervøsitet, hodepine, skjelving, hjertebank, muskelkramper, kvalme, svimmelhet, svimmelhet. , metabolsk acidose, hyperglykemi, hypokalemi. Som med alle sympatomimetiske medisiner, kan hjertestans og til og med død være assosiert med misbruk av formoterol. Ingen klinisk signifikante bivirkninger ble sett når formoterol ble gitt til voksne pasienter med akutt bronkokonstriksjon i en dose på 90 mcg/dag over 3 timer eller til stabile astmatikere 3 ganger daglig med en total dose på 54 mcg/dag i 3 dager.
Behandling av formoteroloverdosering består av seponering av medisinen sammen med innføring av passende symptomatisk og/eller støttende behandling. En fornuftig bruk av en kardioselektiv beta-reseptorblokker kan vurderes, med tanke på at slik medisin kan gi bronkospasme. Det er utilstrekkelig bevis for å avgjøre om dialyse er gunstig for overdosering av formoterol. Hjerteovervåking anbefales i tilfeller av overdosering.
KONTRAINDIKASJONER
Bruk av SYMBICORT er kontraindisert under følgende forhold:
- . Primærbehandling av status asthmaticus eller andre akutte episoder med astma eller KOLS der intensive tiltak er påkrevd. . Overfølsomhet overfor noen av innholdsstoffene i SYMBICORT.
KLINISK FARMAKOLOGI
Virkningsmekanismen
SYMBICORT
SYMBICORT inneholder både budesonid og formoterol; derfor gjelder virkningsmekanismene beskrevet nedenfor for de enkelte komponentene for SYMBICORT. Disse medikamentene representerer to klasser av medisiner (et syntetisk kortikosteroid og en langtidsvirkende selektiv beta2-adrenoceptoragonist) som har forskjellige effekter på kliniske, fysiologiske og inflammatoriske indekser av KOLS og astma.
Budesonid
Budesonid er et anti-inflammatorisk kortikosteroid som viser kraftig glukokortikoid aktivitet og svak mineralokortikoid aktivitet. I standard in vitro- og dyremodeller har budesonid omtrent 200 ganger høyere affinitet for glukokortikoidreseptoren og en 1000 ganger høyere topisk anti-inflammatorisk styrke enn kortisol (rottekrotonolje øreødemanalyse). Som et mål på systemisk aktivitet er budesonid 40 ganger kraftigere enn kortisol når det administreres subkutant og 25 ganger kraftigere når det administreres oralt i rottethymus-involusjonsanalysen.
glukokortikoidreseptoraffinitetsstudier var 22R-formen av budesonid to ganger så aktiv som 22S-epimeren. In vitro-studier indikerte at de to formene for budesonid ikke konverterer hverandre.
Betennelse er en viktig komponent i patogenesen av KOLS og astma. Kortikosteroider har et bredt spekter av hemmende aktiviteter mot flere celletyper (f.eks. mastceller, eosinofiler, nøytrofiler, makrofager og lymfocytter) og mediatorer (f.eks. histamin, eikosanoider, leukotriener og cytokiner) involvert i allergisk og ikke-allergisk-mediert betennelse. Disse antiinflammatoriske virkningene til kortikosteroider kan bidra til deres effekt ved KOLS og astma.
Studier på astmatiske pasienter har vist et gunstig forhold mellom lokal antiinflammatorisk aktivitet og systemiske kortikosteroideffekter over et bredt spekter av doser av budesonid. Dette forklares med en kombinasjon av en relativt høy lokal anti-inflammatorisk effekt, omfattende førstegangslevernedbrytning av oralt absorbert legemiddel (85%-95%) og lav styrke av dannede metabolitter.
Formoterol
Formoterolfumarat er en langtidsvirkende selektiv beta2-adrenerg agonist (beta2-agonist) med raskt innsettende virkning. Inhalert formoterolfumarat virker lokalt i lungen som en bronkodilatator. In vitro-studier har vist at formoterol har mer enn 200 ganger større agonistaktivitet ved beta2-reseptorer enn ved beta1-reseptorer. In vitro-bindingsselektiviteten til beta2-over beta1-adrenoreseptorer er høyere for formoterol enn for albuterol (5 ganger), mens salmeterol har et høyere (3 ganger) beta2-selektivitetsforhold enn formoterol.
Selv om beta2-reseptorer er de dominerende adrenerge reseptorene i glatt muskulatur i bronkiene og beta1-reseptorer er de dominerende reseptorene i hjertet, er det også beta2-reseptorer i det menneskelige hjertet som utgjør 10 % til 50 % av de totale beta-adrenerge reseptorene. Den nøyaktige funksjonen til disse reseptorene er ikke fastslått, men de øker muligheten for at selv svært selektive beta2-agonister kan ha hjerteeffekter.
De farmakologiske effektene av beta2-adrenoreseptoragonistmedisiner, inkludert formoterol, kan i det minste delvis tilskrives stimulering av intracellulær adenylcyklase, enzymet som katalyserer omdannelsen av adenosintrifosfat (ATP) til syklisk-3', 5'-adenosinmonofosfat ( syklisk AMP). Økte sykliske AMP-nivåer forårsaker avslapning av bronkial glatt muskulatur og hemming av frigjøring av mediatorer av umiddelbar overfølsomhet fra celler, spesielt fra mastceller.
In vitro-tester viser at formoterol er en hemmer av frigjøring av mastcellemediatorer, som histamin og leukotriener, fra menneskelungene. Formoterol hemmer også histaminindusert plasmaalbumin-ekstravasasjon hos bedøvede marsvin og hemmer allergenindusert eosinofiltilstrømning hos hunder med hyperrespons i luftveiene. Relevansen av disse in vitro- og dyrefunnene for mennesker er ukjent.
Farmakodynamikk
Astma
Kardiovaskulære effekter
en enkeltdose-cross-over-studie som involverte 201 pasienter med vedvarende astma, ble enkeltdosebehandlinger på 4,5, 9 og 18 mcg formoterol i kombinasjon med 320 mcg budesonid levert via SYMBICORT sammenlignet med budesonid 320 mcg alene. Doseordnede forbedringer i FEV1 ble vist sammenlignet med budesonid. EKG og blodprøver for glukose og kalium ble tatt etter dosering. For SYMBICORT 4,5 mcg ble små gjennomsnittlige økninger i serumglukose og reduksjoner i serumkalium (henholdsvis +0,44 mmol/L og -0,18 mmol/L ved høyeste dose) observert med økende doser formoterol sammenlignet med budesonid. I EKG ga SYMBICORT små doserelaterte gjennomsnittsøkninger i hjertefrekvens (ca. 3 slag/min ved høyeste dose) og QTc-intervaller (3-6 msek) sammenlignet med budesonid alene. Ingen forsøkspersoner hadde en QT- eller QTc-verdi ≥500 msek.
USA evaluerte fem 12-ukers, aktive og placebokontrollerte studier og en 6-måneders aktiv-kontrollert studie 2976 pasienter i alderen 6 år og eldre med astma. Systemiske farmakodynamiske effekter av formoterol (hjerte/puls, blodtrykk, QTc-intervall, kalium og glukose) var lik hos pasienter behandlet med SYMBICORT, sammenlignet med pasienter behandlet med formoterol tørt inhalasjonspulver 4,5 mcg, 2 inhalasjoner to ganger daglig. Ingen pasienter hadde en QT- eller QTc-verdi ≥500 msek under behandlingen.
I tre placebokontrollerte studier på ungdom og voksne med astma, i alderen 12 år og eldre, hadde totalt 1232 pasienter (553 pasienter i SYMBICORT 160 mg-gruppen) evaluerbar kontinuerlig 24-timers elektrokardiografisk overvåking. Totalt sett var det ingen viktige forskjeller i forekomsten av ventrikulær eller supraventrikulær ektopi og ingen bevis for økt risiko for klinisk signifikant dysrytmi i SYMBICORT 160 mg-gruppen sammenlignet med placebo.
HPA-akseeffekter
Totalt sett ble det ikke observert noen klinisk viktige effekter på HPA-aksen, målt ved 24-timers urinkortisol, for SYMBICORT-behandlede voksne eller ungdomspasienter ved doser på opptil 640/18 mikrogram/dag sammenlignet med budesonid.
Kronisk obstruktiv lungesykdom
Kardiovaskulære effekter
I to KOLS-lungefunksjonsstudier, 6 måneder og 12 måneder med varighet inkludert 3668 KOLS-pasienter, ble det ikke sett noen klinisk viktige forskjeller i pulsfrekvens, blodtrykk, kalium og glukose mellom SYMBICORT, de individuelle komponentene i SYMBICORT 160mg og placebo [se Kliniske studier ].
EKG registrert ved flere klinikkbesøk på behandling i begge studiene viste ingen klinisk viktige forskjeller for hjertefrekvens, PR-intervall, QRS-varighet, hjertefrekvens, tegn på hjerteiskemi eller arytmier mellom SYMBICORT 160/4.5 monoproduktene og placebo, alle administrert som 2 inhalasjoner to ganger daglig. Basert på EKG, opplevde 6 pasienter behandlet med SYMBICORT 160/4.5, 6 pasienter behandlet med formoterol 4,5 mcg og 6 pasienter i placebogruppen atrieflimmer eller flutter som ikke var tilstede ved baseline. Det var ingen tilfeller av ikke-vedvarende ventrikkeltakykardi i gruppene SYMBICORT 160/4,5, formoterol 4,5 mcg eller placebo.
den 12 måneder lange studien hadde 520 pasienter evaluerbar kontinuerlig 24-timers EKG (Holter) overvåking før den første dosen og etter ca. 1 og 4 måneder i behandling. Ingen klinisk viktige forskjeller i ventrikulære eller supraventrikulære arytmier, ventrikulære eller supraventrikulære ektopiske slag eller hjertefrekvens ble observert blant gruppene behandlet med SYMBICORT 160/4.5, formoterol eller placebo tatt som 2 inhalasjoner to ganger daglig. Basert på EKG (Holter)-overvåking, opplevde en pasient på SYMBICORT 160/4,5, ingen pasienter på formoterol 4,5 mcg og tre pasienter i placebogruppen atrieflimmer eller flutter som ikke var tilstede ved baseline.
HPA-akse effekter
Tjuefire timers urinkortisolmålinger ble samlet inn i en samlet undergruppe (n=616) av pasienter fra to KOLS-lungefunksjonsstudier. Dataene indikerte omtrent 30 % lavere gjennomsnittlige 24-timers urinfri kortisolverdier etter kronisk administrering (> 6 måneder) av SYMBICORT sammenlignet med placebo. SYMBICORT 4,5 mcg så ut til å vise sammenlignbar kortisolundertrykkelse med budesonid 160 mcg alene eller samtidig administrering av budesonid 160 mcg og formoterol 4,5 mcg. For pasienter behandlet med SYMBICORT 160 mg eller placebo i opptil 12 måneder, var prosentandelen av pasienter som skiftet fra normal til lav for dette tiltaket generelt sammenlignbar.
Andre Budesonide-produkter
For å bekrefte at systemisk absorpsjon ikke er en signifikant faktor i den kliniske effekten av inhalert budesonid, ble det utført en klinisk studie på pasienter med astma som sammenlignet 400 mcg budesonid administrert via en trykkmålt doseinhalator med et røravstandsstykke med 1400 mcg oralt budesonid og placebo . Studien viste effekten av inhalert budesonid, men ikke oralt inntatt budesonid, til tross for sammenlignbare systemiske nivåer. Således er den terapeutiske effekten av konvensjonelle doser av oralt inhalert budesonid i stor grad forklart av dens direkte virkning på luftveiene.
Inhalert budesonid har vist seg å redusere luftveisreaktiviteten til ulike utfordringsmodeller, inkludert histamin, metakolin, natriummetabisulfitt og adenosinmonofosfat hos pasienter med hyperreaktive luftveier. Den kliniske relevansen til disse modellene er ikke sikker.
Forbehandling med inhalert budesonid, 1600 mcg daglig (800 mcg to ganger daglig) i 2 uker reduserte den akutte (tidligfasereaksjonen) og forsinkede (senfasereaksjonen) reduksjonen i FEV1 etter inhalert allergenutfordring.
De systemiske effektene av inhalerte kortikosteroider er relatert til systemisk eksponering for slike legemidler. Farmakokinetiske studier har vist at hos både voksne og barn med astma er den systemiske eksponeringen for budesonid lavere med SYMBICORT 160mg sammenlignet med inhalert budesonid administrert i samme leverte dose via en tørrpulverinhalator [se KLINISK FARMAKOLOGI ]. Derfor vil de systemiske effektene (HPA-aksen og vekst) av budesonid levert fra SYMBICORT ikke forventes å være større enn det som er rapportert for inhalert budesonid når det administreres i sammenlignbare doser via tørrpulverinhalatoren [se Bruk i spesifikke populasjoner ].
HPA-akseeffekter
Effekten av inhalert budesonid administrert via en tørrpulverinhalator på HPA-aksen ble studert hos 905 voksne og 404 pediatriske pasienter med astma. For de fleste pasienter forble evnen til å øke kortisolproduksjonen som respons på stress, vurdert ved cosyntropin (ACTH) stimuleringstest, intakt med budesonidbehandling ved anbefalte doser. For voksne pasienter behandlet med 100, 200, 400 eller 800 mcg to ganger daglig i 12 uker, hadde henholdsvis 4 %, 2 %, 6 % og 13 % en unormal stimulert kortisolrespons (toppkortisol
Andre Formoterol-produkter
Mens den farmakodynamiske effekten er via stimulering av beta-adrenerge reseptorer, fører overdreven aktivering av disse reseptorene vanligvis til skjelettmuskelskjelvinger og kramper, søvnløshet, takykardi, reduksjon i plasmakalium og økning i plasmaglukose. Inhalert formoterol, som andre beta2-adrenerge agonister, kan gi doserelaterte kardiovaskulære effekter og effekter på blodsukker og/eller serumkalium [se ADVARSLER OG FORHOLDSREGLER ]. For SYMBICORT 160mg er disse effektene beskrevet i avsnittet Klinisk farmakologi, farmakodynamikk, SYMBICORT (12.2).
Bruk av LABA-medisiner kan resultere i toleranse for bronkobeskyttende og bronkodilaterende effekter.
Rebound bronkial hyperrespons etter seponering av kronisk langtidsvirkende beta-agonistbehandling er ikke observert.
Farmakokinetikk
SYMBICORT
Absorpsjon
Budesonid
Sunne fag
Oralt inhalert budesonid absorberes raskt i lungene og maksimal konsentrasjon nås vanligvis innen 20 minutter. Etter oral administrering av budesonid ble maksimal plasmakonsentrasjon oppnådd i løpet av ca. 1 til 2 timer, og den absolutte systemiske tilgjengeligheten var 6 %-13 % på grunn av omfattende førstegangsmetabolisme. I motsetning til dette ble det meste av budesonidet levert til lungene systemisk absorbert. Hos friske forsøkspersoner ble 34 % av den oppmålte dosen avsatt i lungen (som vurdert ved hjelp av plasmakonsentrasjonsmetoden og ved bruk av en budesonidholdig tørrpulverinhalator) med en absolutt systemisk tilgjengelighet på 39 % av den oppmålte dosen.
Etter administrering av SYMBICORT 160/4.5, to eller fire inhalasjoner to ganger daglig i 5 dager hos friske personer, økte plasmakonsentrasjonen av budesonid generelt i forhold til dosen. Akkumuleringsindeksen for gruppen som fikk 2 inhalasjoner to ganger daglig var 1,32 for budesonid.
Astmapasienter
en enkeltdosestudie ble høyere enn anbefalte doser av SYMBICORT (12 inhalasjoner av SYMBICORT 160/4,5) administrert til pasienter med moderat astma. Maksimal plasmakonsentrasjon av budesonid på 4,5 nmol/L oppstod 20 minutter etter dosering. Denne studien viste at den totale systemiske eksponeringen for budesonid fra SYMBICORT 4,5 mcg var omtrent 30 % lavere enn fra inhalert budesonid via en tørrpulverinhalator (DPI) ved samme leverte dose. Etter administrering av SYMBICORT var halveringstiden for budesonidkomponenten 4,7 timer.
en studie med gjentatt dose ble den høyeste anbefalte dosen av SYMBICORT (160/4,5, to inhalasjoner to ganger daglig) administrert til pasienter med moderat astma og friske personer i 1 uke. Maksimal budesonidplasmakonsentrasjon på 1,2 nmol/L oppstod etter 21 minutter hos astmapasienter. Maksimal plasmakonsentrasjon av budesonid var 27 % lavere hos astmapasienter sammenlignet med hos friske personer. Den totale systemiske eksponeringen av budesonid var imidlertid sammenlignbar med den hos astmapasienter.
Maksimal steady-state plasmakonsentrasjon av budesonid administrert av DPI hos voksne med astma var i gjennomsnitt 0,6 og 1,6 nmol/L ved doser på henholdsvis 180 mcg og 360 mcg to ganger daglig. Hos astmatiske pasienter viste budesonid en lineær økning i AUC og Cmax med økende dose etter både enkelt- og gjentatt dosering av inhalert budesonid.
KOLS-pasienter
en enkeltdosestudie ble 12 inhalasjoner av SYMBICORT 80/4,5 (total dose 960/54 mcg) administrert til pasienter med KOLS. Gjennomsnittlig maksimal plasmakonsentrasjon av budesonid på 3,3 nmol/L forekom 30 minutter etter dosering. Systemisk eksponering for budesonid var sammenlignbar mellom SYMBICORT pMDI og samtidig administrering av budesonid via en doseinhalator og formoterol via en tørrpulverinhalator (budesonid 960 mcg og formoterol 54 mcg). I samme studie fikk også en åpen gruppe med moderat astmapasienter samme høyere dose SYMBICORT. For budesonid viste KOLS-pasienter 12 % høyere AUC og 10 % lavere Cmax sammenlignet med astmapasienter.
den 6-måneders pivotale kliniske lungefunksjonsstudien ble steady-state farmakokinetiske data for budesonid innhentet i en undergruppe av KOLS-pasienter med behandlingsarmer av SYMBICORT 4,5 mcg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5 m, budesonid 160 mcg, budeson 160 mcg og formoterol 4,5 mcg gitt sammen, alle administrert som 2 inhalasjoner to ganger daglig. Systemisk budesonideksponering (AUC og Cmax) økte proporsjonalt med doser fra 80 mcg til 160 mcg og var generelt lik mellom de 3 behandlingsgruppene som fikk samme dose budesonid (SYMBICORT 4,5 mcg pMDI 160/4,5, budesonid 160 mcg og 16 budesonid formoterol 4,5 mcg administrert sammen).
Formoterol
Inhalert formoterol absorberes raskt; maksimale plasmakonsentrasjoner nås vanligvis ved første plasmaprøvetaking, innen 5-10 minutter etter dosering. Som med mange legemidler for oral inhalasjon, er det sannsynlig at størstedelen av den inhalerte formoterolen som leveres, svelges og deretter absorberes fra mage-tarmkanalen.
Sunne fag
Etter administrering av SYMBICORT (160/4,5, to eller fire inhalasjoner to ganger daglig) i 5 dager hos friske personer, økte plasmakonsentrasjonen av formoterol generelt i forhold til dosen. Akkumuleringsindeksen for gruppen som fikk 2 inhalasjoner to ganger daglig var 1,77 for formoterol.
Astmapasienter
I en enkeltdosestudie ble høyere enn anbefalte doser av SYMBICORT (12 inhalasjoner av SYMBICORT 160/4,5) administrert til pasienter med moderat astma. Maksimal plasmakonsentrasjon for formoterol på 136 pmol oppstod 10 minutter etter dosering. Omtrent 8 % av den leverte dosen av formoterol ble gjenvunnet i urinen som uendret medikament.
en studie med gjentatt dose ble den høyeste anbefalte dosen av SYMBICORT (160/4,5, to inhalasjoner to ganger daglig) administrert til pasienter med moderat astma og friske personer i 1 uke. Maksimal formoterolplasmakonsentrasjon på 28 pmol/L oppstod etter 10 minutter hos astmapasienter. Maksimal plasmakonsentrasjon av formoterol var omtrent 42 % lavere hos astmapasienter sammenlignet med friske personer. Imidlertid var den totale systemiske eksponeringen av formoterol sammenlignbar med den hos astmapasienter.
KOLS-pasienter
Etter enkeltdoseadministrasjon av 12 inhalasjoner av SYMBICORT 80/4.5, ble gjennomsnittlig maksimal plasmakonsentrasjon for formoterol på 167 pmol/L raskt oppnådd 15 minutter etter dosering. Formoteroleksponeringen var litt større (~16-18 %) fra SYMBICORT 160 mg pMDI sammenlignet med samtidig administrering av budesonid via en doseinhalator og formoterol via en tørrpulverinhalator (total dose budesonid 960 mcg og formoterol 54 mcg). I den samme studien fikk en åpen gruppe av pasienter med moderat astma samme dose SYMBICORT. KOLS-pasienter viste 12-15 % høyere AUC og Cmax for formoterol sammenlignet med astmapasienter.
den 6-måneders pivotale kliniske lungefunksjonsstudien ble steady-state farmakokinetiske data for formoterol oppnådd i en undergruppe av KOLS-pasienter med behandlingsarmer av SYMBICORT 160 mg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, for. mcg og formoterol 4,5 mcg gitt sammen, alle administrert som 2 inhalasjoner to ganger daglig. Den systemiske eksponeringen av formoterol, som påvist av AUC, var omtrent 30 % og 16 % høyere fra SYMBICORT pMDI sammenlignet med formoterol alene behandlingsarm og samtidig administrering av individuelle komponenter av budesonid og formoterol behandlingsarm, henholdsvis.
Fordeling
Budesonid
Distribusjonsvolumet av budesonid var ca. 3 l/kg. Det var 85 %-90 % bundet til plasmaproteiner. Proteinbindingen var konstant over konsentrasjonsområdet (1-100 nmol/L) oppnådd med, og overskredet, anbefalte inhalerte doser. Budesonid viste liten eller ingen binding til kortikosteroidbindende globulin. Budesonid kom raskt i likevekt med røde blodceller på en konsentrasjonsuavhengig måte med et blodplasmaforhold på ca. 0,8.
Formoterol
Over konsentrasjonsområdet 10-500 nmol/L var plasmaproteinbindingen for RR- og SS-enantiomerene av formoterol henholdsvis 46 % og 58 %. Konsentrasjonene av formoterol som ble brukt til å vurdere plasmaproteinbindingen var høyere enn de som ble oppnådd i plasma etter inhalasjon av en enkeltdose på 54 mcg.
Metabolisme
Budesonid
In vitro-studier med humane leverhomogenater har vist at budesonid ble raskt og omfattende metabolisert. To hovedmetabolitter dannet via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4) katalysert biotransformasjon har blitt isolert og identifisert som 16α-hydroksyprednisolon og 6ß-hydroksybudesonid. Kortikosteroidaktiviteten til hver av disse to metabolittene var mindre enn 1 % av den til moderforbindelsen. Ingen kvalitative forskjeller mellom in vitro og in vivo metabolske mønstre ble påvist. Ubetydelig metabolsk inaktivering ble observert i humane lunge- og serumpreparater.
Formoterol
Den primære metabolismen av formoterol er ved direkte glukuronidering og ved O-demetylering etterfulgt av konjugering til inaktive metabolitter. Sekundære metabolske veier inkluderer deformylering og sulfatkonjugering. CYP2D6 og CYP2C har blitt identifisert som hovedansvarlige for Odemetylering.
Eliminering
Budesonid
Budesonid ble skilt ut i urin og avføring i form av metabolitter. Omtrent 60 % av en intravenøs radiomerket dose ble gjenfunnet i urinen.
Det ble ikke påvist uforandret budesonid i urinen. 22R-formen av budesonid ble fortrinnsvis eliminert av leveren med systemisk clearance på 1,4 l/min vs. 1,0 l/min for 22S-formen. Den terminale halveringstiden, 2 til 3 timer, var den samme for begge epimerene og var uavhengig av dose.
Formoterol
Utskillelsen av formoterol ble undersøkt hos fire friske forsøkspersoner etter samtidig administrering av radiomerket formoterol oralt og intravenøst. I den studien ble 62 % av radiomerket formoterol skilt ut i urinen mens 24 % ble eliminert i feces.
Spesielle populasjoner
Geriatrisk
Farmakokinetikken til SYMBICORT 4,5 mcg hos geriatriske pasienter har ikke blitt spesifikt studert.
Pediatrisk
Plasmakonsentrasjoner av budesonid ble målt etter administrering av fire inhalasjoner av SYMBICORT 160/4.5 i en enkeltdosestudie hos pediatriske pasienter med astma, 6 til under 12 år. Maksimal budesonidkonsentrasjon på 1,4 nmol/L forekom 20 minutter etter dosering. Denne studien viste også at den totale systemiske eksponeringen for budesonid fra SYMBICORT 4,5 mcg var omtrent 30 % lavere enn fra inhalert budesonid via en tørrpulverinhalator som også ble evaluert ved den samme leverte dosen. Den dosenormaliserte Cmax og AUC0-inf for budesonid etter enkeltdoseinhalasjon hos barn 6 til under 12 år var numerisk lavere enn det som ble observert hos voksne.
Etter 2 inhalasjoner av SYMBICORT 160/4,5 to ganger daglig behandling, var formoterol Cmax og AUC0-6 ved steady state hos barn 6 til under 12 år sammenlignbare med det som ble observert hos voksne.
Kjønn/rase
Spesifikke studier for å undersøke effekten av kjønn og rase på farmakokinetikken til SYMBICORT er ikke utført. Populasjons-PK-analyse av SYMBICORT 4,5 mcg-data indikerer at kjønn ikke påvirker farmakokinetikken til budesonid og formoterol. Ingen konklusjoner kan trekkes på effekten av rase på grunn av det lave antallet ikke-kaukasiere evaluert for PK.
Ammende mødre
Disponeringen av budesonid ved inhalering fra en tørrpulverinhalator i doser på 200 eller 400 mcg to ganger daglig i minst 3 måneder ble studert hos åtte ammende kvinner med astma fra 1 til 6 måneder etter fødselen. Systemisk eksponering for budesonid hos disse kvinnene ser ut til å være sammenlignbar med den hos ikke-ammende kvinner med astma fra andre studier. Morsmelk oppnådd i løpet av åtte timer etter dosering avslørte at den maksimale konsentrasjonen av budesonid for de totale daglige dosene på 400 og 800 mikrogram var henholdsvis 0,39 og 0,78 nmol/L og inntraff innen 45 minutter etter dosering. Den estimerte orale daglige dosen av budesonid fra morsmelk til spedbarnet er omtrent 0,007 og 0,014 mikrogram/kg/dag for de to doseregimene som ble brukt i denne studien, som representerer omtrent 0,3 % til 1 % av dosen inhalert av moren. Budesonidnivåer i plasmaprøver oppnådd fra fem spedbarn ca. 90 minutter etter amming (og ca. 140 minutter etter legemiddeladministrering til moren) var under kvantifiserbare nivåer ( Bruk i spesifikke populasjoner ].
Nyre- eller leverinsuffisiens
Det finnes ingen data vedrørende spesifikk bruk av SYMBICORT hos pasienter med nedsatt lever- eller nyrefunksjon. Redusert leverfunksjon kan påvirke eliminasjonen av kortikosteroider. Budesonids farmakokinetikk ble påvirket av kompromittert leverfunksjon, noe som fremgår av en doblet systemisk tilgjengelighet etter oralt inntak. Den intravenøse farmakokinetikken av budesonid var imidlertid lik hos cirrhotiske pasienter og hos friske personer. Spesifikke data for formoterol er ikke tilgjengelig, men fordi formoterol primært elimineres via levermetabolisme, kan en økt eksponering forventes hos pasienter med alvorlig nedsatt leverfunksjon.
Legemiddel-legemiddelinteraksjoner
En enkeltdose-crossover-studie ble utført for å sammenligne farmakokinetikken til åtte inhalasjoner av følgende: budesonid, formoterol og budesonid pluss formoterol administrert samtidig. Resultatene av studien indikerte at det ikke var bevis for en farmakokinetisk interaksjon mellom de to komponentene i SYMBICORT.
Hemmere av cytokrom P450 enzymer
Ketokonazol
Ketokonazol, en sterk hemmer av cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4), det viktigste metabolske enzymet for kortikosteroider, økte plasmanivåer av oralt inntatt budesonid.
Cimetidin
Ved anbefalte doser hadde cimetidin, en ikke-spesifikk hemmer av CYP-enzymer, en liten, men klinisk ubetydelig effekt på farmakokinetikken til oral budesonid.
Spesifikke legemiddelinteraksjonsstudier med formoterol er ikke utført.
Dyretoksikologi og/eller farmakologi
Preklinisk
Studier på laboratoriedyr (minigriser, gnagere og hunder) har vist forekomst av hjertearytmier og plutselig død (med histologiske tegn på myokardnekrose) når beta-agonister og metylxantiner administreres samtidig. Den kliniske betydningen av disse funnene er ukjent.
Kliniske studier
Astma
Pasienter med astma 12 år og eldre
to kliniske studier som sammenlignet SYMBICORT 4,5 mcg med de individuelle komponentene, var forbedringer i de fleste effektendepunktene større med SYMBICORT enn med bruk av enten budesonid eller formoterol alene. I tillegg viste en klinisk studie lignende resultater mellom SYMBICORT og samtidig bruk av budesonid og formoterol ved tilsvarende doser fra separate inhalatorer.
Sikkerheten og effekten av SYMBICORT 160 mg ble vist i to randomiserte, dobbeltblindede, placebokontrollerte amerikanske kliniske studier med 1076 pasienter 12 år og eldre. Faste SYMBICORT-doser på 160/9 mcg og 320/9 mcg to ganger daglig (hver dose administrert som 2 inhalasjoner av henholdsvis 80/4,5 og 160/4,5 mcg styrker) ble sammenlignet med monokomponentene (budesonid og formoterol) og placebo-toerol. gi informasjon om passende dosering for å dekke en rekke astmaalvorlighetsgrader.
Studie 1: Klinisk studie med SYMBICORT 160/4.5
Denne 12-ukers studien evaluerte 596 pasienter 12 år og eldre ved å sammenligne SYMBICORT 160/4.5, den frie kombinasjonen av budesonid 160 mcg pluss formoterol 4,5 mcg i separate inhalatorer, budesonid 160 mcg, formoterol 4,5 mcg og placebo; hver administrert som 2 inhalasjoner to ganger daglig. Studien inkluderte en 2-ukers innkjøringsperiode med budesonid 80 mcg, 2 inhalasjoner to ganger daglig. De fleste pasientene hadde moderat til alvorlig astma og brukte moderate til høye doser inhalerte kortikosteroider før studiestart. Randomisering ble stratifisert av tidligere inhalert kortikosteroidbehandling (71,6 % på moderat og 28,4 % på høydose inhalert kortikosteroid). Gjennomsnittlig prosent spådd FEV1 ved baseline var 68,1 % og var lik på tvers av behandlingsgruppene. De co-primære effektendepunktene var 12-timers gjennomsnittlig post-dose FEV1 ved uke 2, og pre-dose FEV1 gjennomsnitt i løpet av studien. Studien krevde også at pasienter som tilfredsstilte et forhåndsdefinert astmaforverrende kriterium ble trukket tilbake. De forhåndsdefinerte kriteriene for astmaforverring var en klinisk viktig reduksjon i FEV1 eller PEF, økning i bruk av redningsalbuterol, nattlig oppvåkning på grunn av astma, akuttintervensjon eller sykehusinnleggelse på grunn av astma, eller krav om astmamedisinering som ikke er tillatt i protokollen. For kriteriet nattlig oppvåkning på grunn av astma, fikk pasienter forbli i studien etter utrederens skjønn dersom ingen av de andre astmaforverrende kriteriene var oppfylt. Prosentandelen av pasienter som trekker seg på grunn av eller oppfyller forhåndsdefinerte kriterier for forverret astma, er vist i tabell 4.
Gjennomsnittlig prosentvis endring fra baseline i FEV1 målt rett før dosering (førdose) over 12 uker er vist i figur 1. Fordi denne studien brukte forhåndsdefinerte abstinenskriterier for forverring av astma, som forårsaket en differensiell abstinensrate i behandlingsgruppene, ble pre- dose FEV1-resultater ved siste tilgjengelige studiebesøk (slutt på behandling, EOT) er også gitt. Pasienter som fikk SYMBICORT 160/4,5 hadde signifikant større gjennomsnittlig forbedring fra baseline i førdose FEV1 ved slutten av behandlingen (0,19 l, 9,4 %), sammenlignet med budesonid 160 mcg (0,10 l, 4,9 %), formoterol 4,5 mcg (-0. L, -4,8%) og placebo (-0,17 L, -6,9%).
Figur 1: Gjennomsnittlig prosentvis endring fra baseline i FEV1 før dose over 12 uker (studie 1)
PASIENTINFORMASJON
SYMBICORT (SIM-bi-kort) (budesonid 80 mcg og formoterolfumarat dihydrat 4,5 mcg) Innånding Aerosol
SYMBICORT (SIM-bi-kort) (budesonid 160 mcg og formoterolfumaratdihydrat 4,5 mcg) Innånding Aerosol
Hva er SYMBICORT?
SYMBICORT kombinerer et inhalert kortikosteroidmedisin (ICS), budesonid og en langtidsvirkende beta2-adrenerg agonist (LABA), formoterol.
- . Inhalerte kortikosteroider bidrar til å redusere betennelse i lungene. Betennelse i lungene kan føre til pusteproblemer. . LABA-medisiner brukes til personer med kronisk obstruktiv lungesykdom (KOLS) og astma. LABA-medisiner hjelper musklene rundt luftveiene i lungene til å holde seg avslappet for å forhindre symptomer som tungpustethet, hoste, tetthet i brystet og kortpustethet. Disse symptomene kan oppstå når musklene rundt luftveiene strammer seg. Dette gjør det vanskelig å puste. I alvorlige tilfeller kan hvesing stoppe pusten din og kan føre til døden hvis den ikke behandles med en gang.
SYMBICORT 4,5mcg brukes ikke til å lindre plutselige pusteproblemer og vil ikke erstatte en redningsinhalator. SYMBICORT brukes ved astma og KOLS som følger:
- . Astma: SYMBICORT brukes til å kontrollere symptomer på astma, og forebygge symptomer som hvesing hos voksne og barn i alderen 6 år og eldre. SYMBICORT 4,5mcg inneholder formoterol. LABA-medisiner som formoterol når de brukes alene øker risikoen for død og sykehusinnleggelser av astmaproblemer. SYMBICORT inneholder en ICS og en LABA. Når en ICS og LABA brukes sammen, er det ikke en signifikant økt risiko ved sykehusinnleggelser og død av astmaproblemer. SYMBICORT 160mg er ikke for voksne og barn med astma som er godt kontrollert med et astmakontrollmiddel, for eksempel en lav til middels dose av en ICS. SYMBICORT 160mg er for voksne og barn med astma som trenger både en ICS- og LABA-medisin. Det er ikke kjent om SYMBICORT er trygt og effektivt hos barn under 6 år med astma. . KOLS: KOLS er en langvarig (kronisk) lungesykdom som inkluderer kronisk bronkitt, emfysem eller begge deler. SYMBICORT 160/4,5 mcg brukes over lang tid, som 2 inhalasjoner 2 ganger hver dag, for å forbedre symptomene på KOLS for bedre pust og for å redusere antall oppbluss (forverring av KOLS-symptomene dine i flere dager).
Ikke bruk SYMBICORT:
- . for å behandle plutselige alvorlige symptomer på astma eller KOLS. . dersom du er allergisk mot noen av innholdsstoffene i SYMBICORT. Se slutten av dette pakningsvedlegget for en liste over ingredienser i SYMBICORT.
Før du bruker SYMBICORT, fortell helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
- . har hjerteproblemer. . har høyt blodtrykk. . har anfall. . har problemer med skjoldbruskkjertelen. . har diabetes. . har leverproblemer. . har osteoporose. . har et immunsystemproblem. . har øyeproblemer som økt trykk i øyet, glaukom eller grå stær. . er allergisk mot noen medisiner. . har noen form for viral, bakteriell, sopp- eller parasittisk infeksjon. . er utsatt for vannkopper eller meslinger. . er gravid eller planlegger å bli gravid. Det er ikke kjent om SYMBICORT 4,5mcg kan skade det ufødte barnet ditt. . ammer. Budesonid, en av de aktive ingrediensene i SYMBICORT, går over i morsmelk. Du og helsepersonell bør bestemme om du skal ta SYMBICORT 160mg mens du ammer.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. SYMBICORT og visse andre legemidler kan interagere med hverandre. Dette kan forårsake alvorlige bivirkninger. Fortell spesielt helsepersonell dersom du tar soppdrepende eller HIV-medisiner.
Kjenn alle medisinene du tar. Hold en liste og vis den til helsepersonell og apotek hver gang du får en ny medisin.
Hvordan bør jeg bruke SYMBICORT?
Se trinn-for-trinn-instruksjonene for bruk av SYMBICORT på slutten av dette pakningsvedlegget. Ikke bruk SYMBICORT 4,5mcg med mindre helsepersonell har lært deg det og du forstår alt. Spør helsepersonell eller apotek hvis du har spørsmål.
- . Bruk SYMBICORT nøyaktig som foreskrevet. Ikke bruk SYMBICORT 160mg oftere enn foreskrevet. SYMBICORT kommer i 2 styrker. Helsepersonell har foreskrevet styrken som er best for deg. Legg merke til forskjellene mellom SYMBICORT og dine andre inhalasjonsmedisiner, inkludert forskjellene i foreskrevet bruk og fysisk utseende. . Barn bør bruke SYMBICORT med en voksens hjelp, som instruert av barnets helsepersonell. . SYMBICORT 160mg bør tas hver dag som 2 drag om morgenen og 2 drag om kvelden med ca. 12 timers mellomrom. . Hvis du glemmer en dose SYMBICORT 160 mg, bør du ta neste dose på samme tid som du vanligvis gjør. . Skyll munnen med vann og spytt ut vannet etter hver dose (2 drag) av SYMBICORT. Ikke svelg vannet. Dette vil bidra til å redusere sjansen for å få en soppinfeksjon (trost) i munn og svelg. . Hvis du tar for mye SYMBICORT, ring legen din eller gå til nærmeste akuttmottak umiddelbart hvis du har uvanlige symptomer, som forverret kortpustethet, brystsmerter, økt hjertefrekvens eller skjelving. . Ikke spray SYMBICORT 4,5mcg i øynene. Hvis du ved et uhell får SYMBICORT 160mg i øynene, skyll øynene med vann, og hvis rødhet eller irritasjon vedvarer, kontakt helsepersonell. . Ikke endre eller stopp noen medisiner som brukes til å kontrollere eller behandle pusteproblemer. Helsepersonell vil endre medisinene dine etter behov. . Mens du bruker SYMBICORT 2 ganger hver dag, ikke bruk andre medisiner som inneholder en LABA uansett grunn. Spør helsepersonell eller apotek om noen av de andre medisinene dine er LABA-medisiner. . SYMBICORT 4,5mcg lindrer ikke plutselige symptomer. Ha alltid med deg en redningsinhalator for å behandle plutselige symptomer. Hvis du ikke har en redningsinhalator, ring helsepersonell for å få en foreskrevet for deg. . Ring helsepersonell eller få medisinsk hjelp med en gang hvis:
- . pusteproblemene dine forverres med SYMBICORT. . du må bruke redningsinhalatormedisinen oftere enn vanlig. . redningsinhalatormedisinen din virker ikke like bra for deg når det gjelder å lindre symptomene. . peak flow meter-resultatene reduseres. Helsepersonell vil fortelle deg tallene som passer for deg. . symptomene dine blir ikke bedre etter å ha brukt SYMBICORT 160mg regelmessig i 1 uke.
Hva er de mulige bivirkningene av SYMBICORT?
SYMBICORT 4,5mcg kan forårsake alvorlige bivirkninger, inkludert:
- . Bruk av for mye av en LABA-medisin kan føre til:
- . brystsmerter . økt blodtrykk . en rask og uregelmessig hjerterytme . hodepine . skjelving . nervøsitet
- . økning i slimproduksjon (sputum). . endring i slimfarge . feber . frysninger . økt hoste . økte pusteproblemer
- . feber . smerte . Smerter i kroppen . frysninger . føler seg sliten . kvalme . oppkast
- . en følelse av nåler eller nåler . influensalignende symptomer nummenhet i armer eller ben . smerte og hevelse i bihulene . utslett
De vanligste bivirkningene av SYMBICORT inkluderer:
Personer med astma:
- . irritasjon i halsen . hodepine . øvre luftveisinfeksjon . smerter i halsen . betennelse i slimhinner i bihulene . influensa (bihulebetennelse) . nesetetthet . ryggsmerte . oppkast . ubehag i magen . trøst i munn og svelg. Skyll munnen med vann uten å svelge etter bruk for å forhindre trøst
Personer med KOLS:
- . irritasjon i halsen. . trøst i munn og svelg. Skyll munnen med vann uten å svelge etter bruk for å forhindre trøst. . infeksjon og betennelse i slimhinnene i bronkiene (bronkitt). . betennelse i slimhinner i bihulene (bihulebetennelse). . øvre luftveisinfeksjon.
Fortell helsepersonell om eventuelle bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av SYMBICORT.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Du kan også rapportere bivirkninger til AstraZeneca på 1-800-236-9933.
Hvordan bør jeg oppbevare SYMBICORT?
- . Oppbevar SYMBICORT ved romtemperatur mellom 68 °F til 77 °F (20 °C til 25 °C). . Oppbevar SYMBICORT med munnstykket nede. . Innholdet i SYMBICORT-beholderen er under trykk. Ikke punkter eller kast beholderen i ild eller forbrenningsovn. Ikke bruk eller oppbevar den i nærheten av varme eller åpen ild. Oppbevaring over 120°F kan føre til at beholderen sprekker. . Kast SYMBICORT 160mg når telleren når null ("0") eller 3 måneder etter at du har tatt SYMBICORT ut av folieposen, avhengig av hva som kommer først. . Oppbevar SYMBICORT 4,5mcg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av SYMBICORT.
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i et pasientinformasjonshefte. Ikke bruk SYMBICORT 4,5mcg for en tilstand det ikke er foreskrevet for. Ikke gi SYMBICORT til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Du kan spørre helsepersonell eller apotek om informasjon om SYMBICORT 4,5mcg som er skrevet for helsepersonell.
Hva er ingrediensene i SYMBICORT 4,5mcg?
Aktive ingredienser: mikronisert budesonid og mikronisert formoterolfumaratdihydrat
Inaktive ingredienser: hydrofluoralkan (HFA 227), povidon K25 USP og polyetylenglykol 1000 NF
Instruksjoner for bruk
SYMBICORT (SIM-bi-kort)(budesonid 80 mcg og formoterolfumaratdihydrat 4,5 mcg) Innånding Aerosol
SYMBICORT (SIM-bi-kort) (budesonid 160 mcg og formoterolfumaratdihydrat 4,5 mcg) Innånding Aerosol
Figur 1  Oppreist posisjon
Oppreist posisjon
Slik bruker du SYMBICORT
Følg instruksjonene nedenfor for bruk av SYMBICORT. Du vil puste inn (inhalere) medisinen. Spør legen din eller apoteket hvis du har spørsmål.
Klargjøring av SYMBICORT-inhalatoren for bruk
. Ta SYMBICORT 4,5mcg ut av den fuktighetsbeskyttende folieposen før du bruker den for første gang og kast folien. Skriv datoen du åpner folieposen på esken. . En teller er festet til toppen av metallbeholderen. Telleren vil telle ned hver gang du slipper et drag med SYMBICORT. Pilen peker på antall inhalasjoner (puff) som er igjen i beholderen. Telleren vil slutte å telle ved null ("0"). . Bruk SYMBICORT 4,5 mcg-beholderen kun med den røde SYMBICORT-inhalatoren som følger med produktet. Deler av SYMBICORT 4,5 mcg inhalatoren skal ikke brukes med deler fra andre inhalasjonsprodukter. . Rist SYMBICORT 4,5 mcg inhalatoren godt i 5 sekunder rett før hver bruk. Fjern munnstykkedekselet ved å klemme forsiktig på begge sider, og deretter trekke ut (se figur 2). Sjekk munnstykket for fremmedlegemer før bruk. Figur 2 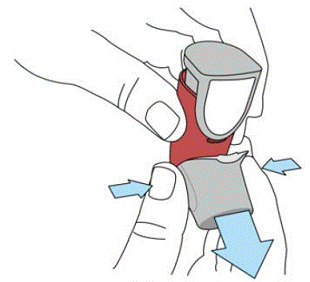
5. Fyll SYMBICORT-inhalatoren
Før du bruker SYMBICORT for første gang, må du prime den. For å prime SYMBICORT 160mg, hold den i oppreist stilling. Se figur 1. Rist SYMBICORT 4,5 mcg inhalatoren godt i 5 sekunder. Hold SYMBICORT 160mg-inhalatoren vendt bort fra deg og trykk fast og helt ned på toppen av telleren på SYMBICORT 160mg-inhalatoren for å frigjøre en testspray. Rist den deretter igjen i 5 sekunder og slipp ut en ny testspray. Din SYMBICORT 160mg inhalator er nå klargjort og klar til bruk. Etter at du har klargjort SYMBICORT-inhalatoren for første gang, vil telleren vise enten 120 eller 60, avhengig av hvilken størrelse du har fått.
Hvis du ikke bruker SYMBICORT-inhalatoren på mer enn 7 dager, eller hvis du mister den, må du fylle på nytt.
Måter å holde SYMBICORT 160mg inhalatoren på for bruk
Figur 3 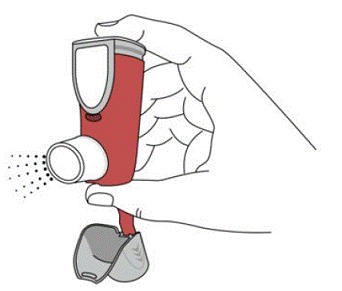
ELLER
Figur 4 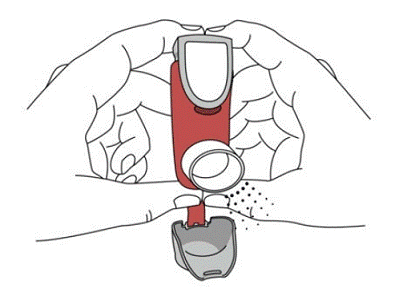
Bruke SYMBICORT-inhalatoren
6. Rist SYMBICORT 160 mg inhalatoren godt i 5 sekunder. Fjern munnstykkedekselet. Sjekk munnstykket for fremmedlegemer.
7. Pust helt ut (pust ut). Hold SYMBICORT-inhalatoren opp til munnen. Plasser det hvite munnstykket helt inn i munnen og lukk leppene rundt det. Pass på at SYMBICORT 4,5 mcg-inhalatoren står oppreist og at åpningen på munnstykket peker mot baksiden av halsen (se figur 5).
Figur 5 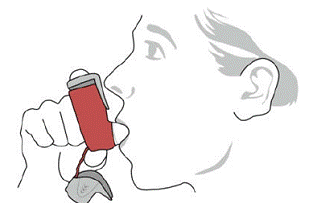
8. Pust inn (pust inn) dypt og sakte gjennom munnen. Trykk fast og helt ned på toppen av telleren på SYMBICORT-inhalatoren for å frigjøre medisinen (se figur 3 og 4).
9. Fortsett å puste inn (pust inn) og hold pusten i ca. 10 sekunder, eller så lenge det er behagelig. Før du puster ut (puster ut), slipper du fingeren fra toppen av disken. Hold SYMBICORT-inhalatoren oppreist og ta den ut av munnen.
10. Rist SYMBICORT-inhalatoren igjen i 5 sekunder og gjenta trinn 7 til 9.
Etter bruk av SYMBICORT-inhalatoren
11. Etter bruk lukker du munnstykkedekselet ved å trykke til det klikker på plass.
12. Etter at du er ferdig med å ta SYMBICORT (2 drag), skyll munnen med vann. Spytt ut vannet. Ikke svelg den.
Leser telleren
- . Pilen på telleren på toppen av SYMBICORT-inhalatoren peker på antall inhalasjoner (puff) som er igjen i inhalatoren.
DISK 
- . Telleren vil telle ned hver gang du slipper et drag med medisin (enten når du fyller SYMBICORT-inhalatoren eller når du tar medisinen). . Når pilen på telleren nærmer seg 20, vil du legge merke til begynnelsen av et gult område som forteller deg at det er på tide å ringe helsepersonell for å få påfyll.
DISK 
- . Det er viktig at du tar hensyn til antall inhalasjoner (puff) som er igjen i SYMBICORT 160mg-inhalatoren ved å lese telleren. Kast SYMBICORT når telleren viser null ("0") eller 3 måneder etter at du har tatt SYMBICORT 160mg-inhalatoren ut av folieposen, avhengig av hva som kommer først. SYMBICORT-inhalatoren din føles kanskje ikke tom og den kan fortsette å fungere, men du vil ikke få riktig mengde medisin hvis du fortsetter å bruke den. Bruk en ny SYMBICORT-inhalator og følg instruksjonene for priming (se instruksjon 5 ovenfor).
Slik rengjør du SYMBICORT-inhalatoren
Rengjør det hvite munnstykket på SYMBICORT 4,5 mcg inhalatoren hver 7. dag. Slik rengjør du munnstykket:
- . Fjern det grå munnstykkedekselet . Tørk av innsiden og utsiden av den hvite munnstykkets åpning med en ren, tørr klut . Sett på munnstykkedekselet . Ikke legg SYMBICORT-inhalatoren i vann . Ikke prøv å ta fra hverandre din SYMBICORT inhalator
Denne pasientinformasjonen og bruksanvisningen er godkjent av US Food and Drug Administration.
