Uniphyl 400mg Theophylline Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Uniphyl 400mg og hvordan brukes det?
Uniphyl er et reseptbelagt legemiddel som brukes til å behandle symptomene på astma, bronkitt, emfysem og andre pusteproblemer (akutt bronkospasme). Uniphyl 400mg kan brukes alene eller sammen med andre medisiner.
Uniphyl tilhører en klasse legemidler som kalles Xanthine-derivater; Fosfodiesterase-enzymhemmere, ikke-selektive.
Det er ikke kjent om Uniphyl 400mg er trygt og effektivt hos barn yngre enn 1 ½ måned.
Hva er de mulige bivirkningene av Uniphyl?
Uniphyl kan forårsake alvorlige bivirkninger, inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . alvorlig eller pågående oppkast, . vedvarende hodepine, . problemer med å sove, . raske hjerteslag, . anfall, . feber, . kramper i benet, . forstoppelse, . uregelmessige hjerteslag, . flagrende i brystet, . økt tørste eller vannlating, . nummenhet eller prikking, . muskel svakhet, . slapp følelse, . økt tørst, . økt vannlating, . tørr munn, og . fruktig pust lukt
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Uniphyl inkluderer:
- . kvalme, . oppkast, . diaré, . hodepine, . søvnproblemer (søvnløshet), . skjelvinger, . svette, . rastløshet, og . irritabilitet
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Uniphyl. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Uniphyl (vannfri teofyllin tablett) ® (teofyllin, vannfri) Tabletter i et system med kontrollert frigjøring tillater et 24-timers doseringsintervall for passende pasienter.
Teofyllin er strukturelt klassifisert som en metylxantin. Det forekommer som et hvitt, luktfritt, krystallinsk pulver med en bitter smak.
Vannfri teofyllin har det kjemiske navnet 1H-Purine-2,6-dion, 3,7-dihydro-1,3-dimethyl-, og er representert med følgende strukturformel:
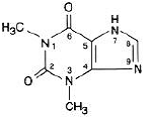
Molekylformelen for vannfritt teofyllin er C7H8N4O2 med en molekylvekt på 180,17.
Hver tablett med kontrollert frigjøring for oral administrering inneholder 400 eller 600 mg vannfri teofyllin.
Inaktive ingredienser: cetostearylalkohol, hydroksyetylcellulose, magnesiumstearat, povidon og talkum.
INDIKASJONER
Teofyllin er indisert for behandling av symptomer og reversibel luftstrømsobstruksjon forbundet med kronisk astma og andre kroniske lungesykdommer, f.eks. emfysem og kronisk bronkitt.
DOSERING OG ADMINISTRASJON
Uniphyl (vannfri teofyllin tablett) ® 400 eller 600 mg tabletter kan tas en gang daglig om morgenen eller kvelden. Det anbefales at Uniphyl (vannfri teofyllintablett) tas sammen med måltider. Pasienter bør informeres om at hvis de velger å ta Uniphyl (vannfri teofyllintablett) sammen med mat, bør den tas konsekvent med mat, og hvis de tar den i fastende tilstand, bør den rutinemessig tas fastende. Det er viktig at produktet alltid doseres konsekvent med eller uten mat.
Uniphyl (vannfri teofyllin tablett) ® Tabletter skal ikke tygges eller knuses fordi det kan føre til en rask frigjøring av teofyllin med potensiell toksisitet. Den skårede tabletten kan deles. I sjeldne tilfeller kan pasienter som får Uniphyl (vannfri teofyllin tablett) 400 eller 600 mg tabletter passere en intakt matrisetablett i avføringen eller via kolostomi. Disse matrisetablettene inneholder vanligvis lite eller ingen rester av teofyllin.
Stabiliserte pasienter, 12 år eller eldre, som tar et teofyllinprodukt med umiddelbar frigjøring eller kontrollert frigjøring, kan gå over til administrering én gang daglig av 400 mg eller 600 mg Uniphyl (vannfri teofyllintablett) tabletter på en mg-for- mg basis.
Det må erkjennes at topp- og bunnverdiene av teofyllin i serum produsert ved dosering én gang daglig kan variere fra de som ble produsert av forrige produkt og/eller regime.
Generelle betraktninger
Steady-state topp serum teofyllinkonsentrasjon er en funksjon av dosen, doseringsintervallet og hastigheten på teofyllinabsorpsjon og clearance hos den enkelte pasient. På grunn av markante individuelle forskjeller i hastigheten på teofyllinclearance, varierer dosen som kreves for å oppnå en maksimal serum-teofyllinkonsentrasjon i området 10-20 mcg/mL fire ganger blant ellers lignende pasienter i fravær av faktorer som er kjent for å endre teofyllinclearance (f.eks. 400-1600 mg/dag hos voksne Dosen av teofyllin må individualiseres på grunnlag av maksimale målinger av teofyllin i serum for å oppnå en dose som vil gi maksimal potensiell fordel med minimal risiko for uønskede effekter.
Forbigående koffeinlignende bivirkninger og for høye serumkonsentrasjoner i langsomme metabolisatorer kan unngås hos de fleste pasienter ved å starte med en tilstrekkelig lav dose og sakte øke dosen, hvis det vurderes å være klinisk indisert, i små trinn (Se ). Doseøkninger bør kun gjøres hvis den forrige dosen tolereres godt og med intervaller på ikke mindre enn 3 dager for å la serum-teofyllinkonsentrasjonen nå den nye steady-state. Dosejustering bør styres av serum teofyllinkonsentrasjonsmåling (se FORHOLDSREGLER , Laboratorietester og DOSERING OG ADMINISTRASJON ). Helsepersonell bør instruere pasienter og omsorgspersoner om å seponere enhver dosering som forårsaker bivirkninger, holde tilbake medisinen til disse symptomene er borte og deretter gjenoppta behandlingen med en lavere, tidligere tolerert dosering (se ADVARSLER ).
Hvis pasientens symptomer er godt kontrollert, er det ingen tilsynelatende bivirkninger, og ingen intervenerende faktorer som kan endre doseringskravene (se ADVARSLER og FORHOLDSREGLER ), bør serum teofyllinkonsentrasjoner overvåkes med 6 måneders intervaller for raskt voksende barn og med årlige intervaller for alle andre. Hos akutt syke pasienter bør serumkonsentrasjonen av teofyllin overvåkes med hyppige intervaller, f.eks. hver 24. time.
Teofyllin fordeler seg dårlig i kroppsfett, derfor bør mg/kg dose beregnes på grunnlag av ideell kroppsvekt.
Tabell V inneholder titreringsskjema for teofyllin anbefalt for pasienter i ulike aldersgrupper og kliniske forhold.
Tabell VI inneholder anbefalinger for dosejustering av teofyllin basert på serumkonsentrasjoner av teofyllin. Anvendelse av disse generelle doseringsanbefalingene på individuelle pasienter må ta hensyn til de unike kliniske egenskapene til hver pasient. Generelt bør disse anbefalingene tjene som øvre grense for dosejusteringer for å redusere risikoen for potensielt alvorlige bivirkninger forbundet med uventede store økninger i serumkonsentrasjonen av teofyllin.
B. Pasienter med risikofaktorer for nedsatt clearance, eldre (>60 år) og de som det ikke er mulig å overvåke serumteofyllinkonsentrasjoner hos:
Hos barn 12-15 år bør teofyllindosen ikke overstige 16 mg/kg/dag opp til maksimalt 400 mg/dag i nærvær av risikofaktorer for redusert teofyllinclearance (se ADVARSLER ) eller hvis det ikke er mulig å overvåke serum teofyllinkonsentrasjoner.
Hos ungdom ≥ 16 år og voksne, inkludert eldre, bør teofyllindosen ikke overstige 400 mg/dag i nærvær av risikofaktorer for redusert teofyllinclearance (se ADVARSLER ) eller hvis det ikke er mulig å overvåke serum teofyllinkonsentrasjoner.
*Pasienter med raskere metabolisme som er klinisk identifisert ved høyere dosekrav enn gjennomsnittet, bør få en mindre dose oftere (hver 12. time) for å forhindre gjennombruddssymptomer som følge av lave bunnkonsentrasjoner før neste dose.
TABELL VI. Dosejustering veiledet av serum teofyllinkonsentrasjon.
HVORDAN LEVERES
Uniphyl® (teofyllin, vannfri) tabletter med kontrollert frigjøring 400 mg leveres i hvit, ugjennomsiktig, barnesikret plastflaske som inneholder 100 tabletter ( NDC 67781-251-01) eller 500 nettbrett ( NDC 67781-251-05). Hver rund, hvit 400 mg tablett bærer symbolet PF på siden med delestrek og U400 på den andre siden.
Uniphyl® (teofyllin, vannfri) tabletter med kontrollert frigjøring 600 mg leveres i hvit, ugjennomsiktig, barnesikret plastflaske som inneholder 100 tabletter ( NDC 67781-252-01). Hver rektangulær, konkav, hvit 600 mg tablett bærer symbolet PF på siden med delestrek og U 600 på den andre siden.
Oppbevares ved 25°C (77°F); utflukter tillatt mellom 15°-30°C (59°-86°F).
Dispenser i en tett, lysbestandig beholder.
Purdue Pharmaceutical Products LP, Dist. av: Purdue Pharmaceutical Products LP, Stamford, CT 06901-3431. 17. mars 2004.
BIVIRKNINGER
Bivirkninger assosiert med teofyllin er generelt milde når maksimale serumkonsentrasjoner av teofyllin er OVERDOSERING ). De forbigående koffeinlignende bivirkningene forekommer hos omtrent 50 % av pasientene når teofyllinbehandling startes med doser høyere enn anbefalte startdoser (f.eks. > 300 mg/dag hos voksne og > 12 mg/kg/dag hos barn over > 1 år. ). Under oppstart av teofyllinbehandling kan koffeinlignende bivirkninger forbigående endre pasientadferd, spesielt hos barn i skolealder, men denne responsen vedvarer sjelden. Oppstart av teofyllinbehandling med en lav dose med påfølgende langsom titrering til en forhåndsbestemt aldersrelatert maksimal dose vil betydelig redusere frekvensen av disse forbigående bivirkningene (se DOSERING OG ADMINISTRASJON ). Hos en liten prosentandel av pasientene (
Andre bivirkninger som er rapportert ved serum-teofyllinkonsentrasjoner
TABELL IV. Manifestasjoner av teofyllin toksisitet. *
NARKOTIKAHANDEL
Teofyllin interagerer med et bredt utvalg av legemidler. Interaksjonen kan være farmakodynamisk, dvs. endringer i den terapeutiske responsen på teofyllin eller et annet medikament eller forekomst av bivirkninger uten endring i serumkonsentrasjonen av teofyllin. Oftere er imidlertid interaksjonen farmakokinetisk, dvs. at hastigheten på teofyllinclearance endres av et annet medikament, noe som resulterer i økte eller reduserte serumkonsentrasjoner av teofyllin. Teofyllin endrer bare sjelden farmakokinetikken til andre legemidler. Legemidlene oppført i tabell II har potensial til å produsere klinisk signifikante farmakodynamiske eller farmakokinetiske interaksjoner med teofyllin. Informasjonen i "Effekt"-kolonnen i tabell II antar at det interagerende medikamentet legges til et steadystate teofyllin-regime. Hvis teofyllin initieres hos en pasient som allerede tar et medikament som hemmer teofyllinclearance (f.eks. cimetidin, erytromycin), vil dosen teofyllin som kreves for å oppnå en terapeutisk serumteofyllinkonsentrasjon være mindre. Omvendt, hvis teofyllin initieres hos en pasient som allerede tar et medikament som øker teofyllinclearance (f.eks. rifampin), vil dosen av teofyllin som kreves for å oppnå en terapeutisk serumteofyllinkonsentrasjon være større. Seponering av et samtidig medikament som øker teofyllinclearance vil resultere i akkumulering av teofyllin til potensielt toksiske nivåer, med mindre teofyllindosen er passende redusert. Seponering av et samtidig legemiddel som hemmer teofyllinclearance vil resultere i reduserte serumkonsentrasjoner av teofyllin, med mindre teofyllindosen økes passende. Legemidlene oppført i tabell III har enten blitt dokumentert å ikke interagere med teofyllin eller ikke produsere en klinisk signifikant interaksjon (dvs.
Listen over legemidler i tabell II og III er gjeldende per 9. februar 1995. Nye interaksjoner rapporteres kontinuerlig for teofyllin, spesielt med nye kjemiske enheter. Helsepersonell bør ikke anta at et legemiddel ikke interagerer med teofyllin hvis det ikke er oppført i tabell II. Før tilsetning av et nylig tilgjengelig medikament til en pasient som får teofyllin, bør pakningsvedlegget til det nye legemidlet og/eller medisinsk litteratur konsulteres for å avgjøre om en interaksjon mellom det nye legemidlet og teofyllin er rapportert.
TABELL II. Klinisk signifikante legemiddelinteraksjoner med teofyllin.*
TABELL III. Legemidler som er dokumentert ikke å interagere med teofyllin eller legemidler som ikke gir noen klinisk signifikant interaksjon med teofyllin. *
Interaksjoner mellom narkotika og mat
Biotilgjengeligheten til Uniphyl®-tabletter (teofyllin, vannfri) er studert ved samtidig administrasjon av mat. I tre enkeltdosestudier ble forsøkspersoner som fikk Uniphyl (vannfri teofyllintablett) 400 mg eller 600 mg tabletter sammen med et standardisert måltid med høyt fettinnhold sammenlignet med fastende tilstander. Under fôringsforhold ble maksimal plasmakonsentrasjon og biotilgjengelighet økt; Det var imidlertid ikke tydelig økning i hastigheten og omfanget av absorpsjon (se Farmakokinetikk, Absorpsjon ). Den økte toppen og omfanget av absorpsjon under matforhold antyder at dosering ideelt sett bør administreres konsekvent enten med eller uten mat.
Effekten av andre legemidler på teofyllin serumkonsentrasjonsmålinger
De fleste serumteofyllinanalyser i klinisk bruk er immunanalyser som er spesifikke for teofyllin. Andre xantiner som koffein, dypfyllin og pentoksifyllin blir ikke oppdaget av disse analysene. Noen legemidler (f.eks. cefazolin, cephalothin) kan imidlertid forstyrre visse HPLC-teknikker. Koffein- og xantinmetabolitter hos nyfødte eller pasienter med nedsatt nyrefunksjon kan føre til at avlesningen fra noen tørre reagenskontormetoder er høyere enn den faktiske serumteofyllinkonsentrasjonen.
ADVARSLER
Samtidig sykdom
Teofyllin bør brukes med ekstrem forsiktighet hos pasienter med følgende kliniske tilstander på grunn av økt risiko for forverring av den samtidige tilstanden:
Aktiv magesårsykdom Anfallsforstyrrelser Hjertearytmier (ikke inkludert bradyarytmier)
Tilstander som reduserer teofyllinclearance
Det er flere lett identifiserbare årsaker til redusert teofyllinclearance. Hvis den totale daglige dosen ikke reduseres riktig i nærvær av disse risikofaktorene, kan alvorlig og potensielt dødelig teofyllintoksisitet oppstå. Fordelene og risikoene ved bruk av teofyllin må vurderes nøye, og behovet for mer intensiv overvåking av serumkonsentrasjonen av teofyllin hos pasienter med følgende risikofaktorer:
Alder
Nyfødte (bårne og premature) Barn 60 år)
Samtidige sykdommer
Akutt lungeødem Kongestiv hjertesvikt Cor-pulmonale Feber; ≥ 102° i 24 timer eller mer; eller mindre temperaturøkninger i lengre perioder Hypotyreose Leversykdom; cirrhose, akutt hepatitt Redusert nyrefunksjon hos spedbarn
Røykeslutt
Narkotikahandel
Legge til et medikament som hemmer teofyllinmetabolismen (f.eks. cimetidin, erytromycin, takrin) eller stoppe et samtidig administrert medikament som øker teofyllinmetabolismen (f.eks. karbamazepin, rifampin). (Se FORHOLDSREGLER: MEDIKEMELIGE INTERAKSJONER , ).
Når tegn eller symptomer på teofyllintoksisitet er tilstede
Når en pasient som får teofyllin utvikler kvalme eller brekninger, spesielt gjentatte oppkast, eller andre tegn eller symptomer forenlig med teofyllintoksisitet (selv om en annen årsak kan mistenkes), bør ytterligere doser av teofyllin holdes tilbake og en serumteofyllinkonsentrasjon måles umiddelbart. Pasienter bør instrueres om ikke å fortsette noen doser som forårsaker bivirkninger og å holde tilbake påfølgende doser til symptomene har forsvunnet, da kan helsepersonell instruere pasienten om å gjenoppta legemidlet med en lavere dose (se DOSERING OG ADMINISTRASJON , Doseringsretningslinjer, tabell VI ).
Dosering øker
Økning i dosen av teofyllin bør ikke gjøres som svar på en akutt forverring av symptomer på kronisk lungesykdom, siden teofyllin gir liten ekstra fordel for inhalerte beta2-selektive agonister og systemisk administrerte kortikosteroider i denne omstendigheten og øker risikoen for bivirkninger. En maksimal steady-state serum-teofyllinkonsentrasjon bør måles før doseøkning som respons på vedvarende kroniske symptomer for å fastslå om en økning i dosen er trygg. Før du øker teofyllindosen på grunnlag av lav serumkonsentrasjon, bør helsepersonell vurdere om blodprøven ble tatt på et passende tidspunkt i forhold til dosen og om pasienten har overholdt det foreskrevne regimet (se FORHOLDSREGLER , Laboratorietester ).
Siden hastigheten på teofyllinclearance kan være doseavhengig (dvs. steady-state serumkonsentrasjoner kan øke uforholdsmessig med doseøkningen), bør en økning i dose basert på en subterapeutisk serumkonsentrasjonsmåling være konservativ. Generelt vil begrensende doseøkninger til ca. 25 % av den forrige totale daglige dosen redusere risikoen for utilsiktet overdreven økning i serumteofyllinkonsentrasjonen (se DOSERING OG ADMINISTRASJON , ).
FORHOLDSREGLER
Generell
Nøye vurdering av de ulike interagerende legemidlene og fysiologiske tilstander som kan endre teofyllinclearance og krever dosejustering bør skje før oppstart av teofyllinbehandling, før økning i teofyllindose og under oppfølging (se ADVARSLER ). Dosen av teofyllin som velges for initiering av behandlingen bør være lav og, hvis den tolereres, økes sakte over en periode på en uke eller lenger med den endelige dosen veiledet av overvåking av serum-teofyllinkonsentrasjoner og pasientens kliniske respons (se DOSERING OG ADMINISTRASJON , ).
Overvåking av serum teofyllinkonsentrasjoner
Serum-teofyllinkonsentrasjonsmålinger er lett tilgjengelige og bør brukes for å avgjøre om doseringen er passende. Spesifikt bør serumteofyllinkonsentrasjonen måles som følger:
. Ved oppstart av behandling for å veilede den endelige dosejusteringen etter titrering. . Før du foretar en doseøkning for å finne ut om serumkonsentrasjonen er subterapeutisk hos en pasient som fortsetter å være symptomatisk. . Når tegn eller symptomer på teofyllintoksisitet er tilstede. . Hver gang det er en ny sykdom, forverring av en kronisk sykdom eller en endring i pasientens behandlingsregime som kan endre teofyllinclearance (f.eks. feber > 102 °F vedvarende i ≥ 24 timer, tilsettes hepatitt eller legemidler oppført i tabell II eller avviklet).For å veilede en doseøkning bør blodprøven tas på tidspunktet for den forventede maksimale serumteofyllinkonsentrasjonen; 12 timer etter en kveldsdose eller 9 timer etter en morgendose ved steady-state. For de fleste pasienter vil steady-state nås etter 3 dagers dosering når ingen doser er glemt, ingen ekstra doser er lagt til, og ingen av dosene er tatt med ulikt mellomrom. En bunnkonsentrasjon (dvs. ved slutten av doseringsintervallet) gir ingen ytterligere nyttig informasjon og kan føre til en upassende doseøkning siden den maksimale serum-teofyllinkonsentrasjonen kan være to eller flere ganger høyere enn bunnkonsentrasjonen med en formulering med umiddelbar frigjøring . Hvis serumprøven tas mer enn 12 timer etter kveldsdosen, eller mer enn 9 timer etter en morgendose, må resultatene tolkes med forsiktighet siden konsentrasjonen kanskje ikke reflekterer toppkonsentrasjonen. Derimot, når tegn eller symptomer på teofyllintoksisitet er tilstede, bør en serumprøve tas så snart som mulig, analyseres umiddelbart, og resultatet rapporteres til helsepersonell uten forsinkelse. Hos pasienter hvor det er mistanke om redusert serumproteinbinding (f.eks. skrumplever, kvinner i tredje trimester av svangerskapet), bør konsentrasjonen av ubundet teofyllin måles og dosen justeres for å oppnå en ubundet konsentrasjon på 6-12 mcg/ml. Spyttkonsentrasjoner av teofyllin kan ikke brukes pålitelig for å justere dosen uten spesielle teknikker.
Effekter på laboratorietester
Som et resultat av dets farmakologiske effekter, øker teofyllin i serumkonsentrasjoner innenfor 10-20 mcg/mL-området moderat plasmaglukose (fra gjennomsnittlig 88 mg% til 98 mg%), urinsyre (fra gjennomsnittlig 4 mg/dL) til 6 mg/dL), frie fettsyrer (fra et gjennomsnitt på 451 μEq/L til 800 μEq/L, totalkolesterol (fra et gjennomsnitt på 140 vs 160 mg/dL), HDL (fra et gjennomsnitt på 36 til 50 mg /dL), HDL/LDL-forhold (fra et gjennomsnitt på 0,5 til 0,7) og urinfri kortisolutskillelse (fra et gjennomsnitt på 44 til 63 mcg/24 timer). kan også forbigående redusere serumkonsentrasjoner av trijodtyronin (144 før, 131 etter én uke og 142 ng/dL etter 4 uker med teofyllin) Den kliniske betydningen av disse endringene bør veies opp mot den potensielle terapeutiske fordelen av teofyllin hos individuelle pasienter.
Karsinogenese, mutagenese og svekkelse av fruktbarhet
Langtidskarsinogenitetsstudier er utført på mus (orale doser 30-150 mg/kg) og rotter (orale doser 5-75 mg/kg). Resultatene venter.
Teofyllin har blitt studert i Ames salmonella, in vivo og in vitro cytogenetikk, mikronukleus og kinesisk hamster ovarie testsystemer og har ikke vist seg å være genotoksisk.
en 14 ukers kontinuerlig avlsstudie svekket teofyllin, administrert til parende par av B6C3F1-mus ved orale doser på 120, 270 og 500 mg/kg (omtrent 1,0-3,0 ganger den menneskelige dosen på mg/m²-basis) fruktbarheten, noe som fremgår av reduksjon i antall levende unger per kull, reduksjon i gjennomsnittlig antall kull per fertile par, og økning i drektighetsperioden ved høy dose samt reduksjon i andel unger født levende ved middels og høy dose. I 13 ukers toksisitetsstudier ble teofyllin administrert til F344-rotter og B6C3F1-mus i orale doser på 40-300 mg/kg (omtrent 2,0 ganger human dose på mg/m²-basis). Ved høy dose ble systemisk toksisitet observert hos begge arter, inkludert reduksjon i testikkelvekt.
Svangerskap
Teratogene effekter: Kategori C
I studier der gravide mus, rotter og kaniner ble doseret i løpet av organogeneseperioden, ga teofyllin teratogene effekter.
studier med mus ga en enkelt intraperitoneal dose på og over 100 mg/kg (omtrent lik maksimal anbefalt oral dose for voksne på mg/m²-basis) under organogenese ganespalte og digitale abnormiteter. Mikromeli, mikrognati, klumpfot, subkutant hematom, åpne øyelokk og embryodødelighet ble observert ved doser som er omtrent 2 ganger den maksimale anbefalte orale dosen for voksne på mg/m²-basis.
en studie med rotter dosert fra unnfangelse til organogenese, ga en oral dose på 150 mg/kg/dag (ca. 2 ganger den maksimale anbefalte orale dosen for voksne på mg/m²-basis) digitale abnormiteter. Embryoletalitet ble observert med en subkutan dose på 200 mg/kg/dag (omtrent 4 ganger maksimal anbefalt oral dose for voksne på mg/m²-basis). I en studie der drektige kaniner ble dosert gjennom hele organogenesen, forårsaket en intravenøs dose på 60 mg/kg/dag (ca. 2 ganger den maksimale anbefalte orale dosen for voksne på mg/m²-basis), som forårsaket døden til én doe og klinisk tegn hos andre, ga ganespalte og var embryodødelig. Doser på og over 15 mg/kg/dag (mindre enn maksimal anbefalt oral dose for voksne på mg/m²-basis) økte forekomsten av skjelettvariasjoner.
Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Teofyllin bør kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.

Ammende mødre
Teofyllin skilles ut i morsmelk og kan forårsake irritabilitet eller andre tegn på mild toksisitet hos ammende spedbarn. Konsentrasjonen av teofyllin i morsmelk tilsvarer omtrent konsentrasjonen av mors serum. Et spedbarn som får i seg en liter morsmelk som inneholder 10-20 mcg/ml teofyllin per dag vil sannsynligvis motta 10-20 mg teofyllin per dag. Alvorlige bivirkninger hos spedbarnet er usannsynlig med mindre moren har toksiske serumteofyllinkonsentrasjoner.
Pediatrisk bruk
Teofyllin er trygt og effektivt for de godkjente indikasjonene hos pediatriske pasienter. Vedlikeholdsdosen av teofyllin må velges med forsiktighet hos pediatriske pasienter siden frekvensen av teofyllinclearance er svært varierende over det pediatriske aldersområdet (se KLINISK FARMAKOLOGI , , ADVARSLER , og DOSERING OG ADMINISTRASJON , ).
Geriatrisk bruk
Eldre pasienter har en betydelig større risiko for å oppleve alvorlig toksisitet fra teofyllin enn yngre pasienter på grunn av farmakokinetiske og farmakodynamiske endringer forbundet med aldring. Clearance av teofyllin er redusert med gjennomsnittlig 30 % hos friske eldre voksne (> 60 år) sammenlignet med friske unge voksne. Teofyllinclearance kan reduseres ytterligere ved samtidige sykdommer som er utbredt hos eldre, som ytterligere svekker clearance av dette legemidlet og har potensial til å øke serumnivåer og potensiell toksisitet. Disse tilstandene inkluderer nedsatt nyrefunksjon, kronisk obstruktiv lungesykdom, kongestiv hjertesvikt, leversykdom og økt forekomst av bruk av visse medisiner (se FORHOLDSREGLER : NARKOTIKAHANDEL ) med potensial for farmakokinetisk og farmakodynamisk interaksjon. Proteinbindingen kan være redusert hos eldre, noe som resulterer i en økt andel av den totale serumteofyllinkonsentrasjonen i den farmakologisk aktive ubundne formen. Eldre pasienter ser også ut til å være mer følsomme for de toksiske effektene av teofyllin etter kronisk overdosering enn yngre pasienter. Nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serum teofyllinkonsentrasjoner er nødvendig hos eldre pasienter (se FORHOLDSREGLER , Overvåking av serum teofyllinkonsentrasjoner , og DOSERING OG ADMINISTRASJON ).
Den maksimale daglige dosen av teofyllin hos pasienter over 60 år bør vanligvis ikke overstige 400 mg/dag med mindre pasienten fortsetter å være symptomatisk og maksimal steady-state serum teofyllinkonsentrasjon er DOSERING OG ADMINISTRASJON ). Teofyllindoser større enn 400 mg/d bør foreskrives med forsiktighet hos eldre pasienter.
OVERDOSE
Generell
Kronisiteten og mønsteret av overdosering av teofyllin påvirker signifikant kliniske manifestasjoner av toksisitet, behandling og utfall. Det er to vanlige presentasjoner: (1) akutt overdose, dvs. inntak av en enkelt stor overdose (> 10 mg/kg), som forekommer i sammenheng med et selvmordsforsøk eller isolert medisineringsfeil, og (2) kronisk overdosering, dvs. inntak av gjentatte doser som er for høye for pasientens hastighet av teofyllinclearance. De vanligste årsakene til kronisk overdosering av teofyllin inkluderer feil i dosering av pasient eller omsorgsperson, forskrivning av en for høy dose eller en normal dose av helsepersonell i nærvær av faktorer som er kjent for å redusere hastigheten av teofyllinclearance, og økning av dosen som svar på en forverring. av symptomer uten først å måle serum teofyllinkonsentrasjonen for å avgjøre om en doseøkning er trygg.
Alvorlig toksisitet fra overdose av teofyllin er en relativt sjelden hendelse. I en helsevedlikeholdsorganisasjon var frekvensen av sykehusinnleggelser for kronisk overdosering av teofyllin omtrent 1 per 1000 personår eksponering. I en annen studie, blant 6000 blodprøver oppnådd for måling av serum teofyllinkonsentrasjon, uansett grunn, fra pasienter behandlet på en akuttmottak, var 7 % i området 20-30 mcg/ml og 3 % var > 30 mcg/ml. Omtrent to tredjedeler av pasientene med serumteofyllinkonsentrasjoner i området 20-30 mcg/ml hadde en eller flere manifestasjoner av toksisitet, mens > 90 % av pasientene med serumteofyllinkonsentrasjoner > 30 mcg/ml var klinisk berusede. Tilsvarende, i andre rapporter, er alvorlig toksisitet fra teofyllin sett hovedsakelig ved serumkonsentrasjoner > 30 mcg/ml.
Flere studier har beskrevet de kliniske manifestasjonene av teofyllinoverdose og forsøkt å bestemme faktorene som forutsier livstruende toksisitet. Generelt er det mindre sannsynlig at pasienter som opplever en akutt overdose opplever anfall enn pasienter som har opplevd en kronisk overdose, med mindre den maksimale serum teofyllinkonsentrasjonen er > 100 mcg/ml. Etter en kronisk overdosering kan generaliserte anfall, livstruende hjertearytmier og død forekomme ved serumteofyllinkonsentrasjoner > 30 mcg/ml. Alvorlighetsgraden av toksisitet etter kronisk overdosering er sterkere korrelert med pasientens alder enn maksimal serum teofyllinkonsentrasjon; Pasienter > 60 år har størst risiko for alvorlig toksisitet og dødelighet etter en kronisk overdosering. Eksisterende eller samtidig sykdom kan også signifikant øke en pasients mottakelighet for en bestemt toksisk manifestasjon, f.eks. har pasienter med nevrologiske lidelser økt risiko for anfall og pasienter med hjertesykdom har økt risiko for hjertearytmier for en gitt serumteofyllinkonsentrasjon sammenlignet med til pasienter uten den underliggende sykdommen.
Frekvensen av forskjellige rapporterte manifestasjoner av teofyllinoverdosering i henhold til overdoseringsmåten er oppført i tabell IV. Andre manifestasjoner av teofyllintoksisitet inkluderer økning i serumkalsium, kreatinkinase, myoglobin og leukocytttelling, reduksjon i serumfosfat og magnesium, akutt hjerteinfarkt og urinretensjon hos menn med obstruktiv uropati. Anfall assosiert med serum teofyllinkonsentrasjoner > 30 mcg/ml er ofte resistente mot krampestillende terapi og kan føre til irreversibel hjerneskade hvis den ikke kontrolleres raskt. Død fra teofyllintoksisitet er oftest sekundært til kardiorespirasjonsstans og/eller hypoksisk encefalopati etter langvarige generaliserte anfall eller intraktable hjertearytmier som forårsaker hemodynamisk kompromittering.
Overdosebehandling
Generelle anbefalinger for pasienter med symptomer på teofyllinoverdose eller serumteofyllinkonsentrasjoner > 30 mcg/ml (Merk: Serumteofyllinkonsentrasjoner kan fortsette å øke etter presentasjon av pasienten for medisinsk behandling.)
Mens du samtidig iverksetter behandling, kontakt et regionalt giftsenter for å få oppdatert informasjon og råd om individualisering av anbefalingene som følger.
Institutt støttende behandling, inkludert etablering av intravenøs tilgang, vedlikehold av luftveiene og elektrokardiografisk overvåking.
Behandling av anfall
På grunn av den høye morbiditeten og dødeligheten forbundet med teofyllininduserte anfall, bør behandlingen være rask og aggressiv. Antikonvulsiv behandling bør initieres med et intravenøst benzodiazepin, f.eks. diazepam, i trinn på 0,1-0,2 mg/kg hvert 1.-3. minutt inntil anfallene er avsluttet. Gjentatte anfall bør behandles med en startdose fenobarbital (20 mg/kg infundert over 30-60 minutter). Kasusrapporter om overdosering av teofyllin hos mennesker og dyrestudier tyder på at fenytoin er ineffektivt for å avslutte teofyllininduserte anfall. Dosene av benzodiazepiner og fenobarbital som kreves for å avslutte teofyllininduserte anfall er nær dosene som kan forårsake alvorlig respirasjonsdepresjon eller respirasjonsstans; helsepersonell bør derfor være forberedt på å gi assistert ventilasjon. Eldre pasienter og pasienter med KOLS kan være mer utsatt for de respirasjonsdempende effektene av antikonvulsiva. Barbituratindusert koma eller administrering av generell anestesi kan være nødvendig for å avslutte gjentatte anfall eller status epilepticus. Generell anestesi bør brukes med forsiktighet hos pasienter med teofyllinoverdose fordi fluorholdige flyktige anestetika kan sensibilisere myokard for endogene katekolaminer frigitt av teofyllin. Enfluran ser ut til å være mindre sannsynlig forbundet med denne effekten enn halotan og kan derfor være tryggere. Nevromuskulære blokkerende midler alene bør ikke brukes for å terminere anfall siden de eliminerer muskel- og skjelettmanifestasjoner uten å stoppe anfallsaktiviteten i hjernen.
Forutse behovet for antikonvulsiva
Hos pasienter med teofyllinoverdose som har høy risiko for teofyllininduserte anfall, f.eks. pasienter med akutte overdoser og serumteofyllinkonsentrasjoner > 100 mcg/ml eller kronisk overdosering hos pasienter > 60 år med serumteofyllinkonsentrasjoner > 30 mcg/mL , bør behovet for antikonvulsiv behandling påregnes. Et benzodiazepin som diazepam bør trekkes inn i en sprøyte og oppbevares ved pasientens seng, og medisinsk personell som er kvalifisert til å behandle anfall bør være umiddelbart tilgjengelig. Hos utvalgte pasienter med høy risiko for teofyllininduserte anfall, bør administrasjon av profylaktisk antikonvulsiv behandling vurderes. Situasjoner der profylaktisk antikonvulsiv behandling bør vurderes hos høyrisikopasienter inkluderer forventede forsinkelser i å sette i gang metoder for ekstrakorporal fjerning av teofyllin (f.eks. overføring av en høyrisikopasient fra en helseinstitusjon til en annen for ekstrakorporal fjerning) og kliniske forhold som i betydelig grad forstyrrer innsatsen. for å forbedre teofyllinclearance (f.eks. et nyfødt barn hvor dialyse kanskje ikke er teknisk mulig eller en pasient med oppkast som ikke reagerer på antiemetika som ikke er i stand til å tolerere multiple doser oralt aktivt kull). I dyrestudier har profylaktisk administrering av fenobarbital, men ikke fenytoin, vist seg å forsinke utbruddet av teofyllininduserte generaliserte anfall og øke dosen av teofyllin som kreves for å indusere anfall (dvs. øker LD50 markant). Selv om det ikke er noen kontrollerte studier på mennesker, kan en startdose av intravenøs fenobarbital (20 mg/kg infundert over 60 minutter) forsinke eller forhindre livstruende anfall hos høyrisikopasienter mens arbeidet med å forbedre teofyllinclearance fortsetter. Fenobarbital kan forårsake respirasjonsdepresjon, spesielt hos eldre pasienter og pasienter med KOLS.
Behandling av hjertearytmier
Sinustakykardi og enkle ventrikulære premature slag er ikke varsler om livstruende arytmier, de krever ikke behandling i fravær av hemodynamisk kompromittering, og de går over med synkende teofyllinkonsentrasjoner i serum. Andre arytmier, spesielt de som er assosiert med hemodynamisk kompromittering, bør behandles med antiarytmisk behandling som passer for typen arytmi.
Gastrointestinal dekontaminering
Oralt aktivt kull (0,5 g/kg opp til 20 g og gjentas minst én gang 1-2 timer etter første dose) er ekstremt effektivt for å blokkere absorpsjonen av teofyllin i hele mage-tarmkanalen, selv når det administreres flere timer etter inntak. Hvis pasienten kaster opp, bør kullet administreres gjennom en nasogastrisk sonde eller etter administrering av et antiemetikum. Fetiazin-antiemetika som proklorperazin eller perfenazin bør unngås siden de kan senke anfallsterskelen og ofte forårsake dystoniske reaksjoner. En enkelt dose sorbitol kan brukes for å fremme avføring for å lette fjerning av teofyllin bundet til kull fra mage-tarmkanalen. Sorbitol bør imidlertid doseres med forsiktighet siden det er et kraftig rensemiddel som kan forårsake dype væske- og elektrolyttavvik, spesielt etter flere doser. Kommersielt tilgjengelige faste kombinasjoner av flytende kull og sorbitol bør unngås hos små barn og etter den første dosen hos ungdom og voksne siden de ikke tillater individualisering av kull- og sorbitoldosering. Ipecac sirup bør unngås ved overdoser av teofyllin. Selv om ipecac induserer brekninger, reduserer det ikke absorpsjonen av teofyllin med mindre det administreres innen 5 minutter etter inntak, og selv da er det mindre effektivt enn oralt aktivt kull. I tillegg kan ipecac-indusert brekning vedvare i flere timer etter en enkelt dose og redusere retensjonen og effektiviteten av oralt aktivt kull betydelig.
Serum Theophy linje
Konsentrasjonsovervåking Serumteofyllinkonsentrasjonen bør måles umiddelbart etter presentasjon, 2-4 timer senere, og deretter med tilstrekkelige intervaller, f.eks. hver 4. time, for å veilede behandlingsbeslutninger og for å vurdere effektiviteten av behandlingen. Serumteofyllinkonsentrasjoner kan fortsette å øke etter presentasjon av pasienten for medisinsk behandling som følge av fortsatt absorpsjon av teofyllin fra mage-tarmkanalen. Seriell overvåking av serum teofyllin serumkonsentrasjoner bør fortsettes til det er klart at konsentrasjonen ikke lenger stiger og har returnert til ikke-toksiske nivåer.
Generell overvåking
Prosedyrer Elektrokardiografisk overvåking bør startes ved presentasjon og fortsettes til serumteofyllinnivået har returnert til et ikke-toksisk nivå. Serumelektrolytter og glukose bør måles ved presentasjon og med passende intervaller angitt av kliniske forhold. Væske- og elektrolyttavvik bør korrigeres umiddelbart. Overvåking og behandling bør fortsettes til serumkonsentrasjonen synker under 20 mcg/ml.
Forbedre clearance av teofyllin
Multippel-dose oralt aktivt kull (f.eks. 0,5 mg/kg opp til 20 g, annenhver time) øker clearance av teofyllin minst to ganger ved adsorpsjon av teofyllin utskilt i gastrointestinale væsker. Kull må beholdes i, og passere gjennom, mage-tarmkanalen for å være effektiv; emesis bør derfor kontrolleres ved administrering av passende antiemetika. Alternativt kan trekullet administreres kontinuerlig gjennom en nasogastrisk sonde i forbindelse med passende antiemetika. En enkelt dose sorbitol kan administreres med det aktive kullet for å fremme avføring for å lette fjerning av det adsorberte teofyllinet fra mage-tarmkanalen. Sorbitol alene øker ikke clearance av teofyllin og bør doseres med forsiktighet for å forhindre overdreven avføring som kan føre til alvorlig væske- og elektrolyttubalanse. Kommersielt tilgjengelige faste kombinasjoner av flytende kull og sorbitol bør unngås hos små barn og etter den første dosen hos ungdom og voksne siden de ikke tillater individualisering av kull- og sorbitoldosering. Hos pasienter med uhåndterlige oppkast, bør ekstrakorporale metoder for fjerning av teofyllin igangsettes (se OVERDOSERING , Ekstrakorporal fjerning ).
Spesifikke anbefalinger
Akutt overdose
. Serumkonsentrasjon > 20 . Administrer en enkelt dose oralt aktivt kull. . Overvåk pasienten og oppnå en serum teofyllinkonsentrasjon i løpet av 2-4 timer for å sikre at konsentrasjonen ikke øker. . Serumkonsentrasjon > 30 . Administrer multiple doser oralt aktivt kull og tiltak for å kontrollere emesis. . Overvåk pasienten og oppnå serielle teofyllinkonsentrasjoner hver 2.-4. time for å måle effektiviteten av behandlingen og for å veilede videre behandlingsbeslutninger. . Sett i gang ekstrakorporal fjerning hvis brekninger, anfall eller hjertearytmier ikke kan kontrolleres tilstrekkelig (se OVERDOSERING , Ekstrakorporal fjerning ). . Serumkonsentrasjon > 100 mcg/ml . Vurder profylaktisk antikonvulsiv terapi. . Administrer multiple doser oralt aktivt kull og tiltak for å kontrollere emesis. . Vurder ekstrakorporal fjerning, selv om pasienten ikke har opplevd et anfall (se OVERDOSERING , Ekstrakorporal fjerning ). . Overvåk pasienten og oppnå serielle teofyllinkonsentrasjoner hver 2.-4. time for å måle effektiviteten av behandlingen og for å veilede videre behandlingsbeslutninger.Kronisk overdosering
. Serumkonsentrasjon > 20 . Administrer en enkelt dose oralt aktivt kull. . Overvåk pasienten og oppnå en serum teofyllinkonsentrasjon i løpet av 2-4 timer for å sikre at konsentrasjonen ikke øker. . Serumkonsentrasjon > 30 mcg/ml hos pasienter . Administrer multiple doser oralt aktivt kull og tiltak for å kontrollere emesis. . Overvåk pasienten og oppnå serielle teofyllinkonsentrasjoner hver 2.-4. time for å måle effektiviteten av behandlingen og for å veilede videre behandlingsbeslutninger. . Sett i gang ekstrakorporal fjerning hvis brekninger, anfall eller hjertearytmier ikke kan kontrolleres tilstrekkelig (se OVERDOSERING , Ekstrakorporal fjerning ). . Serumkonsentrasjon > 30 mcg/ml hos pasienter ≥ 60 år . Vurder profylaktisk antikonvulsiv terapi. . Administrer multiple doser oralt aktivt kull og tiltak for å kontrollere emesis. . Vurder ekstrakorporal fjerning selv om pasienten ikke har opplevd et anfall (se OVERDOSERING , Ekstrakorporal fjerning ). . Overvåk pasienten og oppnå serielle teofyllinkonsentrasjoner hver 2.-4. time for å måle effektiviteten av behandlingen og for å veilede videre behandlingsbeslutninger.Ekstrakorporal fjerning
Å øke graden av teofyllinclearance med ekstrakorporale metoder kan raskt redusere serumkonsentrasjonen, men risikoen ved prosedyren må veies opp mot den potensielle fordelen. Kullhemoperfusjon er den mest effektive metoden for ekstrakorporal fjerning, og øker teofyllinclearance opptil seks ganger, men alvorlige komplikasjoner, inkludert hypotensjon, hypokalsemi, blodplateforbruk og blødningsdiateser kan forekomme. Hemodialyse er omtrent like effektivt som flerdose oralt aktivt kull og har lavere risiko for alvorlige komplikasjoner enn kullhemoperfusjon. Hemodialyse bør vurderes som et alternativ når kullhemoperfusjon ikke er mulig og flerdoser oralt kull er ineffektivt på grunn av uhåndterlig emesis. Serumteofyllinkonsentrasjoner kan gå tilbake 5-10 mcg/ml etter seponering av kullhemoperfusjon eller hemodialyse på grunn av omfordeling av teofyllin fra vevsrommet. Peritonealdialyse er ineffektiv for fjerning av teofyllin; utvekslingstransfusjoner hos nyfødte har vært minimalt effektive.
KONTRAINDIKASJONER
Uniphyl (vannfri teofyllin tablett) ® er kontraindisert hos pasienter med en historie med overfølsomhet overfor teofyllin eller andre komponenter i produktet.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Teofyllin har to distinkte virkninger i luftveiene til pasienter med reversibel obstruksjon; glatt muskelavslapning (dvs. bronkodilatasjon) og undertrykkelse av responsen fra luftveiene på stimuli (dvs. ikke-bronkodilaterende profylaktiske effekter). Selv om virkningsmekanismene til teofyllin ikke er kjent med sikkerhet, antyder studier på dyr at bronkodilatasjon medieres av hemming av to isozymer av fosfodiesterase (PDE III og, i mindre grad, PDE IV), mens ikke-bronkodilaterende profylaktiske virkninger sannsynligvis er mediert gjennom en eller flere forskjellige molekylære mekanismer, som ikke involverer hemming av PDE III eller antagonisme av adenosinreseptorer. Noen av bivirkningene assosiert med teofyllin ser ut til å være mediert av hemming av PDE III (f.eks. hypotensjon, takykardi, hodepine og emesis) og adenosinreseptorantagonisme (f.eks. endringer i cerebral blodstrøm).
Teofyllin øker sammentrekningskraften av diafragmatiske muskler. Denne handlingen ser ut til å skyldes økt kalsiumopptak gjennom en adenosin-mediert kanal.
Serum konsentrasjon-effekt forhold
Bronkodilatasjon skjer over serumteofyllinkonsentrasjonsområdet på 5-20 mcg/ml. Klinisk viktig forbedring i symptomkontroll er i de fleste studier funnet å kreve maksimale serum-teofyllinkonsentrasjoner > 10 mcg/ml, men pasienter med mild sykdom kan ha nytte av lavere konsentrasjoner. Ved serum teofyllinkonsentrasjoner > 20 mcg/ml øker både frekvensen og alvorlighetsgraden av bivirkningene. Generelt vil opprettholdelse av maksimale serum-teofyllinkonsentrasjoner mellom 10 og 15 mcg/ml oppnå mesteparten av legemidlets potensielle terapeutiske fordel samtidig som risikoen for alvorlige bivirkninger minimeres.
Farmakokinetikk
Oversikt
Teofyllin absorberes raskt og fullstendig etter oral administrering i oppløsning eller fast oral doseringsform med umiddelbar frigjøring. Teofyllin gjennomgår ingen nevneverdig pre-systemisk eliminering, distribueres fritt til fettfritt vev og metaboliseres i stor grad i leveren.
Farmakokinetikken til teofyllin varierer mye blant lignende pasienter og kan ikke forutsies ut fra alder, kjønn, kroppsvekt eller andre demografiske egenskaper. I tillegg kan visse samtidige sykdommer og endringer i normal fysiologi (se tabell I) og samtidig administrering av andre legemidler (se tabell II) signifikant endre de farmakokinetiske egenskapene til teofyllin. Variasjon i metabolisme innen individ er også rapportert i noen studier, spesielt hos akutt syke pasienter. Det anbefales derfor at serumteofyllinkonsentrasjoner måles hyppig hos akutt syke pasienter (f.eks. med 24-timers intervaller) og med jevne mellomrom hos pasienter som får langtidsbehandling, f.eks. med 6-12 måneders intervaller. Hyppigere målinger bør gjøres i nærvær av enhver tilstand som kan endre teofyllinclearance betydelig (se FORHOLDSREGLER, Laboratorietester ).
TABELL I. Gjennomsnitt og rekkevidde av total kroppsclearance og halveringstid for teofyllin relatert til alder og endrede fysiologiske tilstander.¶
Merk: I tillegg til faktorene som er oppført ovenfor, økes teofyllinclearance og halveringstiden reduseres ved lavkarbohydrat-/høyproteindietter, parenteral ernæring og daglig inntak av kullstekt biff. En diett med høyt karbohydrat/lavt proteininnhold kan redusere clearance og forlenge halveringstiden til teofyllin.
Absorpsjon
Uniphyl (vannfri teofyllin tablett) ® administrert i matet tilstand absorberes fullstendig etter oral administrering.
en enkeltdose-crossover-studie ble to 400 mg Uniphyl (vannfri teofyllin-tablett) administrert til 19 normale frivillige om morgenen eller kvelden umiddelbart etter det samme standardiserte måltidet (769 kalorier bestående av 97 gram karbohydrater, 33 gram protein og 27 gram fett). Det var ingen bevis for dosedumping, og det var heller ingen signifikante forskjeller i farmakokinetiske parametere som kan tilskrives tidspunktet for legemiddeladministrering. På morgenarmen var de farmakokinetiske parameterne AUC = 241,9 ± 83,0 mcg time/mL, Cmax = 9,3 ± 2,0 mcg/ml, Tmax = 12,8 ± 4,2 timer. På kveldsarmen var de farmakokinetiske parametrene AUC = 219,7 ± 83,0 mcg time/mL, Cmax = 9,2 ± 2,0 mcg/ml, Tmax = 12,5 ± 4,2 timer.
En studie der Uniphyl (vannfri teofyllin-tablett) 400 mg tabletter ble administrert til 17 matte voksne astmatikere ga lignende kurver for teofyllinnivå-tid når det ble administrert om morgenen eller kvelden. Serumnivåene var generelt høyere i kveldsregimet, men det var ingen statistisk signifikante forskjeller mellom de to regimene.
En enkeltdosestudie med 15 normale fastende mannlige frivillige hvis teofyllin iboende gjennomsnittlige eliminasjonshalveringstid ble verifisert av et flytende teofyllinprodukt til å være 6,9 ± 2,5 (SD) timer, ble administrert to eller tre 400 mg Uniphyl (vannfri teofyllin tablett) ® tabletter . Den relative biotilgjengeligheten til Uniphyl (vannfri teofyllin-tablett) gitt i fastende tilstand sammenlignet med et produkt med umiddelbar frigjøring var 59 %. Maksimale serumteofyllinnivåer oppsto etter 6,9 ± 5,2 (SD) timer, med et normalisert (til 800 mg) toppnivå på 6,2 ± 2,1 (SD). Den tilsynelatende eliminasjonshalveringstiden for 400 mg Uniphyl (vannfri teofyllin tablett) var 17,2 ± 5,8 (SD) timer.
Steady-state farmakokinetikk ble bestemt i en studie med 12 fastende pasienter med kronisk reversibel obstruktiv lungesykdom. Alle ble dosert med to 400 mg Uniphyl (vannfri teofyllin-tablett) gitt én gang daglig om morgenen og et referanseprodukt med kontrollert frigivelse BID administrert som to 200 mg-tabletter gitt med 12 timers mellomrom. De farmakokinetiske parametrene oppnådd for Uniphyl (vannfri teofyllin-tablett) gitt i doser på 800 mg én gang daglig om morgenen var praktisk talt identiske med de tilsvarende parameterne for referansemedikamentet når de ble gitt som 400 mg BID. Spesielt AUC-, Cmax- og Cmin-verdiene oppnådd i denne studien var som følger:
Enkeltdosestudier der forsøkspersoner ble fastet i tolv (12) timer før og ytterligere fire (4) timer etter dosering, viste redusert biotilgjengelighet sammenlignet med dosering med mat. En enkeltdosestudie med 20 normale frivillige dosert med to (2) 400 mg tabletter om morgenen, sammenlignet dosering under disse fastetilstandene med dosering rett før en standardisert frokost (769 kalorier, bestående av 97 gram karbohydrater, 33 gram protein og 27 gram fett). Under matforhold var de farmakokinetiske parameterne: AUC = 231,7 ± 92,4 mcg time/mL, Cmax = 8,4 ± 2,6 mcg/ml, Tmax = 17,3 ± 6,7 timer. Under fastende forhold var disse parameterne AUC = 141,2 ± 6,53 mcg time/mL, Cmax = 5,5 ± 1,5 mcg/ml, Tmax = 6,5 ± 2,1 timer.
En annen enkeltdosestudie på 21 normale mannlige frivillige, dosert om kvelden, sammenlignet faste med et standardisert måltid med høyt kaloriinnhold og høyt fettinnhold (870-1020 kalorier, bestående av 33 gram protein, 55-75 gram fett, 58 gram karbohydrater). I den fastende armen fikk forsøkspersonene én Uniphyl (vannfri teofyllintablett) ® 400 mg tablett kl. 20.00 etter en åtte timers faste etterfulgt av ytterligere fire timers faste. I den matede armen ble forsøkspersoner igjen dosert med en 400 mg Uniphyl (vannfri teofyllin-tablett), men kl. 20.00 umiddelbart etter det standardiserte måltidet med høyt fettinnhold som er sitert ovenfor. De farmakokinetiske parameterne (normalisert til 800 mg) matet var AUC = 221,8 ± 40,9 mcg time/ml, Cmax = 10,9 ± 1,7 mcg/ml, Tmax = 11,8 ± 2,2 timer. I den fastende armen var de farmakokinetiske parameterne (normalisert til 800 mg) AUC = 146,4 ± 40,9 mcg time/mL, Cmax = 6,7 ± 1,7 mcg/ml, Tmax = 7,3 ± 2,2 timer.
Administrering av enkeltdoser av Uniphyl (vannfri teofyllin-tablett) til friske, normale frivillige under langvarig fasteforhold (minst 10 timers faste over natten før dosering etterfulgt av ytterligere fire (4) timers faste etter dosering) resulterer i redusert biotilgjengelighet. Det var imidlertid ingen svikt i dette leveringssystemet som førte til en plutselig og uventet frigjøring av en stor mengde teofyllin med Uniphyl (vannfri teofyllin tablett) selv når de administreres sammen med et måltid med høyt fettinnhold og høyt kaloriinnhold.
Lignende studier ble utført med 600 mg Uniphyl (vannfri teofyllintablett) tablett. En enkeltdosestudie med 24 forsøkspersoner med en etablert teofyllinclearance på ≤ 4 l/time, sammenlignet den farmakokinetiske evalueringen av én 600 mg Uniphyl (vannfri teofyllin tablett) og halvannen 400 mg Uniphyl (vannfri teofyllin tablett) tabletter under fôret (ved bruk av en standard diett med høyt fettinnhold) og fastende forhold. Resultatene av denne 4-veis randomiserte crossover-studien viser bioekvivalensen til 400 mg og 600 mg Uniphyl (vannfri teofyllin tablett) tabletter. Under matforhold var de farmakokinetiske resultatene for halvannen 400 mg tabletter AUC = 214,64 ± 55,88 mcg t/mL, Cmax = 10,58 ± 2,21 mcg/ml og Tmax = 9,00 ± 2,64 timer, og mg i 2,64 timer. var AUC = 207,85 ± 48,9 mcg time/mL, Cmax = 10,39 ± 1,91 mcg/mL og Tmax = 9,58 ± 1,86 timer. Under fastende forhold var de farmakokinetiske resultatene for halvannen 400 mg tabletter AUC = 191,85 ± 51,1 mcg time/mL, Cmax = 7,37 ± 1,83 mcg/ml og Tmax = 8,08 ± 4,39 timer; og for 600 mg tabletten var AUC = 199,39 ± 70,27 mcg time/ml, Cmax = 7,66 ± 2,09 mcg/ml og Tmax = 9,67 ± 4,89 timer.
denne studien var gjennomsnittlig mat/faste-ratio for en og en halv 400 mg tabletter og 600 mg tabletter henholdsvis ca. 112 % og 104 %.
I en annen studie ble biotilgjengeligheten til 600 mg Uniphyl (vannfri teofyllin tablett) undersøkt med morgen- og kveldsadministrasjon. Denne enkeltdose-crossover-studien på 22 friske menn ble utført under matforhold (standard diett med høyt fettinnhold). Resultatene viste ingen klinisk signifikant forskjell i biotilgjengeligheten til 600 mg Uniphyl (vannfri teofyllin tablett) administrert om morgenen eller om kvelden. Resultatene var: AUC = 233,6 ± 45,1 mcg time/mL, Cmax = 10,6 ± 1,3 mcg/mL og Tmax = 12,5 ± 3,2 timer med morgendosering; AUC = 209,8 ± 46,2 mcg time/mL, Cmax = 9,7 ± 1,4 mcg/mL og Tmax = 13,7 ± 3,3 timer med kveldsdosering. PM/AM-forholdet var 89,3 %.
Absorpsjonsegenskapene til Uniphyl®-tabletter (teofyllin, vannfri) har blitt grundig studert. En steady-state crossover biotilgjengelighetsstudie på 22 normale menn sammenlignet to Uniphyl (vannfri teofyllin tablett) 400 mg tabletter administrert 24 timer i døgnet kl. 08.00 rett etter frokost med et referanse-teofyllinprodukt med kontrollert frigivelse administrert to ganger daglig i fôrede forsøkspersoner kl. 8.00 umiddelbart etter frokost og 20.00 rett etter middag (769 kalorier, bestående av 97 gram karbohydrater, 33 gram protein og 27 gram fett).
De farmakokinetiske parametrene for Uniphyl (vannfri teofyllin-tablett) 400 mg tabletter under disse steady-state-forholdene var AUC = 203,3 ± 87,1 mcg time/ml, Cmax = 12,1 ± 3,8 mcg/ml, Cmin = 4,80 ± 4,60 ± 4,8 ± max. timer. For referanse BID-produktet var de farmakokinetiske parameterne AUC = 219,2 ± 88,4 mcg time/mL, Cmax = 11,0 ± 4,1 mcg/ml, Cmin = 7,28 ± 3,5, Tmax = 6,9 ± 3,4 timer. Den gjennomsnittlige prosentvise fluktuasjonen [(Cmax-Cmin/Cmin)x100] = 169 % for regimet én gang daglig og 51 % for referanseproduktet BID-regimet.
Biotilgjengeligheten til 600 mg Uniphyl (vannfri teofyllin tablett) ble videre evaluert i en flerdose, steady-state studie på 26 friske menn som sammenlignet 600 mg tabletten med halvannen 400 mg Uniphyl (vannfri teofyllin tablett). Alle forsøkspersoner hadde tidligere etablert teofyllinclearance på ≤ 4 l/time og ble doseret én gang daglig i 6 dager under matforhold. Resultatene viste ingen klinisk signifikant forskjell mellom 600 mg og en og en halv 400 mg Uniphyl (vannfri teofyllin tablett)-tablettregimet. Steady-state resultater var:
Biotilgjengelighetsforholdet for 600/400 mg tabletter var 98,8 %. Under alle studieforhold er 600 mg tabletten derfor bioekvivalent med halvannen 400 mg tablett.
Studier viser at så lenge forsøkspersonene enten ble matet konsekvent eller konsekvent fastet, er det tilsvarende biotilgjengelighet ved administrering én gang daglig av Uniphyl (vannfri teofyllintablett) tabletter, enten de doseres om morgenen eller om kvelden.
Fordeling
Når teofyllin kommer inn i den systemiske sirkulasjonen, er omtrent 40 % bundet til plasmaprotein, primært albumin. Ubundet teofyllin fordeler seg gjennom kroppsvannet, men fordeler seg dårlig til kroppsfettet. Det tilsynelatende distribusjonsvolumet av teofyllin er omtrent 0,45 l/kg (område 0,3-0,7 l/kg) basert på ideell kroppsvekt. Teofyllin passerer fritt over morkaken, inn i morsmelk og inn i cerebrospinalvæsken (CSF). Spyttteofyllinkonsentrasjoner tilnærmer ubundne serumkonsentrasjoner, men er ikke pålitelige for rutinemessig eller terapeutisk overvåking med mindre spesielle teknikker brukes. En økning i distribusjonsvolumet av teofyllin, primært på grunn av reduksjon i plasmaproteinbinding, forekommer hos premature nyfødte, pasienter med levercirrhose, ukorrigert acidemi, eldre og hos kvinner i tredje trimester av svangerskapet. I slike tilfeller kan pasienten vise tegn på toksisitet ved totale (bundet+ubundet) serumkonsentrasjoner av teofyllin i det terapeutiske området (10-20 mcg/ml) på grunn av forhøyede konsentrasjoner av det farmakologisk aktive ubundne medikamentet. Tilsvarende kan en pasient med redusert teofyllinbinding ha en subterapeutisk total medikamentkonsentrasjon mens den farmakologisk aktive ubundne konsentrasjonen er i det terapeutiske området. Hvis kun total serum teofyllinkonsentrasjon måles, kan dette føre til en unødvendig og potensielt farlig doseøkning. Hos pasienter med redusert proteinbinding gir måling av ubundet teofyllinkonsentrasjon i serum en mer pålitelig måte å justere dosen på enn måling av total serumteofyllinkonsentrasjon. Generelt bør konsentrasjoner av ubundet teofyllin holdes i området 6-12 mcg/ml.
Metabolisme
Etter oral dosering gjennomgår ikke teofyllin noen målbar first-pass-eliminasjon. Hos voksne og barn over ett år metaboliseres omtrent 90 % av dosen i leveren. Biotransformasjon skjer gjennom demetylering til 1-metylxantin og 3-metylxantin og hydroksylering til 1,3-dimetylurinsyre. 1-metylxantin hydroksyleres videre, ved hjelp av xantinoksidase, til 1-metylurinsyre. Omtrent 6 % av en teofyllindose er N-metylert til koffein. Teofyllin-demetylering til 3-metylxantin katalyseres av cytokrom P-450 1A2, mens cytokrom P-450 2E1 og P-450 3A3 katalyserer hydroksyleringen til 1,3-dimetylurinsyre. Demetylering til 1-metylxantin ser ut til å være katalysert enten av cytokrom P-450 1A2 eller et nært beslektet cytokrom. Hos nyfødte er N-demetyleringsveien fraværende mens funksjonen til hydroksyleringsveien er markant mangelfull. Aktiviteten til disse banene øker sakte til maksimale nivåer ved ett års alder.
Koffein og 3-metylxantin er de eneste teofyllinmetabolittene med farmakologisk aktivitet. 3-metylxantin har omtrent en tidel av den farmakologiske aktiviteten til teofyllin og serumkonsentrasjoner hos voksne med normal nyrefunksjon er
Både N-demetylerings- og hydroksyleringsveiene for biotransformasjon av teofyllin er kapasitetsbegrenset. På grunn av den store variasjonen mellom individene i hastigheten på teofyllinmetabolisme, kan ikke-linearitet av eliminering begynne hos noen pasienter ved serumteofyllinkonsentrasjoner DOSERING OG ADMINISTRASJON, Tabell VI ). Nøyaktig prediksjon av doseavhengighet av teofyllinmetabolismen hos pasienter a priori er ikke mulig, men pasienter med svært høy initial clearance rate (dvs. lave steady-state serum teofyllinkonsentrasjoner ved over gjennomsnittlige doser) har størst sannsynlighet for å oppleve store endringer i serum teofyllinkonsentrasjon som respons på doseendringer.
Utskillelse
Hos nyfødte utskilles omtrent 50 % av teofyllindosen uendret i urinen. Utover de tre første levemånedene utskilles omtrent 10 % av teofyllindosen uendret i urinen. Resten skilles ut i urinen hovedsakelig som 1,3-dimetylurinsyre (35-40%), 1-metylurinsyre (20-25%) og 3-metylxantin (15-20%). Siden lite teofyllin skilles ut uforandret i urinen og siden aktive metabolitter av teofyllin (dvs. koffein, 3-metylxantin) ikke akkumuleres til klinisk signifikante nivåer selv i møte med sluttstadium nyresykdom, er det ikke nødvendig med dosejustering for nyreinsuffisiens. hos voksne og barn > 3 måneder. I motsetning til dette krever den store andelen av teofyllindosen som skilles ut i urinen som uendret teofyllin og koffein hos nyfødte nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serumkonsentrasjoner av teofyllin hos nyfødte med redusert nyrefunksjon (se pkt. ADVARSLER ).
Serumkonsentrasjoner ved Steady-State
Etter gjentatte doser av teofyllin oppnås steady-state i løpet av 30-65 timer (gjennomsnittlig 40 timer) hos voksne. Ved steady-state, på et doseringsregime med 24-timers intervaller, er forventet gjennomsnittlig bunnkonsentrasjon ca. 50 % av gjennomsnittlig toppkonsentrasjon, forutsatt en gjennomsnittlig teofyllinhalveringstid på 8 timer. Forskjellen mellom topp- og bunnkonsentrasjoner er større hos pasienter med raskere teofyllinclearance. Hos disse pasientene kan administrering av Uniphyl (vannfri teofyllin tablett) ® være nødvendig oftere (hver 12. time).
Spesielle populasjoner (se tabell I for gjennomsnittlig clearance og halveringstid)
Geriatrisk
Clearance av teofyllin er redusert med gjennomsnittlig 30 % hos friske eldre voksne (> 60 år) sammenlignet med friske unge voksne. Nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serum teofyllinkonsentrasjoner er nødvendig hos eldre pasienter (se ADVARSLER ).
Pediatri
Clearance av teofyllin er svært lav hos nyfødte (se ADVARSLER ). Teofyllinclearance når maksimale verdier ved ett års alder, forblir relativt konstant til ca. 9 år og avtar deretter sakte med ca. 50 % til voksenverdier ved ca. 16 år. Renal utskillelse av uendret teofyllin hos nyfødte utgjør ca. 50 % av dose, sammenlignet med ca. 10 % hos barn eldre enn tre måneder og hos voksne. Nøye oppmerksomhet til doseringsvalg og overvåking av serum teofyllinkonsentrasjoner er nødvendig hos pediatriske pasienter (se ADVARSLER og DOSERING OG ADMINISTRASJON ).
Kjønn
Kjønnsforskjeller i teofyllinclearance er relativt små og vil neppe være av klinisk betydning. Signifikant reduksjon i teofyllinclearance er imidlertid rapportert hos kvinner på den 20. dagen av menstruasjonssyklusen og i tredje trimester av svangerskapet.
Løp
Farmakokinetiske forskjeller i teofyllinclearance på grunn av rase er ikke studert.
Nyreinsuffisiens
Bare en liten brøkdel, f.eks. ca. 10 %, av den administrerte teofyllindosen utskilles uendret i urinen hos barn eldre enn tre måneder og voksne. Siden lite teofyllin skilles ut uendret i urinen og siden aktive metabolitter av teofyllin (dvs. koffein, 3-metylxantin) ikke akkumuleres til klinisk signifikante nivåer selv i møte med nyresykdom i sluttstadiet, er det ikke nødvendig med dosejustering for nyreinsuffisiens hos voksne og barn > 3 måneder. I motsetning til dette utskilles omtrent 50 % av den administrerte teofyllindosen uendret i urinen hos nyfødte. Nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serum teofyllinkonsentrasjoner er nødvendig hos nyfødte med nedsatt nyrefunksjon (se ADVARSLER ).
Leverinsuffisiens
Teofyllinclearance reduseres med 50 % eller mer hos pasienter med leverinsuffisiens (f.eks. skrumplever, akutt hepatitt, kolestase). Nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serum teofyllinkonsentrasjoner er nødvendig hos pasienter med redusert leverfunksjon (se ADVARSLER ).
Kongestiv hjertesvikt (CHF)
Teofyllinclearance er redusert med 50 % eller mer hos pasienter med CHF. Graden av reduksjon i teofyllinclearance hos pasienter med CHF ser ut til å være direkte korrelert til alvorlighetsgraden av hjertesykdommen. Siden teofyllinclearance er uavhengig av leverens blodstrøm, ser reduksjonen i clearance ut til å skyldes nedsatt hepatocyttfunksjon snarere enn redusert perfusjon. Nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serum teofyllinkonsentrasjoner er nødvendig hos pasienter med CHF (se ADVARSLER ).
Røykere
Røyking av tobakk og marihuana ser ut til å øke clearance av teofyllin ved induksjon av metabolske veier. Teofyllinclearance har vist seg å øke med omtrent 50 % hos unge voksne tobakksrøykere og med omtrent 80 % hos eldre tobakksrøykere sammenlignet med ikke-røykere. Passiv røykeksponering har også vist seg å øke teofyllinclearance med opptil 50 %. Avholdenhet fra tobakksrøyking i én uke fører til en reduksjon på ca. 40 % i teofyllinclearance. Nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serum teofyllinkonsentrasjoner er nødvendig hos pasienter som slutter å røyke (se ADVARSLER ). Bruk av nikotintyggegummi har vist seg å ikke ha noen effekt på teofyllinclearance.
Feber
Feber, uavhengig av dens underliggende årsak, kan redusere clearance av teofyllin. Størrelsen og varigheten av feberen ser ut til å være direkte korrelert med graden av reduksjon av teofyllinclearance. Nøyaktige data mangler, men en temperatur på 39 °C (102 °F) i minst 24 timer er sannsynligvis nødvendig for å gi en klinisk signifikant økning i serumteofyllinkonsentrasjoner. Barn med raske rater av teofyllinclearance (dvs. de som trenger en dose som er vesentlig større enn gjennomsnittet [f.eks > 22 mg/kg/dag] for å oppnå en terapeutisk topp serum-teofyllinkonsentrasjon når de er afebrile) kan ha større risiko for toksisk effekter fra redusert clearance under vedvarende feber. Nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serum teofyllinkonsentrasjoner er nødvendig hos pasienter med vedvarende feber (se ADVARSLER ).
Diverse
Andre faktorer assosiert med redusert teofyllinclearance inkluderer tredje trimester av svangerskapet, sepsis med multippel organsvikt og hypotyreose. Nøye oppmerksomhet til dosereduksjon og hyppig overvåking av serum teofyllinkonsentrasjoner er nødvendig hos pasienter med noen av disse tilstandene (se ADVARSLER ). Andre faktorer assosiert med økt teofyllinclearance inkluderer hypertyreose og cystisk fibrose.
Kliniske studier
Hos pasienter med kronisk astma, inkludert pasienter med alvorlig astma som krever inhalerte kortikosteroider eller orale kortikosteroider for vekselvis dag, har mange kliniske studier vist at teofyllin reduserer hyppigheten og alvorlighetsgraden av symptomene, inkludert nattlige eksaserbasjoner, og reduserer bruken av inhalert "etter behov". beta-2 agonister. Teofyllin har også vist seg å redusere behovet for korte kurer med daglig oral prednison for å lindre forverringer av luftveisobstruksjon som ikke reagerer på bronkodilatatorer hos astmatikere.
Hos pasienter med kronisk obstruktiv lungesykdom (KOLS) har kliniske studier vist at teofyllin reduserer dyspné, luftfangst, pustearbeidet og forbedrer kontraktiliteten til diafragmamuskler med liten eller ingen forbedring i målinger av lungefunksjon.
PASIENTINFORMASJON
Pasienten (eller forelder/omsorgsperson) bør instrueres om å søke lege når det oppstår kvalme, oppkast, vedvarende hodepine, søvnløshet eller rask hjerterytme under behandling med teofyllin, selv om det er mistanke om en annen årsak. Pasienten bør instrueres om å kontakte helsepersonell dersom de utvikler en ny sykdom, spesielt hvis de er ledsaget av vedvarende feber, hvis de opplever forverring av en kronisk sykdom, hvis de begynner eller slutter å røyke sigaretter eller marihuana, eller hvis et annet helsepersonell legger til en ny medisin eller avbryter en tidligere foreskrevet medisin. Pasienter bør informeres om at teofyllin interagerer med en lang rekke legemidler (se tabell II). Kosttilskuddet johannesurt (Hypericum perforatum) bør ikke tas samtidig med teofyllin, siden det kan føre til reduserte teofyllinnivåer. Hvis pasienter allerede tar johannesurt og teofyllin sammen, bør de konsultere helsepersonell før de slutter med johannesurt, siden teofyllinkonsentrasjonen kan øke når dette gjøres, noe som resulterer i toksisitet. Pasienter bør instrueres om å informere alt helsepersonell som er involvert i deres omsorg om at de tar teofyllin, spesielt når en medisin legges til eller slettes fra behandlingen. Pasienter bør instrueres om å ikke endre dosen, tidspunktet for dosen eller administreringsfrekvensen uten først å konsultere helsepersonell. Hvis en dose glemmes, bør pasienten instrueres om å ta neste dose til det vanligvis planlagte tidspunktet og ikke forsøke å gjøre opp for den glemte dosen.
Uniphyl (vannfri teofyllin tablett) ® Tabletter kan tas en gang daglig om morgenen eller kvelden. Det anbefales at Uniphyl (vannfri teofyllintablett) tas sammen med måltider. Pasienter bør informeres om at hvis de velger å ta Uniphyl (vannfri teofyllintablett) sammen med mat, bør den tas konsekvent med mat, og hvis de tar den i fastende tilstand, bør den rutinemessig tas fastende. Det er viktig at produktet alltid doseres konsekvent med eller uten mat.
Uniphyl (vannfri teofyllintablett) Tabletter skal ikke tygges eller knuses fordi det kan føre til en rask frigjøring av teofyllin med potensiell toksisitet. Den skårede tabletten kan deles. Pasienter som får Uniphyl (vannfri teofyllintablett) tabletter kan passere en intakt matrisetablett i avføringen eller via kolostomi. Disse matrisetablettene inneholder vanligvis lite eller ingen rester av teofyllin.
