Medisiner mot psykiske lidelser: Strattera 10mg, 18mg, 25mg, 40mg Atomoxetine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Strattera 40mg og hvordan brukes det?
Strattera er en reseptbelagt medisin som brukes til å behandle symptomene på oppmerksomhetssvikt/hyperaktivitetsforstyrrelse (ADHD). Strattera 18mg kan brukes alene eller sammen med andre medisiner.
Strattera 10mg er en selektiv noradrenalin-reopptakshemmer.
Det er ikke kjent om Strattera er trygt og effektivt hos barn under 2 år.
Hva er de mulige bivirkningene av Strattera?
Strattera 25mg kan forårsake alvorlige bivirkninger inkludert:
- . brystsmerter, . problemer med å puste, . svimmelhet, . hallusinasjoner, . nye atferdsproblemer, . aggresjon, . fiendtlighet, . paranoia, . magesmerter, . kløe, . influensalignende symptomer, . mørk urin, . gulsott (gulfarging av hud eller øyne), . smertefull eller vanskelig vannlating, og . ereksjon som er smertefull eller varer lenger enn 4 timer
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Strattera 40mg inkluderer:
- . kvalme, . oppkast, . urolig mage, . forstoppelse, . tørr i munnen, . tap av Appetit, . humørsvingninger, . føler meg sliten, . svimmelhet, . vannlatingsproblemer, og . impotens, problemer med å få ereksjon,
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Strattera. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
SELVMIDSIDEASJONER HOS BARN OG UNGDOMMER
STRATTERA (atomoksetin) økte risikoen for selvmordstanker i korttidsstudier hos barn eller ungdom med oppmerksomhetssvikt/hyperaktivitetsforstyrrelse (ADHD). Alle som vurderer bruk av STRATTERA 18mg hos barn eller ungdom må balansere denne risikoen med det kliniske behovet. Komorbiditeter som oppstår med ADHD kan være assosiert med en økning i risikoen for selvmordstanker og/eller selvmordsatferd. Pasienter som starter på behandling bør overvåkes nøye for suicidalitet (suicidal tenkning og atferd), klinisk forverring eller uvanlige endringer i atferd. Familier og omsorgspersoner bør informeres om behovet for tett observasjon og kommunikasjon med forskriveren. STRATTERA 10mg er godkjent for ADHD hos pediatriske og voksne pasienter. STRATTERA 40mg er ikke godkjent for alvorlig depressiv lidelse. Samlede analyser av korttids (6 til 18 uker) placebokontrollerte studier av STRATTERA 10 mg hos barn og ungdom (totalt 12 studier som involverte over 2200 pasienter, inkludert 11 studier med ADHD og 1 studie med enurese) har avdekket en større risiko av selvmordstanker tidlig under behandlingen hos de som fikk STRATTERA sammenlignet med placebo. Gjennomsnittlig risiko for selvmordstanker hos pasienter som fikk STRATTERA 25 mg var 0,4 % (5/1357 pasienter), sammenlignet med ingen hos placebobehandlede pasienter (851 pasienter). Ingen selvmord skjedde i disse forsøkene [se ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
STRATTERA® (atomoksetin) er en selektiv noradrenalin-reopptakshemmer. Atomoksetin-HCl er R(-)-isomeren bestemt ved røntgendiffraksjon. Den kjemiske betegnelsen er (-)-N-metyl-3-fenyl-3-(o-tolyloksy)-propylaminhydroklorid. Molekylformelen er C17H21NO•HCl, som tilsvarer en molekylvekt på 291,82. Den kjemiske strukturen er:
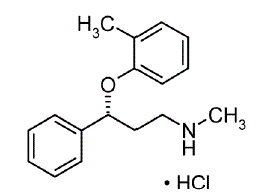
Atomoxetine HCl er et hvitt til praktisk talt hvitt fast stoff, som har en løselighet på 27,8 mg/ml i vann.
STRATTERA kapsler er kun beregnet for oral administrering.
Hver kapsel inneholder atomoksetin HCl tilsvarende 10, 18, 25, 40, 60, 80 eller 100 mg atomoksetin. Kapslene inneholder også pregelatinisert stivelse og dimetikon. Kapselskallene inneholder gelatin, natriumlaurylsulfat og andre inaktive ingredienser. Kapselskallene inneholder også ett eller flere av følgende:
FD&C Blue No. 2, syntetisk gult jernoksid, titandioksid, rødt jernoksid. Kapslene er påtrykt spiselig svart blekk.
INDIKASJONER
Attention Deficit/Hyperactivity Disorder (ADHD)
STRATTERA 25mg er indisert for behandling av oppmerksomhetssvikt/hyperaktivitetsforstyrrelse (ADHD).
Effekten av STRATTERA kapsler ble fastslått i syv kliniske studier hos polikliniske pasienter med ADHD: fire 6 til 9 ukers studier hos pediatriske pasienter (alder 6 til 18), to 10-ukers forsøk hos voksne og en vedlikeholdsstudie i pediatri (6 år). til 15) [se Kliniske studier ].
Diagnostiske hensyn
En diagnose av ADHD (DSM-IV) innebærer tilstedeværelsen av hyperaktive-impulsive eller uoppmerksomme symptomer som forårsaker svekkelse og som var tilstede før fylte 7 år. Symptomene må være vedvarende, må være mer alvorlige enn det som vanligvis observeres hos individer på et sammenlignbart utviklingsnivå, må forårsake klinisk signifikant svekkelse, for eksempel i sosial, akademisk eller yrkesmessig funksjon, og må være tilstede i 2 eller flere settinger, f.eks. skole (eller jobb) og hjemme. Symptomene må ikke forklares bedre av en annen psykisk lidelse.
Den spesifikke etiologien til ADHD er ukjent, og det er ingen enkelt diagnostisk test. Adekvat diagnose krever bruk ikke bare av medisinske, men også spesielle psykologiske, pedagogiske og sosiale ressurser. Læring kan være svekket eller ikke. Diagnosen må være basert på en fullstendig anamnese og evaluering av pasienten og ikke bare på tilstedeværelsen av det nødvendige antallet DSM-IV-karakteristikker.
For den uoppmerksomme typen må minst 6 av følgende symptomer ha vedvart i minst 6 måneder: mangel på oppmerksomhet på detaljer/forsiktige feil, mangel på vedvarende oppmerksomhet, dårlig lytter, manglende gjennomføring av oppgaver, dårlig organisering, unngår oppgaver krever vedvarende mental innsats, mister ting, lett distrahert, glemsom. For den hyperaktive-impulsive typen, må minst 6 av følgende symptomer ha vedvart i minst 6 måneder: fiksing/virring, forlate setet, upassende løping/klatring, problemer med rolige aktiviteter, «på farten», overdreven prat, blurting svar, kan ikke vente tur, påtrengende. For en kombinert type diagnose må både uoppmerksomme og hyperaktiv-impulsive kriterier være oppfylt.
Behov for omfattende behandlingsprogram
STRATTERA 18mg er indisert som en integrert del av et totalt behandlingsprogram for ADHD som kan inkludere andre tiltak (psykologiske, pedagogiske, sosiale) for pasienter med dette syndromet. Medikamentell behandling er kanskje ikke indisert for alle pasienter med dette syndromet. Medikamentell behandling er ikke beregnet på bruk hos pasienter som viser symptomer sekundært til miljøfaktorer og/eller andre primære psykiatriske lidelser, inkludert psykose. Riktig pedagogisk plassering er avgjørende for barn og unge med denne diagnosen, og psykososial intervensjon er ofte nyttig. NÅR korrigerende tiltak alene er utilstrekkelige, vil beslutningen om å foreskrive medikamentell behandling avhenge av legens vurdering av kroniske karakter og alvorlighetsgrad av pasientens symptomer.
DOSERING OG ADMINISTRASJON
Akutt behandling
Dosering av barn og ungdom opptil 70 kg kroppsvekt
STRATTERA 40 mg bør initieres med en total daglig dose på ca. 0,5 mg/kg og økes etter minimum 3 dager til en mål total daglig dose på ca. 1,2 mg/kg administrert enten som en enkelt daglig dose om morgenen eller som jevnt fordelt doser om morgenen og sen ettermiddag/tidlig kveld. Ingen ytterligere fordel er vist for doser høyere enn 1,2 mg/kg/dag [se Kliniske studier ].
Den totale daglige dosen til barn og ungdom bør ikke overstige 1,4 mg/kg eller 100 mg, avhengig av hva som er lavere.
Dosering Av Barn Og Ungdom Over 70 kg Kroppsvekt Og Voksne
STRATTERA 18 mg bør startes med en total daglig dose på 40 mg og økes etter minimum 3 dager til en mål total daglig dose på ca. 80 mg administrert enten som en enkelt daglig dose om morgenen eller som jevnt fordelte doser om morgenen og sen ettermiddag/tidlig kveld. Etter 2 til 4 ekstra uker kan dosen økes til maksimalt 100 mg hos pasienter som ikke har oppnådd optimal respons. Det er ingen data som støtter økt effektivitet ved høyere doser [se Kliniske studier ].
Maksimal anbefalt total daglig dose for barn og ungdom over 70 kg og voksne er 100 mg.
Vedlikehold/utvidet behandling
Det er generelt enighet om at farmakologisk behandling av ADHD kan være nødvendig i lengre perioder. Fordelen med å opprettholde pediatriske pasienter (i alderen 6-15 år) med ADHD på STRATTERA 18 mg etter å ha oppnådd respons i et doseområde på 1,2 til 1,8 mg/kg/dag ble vist i en kontrollert studie. Pasienter som ble tildelt STRATTERA i vedlikeholdsfasen ble vanligvis fortsatt med samme dose som ble brukt for å oppnå respons i den åpne fasen. Legen som velger å bruke STRATTERA i lengre perioder bør med jevne mellomrom revurdere den langsiktige nytten av stoffet for den enkelte pasient [se Kliniske studier ].
Generell doseringsinformasjon
STRATTERA kan tas med eller uten mat.
STRATTERA 40 mg kan seponeres uten å trappes ned.
STRATTERA kapsler er ikke ment å åpnes, de skal tas hele [se PASIENTINFORMASJON ].
Sikkerheten til enkeltdoser over 120 mg og totale daglige doser over 150 mg har ikke blitt systematisk evaluert.
Dosering i spesifikke populasjoner
Dosejustering for pasienter med nedsatt leverfunksjon
For de ADHD-pasienter som har leversvikt (HI), anbefales dosejustering som følger: For pasienter med moderat HI (Child-Pugh klasse B) bør start- og måldoser reduseres til 50 % av normal dose (for pasienter uten HI). For pasienter med alvorlig HI (Child-Pugh klasse C), bør startdose og måldoser reduseres til 25 % av normal [se Bruk i spesifikke populasjoner ].
Dosejustering for bruk med en sterk CYP2D6-hemmer eller hos pasienter som er kjent for å være CYP2D6 PM
Hos barn og ungdom opp til 70 kg kroppsvekt administrert sterke CYP2D6-hemmere, f.eks. paroksetin, fluoksetin og kinidin, eller hos pasienter som er kjent for å være CYP2D6 PMs, bør STRATTERA initieres med 0,5 mg/kg/dag og kun økes til den vanlige måldosen på 1,2 mg/kg/dag hvis symptomene ikke bedrer seg etter 4 uker og startdosen tolereres godt.
Hos barn og ungdom over 70 kg kroppsvekt og voksne som får sterke CYP2D6-hemmere, f.eks. paroksetin, fluoksetin og kinidin, bør STRATTERA initieres med 40 mg/dag og kun økes til vanlig måldose på 80 mg/dag hvis symptomene svikter. forbedres etter 4 uker og startdosen tolereres godt.
HVORDAN LEVERES
Doseringsformer og styrker
Hver kapsel inneholder atomoksetin HCl tilsvarende 10 mg (ugjennomsiktig hvit, ugjennomsiktig hvit), 18 mg (gull, ugjennomsiktig hvit), 25 mg (ugjennomsiktig blå, ugjennomsiktig hvit), 40 mg (ugjennomsiktig blå, ugjennomsiktig blå), 60 mg (ugjennomsiktig Blå, Gull), 80 mg (ugjennomsiktig brun, ugjennomsiktig hvit), eller 100 mg (ugjennomsiktig brun, ugjennomsiktig brun) atomoksetin.
Oppbevaring og håndtering
Oppbevares ved 25°C (77°F); utflukter tillatt til 15° til 30°C (59° til 86°F) [se USP kontrollert romtemperatur].
Markedsført av: Lilly USA, LLC Indianapolis, IN 46285, USA. Revidert: mai 2017.
BIVIRKNINGER
Erfaring fra kliniske forsøk
STRATTERA 10 mg ble administrert til 5382 barn eller ungdomspasienter med ADHD og 1007 voksne med ADHD i kliniske studier. Under de kliniske studiene med ADHD ble 1625 barn og ungdomspasienter behandlet i mer enn 1 år og 2529 barn og ungdomspasienter ble behandlet i over 6 måneder.
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Kliniske studier for barn og ungdom
Årsaker til seponering av behandling på grunn av uønskede reaksjoner i kliniske studier for barn og ungdom
akutte placebokontrollerte studier for barn og ungdom, avbrøt 3,0 % (48/1613) av atomoksetin-personene og 1,4 % (13/945) placebo-pasientene på grunn av bivirkninger. For alle studier, (inkludert åpne og langtidsstudier), avbrøt 6,3 % av pasientene med omfattende metabolisering (EM) og 11,2 % av pasientene med dårlig metabolisering (PM) på grunn av en bivirkning. Blant STRATTERA-behandlede pasienter, irritabilitet (0,3 %, N=5); somnolens (0,3 %, N=5); aggresjon (0,2%, N=4); kvalme (0,2%, N=4); oppkast (0,2%, N=4); magesmerter (0,2 %, N=4); obstipasjon (0,1%, N=2); tretthet (0,1%, N=2); unormal følelse (0,1 %, N=2); og hodepine (0,1 %, N=2) var årsakene til seponering rapportert av mer enn 1 pasient.
Anfall
STRATTERA har ikke blitt systematisk evaluert hos pediatriske pasienter med anfallsforstyrrelser, da disse pasientene ble ekskludert fra kliniske studier under produktets premarket testing. I det kliniske utviklingsprogrammet ble anfall rapportert hos 0,2 % (12/5073) av barn med gjennomsnittsalder på 10 år (spredning 6 til 16 år). I disse kliniske studiene var anfallsrisikoen blant dårlige metaboliserere 0,3 % (1/293) sammenlignet med 0,2 % (11/4741) for omfattende metabolisatorer.
Vanlige observerte bivirkninger i akutte barn og unge, placebokontrollerte forsøk
Vanlige observerte bivirkninger assosiert med bruk av STRATTERA (forekomst på 2 % eller mer) og som ikke er observert med tilsvarende forekomst blant placebo-behandlede pasienter (STRATTERA 40 mg forekomst høyere enn placebo) er oppført i tabell 2. Resultatene var like i BID og QD-studien bortsett fra som vist i tabell 3, som viser både BID- og QD-resultater for utvalgte bivirkninger basert på statistisk signifikante Breslow-Day-tester. De vanligst observerte bivirkningene hos pasienter behandlet med STRATTERA (forekomst på 5 % eller høyere og minst to ganger forekomsten hos placebopasienter, for enten BID- eller QD-dosering) var: kvalme, oppkast, tretthet, nedsatt appetitt, magesmerter og somnolens (se tabell 2 og 3).
Ytterligere data fra ADHD kliniske studier (kontrollerte og ukontrollerte) har vist at omtrent 5 til 10 % av pediatriske pasienter opplevde potensielt klinisk viktige endringer i hjertefrekvens (≥20 slag per min) eller blodtrykk (≥15 til 20 mm Hg) [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Følgende bivirkninger forekom hos minst 2 % av CYP2D6 PM-pasienter hos barn og ungdom og var statistisk signifikant hyppigere hos PM-pasienter sammenlignet med CYP2D6 EM-pasienter: søvnløshet (11 % av PM, 6 % av EM); vekten gikk ned (7 % av PM, 4 % av EM); forstoppelse (7 % av PM, 4 % av EM); depresjon1 (7 % av PM, 4 % av EM); tremor (5 % av PM, 1 % av EM); ekskoriasjon (4 % av PM, 2 % av EM); middels søvnløshet (3 % av PM, 1 % av EM); konjunktivitt (3 % av PM, 1 % av EM); synkope (3 % av PM, 1 % av EM); tidlig morgenoppvåkning (2 % av PM, 1 % av EM); mydriasis (2 % av PM, 1 % av EM); sedasjon (4 % av PM, 2 % av EM).
1Depresjon inkluderer følgende begreper: depresjon, alvorlig depresjon, depressive symptomer, deprimert humør, dysfori.
Voksen kliniske forsøk
Årsaker til seponering av behandling på grunn av uønskede reaksjoner i akutte placebokontrollerte studier for voksne
de akutte, placebokontrollerte studiene for voksne, avbrøt 11,3 % (61/541) atomoksetinpasienter og 3,0 % (12/405) placebopasienter på grunn av bivirkninger. Blant STRATTERA-behandlede pasienter, søvnløshet (0,9 %, N=5); kvalme (0,9 %, N=5); brystsmerter (0,6 %, N=3); tretthet (0,6%, N=3); angst (0,4 %, N=2); erektil dysfunksjon (0,4 %, N=2); humørsvingninger (0,4 %, N=2); nervøsitet (0,4 %, N=2); hjertebank (0,4%, N=2); og urinretensjon (0,4 %, N=2) var årsakene til seponering rapportert av mer enn 1 pasient.
Anfall
STRATTERA har ikke blitt systematisk evaluert hos voksne pasienter med anfallsforstyrrelse da disse pasientene ble ekskludert fra kliniske studier under produktets premarket testing. I det kliniske utviklingsprogrammet ble det rapportert anfall hos 0,1 % (1/748) av voksne pasienter. I disse kliniske studiene rapporterte ingen dårlige metabolisatorer (0/43) anfall sammenlignet med 0,1 % (1/705) for omfattende metabolisatorer.
Vanlige observerte bivirkninger i akutte placebokontrollerte studier for voksne
Vanlige observerte bivirkninger assosiert med bruk av STRATTERA (forekomst på 2 % eller mer) og som ikke er observert ved en tilsvarende forekomst blant placebo-behandlede pasienter (STRATTERA 25 mg forekomst større enn placebo) er oppført i tabell 4. De vanligst observerte bivirkningene hos pasienter behandlet med STRATTERA (insidens på 5 % eller høyere og minst dobbelt så høy forekomst hos placebopasienter) var: forstoppelse, munntørrhet, kvalme, nedsatt appetitt, svimmelhet, erektil dysfunksjon og urinnøling (se tabell 4). Ytterligere data fra ADHD kliniske studier (kontrollerte og ukontrollerte) har vist at omtrent 5 til 10 % av voksne pasienter opplevde potensielt klinisk viktige endringer i hjertefrekvens (≥20 slag per min) eller blodtrykk (≥15 til 20 mm Hg) [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Følgende bivirkninger forekom hos minst 2 % av voksne CYP2D6-pasienter med dårlig metabolisme (PM) og var statistisk signifikant hyppigere hos PM-pasienter sammenlignet med CYP2D6-ekstensive metaboliser (EM)-pasienter: uskarpt syn (4 % av PM-er, 1 % av EM-er) ); tørr munn (35 % av PM, 17 % av EM); forstoppelse (11 % av PM, 7 % av EM); følelse av nervøsitet (5 % av PM, 2 % av EM); redusert appetitt (23 % av PM, 15 % av EM); tremor (5 % av PM, 1 % av EM); søvnløshet (19 % av PM, 11 % av EM); søvnforstyrrelser (7 % av PM, 3 % av EM); middels søvnløshet (5 % av PM, 3 % av EM); terminal søvnløshet (3 % av PM, 1 % av EM); urinretensjon (6 % av PM, 1 % av EM); erektil dysfunksjon (21 % av PM, 9 % av EM); ejakulasjonsforstyrrelse (6 % av PM, 2 % av EM); hyperhidrose (15 % av PM, 7 % av EM); perifer kulde (3 % av PM, 1 % av EM).
Mannlig og kvinnelig seksuell dysfunksjon
Atomoksetin ser ut til å svekke seksuell funksjon hos noen pasienter. Endringer i seksuell lyst, seksuell ytelse og seksuell tilfredshet er ikke godt vurdert i de fleste kliniske studier fordi de trenger spesiell oppmerksomhet og fordi pasienter og leger kan være motvillige til å diskutere dem. Følgelig vil estimater av forekomsten av uønsket seksuell opplevelse og ytelse som er sitert i produktmerking sannsynligvis undervurdere den faktiske forekomsten. Tabell 4 ovenfor viser forekomsten av seksuelle bivirkninger rapportert av minst 2 % av voksne pasienter som tar STRATTERA i placebokontrollerte studier.
Det er ingen tilstrekkelige og godt kontrollerte studier som undersøker seksuell dysfunksjon med STRATTERA 40 mg behandling. Selv om det er vanskelig å vite den nøyaktige risikoen for seksuell dysfunksjon forbundet med bruk av STRATTERA 40 mg, bør leger rutinemessig spørre om slike mulige bivirkninger.
Spontanrapporter etter markedsføring
Følgende bivirkninger er identifisert under bruk av STRATTERA etter godkjenning. Med mindre annet er spesifisert, har disse bivirkningene forekommet hos voksne og barn og ungdom. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Sirkulasjonssystem - QT-forlengelse, synkope.
Perifere vaskulære effekter - Raynauds fenomen.
Generelle lidelser og tilstander på administrasjonsstedet - Sløvhet.
Muskel- og skjelettsystemet - Rabdomyolyse.
Forstyrrelser i nervesystemet - Hypoestesi; parestesi hos barn og ungdom; sensoriske forstyrrelser; tics.
Psykiatriske lidelser - Depresjon og deprimert humør; angst, libido endringer.
Anfall Det er rapportert om anfall i perioden etter markedsføring. Anfallstilfellene etter markedsføring inkluderer pasienter med allerede eksisterende anfallsforstyrrelser og de med identifiserte risikofaktorer for anfall, samt pasienter med verken en historie med eller identifiserte risikofaktorer for anfall. Den nøyaktige sammenhengen mellom STRATTERA 40mg og anfall er vanskelig å evaluere på grunn av usikkerhet om bakgrunnsrisikoen for anfall hos ADHD-pasienter.
Hud- og subkutane vevssykdommer - Alopecia, hyperhidrose.
Urogenital system - Mannlige bekkensmerter; urinnøling hos barn og ungdom; urinretensjon hos barn og ungdom.
NARKOTIKAHANDEL
Monoaminoksidasehemmere
Med andre legemidler som påvirker hjernens monoaminkonsentrasjoner, har det vært rapportert om alvorlige, noen ganger dødelige reaksjoner (inkludert hypertermi, rigiditet, myoklonus, autonom ustabilitet med mulige raske svingninger av vitale tegn, og mental statusendringer som inkluderer ekstrem agitasjon som utvikler seg til delirium og koma. ) når det tas i kombinasjon med en MAO-hemmer. Noen tilfeller presentert med trekk som ligner malignt nevroleptikasyndrom. Slike reaksjoner kan oppstå når disse legemidlene gis samtidig eller i umiddelbar nærhet [se KONTRAINDIKASJONER ].
Effekt av CYP2D6-hemmere på atomoksetin
Hos ekstensive metabolisatorer (EMs), øker hemmere av CYP2D6 (f.eks. paroksetin, fluoksetin og kinidin) atomoksetin steady-state plasmakonsentrasjoner til eksponeringer tilsvarende de som er observert hos lavt metaboliserte (PM). Hos EM-individer behandlet med paroksetin eller fluoksetin er AUC for atomoksetin omtrent 6 til 8 ganger og Css, max er omtrent 3 til 4 ganger større enn atomoksetin alene.
In vitro-studier tyder på at samtidig administrering av cytokrom P450-hemmere til PM ikke vil øke plasmakonsentrasjonen av atomoksetin.
Antihypertensiva og pressormidler
På grunn av mulige effekter på blodtrykket, bør STRATTERA brukes med forsiktighet sammen med antihypertensiva og pressormidler (f.eks. dopamin, dobutamin) eller andre legemidler som øker blodtrykket.
Albuterol
STRATTERA bør administreres med forsiktighet til pasienter som behandles med systemisk administrert (oralt eller intravenøst) albuterol (eller andre beta2-agonister) fordi virkningen av albuterol på det kardiovaskulære systemet kan forsterkes og resultere i økning i hjertefrekvens og blodtrykk. Albuterol (600 mcg iv over 2 timer) induserte økninger i hjertefrekvens og blodtrykk. Disse effektene ble forsterket av atomoksetin (60 mg to ganger daglig i 5 dager) og var mest markert etter den første samtidige administreringen av albuterol og atomoksetin. Disse effektene på hjertefrekvens og blodtrykk ble imidlertid ikke sett i en annen studie etter samtidig administrering med inhalert dose av albuterol (200-800 mikrogram) og atomoksetin (80 mg daglig i 5 dager) hos 21 friske asiatiske personer som ble ekskludert for dårlige personer. metabolisatorstatus.
Effekt av Atomoxetine på P450-enzymer
Atomoksetin forårsaket ikke klinisk viktig hemming eller induksjon av cytokrom P450-enzymer, inkludert CYP1A2, CYP3A, CYP2D6 og CYP2C9.
CYP3A-substrat (f.eks. Midazolam)
Samtidig administrering av STRATTERA (60 mg BID i 12 dager) med midazolam, en modellforbindelse for CYP3A4-metaboliserte legemidler (enkeltdose på 5 mg), resulterte i 15 % økning i AUC for midazolam. Ingen dosejustering anbefales for legemidler som metaboliseres av CYP3A.
CYP2D6-substrat (f.eks. Desipramin)
Samtidig administrering av STRATTERA (40 eller 60 mg BID i 13 dager) med desipramin, en modellforbindelse for CYP2D6-metaboliserte legemidler (enkeltdose på 50 mg), endret ikke farmakokinetikken til desipramin. Ingen dosejustering anbefales for legemidler som metaboliseres av CYP2D6.
Alkohol
Inntak av etanol med STRATTERA 18 mg endret ikke ruseffekten av etanol.
Metylfenidat
Samtidig administrering av metylfenidat og STRATTERA 18 mg økte ikke kardiovaskulære effekter utover det som ble sett med metylfenidat alene.
Legemidler som er sterkt bundet til plasmaprotein
In vitro legemiddelfortrengningsstudier ble utført med atomoksetin og andre sterkt bundne legemidler i terapeutiske konsentrasjoner. Atomoksetin påvirket ikke bindingen av warfarin, acetylsalisylsyre, fenytoin eller diazepam til humant albumin. Tilsvarende påvirket ikke disse forbindelsene bindingen av atomoksetin til humant albumin.
Legemidler som påvirker gastrisk pH
Legemidler som øker mage-pH (magnesiumhydroksid/aluminiumhydroksid, omeprazol) hadde ingen effekt på STRATTERA biotilgjengelighet.
Narkotikamisbruk og avhengighet
Kontrollert stoff
STRATTERA er ikke et kontrollert stoff.
Misbruke
I en randomisert, dobbeltblind, placebokontrollert, misbrukspotensialstudie hos voksne som sammenlignet effekten av STRATTERA og placebo, var STRATTERA ikke assosiert med et responsmønster som antydet stimulerende eller euforiserende egenskaper.
Avhengighet
Data fra kliniske studier hos over 2000 barn, ungdom og voksne med ADHD og over 1200 voksne med depresjon viste kun isolerte hendelser med avledning av medikamenter eller upassende selvadministrasjon assosiert med STRATTERA. Det var ingen tegn på symptomrebound eller bivirkninger som tydet på seponering av medikament eller abstinenssyndrom.
Dyreopplevelse
Studier av narkotikadiskriminering hos rotter og aper viste inkonsekvent stimulusgeneralisering mellom atomoksetin og kokain.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Selvmordstanker
STRATTERA økte risikoen for selvmordstanker i korttidsstudier hos barn og ungdom med oppmerksomhetssvikt/hyperaktivitetsforstyrrelse (ADHD). Samlede analyser av kortsiktige (6 til 18 uker) placebokontrollerte studier av STRATTERA hos barn og ungdom har avdekket en større risiko for selvmordstanker tidlig under behandlingen hos de som får STRATTERA. Det var totalt 12 studier (11 ved ADHD og 1 ved enurese) som involverte over 2200 pasienter (inkludert 1357 pasienter som fikk STRATTERA og 851 som fikk placebo). Gjennomsnittlig risiko for selvmordstanker hos pasienter som fikk STRATTERA var 0,4 % (5/1357 pasienter), sammenlignet med ingen hos placebobehandlede pasienter. Det var 1 selvmordsforsøk blant disse ca. 2200 pasientene, som skjedde hos en pasient behandlet med STRATTERA. Ingen selvmord skjedde i disse forsøkene. Alle reaksjoner oppstod hos barn 12 år eller yngre. Alle reaksjoner oppsto i løpet av den første måneden av behandlingen. Det er ukjent om risikoen for selvmordstanker hos pediatriske pasienter strekker seg til langtidsbruk. En lignende analyse hos voksne pasienter behandlet med STRATTERA for enten ADHD eller alvorlig depressiv lidelse (MDD) viste ikke økt risiko for selvmordstanker eller selvmordsatferd i forbindelse med bruk av STRATTERA.
Alle pediatriske pasienter som behandles med STRATTERA bør overvåkes på passende måte og observeres nøye for klinisk forverring, suicidalitet og uvanlige endringer i atferd, spesielt i løpet av de første månedene av en medikamentell behandlingskur, eller ved doseendringer, enten økning eller reduksjon. .
Følgende symptomer er rapportert med STRATTERA: angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshet), hypomani og mani. Selv om det ikke er etablert en årsakssammenheng mellom fremveksten av slike symptomer og fremveksten av selvmordsimpulser, er det en bekymring for at slike symptomer kan representere forløpere til fremvoksende suicidalitet. Pasienter som behandles med STRATTERA 40 mg bør derfor observeres for opptreden av slike symptomer.
Det bør vurderes å endre det terapeutiske regimet, inkludert eventuelt seponering av medisinen, hos pasienter som opplever fremvoksende suicidalitet eller symptomer som kan være forløpere til fremvoksende suicidalitet, spesielt hvis disse symptomene er alvorlige eller plutselig debuterte, eller ikke var en del av pasientens symptomer.
Familier og omsorgspersoner til pediatriske pasienter som behandles med STRATTERA 10 mg bør varsles om behovet for å overvåke pasienter for fremvekst av agitasjon, irritabilitet, uvanlige endringer i atferd og de andre symptomene beskrevet ovenfor, samt fremveksten av suicidalitet, og rapporter slike symptomer umiddelbart til helsepersonell. Slik overvåking bør inkludere daglig observasjon av familier og omsorgspersoner.
Alvorlig leverskade
Rapporter etter markedsføring indikerer at STRATTERA kan forårsake alvorlig leverskade. Selv om det ikke ble påvist bevis for leverskade i kliniske studier med ca. 6000 pasienter, har det vært sjeldne tilfeller av klinisk signifikant leverskade som ble ansett som sannsynlig eller mulig relatert til bruk av STRATTERA 40 mg etter markedsføring. Sjeldne tilfeller av leversvikt er også rapportert, inkludert et tilfelle som resulterte i en levertransplantasjon. På grunn av sannsynlig underrapportering er det umulig å gi et nøyaktig estimat av den sanne forekomsten av disse reaksjonene. Rapporterte tilfeller av leverskade oppsto innen 120 dager etter oppstart av atomoksetin i de fleste tilfellene, og noen pasienter presenterte markert forhøyede leverenzymer [>20 X øvre normalgrense (ULN)], og gulsott med signifikant forhøyede bilirubinnivåer (>2) X ULN), etterfulgt av bedring ved seponering av atomoksetin. Hos en pasient gjentok leverskaden, manifestert av forhøyede leverenzymer opp til 40 X ULN og gulsott med bilirubin opptil 12 X ULN, ved ny behandling og ble fulgt av bedring ved seponering av medikamentet, noe som ga bevis for at STRATTERA sannsynligvis forårsaket leverskaden. Slike reaksjoner kan oppstå flere måneder etter at behandlingen er startet, men laboratorieavvik kan fortsette å forverres i flere uker etter at legemidlet er stoppet. Pasienten beskrevet ovenfor kom seg etter leverskaden og trengte ikke levertransplantasjon.
STRATTERA bør seponeres hos pasienter med gulsott eller laboratoriebevis på leverskade, og bør ikke startes på nytt. Laboratorietesting for å bestemme leverenzymnivåer bør utføres ved det første symptomet eller tegn på leverdysfunksjon (f.eks. kløe, mørk urin, gulsott, ømhet i høyre øvre kvadrant eller uforklarlige "influensalignende" symptomer) [se Laboratorietester , PASIENTINFORMASJON ].
Alvorlige kardiovaskulære hendelser
Plutselig død og eksisterende strukturelle hjerteabnormiteter eller andre alvorlige hjerteproblemer
Barn og ungdom
Plutselig død er rapportert i forbindelse med atomoksetinbehandling i vanlige doser hos barn og ungdom med strukturelle hjerteavvik eller andre alvorlige hjerteproblemer. Selv om noen alvorlige hjerteproblemer alene medfører økt risiko for plutselig død, bør atomoksetin generelt ikke brukes til barn eller ungdom med kjente alvorlige strukturelle hjerteavvik, kardiomyopati, alvorlige hjerterytmeforstyrrelser eller andre alvorlige hjerteproblemer som kan gjøre dem mer sårbare. til de noradrenerge effektene av atomoksetin.
Voksne
Plutselige dødsfall, hjerneslag og hjerteinfarkt er rapportert hos voksne som tar atomoksetin i vanlige doser for ADHD. Selv om rollen til atomoksetin i disse voksne tilfellene også er ukjent, har voksne større sannsynlighet enn barn for å ha alvorlige strukturelle hjerteavvik, kardiomyopati, alvorlige hjerterytmeforstyrrelser, koronarsykdom eller andre alvorlige hjerteproblemer. Det bør vurderes å ikke behandle voksne med klinisk signifikante hjerteavvik.
Vurdering av kardiovaskulær status hos pasienter som behandles med atomoksetin
Barn, ungdom eller voksne som vurderes for behandling med atomoksetin bør ha en nøye anamnese (inkludert vurdering for en familiehistorie med plutselig død eller ventrikkelarytmi) og fysisk undersøkelse for å vurdere forekomsten av hjertesykdom, og bør få ytterligere hjertesykdom. evaluering hvis funn tyder på slik sykdom (f.eks. elektrokardiogram og ekkokardiogram). Pasienter som utvikler symptomer som anstrengende brystsmerter, uforklarlig synkope eller andre symptomer som tyder på hjertesykdom under atomoksetinbehandling, bør gjennomgå en umiddelbar hjerteevaluering.
Effekter på blodtrykk og hjertefrekvens
STRATTERA bør brukes med forsiktighet hos pasienter hvis underliggende medisinske tilstander kan forverres av økt blodtrykk eller hjertefrekvens, slik som enkelte pasienter med hypertensjon, takykardi eller kardiovaskulær eller cerebrovaskulær sykdom. Det skal ikke brukes til pasienter med alvorlige hjerte- eller vaskulære lidelser hvis tilstand forventes å forverres dersom de opplevde klinisk viktig økning i blodtrykk eller hjertefrekvens [se KONTRAINDIKASJONER ]. Puls og blodtrykk bør måles ved baseline, etter STRATTERA doseøkninger, og periodisk under behandling for å oppdage mulige klinisk viktige økninger.
Følgende tabell gir kortsiktige, placebokontrollerte kliniske studiedata for andelen pasienter som har en økning i: diastolisk blodtrykk ≥15 mm Hg; systolisk blodtrykk ≥20 mm Hg; hjertefrekvens større enn eller lik 20 slag/min, både i pediatriske og voksne populasjoner (se tabell 1).
placebokontrollerte registreringsstudier som involverte pediatriske pasienter, ble takykardi identifisert som en bivirkning for 0,3 % (5/1597) av disse STRATTERA 10 mg-pasientene sammenlignet med 0 % (0/934) av placebopasientene. Gjennomsnittlig hjertefrekvensøkning hos pasienter med ekstensiv metabolisering (EM) var 5,0 slag/minutt, og hos pasienter med dårlig metabolisering (PM) 9,4 slag/minutt.
I kliniske studier for voksne hvor EM/PM-status var tilgjengelig, var gjennomsnittlig hjertefrekvensøkning hos PM-pasienter signifikant høyere enn hos EM-pasienter (11 slag/minutt versus 7,5 slag/minutt). Hjertefrekvenseffektene kan være klinisk viktige hos enkelte PM-pasienter.
I placebokontrollerte registreringsstudier som involverte voksne pasienter, ble takykardi identifisert som en bivirkning for 1,5 % (8/540) av STRATTERA 25 mg pasienter sammenlignet med 0,5 % (2/402) av placebopasientene.
kliniske studier for voksne der EM/PM-status var tilgjengelig, var gjennomsnittlig endring fra baseline i diastolisk blodtrykk hos PM-pasienter høyere enn hos EM-pasienter (4,21 versus 2,13 mm Hg), og det samme var gjennomsnittlig endring fra baseline i systolisk blodtrykk (PM) : 2,75 versus EM: 2,40 mm Hg). Blodtrykkseffektene kan være klinisk viktige hos noen PM-pasienter.
Ortostatisk hypotensjon og synkope er rapportert hos pasienter som tar STRATTERA. I registreringsstudier for barn og ungdom opplevde 0,2 % (12/5596) av STRATTERA-behandlede pasienter ortostatisk hypotensjon og 0,8 % (46/5596) opplevde synkope. I korttidsregistreringsstudier for barn og ungdom opplevde 1,8 % (6/340) av STRATTERA-behandlede pasienter ortostatisk hypotensjon sammenlignet med 0,5 % (1/207) av placebobehandlede pasienter. Synkope ble ikke rapportert under korttids placebokontrollerte ADHD-registreringsstudier for barn og ungdom. STRATTERA 10 mg bør brukes med forsiktighet ved enhver tilstand som kan disponere pasienter for hypotensjon, eller tilstander forbundet med brå hjertefrekvens eller blodtrykksendringer.
Fremveksten av nye psykotiske eller maniske symptomer
Behandlingsoppståtte psykotiske eller maniske symptomer, f.eks. hallusinasjoner, vrangforestillinger eller mani hos barn og ungdom uten tidligere psykotisk sykdom eller mani kan være forårsaket av atomoksetin ved vanlige doser. Hvis slike symptomer oppstår, bør en mulig årsaksrolle til atomoksetin vurderes, og seponering av behandlingen bør vurderes. I en samlet analyse av flere kortsiktige, placebokontrollerte studier, forekom slike symptomer hos omtrent 0,2 % (4 pasienter med reaksjoner av 1939 som ble eksponert for atomoksetin i flere uker ved vanlige doser) av atomoksetin-behandlede pasienter sammenlignet med 0 av pasienter 1056 placebo-behandlede pasienter.
Screening av pasienter for bipolar lidelse
Generelt bør det utvises spesiell forsiktighet ved behandling av ADHD hos pasienter med komorbid bipolar lidelse på grunn av bekymring for mulig induksjon av en blandet/manisk episode hos pasienter med risiko for bipolar lidelse. Hvorvidt noen av symptomene beskrevet ovenfor representerer en slik konvertering er ukjent. Før oppstart av behandling med STRATTERA 40 mg bør imidlertid pasienter med komorbide depressive symptomer screenes tilstrekkelig for å avgjøre om de har risiko for bipolar lidelse; slik screening bør inkludere en detaljert psykiatrisk historie, inkludert en familiehistorie med selvmord, bipolar lidelse og depresjon.
Aggressiv oppførsel eller fiendtlighet
Pasienter som begynner behandling for ADHD bør overvåkes for utseende eller forverring av aggressiv atferd eller fiendtlighet. Aggressiv oppførsel eller fiendtlighet er ofte observert hos barn og unge med ADHD. I pediatriske korttidskontrollerte kliniske studier rapporterte 21/1308 (1,6 %) av atomoksetinpasientene versus 9/806 (1,1 %) av placebobehandlede pasienter spontant behandlingsoppståtte fiendtlighetsrelaterte bivirkninger (totalt risikoforhold på 1,33 [95 %). KI 0,67-2,64 – ikke statistisk signifikant]). I placebokontrollerte kliniske studier hos voksne rapporterte 6/1697 (0,35 %) av atomoksetinpasientene mot 4/1560 (0,26 %) av placebobehandlede pasienter spontant behandlingsoppståtte fiendtlighetsrelaterte bivirkninger (totalt risikoforhold på 1,38 [95 % KI) 0,39-4,88 – ikke statistisk signifikant]). Selv om dette ikke er avgjørende bevis på at STRATTERA 10 mg forårsaker aggressiv atferd eller fiendtlighet, ble denne atferden oftere observert i kliniske studier blant barn, ungdom og voksne behandlet med STRATTERA sammenlignet med placebo.
Allergiske hendelser
Selv om det er uvanlig, har allergiske reaksjoner, inkludert anafylaktiske reaksjoner, angioneurotisk ødem, urticaria og utslett, blitt rapportert hos pasienter som tar STRATTERA.
Effekter på urinstrøm fra blæren
I ADHD-kontrollerte studier for voksne var frekvensen av urinretensjon (1,7 %, 9/540) og urinnøling (5,6 %, 30/540) økt blant atomoksetin-pasienter sammenlignet med placebo-personer (0 %, 0/402 ; 0,5 %, 2/402, henholdsvis). To voksne atomoksetin-personer og ingen placebo-individer avbrøt fra kontrollerte kliniske studier på grunn av urinretensjon. En klage på urinretensjon eller urinnøling bør vurderes som potensielt relatert til atomoksetin.
Priapisme
Sjeldne tilfeller av priapisme etter markedsføring, definert som smertefull og ikke-smertefull penisereksjon som varer mer enn 4 timer, er rapportert for pediatriske og voksne pasienter behandlet med STRATTERA. Ereksjonene forsvant i tilfeller der oppfølgingsinformasjon var tilgjengelig, noen etter seponering av STRATTERA. Rask legehjelp er nødvendig ved mistanke om priapisme.
Effekter på vekst
Data om langtidseffekter av STRATTERA 25 mg på vekst kommer fra åpne studier, og vekt- og høydeendringer sammenlignes med normative populasjonsdata. Generelt henger vekt- og høydeøkningen til pediatriske pasienter behandlet med STRATTERA etter det som er forutsagt av normative populasjonsdata for omtrent de første 9-12 månedene av behandlingen. Deretter tar vektøkningen seg tilbake, og etter ca. 3 års behandling har pasienter behandlet med STRATTERA gått opp 17,9 kg i gjennomsnitt, 0,5 kg mer enn forutsagt av baseline-data. Etter ca. 12 måneder stabiliserer høydeøkningen seg, og etter 3 år har pasienter behandlet med STRATTERA 40 mg økt i gjennomsnitt 19,4 cm, 0,4 cm mindre enn forutsagt av baseline-dataene (se figur 1 nedenfor).
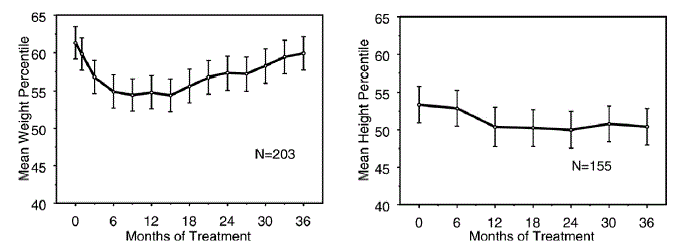
Figur 1: Gjennomsnittlig vekt- og høydepersentiler over tid for pasienter med tre års STRATTERA 40 mg-behandling
Dette vekstmønsteret var generelt likt uavhengig av pubertalstatus på tidspunktet for behandlingsstart. Pasienter som var pre-pubertale ved behandlingsstart (jenter ≤8 år, gutter ≤9 år) økte i gjennomsnitt 2,1 kg og 1,2 cm mindre enn antatt etter tre år. Pasienter som var pubertet (jenter >8 til ≤13 år, gutter >9 til ≤14 år) eller sen pubertet (jenter >13 år, gutter >14 år) hadde gjennomsnittlig vekt- og høydeøkning som var nær eller overgikk de som ble anslått etter tre års behandling.
Veksten fulgte et lignende mønster hos både omfattende og dårlige metabolisatorer (EM, PM). PM-er behandlet i minst to år økte i gjennomsnitt 2,4 kg og 1,1 cm mindre enn spådd, mens EM-er økte i gjennomsnitt 0,2 kg og 0,4 cm mindre enn spådd.
kontrollerte korttidsstudier (opptil 9 uker) gikk STRATTERA-behandlede pasienter ned i gjennomsnitt 0,4 kg og gikk opp i gjennomsnitt 0,9 cm, sammenlignet med en økning på 1,5 kg og 1,1 cm hos placebobehandlede pasienter. I en kontrollert studie med fast dose mistet 1,3 %, 7,1 %, 19,3 % og 29,1 % av pasientene minst 3,5 % av kroppsvekten i dosegruppene med placebo, 0,5, 1,2 og 1,8 mg/kg/dag.
Veksten bør overvåkes under behandling med STRATTERA.
Laboratorietester
Rutinemessige laboratorietester er ikke nødvendig.
CYP2D6 Metabolisme
Dårlige metabolisatorer (PM) av CYP2D6 har en 10 ganger høyere AUC og en 5 ganger høyere toppkonsentrasjon til en gitt dose STRATTERA 25 mg sammenlignet med omfattende metabolisatorer (EM). Omtrent 7 % av en kaukasisk befolkning er PM. Laboratorietester er tilgjengelige for å identifisere CYP2D6 PM. Blodnivåene i PM er lik de som oppnås ved å ta sterke hemmere av CYP2D6. De høyere blodnivåene i PM fører til en høyere rate av noen bivirkninger av STRATTERA [se BIVIRKNINGER ].
Samtidig bruk av kraftige CYP2D6-hemmere eller bruk hos pasienter som er kjent for å være CYP2D6 PM
Atomoksetin metaboliseres primært via CYP2D6-veien til 4-hydroksyatomoksetin. Dosejustering av STRATTERA kan være nødvendig når det administreres sammen med potente CYP2D6-hemmere (f.eks. paroksetin, fluoksetin og kinidin) eller når det administreres til CYP2D6 PM. [Se DOSERING OG ADMINISTRASJON og NARKOTIKAHANDEL ].
Informasjon om pasientveiledning
Se FDA-godkjent PASIENTINFORMASJON .
Generell informasjon
Leger bør instruere sine pasienter om å lese medisinveiledningen før de starter behandling med STRATTERA og å lese den på nytt hver gang resepten fornyes.
Forskrivere eller annet helsepersonell bør informere pasienter, deres familier og deres omsorgspersoner om fordelene og risikoene forbundet med behandling med STRATTERA og bør gi dem råd om riktig bruk. Forskriveren eller helsepersonell bør instruere pasienter, deres familier og deres omsorgspersoner om å lese medisinveiledningen og bør hjelpe dem med å forstå innholdet. Pasienter bør gis mulighet til å diskutere innholdet i legemiddelveiledningen og få svar på spørsmål de måtte ha.
Pasienter bør informeres om følgende problemer og bes om å varsle forskriveren dersom disse oppstår mens de tar STRATTERA.
Selvmordsrisiko
Pasienter, deres familier og deres omsorgspersoner bør oppmuntres til å være oppmerksomme på fremveksten av angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshet), hypomani, mani, andre uvanlige endringer i atferd. , depresjon og selvmordstanker, spesielt tidlig under behandling med STRATTERA og når dosen justeres. Familier og omsorgspersoner til pasienter bør rådes til å observere for opptreden av slike symptomer på en daglig basis, siden endringer kan være brå. Slike symptomer bør rapporteres til pasientens forskriver eller helsepersonell, spesielt hvis de er alvorlige, plutselige eller ikke var en del av pasientens symptomer. Symptomer som disse kan være assosiert med økt risiko for suicidal tenkning og atferd og indikerer behov for svært tett oppfølging og muligens endringer i medisinen.
Alvorlig leverskade
Pasienter som starter STRATTERA bør advares om at alvorlig leverskade kan utvikles. Pasienter bør instrueres om å kontakte legen sin umiddelbart dersom de utvikler kløe, mørk urin, gulsott, ømhet i høyre øvre kvadrant eller uforklarlige "influensalignende" symptomer [se ADVARSLER OG FORHOLDSREGLER ].
Aggresjon eller fiendtlighet
Pasienter bør instrueres om å ringe legen sin så snart som mulig dersom de merker en økning i aggresjon eller fiendtlighet.
Priapisme
Sjeldne tilfeller av priapisme etter markedsføring, definert som smertefull og ikke-smertefull penisereksjon som varer mer enn 4 timer, er rapportert for pediatriske og voksne pasienter behandlet med STRATTERA. Foreldre eller foresatte til pediatriske pasienter som tar STRATTERA 25 mg og voksne pasienter som tar STRATTERA bør instrueres om at priapisme krever øyeblikkelig legehjelp.
Øyeirriterende
STRATTERA er øyeirriterende. STRATTERA kapsler er ikke ment å åpnes. I tilfelle kapselinnhold kommer i kontakt med øyet, skal det berørte øyet skylles umiddelbart med vann, og medisinsk råd innhentes. Hendene og eventuelle potensielt forurensede overflater bør vaskes så snart som mulig.
Legemiddel-legemiddelinteraksjon
Pasienter bør instrueres om å konsultere en lege hvis de tar eller planlegger å ta reseptbelagte eller reseptfrie legemidler, kosttilskudd eller urtemedisiner.
Svangerskap
Pasienter bør instrueres om å konsultere en lege hvis de ammer, er gravide eller tenker på å bli gravide mens de tar STRATTERA.
Mat
Pasienter kan ta STRATTERA 25 mg med eller uten mat.
Glemt dose
Hvis pasienter glemmer en dose, bør de instrueres om å ta den så snart som mulig, men bør ikke ta mer enn den foreskrevne totale daglige mengden STRATTERA i en 24-timers periode.
Interferens med psykomotorisk ytelse
Pasienter bør instrueres om å være forsiktige når de kjører bil eller bruker farlige maskiner inntil de er rimelig sikre på at ytelsen deres ikke påvirkes av atomoksetin.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Atomoksetin HCl var ikke kreftfremkallende hos rotter og mus når det ble gitt i dietten i 2 år ved tidsvektede gjennomsnittsdoser opp til henholdsvis 47 og 458 mg/kg/dag. Den høyeste dosen brukt til rotter er ca. 8 og 5 ganger den maksimale dosen til mennesker hos henholdsvis barn og voksne, på mg/m2-basis. Plasmanivåer (AUC) av atomoksetin ved denne dosen hos rotter er estimert til å være 1,8 ganger (omfattende metabolisatorer) eller 0,2 ganger (dårlige metabolisatorer) de hos mennesker som får maksimal human dose. Den høyeste dosen som brukes til mus er omtrent 39 og 26 ganger den maksimale dosen til mennesker hos henholdsvis barn og voksne, på mg/m2-basis.
Mutagenese
Atomoksetin HCl var negativ i en rekke gentoksisitetsstudier som inkluderte en reverspunktmutasjonsanalyse (Ames-test), en in vitro muselymfomanalyse, en kromosomavvikstest i eggstokkceller fra kinesisk hamster, en ikke-planlagt DNA-syntesetest i rottehepatocytter, og en in vivo mikronukleustest i mus. Imidlertid var det en liten økning i prosentandelen av eggstokkceller fra kinesisk hamster med diplokromosomer, noe som tyder på endoreduplisering (numerisk aberrasjon).
Metabolitten N-desmetylatomoksetin HCl var negativ i Ames-testen, muselymfomanalysen og ikke-planlagt DNA-syntesetest.
Nedsatt fruktbarhet
Atomoksetin HCl svekket ikke fertiliteten hos rotter når det ble gitt i dietten i doser på opptil 57 mg/kg/dag, som er omtrent 6 ganger den maksimale humane dosen på mg/m2-basis.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori C
Drektige kaniner ble behandlet med opptil 100 mg/kg/dag atomoksetin ved sonde under hele organogeneseperioden. Ved denne dosen, i 1 av 3 studier, ble det observert en reduksjon i levende fostre og en økning i tidlige resorpsjoner. Små økninger i forekomsten av atypisk opprinnelse av halspulsåren og fraværende subclaviaarterien ble observert. Disse funnene ble observert ved doser som forårsaket lett maternell toksisitet. Ingen-effektdosen for disse funnene var 30 mg/kg/dag. Dosen på 100 mg/kg er omtrent 23 ganger den maksimale dosen til mennesker på mg/m2-basis; plasmanivåer (AUC) av atomoksetin ved denne dosen hos kaniner er estimert til å være 3,3 ganger (omfattende metabolisatorer) eller 0,4 ganger (dårlige metabolisatorer) de hos mennesker som får maksimal human dose.
Rotter ble behandlet med opptil ca. 50 mg/kg/dag atomoksetin (omtrent 6 ganger maksimal human dose på mg/m2-basis) i dietten fra 2 uker (hunn) eller 10 uker (hann) før paring gjennom perioder med organogenese og laktasjon. I 1 av 2 studier ble det observert reduksjon i valpevekt og valpeoverlevelse. Den reduserte valpeoverlevelsen ble også sett ved 25 mg/kg (men ikke ved 13 mg/kg). I en studie der rotter ble behandlet med atomoksetin i dietten fra 2 uker (hunn) eller 10 uker (hann) før paring gjennom hele perioden med organogenese, en reduksjon i fostervekt (kun hunndyr) og en økning i forekomsten av ufullstendig forbening av vertebralbuen hos fostre ble observert ved 40 mg/kg/dag (ca. 5 ganger maksimal human dose på mg/m2 basis), men ikke ved 20 mg/kg/dag.
Ingen uønskede fostereffekter ble sett når drektige rotter ble behandlet med opptil 150 mg/kg/dag (omtrent 17 ganger maksimal human dose på mg/m2-basis) ved sonde gjennom hele perioden med organogenese. Det er ikke utført tilstrekkelige og godt kontrollerte studier på gravide kvinner. STRATTERA 18mg skal ikke brukes under graviditet med mindre den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Arbeid og levering
Fødsel hos rotter ble ikke påvirket av atomoksetin. Effekten av STRATTERA på fødsel og fødsel hos mennesker er ukjent.
Ammende mødre
Atomoksetin og/eller dets metabolitter ble skilt ut i melken til rotter. Det er ikke kjent om atomoksetin skilles ut i morsmelk. Forsiktighet bør utvises hvis STRATTERA gis til en ammende kvinne.
Pediatrisk bruk
Alle som vurderer bruk av STRATTERA hos et barn eller ungdom, må balansere den potensielle risikoen med det kliniske behovet [se BOKS ADVARSEL og ADVARSLER OG FORHOLDSREGLER ]. Farmakokinetikken til atomoksetin hos barn og ungdom er lik den hos voksne. Sikkerhet, effekt og farmakokinetikk til STRATTERA hos pediatriske pasienter under 6 år har ikke blitt evaluert.
En studie ble utført på unge rotter for å evaluere effekten av atomoksetin på vekst og nevroadferdsmessig og seksuell utvikling. Rotter ble behandlet med 1, 10 eller 50 mg/kg/dag (henholdsvis ca. 0,2, 2 og 8 ganger den maksimale menneskelige dosen på mg/m2-basis) atomoksetin gitt med sonde fra den tidlige postnatale perioden (dag 10 år) gjennom voksen alder. Små forsinkelser i utbruddet av vaginal åpenhet (alle doser) og preputial separasjon (10 og 50 mg/kg), liten reduksjon i bitestikkelvekt og spermantall (10 og 50 mg/kg), og en liten reduksjon i corpora lutea (50 mg) /kg) ble sett, men det var ingen effekter på fertilitet eller reproduksjonsevne. En liten forsinkelse i starten av fortennende utbrudd ble sett ved 50 mg/kg. En svak økning i motorisk aktivitet ble sett på dag 15 (hann ved 10 og 50 mg/kg og kvinner ved 50 mg/kg) og på dag 30 (kvinner ved 50 mg/kg), men ikke på dag 60. Det var ingen effekter på lærings- og hukommelsestester. Betydningen av disse funnene for mennesker er ukjent.
Geriatrisk bruk
Sikkerhet, effekt og farmakokinetikk til STRATTERA 10 mg hos geriatriske pasienter er ikke evaluert.
Leverinsuffisiens
Atomoksetineksponering (AUC) er økt sammenlignet med normale forsøkspersoner hos EM-personer med moderat (Child-Pugh klasse B) (2 ganger økning) og alvorlig (Child-Pugh klasse C) (4 ganger økning) leversvikt. Dosejustering anbefales for pasienter med moderat eller alvorlig leverinsuffisiens [se DOSERING OG ADMINISTRASJON ].
Nyreinsuffisiens
EM-personer med nyresykdom i sluttstadiet hadde høyere systemisk eksponering for atomoksetin enn friske personer (ca. 65 % økning), men det var ingen forskjell når eksponeringen ble korrigert for mg/kg dose. STRATTERA 25 mg kan derfor administreres til ADHD-pasienter med nyresykdom i sluttstadiet eller mindre grader av nyreinsuffisiens ved bruk av vanlig doseringsregime.
Kjønn
Kjønn påvirket ikke atomoksetin-disponeringen.
Etnisk opprinnelse
Etnisk opprinnelse påvirket ikke atomoksetindisponeringen (bortsett fra at PM er mer vanlig hos kaukasiere).
Pasienter med samtidig sykdom
Tics hos pasienter med ADHD og komorbid Tourettes lidelse
Atomoksetin administrert i et fleksibelt doseområde på 0,5 til 1,5 mg/kg/dag (gjennomsnittlig dose på 1,3 mg/kg/dag) og placebo ble sammenlignet i 148 randomiserte pediatriske (717 år) personer med en DSM-IV diagnose ADHD og komorbid tic-lidelse i en 18 ukers, dobbeltblind, placebokontrollert studie der majoriteten (80 %) deltok i denne studien med Tourettes lidelse (Tourettes lidelse: 116 personer; kronisk motorisk tic-lidelse: 29 personer). En ikke-inferioritetsanalyse viste at STRATTERA 10 mg ikke forverret tics hos disse pasientene, bestemt av Yale Global Tic Severity Scale Total Score (YGTSS). Av 148 pasienter som gikk inn i den akutte behandlingsfasen, avbrøt 103 (69,6 %) pasienter studien. Den primære årsaken til seponering i både atomoksetin- (38 av 76 pasienter, 50,0 %) og placebo- (45 av 72 pasienter, 62,5 %) behandlingsgruppene ble identifisert som manglende effekt med de fleste pasientene som avsluttet ved uke 12. Dette var første besøk hvor pasienter med en CGI-S≥4 også kunne oppfylle kriteriene for "klinisk ikke-responder" (CGI-S forble den samme eller økt fra studiens baseline) og være kvalifisert til å delta i en åpen utvidelsesstudie med atomoksetin. Det har vært rapporter om tics etter markedsføring [se BIVIRKNINGER ].
Angst hos pasienter med ADHD og komorbide angstlidelser
I to dobbeltblindede, placebokontrollerte studier etter markedsføring har det blitt vist at behandling av pasienter med ADHD og komorbide angstlidelser med STRATTERA 10 mg ikke forverrer deres angst.
I en 12-ukers dobbeltblind, placebokontrollert studie ble 176 pasienter i alderen 8-17 år som oppfylte DSM-IV-kriteriene for ADHD og minst én av angstlidelsene ved separasjonsangst, generalisert angstlidelse eller sosial fobi. randomisert. Etter en 2-ukers dobbeltblind placebo-innføring, ble STRATTERA 25 mg initiert med 0,8 mg/kg/dag med økning til en måldose på 1,2 mg/kg/dag (median dose 1,30 mg/kg/dag +/- 0,29 mg/kg/dag). STRATTERA forverret ikke angsten hos disse pasientene som bestemt av Pediatric Anxiety Rating Scale (PARS). Av de 158 pasientene som fullførte den dobbeltblinde placebo-innføringen, avbrøt 26 (16 %) pasienter studien.
en separat 16 ukers, dobbeltblind, placebokontrollert studie ble 442 pasienter i alderen 18-65, som oppfylte DSM-IV-kriteriene for voksen ADHD og sosial angstlidelse (hvorav 23 % også hadde generalisert angstlidelse) randomisert. Etter en 2-ukers dobbeltblind placebo-innføring, ble STRATTERA 10 mg initiert med 40 mg/dag til en maksimal dose på 100 mg/dag (gjennomsnittlig daglig dose 83 mg/dag +/- 19,5 mg/dag). STRATTERA 18 mg forverret ikke angsten hos disse pasientene som bestemt av Liebowitz Social Anxiety Scale (LSAS). Av de 413 pasientene som fullførte den dobbeltblinde placebo-innføringen, avbrøt 149 (36,1 %) pasienter studien. Det har vært rapporter om angst etter markedsføring [se BIVIRKNINGER ] .
OVERDOSE
Menneskelig erfaring
Det er begrenset erfaring med kliniske studier med STRATTERA overdosering. I løpet av postmarketing har det vært rapportert dødsulykker som involverer en blandet overdose av STRATTERA 10 mg og minst ett annet legemiddel. Det har ikke vært rapporter om dødsfall med overdosering av STRATTERA alene, inkludert tilsiktede overdoser i mengder opp til 1400 mg. I noen tilfeller av overdosering med STRATTERA, er det rapportert om anfall. De hyppigst rapporterte symptomene som fulgte med akutte og kroniske overdoser av STRATTERA var gastrointestinale symptomer, somnolens, svimmelhet, skjelving og unormal oppførsel. Hyperaktivitet og agitasjon er også rapportert. Tegn og symptomer forenlig med mild til moderat aktivering av det sympatiske nervesystemet (f.eks. takykardi, økt blodtrykk, mydriasis, munntørrhet) er også observert. De fleste hendelsene var milde til moderate. Mindre vanlig har det vært rapporter om QT-forlengelse og mentale endringer, inkludert desorientering og hallusinasjoner [se KLINISK FARMAKOLOGI ].
Håndtering av overdose
Rådfør deg med et sertifisert giftkontrollsenter for oppdatert veiledning og råd. Fordi atomoksetin er sterkt proteinbundet, er det ikke sannsynlig at dialyse vil være nyttig ved behandling av overdose.
KONTRAINDIKASJONER
Overfølsomhet
STRATTERA er kontraindisert hos pasienter kjent for å være overfølsomme overfor atomoksetin eller andre bestanddeler av produktet [se ADVARSLER OG FORHOLDSREGLER ].
Monoaminoksidasehemmere (MAOI)
STRATTERA skal ikke tas med en MAO-hemmer, eller innen 2 uker etter seponering av en MAO-hemmer. Behandling med en MAO-hemmer bør ikke startes innen 2 uker etter seponering av STRATTERA. Med andre legemidler som påvirker hjernens monoaminkonsentrasjoner, har det vært rapporter om alvorlige, noen ganger dødelige reaksjoner (inkludert hypertermi, rigiditet, myoklonus, autonom ustabilitet med mulige raske svingninger av vitale tegn, og mental statusendringer som inkluderer ekstrem agitasjon som utvikler seg til delirium og koma) når det tas i kombinasjon med en MAO-hemmer. Noen tilfeller presentert med trekk som ligner malignt nevroleptikasyndrom. Slike reaksjoner kan oppstå når disse legemidlene gis samtidig eller i umiddelbar nærhet [se NARKOTIKAHANDEL ].
Smalvinklet glaukom
I kliniske studier var bruk av STRATTERA assosiert med økt risiko for mydriasis, og derfor anbefales det ikke til pasienter med trangvinklet glaukom.
Feokromocytom
Alvorlige reaksjoner, inkludert forhøyet blodtrykk og takyarytmi, er rapportert hos pasienter med feokromocytom eller en historie med feokromocytom som har fått STRATTERA. Derfor bør STRATTERA 18 mg ikke tas av pasienter med feokromocytom eller tidligere feokromocytom.
Alvorlige kardiovaskulære lidelser
STRATTERA 40 mg skal ikke brukes til pasienter med alvorlige hjerte- eller vaskulære lidelser hvis tilstand forventes å forverres hvis de opplever økning i blodtrykk eller hjertefrekvens som kan være klinisk viktig (for eksempel 15 til 20 mm Hg i blodtrykk eller 20 slag per minutt i hjertefrekvens). [Se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Den nøyaktige mekanismen som atomoksetin produserer sine terapeutiske effekter ved oppmerksomhetsunderskudd/hyperaktivitetsforstyrrelse (ADHD) er ukjent, men antas å være relatert til selektiv hemming av den presynaptiske noradrenalintransportøren, som bestemt i ex vivo opptaks- og nevrotransmitterutarmingsstudier .
Farmakodynamikk
En eksponerings-responsanalyse som omfattet doser av atomoksetin (0,5, 1,2 eller 1,8 mg/kg/dag) eller placebo viste at atomoksetineksponering korrelerer med effekt målt ved vurderingsskalaen for oppmerksomhetsunderskudd/hyperaktivitetsforstyrrelser-IV-foreldreversjon: etterforsker administrert og scoret. Forholdet mellom eksponering og effekt var lik det som ble observert mellom dose og effekt med median eksponering ved de to høyeste dosene, noe som resulterte i nesten maksimale endringer fra baseline [se Kliniske studier ].
Hjerteelektrofysiologi
Effekten av STRATTERA på QTc-forlengelse ble evaluert i en randomisert, dobbeltblindet, positiv (moxifloxacin 400 mg) og placebokontrollert, cross-over-studie hos friske mannlige CYP2D6-metabolisatorer. Totalt 120 friske personer ble administrert STRATTERA (20 mg og 60 mg) to ganger daglig i 7 dager. Ingen store endringer i QTc-intervall (dvs. økninger >60 msek fra baseline, absolutt QTc >480 msek) ble observert i studien. Små endringer i QTc-intervall kan imidlertid ikke utelukkes fra den nåværende studien, fordi studien ikke klarte å demonstrere analysesensitivitet. Det var en svak økning i QTc-intervall med økt atomoksetinkonsentrasjon.
Farmakokinetikk
Atomoksetin absorberes godt etter oral administrering og påvirkes minimalt av mat. Det elimineres primært ved oksidativ metabolisme gjennom cytokrom P450 2D6 (CYP2D6) enzymvei og påfølgende glukuronidering. Atomoksetin har en halveringstid på ca. 5 timer. En brøkdel av befolkningen (omtrent 7 % av kaukasiere og 2 % av afroamerikanere) er dårlige metaboliserere (PM) av CYP2D6-metaboliserte legemidler. Disse personene har redusert aktivitet i denne banen, noe som resulterer i 10 ganger høyere AUC, 5 ganger høyere maksimale plasmakonsentrasjoner og langsommere eliminering (plasmahalveringstid på ca. 24 timer) av atomoksetin sammenlignet med personer med normal aktivitet [omfattende metabolisatorer (EMs) )]. Legemidler som hemmer CYP2D6, som fluoksetin, paroksetin og kinidin, forårsaker lignende økninger i eksponering.
Farmakokinetikken til atomoksetin har blitt evaluert hos mer enn 400 barn og ungdom i utvalgte kliniske studier, hovedsakelig ved bruk av populasjonsfarmakokinetiske studier. Enkeltdose og steady-state individuelle farmakokinetiske data ble også innhentet hos barn, ungdom og voksne. Når doser ble normalisert til en mg/kg-basis, ble tilsvarende halveringstid, Cmax og AUC-verdier observert hos barn, ungdom og voksne. Clearance og distribusjonsvolum etter justering for kroppsvekt var også like.
Absorpsjon og distribusjon
Atomoksetin absorberes raskt etter oral administrering, med en absolutt biotilgjengelighet på ca. 63 % ved EM og 94 % ved PM. Maksimal plasmakonsentrasjon (Cmax) nås ca. 1 til 2 timer etter dosering.
STRATTERA 18mg kan administreres med eller uten mat. Administrering av STRATTERA sammen med et standard måltid med høyt fettinnhold hos voksne påvirket ikke graden av oral absorpsjon av atomoksetin (AUC), men reduserte absorpsjonshastigheten, noe som resulterte i en 37 % lavere Cmax og forsinket Tmax med 3 timer. I kliniske studier med barn og ungdom resulterte administrering av STRATTERA sammen med mat i en 9 % lavere Cmax.
Steady-state distribusjonsvolumet etter intravenøs administrering er 0,85 l/kg, noe som indikerer at atomoksetin hovedsakelig fordeler seg i hele kroppsvannet. Distribusjonsvolumet er likt over pasientens vektområde etter normalisering for kroppsvekt.
Ved terapeutiske konsentrasjoner er 98 % av atomoksetin i plasma bundet til protein, primært albumin.
Metabolisme og eliminering
Atomoksetin metaboliseres primært gjennom den enzymatiske CYP2D6-veien. Personer med redusert aktivitet i denne banen (PM) har høyere plasmakonsentrasjoner av atomoksetin sammenlignet med personer med normal aktivitet (EM). For PM er AUC for atomoksetin omtrent 10 ganger og Css, max er omtrent 5 ganger større enn EM. Laboratorietester er tilgjengelige for å identifisere CYP2D6 PM. Samtidig administrering av STRATTERA med potente hemmere av CYP2D6, som fluoksetin, paroksetin eller kinidin, resulterer i en betydelig økning i plasmaeksponering for atomoksetin, og dosejustering kan være nødvendig [se ADVARSLER OG FORHOLDSREGLER ]. Atomoksetin hemmet eller induserte ikke CYP2D6-banen.
Den viktigste oksidative metabolitten som dannes, uavhengig av CYP2D6-status, er 4-hydroksyatomoksetin, som er glukuronidert. 4-hydroksyatomoksetin er ekvipotent med atomoksetin som en hemmer av noradrenalintransportøren, men sirkulerer i plasma ved mye lavere konsentrasjoner (1 % av atomoksetinkonsentrasjonen i EM og 0,1 % av atomoksetinkonsentrasjonen i PM). 4-hydroksyatomoksetin dannes først og fremst av CYP2D6, men i PM dannes 4-hydroksyatomoksetin i langsommere hastighet av flere andre cytokrom P450-enzymer. N-desmetylatomoksetin dannes av CYP2C19 og andre cytokrom P450-enzymer, men har vesentlig mindre farmakologisk aktivitet sammenlignet med atomoksetin og sirkulerer i plasma ved lavere konsentrasjoner (5 % av atomoksetinkonsentrasjonen i EM og 45 % av atomoksetinkonsentrasjonen i PM).
Gjennomsnittlig tilsynelatende plasmaclearance av atomoksetin etter oral administrering hos voksne EM er 0,35 l/time/kg og gjennomsnittlig halveringstid er 5,2 timer. Etter oral administrering av atomoksetin til PM er gjennomsnittlig tilsynelatende plasmaclearance 0,03 l/time/kg og gjennomsnittlig halveringstid er 21,6 timer. For PM er AUC for atomoksetin omtrent 10 ganger og Css, max er omtrent 5 ganger større enn EM. Eliminasjonshalveringstiden for 4-hydroksyatomoksetin er lik den for N-desmetylatomoksetin (6 til 8 timer) hos EM-personer, mens halveringstiden til N-desmetylatomoksetin er mye lengre hos pasienter med PM (34 til 40 timer).
Atomoksetin skilles primært ut som 4-hydroksyatomoksetin-O-glukuronid, hovedsakelig i urinen (større enn 80 % av dosen) og i mindre grad i feces (mindre enn 17 % av dosen). Bare en liten del av STRATTERA 40 mg dose skilles ut som uendret atomoksetin (mindre enn 3 % av dosen), noe som indikerer omfattende biotransformasjon.
[Se Bruk i spesifikke populasjoner ].
Kliniske studier
ADHD-studier hos barn og ungdom
Akuttstudier
Effektiviteten av STRATTERA 40 mg i behandlingen av ADHD ble fastslått i 4 randomiserte, dobbeltblindede, placebokontrollerte studier av pediatriske pasienter (i alderen 6 til 18). Omtrent en tredjedel av pasientene oppfylte DSM-IV-kriteriene for uoppmerksom subtype og to tredjedeler oppfylte kriterier for både uoppmerksomme og hyperaktive/impulsive subtyper.
Tegn og symptomer på ADHD ble evaluert ved en sammenligning av gjennomsnittlig endring fra baseline til endepunkt for STRATTERA- og placebo-behandlede pasienter ved å bruke en intent-to-treat-analyse av det primære utfallsmålet, etterforskeren administrerte og skåret ADHD Rating Scale-IV- Foreldreversjon (ADHDRS) totalscore inkludert hyperaktive/impulsive og uoppmerksomme subskalaer. Hvert element på ADHDRS tilordnes direkte til ett symptomkriterium for ADHD i DSM-IV.
studie 1, en 8-ukers randomisert, dobbeltblind, placebokontrollert, dose-respons, akuttbehandlingsstudie av barn og ungdom i alderen 8 til 18 (N=297), fikk pasientene enten en fast dose STRATTERA (0,5, 1,2 eller 1,8 mg/kg/dag) eller placebo. STRATTERA 10 mg ble administrert som en delt dose tidlig morgen og sen ettermiddag/tidlig kveld. Ved de 2 høyere dosene var forbedringer i ADHD-symptomer statistisk signifikant overlegne hos STRATTERA-behandlede pasienter sammenlignet med placebo-behandlede pasienter målt på ADHDRS-skalaen. Dosen på 1,8 mg/kg/dag STRATTERA 25 mg ga ingen ytterligere fordel i forhold til den som ble observert med dosen på 1,2 mg/kg/dag. 0,5 mg/kg/dag STRATTERA-dosen var ikke bedre enn placebo.
studie 2, en 6-ukers randomisert, dobbeltblind, placebokontrollert, akuttbehandlingsstudie av barn og ungdom i alderen 6 til 16 (N=171), fikk pasientene enten STRATTERA 40 mg eller placebo. STRATTERA ble administrert som en enkeltdose tidlig om morgenen og titrert på vektjustert basis i henhold til klinisk respons, opp til en maksimal dose på 1,5 mg/kg/dag. Gjennomsnittlig sluttdose av STRATTERA 10 mg var ca. 1,3 mg/kg/dag. ADHD-symptomer ble statistisk signifikant forbedret på STRATTERA sammenlignet med placebo, målt på ADHDRS-skalaen. Denne studien viser at STRATTERA er effektivt når det administreres én gang daglig om morgenen.
2 identiske, 9 ukers, akutte, randomiserte, dobbeltblinde, placebokontrollerte studier av barn i alderen 7 til 13 (studie 3, N=147; studie 4, N=144), ble STRATTERA 40 mg og metylfenidat sammenlignet med placebo . STRATTERA 18 mg ble administrert som en delt dose tidlig på morgenen og sen ettermiddag (etter skoletid) og titrert på vektjustert basis i henhold til klinisk respons. Maksimal anbefalt STRATTERA-dose var 2,0 mg/kg/dag. Gjennomsnittlig sluttdose av STRATTERA 18 mg for begge studiene var ca. 1,6 mg/kg/dag. I begge studiene forbedret ADHD-symptomer statistisk signifikant mer på STRATTERA 10mg enn på placebo, målt på ADHDRS-skalaen.
Undersøkelse av populasjonsundergrupper basert på kjønn og alder (
Vedlikeholdsstudie
Effektiviteten av STRATTERA 18 mg i vedlikeholdsbehandling av ADHD ble fastslått i en poliklinisk studie av barn og ungdom (alder 6-15 år). Pasienter som oppfyller DSM-IV-kriteriene for ADHD som viste kontinuerlig respons i ca. 4 uker i løpet av en innledende 10 ukers åpen behandlingsfase med STRATTERA (1,2 til 1,8 mg/kg/dag) ble randomisert til å fortsette med sin nåværende dose av STRATTERA (N =292) eller til placebo (N=124) under dobbeltblind behandling for observasjon av tilbakefall. Respons under den åpne fasen ble definert som CGI-ADHD-S-score ≤2 og en reduksjon på minst 25 % fra baseline i ADHDRS-IV-Parent:Inv totalscore. Pasienter som ble tildelt STRATTERA og viste kontinuerlig respons i omtrent 8 måneder i løpet av den første dobbeltblinde behandlingsfasen ble igjen randomisert til fortsettelse av sin nåværende dose av STRATTERA (N=81) eller til placebo (N=82) under dobbeltblinde behandling for observasjon av tilbakefall. Tilbakefall under den dobbeltblinde fasen ble definert som en økning i CGI-ADHD-S poengsum på minst 2 fra slutten av den åpne fasen og ADHDRS-IV-Foreldre:Inv total poengsum går tilbake til ≥90 % av studiestartscore for 2 påfølgende besøk. I begge de dobbeltblinde fasene opplevde pasienter som fikk fortsatt STRATTERA-behandling betydelig lengre tid til tilbakefall enn de som fikk placebo.
ADHD-studier hos voksne
Effektiviteten av STRATTERA i behandlingen av ADHD ble fastslått i 2 randomiserte, dobbeltblindede, placebokontrollerte kliniske studier av voksne pasienter, 18 år og eldre, som oppfylte DSM-IV-kriteriene for ADHD.
Tegn og symptomer på ADHD ble evaluert ved å bruke den etterforsker-administrerte Conners Adult ADHD Rating Scale Screening Version (CAARS), en 30-elements skala. Det primære effektivitetsmålet var 18-elements Total ADHD Symptom-score (summen av uoppmerksomhet og hyperaktivitet/impulsivitets-subskalaene fra CAARS) evaluert ved en sammenligning av gjennomsnittlig endring fra baseline til endepunkt ved bruk av en intent-to-treat-analyse.
2 identiske, 10-ukers, randomiserte, dobbeltblinde, placebokontrollerte akuttbehandlingsstudier (Studie 5, N=280; Studie 6, N=256), fikk pasientene enten STRATTERA 25 mg eller placebo. STRATTERA ble administrert som en delt dose tidlig om morgenen og sen ettermiddag/tidlig kveld og titrert i henhold til klinisk respons i området 60 til 120 mg/dag. Gjennomsnittlig sluttdose av STRATTERA 40 mg for begge studiene var ca. 95 mg/dag. I begge studiene ble ADHD-symptomer statistisk signifikant forbedret på STRATTERA, målt på ADHD Symptom-score fra CAARS-skalaen.
Undersøkelse av populasjonsundergrupper basert på kjønn og alder (
PASIENTINFORMASJON
STRATTERA® (Stra-TAIR-a) (atomoksetin) Kapsler
Les medisinveiledningen som følger med STRATTERA® før du eller barnet ditt begynner å ta det og hver gang du får påfyll. Det kan komme ny informasjon. Denne medisinveiledningen erstatter ikke å snakke med legen din om behandlingen eller barnets behandling med STRATTERA.
Hva er den viktigste informasjonen jeg bør vite om STRATTERA 18mg?
Følgende er rapportert ved bruk av STRATTERA:
. Selvmordstanker og -handlinger hos barn og tenåringer:Barn og tenåringer tenker noen ganger på selvmord, og mange rapporterer at de prøver å drepe seg selv. Resultater fra STRATTERA kliniske studier med over 2200 barn eller tenåringer ADHD-pasienter tyder på at noen barn og tenåringer kan ha større sjanse for å ha selvmordstanker eller -handlinger. Selv om det ikke skjedde selvmord i disse studiene, utviklet 4 av hver 1000 pasienter selvmordstanker. Fortell barnets eller tenåringens lege dersom barnet eller tenåringen din (eller det er en familiehistorie om):
- . har bipolar sykdom (manisk-depressiv sykdom) . hadde selvmordstanker eller -handlinger før du startet STRATTERA
Sjansen for selvmordstanker og -handlinger kan være høyere:
- . tidlig under behandlingen med STRATTERA 10 mg . under dosejusteringer
Forhindre selvmordstanker og handlinger hos barnet ditt eller tenåringen din ved å:
- . følge nøye med på barnets eller tenåringens humør, atferd, tanker og følelser under behandlingen med STRATTERA 25 mg . holde alle oppfølgingsbesøk hos barnet eller tenåringens lege som planlagt
Se etter følgende tegn hos barnet eller tenåringen din under behandlingen med STRATTERA 25 mg:
- . angst . opphisselse . panikk anfall . problemer med å sove . irritabilitet . fiendtlighet . aggressivitet . impulsivitet . rastløshet . mani . depresjon . selvmordstanker
Ring barnets eller tenåringens lege med en gang hvis de har noen av de ovennevnte tegnene, spesielt hvis de er nye, plutselige eller alvorlige. Barnet eller tenåringen din må kanskje overvåkes nøye for selvmordstanker og -handlinger eller trenger en endring i medisin.
. Alvorlig leverskade:STRATTERA kan forårsake leverskade hos noen pasienter. Ring legen din med en gang hvis du eller barnet ditt har følgende tegn på leverproblemer:
- . kløe . smerter i høyre øvre del av magen . mørk urin . gul hud eller øyne . uforklarlige influensalignende symptomer
- . plutselig død hos pasienter som har hjerteproblemer eller hjertefeil . hjerneslag og hjerteinfarkt hos voksne . økt blodtrykk og hjertefrekvens
Fortell legen din dersom du eller barnet ditt har hjerteproblemer, hjertefeil, høyt blodtrykk eller en familiehistorie med disse problemene. Legen din bør sjekke deg eller barnet ditt nøye for hjerteproblemer før du starter STRATTERA.
Legen din bør sjekke blodtrykket ditt eller barnets blodtrykk og hjertefrekvens regelmessig under behandling med STRATTERA.
Ring legen din umiddelbart hvis du eller barnet ditt har tegn på hjerteproblemer som brystsmerter, kortpustethet eller besvimelse mens du tar STRATTERA.
. Nye psykiske (psykiatriske) problemer hos barn og tenåringer:- . nye psykotiske symptomer (som å høre stemmer, tro på ting som ikke er sant, være mistenksom) eller nye maniske symptomer
Ring legen til barnet eller tenåringen din med en gang om nye psykiske symptomer fordi justering eller avslutning av behandlingen med STRATTERA 40 mg kan være nødvendig å vurdere.
Hva er STRATTERA 18mg?
STRATTERA er en selektiv noradrenalin-reopptakshemmer. Det brukes til behandling av oppmerksomhetssvikt og hyperaktivitetsforstyrrelse (ADHD). STRATTERA kan bidra til å øke oppmerksomheten og redusere impulsivitet og hyperaktivitet hos pasienter med ADHD.
STRATTERA 10 mg bør brukes som en del av et totalt behandlingsprogram for ADHD som kan inkludere rådgivning eller andre terapier.
STRATTERA har ikke blitt undersøkt hos barn under 6 år.
Hvem bør ikke ta STRATTERA?
STRATTERA skal ikke tas hvis du eller barnet ditt:
- . tar eller har tatt i løpet av de siste 14 dagene et legemiddel mot depresjon kalt en monoaminoksidasehemmer eller MAO-hemmer. Noen navn på MAO-hemmere er Nardil® (fenelzinsulfat), Parnate® (tranylcyprominsulfat) og Emsam® (selegilin transdermalt system). . har et øyeproblem som kalles trangvinklet glaukom . er allergisk mot noe i STRATTERA. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser. . har eller har hatt en sjelden svulst kalt feokromocytom.
STRATTERA er kanskje ikke riktig for deg eller barnet ditt. Før du starter STRATTERA, fortell legen din eller barnets lege om alle helsetilstander (eller en familiehistorie av), inkludert:
- . har eller hatt selvmordstanker eller -handlinger . hjerteproblemer, hjertefeil, uregelmessig hjerterytme, høyt blodtrykk eller lavt blodtrykk . psykiske problemer, psykose, mani, bipolar sykdom eller depresjon . leverproblemer Fortell legen din dersom du eller barnet ditt er gravid, planlegger å bli gravid eller ammer.
Kan STRATTERA tas sammen med andre legemidler?
Fortell legen din om alle medisinene du eller barnet ditt tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. STRATTERA og noen legemidler kan interagere med hverandre og forårsake alvorlige bivirkninger. Legen din vil avgjøre om STRATTERA kan tas sammen med andre legemidler.
Fortell legen din spesielt hvis du eller barnet ditt tar:
- . astmamedisiner . medisiner mot depresjon inkludert MAO-hemmere . blodtrykksmedisiner . forkjølelses- eller allergimedisiner som inneholder avsvellende midler
Kjenn til medisinene du eller barnet ditt tar. Ha en liste over medisinene dine med deg for å vise legen din og apoteket.
Ikke start noen ny medisin mens du tar STRATTERA uten å snakke med legen din først.
Hvordan skal STRATTERA tas?
- . Ta STRATTERA 40 mg nøyaktig som foreskrevet. STRATTERA 18mg kommer i kapsler med forskjellige dosestyrker. Legen din kan justere dosen til den er riktig for deg eller barnet ditt. . Ikke tygg, knus eller åpne kapslene. Svelg STRATTERA kapsler hele med vann eller andre væsker. Fortell legen din dersom du eller barnet ditt ikke kan svelge STRATTERA 10 mg hel. En annen medisin må kanskje foreskrives. . Unngå å berøre en ødelagt STRATTERA 18 mg kapsel. Vask hender og overflater som berørte en åpen STRATTERA 10 mg kapsel. Hvis noe av pulveret kommer i øynene dine eller barnets øyne, skyll dem med vann med en gang og ring legen din. . STRATTERA kan tas med eller uten mat. . STRATTERA 10 mg tas vanligvis en eller to ganger daglig. Ta STRATTERA 25 mg til samme tid hver dag for å hjelpe deg å huske. Hvis du glemmer en dose STRATTERA, ta den så snart du husker den dagen. Hvis du går glipp av en dag med STRATTERA 10 mg, må du ikke doble dosen neste dag. Bare hopp over dagen du gikk glipp av. . Fra tid til annen kan legen din stoppe behandlingen med STRATTERA 25 mg en stund for å sjekke ADHD-symptomer. . Legen din kan gjøre regelmessige kontroller av blod, hjerte og blodtrykk mens du tar STRATTERA. Barn bør få sjekket høyde og vekt ofte mens de tar STRATTERA. STRATTERA-behandlingen kan stoppes hvis det oppdages et problem under disse kontrollene. . Hvis du eller barnet ditt tar for mye STRATTERA eller overdoser, ring legen din eller giftkontrollsenteret umiddelbart, eller få akuttbehandling.
Hva er mulige bivirkninger av STRATTERA?
Se "Hva er den viktigste informasjonen jeg bør vite om STRATTERA 10mg?" for informasjon om rapporterte selvmordstanker og -handlinger, andre psykiske problemer, alvorlig leverskade og hjerteproblemer.
Andre alvorlige bivirkninger inkluderer:
- . alvorlige allergiske reaksjoner (ring legen din hvis du har problemer med å puste, ser hevelse eller elveblest, eller opplever andre allergiske reaksjoner) . bremse vekst (høyde og vekt) hos barn . problemer med å tisse, inkludert
- . problemer med å starte eller holde en urinstrøm . kan ikke tømme blæren helt
Vanlige bivirkninger hos barn og tenåringer inkluderer:
- . urolig mage . nedsatt appetitt . kvalme eller oppkast . svimmelhet . tretthet . humørsvingninger
Vanlige bivirkninger hos voksne inkluderer:
- . forstoppelse . tørr i munnen . kvalme . nedsatt appetitt . svimmelhet . seksuelle bivirkninger . problemer med å tisse
Annen informasjon for barn, tenåringer og voksne:
- . Ereksjoner som ikke vil forsvinne (priapisme) har forekommet sjelden under behandling med STRATTERA. Hvis du har en ereksjon som varer mer enn 4 timer, søk medisinsk hjelp umiddelbart. På grunn av potensialet for varig skade, inkludert potensiell manglende evne til å få ereksjon, bør priapisme vurderes av en lege umiddelbart. . STRATTERA 10 mg kan påvirke din evne eller barnets evne til å kjøre bil eller bruke tunge maskiner. Vær forsiktig til du vet hvordan STRATTERA 25 mg påvirker deg eller barnet ditt. . Snakk med legen din dersom du eller barnet ditt har bivirkninger som er plagsomme eller ikke går over.
Dette er ikke en fullstendig liste over mulige bivirkninger. Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg oppbevare STRATTERA?
- . Oppbevar STRATTERA på et trygt sted ved romtemperatur, 59 til 86 °F (15 til 30 °C). . Oppbevar STRATTERA 40mg og alle legemidler utilgjengelig for barn.
Generell informasjon om STRATTERA
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk STRATTERA 25 mg for en tilstand som det ikke er foreskrevet for. Ikke gi STRATTERA andre personer, selv om de har samme tilstand. Det kan skade dem.
Denne medisinguiden oppsummerer den viktigste informasjonen om STRATTERA. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre legen din eller apoteket om informasjon om STRATTERA som er skrevet for helsepersonell. For mer informasjon om STRATTERA ring 1-800-Lilly-Rx (1-800-545-5979) eller besøk www.strattera.com.
Hva er ingrediensene i STRATTERA 40mg?
Aktiv ingrediens: atomoksetinhydroklorid.
Inaktive ingredienser: pregelatinisert stivelse, dimetikon, gelatin, natriumlaurylsulfat, FD&CBlue nr. 2, syntetisk gult jernoksid, titandioksid, rødt jernoksid og spiselig svart blekk.
Denne medisinveiledningen er godkjent av US Food and Drug Administration.
