Copegus 100mg Ribavirin Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Copegus 100mg og hvordan brukes det?
Copegus 100mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på kronisk hepatitt C. Copegus 100mg kan brukes alene eller sammen med andre medisiner.
Copegus tilhører en klasse medikamenter kalt hepatitt B/hepatitt C-midler; RSV-agenter.
Hva er de mulige bivirkningene av Copegus?
Copegus kan forårsake alvorlige bivirkninger inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . problemer med synet ditt, . sterke smerter i øvre del av magen sprer seg til ryggen, . kvalme, . oppkast, . diaré, . ny eller forverret hoste, . feber, . stikkende brystsmerter, . hvesing, . kortpustethet, . alvorlig depresjon, . tanker om selvskading eller skade på noen andre, . blek eller gulnet hud, . mørk farget urin, . forvirring, . svakhet, . frysninger, . influensalignende symptomer, . hovent tannkjøtt, . munnsår, . hudsår, . lett blåmerker, . uvanlig blødning, og . svimmelhet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Copegus inkluderer:
- . kvalme, . oppkast, . tap av Appetit, . feber, . frysninger eller risting, . lavt antall blodceller, . anemi, . svakhet, . tretthet, . hodepine, . Muskelsmerte, . humørsvingninger, . angst, og . irritabilitet
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Copegus. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
RISIKO FOR ALVORLIG LIDELSER OG RIBAVIRIN-ASSOSIERTE EFFEKTER
COPEGUS (ribavirin) monoterapi er ikke effektiv for behandling av kronisk hepatitt C-virusinfeksjon og bør ikke brukes alene for denne indikasjonen.
Den primære kliniske toksisiteten til ribavirin er hemolytisk anemi. Anemi forbundet med ribavirinbehandling kan føre til forverring av hjertesykdom og føre til dødelige og ikke-dødelige hjerteinfarkter. Pasienter med en historie med betydelig eller ustabil hjertesykdom skal ikke behandles med COPEGUS [se ADVARSLER OG FORHOLDSREGLER, BIVIRKNINGER og DOSERING OG ADMINISTRASJON].
Signifikante teratogene og/eller embryocidale effekter er påvist hos alle dyrearter som er eksponert for ribavirin. I tillegg har ribavirin en flerdose-halveringstid på 12 dager, og det kan vedvare i ikke-plasma-rom i så lenge som 6 måneder. Derfor er ribavirin, inkludert COPEGUS 100 mg, kontraindisert hos kvinner som er gravide og hos mannlige partnere til kvinner som er gravide. Ekstrem forsiktighet må utvises for å unngå graviditet under behandlingen og i 6 måneder etter avsluttet behandling hos både kvinnelige pasienter og kvinnelige partnere til mannlige pasienter som tar ribavirinbehandling. Minst to pålitelige former for effektiv prevensjon må brukes under behandlingen og i løpet av den 6-måneders oppfølgingsperioden etter behandling [se KONTRAINDIKASJONER, ADVARSLER OG FORHOLDSREGLER, og bruk i spesifikke populasjoner].
BESKRIVELSE
COPEGUS 100mg, ribavirin, er en nukleosidanalog med antiviral aktivitet. Det kjemiske navnet på ribavirin er 1-β-Dribofuranosyl-1H-1,2,4-triazol-3-karboksamid og har følgende strukturformel:
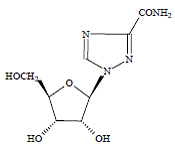
Den empiriske formelen til ribavirin er C8H12N4O5 og molekylvekten er 244,2. Ribavirin er et hvitt til off-white pulver. Det er fritt løselig i vann og lett løselig i vannfri alkohol.
COPEGUS (ribavirin) er tilgjengelig som en lys rosa til rosa farget, flat, oval, filmdrasjert tablett for oral administrering. Hver tablett inneholder 200 mg ribavirin og følgende inaktive ingredienser: pregelatinisert stivelse, mikrokrystallinsk cellulose, natriumstivelsesglykolat, maisstivelse og magnesiumstearat. Belegget på tabletten inneholder Chromatone-P eller Opadry Pink (laget ved bruk av hydroksypropylmetylcellulose, talkum, titandioksid, syntetisk gult jernoksid og syntetisk rødt jernoksid), etylcellulose (ECD-30) og triacetin.
INDIKASJONER
COPEGUS 100 mg i kombinasjon med PEGASYS (peginterferon alfa-2a) er indisert for behandling av pasienter 5 år og eldre med kronisk hepatitt C (CHC) virusinfeksjon som har kompensert leversykdom og ikke tidligere har blitt behandlet med interferon alfa.
Følgende punkter bør vurderes når man starter COPEGUS 100 mg kombinasjonsbehandling med PEGASYS:
- . Denne indikasjonen er basert på kliniske studier av kombinasjonsbehandling hos pasienter med CHC og kompensert leversykdom, hvorav noen hadde histologiske tegn på skrumplever (Child-Pugh klasse A), og hos voksne pasienter med klinisk stabil HIV-sykdom og CD4-tall over 100 celler/mm³ . . Denne indikasjonen er basert på oppnåelse av ikke-detekterbart HCV-RNA etter behandling i 24 eller 48 uker, basert på HCV-genotype, og opprettholdelse av en vedvarende virologisk respons (SVR) 24 uker etter siste dose. . Sikkerhets- og effektdata er ikke tilgjengelige for behandling lenger enn 48 uker. . Sikkerhet og effekt av COPEGUS 100 mg og PEGASYS-behandling har ikke blitt fastslått hos lever- eller andre organtransplanterte pasienter, pasienter med dekompensert leversykdom eller tidligere ikke-reagerte på interferonbehandling. . Sikkerhet og effekt av COPEGUS-behandling for behandling av adenovirus, RSV, parainfluensa eller influensainfeksjoner er ikke fastslått. COPEGUS skal ikke brukes til disse indikasjonene. Ribavirin for inhalasjon har et eget pakningsvedlegg, som bør konsulteres dersom ribavirin inhalasjonsbehandling vurderes.
DOSERING OG ADMINISTRASJON
COPEGUS 100mg bør tas sammen med mat. COPEGUS bør gis i kombinasjon med PEGASYS; det er viktig å merke seg at COPEGUS 100mg aldri skal gis som monoterapi. Se PEGASYS pakningsvedlegg for alle instruksjoner angående PEGASYS dosering og administrering.
Kronisk hepatitt C monoinfeksjon
Voksne pasienter
Den anbefalte dosen av COPEGUS 100 mg tabletter er gitt i tabell 1. Anbefalt behandlingsvarighet for pasienter som tidligere ikke har vært behandlet med ribavirin og interferon er 24 til 48 uker.
Den daglige dosen av COPEGUS 100 mg er 800 mg til 1200 mg administrert oralt i to oppdelte doser. Dosen bør tilpasses pasienten avhengig av sykdomskarakteristika ved baseline (f.eks. genotype), respons på terapi og tolerabilitet av regimet (se ).
Pediatriske pasienter
PEGASYS administreres som 180 mcg/1,73 m² x BSA en gang ukentlig subkutant, til en maksimal dose på 180 mcg, og bør gis i kombinasjon med ribavirin. Anbefalt behandlingsvarighet for pasienter med genotype 2 eller 3 er 24 uker og for andre genotyper er 48 uker.
COPEGUS bør gis i kombinasjon med PEGASYS. COPEGUS 100 mg er kun tilgjengelig som en 200 mg tablett, og derfor bør helsepersonell avgjøre om denne størrelse tabletten kan svelges av den pediatriske pasienten. De anbefalte dosene for COPEGUS er gitt i tabell 2. Pasienter som starter behandling før 18-årsdagen bør opprettholde pediatrisk dosering gjennom fullføring av behandlingen.
Kronisk hepatitt C med HIV-kombinasjon
Voksne pasienter
Den anbefalte dosen for behandling av kronisk hepatitt C hos pasienter samtidig med HIV er PEGASYS 180 mcg subkutant én gang ukentlig og COPEGUS 800 mg gjennom munnen daglig i en total varighet på 48 uker, uavhengig av HCV-genotype.
Doseendringer
Voksne og pediatriske pasienter
Hvis det oppstår alvorlige bivirkninger eller laboratorieavvik under kombinasjonsbehandling med COPEGUS/PEGASYS, bør dosen endres eller seponeres, om nødvendig, inntil bivirkningene avtar eller reduseres i alvorlighetsgrad. Hvis intoleransen vedvarer etter dosejustering, bør COPEGUS/PEGASYS-behandlingen seponeres. Tabell 3 gir retningslinjer for doseendringer og seponering basert på pasientens hemoglobinkonsentrasjon og hjertestatus.
COPEGUS 100 mg bør administreres med forsiktighet til pasienter med allerede eksisterende hjertesykdom. Pasienter bør vurderes før behandlingsstart og bør overvåkes hensiktsmessig under behandlingen. Hvis det er noen forverring av kardiovaskulær status, bør behandlingen avbrytes [se ADVARSLER OG FORHOLDSREGLER ].
Retningslinjene for COPEGUS 100 mg dosemodifikasjoner skissert i denne tabellen gjelder også for laboratorieavvik eller andre bivirkninger enn reduksjoner i hemoglobinverdier.
Voksne pasienter
Når COPEGUS 100 mg har blitt holdt tilbake på grunn av enten laboratorieavvik eller klinisk bivirkning, kan det gjøres et forsøk på å starte COPEGUS 100 mg på nytt med 600 mg daglig og øke dosen ytterligere til 800 mg daglig. Det anbefales imidlertid ikke å øke COPEGUS til den opprinnelige tildelte dosen (1000 mg til 1200 mg).
Pediatriske pasienter
Ved oppløsning av en laboratorieavvik eller klinisk bivirkning, kan en økning i COPEGUS 100 mg dose til den opprinnelige dosen forsøkes avhengig av legens vurdering. Hvis COPEGUS har blitt holdt tilbake på grunn av en laboratorieavvik eller klinisk bivirkning, kan det gjøres et forsøk på å starte COPEGUS 100 mg på nytt med halvparten av full dose.
Nedsatt nyrefunksjon
Den totale daglige dosen av COPEGUS bør reduseres for pasienter med kreatininclearance mindre enn eller lik 50 ml/min. og den ukentlige dosen av PEGASYS bør reduseres for kreatininclearance mindre enn 30 ml/min som følger i tabell 4 [se Bruk i spesifikke populasjoner , Farmakokinetikk , og PEGASYS pakningsvedlegg ].
Dosen av COPEGUS 100 mg bør ikke endres ytterligere hos pasienter med nedsatt nyrefunksjon. Hvis det oppstår alvorlige bivirkninger eller laboratorieavvik, bør COPEGUS seponeres, om nødvendig, inntil bivirkningene avtar eller reduseres i alvorlighetsgrad. Hvis intoleransen vedvarer etter restart av COPEGUS 100 mg, bør COPEGUS/PEGASYS-behandlingen avbrytes.
Ingen data er tilgjengelig for pediatriske personer med nedsatt nyrefunksjon.
Seponering av dosering
Seponering av PEGASYS/COPEGUS 100 mg-behandling bør vurderes hvis pasienten ikke har klart å demonstrere en reduksjon på minst 2 log10 fra baseline i HCV-RNA med 12 ukers behandling, eller upåviselige HCV-RNA-nivåer etter 24 ukers behandling.
Behandling med PEGASYS/COPEGUS 100 mg bør seponeres hos pasienter som utvikler leverdekompensasjon under behandlingen [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERES
Doseringsformer og styrker
COPEGUS (ribavirin) er tilgjengelig som en lys rosa til rosa farget, flat, oval, filmdrasjert tablett for oral administrering. Hver tablett inneholder 200 mg ribavirin.
COPEGUS® (ribavirin) er tilgjengelig som tabletter for oral administrering. Hver tablett inneholder 200 mg ribavirin og er lys rosa til rosa, flat, oval, filmdrasjert og merket med RIB 200 på den ene siden og ROCHE på den andre siden. De er pakket som en flaske med 168 tabletter ( NDC 0004-0086-94).
Oppbevaring og håndtering
Oppbevar COPEGUS® Tablets-flasken ved 25°C (77°F); utflukter er tillatt mellom 15°C og 30°C (59°F og 86°F) [se USP kontrollert romtemperatur ]. Hold flasken tett lukket.
Produsert av: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Medlem av Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990. Revidert: august 2015
BIVIRKNINGER
PEGASYS i kombinasjon med COPEGUS forårsaker en lang rekke alvorlige bivirkninger [se ADVARSEL i boks og ADVARSLER OG FORHOLDSREGLER ]. De vanligste alvorlige eller livstruende bivirkningene indusert eller forverret av COPEGUS/PEGASYS inkluderer depresjon, selvmord, tilbakefall av narkotikamisbruk/overdose og bakterielle infeksjoner som hver forekommer med en frekvens på mindre enn 1 %. Leverdekompensasjon oppstod hos 2 % (10/574) CHC/HIV-pasienter [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring fra kliniske studier
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
Voksne pasienter
I de pivotale registreringsforsøkene NV15801 og NV15942 fikk 886 pasienter COPEGUS i 48 uker i doser på 1000/1200 mg basert på kroppsvekt. I disse studiene oppsto en eller flere alvorlige bivirkninger hos 10 % av monoinfiserte pasienter med CHC og hos 19 % av pasienter med CHC/HIV som fikk PEGASYS alene eller i kombinasjon med COPEGUS. Den vanligste alvorlige bivirkningen (3 % ved CHC og 5 % ved CHC/HIV) var bakteriell infeksjon (f.eks. sepsis, osteomyelitt, endokarditt, pyelonefritt, lungebetennelse).
Andre alvorlige bivirkninger forekom med en frekvens på mindre enn 1 % og inkluderte: selvmord, selvmordstanker, psykose, aggresjon, angst, narkotikamisbruk og overdose, angina, leverdysfunksjon, fettlever, kolangitt, arytmi, diabetes mellitus, autoimmune fenomener (f.eks. hypertyreose, hypotyreose, sarkoidose, systemisk lupus erythematosus, revmatoid artritt), perifer nevropati, aplastisk anemi, magesår, gastrointestinal blødning, pankreatitt, kolitt, hornhinnesår, pulmonal emboli, lungeemboli, hembocytt, lungeemboli, psykotisk lidelse og hallusinasjoner.
Andelen pasienter i kliniske studier som opplevde én eller flere bivirkninger var 98 %. De vanligst rapporterte bivirkningene var psykiatriske reaksjoner, inkludert depresjon, søvnløshet, irritabilitet, angst og influensalignende symptomer som tretthet, feber, myalgi, hodepine og rigor. Andre vanlige reaksjoner var anoreksi, kvalme og oppkast, diaré, artralgier, reaksjoner på injeksjonsstedet, alopecia og kløe.
viser frekvenser av uønskede hendelser som forekommer hos mer enn eller lik 5 % av pasientene som fikk kombinasjonsbehandling med pegylert interferon og ribavirin i CHC Clinical Trial, NV15801.
Ti prosent av monoinfiserte CHC-pasienter som fikk 48 ukers behandling med PEGASYS i kombinasjon med COPEGUS 100 mg, avbrøt behandlingen; 16 % av CHC/HIV-saminfiserte pasienter avbrøt behandlingen. De vanligste årsakene til seponering av behandlingen var psykiatrisk, influensalignende syndrom (f.eks. sløvhet, tretthet, hodepine), dermatologiske og gastrointestinale lidelser og laboratorieavvik (trombocytopeni, nøytropeni og anemi).
Totalt krevde 39 % av pasientene med CHC eller CHC/HIV modifikasjon av PEGASYS- og/eller COPEGUS-behandlingen. Den vanligste årsaken til doseendring av PEGASYS hos CHC- og CHC/HIV-pasienter var laboratorieavvik; nøytropeni (henholdsvis 20 % og 27 %) og trombocytopeni (henholdsvis 4 % og 6 %). Den vanligste årsaken til doseendring av COPEGUS hos CHC- og CHC/HIV-pasienter var anemi (henholdsvis 22 % og 16 %).
PEGASYS-dosen ble redusert hos 12 % av pasientene som fikk 1000 mg til 1200 mg COPEGUS 100 mg i 48 uker og hos 7 % av pasientene som fikk 800 mg COPEGUS i 24 uker. COPEGUS-dosen ble redusert hos 21 % av pasientene som fikk 1000 mg til 1200 mg COPEGUS 100 mg i 48 uker og hos 12 % av pasientene som fikk 800 mg COPEGUS 100 mg i 24 uker.
Monoinfiserte pasienter med kronisk hepatitt C behandlet i 24 uker med PEGASYS og 800 mg COPEGUS 100 mg ble observert å ha lavere forekomst av alvorlige bivirkninger (3 % vs. 10 %), hemoglobin mindre enn 10 g/dL (3 % vs. 15 %) , doseendring av PEGASYS (30 % vs. 36 %) og COPEGUS (19 % vs. 38 %), og av seponering fra behandling (5 % vs. 15 %) sammenlignet med pasienter behandlet i 48 uker med PEGASYS og 1000 mg eller 1200 mg COPEGUS. På den annen side så den totale forekomsten av uønskede hendelser ut til å være lik i de to behandlingsgruppene.
Pediatriske pasienter
en klinisk studie med 114 pediatriske forsøkspersoner (5 til 17 år) behandlet med PEGASYS alene eller i kombinasjon med COPEGUS 100 mg, var doseendringer nødvendig hos omtrent en tredjedel av pasientene, oftest for nøytropeni og anemi. Generelt var sikkerhetsprofilen observert hos pediatriske personer lik den som ble sett hos voksne. I den pediatriske studien var de vanligste bivirkningene hos personer behandlet med kombinasjonsbehandling PEGASYS og COPEGUS 100 mg i opptil 48 uker influensalignende sykdom (91 %), øvre luftveisinfeksjon (60 %), hodepine (64 %), gastrointestinal lidelse (56 %), hudlidelse (47 %) og reaksjon på injeksjonsstedet (45 %). Syv personer som fikk kombinasjonsbehandling med PEGASYS og COPEGUS i 48 uker, avbrøt behandlingen av sikkerhetsgrunner (depresjon, unormal psykiatrisk evaluering, forbigående blindhet, netthinneeksudater, hyperglykemi, type 1 diabetes mellitus og anemi). Alvorlige bivirkninger ble rapportert hos 2 personer i gruppen PEGASYS pluss COPEGUS 100 mg kombinasjonsterapi (hyperglykemi og kolecystektomi).
Hos pediatriske forsøkspersoner randomisert til kombinasjonsbehandling var forekomsten av de fleste bivirkninger lik for hele behandlingsperioden (opptil 48 uker pluss 24 ukers oppfølging) sammenlignet med de første 24 ukene, og økte bare litt for hodepine, gastrointestinale lidelser , irritabilitet og utslett. De fleste bivirkningene oppsto i løpet av de første 24 ukene av behandlingen.
Veksthemming hos pediatriske personer
[se ADVARSLER OG FORHOLDSREGLER ].
Pediatriske personer behandlet med PEGASYS pluss ribavirin kombinasjonsterapi viste en forsinkelse i vekt- og høydeøkning med opptil 48 ukers behandling sammenlignet med baseline. Både vekt for alder og høyde for alder z-score samt persentilene til den normative populasjonen for forsøkspersonens vekt og høyde sank under behandlingen. Ved slutten av 2 års oppfølging etter behandling hadde de fleste forsøkspersonene gått tilbake til normative kurvepersentiler for baseline for vekt (64. gjennomsnittspersentil ved baseline, 60. gjennomsnittspersentil 2 år etter behandling) og høyde (54. gjennomsnittspersentil ved baseline, 56. gjennomsnittlig persentil 2 år etter behandling). Ved slutten av behandlingen opplevde 43 % (23 av 53) av forsøkspersonene en vektpersentilreduksjon på mer enn 15 persentiler, og 25 % (13 av 53) opplevde en høydepersentilreduksjon på mer enn 15 persentil på de normative vekstkurvene. 2 år etter behandling var 16 % (6 av 38) av forsøkspersonene mer enn 15 persentiler under vektkurven ved baseline og 11 % (4 av 38) var mer enn 15 persentiler under høydekurven ved baseline.
Trettiåtte av de 114 forsøkspersonene ble registrert i den langsiktige oppfølgingsstudien, som strekker seg opptil 6 år etter behandling. For de fleste forsøkspersoner ble gjenoppretting av vekst etter behandling 2 år etter behandling opprettholdt til 6 år etter behandling.
Vanlige bivirkninger ved CHC med HIV-saminfeksjon (voksne)
Bivirkningsprofilen for samtidig infiserte pasienter behandlet med PEGASYS/COPEGUS i studie NR15961 var generelt lik den som ble vist for monoinfiserte pasienter i studie NV15801 (tabell 5). Hendelser som forekom hyppigere hos pasienter med samtidig infeksjon var nøytropeni (40 %), anemi (14 %), trombocytopeni (8 %), vektreduksjon (16 %) og humørsendring (9 %).
Unormale laboratorieprøver
Voksne pasienter
Anemi på grunn av hemolyse er den mest signifikante toksisiteten ved ribavirinbehandling. Anemi (hemoglobin mindre enn 10 g/dL) ble observert hos 13 % av alle COPEGUS- og PEGASYS-kombinasjonsbehandlede pasienter i kliniske studier. Det maksimale hemoglobinfallet skjedde i løpet av de første 8 ukene etter oppstart av ribavirinbehandling [se DOSERING OG ADMINISTRASJON ].
Pediatriske pasienter
Nedgang i hemoglobin, nøytrofiler og blodplater kan kreve dosereduksjon eller permanent seponering av behandlingen [se DOSERING OG ADMINISTRASJON ]. De fleste laboratorieavvik som ble notert under den kliniske studien, returnerte til baseline-nivåer kort tid etter avsluttet behandling.
Hos pasienter randomisert til kombinasjonsbehandling økte forekomsten av abnormiteter under hele behandlingsfasen (opptil 48 uker pluss 24 ukers oppfølging) i forhold til de første 24 ukene noe for nøytrofiler mellom 500 og 1000 celler/mm³ og hemoglobinverdier mellom 8,5 og 10 g/dL. De fleste hematologiske abnormiteter oppsto i løpet av de første 24 ukene av behandlingen.
Postmarketing-erfaring
Følgende bivirkninger er identifisert og rapportert under bruk av PEGASYS/COPEGUS 100 mg kombinasjonsbehandling etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Blod- og lymfesystemlidelser
Ren rødcelleaplasi
Øre- og labyrintlidelser
Hørselsnedsettelse, hørselstap
Øyelidelser
Serøs netthinneløsning
Immunforstyrrelser
Lever- og nyretransplantatavstøtning
Metabolisme og ernæringsforstyrrelser
Dehydrering
Hud- og subkutane vevslidelser
Stevens-Johnson syndrom (SJS)
Toksisk epidermal nekrolyse (TEN)
NARKOTIKAHANDEL
Resultater fra en farmakokinetisk sub-studie viste ingen farmakokinetisk interaksjon mellom PEGASYS (peginterferon alfa-2a) og ribavirin.
Nukleosid revers transkriptasehemmere (NRTI)
In vitro-data indikerer at ribavirin reduserer fosforylering av lamivudin, stavudin og zidovudin. Imidlertid ble ingen farmakokinetisk (f.eks. plasmakonsentrasjoner eller intracellulære trifosforylerte aktive metabolittkonsentrasjoner) eller farmakodynamiske (f.eks. tap av HIV/HCV virologisk undertrykkelse) interaksjon observert når ribavirin og lamivudin (n=18), stavudin (n=10), eller zidovudin (n=6) ble administrert samtidig som en del av et multimedikamentregime til HCV/HIV-saminfiserte pasienter.
I studie NR15961 blant CHC/HIV-saminfiserte cirrhotiske pasienter som fikk NRTI, ble tilfeller av leverdekompensasjon (noen dødelig) observert [se ADVARSLER OG FORHOLDSREGLER ].
Pasienter som får PEGASYS/COPEGUS 100 mg og NRTIer bør overvåkes nøye for behandlingsassosierte toksisiteter. Leger bør henvise til forskrivningsinformasjon for de respektive NRTI-ene for veiledning angående toksisitetshåndtering. I tillegg bør dosereduksjon eller seponering av PEGASYS, COPEGUS 100 mg eller begge vurderes hvis forverrede toksisiteter observeres, inkludert leverdekompensasjon (f.eks. Child-Pugh større enn eller lik 6) [se ADVARSLER OG FORHOLDSREGLER og DOSERING OG ADMINISTRASJON ].
Didanosin
Samtidig administrering av COPEGUS og didanosin er kontraindisert. Konsentrasjonene av didanosin eller dets aktive metabolitt (dideoksyadenosin 5'-trifosfat) øker når didanosin administreres samtidig med ribavirin, noe som kan forårsake eller forverre klinisk toksisitet. Rapporter om fatal leversvikt så vel som perifer nevropati, pankreatitt og symptomatisk hyperlaktatemi/laktacidose er rapportert i kliniske studier [se KONTRAINDIKASJONER ].
Zidovudin
studie NR15961 utviklet pasienter som ble administrert zidovudin i kombinasjon med PEGASYS/COPEGUS alvorlig nøytropeni (ANC mindre enn 500) og alvorlig anemi (hemoglobin mindre enn 8 g/dL) hyppigere enn tilsvarende pasienter som ikke fikk zidovudin (nøytropeni 15 %). 9 %) (anemi 5 % vs. 1 %). Seponering av zidovudin bør anses som medisinsk hensiktsmessig.
Legemidler metabolisert av Cytokrom P450
In vitro-studier indikerer at ribavirin ikke hemmer CYP 2C9, CYP 2C19, CYP 2D6 eller CYP 3A4.
Azatioprin
Bruk av ribavirin for å behandle kronisk hepatitt C hos pasienter som får azatioprin har blitt rapportert å indusere alvorlig pancytopeni og kan øke risikoen for azatioprin-relatert myelotoksisitet. Inosinmonofosfatdehydrogenase (IMDH) er nødvendig for en av metabolske veier til azatioprin. Ribavirin er kjent for å hemme IMDH, og dermed føre til akkumulering av en azatioprinmetabolitt, 6-metyltioinosinmonofosfat (6-MTITP), som er assosiert med myelotoksisitet (nøytropeni, trombocytopeni og anemi). Pasienter som får azatioprin sammen med ribavirin bør ha fullstendige blodtellinger, inkludert blodplatetall, overvåket ukentlig den første måneden, to ganger månedlig i den andre og tredje måneden av behandlingen, deretter månedlig eller oftere hvis dosendringer eller andre behandlingsendringer er nødvendig [se ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Signifikante bivirkninger assosiert med COPEGUS/PEGASYS kombinasjonsbehandling inkluderer alvorlig depresjon og selvmordstanker, hemolytisk anemi, undertrykkelse av benmargsfunksjon, autoimmune og infeksjonssykdommer, oftalmologiske lidelser, cerebrovaskulære lidelser, pulmonal dysfunksjon, kolitt, pankreatitt og diabetes.
PEGASYS pakningsvedlegget bør gjennomgås i sin helhet for ytterligere sikkerhetsinformasjon før oppstart av kombinasjonsbehandling.
Svangerskap
COPEGUS 100mg kan forårsake fødselsskader og/eller død hos det eksponerte fosteret. Ribavirin har vist signifikante teratogene og/eller embryocidale effekter hos alle dyrearter der tilstrekkelige studier er utført. Disse effektene oppsto ved doser så lave som en tjuendedel av den anbefalte humane dosen av ribavirin.
COPEGUS-behandling skal ikke startes med mindre en rapport om en negativ graviditetstest er innhentet rett før planlagt behandlingsstart. Ekstrem forsiktighet må utvises for å unngå graviditet hos kvinnelige pasienter og hos kvinnelige partnere til mannlige pasienter. Pasienter bør instrueres om å bruke minst to former for effektiv prevensjon under behandlingen og i 6 måneder etter at behandlingen er avsluttet. Graviditetstesting bør utføres månedlig under COPEGUS 100 mg-behandling og i 6 måneder etter at behandlingen er avsluttet [se ADVARSEL i boks , KONTRAINDIKASJONER , Bruk i spesifikke populasjoner , og PASIENTINFORMASJON ].
Anemi
Den primære toksisiteten til ribavirin er hemolytisk anemi, som ble observert hos omtrent 13 % av alle COPEGUS/PEGASYS-behandlede forsøkspersoner i kliniske studier. Anemi assosiert med COPEGUS 100 mg oppstår innen 1 til 2 uker etter oppstart av behandlingen. Fordi det første fallet i hemoglobin kan være betydelig, anbefales det at hemoglobin eller hematokrit oppnås forbehandling og ved uke 2 og uke 4 av behandlingen eller oftere hvis det er klinisk indisert. Pasienter bør deretter følges etter klinisk hensikt. Forsiktighet bør utvises ved oppstart av behandling hos alle pasienter med grunnlinjerisiko for alvorlig anemi (f.eks. sfærocytose, gastrointestinal blødning i anamnesen) [se DOSERING OG ADMINISTRASJON ].
Fatale og ikke-dødelige hjerteinfarkter er rapportert hos pasienter med anemi forårsaket av COPEGUS. Pasienter bør vurderes for underliggende hjertesykdom før oppstart av ribavirinbehandling. Pasienter med allerede eksisterende hjertesykdom bør ha elektrokardiogram administrert før behandling, og bør overvåkes på passende måte under behandlingen. Hvis det er noen forverring av kardiovaskulær status, bør behandlingen avbrytes eller avbrytes [se DOSERING OG ADMINISTRASJON ]. Fordi hjertesykdom kan forverres av legemiddelindusert anemi, bør pasienter med en historie med betydelig eller ustabil hjertesykdom ikke bruke COPEGUS [se ADVARSEL i boks og DOSERING OG ADMINISTRASJON ].
Leversvikt
Pasienter med kronisk hepatitt C (CHC) med cirrhose kan ha risiko for leverdekompensasjon og død når de behandles med alfa-interferoner, inkludert PEGASYS. Pasienter med cirrhotic CHC samtidig med HIV som får høyaktiv antiretroviral terapi (HAART) og interferon alfa-2a med eller uten ribavirin ser ut til å ha økt risiko for utvikling av leverdekompensasjon sammenlignet med pasienter som ikke får HAART. I studie NR15961 [se Kliniske studier ], blant 129 CHC/HIV-cirrhotiske pasienter som fikk HAART, utviklet 14 (11 %) av disse pasientene i alle behandlingsarmene leverdekompensasjon som resulterte i 6 dødsfall. Alle 14 pasientene var på NRTI, inkludert stavudin, didanosin, abakavir, zidovudin og lamivudin. Dette lille antallet pasienter tillater ikke diskriminering mellom spesifikke NRTI-er eller tilhørende risiko. Under behandlingen bør pasientens kliniske status og leverfunksjon overvåkes nøye for tegn og symptomer på leverdekompensasjon. Behandling med PEGASYS/COPEGUS 100 mg bør avbrytes umiddelbart hos pasienter med leverdekompensasjon [se KONTRAINDIKASJONER ].
Overfølsomhet
Alvorlige akutte overfølsomhetsreaksjoner (f.eks. urticaria, angioødem, bronkokonstriksjon og anafylaksi) er observert under alfa-interferon- og ribavirinbehandling. Hvis en slik reaksjon oppstår, bør behandlingen med PEGASYS og COPEGUS 100 mg avbrytes umiddelbart og passende medisinsk behandling settes i gang. Alvorlige hudreaksjoner inkludert vesikulobulløse utbrudd, reaksjoner i spekteret av Stevens-Johnsons syndrom (erythema multiforme major) med varierende grad av hud- og slimhinneinvolvering og eksfoliativ dermatitt (erytrodermi) er rapportert hos pasienter som får PEGASYS med og uten ribavirin. Pasienter som utvikler tegn eller symptomer på alvorlige hudreaksjoner, må avbryte behandlingen [se BIVIRKNINGER ].
Lungelidelser
Dyspné, lungeinfiltrater, pneumonitt, pulmonal hypertensjon og lungebetennelse er rapportert under behandling med ribavirin og interferon. Det har forekommet sporadiske tilfeller av dødelig lungebetennelse. I tillegg er det rapportert om sarkoidose eller forverring av sarkoidose. Hvis det er tegn på lungeinfiltrater eller lungefunksjonssvikt, bør pasientene overvåkes nøye, og hvis det er hensiktsmessig bør kombinasjonsbehandling med COPEGUS/PEGASYS seponeres.
Benmargsundertrykkelse
Pancytopeni (markert reduksjon i røde blodlegemer, nøytrofiler og blodplater) og benmargssuppresjon er rapportert i litteraturen å oppstå innen 3 til 7 uker etter samtidig administrering av pegylert interferon/ribavirin og azatioprin. Hos dette begrensede antallet pasienter (n=8) var myelotoksisiteten reversibel innen 4 til 6 uker etter seponering av både HCV antiviral behandling og samtidig azatioprin og kom ikke tilbake ved gjeninnføring av noen av behandlingene alene. PEGASYS, COPEGUS 100 mg og azatioprin bør seponeres for pancytopeni, og pegylert interferon/ribavirin bør ikke re-introduseres med samtidig azatioprin [se NARKOTIKAHANDEL ].
Pankreatitt
Behandling med COPEGUS og PEGASYS bør avbrytes hos pasienter med tegn og symptomer på pankreatitt, og seponeres hos pasienter med bekreftet pankreatitt.
Virkning på vekst hos pediatriske pasienter
Under kombinasjonsbehandling i opptil 48 uker med PEGASYS pluss ribavirin, ble vekstinhibering observert hos pediatriske personer i alderen 5 til 17 år. Reduksjon i vekt for alder z-score og høyde for alder z-score opp til 48 ukers behandling sammenlignet med baseline ble observert. 2 år etter behandling var 16 % av pediatriske forsøkspersoner mer enn 15 persentiler under vektkurven ved baseline og 11 % var mer enn 15 persentiler under høydekurven ved baseline.
De tilgjengelige langtidsdataene om forsøkspersoner som ble fulgt opp til 6 år etter behandling er for begrenset til å bestemme risikoen for redusert voksenhøyde hos noen pasienter [se Erfaring fra kliniske studier ].
Laboratorietester
Før du starter PEGASYS/COPEGUS kombinasjonsbehandling, anbefales standard hematologiske og biokjemiske laboratorietester for alle pasienter. Graviditetsscreening for kvinner i fertil alder må utføres. Pasienter som har allerede eksisterende hjerteabnormaliteter bør få elektrokardiogram gitt før behandling med PEGASYS/COPEGUS.
Etter oppstart av behandlingen bør hematologiske tester utføres etter 2 uker og 4 uker, og biokjemiske tester bør utføres etter 4 uker. Ytterligere testing bør utføres med jevne mellomrom under behandlingen. I kliniske studier hos voksne ble CBC (inkludert hemoglobinnivå og antall hvite blodlegemer og blodplater) og kjemi (inkludert leverfunksjonstester og urinsyre) målt etter 1, 2, 4, 6 og 8 uker, og deretter hver 4. 6 uker eller oftere hvis det ble funnet abnormiteter. I den pediatriske kliniske studien var hematologiske og kjemiske vurderinger etter 1, 3, 5 og 8 uker, deretter hver 4. uke. Skjoldbruskstimulerende hormon (TSH) ble målt hver 12. uke. Månedlig graviditetstesting bør utføres under kombinasjonsbehandling og i 6 måneder etter avsluttet behandling.
Inngangskriteriene som brukes for de kliniske studiene av COPEGUS 100mg og PEGASYS kan betraktes som en retningslinje for akseptable baseline-verdier for oppstart av behandling:
- . Blodplateantall større enn eller lik 90 000 celler/mm³ (så lavt som 75 000 celler/mm³ hos HCV-pasienter med cirrhose eller 70 000 celler/mm³ hos pasienter med CHC og HIV) . Absolutt nøytrofiltall (ANC) større enn eller lik 1500 celler/mm³ . TSH og T4 innenfor normale grenser eller tilstrekkelig kontrollert skjoldbruskkjertelfunksjon . CD4+-celletall større enn eller lik 200 celler/mm³ eller CD4+-celleantall større enn eller lik 100 celler/mm³, men mindre enn 200 celler/mm³ og HIV-1-RNA mindre enn 5000 kopier/ml hos pasienter som er samtidig infisert med HIV . Hemoglobin større enn eller lik 12 g/dL for kvinner og større enn eller lik 13 g/dL for menn hos monoinfiserte CHC-pasienter . Hemoglobin større enn eller lik 11 g/dL for kvinner og større enn eller lik 12 g/dL for menn hos pasienter med CHC og HIV
Informasjon om pasientveiledning
- . Se FDA-godkjent pasientmerking (medisineringsveiledning)
Svangerskap
Pasienter må informeres om at ribavirin kan forårsake fødselsskader og/eller død hos det eksponerte fosteret. COPEGUS 100 mg terapi må ikke brukes av kvinner som er gravide eller av menn hvis kvinnelige partnere er gravide. Ekstrem forsiktighet må utvises for å unngå graviditet hos kvinnelige pasienter og hos kvinnelige partnere til mannlige pasienter som tar COPEGUS-behandling og i 6 måneder etter behandling. Pasienter bør bruke to pålitelige prevensjonsmetoder mens de tar COPEGUS-behandling og i 6 måneder etter behandling. COPEGUS-behandling skal ikke startes før en rapport om en negativ graviditetstest er innhentet rett før behandlingsstart. Pasienter må utføre en graviditetstest månedlig under behandlingen og i 6 måneder etter behandlingen.
Kvinnelige pasienter i fertil alder og mannlige pasienter med kvinnelige partnere i fertil alder må informeres om teratogene/embryocidale risikoer og må instrueres om å bruke effektiv prevensjon under COPEGUS-behandling og i 6 måneder etter behandling. Pasienter bør rådes til å varsle helsepersonell umiddelbart i tilfelle graviditet [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Anemi
Den vanligste bivirkningen forbundet med ribavirin er anemi, som kan være alvorlig [se ADVARSEL i boks , ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ]. Pasienter bør informeres om at laboratorieevalueringer er nødvendig før oppstart av COPEGUS-behandling og med jevne mellomrom etterpå [se ADVARSLER OG FORHOLDSREGLER ]. Det anbefales at pasienter er godt hydrert, spesielt i de innledende stadiene av behandlingen.
Pasienter som utvikler svimmelhet, forvirring, somnolens og tretthet bør advares mot å kjøre bil eller bruke maskiner.
Pasienter bør rådes til å ta COPEGUS 100 mg sammen med mat.
Pasienter bør avhøres om tidligere narkotikamisbruk før oppstart av COPEGUS/PEGASYS, ettersom tilbakefall av medikamentavhengighet og overdoser er rapportert hos pasienter behandlet med interferoner.
Pasienter bør rådes til ikke å drikke alkohol, da alkohol kan forverre kronisk hepatitt C-infeksjon.
Pasienter bør informeres om hva de skal gjøre dersom de glemmer en dose COPEGUS. De glemte dosene bør tas så snart som mulig i løpet av samme dag. Pasienter bør ikke doble neste dose. Pasienter bør rådes til å ringe helsepersonell dersom de har spørsmål.
Pasienter bør informeres om at effekten av PEGASYS/COPEGUS-behandling av hepatitt C-infeksjon på overføring ikke er kjent, og at passende forholdsregler for å forhindre overføring av hepatitt C-virus under behandling eller ved behandlingssvikt bør tas.
Pasienter bør informeres om potensielle fordeler og risikoer forbundet med bruk av COPEGUS. Instruksjoner om riktig bruk bør gis, inkludert gjennomgang av innholdet i vedlagte MEDISINERINGSVEILEDNING , som ikke er en avsløring av alle eller mulige bivirkninger.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
I en p53 (+/-) mus karsinogenitetsstudie opp til maksimal tolerert dose på 100 mg/kg/dag, var ribavirin ikke onkogent. Ribavirin var heller ikke onkogent i en 2-årig karsinogenitetsstudie hos rotter ved doser opp til den maksimalt tolererte dosen på 60 mg/kg/dag. På basis av kroppsoverflate er disse dosene henholdsvis omtrent 0,5 og 0,6 ganger den maksimale anbefalte daglige dosen av ribavirin til mennesker.
Mutagenese
Ribavirin viste mutagen aktivitet i in vitro muselymfomanalysen. Ingen klastogen aktivitet ble observert i en in vivo musemikronukleusanalyse ved doser opp til 2000 mg/kg. Imidlertid viser resultater fra studier publisert i litteraturen klastogen aktivitet i in vivo musemikronukleusanalysen ved orale doser opp til 2000 mg/kg. En dominant dødelig analyse hos rotter var negativ, noe som indikerer at hvis mutasjoner oppsto i rotter, ble de ikke overført gjennom hannkjønnsceller.
Nedsatt fertilitet
en fertilitetsstudie på rotter viste ribavirin en marginal reduksjon i spermatall ved dosen 100 mg/kg/dag uten effekt på fertiliteten. Ved avslutning av behandlingen skjedde total bedring etter 1 spermatogenesesyklus. Abnormiteter i sæd ble observert i studier på mus designet for å evaluere tidsforløpet og reversibiliteten av ribavirin-indusert testikkeldegenerasjon ved doser på 15 til 150 mg/kg/dag (omtrent 0,1 til 0,8 ganger den maksimale anbefalte daglige dosen av ribavirin) administrert. i 3 til 6 måneder. Ved seponering av behandlingen var i det vesentlige total bedring fra ribavirinindusert testikkeltoksisitet tydelig innen 1 eller 2 spermatogene sykluser.
Kvinnelige pasienter i fertil alder og mannlige pasienter med kvinnelige partnere i fertil alder bør ikke få COPEGUS med mindre pasienten og hans/hennes partner bruker effektiv prevensjon (to pålitelige former). Basert på en flerdosehalveringstid (t½) av ribavirin på 12 dager, må effektiv prevensjon brukes i 6 måneder etter behandling (dvs. 15 halveringstider for clearance for ribavirin).
Ingen reproduksjonstoksikologiske studier er utført ved bruk av PEGASYS i kombinasjon med COPEGUS. Imidlertid har peginterferon alfa-2a og ribavirin, når de administreres separat, uønskede effekter på reproduksjonen. Det bør antas at effektene som produseres av begge midlene alene, også vil være forårsaket av kombinasjonen av de to midlene.
Bruk i spesifikke populasjoner
Svangerskap
Kategori X [se KONTRAINDIKASJONER ]. Ribavirin ga betydelige embryocidale og/eller teratogene effekter hos alle dyrearter der tilstrekkelige studier er utført. Misdannelser i hodeskallen, ganen, øyet, kjeven, lemmer, skjelett og mage-tarmkanalen ble notert. Forekomsten og alvorlighetsgraden av teratogene effekter økte med eskalering av medikamentdosen. Overlevelse av fostre og avkom ble redusert [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
I konvensjonelle embryotoksisitets-/teratogenesitetsstudier på rotter og kaniner, var de observerte dosenivåene uten effekt godt under de for foreslått klinisk bruk (0,3 mg/kg/dag for både rotte og kanin; omtrent 0,06 ganger anbefalt daglig dose av ribavirin til mennesker) . Ingen maternell toksisitet eller effekter på avkom ble observert i en peri/postnatal toksisitetsstudie på rotter doseret oralt med opptil 1 mg/kg/dag (omtrent 0,01 ganger maksimal anbefalt daglig dose av ribavirin til mennesker).
Behandling og etterbehandling: Potensiell risiko for fosteret
Ribavirin er kjent for å akkumulere i intracellulære komponenter hvorfra det fjernes veldig sakte. Det er ikke kjent om ribavirin finnes i sædceller, og i så fall vil det ha en potensiell teratogene effekt ved befruktning av eggene. Men på grunn av de potensielle humane teratogene effektene av ribavirin, bør mannlige pasienter rådes til å ta alle forholdsregler for å unngå risiko for graviditet for sine kvinnelige partnere.
COPEGUS skal ikke brukes av gravide kvinner eller av menn hvis kvinnelige partnere er gravide. Kvinnelige pasienter i fertil alder og mannlige pasienter med kvinnelige partnere i fertil alder bør ikke få COPEGUS med mindre pasienten og hans/hennes partner bruker effektiv prevensjon (to pålitelige former) under behandlingen og i 6 måneder etter behandling [se KONTRAINDIKASJONER ].
Ribavirin graviditetsregister
Et ribavirin-graviditetsregister er etablert for å overvåke mors-føtale utfall av svangerskap hos kvinnelige pasienter og kvinnelige partnere til mannlige pasienter eksponert for ribavirin under behandling og i 6 måneder etter avsluttet behandling. Helsepersonell og pasienter oppfordres til å rapportere slike tilfeller ved å ringe 1-800-593-2214.
Ammende mødre
Det er ikke kjent om ribavirin skilles ut i morsmelk. Fordi mange legemidler skilles ut i morsmelk og for å unngå potensielle alvorlige bivirkninger hos ammende spedbarn fra ribavirin, bør det tas en beslutning om enten å avbryte amming eller behandling med COPEGUS 100 mg, basert på hvor viktig behandlingen er for moren.
Pediatrisk bruk
Farmakokinetiske evalueringer hos pediatriske pasienter er ikke utført.
Sikkerhet og effekt av COPEGUS er ikke fastslått hos pasienter under 5 år.
Geriatrisk bruk
Kliniske studier av COPEGUS 100 mg og PEGASYS inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år eller over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Spesifikke farmakokinetiske evalueringer for ribavirin hos eldre er ikke utført. Risikoen for toksiske reaksjoner på dette legemidlet kan være større hos pasienter med nedsatt nyrefunksjon. Dosen av COPEGUS 100 mg bør reduseres hos pasienter med kreatininclearance mindre enn eller lik 50 ml/min. og dosen av PEGASYS bør reduseres hos pasienter med kreatininclearance mindre enn 30 ml/min [se DOSERING OG ADMINISTRASJON ; Bruk i spesifikke populasjoner ].
Løp
En farmakokinetisk studie med 42 personer viste at det ikke er noen klinisk signifikant forskjell i ribavirins farmakokinetikk blant svarte (n=14), latinamerikanske (n=13) og kaukasiske (n=15) personer.
Nedsatt nyrefunksjon
Nyrefunksjonen bør evalueres hos alle pasienter før oppstart av COPEGUS ved å estimere pasientens kreatininclearance.
En klinisk studie evaluerte behandling med COPEGUS og PEGASYS hos 50 CHC-pasienter med moderat (kreatininclearance 30 – 50 ml/min) eller alvorlig (kreatininclearance mindre enn 30 ml/min) nyresvikt eller nyresykdom i sluttstadiet (ESRD) som krever kronisk hemodialyse (HD). Hos 18 personer med ESRD som fikk kronisk HD, ble COPEGUS administrert i en dose på 200 mg daglig uten noen åpenbar forskjell i bivirkningsprofilen sammenlignet med personer med normal nyrefunksjon. Dosereduksjoner og midlertidige avbrudd av COPEGUS (på grunn av COPEGUS-relaterte bivirkninger, hovedsakelig anemi) ble observert hos opptil en tredjedel ESRD/HD-pasienter under behandling; og bare en tredjedel av disse forsøkspersonene fikk COPEGUS i 48 uker. Plasmaeksponeringen for ribavirin var omtrent 20 % lavere hos personer med ESRD på HD sammenlignet med personer med normal nyrefunksjon som fikk standard 1000/1200 mg COPEGUS daglig dose.
Personer med moderat (n=17) eller alvorlig (n=14) nedsatt nyrefunksjon tolererte ikke henholdsvis 600 mg eller 400 mg daglige doser av COPEGUS på grunn av COPEGUS-relaterte bivirkninger, hovedsakelig anemi, og viste 20 % til 30 %. høyere plasmaeksponeringer for ribavirin (til tross for hyppige dosemodifikasjoner) sammenlignet med personer med normal nyrefunksjon (kreatininclearance større enn 80 ml/min) som får standarddosen COPEGUS. Seponeringsfrekvensen var høyere hos personer med alvorlig nedsatt nyrefunksjon sammenlignet med det som ble observert hos personer med moderat nedsatt nyrefunksjon eller normal nyrefunksjon. Farmakokinetisk modellering og simulering indikerer at en dose på 200 mg daglig hos pasienter med alvorlig nedsatt nyrefunksjon og en dose på 200 mg daglig vekslende med 400 mg neste dag hos pasienter med moderat nedsatt nyrefunksjon vil gi plasma-ribavirineksponering som ligner på pasienter med normal nyrefunksjon. mottar det godkjente regimet til COPEGUS. Disse dosene er ikke studert hos pasienter [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
Basert på de farmakokinetiske og sikkerhetsresultatene fra denne studien, bør pasienter med kreatininclearance mindre enn eller lik 50 ml/min. få en redusert dose COPEGUS; og pasienter med kreatininclearance mindre enn 30 ml/min bør få en redusert dose PEGASYS. Den kliniske og hematologiske statusen til pasienter med kreatininclearance mindre enn eller lik 50 ml/min som får COPEGUS 100 mg bør overvåkes nøye. Pasienter med klinisk signifikante laboratorieavvik eller bivirkninger som er vedvarende alvorlige eller forverrede bør få behandlingen seponert [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI , og PEGASYS pakningsvedlegg ].
Nedsatt leverfunksjon
Effekten av nedsatt leverfunksjon på farmakokinetikken til ribavirin etter administrering av COPEGUS har ikke blitt evaluert. De kliniske forsøkene med COPEGUS 100 mg var begrenset til pasienter med Child-Pugh klasse A sykdom.
Kjønn
Ingen klinisk signifikante forskjeller i farmakokinetikken til ribavirin ble observert mellom mannlige og kvinnelige forsøkspersoner.
Ribavirins farmakokinetikk, når korrigert for vekt, er lik hos mannlige og kvinnelige pasienter.
Mottakere av organtransplantasjoner
Sikkerhet og effekt av behandling med PEGASYS og COPEGUS 100 mg er ikke fastslått hos pasienter med lever- og andre transplantasjoner. Som med andre alfa-interferoner, har lever- og nyretransplantatavstøting blitt rapportert på PEGASYS, alene eller i kombinasjon med COPEGUS [se BIVIRKNINGER ].
OVERDOSE
Ingen tilfeller av overdosering med COPEGUS er rapportert i kliniske studier. Hypokalsemi og hypomagnesemi har blitt observert hos personer som har fått høyere dose enn anbefalt ribavirin. I de fleste av disse tilfellene ble ribavirin administrert intravenøst i doser opp til og i noen tilfeller over fire ganger anbefalt maksimal oral daglig dose.
KONTRAINDIKASJONER
COPEGUS (ribavirin) er kontraindisert ved:
- . Kvinner som er gravide. COPEGUS kan forårsake fosterskader når det administreres til en gravid kvinne. COPEGUS er kontraindisert hos kvinner som er eller kan bli gravide. Hvis dette legemidlet brukes under graviditet, eller hvis pasienten blir gravid mens du tar dette legemidlet, bør pasienten informeres om den potensielle faren for fosteret [se ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner , og PASIENTINFORMASJON ]. . Menn hvis kvinnelige partnere er gravide. . Pasienter med hemoglobinopatier (f.eks. thalassemia major eller sigdcelleanemi). . I kombinasjon med didanosin. Rapporter om fatal leversvikt, samt perifer nevropati, pankreatitt og symptomatisk hyperlaktatemi/laktacidose er rapportert i kliniske studier [se NARKOTIKAHANDEL ].
COPEGUS og PEGASYS kombinasjonsbehandling er kontraindisert hos pasienter med:
- . Autoimmun hepatitt. . Leverdekompensasjon (Child-Pugh score større enn 6; klasse B og C) hos cirrhotiske CHC monoinfiserte pasienter før behandling [se ADVARSLER OG FORHOLDSREGLER ]. . Leverdekompensasjon (Child-Pugh-score større enn eller lik 6) hos cirrhotiske CHC-pasienter samtidig med HIV før behandling [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Ribavirin er et antiviralt legemiddel [se Mikrobiologi ].
Farmakokinetikk
Multiple dose ribavirin farmakokinetiske data er tilgjengelige for HCV-pasienter som fikk ribavirin i kombinasjon med peginterferon alfa-2a. Etter administrering av 1200 mg/dag med mat i 12 uker gjennomsnitt±SD (n=39; kroppsvekt større enn 75 kg) var AUC0-12t 25 361±7110 ng·t/mL og Cmax var 2748±818 ng/mL. Gjennomsnittlig tid for å nå Cmax var 2 timer. Laveste plasmakonsentrasjoner av ribavirin etter 12 ukers dosering med mat var 1662±545 ng/ml hos HCV-infiserte pasienter som fikk 800 mg/dag (n=89), og 2112±810 ng/ml hos pasienter som fikk 1200 mg/dag ( n=75; kroppsvekt over 75 kg).
Den terminale halveringstiden for ribavirin etter administrering av en enkelt oral dose COPEGUS er ca. 120 til 170 timer. Den totale tilsynelatende clearance etter administrering av en enkelt oral dose av COPEGUS 100 mg er ca. 26 l/time. Det er omfattende akkumulering av ribavirin etter gjentatt dosering (to ganger daglig), slik at Cmax ved steady state var fire ganger høyere enn for en enkeltdose.
Effekt av mat på absorpsjon av ribavirin
Biotilgjengeligheten av en enkelt oral dose ribavirin ble økt ved samtidig administrering med et fettrikt måltid. Absorpsjonen ble redusert (Tmax ble doblet) og AUC0-192h og Cmax økte med henholdsvis 42 % og 66 % når COPEGUS ble tatt sammen med et fettrikt måltid sammenlignet med fastetilstander [se DOSERING OG ADMINISTRASJON og PASIENTINFORMASJON ].
Eliminasjon og metabolisme
Bidraget fra nyre- og leverveier til eliminering av ribavirin etter administrering av COPEGUS 100 mg er ikke kjent. In vitro-studier indikerer at ribavirin ikke er et substrat for CYP450-enzymer.
Nedsatt nyrefunksjon
En klinisk studie evaluerte 50 CHC-pasienter med enten moderat (kreatininclearance 30 til 50 ml/min) eller alvorlig (kreatininclearance mindre enn 30 ml/min) nedsatt nyrefunksjon eller sluttstadium nyresykdom (ESRD) som krever kronisk hemodialyse (HD). Den tilsynelatende clearance av ribavirin ble redusert hos personer med kreatininclearance mindre enn eller lik 50 ml/min, inkludert personer med ESRD på HD, som viste omtrent 30 % av verdien funnet hos personer med normal nyrefunksjon. Farmakokinetisk modellering og simulering indikerer at en dose på 200 mg daglig hos pasienter med alvorlig nedsatt nyrefunksjon og en dose på 200 mg daglig, alternerende med 400 mg neste dag hos pasienter med moderat nedsatt nyrefunksjon, vil gi plasma-ribavirineksponeringer tilsvarende den som er observert hos pasienter med normal nyrefunksjon som får standard 1000/1200 mg COPEGUS daglig dose. Disse dosene er ikke studert hos pasienter.
Hos 18 personer med ESRD som fikk kronisk HD, ble COPEGUS administrert i en dose på 200 mg daglig. Ribavirinplasmaeksponeringen hos disse pasientene var omtrent 20 % lavere sammenlignet med personer med normal nyrefunksjon som fikk standard 1000/1200 mg COPEGUS daglig dose [se DOSERING OG ADMINISTRASJON , Bruk i spesifikke populasjoner ].
Plasmaribavirin fjernes ved hemodialyse med et ekstraksjonsforhold på ca. 50 %; På grunn av det store distribusjonsvolumet av ribavirin, forventes imidlertid ikke plasmaeksponering å endre seg med hemodialyse.
Mikrobiologi
Virkningsmekanismen
Mekanismen som ribavirin bidrar til sin antivirale effekt i klinikken er ikke fullt ut forstått. Ribavirin har direkte antiviral aktivitet i vevskultur mot mange RNA-virus. Ribavirin øker mutasjonsfrekvensen i genomene til flere RNA-virus og ribavirintrifosfat hemmer HCV-polymerase i en biokjemisk reaksjon.
Antiviral aktivitet i cellekultur
det stabile HCV-cellekulturmodellsystemet (HCV-replikon) hemmet ribavirin autonom HCV RNA-replikasjon med en 50 % effektiv konsentrasjon (EC50) verdi på 11-21 mcM. I samme modell hemmet PEG-IFN α-2a også HCV RNA-replikasjon, med en EC50-verdi på 0,1-3 ng/ml. Kombinasjonen av PEG-IFN α-2a og ribavirin var mer effektiv til å hemme HCV RNA-replikasjon enn begge midler alene.
Motstand
Ulike HCV-genotyper viser betydelig klinisk variasjon i deres respons på PEG-IFN-α og ribavirinbehandling. Virale genetiske determinanter assosiert med den variable responsen er ikke definitivt identifisert.
Kryssmotstand
Kryssresistens mellom IFN α og ribavirin er ikke observert.
dyretoksikologi
I en studie på rotter ble det konkludert med at dominant dødelighet ikke ble indusert av ribavirin ved doser opp til 200 mg/kg i 5 dager (opptil 1,7 ganger den maksimale anbefalte humane dosen av ribavirin).
Langtidsstudier på mus og rotter (18 til 24 måneder, henholdsvis dose 20 til 75 og 10 til 40 mg/kg/dag, omtrent 0,1 til 0,4 ganger den maksimale daglige humane dosen av ribavirin) har vist en sammenheng mellom kronisk ribavirineksponering og økt forekomst av vaskulære lesjoner (mikroskopiske blødninger) hos mus. Hos rotter forekom netthinnedegenerasjon hos kontroller, men forekomsten var økt hos ribavirinbehandlede rotter.
Kliniske studier
Pasienter med kronisk hepatitt C
Voksne pasienter
Sikkerheten og effektiviteten til PEGASYS i kombinasjon med COPEGUS for behandling av hepatitt C-virusinfeksjon ble vurdert i to randomiserte kontrollerte kliniske studier. Alle pasientene var voksne, hadde kompensert leversykdom, påvisbart hepatitt C-virus, leverbiopsidiagnose av kronisk hepatitt og var tidligere ubehandlet med interferon. Omtrent 20 % av pasientene i begge studiene hadde kompensert cirrhose (Child-Pugh klasse A). Pasienter samtidig med HIV ble ekskludert fra disse studiene.
studie NV15801 ble pasienter randomisert til å få enten PEGASYS 180 mcg subkutant en gang ukentlig med oral placebo, PEGASYS 180 mcg en gang ukentlig med COPEGUS 1000 mg gjennom munnen (kroppsvekt mindre enn 75 kg) eller 1200 mg gjennom munnen (kroppsvekt større enn eller lik 75 kg) eller interferon alfa-2b 3 MIE subkutant tre ganger i uken pluss ribavirin 1000 mg eller 1200 mg gjennom munnen. Alle pasientene fikk 48 ukers behandling etterfulgt av 24 ukers behandlingsfri oppfølging. COPEGUS eller placebobehandling ble blindet. Vedvarende virologisk respons ble definert som upåviselig (mindre enn 50 IE/mL) HCV RNA på eller etter studieuke 68. PEGASYS i kombinasjon med COPEGUS 100 mg resulterte i en høyere SVR sammenlignet med PEGASYS alene eller interferon alfa-2b og ribavirin (tabell 9). . I alle behandlingsarmer hadde pasienter med viral genotype 1, uavhengig av viral belastning, en lavere responsrate på PEGASYS i kombinasjon med COPEGUS 100 mg sammenlignet med pasienter med andre virale genotyper.
Forskjellen i total behandlingsrespons (PEGASYS/COPEGUS – Interferon alfa-2b/ribavirin) var 9 % (95 % KI 2,3, 15,3).
I studie NV15942 fikk alle pasienter PEGASYS 180 mcg subkutant én gang ukentlig og ble randomisert til behandling i enten 24 eller 48 uker og til en COPEGUS-dose på enten 800 mg eller 1000 mg/1200 mg (for kroppsvekt mindre enn 75 kg/mer enn eller lik 75 kg). Tilordning til de fire behandlingsarmene ble stratifisert etter viral genotype og baseline HCV viral titer. Pasienter med genotype 1 og høy viraltiter (definert som større enn 2 x 106 HCV RNA-kopier/ml serum) ble fortrinnsvis tildelt behandling i 48 uker.
Vedvarende virologisk respons (SVR) og HCV-genotype
HCV 1 og 4 — Uavhengig av virustiter ved baseline, resulterte behandling i 48 uker med PEGASYS og 1000 mg eller 1200 mg COPEGUS i høyere SVR (definert som upåviselig HCV-RNA ved slutten av den 24-ukers behandlingsfrie oppfølgingsperioden) sammenlignet med kortere behandling (24 uker) og/eller 800 mg COPEGUS.
HCV 2 og 3 — Uavhengig av virustiter ved baseline, resulterte behandling i 24 uker med PEGASYS og 800 mg COPEGUS i en lignende SVR sammenlignet med lengre behandling (48 uker) og/eller 1000 mg eller 1200 mg COPEGUS (se tabell 10).
Antallet pasienter med genotype 5 og 6 var for få til å gi meningsfull vurdering.
Pediatriske pasienter
Tidligere ubehandlede pediatriske forsøkspersoner i alderen 5 til 17 år (55 % under 12 år) med kronisk hepatitt C, kompensert leversykdom og påviselig HCV RNA ble behandlet med COPEGUS 100 mg ca. 15 mg/kg/dag pluss PEGASYS 180 mcg/1,73 mcg² x kroppsoverflate én gang ukentlig i 48 uker. Alle forsøkspersoner ble fulgt i 24 uker etter behandling. Vedvarende virologisk respons (SVR) ble definert som upåviselig (mindre enn 50 IE/mL) HCV RNA på eller etter studieuke 68. Totalt 114 forsøkspersoner ble randomisert til å motta enten kombinasjonsbehandling av COPEGUS pluss PEGASYS eller PEGASYS monoterapi; forsøkspersoner som svikter PEGASYS monoterapi ved 24 uker eller senere, kan få åpent COPEGUS pluss PEGASYS. De første randomiserte armene ble balansert for demografiske faktorer; 55 personer fikk innledende kombinasjonsbehandling med COPEGUS 100 mg pluss PEGASYS og 59 fikk PEGASYS pluss placebo; i den totale intent-to-treat-populasjonen var 45 % kvinner, 80 % var kaukasiske og 81 % var infisert med HCV genotype 1. SVR-resultatene er oppsummert i tabell 11.
Andre behandlingsresponsprediktorer
Behandlingsresponsrater er lavere hos pasienter med dårlige prognostiske faktorer som får pegylert interferon alfa-terapi. I studiene NV15801 og NV15942 var behandlingsresponsrater lavere hos pasienter over 40 år (50 % vs. 66 %), hos pasienter med cirrhose (47 % vs. 59 %), hos pasienter som veier over 85 kg (49 % vs. 60 %), og hos pasienter med genotype 1 med høy vs. lav virusmengde (43 % vs. 56 %). Afroamerikanske pasienter hadde lavere responsrate sammenlignet med kaukasiere.
studiene NV15801 og NV15942 var mangel på tidlig virologisk respons etter 12 uker (definert som HCV RNA upåviselig eller mer enn 2 log10 lavere enn baseline) grunn for seponering av behandlingen. Av pasienter som manglet en tidlig viral respons etter 12 uker og fullførte et anbefalt behandlingsforløp til tross for et protokolldefinert alternativ for å avbryte behandlingen, oppnådde 5/39 (13 %) en SVR. Av pasienter som manglet en tidlig viral respons etter 24 uker, fullførte 19 et fullstendig behandlingsforløp og ingen oppnådde en SVR.
Kronisk hepatitt C/HIV-saminfiserte pasienter
studie NR15961 ble pasienter med CHC/HIV randomisert til å motta enten PEGASYS 180 mcg subkutant en gang ukentlig pluss oral placebo, PEGASYS 180 mcg en gang ukentlig pluss COPEGUS 800 mg gjennom munnen daglig eller interferon alfa-2a, 3 MIE subkutant tre ganger i uken pluss COPEGUS 800 mg gjennom munnen daglig. Alle pasientene fikk 48 ukers behandling og vedvarende virologisk respons (SVR) ble vurdert etter 24 ukers behandlingsfri oppfølging. COPEGUS 100 mg eller placebobehandling ble blindet i PEGASYS-behandlingsarmene. Alle pasientene var voksne, hadde kompensert leversykdom, påvisbart hepatitt C-virus, leverbiopsidiagnose av kronisk hepatitt C, og var tidligere ubehandlet med interferon. Pasientene hadde også CD4+-celletall større enn eller lik 200 celler/mm³ eller CD4+-celletall større enn eller lik 100 celler/mm³ men mindre enn 200 celler/mm³ og HIV-1-RNA mindre enn 5000 kopier/ml, og stabil status av HIV. Omtrent 15 % av pasientene i studien hadde cirrhose. Resultatene er vist i tabell 12.
Behandlingsresponsrater var lavere hos CHC/HIV-pasienter med dårlige prognostiske faktorer (inkludert HCV genotype 1, HCV RNA større enn 800 000 IE/mL og cirrhose) som fikk pegylert interferon alfa-behandling.
Av pasientene som ikke viste verken upåviselig HCV RNA eller minst en 2 log10 reduksjon fra baseline i HCV RNA-titer med 12 uker med PEGASYS og COPEGUS kombinasjonsbehandling, oppnådde 2 % (2/85) en SVR.
Hos CHC-pasienter med samtidig HIV-infeksjon som fikk 48 uker med PEGASYS alene eller i kombinasjon med COPEGUS 100 mg-behandling, økte ikke gjennomsnittlig og median HIV RNA-titer over baseline under behandling eller 24 uker etter behandling.
PASIENTINFORMASJON
COPEGUS® (Co-PEG-UHS) (ribavirin) tabletter
Les denne medisinveiledningen nøye før du begynner å ta COPEGUS 100mg og les medisinveiledningen hver gang du får i deg mer COPEGUS. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller din behandling.
Les også Medisineringsveiledningen for PEGASYS (peginterferon alfa-2a).
Hva er den viktigste informasjonen jeg bør vite om COPEGUS?
. Du bør ikke ta COPEGUS alene for å behandle kronisk hepatitt C-infeksjon. COPEGUS 100mg skal brukes sammen med PEGASYS for å behandle kronisk hepatitt C-infeksjon. . COPEGUS kan føre til at du får et blodproblem (hemolytisk anemi) som kan forverre eventuelle hjerteproblemer du har, og føre til at du får et hjerteinfarkt eller dør. Fortell helsepersonell dersom du noen gang har hatt hjerteproblemer. COPEGUS 100mg er kanskje ikke riktig for deg. Hvis du har brystsmerter mens du tar COPEGUS 100mg, få akutt legehjelp umiddelbart. . COPEGUS 100mg kan forårsake fødselsskader eller død av ditt ufødte barn. Hvis du er gravid eller din seksuelle partner er gravid, ikke bruk COPEGUS. Du eller din seksuelle partner bør ikke bli gravid mens du tar COPEGUS 100 mg og i 6 måneder etter at behandlingen er over. Du må bruke to former for prevensjon når du tar COPEGUS og i 6 måneder etter behandling.- . Kvinner må ha en graviditetstest før de starter med COPEGUS, hver måned mens de behandles med COPEGUS 100 mg, og hver måned i 6 måneder etter behandling med COPEGUS. . Hvis du eller din kvinnelige seksuelle partner blir gravid mens du tar COPEGUS 100 mg eller innen 6 måneder etter at du har sluttet å ta COPEGUS, informer helsepersonell med en gang. Du eller helsepersonell bør kontakte Ribavirin Graviditetsregister ved å ringe 1-800-593-2214. Ribavirin Pregnancy Registry samler informasjon om hva som skjer med mødre og deres babyer hvis moren tar COPEGUS mens hun er gravid.
Hva er COPEGUS 100mg?
COPEGUS 100mg er et reseptbelagt legemiddel som brukes sammen med et annet legemiddel kalt PEGASYS (peginterferon alfa-2a) for å behandle kronisk (som varer lenge) hepatitt C-infeksjon hos personer 5 år og eldre hvis lever fortsatt fungerer normalt, og som ikke har blitt behandlet før med et legemiddel kalt interferon alfa. Det er ikke kjent om COPEGUS er trygt og vil virke på barn under 5 år.
Hvem bør ikke ta COPEGUS 100mg?
Se "Hva er den viktigste informasjonen jeg bør vite om COPEGUS 100mg?"
Ikke ta COPEGUS hvis du:
- . har visse typer hepatitt forårsaket av at immunsystemet ditt angriper leveren din (autoimmun hepatitt) . har visse blodsykdommer, for eksempel thalassemia major eller sigdcelleanemi (hemoglobinopatier) . ta didanosin (Videx eller Videx EC)
Snakk med helsepersonell før du starter behandling med COPEGUS 100mg hvis du har noen av disse medisinske tilstandene.
Hva bør jeg fortelle helsepersonell før jeg tar COPEGUS 100mg?
Før du tar COPEGUS, fortell helsepersonell dersom du har eller har hatt:
- . behandling for hepatitt C som ikke fungerte for deg . alvorlige allergiske reaksjoner mot COPEGUS eller noen av ingrediensene i COPEGUS. Se slutten av denne medisinveiledningen for en liste over ingredienser. . pusteproblemer. COPEGUS 100mg kan forårsake eller forverre pusteproblemer du allerede har. . synsproblemer. COPEGUS kan forårsake øyeproblemer eller forverre øyeproblemer du allerede har. Du bør ta en synsundersøkelse før du starter behandling med COPEGUS. . visse blodsykdommer som anemi . høyt blodtrykk, hjerteproblemer eller har hatt et hjerteinfarkt. Helsepersonell bør teste blodet og hjertet ditt før du starter behandling med COPEGUS. . problemer med skjoldbruskkjertelen . diabetes. COPEGUS 100mg og PEGASYS kombinasjonsbehandling kan gjøre diabetesen din verre eller vanskeligere å behandle. . leverproblemer annet enn hepatitt C-virusinfeksjon . humant immunsviktvirus (HIV) eller andre immunitetsproblemer . psykiske problemer, inkludert depresjon eller selvmordstanker . nyreproblemer . en organtransplantasjon . narkotikaavhengighet eller misbruk . infeksjon med hepatitt B-virus . enhver annen medisinsk tilstand . ammer. Det er ikke kjent om COPEGUS 100 mg går over i morsmelk. Du og helsepersonell bør bestemme om du vil ta COPEGUS eller amme.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Noen medisiner kan forårsake alvorlige bivirkninger hvis de tas mens du også tar COPEGUS. Noen medisiner kan påvirke hvordan COPEGUS 100mg virker, eller COPEGUS 100mg kan påvirke hvordan de andre medisinene dine virker.
Fortell spesielt helsepersonell dersom du tar medisiner for å behandle HIV, inkludert didanosin (Videx eller Videx EC), eller hvis du tar azatioprin (Imuran eller Azasan).
Kjenn til medisinene du tar. Hold en liste over dem for å vise helsepersonell eller apotek når du får en ny medisin.
Hvordan skal jeg ta COPEGUS 100mg?
- . Ta COPEGUS nøyaktig slik helsepersonell forteller deg. Helsepersonell vil fortelle deg hvor mye COPEGUS du skal ta og når du skal ta den. For barn 5 år og eldre vil helsepersonell foreskrive dosen COPEGUS 100 mg basert på vekt. . Ta COPEGUS sammen med mat. . Hvis du glemmer en dose COPEGUS 100 mg, ta den glemte dosen så snart som mulig i løpet av samme dag. Ikke dobbel neste dose. Hvis du har spørsmål om hva du skal gjøre, ring helsepersonell. . Hvis du tar for mye COPEGUS 100 mg, ring legen din eller det lokale giftkontrollsenteret med en gang, eller gå til nærmeste legevakt umiddelbart. . Helsepersonell bør ta blodprøver før du starter behandling med COPEGUS, i uke 2 og 4 av behandlingen, og deretter etter behov for å se hvor godt du tåler behandlingen og for å se etter bivirkninger. Helsepersonell kan endre dosen av COPEGUS 100mg basert på blodprøveresultater eller bivirkninger du kan ha. . Hvis du har hjerteproblemer, bør helsepersonell sjekke hjertet ditt ved å ta et elektrokardiogram før du starter behandling med COPEGUS, og om nødvendig under behandlingen.
Hva bør jeg unngå mens jeg tar COPEGUS?
COPEGUS 100mg kan få deg til å føle deg trøtt, svimmel eller forvirret. Du bør ikke kjøre bil eller bruke maskiner hvis du har noen av disse symptomene.
Ikke drikk alkohol, inkludert øl, vin og brennevin. Dette kan gjøre din leversykdom verre.
Hva er de mulige bivirkningene av COPEGUS?
COPEGUS 100mg kan forårsake alvorlige bivirkninger inkludert:
Se "Hva er den viktigste informasjonen jeg bør vite om COPEGUS 100mg?"
- . Hevelse og irritasjon av bukspyttkjertelen (pankreatitt). Du kan ha magesmerter, kvalme, oppkast eller diaré. . Alvorlige allergiske reaksjoner. Symptomer kan omfatte elveblest, hvesing, pusteproblemer, brystsmerter, hevelse i munnen, tungen eller leppene eller alvorlig utslett. . Alvorlige pusteproblemer. Pustevansker kan være et tegn på en alvorlig lungeinfeksjon (lungebetennelse) som kan føre til døden. . Alvorlige øyeproblemer som kan føre til synstap eller blindhet. . Leverproblemer. Noen mennesker kan få forverring av leverfunksjonen. Fortell helsepersonell med en gang hvis du har noen av disse symptomene: oppblåst mage, forvirring, brun urin og gule øyne. . Alvorlig depresjon . Selvmordstanker og -forsøk . Effekt på vekst hos barn. Barn kan oppleve en forsinkelse i vektøkning og høydeøkning mens de behandles med PEGASYS og COPEGUS. Innhenting av vekst skjer etter at behandlingen stopper, men noen barn kan ikke nå den høyden de var forventet å ha før behandlingen. Snakk med helsepersonell hvis du er bekymret for barnets vekst under behandling med PEGASYS og COPEGUS.
Ring helsepersonell eller få medisinsk hjelp med en gang hvis du har noen av symptomene som er oppført ovenfor. Dette kan være tegn på en alvorlig bivirkning av COPEGUS 100 mg behandling.
Vanlige bivirkninger av COPEGUS tatt med PEGASYS inkluderer:
- . influensalignende symptomer - trøtthetsfølelse, hodepine, skjelving sammen med høy temperatur (feber) og muskel- eller leddsmerter . humørsvingninger, irritabel følelse, angst og søvnvansker . tap av matlyst, kvalme, oppkast og diaré . hårtap . kløe
Fortell helsepersonell om eventuelle bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av COPEGUS-behandling. For mer informasjon, spør helsepersonell eller apotek.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Du kan også rapportere bivirkninger til Genentech på 1-888-835-2555.
Hvordan bør jeg oppbevare COPEGUS 100mg?
- . Oppbevar COPEGUS-tabletter mellom 59 °F og 86 °F (15 °C og 30 °C). . Hold flasken tett lukket.
Oppbevar COPEGUS 100mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av COPEGUS
Det er ikke kjent om behandling med COPEGUS 100 mg i kombinasjon med PEGASYS vil hindre en infisert person i å spre hepatitt C-viruset til en annen person under behandling.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk COPEGUS 100mg for en tilstand det ikke er foreskrevet for. Ikke gi COPEGUS til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Denne medisinguiden oppsummerer den viktigste informasjonen om COPEGUS. Hvis du vil ha mer informasjon, snakk med helsepersonell. Du kan spørre helsepersonell eller apotek om informasjon om COPEGUS som er skrevet for helsepersonell.
Hva er ingrediensene i COPEGUS 100mg?
Aktiv ingrediens: ribavirin
Inaktive ingredienser: Kjernen i tabletten inneholder pregelatinisert stivelse, mikrokrystallinsk cellulose, natriumstivelsesglykolat, maisstivelse og magnesiumstearat. Belegget på tabletten inneholder Chromatone-P eller Opadry Pink (laget ved bruk av hydroksypropylmetylcellulose, talkum, titandioksid, syntetisk gult jernoksid og syntetisk rødt jernoksid), etylcellulose (ECD-30) og triacetin.
Denne medisinveiledningen er godkjent av US Food and Drug Administration.
