Famvir 250mg, 500mg Famciclovir Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Famvir og hvordan brukes det?
Famvir er et reseptbelagt legemiddel som brukes til å behandle symptomene på akutt herpes zoster (helvetesild), herpes labiallis og genital herpes. Famvir 250mg kan brukes alene eller sammen med andre medisiner.
Famvir 250mg tilhører en klasse legemidler som heter Antivirals, Other.
Det er ikke kjent om Famvir er trygt og effektivt hos barn under 18 år.
Hva er de mulige bivirkningene av Famvir 250mg?
Famvir 250mg kan forårsake alvorlige bivirkninger inkludert:
- . forvirring, . lite eller ingen vannlating, . hevelse i føttene eller anklene, . tretthet, og . kortpustethet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Famvir 500mg inkluderer:
- . hodepine, og . kvalme
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Famvir. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Den aktive ingrediensen i FAMVIR 500 mg tabletter er famciclovir, et oralt administrert prodrug av det antivirale middelet penciclovir. Kjemisk er famciklovir kjent som 2-[2-(2-amino-9H-purin-9-yl)etyl]-1,3-propandioldiacetat. Dens molekylformel er C14H19N5O4; dens molekylvekt er 321,3. Det er et syntetisk asyklisk guaninderivat og har følgende struktur
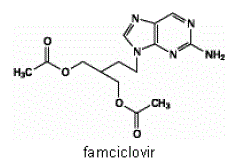
Famciclovir er et hvitt til blekgult fast stoff. Det er fritt løselig i aceton og metanol, og lite løselig i etanol og isopropanol. Ved 25°C er famciklovir fritt løselig (>25 % vekt/volum) i vann til å begynne med, men utfelles raskt som det tungtløselige (2 %-3 % vekt/volum) monohydrat. Famciclovir er ikke hygroskopisk under 85 % relativ fuktighet. Fordelingskoeffisienter er: oktanol/vann (pH 4,8) P=1,09 og oktanol/fosfatbuffer (pH 7,4) P=2,08.
FAMVIR 250 mg tabletter inneholder 125 mg, 250 mg eller 500 mg famciklovir, sammen med følgende inaktive ingredienser: hydroksypropylcellulose, hydroksypropylmetylcellulose, laktose, magnesiumstearat, polyetylenglykoler, natriumstivelsesglykolat og titandioksid.
INDIKASJONER
Immunkompetente voksne pasienter
Herpes Labialis (forkjølelsessår)
FAMVIR er indisert for behandling av tilbakevendende herpes labialis.
Kjønnsherpes
Tilbakevendende episoder:
FAMVIR er indisert for behandling av tilbakevendende episoder med genital herpes. Effekten av FAMVIR ved oppstart mer enn 6 timer etter symptomdebut eller lesjoner er ikke fastslått.
Undertrykkende terapi:
FAMVIR 250mg er indisert for kronisk suppressiv behandling av tilbakevendende episoder med genital herpes. Effekten og sikkerheten til FAMVIR for undertrykkelse av tilbakevendende genital herpes etter 1 år er ikke fastslått.
Herpes zoster (helvetesild)
FAMVIR 500mg er indisert for behandling av herpes zoster. Effekten av FAMVIR ved initiering mer enn 72 timer etter utslett har ikke blitt fastslått.
HIV-infiserte voksne pasienter
Tilbakevendende orolabial eller genital herpes
FAMVIR er indisert for behandling av tilbakevendende episoder av orolabial eller genital herpes hos HIV-infiserte voksne. Effekten av FAMVIR ved oppstart mer enn 48 timer etter oppstart av symptomer eller lesjoner er ikke fastslått.
Bruksbegrensning
Effekten og sikkerheten til FAMVIR er ikke fastslått for:
- . Pasienter . Pasienter med første episode av genital herpes . Pasienter med oftalmisk zoster . Immunkompromitterte pasienter annet enn for behandling av tilbakevendende orolabial eller genital herpes hos HIV-infiserte pasienter . Svarte og afroamerikanske pasienter med tilbakevendende genital herpes
DOSERING OG ADMINISTRASJON
FAMVIR 500 mg kan tas med eller uten mat.
Doseringsanbefaling hos immunkompetente voksne pasienter
Herpes Labialis (forkjølelsessår)
Den anbefalte dosen av FAMVIR 500 mg for behandling av tilbakevendende herpes labialis er 1500 mg som enkeltdose. Terapi bør startes ved det første tegn eller symptom på herpes labialis (f.eks. prikking, kløe, svie, smerte eller lesjon).
Kjønnsherpes
Tilbakevendende episoder
Den anbefalte dosen av FAMVIR for behandling av tilbakevendende episoder med genital herpes er 1000 mg to ganger daglig i 1 dag. Behandlingen bør startes ved første tegn eller symptom på en tilbakevendende episode (f.eks. prikking, kløe, svie, smerte eller lesjon).
Undertrykkende terapi
Den anbefalte dosen av FAMVIR 500 mg for kronisk suppressiv behandling av tilbakevendende episoder med genital herpes er 250 mg to ganger daglig.
Herpes zoster (helvetesild)
Den anbefalte dosen av FAMVIR 250 mg for behandling av herpes zoster er 500 mg hver 8. time i 7 dager. Behandling bør startes så snart herpes zoster er diagnostisert.
Doseringsanbefaling hos HIV-infiserte voksne pasienter
Tilbakevendende orolabial eller genital herpes
Den anbefalte dosen av FAMVIR for behandling av tilbakevendende orolabial eller genital herpes hos HIV-infiserte pasienter er 500 mg to ganger daglig i 7 dager. Behandlingen bør startes ved første tegn eller symptom på en tilbakevendende episode (f.eks. prikking, kløe, svie, smerte eller lesjon).
Doseringsanbefaling hos pasienter med nedsatt nyrefunksjon
Doseringsanbefalinger for voksne pasienter med nedsatt nyrefunksjon er gitt i tabell 1 [se Bruk i spesifikke populasjoner , KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
FAMVIR-tabletter er tilgjengelige i 3 styrker:
- . 125 mg: Hvite, runde filmbelagte, bikonvekse, fasede kanter, preget med "FAMVIR" på den ene siden og "125" på den andre siden . 250 mg: Hvite, runde filmbelagte, bikonvekse, fasede kanter, preget med "FAMVIR" på den ene siden og "250" på den andre siden . 500 mg: Hvit, oval filmbelagt, bikonveks, preget med "FAMVIR" på den ene siden og "500" på den andre siden
Oppbevaring og håndtering
FAMVIR tabletter leveres som filmdrasjerte tabletter som følger: 125 mg i flasker på 30; 250 mg i flasker på 30; 500 mg i flasker på 30 og enkeltenhetspakninger på 50 (kun beregnet for institusjonsbruk).
- . FAMVIR 125 mg tablett: Hvit, rund filmdrasjert, bikonvekse, skrå kanter, merket med "FAMVIR" på den ene siden og "125" på den andre. 125 mg 30-tallet NDC 0078-0366-15 . FAMVIR 250 mg tablett : Hvit, rund filmbelagt, bikonvekse, fasede kanter, preget med "FAMVIR" på den ene siden og "250" på den andre. 250 mg 30-tallet NDC 0078-0367-15 . FAMVIR 500 mg tablett : Hvit, oval filmbelagt, bikonveks, preget med "FAMVIR" på den ene siden og "500" på den andre. 500 mg 30-tallet NDC 0078-0368-15 500 mg SUP 50-tallet NDC 0078-0368-64
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP-kontrollert romtemperatur].
Distribuert av: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Revidert: sep 2016
BIVIRKNINGER
Akutt nyresvikt er omtalt mer detaljert i andre deler av etiketten [se ADVARSLER OG FORHOLDSREGLER ].
De vanligste bivirkningene rapportert ved minst 1 indikasjon av >10 % av voksne pasienter behandlet med FAMVIR 250 mg er hodepine og kvalme.
Erfaring fra kliniske studier hos voksne pasienter
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
Immunkompetente pasienter
Sikkerheten til FAMVIR 250 mg har blitt evaluert i aktive og placebokontrollerte kliniske studier med 816 FAMVIR-behandlede pasienter med herpes zoster (FAMVIR, 250 mg tre ganger daglig til 750 mg tre ganger daglig); 163 FAMVIR-behandlede pasienter med tilbakevendende genital herpes (FAMVIR, 1000 mg to ganger daglig); 1 197 pasienter med tilbakevendende genital herpes behandlet med FAMVIR 250 mg som suppressiv terapi (125 mg én gang daglig til 250 mg tre ganger daglig), hvorav 570 pasienter fikk FAMVIR (åpen og/eller dobbeltblind) i minst 10 måneder; og 447 FAMVIR-behandlede pasienter med herpes labialis (FAMVIR 500 mg, 1500 mg en gang daglig eller 750 mg to ganger daglig). Tabell 2 viser utvalgte uønskede hendelser.
Tabell 3 viser utvalgte laboratorieavvik i genital herpesundertrykkelsesforsøk.
HIV-infiserte pasienter
Hos HIV-infiserte pasienter var de hyppigst rapporterte bivirkningene for henholdsvis FAMVIR (500 mg to ganger daglig; n=150) og acyclovir (400 mg, 5x/dag; n=143) hodepine (17 % vs. 15 % ), kvalme (11 % vs. 13 %), diaré (7 % vs. 11 %), oppkast (5 % vs. 4 %), tretthet (4 % vs. 2 %) og magesmerter (3 % vs. 6 %).
Postmarketing-erfaring
Bivirkningene oppført nedenfor er rapportert under bruk av FAMVIR etter godkjenning. Fordi disse hendelsene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering:
Forstyrrelser i blodet og lymfesystemet : Trombocytopeni
Lever og galleveier : Unormale leverfunksjonstester, kolestatisk gulsott
Forstyrrelser i immunsystemet : Anafylaktisk sjokk, anafylaktisk reaksjon
Forstyrrelser i nervesystemet : Svimmelhet, somnolens, anfall
Psykiatriske lidelser Forvirring (inkludert delirium, desorientering og forvirringstilstand som hovedsakelig forekommer hos eldre), hallusinasjoner
Hud- og subkutane vevssykdommer : Urticaria, erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, angioødem (f.eks. ansikt, øyelokk, periorbitalt og svelgeødem), overfølsomhetsvaskulitt
Hjertelidelser : Hjertebank
NARKOTIKAHANDEL
Potensial for FAMVIR 250mg til å påvirke andre legemidler
Steady-state farmakokinetikken til digoksin ble ikke endret ved samtidig administrering av flere doser famciklovir (500 mg tre ganger daglig). Ingen klinisk signifikant effekt på farmakokinetikken til zidovudin, dets metabolitt zidovudinglukuronid eller emtricitabin ble observert etter en enkelt oral dose på 500 mg famciklovir administrert samtidig med zidovudin eller emtricitabin.
En in vitro-studie med humane levermikrosomer antyder at famciklovir ikke er en hemmer av CYP3A4-enzymer.
Potensial for andre legemidler å påvirke Penciclovir
Ingen klinisk signifikante endringer i penciklovirs farmakokinetikk ble observert etter enkeltdoseadministrasjon av 500 mg famciklovir etter forbehandling med flere doser allopurinol, cimetidin, teofyllin, zidovudin, prometazin, når det ble gitt kort tid etter et syrenøytraliserende middel (magnesium og aluminiumhydroksyd). emtricitabin. Ingen klinisk signifikant effekt på penciklovirs farmakokinetikk ble observert etter administrering av flere doser (tre ganger daglig) av famciklovir (500 mg) med flere doser digoksin.
Samtidig bruk med probenecid eller andre legemidler eliminert betydelig ved aktiv renal tubulær sekresjon kan resultere i økte plasmakonsentrasjoner av penciklovir.
Omdannelsen av 6-deoksy penciklovir til penciklovir katalyseres av aldehydoksidase. Interaksjoner med andre legemidler som metaboliseres av dette enzymet og/eller hemmer dette enzymet kan potensielt forekomme. Kliniske interaksjonsstudier av famciklovir med cimetidin og prometazin, in vitro-hemmere av aldehydoksidase, viste ingen relevante effekter på dannelsen av penciklovir. Raloxifen, en potent aldehydoksidasehemmer in vitro, kan redusere dannelsen av penciklovir. Det er imidlertid ikke utført en klinisk interaksjonsstudie for å bestemme omfanget av interaksjonen mellom penciklovir og raloksifen.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Akutt nyresvikt
Tilfeller av akutt nyresvikt er rapportert hos pasienter med underliggende nyresykdom som har fått upassende høye doser av FAMVIR for deres nyrefunksjonsnivå. Dosereduksjon anbefales ved administrering av FAMVIR til pasienter med nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON , Bruk i spesifikke populasjoner ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen (pasientinformasjon).
Det er ingen bevis for at FAMVIR vil påvirke en pasients evne til å kjøre bil eller bruke maskiner. Pasienter som opplever svimmelhet, somnolens, forvirring eller andre forstyrrelser i sentralnervesystemet mens de tar FAMVIR 500 mg, bør avstå fra å kjøre bil eller betjene maskiner.
Fordi FAMVIR inneholder laktose (FAMVIR 125 mg, 250 mg og 500 mg tabletter inneholder henholdsvis laktose 26,9 mg, 53,7 mg og 107,4 mg), bør pasienter med sjeldne arvelige problemer med galaktoseintoleranse, en alvorlig laktasemangel være galaktisk eller glukose rådes til å diskutere med helsepersonell før du tar FAMVIR.
Herpes Labialis (forkjølelsessår)
Pasienter bør rådes til å starte behandling ved det tidligste tegn eller symptom på tilbakefall av forkjølelsessår (f.eks. prikking, kløe, svie, smerte eller lesjon). Pasienter bør instrueres om at behandling for forkjølelsessår ikke bør overstige 1 dose. Pasienter bør informeres om at FAMVIR ikke er en kur mot forkjølelsessår.
Kjønnsherpes
Pasienter bør informeres om at FAMVIR ikke er en kur mot genital herpes. Det er ingen data som vurderer om FAMVIR vil forhindre overføring av infeksjon til andre. Fordi genital herpes er en seksuelt overførbar sykdom, bør pasienter unngå kontakt med lesjoner eller samleie når lesjoner og/eller symptomer er tilstede for å unngå å infisere partnere. Genital herpes overføres ofte i fravær av symptomer gjennom asymptomatisk viral utsletting. Pasienter bør derfor rådes til å bruke tryggere sexpraksis.
Hvis episodisk behandling for tilbakevendende genital herpes er indisert, bør pasienter rådes til å starte behandlingen ved første tegn eller symptom på en episode.
Det er ingen data om sikkerhet eller effektivitet av kronisk undertrykkende behandling med lengre varighet enn 1 år.
Herpes zoster (helvetesild)
Det er ingen data om behandling startet mer enn 72 timer etter debut av zosterutslett. Pasienter bør rådes til å starte behandling så snart som mulig etter diagnosen herpes zoster.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
To-års diettkarsinogenitetsstudier med famciclovir ble utført på rotter og mus. En økning i forekomsten av brystadenokarsinom (en vanlig svulst hos dyr av denne stammen) ble sett hos hunnrotter som fikk den høye dosen på 600 mg/kg/dag (1,1 til 4,5 ganger den humane systemiske eksponeringen ved anbefalt total daglig oral dose varierer mellom 500 mg og 2000 mg, basert på arealet under plasmakonsentrasjonskurvene [24 timers AUC] for penciklovir). Ingen økning i tumorforekomst ble rapportert hos hannrotter behandlet med doser opp til 240 mg/kg/dag (0,7 til 2,7 ganger human AUC), eller hos hann- og hunnmus ved doser opp til 600 mg/kg/dag (0,3 til 1,2x den humane AUC).
Mutagenese
Famciklovir og penciklovir (den aktive metabolitten til famciklovir) ble testet for genotoksisk potensial i en rekke in vitro og in vivo analyser. Famciclovir og penciclovir var negative i in vitro-tester for genmutasjoner i bakterier (S. typhimurium og E. coli) og ikke-planlagt DNA-syntese i pattedyr HeLa 83-celler (ved doser opp til henholdsvis 10 000 og 5 000 mcg/plate). Famciclovir var også negativ i L5178Y muselymfomanalysen (5000 mcg/ml), in vivo musemikronukleustesten (4800 mg/kg) og rottedominant dødelig studie (5000 mg/kg). Famciklovir induserte økninger i polyploidi i humane lymfocytter in vitro i fravær av kromosomskade (1200 mcg/ml). Penciklovir var positivt i L5178Y muselymfomanalyse for genmutasjon/kromosomavvik, med og uten metabolsk aktivering (1000 mcg/ml). I humane lymfocytter forårsaket penciklovir kromosomavvik i fravær av metabolsk aktivering (250 mcg/ml). Penciklovir forårsaket en økt forekomst av mikrokjerner i benmarg hos mus in vivo når det ble administrert intravenøst i doser som er svært toksiske for benmargen (500 mg/kg), men ikke ved oral administrering.
Nedsatt fruktbarhet
Testikkeltoksisitet ble observert hos rotter, mus og hunder etter gjentatt administrering av famciklovir eller penciklovir. Testikkelforandringer inkluderte atrofi av sædrørene, reduksjon i antall sædceller og/eller økt forekomst av sædceller med unormal morfologi eller redusert motilitet. Graden av toksisitet for mannlig reproduksjon var relatert til dose og eksponeringsvarighet. Hos hannrotter ble redusert fertilitet observert etter 10 ukers dosering med 500 mg/kg/dag (1,4 til 5,7 ganger human AUC). Det ingen observerbare effektnivået for sperm og testikkeltoksisitet hos rotter etter kronisk administrering (26 uker) var 50 mg/kg/dag (0,15 til 0,6 ganger den humane systemiske eksponeringen basert på AUC-sammenligninger). Testikkeltoksisitet ble observert etter kronisk administrering til mus (104 uker) og hunder (26 uker) ved doser på 600 mg/kg/dag (0,3 til 1,2 ganger human AUC) og 150 mg/kg/dag (1,3 til 5,1 ganger human AUC), henholdsvis.
Famciclovir hadde ingen effekt på generell reproduksjonsevne eller fertilitet hos hunnrotter ved doser opp til 1000 mg/kg/dag (2,7 til 10,8 ganger human AUC).
To placebokontrollerte studier på totalt 130 ellers friske menn med normal sædprofil over en 8-ukers baselineperiode og tilbakevendende genital herpes som fikk oral FAMVIR (250 mg to ganger daglig) (n=66) eller placebo (n=64) behandling i 18 uker viste ingen tegn på signifikante effekter på spermantall, motilitet eller morfologi under behandling eller under en 8-ukers oppfølging.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori B
Etter oral administrering omdannes famciklovir (prodrug) til penciklovir (aktivt legemiddel). Det er ingen tilstrekkelige og godt kontrollerte studier av bruk av famciklovir eller penciklovir hos gravide kvinner. Ingen bivirkninger på embryoføtal utvikling ble observert i reproduksjonsstudier på dyr med famciklovir og penciklovir ved doser høyere enn maksimal anbefalt human dose (MRHD) og human eksponering. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for human respons, bør famciklovir kun brukes under graviditet ved behov.
reproduksjonsstudier på dyr fikk gravide rotter og kaniner oral famciklovir i doser (opptil 1000 mg/kg/dag) som ga 2,7 til 10,8 ganger (rotter) og 1,4 til 5,4 ganger (kaniner) den humane systemiske eksponeringen basert på AUC. Ingen bivirkninger ble observert på embryo-føtal utvikling. I andre studier fikk gravide rotter og kaniner intravenøst famciklovir i doser (360 mg/kg/dag) 1,5 til 6 ganger (rotter) og (120 mg/kg/dag) 1,1 til 4,5 ganger (kaniner) eller penciklovir i doser (80) mg/kg/dag) 0,3 til 1,3 ganger (rotter) og (60 mg/kg/dag) 0,5 til 2,1 ganger (kaniner) MRHD basert på sammenligninger av kroppsoverflateareal. Ingen bivirkninger ble observert på embryo-føtal utvikling.
Rapportering om graviditetseksponering
For å overvåke mor-føtale utfall av gravide kvinner som er eksponert for FAMVIR 500mg, vedlikeholder Novartis Pharmaceuticals Corporation et FAMVIR graviditetsrapporteringssystem. Leger oppfordres til å rapportere sine pasienter ved å ringe 1-888-NOW-NOVA (669-6682).
Ammende mødre
Det er ikke kjent om famciklovir (prodrug) eller penciclovir (aktivt legemiddel) utskilles i morsmelk. Etter oral administrering av famciklovir til diegivende rotter, ble penciklovir skilt ut i morsmelk i konsentrasjoner høyere enn de som ble sett i plasma. Det er ingen data om sikkerheten til FAMVIR 250mg hos spedbarn. FAMVIR 500mg skal ikke brukes til ammende mødre med mindre de potensielle fordelene anses å oppveie de potensielle risikoene forbundet med behandling.
Pediatrisk bruk
Effekten av FAMVIR 250 mg er ikke fastslått hos pediatriske pasienter. Den farmakokinetiske profilen og sikkerheten til famciclovir (eksperimentelle granulat blandet med OraSweet® eller tabletter) ble studert i 3 åpne studier.
Studie 1 var en enkeltdose farmakokinetisk og sikkerhetsstudie hos spedbarn 1 måned til
Studie 2 var en åpen, enkeltdose farmakokinetisk sikkerhetsstudie med flere doser av famciclovir eksperimentelle granulat blandet med OraSweet hos barn 1 til
Totalt 100 pasienter ble registrert i sikkerhetsdelen av flere doser av studien; 47 personer med aktiv eller latent HSV-infeksjon og 53 personer med vannkopper. Pasienter med aktiv eller latent HSV-infeksjon fikk famciclovir to ganger daglig i 7 dager. Den daglige dosen av famciclovir varierte fra 150 mg til 500 mg to ganger daglig, avhengig av pasientens kroppsvekt. Pasienter med vannkopper fikk famciclovir tre ganger daglig i 7 dager. Den daglige dosen av famciclovir varierte fra 150 mg til 500 mg tre ganger daglig, avhengig av pasientens kroppsvekt. De kliniske bivirkningene og laboratorietestavvikene som ble observert i denne studien, var lik de som ble sett hos voksne. De tilgjengelige dataene er utilstrekkelige til å støtte bruken av famciclovir til behandling av barn 1 til
Vannkopper
Effekten av famciclovir for behandling av vannkopper er ikke fastslått hos verken pediatriske eller voksne pasienter. Famciclovir er godkjent for behandling av herpes zoster hos voksne pasienter. Ekstrapolering av effektdata fra voksne med herpes zoster til barn med vannkopper vil imidlertid ikke være hensiktsmessig. Selv om vannkopper og herpes zoster er forårsaket av samme virus, er sykdommene forskjellige.
Kjønnsherpes
Klinisk informasjon om genital herpes hos barn er begrenset. Effektdata fra voksne kan derfor ikke ekstrapoleres til denne populasjonen. Videre er famciclovir ikke studert hos barn 1 til
Herpes Labialis
Det er ingen farmakokinetiske data og sikkerhetsdata hos barn 1 til
Studie 3 var en åpen, enkeltarmsstudie for å evaluere farmakokinetikken, sikkerheten og antiviral aktivitet til en enkelt 1500 mg dose (tre 500 mg tabletter) av famciclovir hos barn 12 til
en fase 3-studie med voksne der pasienter fikk en enkeltdose på 1500 mg famciclovir eller placebo, var median tid til tilheling blant pasienter med ikke-aborterte lesjoner 4,4 dager i famciclovir 1500 mg enkeltdosegruppen og 6,2 dager i placebo gruppe. Merk at i voksenstudien ble behandlingen initiert av pasienter innen 1 time etter symptomdebut [se Kliniske studier ]. Basert på effektresultatene i studie 3, anbefales ikke famciklovir til barn 12 til
Geriatrisk bruk
Av 816 pasienter med herpes zoster i kliniske studier som ble behandlet med FAMVIR, var 248 (30,4 %) ≥65 år og 103 (13 %) var ≥75 år. Det ble ikke observert noen generelle forskjeller i forekomst eller typer bivirkninger mellom yngre og eldre pasienter. Av 610 pasienter med tilbakevendende herpes simplex (type 1 eller type 2) i kliniske studier som ble behandlet med FAMVIR 500 mg, var 26 (4,3 %) >65 år og 7 (1,1 %) >75 år. Kliniske studier av FAMVIR 500 mg hos pasienter med tilbakevendende genital herpes inkluderte ikke tilstrekkelig antall personer i alderen 65 år og over til å avgjøre om de responderer annerledes sammenlignet med yngre personer.
Ingen dosejustering av famciclovir basert på alder anbefales med mindre nyrefunksjonen er nedsatt [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ]. Generelt bør det utvises passende forsiktighet ved administrering og overvåking av FAMVIR 250 mg hos eldre pasienter, noe som gjenspeiler den høyere frekvensen av nedsatt nyrefunksjon og samtidig bruk av andre legemidler.
Pasienter med nedsatt nyrefunksjon
Tilsynelatende plasmaclearance, renal clearance og plasma-eliminasjonshastighetskonstanten for penciklovir sank lineært med reduksjoner i nyrefunksjonen. Etter administrering av en enkelt 500 mg famciclovir oral dose (n=27) til friske frivillige og til frivillige med varierende grad av nedsatt nyrefunksjon (CLCR varierte fra 6,4 til 138,8 ml/min), ble følgende resultater oppnådd (tabell 4):
I en flerdosestudie av famciklovir utført på personer med ulik grad av nedsatt nyrefunksjon (n=18), var farmakokinetikken til penciklovir sammenlignbar med den etter enkeltdoser.
En dosejustering anbefales for pasienter med nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON ].
Pasienter med nedsatt leverfunksjon
Mild eller moderat nedsatt leverfunksjon (kronisk hepatitt [n=6], kronisk etanolmisbruk [n=8] eller primær biliær cirrhose [n=1]) hadde ingen effekt på omfanget av tilgjengelighet (AUC) av penciklovir etter en enkeltdose på 500 mg famciclovir. Imidlertid var det en reduksjon på 44 % i penciklovir gjennomsnittlig maksimal plasmakonsentrasjon (Cmax) og tiden til maksimal plasmakonsentrasjon (tmax) ble økt med 0,75 timer hos pasienter med nedsatt leverfunksjon sammenlignet med normale frivillige. Ingen dosejustering anbefales for pasienter med mild eller moderat nedsatt leverfunksjon. Farmakokinetikken til penciklovir har ikke blitt evaluert hos pasienter med alvorlig nedsatt leverfunksjon. Konvertering av famciclovir til den aktive metabolitten penciclovir kan være svekket hos disse pasientene, noe som resulterer i lavere plasmakonsentrasjoner av penciclovir, og dermed muligens en reduksjon av effekten av famciclovir [se KLINISK FARMAKOLOGI ].
Svarte og afroamerikanske pasienter
en randomisert, dobbeltblind, placebokontrollert studie utført med 304 immunkompetente svarte og afroamerikanske voksne med tilbakevendende genital herpes, var det ingen forskjell i median tid til helbredelse mellom pasienter som fikk FAMVIR eller placebo. Generelt var bivirkningsprofilen lik den som ble observert i andre FAMVIR kliniske studier for voksne pasienter [se BIVIRKNINGER ]. Relevansen av disse studieresultatene for andre indikasjoner hos svarte og afroamerikanske pasienter er ukjent [se Kliniske studier ].
OVERDOSE
Egnet symptomatisk og støttende behandling bør gis. Penciklovir fjernes ved hemodialyse.
KONTRAINDIKASJONER
FAMVIR 250mg er kontraindisert hos pasienter med kjent overfølsomhet overfor produktet, dets komponenter eller Denavir® (penciklovirkrem).
KLINISK FARMAKOLOGI
Virkningsmekanismen
Famciclovir er et oralt administrert prodrug av det antivirale middelet penciclovir [se Mikrobiologi ].
Farmakokinetikk
Famciclovir er diacetyl 6-deoksy-analogen til den aktive antivirale forbindelsen penciklovir. Etter oral administrering gjennomgår famciklovir rask og omfattende metabolisme til penciklovir, og lite eller ingen famciklovir påvises i plasma eller urin. Penciklovir elimineres hovedsakelig uendret av nyrene. Derfor må dosen av FAMVIR 500 mg justeres hos pasienter med ulike grader av nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON ].
Farmakokinetikk hos voksne
Absorpsjon og biotilgjengelighet:
Den absolutte biotilgjengeligheten av penciklovir er 77 ± 8 % som bestemt etter administrering av en 500 mg famciklovir oral dose og en 400 mg penciklovir intravenøs dose til 12 friske mannlige forsøkspersoner.
Penciklovirkonsentrasjonen økte proporsjonalt med dosen over et famciklovirdoseområde på 125 mg til 1000 mg administrert som en enkeltdose. Tabell 5 viser gjennomsnittlige farmakokinetiske parametere for penciklovir etter enkelt administrering av FAMVIR til friske mannlige frivillige.
Etter oral enkeltdoseadministrasjon av 500 mg famciclovir til 7 pasienter med herpes zoster, var AUC (gjennomsnittlig ± SD), Cmax og tmax 12,1±1,7 mcg time/ml, 4,0±0,7 mcg/ml og 0,7±0,2 timer. , henholdsvis. AUC for penciklovir var omtrent 35 % høyere hos pasienter med herpes zoster sammenlignet med friske frivillige. Noe av denne forskjellen kan skyldes forskjeller i nyrefunksjon mellom de 2 gruppene.
Det er ingen akkumulering av penciklovir etter administrering av 500 mg famciklovir tre ganger daglig i 7 dager.
Penciclovir Cmax gikk ned med ca. 50 % og tmax ble forsinket med 1,5 timer når en kapselformulering av famciclovir ble administrert sammen med mat (ernæringsinnholdet var ca. 910 kcal og 26 % fett). Det var ingen effekt på omfanget av tilgjengelighet (AUC) av penciklovir. Det var en 18 % reduksjon i Cmax og en forsinkelse i tmax på ca. 1 time når famciclovir ble gitt 2 timer etter et måltid sammenlignet med administrering 2 timer før et måltid. Fordi det ikke var noen effekt på omfanget av systemisk tilgjengelighet av penciklovir, kan FAMVIR 250 mg tas uten hensyn til måltider.
Fordeling:
Distribusjonsvolumet (Vdβ) var 1,08±0,17 l/kg hos 12 friske mannlige forsøkspersoner etter en enkelt intravenøs dose av penciklovir på 400 mg administrert som en 1-times intravenøs infusjon. Penciklovir er
Metabolisme:
Etter oral administrering deacetyleres famciklovir og oksideres til penciklovir. Metabolitter som er inaktive inkluderer 6-deoksy penciklovir, monoacetylert penciklovir og 6-deoksy monoacetylert penciklovir (henholdsvis 5 %, NARKOTIKAHANDEL ].
Eliminering:
Omtrent 94 % av administrert radioaktivitet ble gjenfunnet i urin i løpet av 24 timer (83 % av dosen ble utskilt i løpet av de første 6 timene) etter administrering av 5 mg/kg radiomerket penciklovir som en 1-times infusjon til 3 friske mannlige frivillige. Penciklovir utgjorde 91 % av radioaktiviteten som ble skilt ut i urinen.
Etter oral administrering av en enkeltdose på 500 mg radiomerket famciclovir til 3 friske mannlige frivillige, ble 73 % og 27 % av administrert radioaktivitet gjenfunnet i henholdsvis urin og feces i løpet av 72 timer. Penciklovir utgjorde 82 % og 6-deoksy penciklovir sto for 7 % av radioaktiviteten som ble utskilt i urinen. Omtrent 60 % av den administrerte radiomerket dose ble samlet i urin i løpet av de første 6 timene.
Etter intravenøs administrering av penciklovir hos 48 friske mannlige frivillige, var gjennomsnittlig ± SD total plasmaclearance av penciklovir 36,6±6,3 l/time (0,48±0,09 l/time/kg). Penciklovir renal clearance utgjorde 74,5±8,8 % av total plasmaclearance.
Renal clearance av penciklovir etter oral administrering av en enkelt 500 mg dose famciklovir til 109 friske mannlige frivillige var 27,7±7,6 l/time. Aktiv tubulær sekresjon bidrar til renal eliminering av penciklovir.
Plasmaeliminasjonshalveringstiden for penciklovir var 2,0±0,3 timer etter intravenøs administrering av penciklovir til 48 friske mannlige frivillige og 2,3±0,4 timer etter oral administrering av 500 mg famciklovir til 124 friske mannlige frivillige. Halveringstiden hos 17 pasienter med herpes zoster var 2,8±1,0 timer og 2,7±1,0 timer etter henholdsvis enkeltdoser og gjentatte doser.
Spesielle populasjoner
Geriatriske pasienter
Basert på sammenligning av kryssstudier var penciklovir AUC 40 % høyere og penciklovir renal clearance var 22 % lavere hos eldre forsøkspersoner (n=18, alder 65-79 år) sammenlignet med yngre forsøkspersoner. Noe av denne forskjellen kan skyldes forskjeller i nyrefunksjon mellom de 2 gruppene. Ingen dosejustering av famciclovir basert på alder anbefales med mindre nyrefunksjonen er nedsatt [se DOSERING OG ADMINISTRASJON , Bruk i spesifikke populasjoner ]
Pasienter med nedsatt nyrefunksjon
Hos personer med varierende grad av nedsatt nyrefunksjon, redusert tilsynelatende plasmaclearance, renal clearance og plasma-eliminasjonshastighetskonstanten for penciklovir lineært med reduksjoner i nyrefunksjonen, etter både enkelt og gjentatt dosering [se Bruk i spesifikke populasjoner ]. En dosejustering anbefales for pasienter med nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON ].
Pasienter med nedsatt leverfunksjon
Mild eller moderat nedsatt leverfunksjon hadde ingen effekt på graden av tilgjengelighet (AUC) av penciklovir [se Bruk i spesifikke populasjoner ]. Ingen dosejustering anbefales for pasienter med mild eller moderat nedsatt leverfunksjon. Effekten av alvorlig nedsatt leverfunksjon på farmakokinetikken til penciklovir er ikke evaluert.
HIV-infiserte pasienter
Etter oral administrering av en enkeltdose på 500 mg famciklovir til HIV-positive pasienter, var de farmakokinetiske parametrene til penciklovir sammenlignbare med de som ble observert hos friske personer.
Kjønn
Farmakokinetikken til penciclovir ble evaluert hos 18 friske mannlige og 18 friske kvinnelige frivillige etter oral enkeltdose administrering av 500 mg famciclovir. AUC for penciklovir var 9,3±1,9 mcg time/ml og 11,1±2,1 mcg time/mL hos henholdsvis menn og kvinner. Penciklovir renal clearance var henholdsvis 28,5±8,9 l/time og 21,8±4,3 l/time. Disse forskjellene ble tilskrevet forskjeller i nyrefunksjon mellom de 2 gruppene. Ingen dosejustering av famciclovir basert på kjønn anbefales.
Løp
En retrospektiv evaluering ble utført for å sammenligne de farmakokinetiske parametrene oppnådd hos svarte og kaukasiske forsøkspersoner etter enkelt og gjentatt administrering av famciclovir 500 mg én gang daglig, to ganger daglig eller tre ganger daglig. Data fra en studie med friske frivillige (enkeltdose), en studie med personer med ulik grad av nedsatt nyrefunksjon (enkeltdose og gjentatt dose) og en studie med personer med nedsatt leverfunksjon (enkeltdose) indikerte ingen signifikante forskjeller i farmakokinetikken til penciklovir mellom svarte og kaukasiske forsøkspersoner.
Mikrobiologi
Virkningsmekanismen
Famciclovir er et prodrug av penciclovir, som har vist hemmende aktivitet mot herpes simplex-virus type 1 (HSV-1) og 2 (HSV-2) og varicella zoster-virus (VZV). I celler infisert med HSV-1, HSV-2 eller VZV, fosforylerer den virale tymidinkinasen penciklovir til en monofosfatform som igjen omdannes av cellulære kinaser til den aktive formen penciklovirtrifosfat. Biokjemiske studier viser at penciklovirtrifosfat hemmer HSV-2 DNA-polymerase konkurrerende med deoksyguanosintrifosfat. Følgelig hemmes herpes viral DNA-syntese og derfor replikasjon selektivt. Penciklovirtrifosfat har en intracellulær halveringstid på 10 timer i HSV-1-, 20 timer i HSV-2 og 7 timer i VZV-infiserte celler dyrket i kultur. Den kliniske betydningen av den intracellulære halveringstiden er imidlertid ukjent.
Antiviral aktivitet
cellekulturstudier er penciklovir hemmende for følgende herpesvirus: HSV-1, HSV-2 og VZV. Den antivirale aktiviteten til penciklovir mot villtypestammer dyrket på humane forhudsfibroblaster ble vurdert med en plakkreduksjonsanalyse og farging med krystallfiolett 3 dager etter infeksjon for HSV og 10 dager etter infeksjon for VZV. Median EC50-verdier av penciklovir mot laboratorie- og kliniske isolater av HSV-1, HSV-2 og VZV var 2 μM (område 1,2 til 2,4 μM, n=7), 2,6 μM (område 1,6 til 11 μM, n=6) , og henholdsvis 34 μM (område 6,7 til 71 μM, n=6).
Motstand
Penciklovir-resistente mutanter av HSV og VZV kan skyldes mutasjoner i generene viral tymidinkinase (TK) og DNA-polymerase. Mutasjoner i det virale TK-genet kan føre til fullstendig tap av TK-aktivitet (TK-negativ), reduserte nivåer av TK-aktivitet (TK-delvis), eller endring i evnen til viral TK til å fosforylere legemidlet uten tilsvarende tap i evnen til å fosforylere tymidin (TK endret). Median EC50-verdiene observert i en plakkreduksjonsanalyse med penciklovirresistent HSV-1, HSV-2 og VZV var 69 μM (område 14 til 115 μM, n=6), 46 μM (område 4 til >395 μM, n= 9), og henholdsvis 92 μM (område 51 til 148 μM, n=4). Muligheten for viral resistens mot penciklovir bør vurderes hos pasienter som ikke responderer eller opplever tilbakevendende virusutskillelse under behandlingen.
Kryssmotstand
Kryssresistens er observert blant HSV DNA-polymerasehemmere. De mest vanlige acyclovir-resistente mutantene som er TK-negative er også resistente mot penciklovir.
Kliniske studier
Herpes Labialis (forkjølelsessår)
En randomisert, dobbeltblind, placebokontrollert studie ble utført med 701 immunkompetente voksne med tilbakevendende herpes labialis. Pasienter startet selvbehandling innen 1 time etter første debut av tegn eller symptomer på en tilbakevendende herpes labialis-episode med FAMVIR 1500 mg som enkeltdose (n=227), FAMVIR 750 mg to ganger daglig (n=220) eller placebo (n= 254) i 1 dag. Median tid til tilheling blant pasienter med ikke-aborterte lesjoner (fremgang utover papulestadiet) var 4,4 dager i FAMVIR 1500 mg enkeltdosegruppen (n=152) sammenlignet med 6,2 dager i placebogruppen (n=168) . Median forskjell i tid til helbredelse mellom gruppene som ble behandlet med placebo og FAMVIR 1500 mg var 1,3 dager (95 % KI: 0,6–2,0). Ingen forskjeller i andel pasienter med aborterte lesjoner (som ikke progredierer utover papulestadiet) ble observert mellom pasienter som fikk FAMVIR 250 mg eller placebo: 33 % for FAMVIR 1500 mg enkeltdose og 34 % for placebo. Median tid til tap av smerte og ømhet var 1,7 dager hos FAMVIR 1500 mg enkeltdosebehandlede pasienter vs. 2,9 dager hos placebobehandlede pasienter.
Kjønnsherpes
Tilbakevendende episoder
En randomisert, dobbeltblind, placebokontrollert studie ble utført med 329 immunkompetente voksne med tilbakevendende genital herpes. Pasienter startet selvbehandling innen 6 timer etter første tegn eller symptom på en tilbakevendende genital herpesepisode med enten FAMVIR 1000 mg to ganger daglig (n=163) eller placebo (n=166) i 1 dag. Median tid til tilheling blant pasienter med ikke-aborterte lesjoner (fremgang utover papulestadiet) var 4,3 dager hos FAMVIR-behandlede pasienter (n=125) sammenlignet med 6,1 dager hos placebobehandlede pasienter (n=145). Median forskjell i tid til helbredelse mellom placebo- og FAMVIR-behandlede gruppene var 1,2 dager (95 % KI: 0,5 til 2,0). 23 prosent av FAMVIR-behandlede pasienter hadde aborterte lesjoner (ingen lesjonsutvikling utover erytem) vs. 13 % hos placebo-behandlede pasienter. Mediantiden til tap av alle symptomer (f.eks. prikking, kløe, svie, smerte eller ømhet) var 3,3 dager hos FAMVIR-behandlede pasienter vs. 5,4 dager hos placebobehandlede pasienter.
En randomisert (2:1), dobbeltblind, placebokontrollert studie ble utført med 304 immunkompetente svarte og afroamerikanske voksne med tilbakevendende genital herpes. Pasienter startet selvbehandling innen 6 timer etter første tegn eller symptom på en tilbakevendende genital herpesepisode med enten FAMVIR 1000 mg to ganger daglig (n=206) eller placebo (n=98) i 1 dag. Median tid til tilheling blant pasienter med ikke-aborterte lesjoner var 5,4 dager hos FAMVIR-behandlede pasienter (n=152) sammenlignet med 4,8 dager hos placebobehandlede pasienter (n=78). Medianforskjellen i tid til helbredelse mellom placebo- og FAMVIR-behandlede gruppene var -0,26 dager (95 % KI: -0,98 til 0,40).
Undertrykkende terapi
To randomiserte, dobbeltblinde, placebokontrollerte, 12-måneders studier ble utført på 934 immunkompetente voksne med en historie med 6 eller flere tilbakefall av genital herpes-episoder per år. Sammenligninger inkluderte FAMVIR 125 mg tre ganger daglig, 250 mg to ganger daglig, 250 mg tre ganger daglig og placebo. Etter 12 måneder fikk 60 % til 65 % av pasientene fortsatt FAMVIR og 25 % fikk placebobehandling. Tilbakefallsrater etter 6 og 12 måneder hos pasienter behandlet med 250 mg dose to ganger daglig er vist i tabell 6.
FAMVIR-behandlede pasienter hadde omtrent 1/5 av median antall residiv sammenlignet med placebo-behandlede pasienter. Høyere doser av FAMVIR 250 mg var ikke assosiert med økt effekt.
Tilbakevendende orolabial eller genital herpes hos HIV-infiserte pasienter
En randomisert, dobbeltblind studie sammenlignet famciclovir 500 mg to ganger daglig i 7 dager (n=150) med oral acyclovir 400 mg 5 ganger daglig i 7 dager (n=143) hos HIV-infiserte pasienter med tilbakevendende orolabial eller genital herpes behandlet innen 48 timer med utbruddet av lesjonen. Omtrent 40 % av pasientene hadde et CD4+-tall under 200 celler/mm3, 54 % av pasientene hadde anogenitale lesjoner og 35 % hadde orolabiale lesjoner. Famciklovirbehandling var sammenlignbar med oral acyclovir når det gjaldt å redusere dannelsen av nye lesjoner og i tid til fullstendig helbredelse.
Herpes zoster (helvetesild)
To randomiserte, dobbeltblinde studier, 1 placebokontrollert og 1 aktiv-kontrollert, ble utført på 964 immunkompetente voksne med ukomplisert herpes zoster. Behandlingen ble startet innen 72 timer etter at den første lesjonen dukket opp og ble fortsatt i 7 dager.
den placebokontrollerte studien ble 419 pasienter behandlet med enten FAMVIR 500 mg tre ganger daglig (n=138), FAMVIR 750 mg tre ganger daglig (n=135) eller placebo (n=146). Mediantiden til full skorpedannelse var 5 dager blant FAMVIR 500 mg-behandlede pasienter sammenlignet med 7 dager hos placebo-behandlede pasienter. Tidene til full skorpedannelse, tap av vesikler, tap av sår og tap av skorper var kortere for FAMVIR 500 mg-behandlede pasienter enn for placebo-behandlede pasienter i den totale studiepopulasjonen. Effekten av FAMVIR 500 mg var større når behandlingen ble startet innen 48 timer etter utslett. det var også mer dyptgripende hos pasienter 50 år eller eldre. Blant de 65,2 % av pasientene med minst 1 positiv viral kultur, hadde FAMVIR-behandlede pasienter en kortere median varighet av viral utskillelse enn placebo-behandlede pasienter (henholdsvis 1 dag og 2 dager).
Det var ingen generelle forskjeller i varigheten av smerte før utslettheling mellom FAMVIR- og placebobehandlede grupper. I tillegg var det ingen forskjell i forekomst av smerte etter utsletttilheling (postherpetisk nevralgi) mellom behandlingsgruppene. Hos de 186 pasientene (44,4 % av den totale studiepopulasjonen) som utviklet postherpetisk nevralgi, var median varighet av postherpetisk nevralgi kortere hos pasienter behandlet med FAMVIR 500 mg enn hos de behandlet med placebo (henholdsvis 63 dager og 119 dager). Ingen ytterligere effekt ble vist med høyere dose av FAMVIR.
I den aktivt kontrollerte studien ble 545 pasienter behandlet med 1 av 3 doser FAMVIR tre ganger daglig eller med acyclovir 800 mg fem ganger daglig. Tider til full lesjonsskorpedannelse og tider til tap av akutt smerte var sammenlignbare for alle grupper, og det var ingen statistisk signifikante forskjeller i tiden til tap av postherpetisk neuralgi mellom FAMVIR- og acyclovir-behandlede grupper.
PASIENTINFORMASJON
FAMVIR® (Fam'-veer) (famciclovir) Tabletter
Les denne pasientinformasjonen før du begynner å ta FAMVIR og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller behandling.
Hva er FAMVIR?
Famvir er et reseptbelagt antiviralt legemiddel som brukes til å:
- . behandle utbrudd av forkjølelsessår (feberblemmer) hos friske voksne . behandle utbrudd av genital herpes hos friske voksne . redusere antall utbrudd av genital herpes hos friske voksne . behandle utbrudd av herpes simplex lesjoner i eller rundt munnen, kjønnsorganene og analområdet hos personer som er infisert med HIV . behandle helvetesild (herpes zoster) hos voksne med normalt immunsystem
Det er ikke kjent om FAMVIR 500mg er trygt og effektivt hos barn under 18 år.
FAMVIR 250mg er ikke en kur mot herpes. Det er ikke kjent om FAMVIR kan stoppe spredningen av herpes til andre. Hvis du er seksuelt aktiv, kan du overføre herpes til partneren din selv om du tar FAMVIR. Herpes kan overføres selv om du ikke har aktive symptomer. Du bør fortsette å praktisere tryggere sex for å redusere sjansene for å spre genital herpes til andre. Ikke ha seksuell kontakt med partneren din under et utbrudd av genital herpes eller hvis du har noen symptomer på genital herpes. Bruk kondom laget av lateks eller polyuretan når du har seksuell kontakt. Spør helsepersonell om mer informasjon om tryggere sexpraksis.
Hvem bør ikke ta FAMVIR?
Ikke ta FAMVIR 250mg hvis du er allergisk mot noen av ingrediensene eller mot Denavir® (penciklovirkrem). Se slutten av denne pasientinformasjonen for en fullstendig liste over ingredienser i FAMVIR.
Hva bør jeg fortelle helsepersonell før jeg tar FAMVIR 500mg?
Før du begynner å ta FAMVIR 500mg, fortell helsepersonell dersom du:
- . har nyre- eller leverproblemer . har et sjeldent genetisk problem med galaktoseintoleranse, alvorlig laktasemangel eller du ikke absorberer glukose-galaktose (malabsorpsjon) . er gravid eller planlegger å bli gravid. Det er ikke kjent om FAMVIR 250mg vil skade det ufødte barnet ditt . Rapportering om graviditetseksponering: Novartis Pharmaceuticals Corporation samler inn graviditetsrapporter som rapporteres på frivillig basis. I tilfelle av graviditet, snakk med helsepersonell om å rapportere graviditeten . ammer eller planlegger å amme
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Fortell spesielt helsepersonell hvis du tar:
- . andre medisiner og produkter du bruker for å behandle herpesutbrudd . probenecid (Probalan)
Kjenn til medisinene du tar. Ha en liste over dem med deg for å vise til helsepersonell og apotek hver gang du får en ny medisin.
Hvordan skal jeg ta FAMVIR?
- . Ta FAMVIR nøyaktig som foreskrevet . Helsepersonell vil fortelle deg hvor mange FAMVIR du skal ta og når du skal ta dem. Dosen din av FAMVIR 250 mg og hvor ofte du tar den kan variere avhengig av tilstanden din . FAMVIR kan tas med eller uten mat . Det er viktig for deg å fullføre all medisinen som foreskrevet, selv om du begynner å føle deg bedre . Symptomene dine kan fortsette selv etter at du er ferdig med hele FAMVIR. Dette betyr ikke at du trenger mer medisin, siden du allerede har fullført en hel kur med FAMVIR 500mg og den vil fortsette å virke i kroppen din. Snakk med helsepersonell hvis du har spørsmål om tilstanden din og behandlingen din
Hva er de mulige bivirkningene av FAMVIR 250mg?
De vanligste bivirkningene av FAMVIR 500mg inkluderer:
- . hodepine . kvalme
Snakk med helsepersonell hvis du har noen bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av FAMVIR. Spør helsepersonell eller apotek for mer informasjon.
Ring helsepersonell for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA1088.
Hvordan bør jeg oppbevare FAMVIR 500mg?
- . Oppbevar FAMVIR ved romtemperatur mellom 59 °F og 86 °F (15 °C til 30 °C).
Oppbevar FAMVIR og alle legemidler utilgjengelig for barn.
Generell informasjon om FAMVIR
Medisiner foreskrives noen ganger til andre formål enn de som er oppført i Pasientinformasjonsbrosjyrer. Ikke bruk FAMVIR for en tilstand det ikke er foreskrevet for. Ikke gi FAMVIR 500mg til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Dette pakningsvedlegget oppsummerer den viktigste informasjonen om FAMVIR. Hvis du vil ha mer informasjon, snakk med helsepersonell. Din helsepersonell eller apotek kan gi deg informasjon om FAMVIR 500mg som er skrevet for helsepersonell. For mer informasjon, gå til www.FAMVIR.com eller ring 1-888-669-6682.
Hva er ingrediensene i FAMVIR?
Aktiv ingrediens: famciclovir
Inaktive ingredienser: hydroksypropylcellulose, hydroksypropylmetylcellulose, laktose, magnesiumstearat, polyetylenglykoler, natriumstivelsesglykolat og titandioksid
