Epivir 150mg Lamivudine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Epivir og hvordan brukes det?
Epivir 150mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på HIV-infeksjon og kronisk hepatitt B. Epivir 150mg kan brukes alene eller sammen med andre medisiner.
Epivir tilhører en klasse legemidler kalt hepatitt B/hepatitt C-midler; HIV, NRTIer.
Det er ikke kjent om Epivir er trygt og effektivt hos barn yngre enn 3 måneder.
Hva er de mulige bivirkningene av Epivir 150mg?
Epivir kan forårsake alvorlige bivirkninger inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . uvanlige muskelsmerter, . magesmerter, . oppkast, . uregelmessig hjertefrekvens, . svimmelhet, . føler seg kald, . svakhet, . tretthet, . sterke smerter i øvre del av magen sprer seg til ryggen, . kvalme, . rask puls, . hevelse rundt midtpartiet, . høyresidig øvre magesmerter, . tap av Appetit, . mørk urin, . leirefarget avføring, . gulfarging av hud eller øyne (gulsott), . feber, . nattesvette, . hovne kjertler, . forkjølelsessår, . hoste, . hvesing, . diaré, . vekttap, . problemer med å snakke eller svelge, . problemer med balanse eller øyebevegelser, . stikkende følelse, . hevelse i nakken eller halsen (forstørret skjoldbruskkjertel), . menstruasjonsforandringer, og . maktesløshet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Epivir inkluderer:
- . kvalme, . diaré, . hodepine, . feber, . tretthet, . generell dårlig følelse, . øresmerter eller full følelse, . problemer med å høre, . drenering fra øret, . masete hos et barn, . tett nese, . nysing, . sår hals, og . hoste
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Epivir. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FORVERKRINGER AV HEPATITT B, og ULIKE FORMULERINGER AV EPIVIR.
Forverring av hepatitt B
Alvorlige akutte forverringer av hepatitt B er rapportert hos pasienter som samtidig er infisert med hepatitt B-virus (HBV) og humant immunsviktvirus (HIV-1) og som har seponert EPIVIR. Leverfunksjonen bør overvåkes nøye med både klinisk og laboratorieoppfølging i minst flere måneder hos pasienter som seponerer EPIVIR og samtidig er infisert med HIV-1 og HBV. Hvis det er aktuelt, kan oppstart av antihepatitt B-behandling være nødvendig [se ADVARSLER OG FORHOLDSREGLER].
Viktige forskjeller mellom produkter som inneholder lamivudin
EPIVIR 150 mg tabletter og mikstur (brukes til å behandle HIV-1-infeksjon) inneholder en høyere dose av virkestoffet (lamivudin) enn EPIVIR-HBV tabletter og mikstur (brukes til å behandle kronisk HBV-infeksjon). Pasienter med HIV-1-infeksjon skal kun få doseringsformer som er egnet for behandling av HIV-1 [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
EPIVIR (også kjent som 3TC) er et merkenavn for lamivudin, en syntetisk nukleosidanalog med aktivitet mot HIV-1 og HBV. Det kjemiske navnet på lamivudin er (2R,cis)-4-amino-1(2-hydroksymetyl-1,3-oksatiolan-5-yl)-(1H)-pyrimidin-2-on. Lamivudin er (-)enantiomeren av en dideoksyanalog av cytidin. Lamivudin har også blitt referert til som (-)2',3'-dideoxy, 3'tiacytidin. Den har en molekylformel på C8H11N3O3S og en molekylvekt på 229,3 g per mol. Den har følgende strukturformel:
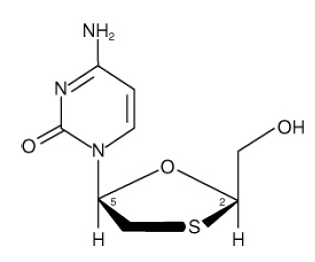
Lamivudin er et hvitt til off-white krystallinsk fast stoff med en løselighet på ca. 70 mg per ml i vann ved 20°C.
EPIVIR 150 mg tabletter er til oral administrering. Hver 150 mg filmdrasjert tablett med skårede deler inneholder 150 mg lamivudin og de inaktive ingrediensene hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyetylenglykol, polysorbat 80, natriumstivelsesglykolat og titandioksid.
Hver 300 mg filmdrasjerte tablett inneholder 300 mg lamivudin og de inaktive ingrediensene svart jernoksid, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyetylenglykol, polysorbat 80, natriumstivelsesglykolat og titandioksid.
EPIVIR mikstur er for oral administrering. En milliliter (1 ml) EPIVIR mikstur inneholder 10 mg lamivudin (10 mg per ml) i en vandig løsning og de inaktive ingrediensene kunstige jordbær- og bananaromaer, sitronsyre (vannfri), metylparaben, propylenglykol, propylparaben, natriumsitrat (dihydrat) og sukrose (200 mg).
INDIKASJONER
EPIVIR 150mg er en nukleosidanalog indisert i kombinasjon med andre antiretrovirale midler for behandling av humant immunsviktvirus type 1 (HIV-1) infeksjon.
Bruksbegrensninger
- . Doseringen av dette produktet er for HIV-1 og ikke for HBV.
DOSERING OG ADMINISTRASJON
Anbefalt dosering for voksne pasienter
Den anbefalte dosen av EPIVIR 150 mg hos HIV-1-infiserte voksne er 300 mg daglig, gitt som enten 150 mg oralt to ganger daglig eller 300 mg oralt én gang daglig med eller uten mat. Hvis lamivudin administreres til en pasient infisert med HIV-1 og HBV, bør dosen indisert for HIV-1-behandling brukes som en del av et passende kombinasjonsregime [se ADVARSLER OG FORHOLDSREGLER ].
Anbefalt dosering for pediatriske pasienter
EPIVIR 150 mg skåret tablett er den foretrukne formuleringen for HIV-1-infiserte pediatriske pasienter som veier minst 14 kg og for hvem en fast doseringsform er passende. Før de foreskriver EPIVIR-tabletter med skår, bør pediatriske pasienter vurderes for evnen til å svelge tabletter. For pasienter som ikke er i stand til å svelge EPIVIR 150 mg tabletter på en sikker og pålitelig måte, kan miksturen foreskrives [se ADVARSLER OG FORHOLDSREGLER ]. Den anbefalte orale dosen av EPIVIR 150 mg tabletter for HIV-1-infiserte pediatriske pasienter er presentert i tabell 1.
Oral løsning
Den anbefalte dosen av EPIVIR 150 mg mikstur til HIV-1-infiserte pediatriske pasienter i alderen 3 måneder og eldre er 5 mg per kg tatt oralt to ganger daglig eller 10 mg per kg oralt en gang daglig (opptil maksimalt 300 mg daglig), administrert i kombinasjon med andre antiretrovirale midler [se KLINISK FARMAKOLOGI ]. Vurder HIV-1 viral belastning og CD4+ celletall/prosent når du velger doseringsintervall for pasienter som starter behandling med mikstur [se ADVARSLER OG FORHOLDSREGLER , KLINISK FARMAKOLOGI ].
Pasienter med nedsatt nyrefunksjon
Dosering av EPIVIR 150 mg justeres i henhold til nyrefunksjonen. Dosejusteringer er oppført i tabell 2 [se KLINISK FARMAKOLOGI ].
Ingen tilleggsdosering av EPIVIR 150 mg er nødvendig etter rutinemessig (4-timers) hemodialyse eller peritonealdialyse.
Selv om det ikke er tilstrekkelige data til å anbefale en spesifikk dosejustering av EPIVIR hos pediatriske pasienter med nedsatt nyrefunksjon, bør en reduksjon i dosen og/eller en økning i doseringsintervallet vurderes.
HVORDAN LEVERES
Doseringsformer og styrker
EPIVIR-scorede tabletter
EPIVIR tabletter med skår inneholder 150 mg lamivudin. Tablettene er hvite, diamantformede, filmdrasjerte tabletter med delestreker merket med "GX CJ7" på begge sider.
EPIVIR-nettbrett
EPIVIR tabletter inneholder 300 mg lamivudin. Tablettene er grå, modifiserte diamantformede, filmdrasjerte og merket med "GX EJ7" på den ene siden og ensfarget på baksiden.
EPIVIR oral løsning
EPIVIR mikstur inneholder 10 mg lamivudin per 1 ml. Løsningen er en klar, fargeløs til blekgul væske med jordbær-banan-smak.
Oppbevaring og håndtering
EPIVIR tabletter med skårede deler inneholder 150 mg lamivudin, er hvite, diamantformede, filmdrasjerte og merket med "GX CJ7" på begge sider. Pakket som følger:
Flaske med 60 tabletter ( NDC 49702-203-18) med barnesikker lukking.
EPIVIR tabletter inneholder 300 mg lamivudin, er grå, modifiserte diamantformede, filmdrasjerte og merket med "GX EJ7" på den ene siden og ensfarget på baksiden. Pakket som følger:
Flaske med 30 tabletter ( NDC 49702-204-13) med barnesikker lukking.
Anbefalt lagring
Oppbevar EPIVIR-tabletter ved 25°C (77°F); utflukter tillatt til 15° til 30°C (59° til 86°F) [se USP kontrollert romtemperatur ].
EPIVIR mikstur er en klar, fargeløs til blekgul væske med jordbær-banan-smak. Hver ml av oppløsningen inneholder 10 mg lamivudin. Pakket som følger:
Plastflaske på 240 mL (NDC 49702-205-48) med barnesikker lukking. Dette produktet krever ikke rekonstituering.
Oppbevares i tett lukkede flasker ved 25°C (77°F) [se USP kontrollert romtemperatur ].
Produsert for: ViiV Healthcare Research Triangle Park, NC 27709. av: GlaxoSmithKline Research Triangle Park, NC 27709, Produsert under avtale fra Shire Pharmaceuticals Group plc. Revidert: april 2018
BIVIRKNINGER
Følgende bivirkninger er omtalt i andre deler av merkingen:
- . Forverring av hepatitt B [se ADVARSEL i boks , ADVARSLER OG FORHOLDSREGLER ]. . Laktacidose og alvorlig hepatomegali med steatose [se ADVARSLER OG FORHOLDSREGLER ]. . Leverdekompensasjon hos pasienter som samtidig er infisert med HIV-1 og hepatitt C [se ADVARSLER OG FORHOLDSREGLER ]. . Pankreatitt [se ADVARSLER OG FORHOLDSREGLER ]. . Immunrekonstitusjonssyndrom [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring fra kliniske forsøk
Erfaring fra kliniske forsøk hos voksne
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel, og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
Sikkerhetsprofilen til EPIVIR 150 mg hos voksne er primært basert på 3 568 HIV-1-infiserte personer i 7 kliniske studier.
De vanligste bivirkningene er hodepine, kvalme, ubehag, tretthet, nasale tegn og symptomer, diaré og hoste.
Utvalgte kliniske bivirkninger hos mer enn eller lik 5 % av pasientene under behandling med EPIVIR 150 mg to ganger daglig pluss RETROVIR 200 mg 3 ganger daglig i opptil 24 uker er oppført i tabell 3.
Pankreatitt
Pankreatitt ble observert hos 9 av 2613 voksne personer (0,3 %) som fikk EPIVIR 150 mg i kontrollerte kliniske studier EPV20001, NUCA3001, NUCB3001, NUCA3002, NUCB3002 og NUCB3007 [se ADVARSLER OG FORHOLDSREGLER ].
EPIVIR 300 mg én gang daglig
Typer og frekvenser av kliniske bivirkninger rapportert hos personer som fikk EPIVIR 300 mg én gang daglig eller EPIVIR 150 mg to ganger daglig (i 3-medisinske kombinasjonsregimer i EPV20001 og EPV40001) i 48 uker var like.
Utvalgte laboratorieavvik observert under behandlingen er oppsummert i tabell 4.
Frekvensen av utvalgte laboratorieavvik rapportert hos forsøkspersoner som fikk EPIVIR 300 mg én gang daglig eller EPIVIR 150 mg to ganger daglig (i 3-legemiddelkombinasjonsregimer i EPV20001 og EPV40001) var like.
Erfaring fra kliniske studier i pediatriske emner
EPIVIR mikstur er studert hos 638 pediatriske personer i alderen 3 måneder til 18 år i 3 kliniske studier.
Utvalgte kliniske bivirkninger og fysiske funn med en frekvens på over eller lik 5 % under behandling med EPIVIR 4 mg per kg to ganger daglig pluss RETROVIR 160 mg per m² 3 ganger daglig i behandlingsnaiv (mindre enn eller lik 56 dager med antiretroviralt middel terapi) pediatriske emner er oppført i tabell 5.
Pankreatitt
Pankreatitt, som i noen tilfeller har vært dødelig, har blitt observert hos antiretrovirale nukleosid-erfarne pediatriske personer som får EPIVIR alene eller i kombinasjon med andre antiretrovirale midler. I en åpen doseøkningsstudie (NUCA2002) utviklet 14 personer (14%) pankreatitt mens de fikk monoterapi med EPIVIR. Tre av disse forsøkspersonene døde av komplikasjoner av pankreatitt. I en andre åpen studie (NUCA2005) utviklet 12 personer (18%) pankreatitt. I studien ACTG300 ble ikke pankreatitt observert hos 236 forsøkspersoner randomisert til EPIVIR 150 mg pluss RETROVIR. Pankreatitt ble observert hos 1 individ i denne studien som fikk åpen EPIVIR i kombinasjon med RETROVIR og ritonavir etter seponering av didanosin monoterapi [se ADVARSLER OG FORHOLDSREGLER ].
Parestesier og perifere nevropatier
Parestesier og perifere nevropatier ble rapportert hos 15 forsøkspersoner (15 %) i prøve NUCA2002, 6 forsøkspersoner (9 %) i prøve NUCA2005 og 2 forsøkspersoner (mindre enn 1 %) i prøve ACTG300.
Utvalgte laboratorieavvik som oppleves av terapi-naive (mindre enn eller lik 56 dager med antiretroviral terapi) pediatriske personer er oppført i tabell 6.
Pediatriske forsøkspersoner én gang daglig versus dosering to ganger daglig (COL105677)
Sikkerheten ved dosering én gang daglig sammenlignet med to ganger daglig dosering av EPIVIR 150 mg ble vurdert i ARROW-studien. Primær sikkerhetsvurdering i ARROW-studien var basert på grad 3 og grad 4 bivirkninger. Frekvensen av grad 3 og 4 bivirkninger var lik blant forsøkspersoner randomisert til dosering én gang daglig sammenlignet med forsøkspersoner randomisert til dosering to ganger daglig. Én hendelse av grad 4 hepatitt i kohorten én gang daglig ble ansett som usikker årsakssammenheng av utrederen, og alle andre grad 3 eller 4 bivirkninger ble ansett som ikke relatert av utforskeren.
Nyfødte
Begrenset kortsiktig sikkerhetsinformasjon er tilgjengelig fra 2 små, ukontrollerte studier i Sør-Afrika med nyfødte som får lamivudin med eller uten zidovudin den første uken av livet etter morsbehandling som starter ved uke 38 eller 36 av svangerskapet [se KLINISK FARMAKOLOGI ]. Utvalgte bivirkninger rapportert hos disse nyfødte inkluderte økte leverfunksjonstester, anemi, diaré, elektrolyttforstyrrelser, hypoglykemi, gulsott og hepatomegali, utslett, luftveisinfeksjoner og sepsis; 3 nyfødte døde (1 av gastroenteritt med acidose og kramper, 1 av traumatisk skade og 1 av ukjente årsaker). To andre tilfeller av ikke-dødelig gastroenteritt eller diaré ble rapportert, inkludert 1 med kramper; 1 spedbarn hadde forbigående nyreinsuffisiens assosiert med dehydrering. Fraværet av kontrollgrupper begrenser vurderinger av årsakssammenheng, men det bør antas at perinatalt eksponerte spedbarn kan ha risiko for bivirkninger som kan sammenlignes med dem som er rapportert hos pediatriske og voksne HIV-1-infiserte pasienter behandlet med kombinasjonsregimer som inneholder lamivudin. Langtidseffekter av eksponering for lamivudin in utero og spedbarn er ikke kjent.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av EPIVIR etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av ukjent størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering. Disse reaksjonene er valgt for inkludering på grunn av en kombinasjon av alvorlighetsgrad, rapporteringsfrekvens eller potensiell årsakssammenheng med lamivudin.
Kroppen som en helhet
Omfordeling/akkumulering av kroppsfett.
Endokrine og metabolske
Hyperglykemi.
Generell
Svakhet. Hemisk og lymfatisk anemi (inkludert ren rødcelleaplasi og alvorlig anemi som utvikler seg under behandling).
Hepatisk og bukspyttkjertel
Laktacidose og hepatisk steatose [se ADVARSLER OG FORHOLDSREGLER ], eksacerbasjoner av hepatitt B etter behandling [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhet
Anafylaksi, urticaria.
Muskuloskeletal
Muskelsvakhet, CPK-økning, rabdomyolyse. Hud Alopecia, kløe.
NARKOTIKAHANDEL
Legemidler som hemmer organiske kationtransportører
Lamivudin elimineres hovedsakelig i urinen ved aktiv organisk kationisk sekresjon. Muligheten for interaksjoner med andre legemidler administrert samtidig bør vurderes, spesielt når deres viktigste eliminasjonsvei er aktiv nyresekresjon via det organiske kationiske transportsystemet (f.eks. trimetoprim) [se KLINISK FARMAKOLOGI ]. Ingen data er tilgjengelig angående interaksjoner med andre legemidler som har renale clearance-mekanismer som ligner på lamivudin.
Sorbitol
Samtidig administrering av enkeltdoser av lamivudin og sorbitol resulterte i en sorbitol doseavhengig reduksjon i eksponeringen for lamivudin. Når det er mulig, unngå bruk av sorbitolholdige legemidler sammen med lamivudin [se ADVARSLER OG FORHOLDSREGLER , KLINISK FARMAKOLOGI ].
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Pasienter med samtidig infeksjon med hepatitt B-virus
Etterbehandlingsforverring av hepatitt
Kliniske og laboratoriemessige bevis på forverring av hepatitt har forekommet etter seponering av lamivudin. Disse forverringene er først og fremst blitt oppdaget ved økte ALAT i serum i tillegg til gjenoppkomst av HBV-DNA. Selv om de fleste hendelsene ser ut til å ha vært selvbegrensende, har dødsfall blitt rapportert i noen tilfeller. Lignende hendelser er rapportert etter markedsføring etter endringer fra lamivudinholdige HIV-1 behandlingsregimer til ikke-lamivudinholdige regimer hos pasienter infisert med både HIV-1 og HBV. Årsakssammenhengen til seponering av lamivudinbehandling er ukjent. Pasienter bør overvåkes nøye med både klinisk og laboratorieoppfølging i minst flere måneder etter avsluttet behandling.
Viktige forskjeller mellom produkter som inneholder lamivudin
EPIVIR 150mg tabletter og mikstur inneholder en høyere dose av samme aktive ingrediens (lamivudin) enn EPIVIR-HBV tabletter og EPIVIR-HBV mikstur. EPIVIR-HBV ble utviklet for pasienter med kronisk hepatitt B. Formuleringen og doseringen av lamivudin i EPIVIR-HBV er ikke egnet for pasienter som samtidig er infisert med HIV-1 og HBV. Sikkerhet og effekt av lamivudin er ikke fastslått for behandling av kronisk hepatitt B hos pasienter som samtidig er infisert med HIV-1 og HBV. Hvis behandling med EPIVIR-HBV foreskrives for kronisk hepatitt B til en pasient med ukjent eller ubehandlet HIV-1-infeksjon, vil det sannsynligvis oppstå rask oppkomst av HIV-1-resistens på grunn av den subterapeutiske dosen og upassende HIV-1-behandling med monoterapi. Hvis det tas en beslutning om å administrere lamivudin til pasienter som samtidig er infisert med HIV-1 og HBV, bør EPIVIR 150 mg tabletter, EPIVIR 150 mg mikstur, eller et annet produkt som inneholder den høyere dosen lamivudin brukes som en del av et passende kombinasjonsregime.
Fremvekst av Lamivudin-resistent HBV
Sikkerhet og effekt av lamivudin er ikke fastslått for behandling av kronisk hepatitt B hos personer som er dobbeltinfisert med HIV-1 og HBV (se fullstendig forskrivningsinformasjon for EPIVIR-HBV). Fremveksten av hepatitt B-virusvarianter assosiert med resistens mot lamivudin har også blitt rapportert hos HIV-1-infiserte personer som har fått lamivudinholdige antiretrovirale regimer i nærvær av samtidig infeksjon med hepatitt B-virus.
Melkesyreacidose og alvorlig hepatomegali med Steatose
Laktacidose og alvorlig hepatomegali med steatose, inkludert fatale tilfeller, er rapportert ved bruk av nukleosidanaloger, inkludert EPIVIR. Et flertall av disse tilfellene har vært hos kvinner. Kvinnelig kjønn og fedme kan være risikofaktorer for utvikling av laktacidose og alvorlig hepatomegali med steatose hos pasienter behandlet med antiretrovirale nukleosidanaloger. Behandling med EPIVIR bør avbrytes hos enhver pasient som utvikler kliniske funn eller laboratoriefunn som tyder på laktacidose eller uttalt levertoksisitet, som kan inkludere hepatomegali og steatose selv i fravær av markerte transaminaseøkninger.
Bruk med interferon-og ribavirin-baserte regimer
In vitro-studier har vist at ribavirin kan redusere fosforyleringen av pyrimidinnukleosidanaloger som lamivudin. Selv om ingen tegn på en farmakokinetisk eller farmakodynamisk interaksjon (f.eks. tap av HIV-1/HCV virologisk undertrykkelse) ble sett når ribavirin ble administrert samtidig med lamivudin hos HIV-1/HCV co-infiserte pasienter [se KLINISK FARMAKOLOGI ], leverdekompensasjon (noen dødelig) har forekommet hos HIV-1/HCV-infiserte pasienter som får antiretroviral kombinasjonsbehandling for HIV-1 og interferon alfa med eller uten ribavirin. Pasienter som får interferon alfa med eller uten ribavirin og EPIVIR bør overvåkes nøye for behandlingsassosierte toksisiteter, spesielt leverdekompensasjon. Seponering av EPIVIR 150 mg bør anses som medisinsk hensiktsmessig. Dosereduksjon eller seponering av interferon alfa, ribavirin eller begge bør også vurderes hvis forverrede kliniske toksisiteter observeres, inkludert leverdekompensasjon (f.eks. Child-Pugh større enn 6). Se den fullstendige forskrivningsinformasjonen for interferon og ribavirin.
Pankreatitt
Hos pediatriske pasienter med tidligere antiretroviral nukleosideksponering, en historie med pankreatitt eller andre signifikante risikofaktorer for utvikling av pankreatitt, bør EPIVIR 150 mg brukes med forsiktighet. Behandling med EPIVIR 150 mg bør avbrytes umiddelbart hvis det oppstår kliniske tegn, symptomer eller laboratorieavvik som tyder på pankreatitt [se BIVIRKNINGER ].
Immunrekonstitusjonssyndrom
Immunrekonstitusjonssyndrom er rapportert hos pasienter behandlet med antiretroviral kombinasjonsterapi, inkludert EPIVIR. Under den innledende fasen av antiretroviral kombinasjonsbehandling kan pasienter hvis immunsystem reagerer utvikle en inflammatorisk respons på indolente eller gjenværende opportunistiske infeksjoner (som Mycobacterium avium-infeksjon, cytomegalovirus, Pneumocystis jirovecii pneumoni [PCP] eller tuberkulose), noe som kan nødvendiggjøre ytterligere evaluering og behandling.
Autoimmune lidelser (som Graves' sykdom, polymyositt og Guillain-Barré syndrom) har også blitt rapportert å forekomme i forbindelse med immunrekonstitusjon, men tiden til debut er mer varierende, og kan forekomme mange måneder etter oppstart av behandling.
Lavere virologisk undertrykkelse og økt risiko for virusresistens med oral løsning
Pediatriske personer som mottok EPIVIR 150 mg mikstur (med vektbåndbaserte doser på omtrent 8 mg per kg per dag) samtidig med andre antiretrovirale mikstur, til enhver tid i ARROW-studien, hadde lavere forekomst av virologisk undertrykkelse, lavere plasmaeksponering av lamivudin og utviklet viral resistens oftere enn de som får EPIVIR-tabletter [se KLINISK FARMAKOLOGI , Mikrobiologi , Kliniske studier ].
EPIVIR-tablet med skår er den foretrukne formuleringen for HIV-1-infiserte pediatriske pasienter som veier minst 14 kg og for hvem en fast doseringsform er passende. Et kur med alle tabletter bør brukes når det er mulig for å unngå en potensiell interaksjon med sorbitol [se KLINISK FARMAKOLOGI ]. Vurder hyppigere overvåking av HIV-1 viral mengde ved behandling med EPIVIR 150 mg mikstur.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen (pasientinformasjon).
Pasienter med hepatitt B eller C samtidig infeksjon
Informer pasienter som samtidig er infisert med HIV-1 og HBV om at forverring av leversykdom har oppstått i noen tilfeller når behandling med lamivudin ble avbrutt. Råd pasientene til å diskutere eventuelle endringer i diett med helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Informer pasienter med HIV-1/HCV samtidig infeksjon om at leverdekompensasjon (noen dødelig) har oppstått hos HIV-1/HCV samtidig infeksjon pasienter som får antiretroviral kombinasjonsbehandling for HIV-1 og interferon alfa med eller uten ribavirin [se ADVARSLER OG FORHOLDSREGLER ].
Forskjeller i formuleringer av EPIVIR
Informer pasienter om at EPIVIR 150 mg tabletter og mikstur inneholder en høyere dose av samme aktive ingrediens (lamivudin) som EPIVIR-HBV tabletter og mikstur. Hvis det tas en beslutning om å inkludere lamivudin i HIV-1 behandlingsregimet til en pasient som samtidig er infisert med HIV-1 og HBV, bør formuleringen og doseringen av lamivudin i EPIVIR (ikke EPIVIR-HBV) brukes [se ADVARSLER OG FORHOLDSREGLER ].
Melkesyreacidose/hepatomegali med Steatose
Informer pasienter om at laktacidose og alvorlig hepatomegali med steatose er rapportert ved bruk av nukleosidanaloger og andre antiretrovirale midler. Råd pasienter til å slutte å ta EPIVIR hvis de utvikler kliniske symptomer som tyder på laktacidose eller uttalt levertoksisitet [se ADVARSLER OG FORHOLDSREGLER ].
Risiko for pankreatitt
Råd foreldre eller foresatte om å overvåke pediatriske pasienter for tegn og symptomer på pankreatitt [se ADVARSLER OG FORHOLDSREGLER ].
Immunrekonstitusjonssyndrom
Råd pasientene til å informere helsepersonell umiddelbart om tegn og symptomer på infeksjon, da betennelse fra tidligere infeksjon kan oppstå like etter antiretroviral kombinasjonsbehandling, inkludert når EPIVIR startes [se ADVARSLER OG FORHOLDSREGLER ].
Lavere virologisk undertrykkelse og økt risiko for virusresistens med oral løsning
Informer pasienter om at et kur med kun tabletter bør brukes når det er mulig på grunn av økt frekvens av behandlingssvikt blant pediatriske personer som fikk EPIVIR mikstur samtidig med andre antiretrovirale mikstur [se ADVARSLER OG FORHOLDSREGLER ].
Sukroseinnhold i EPIVIR oral oppløsning
Informer diabetespasienter om at hver 15 ml dose av EPIVIR mikstur inneholder 3 gram sukrose (1 ml = 200 mg sukrose) [se BESKRIVELSE ].
Svangerskapsregisteret
Gi pasienter beskjed om at det finnes et eksponeringsregister for graviditet som overvåker graviditetsutfall hos kvinner eksponert for EPIVIR under graviditet [se Bruk i spesifikke populasjoner ].
Amming
Instruer kvinner med HIV-1-infeksjon om ikke å amme fordi HIV-1 kan overføres til barnet i morsmelk [se Bruk i spesifikke populasjoner ].
Tapt dosering
Instruer pasienter om at hvis de glemmer en dose EPIVIR 150 mg, skal de ta den så snart de husker det. Råd pasientene til å ikke doble sin neste dose eller ta mer enn den foreskrevne dosen [se DOSERING OG ADMINISTRASJON ].
EPIVIR og RETROVIR er varemerker eid av eller lisensiert til ViiV Healthcare-gruppen av selskaper.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Langtidskarsinogenitetsstudier med lamivudin hos mus og rotter viste ingen tegn på karsinogent potensial ved eksponeringer opptil 10 ganger (mus) og 58 ganger (rotter) eksponeringen hos mennesker ved anbefalt dose på 300 mg.
Mutagenese
Lamivudin var mutagent i en L5178Y muselymfomanalyse og klastogen i en cytogenetisk analyse med dyrkede humane lymfocytter. Lamivudin var ikke mutagent i en mikrobiell mutagenitetsanalyse, i en in vitro celletransformasjonsanalyse, i en mikronukleustest hos rotter, i en cytogenetisk analyse av benmarg hos rotter og i en analyse for ikke-planlagt DNA-syntese i rottelever. Lamivudin viste ingen tegn på in vivo genotoksisk aktivitet hos rotter ved orale doser på opptil 2000 mg per kg, og ga plasmanivåer på 35 til 45 ganger høyere enn hos mennesker ved anbefalt dose for HIV-1-infeksjon.
Nedsatt fruktbarhet
I en studie av reproduksjonsevne, avslørte lamivudin administrert til rotter i doser på opptil 4000 mg per kg per dag, som ga plasmanivåer 47 til 70 ganger høyere enn hos mennesker, ingen tegn på nedsatt fertilitet og ingen effekt på overlevelse, vekst og utvikling til avvenning av avkommet.
Bruk i spesifikke populasjoner
Svangerskap
Eksponeringsregister for graviditet
Det finnes et graviditetseksponeringsregister som overvåker graviditetsutfall hos kvinner eksponert for EPIVIR under graviditet. Helsepersonell oppfordres til å registrere pasienter ved å ringe Antiretroviral Pregnancy Registry (APR) på 1-800-258-4263.
Risikosammendrag
Tilgjengelige data fra APR viser ingen forskjell i den totale risikoen for fødselsdefekter for lamivudin sammenlignet med bakgrunnsraten for fødselsskader på 2,7 % i referansepopulasjonen Metropolitan Atlanta Congenital Defects Program (MACDP) (se Data ). APR bruker MACDP som USAs referansepopulasjon for fødselsskader i den generelle befolkningen. MACDP evaluerer kvinner og spedbarn fra et begrenset geografisk område og inkluderer ikke utfall for fødsler som skjedde ved mindre enn 20 ukers svangerskap. Frekvensen av spontanabort er ikke rapportert i APR. Den estimerte bakgrunnsraten for spontanabort i klinisk anerkjente svangerskap i den generelle befolkningen i USA er 15 % til 20 %. Bakgrunnsrisikoen for store fødselsskader og spontanabort for den angitte befolkningen er ukjent.
I reproduksjonsstudier på dyr resulterte oral administrering av lamivudin til drektige kaniner under organogenese i embryodødelighet ved systemisk eksponering (AUC) tilsvarende anbefalt klinisk dose; Det ble imidlertid ikke observert uønskede utviklingseffekter ved oral administrering av lamivudin til drektige rotter under organogenese ved plasmakonsentrasjoner (Cmax) 35 ganger anbefalt klinisk dose (se Data ).
Data
Menneskelige data
Basert på prospektive rapporter til APR av over 11 000 eksponeringer for lamivudin under svangerskapet som resulterte i levendefødte (inkludert over 4500 eksponerte i første trimester), var det ingen forskjell mellom den totale risikoen for fødselsdefekter for lamivudin sammenlignet med fødselsdefektraten i bakgrunnen på 2,7 % i den amerikanske referansepopulasjonen i MACDP. Prevalensen av defekter hos levendefødte var 3,1 % (95 % KI: 2,6 % til 3,6 %) etter eksponering i første trimester for regimer som inneholder lamivudin og 2,8 % (95 % KI: 2,5 % til 3,3 %) etter eksponering i andre/tredje trimester til regimer som inneholder lamivudin.
Lamivudins farmakokinetikk ble studert hos gravide kvinner under 2 kliniske studier utført i Sør-Afrika. Forsøkene vurderte farmakokinetikken hos 16 kvinner ved 36 ukers svangerskap som brukte 150 mg lamivudin to ganger daglig med zidovudin, 10 kvinner ved 38 ukers svangerskap ved bruk av 150 mg lamivudin to ganger daglig med zidovudin, og 10 kvinner ved 38 ukers mg to ganger i svangerskapet 300. daglig uten andre antiretrovirale midler. Disse forsøkene ble ikke designet eller drevet for å gi informasjon om effekt. Lamivudinkonsentrasjoner var generelt like i serumprøver hos mor, neonatale og navlestreng. Hos en undergruppe av forsøkspersoner ble fostervannsprøver tatt etter naturlig brudd på membraner og bekreftet at lamivudin krysser placenta hos mennesker. Basert på begrensede data ved fødsel var median (område) fostervannskonsentrasjoner av lamivudin 3,9 (1,2 til 12,8) ganger høyere sammenlignet med paret maternal serumkonsentrasjon (n = 8).
Dyredata
Lamivudin ble administrert oralt til gravide rotter (90, 600 og 4000 mg per kg per dag) og kaniner (ved 90, 300 og 1000 mg per kg per dag og med 15, 40 og 90 mg per kg per dag) under organogenese (på drektighetsdagene 7 til 16 [rotte] og 8 til 20 [kanin]). Ingen tegn på føtale misdannelser på grunn av lamivudin ble observert hos rotter og kaniner ved doser som ga plasmakonsentrasjoner (Cmax) ca. 35 ganger høyere enn human eksponering ved anbefalt daglig dose. Bevis for tidlig embryodødelighet ble sett hos kanin ved systemeksponeringer (AUC) tilsvarende de som ble observert hos mennesker, men det var ingen indikasjon på denne effekten hos rotter ved plasmakonsentrasjoner (Cmax) 35 ganger høyere enn menneskelig eksponering ved anbefalt daglig dose . Studier på drektige rotter viste at lamivudin overføres til fosteret gjennom placenta. I fertilitets-/pre- og postnatal utviklingsstudie på rotter ble lamivudin administrert oralt i doser på 180, 900 og 4000 mg per kg per dag (fra før paring til postnatal dag 20). I studien ble ikke utviklingen av avkommet, inkludert fertilitet og reproduksjonsevne, påvirket av maternal administrering av lamivudin.
Amming
Risikosammendrag
Centers for Disease Control and Prevention anbefaler at HIV-1-infiserte mødre i USA ikke ammer sine spedbarn for å unngå å risikere postnatal overføring av HIV-1-infeksjon. Lamivudin finnes i morsmelk. Det er ingen informasjon om effekten av lamivudin på spedbarnet som ammes eller effekten av legemidlene på melkeproduksjonen. På grunn av potensialet for (1) HIV-1-overføring (hos HIV-negative spedbarn), (2) utvikling av virusresistens (hos HIV-positive spedbarn), og (3) bivirkninger hos et spedbarn som ammes, instruer mødre om ikke å amme hvis de mottar EPIVIR.
Pediatrisk bruk
Sikkerheten og effektiviteten til EPIVIR 150 mg i kombinasjon med andre antiretrovirale midler er fastslått hos pediatriske pasienter i alderen 3 måneder og eldre. EPIVIR skåret tablett er den foretrukne formuleringen for HIV-1-infiserte pediatriske pasienter som veier minst 14 kg og for hvem en fast doseringsform er passende fordi pediatriske forsøkspersoner som fikk EPIVIR 150 mg mikstur, hadde lavere forekomst av virologisk suppresjon, lavere plasmaeksponering av lamivudin , og utviklet virusresistens oftere enn de som fikk EPIVIR 150 mg tabletter i ARROW-studien [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER , KLINISK FARMAKOLOGI , Kliniske studier ].
Geriatrisk bruk
Kliniske studier av EPIVIR inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Generelt bør det utvises forsiktighet ved administrering av EPIVIR hos eldre pasienter, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ].
Pasienter med nedsatt nyrefunksjon
Reduksjon av dosen av EPIVIR 150 mg anbefales for pasienter med nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ].
OVERDOSE
Det er ingen kjent spesifikk behandling for overdosering med EPIVIR. Hvis overdosering oppstår, bør pasienten overvåkes og standard støttende behandling brukes etter behov. Fordi en ubetydelig mengde lamivudin ble fjernet via (4-timers) hemodialyse, kontinuerlig ambulatorisk peritonealdialyse og automatisert peritonealdialyse, er det ikke kjent om kontinuerlig hemodialyse ville gi klinisk fordel ved en lamivudinoverdosehendelse.
KONTRAINDIKASJONER
EPIVIR 150 mg er kontraindisert hos pasienter med en tidligere overfølsomhetsreaksjon overfor lamivudin.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Lamivudin er et antiretroviralt middel [se Mikrobiologi ].
Farmakokinetikk
Farmakokinetikk hos voksne
De farmakokinetiske egenskapene til lamivudin er studert hos asymptomatiske, HIV-1-infiserte voksne personer etter administrering av enkeltstående intravenøse (IV) doser fra 0,25 til 8 mg per kg, samt enkelt- og multiple (to ganger daglig) orale doser. varierer fra 0,25 til 10 mg per kg.
De farmakokinetiske egenskapene til lamivudin har også blitt studert som enkelt- og multiple orale doser fra 5 mg til 600 mg per dag administrert til HBV-infiserte personer.
De farmakokinetiske steady-state egenskapene til EPIVIR 300 mg tabletten én gang daglig i 7 dager sammenlignet med EPIVIR 150 mg tabletten to ganger daglig i 7 dager ble vurdert i en crossover-studie med 60 friske personer. EPIVIR 300 mg én gang daglig resulterte i lamivudineksponeringer som var lik EPIVIR 150 mg to ganger daglig med hensyn til plasma AUC24,ss; Cmax,ss var imidlertid 66 % høyere og bunnverdien var 53 % lavere sammenlignet med 150 mg to ganger daglig. Intracellulær lamivudintrifosfateksponering i perifere mononukleære blodceller var også lik med hensyn til AUC24,ss og Cmax24,ss; bunnverdiene var imidlertid lavere sammenlignet med regimet med 150 mg to ganger daglig. Variabiliteten mellom individene var større for intracellulære lamivudintrifosfatkonsentrasjoner versus bunnkonsentrasjoner av lamivudin.
Farmakokinetikken til lamivudin ble evaluert hos 12 voksne HIV-1-infiserte personer doseret med lamivudin 150 mg to ganger daglig i kombinasjon med andre antiretrovirale midler. Det geometriske gjennomsnittet (95 % KI) for AUC(0-12) var 5,53 (4,58, 6,67) mcg.t per ml og for Cmax var 1,40 (1,17, 1,69) mcg per ml.
Absorpsjon og biotilgjengelighet
Absolutt biotilgjengelighet hos 12 voksne personer var 86 % ± 16 % (gjennomsnittlig ± SD) for 150 mg tabletten og 87 % ± 13 % for mikstur. Etter oral administrering av 2 mg per kg to ganger daglig til 9 voksne med HIV-1, var maksimal serumkonsentrasjon av lamivudin (Cmax) 1,5 ± 0,5 mcg per ml (gjennomsnitt ± SD). Arealet under kurven for plasmakonsentrasjon versus tid (AUC) og Cmax økte proporsjonalt med oral dose i området fra 0,25 til 10 mg per kg.
Akkumuleringsraten for lamivudin hos HIV-1-positive asymptomatiske voksne med normal nyrefunksjon var 1,50 etter 15 dagers oral administrering av 2 mg per kg to ganger daglig.
Effekter av mat på oral absorpsjon
EPIVIR 150 mg tabletter og mikstur kan administreres med eller uten mat. En undersøkelsesdose på 25 mg av lamivudin ble administrert oralt til 12 asymptomatiske, HIV-1-infiserte personer ved 2 anledninger, én gang i fastende tilstand og én gang med mat (1 099 kcal; 75 gram fett, 34 gram protein, 72 gram karbohydrater ). Absorpsjon av lamivudin var langsommere i matet tilstand (Tmaks: 3,2 ± 1,3 timer) sammenlignet med fastende (Tmaks: 0,9 ± 0,3 timer); Cmax i matet tilstand var 40 % ± 23 % (gjennomsnitt ± SD) lavere enn i fastende tilstand. Det var ingen signifikant forskjell i systemisk eksponering (AUC∞) i matet og fastende tilstand.
Fordeling
Det tilsynelatende distribusjonsvolumet etter IV administrering av lamivudin til 20 personer var 1,3 ± 0,4 L per kg, noe som tyder på at lamivudin fordeler seg i ekstravaskulære rom. Distribusjonsvolumet var uavhengig av dose og korrelerte ikke med kroppsvekt.
Binding av lamivudin til humane plasmaproteiner er mindre enn 36 %. In vitro-studier viste at over konsentrasjonsområdet 0,1 til 100 mcg per ml, varierte mengden lamivudin assosiert med erytrocytter fra 53 % til 57 % og var uavhengig av konsentrasjonen.
Metabolisme
Metabolisme av lamivudin er en mindre eliminasjonsvei. Hos mennesker er den eneste kjente metabolitten av lamivudin transsulfoksidmetabolitten (omtrent 5 % av en oral dose etter 12 timer). Serumkonsentrasjoner av denne metabolitten er ikke bestemt. Lamivudin metaboliseres ikke signifikant av cytokrom P450-enzymer.
Eliminering
Størstedelen av lamivudin elimineres uendret i urinen ved aktiv organisk kationisk sekresjon. Hos 9 friske personer som fikk en enkelt 300 mg oral dose lamivudin, var renal clearance 199,7 ± 56,9 ml per min (gjennomsnitt ± SD). Hos 20 HIV-1-infiserte personer som fikk en enkelt IV-dose, var renal clearance 280,4 ± 75,2 ml per min (gjennomsnitt ± SD), som representerer 71 % ± 16 % (gjennomsnitt ± SD) av total clearance av lamivudin.
I de fleste enkeltdosestudier med HIV-1-infiserte personer, HBV-infiserte personer eller friske personer med serumprøvetaking i 24 timer etter dosering, varierte den observerte gjennomsnittlige eliminasjonshalveringstiden (t½) fra 5 til 7 timer. Hos HIV-1-infiserte personer var total clearance 398,5 ± 69,1 ml per min (gjennomsnitt ± SD). Oral clearance og eliminasjonshalveringstid var uavhengig av dose og kroppsvekt over et oralt doseringsområde på 0,25 til 10 mg per kg.
Spesifikke populasjoner
Pasienter med nedsatt nyrefunksjon
De farmakokinetiske egenskapene til lamivudin er bestemt hos en liten gruppe HIV-1-infiserte voksne med nedsatt nyrefunksjon (tabell 7).
Tmax ble ikke signifikant påvirket av nyrefunksjonen. Basert på disse observasjonene anbefales det at dosen av lamivudin endres hos pasienter med nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON ].
Basert på en studie med ellers friske personer med nedsatt nyrefunksjon, økte hemodialyse lamivudinclearance fra gjennomsnittlig 64 til 88 ml per min; varigheten av hemodialyse (4 timer) var imidlertid utilstrekkelig til å signifikant endre gjennomsnittlig lamivudineksponering etter en enkeltdoseadministrasjon. Kontinuerlig ambulatorisk peritonealdialyse og automatisert peritonealdialyse har ubetydelig effekt på lamivudinclearance. Derfor anbefales det, etter korrigering av dosen for kreatininclearance, at ingen ytterligere doseendring foretas etter rutinemessig hemodialyse eller peritonealdialyse.
Effekten av nedsatt nyrefunksjon på lamivudins farmakokinetikk hos pediatriske pasienter er ikke kjent.
Pasienter med nedsatt leverfunksjon
De farmakokinetiske egenskapene til lamivudin er bestemt hos voksne med nedsatt leverfunksjon. Farmakokinetiske parametere ble ikke endret av nedsatt leverfunksjon. Sikkerhet og effekt av lamivudin er ikke fastslått ved dekompensert leversykdom.
Gravide kvinner
Lamivudins farmakokinetikk ble studert hos 36 gravide kvinner under 2 kliniske studier utført i Sør-Afrika. Lamivudins farmakokinetikk hos gravide kvinner var lik den som ble sett hos ikke-gravide voksne og hos kvinner etter fødsel. Lamivudinkonsentrasjoner var generelt like i serumprøver hos mor, neonatale og navlestreng.
Pediatriske pasienter
Farmakokinetikken til lamivudin er studert etter enten enkeltdoser eller gjentatte doser av EPIVIR hos 210 pediatriske personer. Pediatriske personer som fikk lamivudin mikstur (dosert med ca. 8 mg per kg per dag) oppnådde ca. 25 % lavere plasmakonsentrasjoner av lamivudin sammenlignet med HIV-1-infiserte voksne. Pediatriske personer som fikk lamivudin orale tabletter oppnådde plasmakonsentrasjoner som var sammenlignbare med eller litt høyere enn de som ble observert hos voksne. Den absolutte biotilgjengeligheten av både EPIVIR tabletter og mikstur er lavere hos barn enn voksne. Den relative biotilgjengeligheten av EPIVIR mikstur er omtrent 40 % lavere enn tabletter som inneholder lamivudin hos pediatriske personer til tross for ingen forskjell hos voksne. Lavere eksponering for lamivudin hos pediatriske pasienter som får EPIVIR 150 mg mikstur, er sannsynligvis på grunn av interaksjonen mellom lamivudin og samtidige oppløsninger som inneholder sorbitol (som ZIAGEN). Modellering av farmakokinetiske data tyder på å øke dosen av EPIVIR mikstur til 5 mg per kg tatt oralt to ganger daglig eller 10 mg per kg tatt oralt én gang daglig (opptil maksimalt 300 mg daglig) for å oppnå tilstrekkelige konsentrasjoner av lamivudin [se DOSERING OG ADMINISTRASJON ]. Det er ingen kliniske data fra HIV-1-infiserte pediatriske pasienter som administreres samtidig med legemidler som inneholder sorbitol i denne dosen.
Farmakokinetikken til lamivudin dosert én gang daglig hos HIV-1-infiserte pediatriske personer i alderen 3 måneder til 12 år ble evaluert i 3 studier (PENTA-15 [n = 17], PENTA 13 [n = 19] og ARROW PK [n = 35]). Alle 3 studiene var 2-perioders, crossover, åpne farmakokinetiske studier med to ganger versus én gang daglig dosering av abakavir og lamivudin. Disse 3 studiene viste at dosering én gang daglig gir tilsvarende AUC0-24 til to ganger daglig dosering av lamivudin ved samme totale daglige dose når man sammenligner doseringsregimene innenfor samme formulering (dvs. enten den orale oppløsningen eller tablettformuleringen). Gjennomsnittlig Cmax var omtrent 80 % til 90 % høyere med lamivudin én gang daglig sammenlignet med dosering to ganger daglig.
Distribusjon av lamivudin til cerebrospinalvæske (CSF) ble vurdert hos 38 pediatriske personer etter gjentatt oral dosering med lamivudin. CSF-prøver ble samlet inn mellom 2 og 4 timer etter dosering. Ved dosen 8 mg per kg per dag varierte CSF-lamivudinkonsentrasjoner hos 8 personer fra 5,6 % til 30,9 % (gjennomsnittlig ± SD på 14,2 % ± 7,9 %) av konsentrasjonen i en samtidig serumprøve, med CSF-lamivudinkonsentrasjoner fra 0,04 til 0,3 mcg per ml.
Begrensede, ukontrollerte farmakokinetiske og sikkerhetsdata er tilgjengelige fra administrering av lamivudin (og zidovudin) til 36 spedbarn i alderen opptil 1 uke i 2 studier i Sør-Afrika. I disse studiene ble lamivudinclearance betydelig redusert hos 1 uke gamle nyfødte sammenlignet med pediatriske forsøkspersoner (over 3 måneder) studert tidligere. Det er utilstrekkelig informasjon til å fastslå tidsforløpet for endringer i clearance mellom den umiddelbare neonatale perioden og aldersgruppene over 3 måneder gamle [se BIVIRKNINGER ].
Geriatriske pasienter
Farmakokinetikken til lamivudin etter administrering av EPIVIR 150 mg til personer over 65 år har ikke blitt studert [se Bruk i spesifikke populasjoner ].
Mannlige og kvinnelige pasienter
Det er ingen signifikante eller klinisk relevante kjønnsforskjeller i lamivudins farmakokinetikk.
Rasegrupper
Det er ingen signifikante eller klinisk relevante raseforskjeller i lamivudins farmakokinetikk.
Legemiddelinteraksjonsstudier
Effekt av Lamivudin på farmakokinetikken til andre midler
Basert på resultater fra in vitro-studier, forventes ikke lamivudin ved terapeutisk legemiddeleksponering å påvirke farmakokinetikken til legemidler som er substrater for følgende transportører: organisk aniontransportørpolypeptid 1B1/3 (OATP1B1/3), brystkreftresistensprotein (BCRP), P-glykoprotein (P-gp), multimedikament- og toksinekstruderingsprotein 1 (MATE)1, MATE2-K, organisk kationtransportør 1 (OCT)1, OCT2 eller OCT3.
Effekt av andre midler på farmakokinetikken til lamivudin
Lamivudin er et substrat for MATE1, MATE2-K og OCT2 in vitro. Trimetoprim (en hemmer av disse legemiddeltransportørene) har vist seg å øke plasmakonsentrasjonen av lamivudin. Denne interaksjonen anses ikke som klinisk signifikant da det ikke er nødvendig med dosejustering av lamivudin.
Lamivudin er et substrat for P-gp og BCRP; tatt i betraktning dens absolutte biotilgjengelighet (87 %), er det imidlertid lite sannsynlig at disse transportørene spiller en signifikant rolle i absorpsjonen av lamivudin. Derfor er det usannsynlig at samtidig administrering av legemidler som hemmer disse efflukstransportørene vil påvirke disposisjonen og eliminasjonen av lamivudin.
Interferon Alfa
Det var ingen signifikant farmakokinetisk interaksjon mellom lamivudin og interferon alfa i en studie med 19 friske mannlige forsøkspersoner [se ADVARSLER OG FORHOLDSREGLER ].
Ribavirin
In vitro-data indikerer at ribavirin reduserer fosforylering av lamivudin, stavudin og zidovudin. Imidlertid ble ingen farmakokinetisk (f.eks. plasmakonsentrasjoner eller intracellulær trifosforylert aktiv metabolittkonsentrasjon) eller farmakodynamisk (f.eks. tap av HIV-1/HCV virologisk undertrykkelse) interaksjon observert når ribavirin og lamivudin (n = 18), stavudin (n = 10) , eller zidovudin (n = 6) ble administrert samtidig som en del av et multimedikamentregime til HIV-1/HCV-infiserte personer [se ADVARSLER OG FORHOLDSREGLER ].
Sorbitol (hjelpestoff)
Lamivudin og sorbitolløsninger ble administrert samtidig til 16 friske voksne forsøkspersoner i en åpen, randomisert sekvens, 4-perioders, crossover-studie. Hvert individ mottok en enkeltdose på 300 mg lamivudin mikstur alene eller samtidig administrert med en enkeltdose på 3,2 gram, 10,2 gram eller 13,4 gram sorbitol i oppløsning. Samtidig administrering av lamivudin og sorbitol resulterte i doseavhengige reduksjoner på 20 %, 39 % og 44 % i AUC(0-24), 14 %, 32 % og 36 % i AUC(∞), og 28 %, 52 % og 55 % i Cmax; av henholdsvis lamivudin.
Trimetoprim/sulfametoksazol
Lamivudin og TMP/SMX ble administrert samtidig til 14 HIV-1-positive personer i en enkeltsenter, åpen, randomisert, crossover-studie. Hver individ fikk behandling med en enkelt 300 mg dose lamivudin og TMP 160 mg/SMX 800 mg én gang daglig i 5 dager med samtidig administrering av lamivudin 300 mg med den femte dosen i en crossover-design. Samtidig administrering av TMP/SMX med lamivudin resulterte i en økning på 43 % ± 23 % (gjennomsnitt ± SD) i lamivudin AUC∞, en reduksjon på 29 % ± 13 % i lamivudin oral clearance, og en reduksjon på 30 % ± 36 % i lamivudin renal clearance. De farmakokinetiske egenskapene til TMP og SMX ble ikke endret ved samtidig administrering med lamivudin. Det er ingen informasjon om effekten på lamivudins farmakokinetikk av høyere doser av TMP/SMX, slik som de som brukes til behandling av PCP.
Zidovudin
Ingen klinisk signifikante endringer i lamivudin eller zidovudin farmakokinetikk ble observert hos 12 asymptomatiske HIV-1-infiserte voksne personer som fikk en enkeltdose zidovudin (200 mg) i kombinasjon med flere doser lamivudin (300 mg hver 12. time).
Mikrobiologi
Virkningsmekanismen
Lamivudin er en syntetisk nukleosidanalog. Intracellulært blir lamivudin fosforylert til dets aktive 5'-trifosfatmetabolitt, lamivudintrifosfat (3TC-TP). Den viktigste virkemåten til 3TC-TP er hemming av HIV-1 revers transkriptase (RT) via DNA-kjedeterminering etter inkorporering av nukleotidanalogen.
Antiviral aktivitet
Den antivirale aktiviteten til lamivudin mot HIV-1 ble vurdert i en rekke cellelinjer inkludert monocytter og ferske humane perifere blodlymfocytter (PBMC) ved bruk av standard følsomhetsanalyser. EC50-verdier var i området 0,003 til 15 mikroM (1 mikroM = 0,23 mikrogram per ml). Median EC50-verdier for lamivudin var 60 nM (område: 20 til 70 nM), 35 nM (område: 30 til 40 nM), 30 nM (område: 20 til 90 nM), 20 nM (område: 3 til 40 nM) , 30 nM (område: 1 til 60 nM), 30 nM (område: 20 til 70 nM), 30 nM (område: 3 til 70 nM) og 30 nM (område: 20 til 90 nM) mot HIV-1-klader AG- og gruppe O-virus (n = 3 unntatt n = 2 for klasse B). EC50-verdiene mot HIV-2-isolater (n = 4) varierte fra 0,003 til 0,120 mikroM i PBMC-er. Lamivudin var ikke antagonistisk overfor alle testede anti-HIV-midler. Ribavirin (50 mikroM) brukt i behandling av kronisk HCV-infeksjon reduserte anti-HIV-1-aktiviteten til lamivudin med 3,5 ganger i MT-4-celler.
Motstand
Lamivudin-resistente varianter av HIV-1 er blitt selektert i cellekultur. Genotypisk analyse viste at resistensen skyldtes en spesifikk aminosyresubstitusjon i HIV-1 revers transkriptase ved kodon 184 som endret metioninet til enten valin eller isoleucin (M184V/I).
HIV-1-stammer som er resistente mot både lamivudin og zidovudin er blitt isolert fra forsøkspersoner. Kliniske isolaters følsomhet for lamivudin og zidovudin ble overvåket i kontrollerte kliniske studier. Hos personer som fikk lamivudin monoterapi eller kombinasjonsbehandling med lamivudin pluss zidovudin, ble HIV-1-isolater fra de fleste forsøkspersoner fenotypisk og genotypisk resistente mot lamivudin i løpet av 12 uker.
Genotypisk og fenotypisk analyse av HIV-1-isolater under behandling fra personer med virologisk svikt
Prøve EPV20001
53 av 554 (10 %) forsøkspersoner registrert i EPV20001 ble identifisert som virologiske feil (plasma HIV-1 RNA-nivå større enn eller lik 400 kopier per ml) innen uke 48. Tjueåtte forsøkspersoner ble randomisert til lamivudin én gang- daglig behandlingsgruppe og 25 til lamivudin to ganger daglig behandlingsgruppe. Median baseline plasma HIV-1 RNA-nivåer hos forsøkspersoner i gruppen med lamivudin én gang daglig og lamivudin to ganger daglig var henholdsvis 4,9 log10 kopier per ml og 4,6 log10 kopier per ml.
Genotypisk analyse av isolater under behandling fra 22 forsøkspersoner identifisert som virologiske svikt i gruppen lamivudin én gang daglig, viste at isolater fra 8 av 22 forsøkspersoner inneholdt en behandlingsfremkommet lamivudinresistens-assosiert substitusjon (M184V eller M184I), isolater fra 0 av 22 forsøkspersoner inneholdt behandlingsfremkomne aminosyresubstitusjoner assosiert med zidovudinresistens (M41L, D67N, K70R, L210W, T215Y/F eller K219Q/E), og isolater fra 10 av 22 personer inneholdt behandlingsfremkomne aminosyresubstitusjoner assosiert med efavirenzresistens ( L100I, K101E, K103N, V108I eller Y181C).
Genotypisk analyse av isolater under behandling fra forsøkspersoner (n = 22) i lamivudin-behandlingsgruppen to ganger daglig viste at isolater fra 5 av 22 forsøkspersoner inneholdt behandlingsfremkomne lamivudin-resistenssubstitusjoner, isolater fra 1 av 22 forsøkspersoner inneholdt behandlingsfremkommet zidovudinresistens substitusjoner og isolater fra 7 av 22 forsøkspersoner inneholdt behandlingsfremkomne efavirenzresistenssubstitusjoner.
Fenotypisk analyse av baseline-matchede HIV-1-isolater under behandling fra forsøkspersoner (n = 13) som fikk lamivudin én gang daglig, viste at isolater fra 7 av 13 forsøkspersoner viste en 85- til 299 ganger reduksjon i mottakelighet for lamivudin, isolater fra 12 av 13 personer var mottakelige for zidovudin, og isolater fra 8 av 13 personer viste en 25- til 295 ganger reduksjon i følsomhet for efavirenz.
Fenotypisk analyse av baseline-matchede HIV-1-isolater under behandling fra forsøkspersoner (n = 13) som fikk lamivudin to ganger daglig, viste at isolater fra 4 av 13 forsøkspersoner viste en 29- til 159 ganger reduksjon i mottakelighet for lamivudin, isolater fra alle 13. forsøkspersoner var følsomme for zidovudin, og isolater fra 3 av 13 forsøkspersoner viste en 21- til 342 ganger reduksjon i følsomhet for efavirenz.
Prøve EPV40001
Femti forsøkspersoner fikk lamivudin 300 mg én gang daglig pluss zidovudin 300 mg to ganger daglig pluss abakavir 300 mg to ganger daglig og 50 forsøkspersoner fikk lamivudin 150 mg pluss zidovudin 300 mg pluss abakavir 300 mg alle to ganger daglig. Median baseline plasma HIV-1 RNA nivåer for forsøkspersoner i de 2 gruppene var henholdsvis 4,79 log10 kopier per ml og 4,83 log10 kopier per ml. Fjorten av 50 forsøkspersoner i gruppen med lamivudin én gang daglig og 9 av 50 forsøkspersoner i gruppen med lamivudin to ganger daglig ble identifisert som virologisk svikt.
Genotypisk analyse av HIV-1-isolater under behandling fra forsøkspersoner (n = 9) i gruppen med lamivudin én gang daglig, viste at isolater fra 6 forsøkspersoner hadde en abakavir- og/eller lamivudinresistensassosiert substitusjon M184V alene. Isolater under behandling fra forsøkspersoner (n = 6) som fikk lamivudin to ganger daglig, viste at isolater fra 2 individer hadde M184V alene, og isolater fra 2 individer hadde M184V-substitusjonen i kombinasjon med zidovudinresistensassosierte aminosyresubstitusjoner.
Fenotypisk analyse av isolater under behandling fra forsøkspersoner (n = 6) som fikk lamivudin én gang daglig, viste at HIV-1-isolater fra 4 forsøkspersoner viste en 32- til 53 ganger reduksjon i følsomhet for lamivudin. HIV-1-isolater fra disse 6 individene var mottakelige for zidovudin.
Fenotypisk analyse av isolater under behandling fra forsøkspersoner (n = 4) som fikk lamivudin to ganger daglig, viste at HIV-1 isolater fra 1 individ viste en 45 ganger reduksjon i følsomhet for lamivudin og en 4,5 ganger reduksjon i følsomhet for zidovudin.
Pediatri
Pediatriske personer som fikk lamivudin mikstur samtidig med andre antiretrovirale mikstur (abakavir, nevirapin/efavirenz eller zidovudin) i ARROW utviklet virusresistens oftere enn de som fikk tabletter. Ved randomisering til én eller to ganger daglig dosering av EPIVIR pluss abakavir, hadde 13 % av forsøkspersonene som startet på tabletter og 32 % av forsøkspersonene som startet med oppløsning resistenssubstitusjoner. Resistensprofilen som er observert i pediatri er lik den som er observert hos voksne når det gjelder genotypiske substitusjoner som er påvist og relativ frekvens, med de mest påviste substitusjonene ved M184 (V eller I) [se Kliniske studier ].
Kryssmotstand
Kryssresistens er observert blant nukleosid revers transkriptasehemmere (NRTI). Lamivudinresistente HIV-1-mutanter var kryssresistente i cellekultur mot didanosin (ddI). Kryssresistens er også forventet med abakavir og emtricitabin, da disse velger M184V-substitusjoner.
Kliniske studier
Bruken av EPIVIR er basert på resultatene fra kliniske studier med HIV-1-infiserte personer i kombinasjonsregimer med andre antiretrovirale midler. Informasjon fra studier med kliniske endepunkter eller en kombinasjon av CD4+-celletall og HIV-1 RNA-målinger er inkludert nedenfor som dokumentasjon på lamivudins bidrag til et kombinasjonsregime i kontrollerte studier.
Voksne emner
Klinisk endepunktforsøk
NUCB3007 (CAESAR) var en multisenter, dobbeltblind, placebokontrollert studie som sammenlignet fortsatt gjeldende behandling (zidovudin alene [62 % av forsøkspersonene] eller zidovudin med didanosin eller zalcitabin [38 % av forsøkspersonene]) med tillegg av EPIVIR 150mg eller EPIVIR 150 mg pluss en ikke-nukleosid revers transkriptasehemmer (NNRTI) til undersøkelse, randomisert 1:2:1. Totalt 1816 HIV-1-infiserte voksne med 25 til 250 CD4+ celler per mm³ (median = 122 celler per mm³) ved baseline ble registrert: median alder var 36 år, 87% var menn, 84% var nukleosid-erfarne, og 16 % var terapinaive. Median varighet på forsøket var 12 måneder. Resultatene er oppsummert i tabell 9.
Surrogat-endepunktforsøk
Doble nukleosid-analogforsøk
Hovedkliniske studier i den initiale utviklingen av lamivudin sammenlignet lamivudin/zidovudin-kombinasjoner med zidovudin monoterapi eller med zidovudin pluss zalcitabin. Disse studiene viste den antivirale effekten av lamivudin i en 2-legemiddelkombinasjon. Nyere bruk av lamivudin i behandling av HIV-1-infeksjon inkorporerer det i flere legemiddelregimer som inneholder minst 3 antiretrovirale legemidler for forbedret viral undertrykkelse.
Sammenligning av doseregimer Surrogatendepunktforsøk hos terapinaive voksne
EPV20001 var en multisenter, dobbeltblind, kontrollert studie der forsøkspersoner ble randomisert 1:1 til å motta EPIVIR 300 mg én gang daglig eller EPIVIR 150 mg to ganger daglig, i kombinasjon med zidovudin 300 mg to ganger daglig og efavirenz 600 mg én gang daglig. Totalt 554 antiretroviral behandling-naive HIV-1-infiserte voksne registrert: menn (79 %), hvite (50 %), median alder på 35 år, baseline CD4+ celletall på 69 til 1 089 celler per mm³ (median = 362 celler per mm³), og median baseline plasma HIV-1 RNA på 4,66 log10 kopier per ml. Utfall av behandling gjennom 48 uker er oppsummert i figur 1 og tabell 10.
Figur 1: Virologisk respons til og med uke 48, EPV20001a,b (Intent-to-Treat) 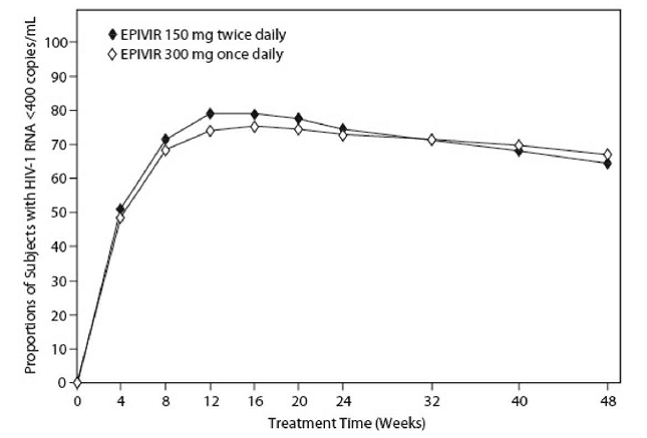
en Roche AMPLICOR HIV-1 MONITOR. b Respondenter ved hvert besøk er forsøkspersoner som hadde oppnådd og opprettholdt HIV-1 RNA mindre enn 400 kopier per ml uten avbrudd ved det besøket.
Andelene av personer med HIV-1 RNA mindre enn 50 kopier per ml (via Roche Ultrasensitive assay) til og med uke 48 var 61 % for personer som fikk EPIVIR 300 mg én gang daglig og 63 % for personer som fikk EPIVIR 150 mg to ganger daglig. Median økning i CD4+-celletall var 144 celler per mm³ ved uke 48 hos personer som fikk EPIVIR 300 mg én gang daglig og 146 celler per mm³ for personer som fikk EPIVIR 150 mg to ganger daglig.
En liten, randomisert, åpen pilotforsøk, EPV40001, ble utført i Thailand. Totalt 159 behandlingsnaive voksne forsøkspersoner (mann 32 %, asiatiske 100 %, median alder 30 år, baseline median CD4+ celletall 380 celler per mm³, median plasma HIV-1 RNA 4,8 log10 kopier per ml) ble registrert. To av behandlingsarmene i denne studien ga en sammenligning mellom lamivudin 300 mg én gang daglig (n = 54) og lamivudin 150 mg to ganger daglig (n = 52), hver i kombinasjon med zidovudin 300 mg to ganger daglig og abakavir 300 mg to ganger daglig. I intent-to-treat-analyser av 48-ukers data var andelen av personer med HIV-1 RNA under 400 kopier per ml 61 % (33 av 54) i gruppen randomisert til lamivudin én gang daglig og 75 % (39 av 52) i gruppen randomisert til å motta alle 3 legemidlene to ganger daglig; proporsjonene med HIV-1 RNA under 50 kopier per ml var 54 % (29 av 54) i gruppen med lamivudin én gang daglig og 67 % (35 av 52) i gruppen med alle to ganger daglig; og median økning i CD4+-celletall var 166 celler per mm³ i gruppen med lamivudin én gang daglig og 216 celler per mm³ i gruppen med alle to ganger daglig.
Pediatriske fag
Klinisk endepunktforsøk
ACTG300 var en multisenter, randomisert, dobbeltblind studie som gjorde det mulig å sammenligne EPIVIR pluss RETROVIR (zidovudin) med didanosin monoterapi. Totalt 471 symptomatiske, HIV-1-infiserte behandlingsnaive (mindre enn eller lik 56 dager med antiretroviral terapi) pediatriske personer ble inkludert i disse 2 behandlingsgruppene. Medianalderen var 2,7 år (område: 6 uker til 14 år), 58 % var kvinner og 86 % var ikke-hvite. Gjennomsnittlig baseline CD4+ celletall var 868 celler per mm³ (gjennomsnitt: 1060 celler per mm³ og område: 0 til 4650 celler per mm³ for forsøkspersoner under eller lik 5 år; gjennomsnitt: 419 celler per mm³ og område: 0 til 1555 celler per mm³ for personer over 5 år) og gjennomsnittlig baseline plasma HIV-1 RNA var 5,0 log10 kopier per ml. Median varighet på studien var 10,1 måneder for forsøkspersonene som fikk EPIVIR 150 mg pluss RETROVIR og 9,2 måneder for forsøkspersoner som fikk didanosin monoterapi. Resultatene er oppsummert i tabell 11.
En gang daglig dosering
ARROW (COL105677) var en 5-årig randomisert, multisenterstudie som evaluerte flere aspekter ved klinisk behandling av HIV-1-infeksjon hos pediatriske personer. HIV-1-infiserte, behandlingsnaive forsøkspersoner i alderen 3 måneder til 17 år ble registrert og behandlet med et førstelinjeregime som inneholdt EPIVIR 150 mg og abakavir, dosert to ganger daglig i henhold til Verdens helseorganisasjons anbefalinger. Etter minimum 36 uker på behandling, fikk forsøkspersoner muligheten til å delta i randomisering 3 av ARROW-studien, der sikkerheten og effekten av dosering én gang daglig ble sammenlignet med dosering to ganger daglig av EPIVIR og abakavir, i kombinasjon med et tredje antiretroviralt middel. medikament, i ytterligere 96 uker. Av de 1 206 opprinnelige ARROW-personene deltok 669 i randomisering 3. Virologisk undertrykkelse var ikke et krav for deltakelse: ved baseline for randomisering 3 (etter minimum 36 uker med behandling to ganger daglig), 75 % av pasientene i to ganger daglig kohorten var virologisk undertrykt, sammenlignet med 71 % av forsøkspersonene i kohorten én gang daglig.
Andelen av personer med HIV-1 RNA på mindre enn 80 kopier per ml gjennom 96 uker er vist i tabell 12. Forskjellene mellom virologisk respons i de to behandlingsarmene var sammenlignbare på tvers av baseline-karakteristika for kjønn og alder.
Analyser etter formulering viste andelen av personer med HIV-1 RNA på mindre enn 80 kopier per ml ved randomisering, og uke 96 var høyere hos personer som hadde fått tablettformuleringer av EPIVIR 150 mg og abakavir (75 % [458/610] og 72 % [434/601]) enn hos de som hadde mottatt oppløsningsformulering(er) (med EPIVIR 150 mg oppløsning gitt i vektbåndbaserte doser på omtrent 8 mg per kg per dag) til enhver tid (52 % [29/56] og 54 % [30/56]), henholdsvis [se ADVARSLER OG FORHOLDSREGLER ]. Disse forskjellene ble observert i hver forskjellige aldersgruppe som ble evaluert.
PASIENTINFORMASJON
EPIVIR (EP-i-veer) (lamivudin) tabletter
EPIVIR (EP-i-veer) (lamivudin) mikstur
Hva er den viktigste informasjonen jeg bør vite om EPIVIR 150mg?
EPIVIR kan forårsake alvorlige bivirkninger, inkludert:
- . Forverring av hepatitt B-virus hos personer som har HIV-1-infeksjon. Hvis du har infeksjon med HIV-1 (humant immunsviktvirus type 1) og hepatitt B-virus (HBV), kan HBV bli verre (oppblussing) hvis du slutter å ta EPIVIR. En "oppblussing" er når HBV-infeksjonen din plutselig kommer tilbake på en verre måte enn før. Forverret leversykdom kan være alvorlig og kan føre til døden.
- . Ikke gå tom for EPIVIR. Fyll på resepten din eller snakk med helsepersonell før EPIVIR er borte. . Ikke stopp EPIVIR uten først å snakke med helsepersonell. . Hvis du slutter å ta EPIVIR, må helsepersonell sjekke helsen din ofte og ta blodprøver regelmessig i flere måneder for å sjekke leveren din.
Hva er EPIVIR?
EPIVIR er et reseptbelagt legemiddel som brukes sammen med andre antiretrovirale legemidler for å behandle infeksjon med humant immunsviktvirus (HIV-1).
HIV-1 er viruset som forårsaker Acquired Immune Deficiency Syndrome (AIDS).
EPIVIR tabletter og mikstur (brukes til å behandle HIV-1-infeksjon) inneholder en høyere dose av samme aktive ingrediens (lamivudin) enn det som er i medisinen EPIVIR-HBV tabletter og mikstur (brukes til å behandle HBV). Hvis du har både HIV-1 og HBV, bør du ikke bruke EPIVIR-HBV til å behandle infeksjonene dine.
Sikkerheten og effekten av EPIVIR er ikke fastslått hos barn under 3 måneder.
Hvem bør ikke ta EPIVIR 150mg?
Ikke ta EPIVIR dersom du er allergisk overfor lamivudin eller noen av innholdsstoffene i EPIVIR. Se slutten av denne pasientinformasjonen for en fullstendig liste over ingredienser i EPIVIR.
Hva bør jeg fortelle helsepersonell før jeg tar EPIVIR?
Før du tar EPIVIR 150mg, fortell helsepersonell dersom du:
- . har eller har hatt leverproblemer, inkludert hepatitt B- eller C-virusinfeksjon. . har nyreproblemer. . har diabetes. Hver 15 ml dose (150 mg) av EPIVIR mikstur inneholder 3 gram sukrose. . er gravid eller planlegger å bli gravid. Å ta EPIVIR under graviditet har ikke vært assosiert med økt risiko for fødselsskader. Snakk med helsepersonell hvis du er gravid eller planlegger å bli gravid. Svangerskapsregisteret. Det finnes et svangerskapsregister for kvinner som tar antiretrovirale medisiner under svangerskapet. Formålet med dette registeret er å samle informasjon om helsen til deg og babyen din. Snakk med helsepersonell om hvordan du kan ta del i dette registeret. . ammer eller planlegger å amme. Ikke amme hvis du tar EPIVIR.
- . Du bør ikke amme hvis du har HIV-1 på grunn av risikoen for å overføre HIV-1 til babyen din.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
Noen medisiner samhandler med EPIVIR. Hold en liste over medisinene dine og vis den til helsepersonell og apotek når du får en ny medisin. Du kan spørre helsepersonell eller apotek om en liste over medisiner som interagerer med EPIVIR.
Ikke begynn å ta en ny medisin uten å fortelle det til helsepersonell. Helsepersonell kan fortelle deg om det er trygt å ta EPIVIR sammen med andre legemidler.
Hvordan skal jeg ta EPIVIR?
- . Ta EPIVIR nøyaktig slik helsepersonell ber deg ta det. . Hvis du glemmer en dose EPIVIR 150 mg, ta den så snart du husker det. Ikke ta 2 doser samtidig eller ta mer enn det helsepersonell forteller deg å ta. . Hold deg under behandling av en helsepersonell under behandling med EPIVIR. . EPIVIR kan tas med eller uten mat. . For barn 3 måneder og eldre vil helsepersonell foreskrive en dose EPIVIR 150 mg basert på barnets kroppsvekt. . Fortell helsepersonell dersom du eller barnet ditt har problemer med å svelge tabletter. EPIVIR 150mg kommer også som væske (mikstur). . Ikke gå tom for EPIVIR. Viruset i blodet ditt kan øke og viruset kan bli vanskeligere å behandle. Når forsyningen begynner å bli lav, kan du få mer fra helsepersonell eller apotek. . Hvis du tar for mye EPIVIR 150 mg, ring legen din eller gå til nærmeste legevakt umiddelbart.
Hva er de mulige bivirkningene av EPIVIR 150mg?
- . EPIVIR 150mg kan forårsake alvorlige bivirkninger inkludert: . Se "Hva er den viktigste informasjonen jeg bør vite om EPIVIR 150mg?" . Oppbygging av en syre i blodet ditt (laktacidose). Laktacidose kan forekomme hos noen personer som tar EPIVIR. Laktacidose er en alvorlig medisinsk nødsituasjon som kan forårsake død. Ring helsepersonell med en gang hvis du får noen av følgende symptomer som kan være tegn på laktacidose:
- . føler meg veldig svak eller trøtt . føler deg kald, spesielt i armer og ben . uvanlige (ikke normale) muskelsmerter . føler deg svimmel eller ør i hodet . problemer med å puste . har rask eller uregelmessig hjerterytme . magesmerter med kvalme og oppkast
- . huden din eller den hvite delen av øynene dine blir gule (gulsott) . tap av matlyst i flere dager eller lenger . kvalme . mørk eller "te-farget" urin . smerte, verking eller ømhet på høyre side av mageområdet . lys avføring (avføring)
Du kan ha større sannsynlighet for å få melkesyreacidose eller alvorlige leverproblemer hvis du er kvinne eller svært overvektig (fedme).
- . Risiko for betennelse i bukspyttkjertelen (pankreatitt). Barn kan ha risiko for å utvikle pankreatitt under behandling med EPIVIR hvis de:
- . har tatt nukleosidanalogmedisiner . har en historie med pankreatitt i det siste . har andre risikofaktorer for pankreatitt
Ring helsepersonell med en gang hvis barnet ditt utvikler tegn og symptomer på pankreatitt, inkludert alvorlige smerter i øvre mageområde, med eller uten kvalme og oppkast. Din helsepersonell kan fortelle deg om å slutte å gi EPIVIR 150 mg til barnet ditt hvis symptomene og blodprøveresultatene viser at barnet ditt kan ha pankreatitt.
- . Endringer i immunsystemet ditt (immunrekonstitusjonssyndrom) kan skje når du begynner å ta HIV-1-medisiner. Immunsystemet ditt kan bli sterkere og begynne å bekjempe infeksjoner som har vært skjult i kroppen din i lang tid. Fortell helsepersonell med en gang hvis du begynner å få nye symptomer etter at du begynner å ta EPIVIR.
De vanligste bivirkningene av EPIVIR 150 mg hos voksne inkluderer:
- . hodepine . nasale tegn og symptomer . kvalme . diaré . føler seg generelt ikke bra . tretthet . hoste
De vanligste bivirkningene av EPIVIR 150 mg hos barn inkluderer feber og hoste.
Fortell helsepersonell dersom du har noen bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av EPIVIR. Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare EPIVIR?
- . Oppbevar EPIVIR 150 mg tabletter og mikstur ved romtemperatur mellom 20 °C til 25 °C (68 °F til 77 °F). . Hold flasker med EPIVIR 150 mg mikstur tett lukket.
Oppbevar EPIVIR og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av EPIVIR.
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i et pasientinformasjonshefte. Ikke bruk EPIVIR for en tilstand det ikke er foreskrevet for. Ikke gi EPIVIR til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Du kan spørre helsepersonell eller apotek om informasjon om EPIVIR 150mg som er skrevet for helsepersonell.
For mer informasjon, gå til www.viivhealthcare.com eller ring 1-877-844-8872.
Hva er ingrediensene i EPIVIR 150mg?
Aktiv ingrediens: lamivudin
Inaktive ingredienser:
EPIVIR 150 mg skårede 150 mg filmdrasjerte tabletter: hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyetylenglykol, polysorbat 80, natriumstivelsesglykolat og titandioksid.
EPIVIR 300 mg filmdrasjerte tabletter: svart jernoksid, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyetylenglykol, polysorbat 80, natriumstivelsesglykolat og titandioksid.
EPIVIR 150 mg mikstur: kunstig jordbær- og banansmak, sitronsyre (vannfri), metylparaben, propylenglykol, propylparaben, natriumsitrat (dihydrat) og sukrose (200 mg per ml).
Denne pasientinformasjonen er godkjent av US Food and Drug Administration.
