Zovirax 200mg, 400mg, 800mg Acyclovir Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Zovirax 800mg og hvordan brukes det?
Zovirax er et reseptbelagt legemiddel som brukes til å behandle symptomene på forkjølelsessår (Herpes Labialis) og Genital Herpes. Zovirax 800mg kan brukes alene eller sammen med andre medisiner.
Zovirax 400mg tilhører en klasse legemidler som kalles Antivirals, Topical.
Det er ikke kjent om Zovirax 200mg er trygt og effektivt hos barn under 12 år.
Hva er de mulige bivirkningene av Zovirax 800mg?
Zovirax 200mg kan forårsake alvorlige bivirkninger inkludert:
- . lett blåmerker eller blødninger, . lilla eller røde prikker under huden, . lite eller ingen vannlating, . smertefull eller vanskelig vannlating, . hevelse i føttene eller anklene, . føler meg sliten, og . kortpustethet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Zovirax inkluderer:
- . kvalme, . oppkast, . diaré, . generell dårlig følelse, . hodepine, og . munnsmerter mens du bruker en acyclovir bukkal tablett
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Zovirax. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
SAMMENDRAG PRODUKTINFORMASJON
Legemiddelstoff
Riktig navn: acyclovir
Kjemisk navn: 9-[(2-hydroksyetoksy)metyl]guanin
Andre navn: acykloguanosin
Molekylær formel: C8H11N503
Molekylmasse: 225.2 Strukturformel:
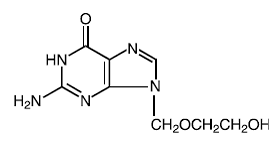
Fysisk-kjemiske egenskaper: Acyclovir er et hvitt, krystallinsk pulver med en maksimal løselighet i vann på 1,3 mg/ml ved 25°C.
INDIKASJONER
Indikasjoner og klinisk bruk
ZOVIRAX® (acyclovir) er indisert for følgende tilstander:
- . Behandling av innledende episoder av herpes genitalis. . Undertrykkelse av uvanlig hyppige tilbakefall av herpes genitalis (6 eller flere episoder per år). . Akuttbehandling av herpes zoster (helvetesild) og varicella (vannkopper).
Resultatene fra kliniske studier tyder på at noen pasienter med tilbakevendende genital herpes kan ha klinisk nytte av administrering av oral ZOVIRAX® dersom det tas ved første tegn på en forestående episode. De som mest sannsynlig vil ha nytte er pasienter som opplever alvorlige, langvarige tilbakefall; slik intermitterende terapi kan være mer hensiktsmessig enn suppressiv terapi når disse tilbakefallene er sjeldne.
Tidlig behandling av akutt herpes zoster (helvetesild) hos immunkompetente individer med oral ZOVIRAX® resulterte i redusert virusutskillelse; redusert tid til helbredelse; mindre spredning; og lindring av akutte smerter.
Behandling av varicella (vannkopper) hos immunkompetente pasienter med oral ZOVIRAX® reduserte det totale antallet lesjoner, akselererte progresjonen av lesjoner til skorpe- og tilhelingsstadiene, og reduserte antall gjenværende hypopigmenterte lesjoner. I tillegg reduserte ZOVIRAX® feber og konstitusjonelle symptomer assosiert med vannkopper.
Profylaktisk bruk av acyclovir ved vannkopper er ikke fastslått.
Geriatri (≥ 65 år): Bruk i den geriatriske populasjonen kan være assosiert med forskjeller i sikkerhet på grunn av aldersrelaterte endringer i nyrefunksjonen, og en kort diskusjon kan finnes i de aktuelle avsnittene (se ADVARSLER OG FORHOLDSREGLER ).
Pediatri ( Ingen data er tilgjengelig.
DOSERING OG ADMINISTRASJON
Doseringshensyn
- . Doseringen av ZOVIRAX® (acyclovir) bør reduseres hos pasienter med nedsatt nyrefunksjon. . Behandling bør startes så snart som mulig etter diagnosen vannkopper eller herpes zoster, eller ved første tegn eller symptomer på et utbrudd av genital herpes. . Anbefalt dose og bruksvarighet avhenger av indikasjonen.
Anbefalt dose- og doseringsjustering
Behandling av førstegangsinfeksjon av Herpes Genitalis: 200 mg (én 200 mg tablett eller en teskje suspensjon [5 ml]) hver 4. time, 5 ganger daglig, totalt 1 g daglig i 10 dager. Behandlingen bør startes så tidlig som mulig etter opptreden av tegn og symptomer.
Undertrykkende terapi for tilbakevendende Herpes Genitalis
Den anbefalte initialdosen er 200 mg (én 200 mg tablett eller en teskje suspensjon [5 ml]) tre ganger daglig. Dette kan økes hvis gjennombrudd oppstår opp til en dose på én 200 mg tablett eller én teskje [5 ml] suspensjon, fem ganger daglig. Om nødvendig kan en dose på 400 mg (to 200 mg tabletter eller to teskjeer suspensjon [10 ml]) gitt to ganger daglig vurderes. Periodisk revurdering av behovet for terapi anbefales.
Administrering av ZOVIRAX® for intermitterende terapi er 200 mg (én 200 mg tablett eller en teskje [5 ml] suspensjon) hver 4. time 5 ganger daglig i 5 dager. Behandlingen bør startes ved det tidligste tegn eller symptom (prodrom) på tilbakefall.
Behandling av Herpes Zoster
800 mg oral ZOVIRAX®, hver 4. time, 5 ganger daglig i 7 til 10 dager. Behandling bør startes innen 72 timer etter at lesjonene har startet. I kliniske studier oppstod den største fordelen når behandlingen ble startet innen 48 timer etter at lesjonene startet.
Behandling av vannkopper
20 mg/kg (ikke over 800 mg) oralt, 4 ganger daglig i 5 dager. Behandlingen bør startes innen 24 timer etter at utslett har vist seg.
Pasienter med akutt eller kronisk nedsatt nyrefunksjon
Forsiktighet anbefales ved administrering av acyclovir til pasienter med nedsatt nyrefunksjon. Tilstrekkelig hydrering bør opprettholdes.
Omfattende farmakokinetiske studier er fullført etter intravenøse acyklovirinfusjoner hos pasienter med nedsatt nyrefunksjon.
Basert på disse studiene anbefales dosejusteringer i tabell 5 for indikasjoner på genital herpes og herpes zoster.
Hemodialyse
For pasienter som trenger hemodialyse, er gjennomsnittlig plasmahalveringstid for acyklovir under hemodialyse ca. 5 timer. Dette resulterer i en 60 % reduksjon i plasmakonsentrasjoner etter en seks timers dialyseperiode. Derfor bør pasientens doseringsplan justeres slik at en ekstra dose gis etter hver dialyse.
Peritonealdialyse
Ingen tilleggsdose ser ut til å være nødvendig etter justering av doseringsintervallet.
Glemt dose
Hvis en dose ZOVIRAX® glemmes, bør pasienten rådes til å ta den så snart han/hun husker det, og deretter fortsette med neste dose med riktig tidsintervall.
HVORDAN LEVERES
Oppbevaring og stabilitet
ZOVIRAX® tabletter skal oppbevares ved kontrollert romtemperatur (15 til 25°C) på et tørt sted og beskyttet mot lys.
ZOVIRAX® Suspensjon bør oppbevares ved kontrollert romtemperatur (15 til 25°C).
Doseringsformer, sammensetning og emballasje
Suspensjon: Hver teskje (5 ml) ZOVIRAX® Suspensjon inneholder 200 mg acyclovir og de ikke-medisinske ingrediensene banansmak, cellulose, glyserin, metylparaben, propylparaben, sorbitol, vanillin og vann.
Hver ZOVIRAX® 200-tablett inneholder 200 mg acyklovir og de ikke-medisinske ingrediensene cellulose, indigotin, laktose, magnesiumstearat, povidon og natriumstivelsesglykolat.
ZOVIRAX® Suspensjon er tilgjengelig i flasker på 125 ml* og 475 ml. Hver teskje (5 ml) off-white suspensjon med banansmak inneholder 200 mg acyclovir.
*125 ml flaske ikke tilgjengelig i Canada
ZOVIRAX® 200 tabletter er tilgjengelig i flasker med 100 tabletter. Hver blå, skjoldformet, skråkantet, komprimert tablett inneholder 200 mg acyclovir og er merket med "ZOVIRAX" på den ene siden og en trekant på den andre siden.
GlaxoSmithKline Inc., 7333 Mississauga Road, Mississauga, Ontario, L5N 6L4 1-800-387-7374. Revidert: 10. november 2014
BIVIRKNINGER
Oversikt over bivirkninger
De hyppigste bivirkningene forbundet med bruk av ZOVIRAX® (acyclovir) er hodepine og kvalme.
Nevrologiske bivirkninger er også rapportert i sjeldne tilfeller. Eldre pasienter og pasienter med tidligere nedsatt nyrefunksjon har økt risiko for å utvikle disse effektene. I de rapporterte tilfellene var disse reaksjonene generelt reversible ved seponering av behandlingen (se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER , Bivirkninger etter markedsføring ).
Uønskede legemiddelreaksjoner i kliniske forsøk
Fordi kliniske studier utføres under svært spesifikke forhold, kan det hende at bivirkningsratene observert i de kliniske forsøkene ikke gjenspeiler frekvensene som er observert i praksis, og bør ikke sammenlignes med frekvensene i de kliniske forsøkene med et annet legemiddel. Bivirkningsinformasjon fra kliniske studier er nyttig for å identifisere legemiddelrelaterte bivirkninger og for å tilnærme frekvenser.
Behandling av Herpes Simplex
Kortvarig administrering (5-10 dager): De hyppigste bivirkningene rapportert under kliniske studier av behandling av genital herpes med oral ZOVIRAX® hos 298 pasienter er oppført i tabell 1.
Undertrykkelse av Herpes Simplex
Langtidsadministrasjon: De hyppigste bivirkningene rapportert i en klinisk studie for forebygging av tilbakefall med kontinuerlig administrering av 400 mg (to 200 mg kapsler) 2 ganger daglig er oppført i tabell 2.
Bevis så langt fra kliniske studier tyder på at alvorlighetsgraden og frekvensen av uønskede hendelser sannsynligvis ikke vil nødvendiggjøre seponering av behandlingen.
Herpes Zoster
De hyppigste bivirkningene rapportert under tre kliniske studier med behandling av herpes zoster (helvetesild) med 800 mg oral ZOVIRAX® 5 ganger daglig i 7 eller 10 dager eller placebo er oppført i tabell 3.
Vannkopper
De hyppigste bivirkningene rapportert under tre kliniske studier med behandling av vannkopper med oral ZOVIRAX® eller placebo er oppført i tabell 4.
Mindre vanlige bivirkninger i kliniske forsøk (
Andre bivirkninger rapportert hos mindre enn 1 % av pasientene som fikk ZOVIRAX® i alle kliniske studier inkluderte: magesmerter, anoreksi, forstoppelse, svimmelhet, ødem, tretthet, flatulens, lyskeadenopati, søvnløshet, smerter i bena, medisinsmak, hudutslett, sår hals, krampaktig håndbevegelse og urticaria.
Unormale hematologiske og kliniske kjemifunn
Ingen klinisk signifikante endringer i laboratorieverdier er observert i kliniske studier for behandling av vannkopper og zoster, og for behandling og undertrykkelse av genital herpes med ZOVIRAX®.
Bivirkninger etter markedsføring
Følgende hendelser har blitt rapportert frivillig under bruk av ZOVIRAX® etter markedsføring i klinisk praksis. Disse hendelsene er valgt for inkludering enten på grunn av deres alvorlighetsgrad, hyppighet av rapportering, potensiell årsakssammenheng til ZOVIRAX® eller en kombinasjon av disse faktorene. Bivirkninger etter markedsføring rapporteres spontant fra en populasjon av ukjent størrelse, og det kan derfor ikke gjøres estimater for frekvens.
Generell: Feber, hodepine, smerte og perifert ødem.
Nervøs: Svimmelhet, parestesi, agitasjon, forvirring, tremor, ataksi, dysartri, hallusinasjoner, psykotiske symptomer, kramper, somnolens, encefalopati og koma er rapportert. Disse hendelsene er generelt reversible og rapporteres vanligvis hos pasienter med nedsatt nyrefunksjon, eller med andre disponerende faktorer (se ADVARSLER OG FORHOLDSREGLER ). Disse symptomene kan være markerte, spesielt hos eldre voksne.
Fordøyelsessystemet: Diaré, gastrointestinale plager og kvalme.
Hematogisk og lymfatisk: Anemi, leukopeni, lymfadenopati og trombocytopeni.
Overfølsomhet og hud: Alopecia, erythema multiforme, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, utslett inkludert lysfølsomhet, pruritus, urticaria, dyspné, angioødem og anafylaksi.
Lever og galleveier og bukspyttkjertel: Rapporter om reversibel hyperbilirubinemi og forhøyede leverrelaterte enzymer. Hepatitt og gulsott.
Muskuloskeletal: Myalgi.
Spesielle sanser: Visuelle abnormiteter.
Urogenital: Forhøyet blodkreatinin og blod urea nitrogen (BUN). Akutt nyresvikt, nyresmerter og hematuri er rapportert. Nyresmerter kan være assosiert med nyresvikt (se ADVARSLER OG FORHOLDSREGLER ).
NARKOTIKAHANDEL
Legemiddel-legemiddelinteraksjoner
Ingen klinisk signifikante interaksjoner er identifisert.
Acyclovir elimineres hovedsakelig uendret i urinen via aktiv renal tubulær sekresjon. Alle legemidler som administreres samtidig som konkurrerer med denne mekanismen kan øke plasmakonsentrasjonen av acyclovir. Probenecid og cimetidin øker arealet under kurven (AUC) av acyclovir ved denne mekanismen, og reduserer acyclovir renal clearance. På samme måte er det vist økninger i plasma-AUC for acyklovir og den inaktive metabolitten av mykofenolatmofetil, et immunsuppressivt middel som brukes hos transplanterte pasienter når legemidlene administreres samtidig. Imidlertid er ingen dosejustering nødvendig på grunn av den brede terapeutiske indeksen til acyclovir.
Interaksjoner mellom narkotika og mat
Det er ingen kjent interaksjon med mat (se Handling og klinisk farmakologi , Farmakokinetikk ).
Interaksjoner mellom narkotika og urter
Interaksjoner med urteprodukter er ikke etablert.
Interaksjoner med legemiddel-laboratorietest
Interaksjoner med laboratorietester er ikke fastslått.
ADVARSLER
ZOVIRAX (acyclovir) kapsler, tabletter og suspensjon er kun beregnet for oralt inntak. Nyresvikt, i noen tilfeller med døden til følge, har blitt observert ved behandling med acyclovir (se BIVIRKNINGER: Observert under klinisk praksis og OVERDOSERING ). Trombotisk trombocytopenisk purpura/hemolytisk uremisk syndrom (TTP/HUS), som har resultert i død, har forekommet hos immunkompromitterte pasienter som får acyclovirbehandling.
FORHOLDSREGLER
Dosejustering anbefales når ZOVIRAX (acyclovir) administreres til pasienter med nedsatt nyrefunksjon (se DOSERING OG ADMINISTRASJON ). Forsiktighet bør også utvises ved administrering av ZOVIRAX (acyklovir) til pasienter som får potensielt nefrotoksiske midler siden dette kan øke risikoen for nyresvikt og/eller risikoen for reversible symptomer på sentralnervesystemet som de som er rapportert hos pasienter behandlet med intravenøs acyclovir. . Tilstrekkelig hydrering bør opprettholdes.
Herpes Zoster: Det er ingen data om behandling startet mer enn 72 timer etter utbruddet av zosterutslett. Pasienter bør rådes til å starte behandling så snart som mulig etter diagnosen herpes zoster.
Genital herpesinfeksjon: Pasienter bør informeres om at ZOVIRAX (acyclovir) ikke er en kur mot genital herpes. Det er ingen data som vurderer om ZOVIRAX (acyclovir) vil forhindre overføring av infeksjon til andre. Fordi genital herpes er en seksuelt overførbar sykdom, bør pasienter unngå kontakt med lesjoner eller samleie når lesjoner og/eller symptomer er tilstede for å unngå å infisere partnere. Genital herpes kan også overføres i fravær av symptomer gjennom asymptomatisk viral utsletting. Hvis medisinsk behandling av tilbakefall av genital herpes er indisert, bør pasienter rådes til å starte behandlingen ved første tegn eller symptom på en episode.
Vannkopper: Vannkopper hos ellers friske barn er vanligvis en selvbegrenset sykdom av mild til moderat alvorlighetsgrad. Ungdom og voksne har en tendens til å ha mer alvorlig sykdom. Behandlingen ble igangsatt innen 24 timer etter det typiske vannkoppeutslettet i de kontrollerte studiene, og det er ingen informasjon om effekten av behandling som ble startet senere i sykdomsforløpet.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Dataene som presenteres nedenfor inkluderer referanser til maksimale steady-state plasma-acyklovirkonsentrasjoner observert hos mennesker behandlet med 800 mg gitt oralt 5 ganger daglig (dosering passende for behandling av herpes zoster) eller 200 mg gitt oralt 5 ganger daglig (dosering passende for behandling) av genital herpes). Plasmamedisinkonsentrasjoner i dyrestudier er uttrykt som multipler av menneskelig eksponering for acyklovir ved høyere og lavere doseringsplaner (se KLINISK FARMAKOLOGI: Farmakokinetikk ).
Acyclovir ble testet i livstidsbioassays på rotter og mus ved daglige enkeltdoser på opptil 450 mg/kg administrert via sonde. Det var ingen statistisk signifikant forskjell i forekomsten av svulster mellom behandlede dyr og kontrolldyr, og acyklovir forkortet heller ikke latensen til svulster. Maksimal plasmakonsentrasjon var 3 til 6 ganger humane nivåer i musebioanalysen og 1 til 2 ganger humane nivåer i rottebioanalysen.
Acyclovir ble testet i 16 in vitro og in vivo genetiske toksisitetsanalyser. Acyclovir var positivt i 5 av analysene.
Acyclovir svekket ikke fertilitet eller reproduksjon hos mus (450 mg/kg/dag, po) eller hos rotter (25 mg/kg/dag, sc). I musestudien var plasmanivåene 9 til 18 ganger menneskelige nivåer, mens i rottestudien var de 8 til 15 ganger menneskelige nivåer. Ved høyere doser (50 mg/kg/dag, sc) hos rotter og kaniner (henholdsvis 11 til 22 og 16 til 31 ganger humane nivåer) ble implantasjonseffektiviteten, men ikke kullstørrelsen, redusert. I en peri- og postnatal rottestudie med 50 mg/kg/dag, sc, var det en statistisk signifikant reduksjon i gruppens gjennomsnittlige antall corpora lutea, totale implantasjonssteder og levende fostre.
Ingen testikkelavvik ble sett hos hunder gitt 50 mg/kg/dag, IV i 1 måned (21 til 41 ganger humane nivåer) eller hos hunder gitt 60 mg/kg/dag oralt i 1 år (6 til 12 ganger humane nivåer). Testikkelatrofi og aspermatogenese ble observert hos rotter og hunder ved høyere dosenivåer.
Svangerskap
Teratogene effekter: Graviditetskategori B. Acyc lovir administrert under organogenese var ikke teratogent hos mus (450 mg/kg/dag, po), kanin (50 mg/kg/dag, sc og IV) eller rotte (50 mg/kg/dag, sc). Disse eksponeringene resulterte i plasmanivåer på henholdsvis 9 og 18, 16 og 106 og 11 og 22 ganger humane nivåer.
Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Et prospektivt epidemiologisk register over bruk av acyklovir under graviditet ble etablert i 1984 og fullført i april 1999. Det ble fulgt 749 graviditeter hos kvinner eksponert for systemisk acyklovir i løpet av svangerskapets første trimester, noe som resulterte i 756 utfall. Forekomsten av fødselsdefekter tilnærmet den som finnes i befolkningen generelt. Den lille størrelsen på registeret er imidlertid utilstrekkelig til å evaluere risikoen for mindre vanlige defekter eller for å tillate pålitelige eller definitive konklusjoner angående sikkerheten til acyclovir hos gravide kvinner og deres fostre i utvikling. Acyclovir bør kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Ammende mødre
Acyklovirkonsentrasjoner er dokumentert i morsmelk hos 2 kvinner etter oral administrering av ZOVIRAX (acyklovir) og varierte fra 0,6 til 4,1 ganger tilsvarende plasmanivåer. Disse konsentrasjonene vil potensielt utsette det ammende spedbarnet for en dose acyklovir på opptil 0,3 mg/kg/dag. ZOVIRAX (acyclovir) skal administreres til en ammende mor med forsiktighet og kun når det er indisert.
Pediatrisk bruk
Sikkerhet og effektivitet av orale formuleringer av acyclovir hos pediatriske pasienter yngre enn 2 år har ikke blitt fastslått.
Geriatrisk bruk
Av 376 forsøkspersoner som fikk ZOVIRAX (acyklovir) i en klinisk studie av herpes zoster-behandling hos immunkompetente forsøkspersoner ¡Ý50 år, var 244 65 år og eldre, mens 111 var 75 år og eldre. Ingen generelle forskjeller i effektivitet for tid til opphør av ny lesjonsdannelse eller tid til helbredelse ble rapportert mellom geriatriske og yngre voksne personer. Varigheten av smerte etter tilheling var lengre hos pasienter 65 år og over. Kvalme, oppkast og svimmelhet ble rapportert hyppigere hos eldre personer. Eldre pasienter har større sannsynlighet for redusert nyrefunksjon og trenger dosereduksjon. Eldre pasienter er også mer sannsynlig å ha nyre- eller CNS-bivirkninger. Med hensyn til CNS-bivirkninger observert under klinisk praksis, ble søvnighet, hallusinasjoner, forvirring og koma rapportert hyppigere hos eldre pasienter (se KLINISK FARMAKOLOGI, BIVIRKNINGER: Observert under klinisk praksis, og DOSERING OG ADMINISTRASJON ).
OVERDOSE
For håndtering av en mistenkt overdose, kontakt ditt regionale giftkontrollsenter.
Aktivt kull kan administreres for å hjelpe til med fjerning av uabsorbert medikament. Generelle støttetiltak anbefales.
Acyclovir absorberes bare delvis i mage-tarmkanalen. Pasienter har fått i seg opptil 20 g acyclovir ved en enkelt anledning, uten uventede bivirkninger. I kliniske studier var den høyeste plasmakonsentrasjonen observert hos en enkelt pasient ved disse dosene 10,0 μg/ml. Tilfeldige, gjentatte overdoser av oral acyclovir over flere dager har vært assosiert med gastrointestinale effekter (som kvalme og oppkast) og nevrologiske effekter (hodepine og forvirring).
Intravenøse doser administrert til mennesker har vært så høye som 1200 mg/m² (28 mg/kg) 3 ganger daglig i opptil 2 uker. Maksimal plasmakonsentrasjon har nådd 80 μg/ml. Overdosering av intravenøs acyklovir har resultert i økte serumkreatinin, urea-nitrogen i blodet og påfølgende nyresvikt. Nevrologiske effekter inkludert forvirring, hallusinasjoner, agitasjon, anfall og koma er beskrevet i forbindelse med intravenøs overdosering.
Pasienter bør observeres nøye for tegn på toksisitet. Hemodialyse øker betydelig fjerning av acyklovir fra blodet og kan derfor betraktes som et behandlingsalternativ i tilfelle symptomatisk overdose. Utfelling av acyklovir i nyretubuli kan forekomme dersom løseligheten (2,5 mg/ml) i den intratubulære væsken overskrides. Ved nyresvikt og anuri kan pasienten ha nytte av hemodialyse inntil nyrefunksjonen er gjenopprettet (se DOSERING OG ADMINISTRASJON ).
KONTRAINDIKASJONER
ZOVIRAX® (acyclovir) er kontraindisert for pasienter som utvikler overfølsomhet eller som er overfølsomme overfor acyclovir, valacyclovir eller andre komponenter i formuleringene av ZOVIRAX®. For en fullstendig liste, se Doseringsformer , Sammensetning og emballasje delen av produktmonografien .
KLINISK FARMAKOLOGI
Handling og klinisk farmakologi
Virkningsmekanismen
ZOVIRAX® (acyclovir), en syntetisk asyklisk purin-nukleosidanalog, er et substrat med høy grad av spesifisitet for herpes simplex og varicella-zoster spesifisert tymidinkinase. Acyclovir er et dårlig substrat for vertscelle-spesifisert tymidin kinase. Herpes simplex og varicella-zoster spesifisert tymidinkinase transformerer acyklovir til monofosfat som deretter transformeres av en rekke cellulære enzymer til acyklovirdifosfat og acyklovirtrifosfat. Acyclovirtrifosfat er både en hemmer av og et substrat for herpesvirus-spesifisert DNA-polymerase. Selv om den cellulære a-DNA-polymerasen i infiserte celler også kan hemmes av acyklovirtrifosfat, skjer dette bare ved konsentrasjoner av acyklovirtrifosfat som er høyere enn de som hemmer den herpesvirus-spesifiserte DNA-polymerase. Acyclovir omdannes selektivt til sin aktive form i herpesvirusinfiserte celler og tas derfor fortrinnsvis opp av disse cellene. Acyclovir har vist et veldig mye lavere toksisk potensiale in vitro for normale uinfiserte celler fordi: 1) mindre tas opp; 2) mindre konverteres til den aktive formen; og 3) cellulær a-DNA-polymerase har en lavere følsomhet for virkningen av den aktive formen av medikamentet. En kombinasjon av tymidinkinasespesifisiteten, inhibering av DNA-polymerase og for tidlig avslutning av DNA-syntese resulterer i hemming av herpesvirusreplikasjon. Ingen effekt på latent ikke-replikerende virus er påvist. Inhibering av viruset reduserer perioden med viral utskillelse, begrenser graden av spredning og patologinivå, og letter derved helbredelsen. Under undertrykkelse er det ingen bevis for at acyclovir forhindrer nevral migrasjon av viruset. Det avbryter episoder med tilbakevendende herpes på grunn av hemming av viral replikasjon etter reaktivering.
Farmakokinetikk
Farmakokinetikken til acyklovir etter oral administrering har blitt evaluert i 6 kliniske studier med 110 voksne pasienter.
Absorpsjon
en studie av 35 immunkompromitterte pasienter med herpes simplex eller varicella-zoster-infeksjon gitt ZOVIRAX® kapsler i doser på 200 til 1000 mg hver 4. time, 6 ganger daglig i 5 dager, ble biotilgjengeligheten estimert til å være 15 til 20 %. I denne studien ble steady-state plasmanivåer nådd innen den andre doseringsdagen. Gjennomsnittlig steady-state topp- og bunnkonsentrasjon etter siste 200 mg dose var henholdsvis 0,49 μg/ml (0,47 til 0,54 μg/mL) og 0,31 μg/mL (0,18 til 0,41 μg/mL), og etter den siste dosen var 800 mg 2,8 μg/mL (2,3 til 3,1 μg/mL) og 1,8 μg/mL (1,3 til 2,5 μg/mL). I en annen studie fikk 20 immunkompetente pasienter med tilbakevendende genital herpes simplex-infeksjoner ZOVIRAX® kapsler i doser på 800 mg hver 6. time, 4 ganger daglig i 5 dager, gjennomsnittlig steady-state topp- og bunnkonsentrasjon var 1,4 μg/ml (0,66 til 1,8 μg/mL) og 0,55 μg/mL (0,14 til 1,1 μg/mL).
en crossover-studie med flere doser hvor 23 frivillige fikk ZOVIRAX® som én 200 mg kapsel, én 400 mg tablett og én 800 mg tablett 6 ganger daglig, reduserte absorpsjonen med økende dose og den estimerte biotilgjengeligheten av acyclovir var 20, 15 og 10 %. , henholdsvis. Nedgangen i biotilgjengelighet antas å være en funksjon av dosen og ikke doseringsformen. Det ble vist at acyklovir ikke er doseproporsjonal over doseringsområdet 200 til 800 mg. I denne studien var steady-state topp- og bunnkonsentrasjoner av acyclovir 0,83 og 0,46 μg/mL, 1,21 og 0,63 μg/mL, og 1,61 og 0,83 μg/mL for regimene på henholdsvis 200, 400 og 800 mg.
I en annen studie med 6 frivillige var påvirkningen av mat på absorpsjonen av acyklovir ikke tydelig.
En enkelt oral dose biotilgjengelighetsstudie hos 23 normale frivillige viste at ZOVIRAX® kapsler 200 mg er bioekvivalente med 200 mg acyklovir i vandig oppløsning. I en egen studie med 20 frivillige ble det vist at ZOVIRAX® Suspensjon er bioekvivalent med ZOVIRAX® Kapsler. I en annen enkeltdose-biotilgjengelighet/bioekvivalensstudie med 24 frivillige, ble en ZOVIRAX® 800 mg tablett vist å være bioekvivalent med fire ZOVIRAX® 200 mg kapsler.
Fordeling
Plasmaproteinbinding er relativt lav (9 til 33 %) og medikamentinteraksjoner som involverer forskyvning av bindingssted er ikke forventet.
Eliminering
Etter oral administrering varierte gjennomsnittlig plasmahalveringstid for acyklovir hos frivillige og pasienter med normal nyrefunksjon fra 2,5 til 3,3 timer. Gjennomsnittlig renal utskillelse av uendret legemiddel utgjør 14,4 % (8,6 til 19,8 %) av den oralt administrerte dosen. Den eneste urinmetabolitten (identifisert ved høyytelses væskekromatografi) er 9-[(karboksymetoksy)metyl]guanin.
Spesielle populasjoner og forhold
Pediatri
Generelt er farmakokinetikken til acyclovir hos barn lik den hos voksne. Gjennomsnittlig halveringstid etter orale doser på 300 og 600 mg/m², hos barn i alderen 7 måneder til 7 år, var 2,6 timer (område 1,59 til 3,74 timer).
Oralt administrert acyklovir til barn under 2 år har ennå ikke blitt fullstendig studert.
Geriatri
Hos eldre faller total kroppsclearance med økende alder, assosiert med reduksjon i kreatininclearance, selv om det er liten endring i terminal plasmahalveringstid. Dosereduksjon kan være nødvendig hos geriatriske pasienter med redusert nyrefunksjon (se DOSERING OG ADMINISTRASJON ).
Nyreinsuffisiens
Halveringstiden og total clearance av acyclovir er avhengig av nyrefunksjonen.
En dosejustering anbefales for pasienter med nedsatt nyrefunksjon (se DOSERING OG ADMINISTRASJON ).
Kliniske studier
Initial Genital Herpes
Dobbeltblinde, placebokontrollerte studier har vist at oralt administrert ZOVIRAX® signifikant reduserte varigheten av akutt infeksjon og varigheten av lesjonsheling. Varigheten av smerte og ny lesjonsdannelse ble redusert i noen pasientgrupper.
Tilbakevendende genital herpes
I en studie med pasienter som fikk ZOVIRAX® 400 mg to ganger daglig i 3 år, forble 45, 52 og 63 % av pasientene fri for tilbakefall i henholdsvis det første, andre og tredje året. Serieanalyser av 3-måneders residivrater for pasientene viste at 71 til 87 % var residivfrie i hvert kvartal.
Herpes zoster infeksjoner
I en dobbeltblind, placebokontrollert studie av immunkompetente pasienter med lokalisert kutan zosterinfeksjon, forkortet ZOVIRAX® (800 mg 5 ganger daglig i 10 dager) tiden til lesjonsskorping, tilheling og fullstendig opphør av smerte, og reduserte varigheten av viral virus. avfall og varigheten av ny lesjonsdannelse.
en lignende dobbeltblind, placebokontrollert studie, forkortet ZOVIRAX® (800 mg 5 ganger daglig i 7 dager) tiden for fullført lesjonsskorping, tilheling og opphør av smerte, og reduserte varigheten av ny lesjonsdannelse.
Behandlingen ble startet innen 72 timer etter utslett og var mest effektiv hvis den ble startet innen de første 48 timene. Voksne eldre enn 50 år viste større nytte.
Vannkopper
Tre randomiserte, dobbeltblindede, placebokontrollerte studier ble utført på 993 pediatriske pasienter i alderen 2 til 18 år med vannkopper. Alle pasientene ble behandlet innen 24 timer etter utslett. I to studier ble ZOVIRAX® administrert med 20 mg/kg fire ganger daglig (opptil 3200 mg per dag) i 5 dager. I den tredje studien ble doser på 10, 15 eller 20 mg/kg administrert fire ganger daglig i 5 til 7 dager. Behandling med ZOVIRAX® forkortet tiden til 50 % tilheling, reduserte maksimalt antall lesjoner, reduserte median antall vesikler, redusert median antall gjenværende lesjoner på dag 28 og redusert andelen pasienter med feber, anoreksi og sløvhet. etter dag 2. Behandling med ZOVIRAX® påvirket ikke varicella zoster-virusspesifikke humorale eller cellulære immunresponser 1 måned eller 1 år etter behandling.
Detaljert farmakologi
Se Handling og klinisk farmakologi.
Virologi
Det kvantitative forholdet mellom in vitro-følsomheten til herpes simplex-virus (HSV) og varicella-zoster-virus (VZV) for acyclovir og den kliniske responsen på terapi er ikke fastslått hos mennesker, og testing av virussensitivitet er ikke standardisert. Resultatet av sensitivitetstesting, uttrykt som konsentrasjonen av medikament som kreves for å hemme veksten av virus i cellekultur (ID50) med 50 %, varierer sterkt avhengig av den bestemte analysen som brukes, celletypen som brukes og laboratoriet som utfører testen. ID50 for acyclovir mot HSV-1-isolater kan variere fra 0,02 μg/mL (plakkreduksjon i Vero-celler) til 5,9-13,5 μg/mL (plakkreduksjon i nyreceller fra grønn ape [GMK]). ID50 mot HSV-2 varierer fra 0,01 til 9,9 μg/mL (plakkreduksjon i henholdsvis Vero- og GMK-celler).
Ved å bruke en fargestoffopptaksmetode i Vero-celler, som gir ID50-verdier ca. 5 til 10 ganger høyere enn plakkreduksjonsanalyser, ble 1417 HSV-isolater (553 HSV-1 og 864 HSV-2) fra ca. 500 pasienter undersøkt over en 5- års periode. Disse analysene fant at 90 % av HSV-1-isolatene var følsomme for ≤ 0,9 μg/ml acyklovir og 50 % av alle isolatene var følsomme for ≤ 0,2 μg/mL acyklovir. For HSV-2-isolater var 90 % følsomme for ≤ 2,2 μg/ml og 50 % av alle isolater var følsomme for ≤ 0,7 μg/mL acyklovir. Isolater med betydelig redusert sensitivitet ble funnet hos 44 pasienter. Det må understrekes at verken pasientene eller isolatene ble tilfeldig utvalgt og derfor ikke representerer den generelle befolkningen. De fleste av de mindre sensitive kliniske HSV-isolatene har vært relativt mangelfulle i den virale tymidinkinase (TK). Stammer med endringer i viral TK eller viral DNA-polymerase er også rapportert.
ID50 mot VZV varierer fra 0,17-1,53 μg/mL (utbyttereduksjon, humane forhudsfibroblaster) til 1,85-3,98 μg/mL (foci-reduksjon, humane embryofibroblaster [HEF]). Reproduksjon av EBV-genom undertrykkes med 50 % i superinfiserte Raji-celler eller P3HR-1 lymfoblastoidceller med 1,5 μg/ml acyclovir. Cytomegalovirus (CMV) er relativt resistent mot acyklovir med ID50-verdier fra 2,3-17,6 μg/mL (plakkreduksjon, HEF-celler) til 1,82-56,8 μg/mL (DNA-hybridisering, HEF-celler). Den latente tilstanden til genomet til noen av de humane herpesvirusene er ikke kjent for å være følsom for acyclovir.
Motstand
Langvarig eksponering av HSV for subhemmende konsentrasjoner (0,1 μg/ml) av acyclovir i cellekultur har resultert i fremveksten av en rekke acyclovir-resistente stammer. Fremveksten av resistente stammer antas å skje ved "seleksjon" av naturlig forekommende virus med relativt lav mottakelighet for acyclovir. Slike stammer er rapportert i pre-terapi isolater fra flere kliniske studier.
To resistensmekanismer som involverer viral tymidinkinase (kreves for aktivering av acyclovir) er beskrevet. Disse er: (a) seleksjon av tymidin-kinase-mangelfulle mutanter som induserer liten eller ingen enzymaktivitet etter infeksjon, og (b) seleksjon av mutanter som har en tymidinkinase med endret substratspesifisitet som er i stand til å fosforylere det naturlige nukleosid tymidin, men ikke acyclovir. Flertallet av mindre følsomme virus som oppstår in vitro er av typen tymidin-kinase-mangel som har redusert infeksjonsevne og patogenisitet og mindre sannsynlighet for å indusere latens hos dyr.
Imidlertid ble det funnet at en acyklovir-resistent HSV-infeksjon hos en immunsupprimert benmargstransplantatmottaker på forlenget acyclovir-behandling skyldes et klinisk isolat som hadde en normal tymidinkinase, men en endret DNA-polymerase. Denne tredje resistensmekanismen som involverer herpes simplex-virus-DNA-polymerase skyldes utvalget av mutanter som koder for et endret enzym, som er motstandsdyktig mot inaktivering av acyclovirtrifosfat.
VZV ser ut til å manifestere resistens mot acyclovir via mekanismer som ligner på de man ser i HSV.
Begrenset klinisk undersøkelse har imidlertid ikke avdekket noen bevis for en signifikant endring i in vitro-følsomhet for VZV med acyclovir-terapi, selv om resistente mutanter av dette viruset kan isoleres in vitro på en måte som er analog med HSV. Analyse av et lite antall kliniske isolater fra pasienter som fikk oral acyclovir eller placebo for akutt herpes zoster tyder på at in vivo-fremkomst av resistent VZV kan forekomme sjelden. Langvarig acyklovirbehandling av svært immunkompromitterte pasienter med ervervet immunsviktsyndrom og alvorlig VZV kan føre til utseendet av resistente virus.
Kryssresistens mot andre antivirale midler forekommer in vitro i acyklovir-resistente mutanter. HSV-mutanter som er resistente mot acyclovir på grunn av fravær av viral tymidinkinase er kryssresistente mot andre midler som er fosforylert av herpesvirus tymidinkinase, slik som bromovinyldeoksyuridin, ganciclovir og 2'-fluorpyrimidinnukleosidene, som f.eks. -5-jodarabinosyl-cytosin (FIAC).
Den kliniske responsen på acyklovirbehandling har vanligvis vært god for pasienter med normal immunitet som HSV med redusert mottakelighet for acyklovir har blitt gjenvunnet fra, enten før, under eller etter behandlingen. Imidlertid har visse pasientgrupper, slik som alvorlig immunkompromitterte (spesielt benmargstransplanterte) og de som gjennomgår kroniske suppressive regimer blitt identifisert som oftest assosiert med fremveksten av resistente herpes simplex-stammer, som kan eller ikke kan ledsage en dårlig respons. til stoffet. Muligheten for utseende av mindre følsomme virus må anerkjennes ved behandling av slike pasienter, og følsomhetsovervåking av kliniske isolater fra disse pasientene bør oppmuntres.
Oppsummert er det kvantitative forholdet mellom in vitro-følsomheten til HSV og VZV overfor acyclovir og den kliniske responsen på terapi ikke klart fastslått hos mennesker. Standardiserte metoder for virussensitivitetstesting er nødvendig for å tillate mer presise korrelasjoner mellom in vitro virusfølsomhet og klinisk respons på acyclovirterapi.
Toksikologi
Akutt toksisitetsstudier
Voksne mus og rotter : Den akutte toksisiteten til oral acyclovir ble bestemt som vist i tabell 6.
Neonatale, umodne og voksne rotter
Grupper på 10 hann- og 10 hunnrotter Charles River CD (Sprague-Dawley) ble gitt store enkeltdoser (5 forskjellige dosenivåer) av en oppløsning (pH 11,0) av acyclovir ved subkutan injeksjon når de var 3, 10, 28 og 71 dager. av alder. De ble observert i 14 dager etter behandling og LD50-verdier ble beregnet ved Litchfield og Wilcoxon-metoden (se tabell 7 nedenfor). Denne studien ble gjort for å bestemme om alder ved eksponering påvirker den akutte toksisiteten til acyclovir; det var ingen bevis for at unge rotter var mer følsomme enn eldre rotter for de akutte toksiske effektene av acyclovir.
Det var ingen tilsynelatende sammenheng mellom lengden på overlevelse etter behandling og alder der behandlingen ble gitt. Kliniske tegn for rottene som ble behandlet ved 3 og 10 dagers alder inkluderte røde og lilla hudblemmer, blå områder, skorper, arr, nekrotisk og utslettet hud, åpne sår, kroppsskjelvinger og alopecia. Nedsatt aktivitet, tåreflåd, lukkede øyelokk, rødbrunt eller brunt materiale rundt øyne, nese og munn, ataksi, utmattelse, kroppsskjelvinger, urinflekker rundt magen eller kjønnsområdet, skorpe eller nekrotiske områder og alopecia ble observert hos rotter behandlet kl. 28 og 71 dager gammel.
Subkronisk oral toksisitetsstudie
Mus
Fire grupper hver bestående av 28 hann- og 28 hunnmus fra Charles River CD-1 (ICR) ble oralt doseret med magesonde i 33 dager med suspensjoner av acyclovir. Daglige dosenivåer var 0, 50, 150 og 450 mg/kg. Hematologiske og kliniske kjemimålinger ble gjort på ytterligere 8 hann- og 8 hunnmus per gruppe (dosert på samme måte) etter den første og fjerde uken med dosering og i løpet av den tredje uken etter dosering.
Plasmamedisinkonsentrasjoner ble målt i sammenslåtte prøver fra ytterligere 4 hann- og 4 hunnmus per gruppe på dosedag 1, 15 og 30.
Basert på foreløpige eksperimenter med rotter og mus, ble den høye dosen på 450 mg/kg valgt for å produsere de høyeste medikamentplasmanivåene som kan oppnås, på en praktisk måte, ved oral dosering i en gnagerart. Gjennomsnittlig medikamentplasmakonsentrasjon varierte fra ca. 3,4 (ved lav dose) til 11,0 (ved høy dose) μg/mL plasma én time etter oral dosering.
Ingen endringer i helse, veksthastighet, hematologi og klinisk kjemimålinger skjedde som definitivt kan tilskrives dosering med acyclovir. Grove og histopatologiske undersøkelser av 16 hann- og 16 hunnrotter fra høydose- og kontrollgruppene ved slutten av doseperioden avslørte ingenting bemerkelsesverdig.
Studier av kronisk toksisitet
Livsvarig oral toksisitetsstudie hos rotter gitt acyclovir ved gastrisk intubasjon
Charles River CD (Sprague-Dawley) rotter ble gitt suspensjoner av acyclovir ved sonde. Det var 50 hann- og 50 hunnrotter ved hvert av følgende dosenivåer: 0, 50, 150 og 450 mg/kg. Etter 30 og 52 ukers behandling ble 10 hann- og 10 hunnrotter fra hver gruppe obdusert. De gjenværende rottene ble doseret hver dag inntil naturlig dødelighet reduserte en gruppestørrelse til omtrent 20 % av antall dyr av det kjønn som var tilstede i testgruppene da studien ble startet. Alle gjenværende rotter ble drept og obdusert når grensepunktet på 20 % ble nådd. Dette var i uke 110 for hannrottene og uke 122 for hunnrottene. Vev fra kontrollrotter og de i høydosegruppen ble evaluert ved lysmikroskopi. Vev fra rotter i lav- og mellomdosegruppene med masser, knuter eller uvanlige lesjoner ble også undersøkt ved lysmikroskopi. Fikserte vev fra rotter som ble funnet døde i løpet av de første 52 ukene av studien ble også evaluert ved lysmikroskopi.
Ingen tegn på toksikose ble observert. Plasmaprøver ble samlet 1,5 timer etter dosering på dag 7, 90, 209, 369, 771 (kun for menn) og 852 (bare for kvinner). Gjennomsnittlige plasmanivåer funnet hos menn med høye doser (450 mg/kg/dag) på tidspunktene angitt ovenfor var som følger: 1,54, 1,63, 1,39, 1,60 og 1,70 μg/ml (6,84, 7,26, 6,17, 7,60 og 7 μM). . Tilsvarende gjennomsnittlige plasmanivåer for høydose-hunnene for de tilsvarende tidsperiodene var 1,76, 2,38, 2,12, 1,71 og 1,81 μg/mL (7,82, 10,58, 9,44, 7,62 og 8,03 μM). Plasmanivåer hos både menn og kvinner ved alle dosenivåer etter ett års behandling var generelt sammenlignbare med plasmanivåer oppnådd ved tidligere prøvetakinger. Verdier for laboratorietester inkludert hematologi, klinisk kjemi og oftalmoskopi var alle innenfor normalområdet. Det var ingen legemiddelinduserte grove eller mikroskopiske lesjoner, og det var ingen bevis for at acyclovir påvirket overlevelsen.
Livsvarig oral kreftfremkallende studie hos rotter
Det var ingen tegn på toksikose hos Charles River CD (Sprague-Dawley) rotter (100 rotter/kjønn/dosegruppe) gitt acyclovir ved oral sonde med 50, 150 og 450 mg/kg i en livslang oral karsinogenitetsstudie. Gjennomsnittlige plasmanivåer oppnådd hos menn med høye doser 1,5 timer etter dosering ved ulike prøvetakingstider i løpet av studien var som følger: 1,54, 1,63, 1,39, 1,60 og 1,70 μg/ml (6,84, 7,26, 6,17, 7,56 dager og 7,10 μm) 7, 90, 209, 369 og 771, henholdsvis. Tilsvarende gjennomsnittsverdier for høydose-hunnene var 1,76, 2,38, 2,12, 1,71 og 1,81 μg/ml (7,82, 10,58, 9,44, 7,62 og 8,03 μM) på henholdsvis dag 7, 92, 82, 82, 82, 82, 82, 82, 89, 82, 89, 58, 9.
Verdier for kliniske laboratorietester inkludert hematologi, klinisk kjemi, urinanalyse, kroppsvekt, matforbruk og oftalmoskopi var alle innenfor normale områder. Det var ingen legemiddelinduserte grove eller mikroskopiske lesjoner, og det var ingen bevis for at acyclovir påvirket overlevelse, tidsmessige mønstre av tumorforekomst eller tumortall for godartede eller ondartede neoplasmer.
De fleste av de relativt få rottene som ble funnet døde eller døende i løpet av de første 52 ukene av denne studien, led av doseringsulykker, noe som fremgår av postmortem funn av esophageal perforasjon som forårsaket pleural effusjon, lungebetennelse eller mediastinitt.
Livsvarig oral kreftfremkallende studie i mus
Det var ingen tegn på toksikose hos Charles River CD-1 (ICR) mus (115 mus/kjønn/dosegruppe) gitt acyclovir ved oral sonde med 50, 150 og 450 mg/kg/dag i en livslang oral karsinogenitetsstudie. Gjennomsnittlige plasmanivåer oppnådd hos menn med høye doser 1,5 timer etter dosering ved forskjellige prøvetakingstider i løpet av studien var som følger: 2,83, 3,17 og 1,82 μg/mL (12,59, 14,10 og 8,10 μM) på henholdsvis dag 90, 3165 og 5. Tilsvarende gjennomsnittsverdier for høydose hunnene var 9,81, 5,85 og 4,0 μg/mL (43,60, 26,0 og 17,79 μM).
Verdiene for kliniske laboratorietester inkludert hematologi, kroppsvekt og matforbruk var alle innenfor normale områder. Det var ingen legemiddelinduserte grove eller mikroskopiske lesjoner. Hunnmus som ble gitt 150 og 450 mg/kg acyclovir overlevde betydelig lenger enn kontroll hunnmus; overlevelse av behandlede hanner var sammenlignbar med overlevelse av kontroll hanner. Mønstre for tumorforekomst og tumortall for benigne eller ondartede neoplasmer ble ikke påvirket av behandling med acyclovir.
Kronisk 12-måneders oral toksisitetsstudie hos hunder
Renrasede Beagle-hunder ble gitt 0, 15, 45 eller 150 mg/kg/dag acyclovir hver dag i de to første ukene av en ettårig studie. Det var 9 hann- og 9 hunnhunder i hver testgruppe. Hundene fikk gelatinkapsler som inneholdt passende dose. De ble behandlet tid, derfor var dosene administrert ved hver av tre doseperioder med lik avstand 0, 5, 15 og 50 mg/kg. Dosenivåene på 45 og 150 mg/kg induserte diaré, brekninger, redusert matforbruk og vekttap hos både hann- og hunnhunder i løpet av de to første ukene av studien. Av denne grunn ble det i løpet av den tredje uken av studien besluttet å redusere mellom- og høydosenivåene til 30 og 60 mg/kg/dag (10 og 20 mg/kg tid). Den lave dosen på 15 mg/kg/dag (5 mg/kg tid) var uendret. Hunder som ble gitt 60 mg/kg/dag kastet av og til opp og hadde av og til diaré, men klarte seg bra under testens varighet, og verdier for kroppsvektsøkning og matinntak var sammenlignbare med kontrollverdier.
Under toksikose indusert av de større dosene av acyclovir, var plasmanivåene av stoffet sannsynligvis svært høye (som indikert av initiale gjennomsnittsverdier på 24,0 μg/mL (106,6 μM) for høydose menn og 17,4 μg/ml (77,2 μM) for høydose kvinner når det bestemmes 1 time etter den tredje dosen på dag 1 av studien). Målt på dag 15 var plasmanivåene av acyclovir hos høydosehunder (150 mg/kg/dag) fortsatt svært høye, men de sank senere når dosene ble redusert. Verdier for plasmanivåer etter 12 måneders behandling var generelt sammenlignbare med verdier registrert etter 1, 3 og 6 måneders behandling. Det var således ingen indikasjon på økt metabolisme av acyclovir som følge av kronisk behandling.
løpet av den 13. uken hadde noen hann- og hunnhunder ved både middels og høye doser følgende tegn: ømhet i forpotene, erosjon av tråkkeputer og brudd og løsne negler. Regenerering av tapte negler begynte noen uker senere. Negler regenerert etter 6 måneder (når 3 hanner og 3 kvinner fra hver gruppe ble drept for et midlertidig offer) og ved slutten av studien var av generelt god kvalitet. Det var aldri tegn til effekt på poter eller negler hos hunder i lavdosegruppen (15 mg/kg/dag).
Det er akseptert at skade på korialepitelet som produserer neglekeratin kan resultere i stoppet produksjon av keratin og produksjon av unormalt keratin. Den forbigående toksikose indusert av de store dosene (45 og 150 mg/kg/dag) av acyclovir gitt i løpet av de to første ukene av studien kan ha påvirket korialepitelet. Hvis det var en forbigående effekt på korialepitelet (muligens relatert til direkte effekter eller sekundært til medikamentindusert sykdom i løpet av de to første ukene av studien) kan senere tap av neglen være en følge. Det ble ikke observert noen merkbare effekter på annet keratinproduserende eller keratinholdig vev. Det bør understrekes at endringene i neglene så ut til å være relatert til den forbigående toksikose indusert av dosenivåer på 50 og 150 mg/kg/dag testet i løpet av de to første ukene av studien og ikke til 30 og 60 mg/kg. /dag dosenivåer testet etterpå.
Det var ingen viktige medikamentinduserte endringer i verdier for biokjemiske serumtester, urinanalyse og elektrokardiografiske tester utført med passende intervaller under denne studien. Verdiene for serumalbumin og totalt protein ble noe redusert hos hunder behandlet med 30 og 60 mg/kg/dag i 6 og 12 måneder. Imidlertid forble alle verdier for disse parameterne innenfor grenser som er akseptert som normale.
Med unntak av gjenværende endringer i gammelt keratin i tuppen av klørne, var det ingen tegn til behandlingsrelaterte effekter i noen av vevene som ble undersøkt ved lysmikroskopi. Det var heller ikke meningsfulle endringer i verdier for organene som ble veid ved obduksjon. Dermed ble dosenivåer opp til 60 mg/kg/dag godt tolerert i ett år. Dosenivået "ingen dose effekt" av acyclovir var 15 mg/kg/dag (5 mg/kg tid); de eneste bivirkningene ved 30 eller 60 mg/kg/dag var imidlertid endringer i negler og tråkkeputer (30 og 60 mg/kg/dag) og milde gastrointestinale tegn (60 mg/kg/dag).
Reproduksjonsstudier
Teratologi – Rotter
Acyclovir ble administrert til gravide ARS Sprague-Dawley hunnrotter ved subkutan injeksjon i løpet av organogeneseperioden (dag 6 til og med dag 15 av svangerskapet) ved dosenivåer på 0,0, 6,0, 12,5 og 25,0 mg/kg kroppsvekt to ganger daglig.
Kriterier som ble evaluert for sammensatt effekt inkluderte mors kroppsvekter, vektøkninger, utseende og oppførsel, overlevelsesrater, øyeforandringer, graviditetsrater og reproduksjonsdata. Avkoms levedyktighet og utvikling ble også evaluert.
I tillegg til målingene ovenfor, ble utpekte dyr avlivet 1 time etter den første dosen på dag 15 for å samle prøver av mors blod, fostervann og fostre for måling av medikamentkonsentrasjon. Gjennomsnittsverdier fra disse prøvene er oppført i tabell 8.
Verdiene oppnådd for plasma vil representere ca. 30 % av initiale plasmanivåer, bedømt av plasmahalveringstiden hos gnagere.
Ingen effekter som kan tilskrives administrering av acyclovir ble notert i sammenligninger av mors kroppsvektverdier, utseende og oppførsel, overlevelsesrater, graviditetsrater eller implantasjonseffektivitet. I tillegg ble det ikke observert noen forbindelsesrelaterte forskjeller i evalueringer av fosterstørrelse, kjønn og utvikling.
Selv om forekomsten av resorpsjon og føtal levedyktighet var innenfor området for normal variasjon i alle gruppene, ble det observert litt høyere forekomster av resorpsjoner hos høydosedyrene som ble avlivet på dag 15 og 19 av svangerskapet; klare doserelaterte trender oppsto imidlertid ikke.
Derfor ble acyklovir ikke ansett som teratogent eller embryotoksisk når det ble administrert til rotter i nivåer opp til 50,0 mg/kg kroppsvekt per dag under organogenese.
Teratologi – kaniner
En teratologistudie ble utført på hvite kaniner fra New Zealand ved bruk av i hovedsak samme eksperimentelle design som hos rotter, bortsett fra at doseringen var fra dag 6 til dag 18 av svangerskapet. Også innsamling av fostre, fostervann og prøver av mors blod skjedde på dag 18 i stedet for dag 15.
Ingen tegn på maternell toksisitet ble observert ved noen dose, men det var en statistisk signifikant (p
Konsentrasjoner av acyklovir ble påvist i plasma- og fostervannsprøver, samt i homogenater av fostervev. Alle prøvene ble tatt en time etter første dose på dag 18 av svangerskapet. Legemiddelkonsentrasjoner i fostervann var vesentlig høyere enn i plasma (se tabell 9).
Reproduksjon – Fertilitet
Acyclovir ble vist ikke å svekke fertilitet eller reproduksjon i grupper på 15 hann- og 30 hunnmus i en to-generasjons fertilitetsstudie. Musene i denne studien ble gitt acyclovir ved gastrisk intubasjon ved dosenivåer på 50, 150 og 450 mg/kg/dag. Hannene ble doseret i 64 påfølgende dager før paring og hunnene i 21 dager før paring.
en fertilitetsstudie med rotter hvor grupper på 20 hann- og 20 hunnrotter ble gitt 0, 12,5, 25,0 og 50,0 mg/kg/dag ved subkutan injeksjon, ble det vist at acyclovir ikke hadde noen effekt på paring eller fertilitet. Hannene ble doseret i 60 dager før paring og til paringsplanen deres var fullført. Hunnrotter ble doseret i 14 dager før paring og frem til dag 7 av svangerskapet. Ved 50 mg/kg/dag sc var det en statistisk signifikant økning i post-implantasjonstap, men ingen samtidig reduksjon i kullstørrelse.
Hos 25 hunnkaniner behandlet subkutant med 50 mg/kg/dag acyclovir på dag 6 til 18 av svangerskapet, var det en statistisk signifikant reduksjon i implantasjonseffektiviteten, men ingen samtidig reduksjon i kullstørrelsen. Det var også en doserelatert økning i antall fostre med overtallige ribbein i alle legemiddelbehandlede grupper. Denne økningen var ikke doserelatert når forekomsten av overtallige ribbein per kull ble undersøkt.
Hos 15 hunnkaniner behandlet intravenøst med 50 mg/kg/dag acyclovir på dag 6 til 18 av svangerskapet, var det ingen effekt på verken implantasjonseffektivitet eller kullstørrelse.
I en peri- og postnatal rottestudie (20 hunnrotter per gruppe) ble acyclovir gitt subkutant med 0, 12,5, 25 og 50 mg/kg/dag fra 17 dagers svangerskap til 21 dager postpartum. Ved 50 mg/kg/dag sc var det en statistisk signifikant reduksjon i gruppens gjennomsnittlige antall corpora lutea, totale implantasjonssteder og levende fostre i F1-generasjonen. Selv om det ikke var statistisk signifikant, var det også en doserelatert reduksjon i gruppens gjennomsnittlige antall levende fostre og implantasjonssteder ved 12,5 mg/kg/dag og 25 mg/kg/dag sc.
en studie med 5 hunnkaniner med doseområde, forårsaket intravenøs administrering av acyclovir i en dose på 100 mg/kg/dag fra dag 6 til 8 av svangerskapet, en dose kjent for å forårsake obstruktiv nefropati, en signifikant økning i føtale resorpsjoner og en tilsvarende nedgang i kullstørrelsen. Ved en maksimal tolerert intravenøs dose på 50 mg/kg/dag hos kaniner var det ingen medikamentrelaterte reproduksjonseffekter.
I en subkronisk toksisitetsstudie der grupper på 20 hann- og 20 hunnrotter ble gitt intraperitoneale doser av acyclovir på 0, 20, 80 eller 320 mg/kg/dag i en måned, og fulgt i en måned etter dose, var det testikkel. atrofi. Noen histologiske bevis på gjenvinning av sædproduksjon var tydelig 30 dager etter dose, men dette var ikke tilstrekkelig tid til å demonstrere full reversibilitet.
Grupper på 25 hann- og 25 hunnrotter ble administrert intraperitoneale doser av acyclovir ved 0, 5, 20 eller 80 mg/kg/dag i 6 måneder. Ti hann- og 10 hunnrotter i hver gruppe ble fortsatt udosert i 13 uker. Testikkelatrofi var begrenset til høydoserotter gitt 80 mg/kg/dag i 6 måneder. Organvektdata og lysmikroskopi definerte full reversibilitet av testikkelatrofien ved slutten av restitusjonsperioden etter dose.
I en 31-dagers hundestudie (16 hanner og 16 hunner per gruppe) der acyclovir ble administrert intravenøst i nivåer på 50, 100 og 200 mg/kg/dag, var testiklene normale hos hunder ved 50 mg/kg. Doser på 100 eller 200 mg/kg/dag forårsaket død hos noen hunder på grunn av cytostatiske effekter (benmarg og gastrointestinalt epitel) og aspermiske testikler eller testikler med spredte aspermiske tubuli. Det kan ikke utelukkes at testikkelforandringen kan ha vært primær, men lignende endringer kan observeres sekundært til alvorlig stress hos døende hunder.
Utviklingstoksisitetsstudier
Neonatale rotter - subkronisk studie
Acyclovir oppløst i 0,4 % sterilt saltvann ble gitt ved subkutan injeksjon til Charles River CD (Sprague-Dawley) neonatale rotter i 19 påfølgende dager, med start på den tredje dagen etter fødselen. Dosenivåene som ble testet var 0, 5, 20 og 80 mg/kg kroppsvekt. Det var 12 kull (hver bestående av 5 hann- og 5 kvinnelige nyfødte som ammer den naturlige damen) på hvert dosenivå. Demningene ble ikke behandlet. Nyfødte ble fjernet fra hver gruppe for obduksjon og mikroskopisk evaluering av et bredt spekter av vev, inkludert øyne og flere deler av hjernen, etter at de hadde blitt behandlet i 5, 12 eller 19 dager og etter en 3-ukers medikamentfri periode etter dose ( da de var 45 dager gamle). Hematologiske (hemoglobin, pakket cellevolum, RBC, WBC og differensielle celletall) og klinisk kjemi (BUN) tester ble utført etter 16 dagers behandling og gjentatt 18 dager etter siste (19.) dose ble gitt.
Blod ble samlet fra noen nyfødte 30 minutter etter behandling på dag 1, på dag 9 og ved slutten av doseperioden for å bestemme konsentrasjonen av acyklovir i plasma. Den største konsentrasjonen av acyklovir i plasma var 99,1 μg/ml (440,5 μM) funnet i sammenslått plasma samlet fra 6 nyfødte kvinnelige høydoser (80 mg/kg) 30 minutter etter den første dosen ble gitt. Behandling med acyklovir økte ikke dødeligheten i nyfødtperioden.
Rotter i lavdosegruppen gikk opp like mye kroppsvekt som de respektive kontrollrottene. Signifikante (p
Øyeundersøkelser og lysmikroskopi avslørte ikke uønskede effekter på okulær utvikling. Det bør understrekes at det ikke var noen morfologiske eller funksjonelle bevis for uønskede effekter på utviklende hjerne eller andre deler av sentralnervesystemet. Således er acyclovir tydelig annerledes enn cytosin-arabinosid som ble rapportert å gi fremtredende cerebellar og retinal dysplasi hos neonatale rotter.
Mutagenitet og andre korttidsstudier
Acyclovir har blitt testet for mutagent potensial i en rekke in vitro og in vivo systemer: 10. november 2014 Side 27 av 38
Mikrobiell
Acyclovir ble testet for mutagen aktivitet i Ames Salmonella plate-analysen; i en preinkubasjonsmodifikasjon av Ames-analysen; i Rosenkrantz E. coli polA+/polA- DNA reparasjonsanalyse; og i eukaryoten S. cerevisiae, D-4. Alle studier ble utført både i nærvær og fravær av eksogen pattedyr metabolsk aktivering. Acyclovir ga ingen positive responser i noen av disse systemene.
De tidligere Salmonella-studiene ble utvidet til ekstremt høye konsentrasjoner for å oppnå toksisitet. Ingen positive effekter ble observert verken i nærvær eller fravær av eksogen metabolsk aktivering av pattedyr, ved konsentrasjoner av acyklovir opp til 300 mg/plate eller 80 mg/ml.
Pattedyrsystemer
Acyclovir ble testet for mutagen aktivitet i dyrkede L5178Y muselymfomceller, heterozygote ved tymidinkinase (TK) locus, ved å måle fremadmutasjonshastigheten til TK-mangel (TK+/- → TK-/-; ytterligere studier ble utført ved HGPRT locus og ved Ouabain-resistensmarkøren i disse samme cellene. Alle studier ble utført i nærvær og i fravær av eksogen pattedyr metabolsk aktivering. Testforbindelsen var mutagent på TK locus ved høye konsentrasjoner (400 -2.400 μg/mL) (Til sammenligning er den øvre grensen for toppplasmanivåer av acyclovir etter oral dosering på 200 mg q4h 0,9 μg/ml.) Den var negativ ved HGPRT-lokuset og Ouabain-resistensmarkøren. Identiske resultater ble oppnådd med og uten metabolsk aktivering.
Inkonklusive resultater uten tilsynelatende doserelatert respons ble oppnådd når acyclovir-mutagenisitet ble studert ved hver av 3 loci (APRT, HGPRT og Ouabain-resistens) i kinesisk hamster-ovarieceller (CHO), både i nærvær og fravær av eksogen metabolsk aktivering.
Acyclovir, i en konsentrasjon på 50 μg/mL (222 μM) for en 72-timers eksponering, har vist seg å forårsake en statistisk signifikant økning i forekomsten av morfologisk transformerte foci som følge av behandling av BALB/C-3T3-celler in vitro i fravær av eksogen metabolsk aktivering. De morfologisk transformerte fociene har vist seg å vokse som svulster etter transplantasjon til immunsupprimerte, syngene, avventende mus. Tumorvev ble diagnostisert som enten udifferensierte sarkomer eller lymfosarkomer.
Acyclovir, ved konsentrasjoner mellom 8 og 64 μg/ml i 18 timers eksponering, induserte ingen morfologisk transformerte foci blant C3H/10T ½-celler behandlet in vitro i fravær av eksogen metabolsk aktivering.
Acyclovir, ved konsentrasjoner på 62,5 og 125 μg/ml for en 48-timers eksponering, induserte ingen kromosomavvik i dyrkede humane lymfocytter i fravær av eksogen metabolsk aktivering. Ved høyere konsentrasjoner, 250 og 500 μg/ml i 48 timers eksponering, forårsaket acyclovir en signifikant økning i forekomsten av kromosombrudd. Det var også en signifikant doserelatert reduksjon i mitotisk indeks ved eksponering for acyklovir.
Acyclovir, ved doser på 25 og 50 mg/kg/dag ip i 5 påfølgende dager, ga ikke en dominerende dødelig effekt hos BKA (CPLP) hannmus. Videre var det ingen bevis for en dominerende dødelig effekt på Charles River CD-1 (ICR) hann- og hunnmus behandlet oralt med dosenivåer på 50, 150 og 450 mg/kg/dag som oppsummert for togenerasjons reproduksjons-/fertilitetsstudien .
Acyclovir, ved enkelt intraperitoneale doser på 25, 50 og 100 mg/kg, klarte ikke å indusere kromosomavvik i benmargsceller hos kinesiske hamstere når de ble undersøkt 24 timer etter dosering. Ved høyere nefrotoksiske doser (500 og 1000 mg/kg) ble det sett en blastogen effekt. (En intraperitoneal dose på 500 mg/kg gir gjennomsnittlige maksimale plasmanivåer hos kinesiske hamstere på 611 μg/mL (2,72 mM), som er 680 ganger høyere enn den øvre grensen for maksimale plasmanivåer hos mennesker under oral dosering på 200 mg q4h).
Acyclovir, ved intravenøse enkeltdoser på 25, 50 og 100 mg/kg, klarte ikke å indusere kromosomavvik i benmargsceller hos hann- og hunnrotter når de ble undersøkt 6, 24 og 48 timer etter behandling.
Dermed viste alle disse studiene at acyclovir ikke forårsaker enkeltgenmutasjoner, men er i stand til å bryte kromosomer.
Immunotoksikologiske studier
Acyclovir ble utsatt for en rekke in vitro og in vivo immunologiske tester.
I to in vivo-tester, lymfocyttmediert cytotoksisitet og nøytrofil kjemotaksi, viste acyclovir ingen hemmende effekter ved konsentrasjoner så høye som 135 μg/ml (600 μM). Forbindelsen hemmet rosettdannelse med omtrent 50 % ved 0,9 μg/ml (4 μM).
fire in vivo-tester på mus som målte cellemediert immunitet (komplementavhengig cellulær cytotoksisitet, komplement-uavhengig cellulær cytotoksisitet, forsinket overfølsomhet og graft vs. vert reaksjon) viste acyclovir ingen hemmende effekter ved enkeltdoser opp til 200 mg/kg gitt på dag 2 etter antigen stimulering.
Fire daglige doser på 100 mg/kg/dag hadde ingen signifikant effekt på Jerne hemolysin plakk eller sirkulerende antistoff på dag 7 etter antigen stimulering. Når Jerne-hemolysin-plakkene og antistofftitere ble undersøkt fire dager etter antigenpåvirkning og én dag etter siste medikamentdose, viste 100 mg/kg kun en svak undertrykkende effekt. Imidlertid ga 200 mg/kg noe vekttap (-2,2 g), en moderat reduksjon i antall Jerne-hemolysinplakk (PFC/milt ble redusert til 33 % av kontrollen, PFC/107 WBC til 46,5 % av kontrollen). Det var imidlertid bare en liten reduksjon i den sirkulerende hemagglutinintiteren (fra 8,3 til 6,5) og den sirkulerende hemolysintiteren (fra 9,5 til 8,3) ved 200 mg/kg.
eksperimenter på mus designet for å teste om acyclovir ville potensere den immunsuppressive effekten av azatioprin på antistoffdannelse, ble det funnet at effekten av de to legemidlene ikke var mer enn additiv. Bare 200 mg/kg dose av acyclovir viste en økt suppresjon av antistoffrespons når det ble gitt i kombinasjon med azatioprin i doser over 25 mg/kg.
Studier ble utført for å evaluere påvirkningen av acyclovir in vitro på human lymfocyttfunksjon. Hemmende effekter på blastogenese ble kun sett i analyser som undersøkte toppkonsentrasjoner av potente mitogener, fytohemagglutinin (PHA) og concanavalin A (Con A), og bare ved konsentrasjoner av medikament over 50 μg/mL (222 μM) og var mye mindre med monilia og tetanustoksoidantigener, hvor den blastogene responsen er karakteristisk mindre kraftig. Det var svært liten effekt på cytotoksisitet eller LIF-produksjon bortsett fra ved konsentrasjoner på 200 μg/mL (890 μM) hvor det allerede er påvist en direkte cytotoksisk effekt. Disse hemmende konsentrasjonene er langt over forventede nivåer fra doser valgt for klinisk bruk og over 1000 ganger høyere enn konsentrasjonen som kreves for å hemme herpesvirusformering in vitro.
Effekten av acyclovir på humane celler ble målt. En konsentrasjon på 11,2 - 22,5 μg/mL (50-100 μM) hemmer delingen av fibroblaster i varierende grad, avhengig av den eksperimentelle designen og sammenløpet av monolaget. Størrelsen på denne effekten var mindre enn den forårsaket av adenin-arabinosid eller humant leukocyttinterferon når disse tre antivirale midlene ble sammenlignet ved klinisk relevante konsentrasjoner. Acyclovir hemmet også tymidininkorporering av mononukleære celler i perifert blod stimulert av PHA eller tre forskjellige herpesvirusantigener. En lineær dose-responskurve ble observert med disse cellene, og deres spredning ble 50 % hemmet av 22,5 μg/ml (100 μM) acyclovir. Inhibering ble utøvd på T-celleproliferasjon uten tilsynelatende effekt på frigjøring av lymfokiner eller på monocyttfunksjon.
Det bør også nevnes at det ikke var bevis for uønskede effekter på immunsystemet i de detaljerte subkroniske og kroniske dyreforsøkene som ble dekket tidligere i dette sammendraget bortsett fra ved for høye doser (50 til 100 mg/kg to ganger daglig) hos hunder med markert lymfoid hypoplasi skjedde.
REFERANSER
1. Balfour HH, Jr., Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD et al. Acyclovir behandling av varicella hos ellers friske barn. J Pediatr 1990; 116(4):633-639.
2. Balfour HH, Jr., Rotbart HA, Feldman S, Dunkle LM, Feder HM, Jr., Prober CG et al. Acyclovir behandling av varicella hos ellers friske ungdommer. The Collaborative Acyclovir Varicella Study Group. J Pediatr 1992; 120(4 Pt 1):627-633.
3. Barry DW, Blum MR. Antivirale legemidler: acyclovir, i nyere fremskritt innen klinisk farmakologi. Turner P, Shand DG (red) Churchill Livingstone, Edinburgh 1983.
4. Barry DW, Nusinoff-Lehrman S. Viral resistens i klinisk praksis: sammendrag av fem års erfaring med acyclovir. Farmakologiske og kliniske tilnærminger til herpesvirus og viruskjemoterapi, Aiso, Japan, 10.–13. september 1984.
5. Barry DW, Nusinoff-Lehrman S, Ellis MN, Biron KK, Furman PA. Viral resistens, klinisk erfaring. Scand J Infect Dis Suppl 1985; 47:155-164.
6. Barry DW, Nusinoff-Lehrman S. Viral resistens i klinisk praksis: sammendrag av fem års erfaring med acyclovir. Proceedings of the International Symposium on Pharmacological and Clinical approachs to Herpes Viruses and Virus Chemotherapy, Elsever, Amsterdam 1985;269-270.
7. Biron KK, Elion GB. Effekt av acyclovir kombinert med andre antiherpetiske midler på varicella zoster-virus in vitro. Am J Med 1982; 73(lA):54-57.
8. Boelaert J, Schurgers M, Daneels R, Van Landuyt HW, Weatherley BC. Multippel dose farmakokinetikk av intravenøs acyclovir hos pasienter på kontinuerlig ambulatorisk peritonealdialyse. J Antimicrob Chemother 1987; 20(1):69-76.
9. Bryson YJ, Dillon M, Lovett M, Acuna G, Taylor S, Cherry JD et al. Behandling av første episoder av genital herpes simplex-virusinfeksjon med oral acyclovir. En randomisert dobbeltblind kontrollert studie i normale forsøkspersoner. N Engl J Med 1983; 308(16):916-921.
10. Burns WH, Saral R, Santos GW, Laskin OL, Lietman PS, McLaren C et al. Isolering og karakterisering av resistent Herpes simplex-virus etter acyclovirbehandling. Lancet 1982; 1(8269):421-423.
11. Christophers J, Sutton RN. Karakterisering av acyklovir-resistente og sensitive kliniske herpes simplex-virusisolater fra en immunkompromittert pasient. J Antimicrob Chemother 1987; 20(3):389-398.
12. Cole NL, Balfour HH, Jr. Varicella-Zoster-virus blir ikke mer motstandsdyktig mot acyclovir under behandlingen. J Infect Dis 1986; 153(3):605-608.
13. Collins P, Bauer DJ. Aktiviteten in vitro mot herpesvirus av 9-(2-hydroksyetoksymetyl)guanin (acykloguanosin), et nytt antiviralt middel. J Antimicrob Chemother 1979; 5(4):431-436.
14. Collins P, Oliver NM. Sensitivitetsovervåking av herpes simplex-virusisolater fra pasienter som får acyclovir. J Antimicrob Chemother 1986; 18 Suppl B:103-112.
15. Collins P. Viral sensitivitet etter introduksjonen av acyclovir. Am J Med 1988; 85(2A):129-134.
16. Collins P, Larder BA, Oliver NM, Kemp S, Smith IW, Darby G. Karakterisering av en DNA-polymerasemutant av herpes simplex-virus fra en alvorlig immunkompromittert pasient som får acyclovir. J Gen Virol 1989; 70 (Pt 2):375-382.
17. Crumpacker CS, Schnipper LE, Zaia JA, Levin MJ. Veksthemming av acycloguanosin av herpesvirus isolert fra menneskelige infeksjoner. Antimicrob Agents Chemother 1979; 15(5):642-645.
18. Crumpacker CS, Schnipper LE, Marlowe SI, Kowalsky PN, Hershey BJ, Levin MJ. Resistens mot antivirale legemidler av herpes simplex-virus isolert fra en pasient behandlet med acyclovir. N Engl J Med 1982; 306(6):343-346.
19. Darby G, Inglis MM, Larder BA. Mekanismer for resistens mot nukleosidanalog-hemmere av herpes simplex-virus. 6th Int Congr Virol 1984;(Abstract #W34-5).
20. De Clercq E, Descamps J, Verhelst G, Walker RT, Jones AS, Torrence PF et al. Sammenlignende effekt av antiherpesmedisiner mot forskjellige stammer av herpes simplex-virus. J Infect Dis 1980; 141(5):563-574.
21. De Clercq E. Sammenlignende effekt av antiherpesmedisiner i forskjellige cellelinjer. Antimicrob Agents Chemother 1982; 21(4):661-663.
22. Dekker C, Ellis MN, McLaren C, Hunter G, Rogers J, Barry DW. Virusresistens i klinisk praksis. J Antimicrob Chemother 1983; 12 Suppl B:137-152.
23. Douglas JM, Davis LG, Remington ML, Paulsen CA, Perrin EB, Goodman P et al. En dobbeltblind, placebokontrollert studie av effekten av kronisk administrert oral acyclovir på sædproduksjon hos menn med hyppig tilbakevendende genital herpes. J Infect Dis 1988 Mar; 157:588-93.
24. Douglas JM, Critchlow C, Benedetti J, Mertz GJ, Connor JD, Hintz MA et al. En dobbeltblind studie av oral acyclovir for undertrykkelse av tilbakefall av genital herpes simplex virusinfeksjon. N Engl J Med 1984; 310(24):1551-1556.
25. Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM, Jr., Feldman S et al. En kontrollert studie av acyclovir for vannkopper hos normale barn. N Engl J Med 1991; 325(22):1539-1544.
26. Ellis MN, Keller PM, Martin JL, Strauss SE, Nusinoff-Lehrman S etal. Karakterisering av et HSV-2 klinisk isolat som inneholder en ACV-resistent mutant som produserer en tymidinkinase med endret substratspesifisitet. Ninth Int Herpesvirus Workshop, Seattle, Washington, 24.–29. august 1984.
27. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Straus SE et al. Klinisk isolat av herpes simplex virus type 2 som induserer en tymidinkinase med endret substratspesifisitet. Antimicrob Agents Chemother 1987; 31(7):1117-1125.
28. Englund JA, Zimmerman ME, Swierkosz EM, Goodman JL, Scholl DR, Balfour HH, Jr. Herpes simplex-virus resistent mot acyclovir. En studie på et tertiærsenter. Ann Intern Med 1990; 112(6):416-422.
29. Erlich KS, Jacobson MA, Koehler JE, Follansbee SE, Drennan DP, Gooze L et al. Foscarnet-terapi for alvorlige acyclovir-resistente herpes simplex-virus type 2-infeksjoner hos pasienter med ervervet immunsviktsyndrom (AIDS). En ukontrollert prøvelse. Ann Intern Med 1989; 110(9):710-713.
30. Erlich KS, Mills J, Chatis P, Mertz GJ, Busch DF, Follansbee SE et al. Acyclovir-resistente herpes simplex-virusinfeksjoner hos pasienter med ervervet immunsviktsyndrom. N Engl J Med 1989; 320(5):293-296.
31. Field HJ, Darby G, Wildy P. Isolering og karakterisering av acyclovir-resistente mutanter av herpes simplex-virus. J Gen Virol 1980; 49(1):115-124.
32. Felt HJ. Problemet med medikamentindusert resistens i virus, i problemer med antiviral terapi. Stuart-Harris CH, Oxford J (Eds) Academic Press, London 1983.
33. Fyfe K. Gjentakelsesmønstre av genital herpes etter opphør av mer enn 5 år med kronisk acyclovir-undertrykkelse. VIII Int Conf AIDS/III Std Wrld Cong 1992;(B240).
34. Huff JC, Bean B, Balfour HH, Jr., Laskin OL, Connor JD, Corey L et al. Terapi av herpes zoster med oral acyclovir. Am J Med 1988; 85(2A):84-89.
35. Jacobson MA, Berger TG, Fikrig S, Becherer P, Moohr JW, Stanat SC et al. Acyclovir-resistent varicella zoster-virusinfeksjon etter kronisk oral acyclovir-behandling hos pasienter med ervervet immunsviktsyndrom (AIDS). Ann Intern Med 1990; 112(3):187-191.
36. Kaplowitz LG, Baker D, Gelb L, Blythe J, Hale R, Frost P et al. Langvarig kontinuerlig acyklovirbehandling av normale voksne med hyppig tilbakevendende genital herpes simplex-virusinfeksjon. Acyclovir-studiegruppen. JAMA 1991; 265(6):747-751.
37. Krasny HC, Liao SH, de Miranda P, Laskin OL, Whelton A, Lietman PS. Påvirkning av hemodialyse på acyklovirs farmakokinetikk hos pasienter med kronisk nyresvikt. Am J Med 1982; 73(1A):202-204.
38. Kurtz T. Sikkerhet og effekt av langvarig undertrykkende cyklovirbehandling av hyppig tilbakevendende genital herpes: resultater for år 5. 30th Intersci Conf Antimicrob Agents Chemother 1990;270.
39. Laskin OL, Longstreth JA, Whelton A, Krasny HC, Keeney RE, Rocco L et al. Effekt av nyresvikt på farmakokinetikken til acyklovir. Am J Med 1982; 73(1A):197-201.
40. Lau RJ, Emery MG, Galinsky RE. Uventet akkumulering av acyclovir i morsmelk med estimering av spedbarnseksponering. Obstet Gynecol 1987; 69(3 Pt 2):468-471.
41. Lehrman SN, Douglas JM, Corey L, Barry DW. Tilbakevendende genital herpes og undertrykkende oral acyclovirbehandling. Sammenheng mellom klinisk utfall og in vitro legemiddelsensitivitet. Ann Intern Med 1986; 104(6):786-790.
42. Marlowe S, Douglas J, Corey L, Schnipper L, Crumpacker C. Sensitivitet av HSV genitale isolater etter oral acyclovir. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.–10. oktober 1984.
43. Mattison HR, Reichman RC, Benedetti J, Bolgiano D, Davis LG, Bailey-Farchione A et al. Dobbeltblind, placebokontrollert studie som sammenligner langvarig undertrykkende med kortsiktig oral acyclovirbehandling for behandling av tilbakevendende genital herpes. Am J Med 1988; 85(2A):20-25.
44. McLaren C, Sibrack CD, Barry DW. Spektrum av følsomhet for acyclovir av kliniske isolater av herpes simplex-virus. Am J Med 1982; 73(lA):376-379.
45. McLaren C, Ellis MN, Hunter GA. En kolorimetrisk analyse for måling av følsomheten til herpes simplex-virus for antivirale midler. Antiviral Res 1983; 3(4):223-234.
46. McLaren C, Corey L, Dekket C, Barry DW. In vitro følsomhet for acyclovir i genital herpes simplex-virus fra acyclovir-behandlede pasienter. J Infect Dis 1983; 148(5):868-875.
47. Mertz GJ, Critchlow CW, Benedetti J, Reichman RC, Dolin R, Connor J et al. Dobbeltblind placebokontrollert utprøving av oral acyclovir i første episode av genital herpes simplex-virusinfeksjon. JAMA 1984; 252(9):1147-1151.
48. Mertz GJ, Jones CC, Mills J, Fife KH, Lemon SM, Stapleton JT et al. Langvarig acyclovir-undertrykkelse av hyppig tilbakevendende genital herpes simplex-virusinfeksjon. En multisenter dobbeltblindet prøveversjon. JAMA 1988; 260(2):201-206.
49. Mertz GJ, Eron L, Kaufman R, Goldberg L, Raab B, Conant M et al. Langvarig kontinuerlig versus intermitterende oral acyclovirbehandling hos normale voksne med hyppig tilbakevendende genital herpes simplex-virusinfeksjon. Am J Med 1988; 85(2A):14-19.
50. Meyer LJ, de Miranda P, Sheth N, Spruance S. Acyclovir in human brystmelk. Am J Obstet Gynecol 1988; 158(3 Pt 1):586-588.
51. Mindel A, Weller IV, Faherty A, Sutherland S, Hindley D, Fiddian AP et al. Profylaktisk oral acyclovir ved tilbakevendende genital herpes. Lancet 1984; 2(8394):57-59.
52. Morton P, Thomson AN. Oral acyclovir i behandling av herpes zoster i allmennpraksis. NZ Med J 1989; 102(863):93-95.
53. Naib ZM, Nahmias AJ, Josey WE, Zaki SA. Forholdet mellom cytohistopatologi av genital herpesvirusinfeksjon og cervikal anaplasi. Cancer Res 1973; 33(6):1452-1463.
54. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K et al. Effekten av oral acyclovir i behandlingen av initial og tilbakevendende genital herpes. Lancet 1982; 2(8298):571-573.
55. Nusinoff-Lehrman S, Hunter G, Rogers J, Corey L, Davis G. In vitro acyclovir-sensitiviteten til herpesvirus utslettes av pasienter som får undertrykkende oral terapi. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8.-10. oktober 1984;(Abstract #1015).
56. O'Brien JJ, Campoli-Richards DM. Acyclovir. En oppdatert gjennomgang av dens antivirale aktivitet, farmakokinetiske egenskaper og terapeutisk effekt. Drugs 1989; 37(3):233-309.
57. Pahwa S, Biron K, Lim W, Swenson P, Kaplan MH, Sadick N et al. Kontinuerlig varicella-zoster-infeksjon assosiert med acyclovirresistens hos et barn med AIDS. JAMA 1988; 260(19):2879-2882.
58. Parker AC, Craig JI, Collins P, Oliver N, Smith I. Acyclovir-resistent herpes simplex-virusinfeksjon på grunn av endret DNA-polymerase. Lancet 1987; 2(8573):1461.
59. Parris DS, Harrington JE. Herpes simplex-virusvarianter som begrenser høye konsentrasjoner av acyclovir finnes i kliniske isolater. Antimicrob Agents Chemother 1982; 22(1):71-77.
60. Preblud SR, Arbeter AM, Proctor EA, Starr SE, Plotkin SA. Mottakelighet av vaksinestammer av varicella-zoster-virus for antivirale forbindelser. Antimicrob Agents Chemother 1984; 25(4):417-421.
61. Reichman RC, Badger GJ, Mertz GJ, Corey L, Richman DD, Connor JD et al. Behandling av tilbakevendende genital herpes simplex-infeksjoner med oral acyclovir. En kontrollert prøvelse. JAMA 1984; 251(16):2103-2107.
62. Shah GM, Winer RL, Krasny HC. Acyclovir farmakokinetikk hos en pasient på kontinuerlig ambulatorisk peritonealdialyse. Am J Kidney Dis 1986; 7(6):507-510.
63. Sibrack CD, Gutman LT, Wilfert CM, McLaren C, St Clair MH, Keller PM et al. Patogenisitet av acyclovir-resistent herpes simplex-virus type 1 fra et immundefekt barn. J Infect Dis 1982; 146(5):673-682.
64. Straus SE, Seidlin M, Takiff H, Jacobs D, Bowen D, Smith HA. Oral acyclovir for å undertrykke tilbakevendende herpes simplex-virusinfeksjoner hos immundefekte pasienter. Ann Intern Med 1984; 100(4):522-524.
65. Straus SE, Takiff HE, Seidlin M, Bachrach S, Lininger L, DiGiovanna JJ et al. Undertrykkelse av ofte tilbakevendende genital herpes. En placebokontrollert dobbeltblind studie av oral acyclovir. N Engl J Med 1984; 310(24):1545-1550.
66. Straus SE, Croen KD, Sawyer MH, Freifeld AG, Felser JM, Dale JK et al. Acyclovir undertrykkelse av hyppig tilbakevendende genital herpes. Effekt og avtagende behov i løpet av påfølgende år med behandling. JAMA 1988; 260(15):2227-2230.
67. Vinckier F, Boogaerts M, De Clerck D, De Clercq E. Kronisk herpetisk infeksjon hos en immunkompromittert pasient: rapport om et tilfelle. J Oral Maxillofac Surg 1987; 45(8):723-728.
68. Wade JC, Newton B, McLaren C, Flournoy N, Keeney RE, Meyers JD. Intravenøs acyclovir for å behandle mukokutan herpes simplex-virusinfeksjon etter margtransplantasjon: en dobbeltblind studie. Ann Intern Med 1982; 96(3):265-269.
69. Wade JC, McLaren C, Meyers JD. Frekvens og betydning av acyklovir-resistent herpes simplex-virus isolert fra margtransplanterte pasienter som får flere behandlingskurer med acyclovir. J Infect Dis 1983; 148(6):1077-1082.
PASIENTINFORMASJON
Pasienter blir bedt om å rådføre seg med legen sin dersom de opplever alvorlige eller plagsomme bivirkninger, de blir gravide eller har tenkt å bli gravide, de har tenkt å amme mens de tar oralt administrert ZOVIRAX (acyclovir), eller de har andre spørsmål.
Pasienter bør rådes til å opprettholde tilstrekkelig hydrering.
