Sustiva 200mg, 600mg Efavirenz Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Sustiva 600mg og hvordan brukes det?
Sustiva er et reseptbelagt legemiddel som brukes til å behandle symptomene på HIV-infeksjon. Sustiva kan brukes alene eller sammen med andre medisiner.
Sustiva tilhører en klasse legemidler som kalles HIV, NNRTIs.
Det er ikke kjent om Sustiva er trygt og effektivt hos barn yngre enn 3 måneder.
Hva er de mulige bivirkningene av Sustiva?
Sustiva kan forårsake alvorlige bivirkninger, inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . feber, . sår hals, . brennende øyne, . hudsmerter, . rødt eller lilla hudutslett med blemmer og avskalling, . anfall, . hallusinasjoner, . problemer med å konsentrere seg, . problemer med å snakke eller bevege seg (kan oppstå måneder eller år etter at du har startet medisinen), . svimmelhet, . døsighet, . forvirring, . problemer med å konsentrere seg, . merkelige drømmer, . søvnløshet, . problemer med tale, . problemer med balansen eller muskelbevegelsen, . angst, . paranoia, . uvanlig oppførsel, . føler seg trist eller håpløs, . selvmordstanker, . kvalme, . magesmerter, . tap av Appetit, . mørk urin, . leirefarget avføring, . gulfarging av hud eller øyne (gulsott), . nattesvette, . hovne kjertler, . forkjølelsessår, . hoste, . hvesing, . diaré, . vekttap, . problemer med å svelge, . problemer med balanse eller øyebevegelser, . svakhet, . stikkende følelse, . hevelse i nakken eller halsen (forstørret skjoldbruskkjertel), . menstruasjonsforandringer, og . maktesløshet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Sustiva inkluderer:
- . kvalme, . oppkast, . svimmelhet, . døsighet, . problemer med å konsentrere seg, . utslett, . hodepine, . tretthet, . søvnproblemer (søvnløshet), . merkelige drømmer, og . endringer i form eller plassering av kroppsfett (spesielt i armer, ben, ansikt, nakke, bryster og midje)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Sustiva. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
SUSTIVA® (efavirenz) er en HIV-1-spesifikk, ikke-nukleosid, revers transkriptasehemmer (NNRTI). Efavirenz er kjemisk beskrevet som (S)-6-klor-4-(cyklopropyletynyl)-1,4-dihydro4-(trifluormetyl)-2H-3,1-benzoksazin-2-on. Dens empiriske formel er C14H9ClF3NO2 og dens strukturformel er:
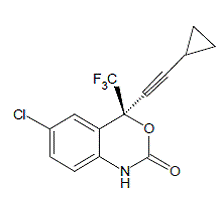
Efavirenz er et hvitt til svakt rosa krystallinsk pulver med en molekylmasse på 315,68. Det er praktisk talt uløselig i vann (
Kapsler
SUSTIVA er tilgjengelig som kapsler for oral administrering som inneholder enten 50 mg eller 200 mg efavirenz og følgende inaktive ingredienser: laktosemonohydrat, magnesiumstearat, natriumlaurylsulfat og natriumstivelsesglykolat. Kapselskallet inneholder følgende inaktive ingredienser og fargestoffer: gelatin, natriumlaurylsulfat, titandioksid og/eller gult jernoksid. Kapselskallene kan også inneholde silisiumdioksid. Kapslene er trykt med blekk som inneholder carmine 40 blue, FD&C Blue No. 2 og titandioksid.
Nettbrett
SUSTIVA 600mg er tilgjengelig som filmdrasjerte tabletter for oral administrering som inneholder 600 mg efavirenz og følgende inaktive ingredienser: kroskarmellosenatrium, hydroksypropylcellulose, laktosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose og natriumlaurylsulfat. Filmbelegget inneholder Opadry Yellow og Opadry Clear. Tablettene er polert med karnaubavoks og trykket med lilla blekk, Opacode WB.
INDIKASJONER
SUSTIVA® (efavirenz) i kombinasjon med andre antiretrovirale midler er indisert for behandling av humant immunsviktvirus type 1 (HIV-1)-infeksjon hos voksne og pediatriske pasienter som er minst 3 måneder gamle og som veier minst 3,5 kg.
DOSERING OG ADMINISTRASJON
Leverfunksjon
Overvåk leverfunksjonen før og under behandling med SUSTIVA [se ADVARSLER OG FORHOLDSREGLER ]. SUSTIVA 600mg anbefales ikke til pasienter med moderat eller alvorlig nedsatt leverfunksjon (Child Pugh B eller C) [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Voksne
Den anbefalte dosen av SUSTIVA (efavirenz) er 600 mg oralt, én gang daglig, i kombinasjon med en proteasehemmer og/eller nukleosidanalog revers transkriptasehemmere (NRTI). Det anbefales at SUSTIVA tas på tom mage, helst ved sengetid. De økte efavirenzkonsentrasjonene observert etter administrering av SUSTIVA 600 mg sammen med mat kan føre til en økning i frekvensen av bivirkninger [se KLINISK FARMAKOLOGI ]. Dosering ved sengetid kan forbedre toleransen av symptomer på nervesystemet [se ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER , og PASIENTINFORMASJON ]. SUSTIVA kapsler eller tabletter skal svelges intakte med væske. For pasienter som ikke kan svelge kapsler eller tabletter, anbefales administrasjonsmåte med kapseldryss [se Kapseldryss Administrasjonsmåte ].
Samtidig antiretroviral terapi
SUSTIVA må gis i kombinasjon med andre antiretrovirale medisiner [se INDIKASJONER , ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL , og KLINISK FARMAKOLOGI ].
Doseringsjustering
Hvis SUSTIVA 200 mg administreres samtidig med voriconazol, bør vedlikeholdsdosen for voriconazol økes til 400 mg hver 12. time, og dosen SUSTIVA 200 mg bør reduseres til 300 mg én gang daglig ved bruk av kapselformuleringen (én 200 mg og to 50 mg kapsler eller seks 50 mg kapsler). mg kapsler). SUSTIVA 600 mg tabletter må ikke brytes. [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI .]
Hvis SUSTIVA gis samtidig med rifampin til pasienter som veier 50 kg eller mer, anbefales en økning i dosen av SUSTIVA 200 mg til 800 mg én gang daglig [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
Pediatriske pasienter
Det anbefales at SUSTIVA 600 mg tas på tom mage, helst ved sengetid. Tabell 1 beskriver anbefalt dose av SUSTIVA for pediatriske pasienter 3 måneder eller eldre og som veier mellom 3,5 kg og 40 kg [se KLINISK FARMAKOLOGI ]. Den anbefalte dosen av SUSTIVA for pediatriske pasienter som veier 40 kg eller mer er 600 mg én gang daglig. For pediatriske pasienter som ikke kan svelge kapsler, kan kapselinnholdet administreres med en liten mengde mat eller morsmelkerstatning ved bruk av kapseldryss [se Kapseldryss Administrasjonsmåte ].
Kapseldryss Administrasjonsmåte
For pediatriske pasienter som er minst 3 måneder gamle og som veier minst 3,5 kg og voksne som ikke kan svelge kapsler eller tabletter, kan kapselinnholdet administreres med en liten mengde (1 til 2 ts) mat. Bruk av morsmelkerstatning for blanding bør kun vurderes for de små spedbarn som ikke kan konsumere fast føde på en pålitelig måte. Pasienter og omsorgspersoner bør instrueres om å åpne kapselen forsiktig for å unngå søl eller spredning av kapselinnholdet i luften. Kapselen skal holdes horisontalt over en liten beholder og forsiktig vridd for å åpne. For pasienter som tåler fast føde, bør hele kapselinnholdet blandes forsiktig med en alderstilpasset myk mat, som eplemos, druegelé eller yoghurt, i den lille beholderen. For små spedbarn som mottar blandingen kapseldryss-morsmelkerstatning, skal hele kapselinnholdet forsiktig blandes til 2 ts rekonstituert morsmelkerstatning i romtemperatur i en liten beholder ved å røre forsiktig med en liten skje, og deretter trekke opp blandingen til en 10 stk. ml oral doseringssprøyte for administrering. Etter administrering av SUSTIVA-mat- eller formelblandingen, må en ekstra liten mengde (ca. 2 teskjeer) mat eller formel tilsettes i den tomme blandebeholderen, røres for å spre gjenværende SUSTIVA-rester og administreres til pasienten. SUSTIVA-mat- eller formelblandingen skal administreres innen 30 minutter etter blanding. Ingen ekstra mat skal inntas i 2 timer etter administrering av SUSTIVA.
Ytterligere pasientinstruksjoner om administrasjonsmåten for kapseldryss er gitt i den FDA-godkjente pasientetiketten (se PASIENTINFORMASJON og INSTRUKSJONER FOR BRUK ).
HVORDAN LEVERES
Doseringsformer og styrker
Kapsler
200 mg kapsler er gullfargede, omvendt trykket med "SUSTIVA" på kroppen og trykket "200 mg" på hetten.
50 mg kapsler er gullfargede og hvite, trykket med "SUSTIVA" på den gullfargede hetten og omvendt trykket "50 mg" på den hvite delen.
Nettbrett
600 mg tabletter er gule, kapselformede, filmdrasjerte tabletter med "SUSTIVA" trykt på begge sider.
Oppbevaring og håndtering
Kapsler
SUSTIVA® (efavirenz) kapsler er tilgjengelige som følger:
Kapsler 200 mg er gullfargede, omvendt trykt med "SUSTIVA" på kroppen og merket "200 mg" på hetten.
Flasker på 90 - NDC 0056-0474-92
Kapsler 50 mg er gullfarge og hvite, trykket med "SUSTIVA" på den gullfargede hetten og omvendt trykket "50 mg" på den hvite delen.
Flasker på 30 - NDC 0056-0470-30
Nettbrett
SUSTIVA® (efavirenz) tabletter er tilgjengelige som følger:
Tabletter 600 mg er gule, kapselformede, filmdrasjerte tabletter, med "SUSTIVA" trykt på begge sider.
Flasker på 30 - NDC 0056-0510-30
Oppbevaring
SUSTIVA 600mg kapsler og SUSTIVA tabletter skal oppbevares ved 25°C (77°F); utflukter tillatt til 15°C-30°C (59°F-86°F) [se USP kontrollert romtemperatur].
Distribuert av: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Revidert: oktober 2020
BIVIRKNINGER
De mest signifikante bivirkningene observert hos pasienter behandlet med SUSTIVA er:
- . psykiatriske symptomer [se ADVARSLER OG FORHOLDSREGLER ], . nervesystemsymptomer [se ADVARSLER OG FORHOLDSREGLER ], . utslett [se ADVARSLER OG FORHOLDSREGLER ]. . hepatotoksisitet [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier er utført under vidt varierende forhold, kan ikke rapporterte bivirkningsrater direkte sammenlignes med frekvenser i andre kliniske studier og gjenspeiler kanskje ikke frekvensene observert i klinisk praksis.
Bivirkninger hos voksne
De vanligste (>5 % i begge behandlingsgruppene for efavirenz) bivirkningene av minst moderat alvorlighetsgrad blant pasienter i studie 006 behandlet med SUSTIVA 200 mg i kombinasjon med zidovudin/lamivudin eller indinavir var utslett, svimmelhet, kvalme, hodepine, tretthet, søvnløshet, og oppkast.
Utvalgte kliniske bivirkninger av moderat eller alvorlig intensitet observert hos ≥2 % av SUSTIVA-behandlede pasienter i to kontrollerte kliniske studier er presentert i tabell 2.
Pankreatitt er rapportert, selv om en årsakssammenheng med efavirenz ikke er fastslått. Asymptomatiske økninger i serumamylasenivåer ble observert hos et signifikant høyere antall pasienter behandlet med efavirenz 600 mg enn hos kontrollpasienter (se Laboratorieavvik ).
Symptomer på nervesystemet
For 1008 pasienter behandlet med kurer som inneholder SUSTIVA og 635 pasienter behandlet med kontrollkur i kontrollerte studier, viser tabell 3 frekvensen av symptomer av ulik alvorlighetsgrad og gir seponeringsrater for ett eller flere av følgende nervesystemsymptomer: svimmelhet, søvnløshet, nedsatt konsentrasjon, somnolens, unormal drømming, eufori, forvirring, agitasjon, hukommelsestap, hallusinasjoner, stupor, unormal tenkning og depersonalisering [se ADVARSLER OG FORHOLDSREGLER ]. Frekvensen av spesifikke symptomer på sentral- og perifert nervesystem er gitt i tabell 2.
Psykiatriske symptomer
Alvorlige psykiatriske bivirkninger er rapportert hos pasienter behandlet med SUSTIVA. I kontrollerte studier var psykiatriske symptomer observert med en frekvens på over 2 % blant pasienter behandlet med henholdsvis SUSTIVA 600 mg eller kontrollregimer depresjon (19 %, 16 %), angst (13 %, 9 %) og nervøsitet (7 % , 2 %).
Utslett
kontrollerte kliniske studier var frekvensen av utslett (alle grader, uavhengig av årsakssammenheng) 26 % for 1008 voksne behandlet med regimer som inneholder SUSTIVA 200 mg og 17 % for 635 voksne behandlet med kontrollregime. De fleste rapportene om utslett var milde eller moderate i alvorlighetsgrad. Frekvensen av grad 3-utslett var 0,8 % for SUSTIVA-behandlede pasienter og 0,3 % for kontrollgruppene, og frekvensen av grad 4-utslett var 0,1 % for SUSTIVA og 0 for kontrollgruppene. Seponeringsraten som følge av utslett var 1,7 % for SUSTIVA-behandlede pasienter og 0,3 % for kontrollgruppene [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring med SUSTIVA hos pasienter som har seponert andre antiretrovirale midler i NNRTI-klassen er begrenset. Nitten pasienter som avbrøt behandlingen med nevirapin på grunn av utslett har blitt behandlet med SUSTIVA. Ni av disse pasientene utviklet mildt til moderat utslett mens de fikk behandling med SUSTIVA, og to av disse pasientene sluttet på grunn av utslett.
Laboratorieavvik
Utvalgte laboratorieavvik i grad 3-4 rapportert hos ≥2 % av SUSTIVA-behandlede pasienter i to kliniske studier er presentert i tabell 4.
Pasienter med samtidig hepatitt B eller C
Leverfunksjonstester bør overvåkes hos pasienter med hepatitt B og/eller C i anamnesen. I langtidsdatasettet fra studie 006 ble 137 pasienter behandlet med regimer som inneholder SUSTIVA (median behandlingsvarighet, 68 uker) og 84 behandlet med et kontrollregime (median varighet, 56 uker) var seropositive ved screening for hepatitt B (overflateantigenpositiv) og/eller C (hepatitt C-antistoffpositiv). Blant disse samtidig infiserte pasientene utviklet forhøyninger i ASAT til mer enn fem ganger ULN hos 13 % av pasientene i SUSTIVA-armene og 7 % av de i kontrollarmen, og forhøyninger i ALAT til mer enn fem ganger ULN utviklet hos 20 % av pasientene i SUSTIVA-armene og 7 % av pasientene i kontrollarmen. Blant samtidig infiserte pasienter, avbrøt 3 % av de som ble behandlet med SUSTIVA-holdige regimer og 2 % i kontrollarmen fra studien på grunn av lever- eller gallesystemsykdommer [se ADVARSLER OG FORHOLDSREGLER ].
Lipider
Økninger fra baseline i totalkolesterol på 10-20 % er observert hos noen uinfiserte frivillige som har fått SUSTIVA. Hos pasienter behandlet med SUSTIVA + zidovudin + lamivudin ble det observert økninger fra baseline i ikke-fastende totalkolesterol og HDL på henholdsvis ca. 20 % og 25 %. Hos pasienter behandlet med SUSTIVA + indinavir ble det observert økninger fra baseline i ikke-fastende kolesterol og HDL på henholdsvis ca. 40 % og 35 %. Ikke-fastende totale kolesterolnivåer ≥240 mg/dL og ≥300 mg/dL ble rapportert hos henholdsvis 34 % og 9 % av pasientene behandlet med SUSTIVA + zidovudin + lamivudin; henholdsvis 54 % og 20 % av pasientene behandlet med SUSTIVA + indinavir; og henholdsvis 28 % og 4 % av pasientene behandlet med indinavir + zidovudin + lamivudin. Effekten av SUSTIVA 600 mg på triglyserider og LDL i denne studien var ikke godt karakterisert siden prøver ble tatt fra ikke-fastende pasienter. Den kliniske betydningen av disse funnene er ukjent [se ADVARSLER OG FORHOLDSREGLER ].
Bivirkninger hos pediatriske pasienter
Fordi kliniske studier er utført under vidt varierende forhold, kan ikke rapporterte bivirkningsrater direkte sammenlignes med frekvenser i andre kliniske studier og gjenspeiler kanskje ikke frekvensene observert i klinisk praksis.
Vurdering av bivirkninger er basert på tre kliniske studier med 182 HIV-1-infiserte pediatriske pasienter (3 måneder til 21 år) som fikk SUSTIVA 200 mg i kombinasjon med andre antiretrovirale midler i en median på 123 uker. Bivirkningene observert i de tre studiene var lik de som ble observert i kliniske studier hos voksne, bortsett fra at utslett var mer vanlig hos pediatriske pasienter (32 % for alle grader uavhengig av årsakssammenheng) og oftere av høyere grad (dvs. mer alvorlig). To (1,1 %) pediatriske pasienter fikk grad 3 utslett (konfluent utslett med feber, generalisert utslett), og fire (2,2 %) pediatriske pasienter hadde grad 4 utslett (alle erythema multiforme). Fem pediatriske pasienter (2,7 %) avbrøt fra studien på grunn av utslett [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av SUSTIVA etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av ukjent størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering.
Kroppen som helhet: allergiske reaksjoner, asteni, omfordeling/akkumulering av kroppsfett [se ADVARSLER OG FORHOLDSREGLER ]
Sentral- og perifert nervesystem: unormal koordinasjon, ataksi, encefalopati, cerebellar koordinasjon og balanseforstyrrelser, kramper, hypoestesi, parestesi, nevropati, tremor, vertigo
Endokrine: gynekomasti
Gastrointestinale: forstoppelse, malabsorpsjon
Kardiovaskulær: rødming, hjertebank
Lever og gallesystem: hepatisk enzymøkning, leversvikt, hepatitt.
Metabolsk og ernæringsmessig: hyperkolesterolemi, hypertriglyseridemi
Muskuloskeletal: artralgi, myalgi, myopati
Psykiatrisk: aggressive reaksjoner, agitasjon, vrangforestillinger, emosjonell labilitet, mani, nevrose, paranoia, psykose, selvmord, katatoni
Luftveiene: dyspné
Hud og vedheng: erythema multiforme, fotoallergisk dermatitt, Stevens-Johnsons syndrom
Spesielle sanser: unormalt syn, tinnitus
NARKOTIKAHANDEL
Potensial for SUSTIVA til å påvirke andre legemidler
Efavirenz har vist seg in vivo å indusere CYP3A og CYP2B6. Andre forbindelser som er substrater for CYP3A eller CYP2B6 kan ha reduserte plasmakonsentrasjoner når de administreres sammen med SUSTIVA.
Potensial for andre legemidler å påvirke SUSTIVA
Legemidler som induserer CYP3A-aktivitet (f.eks. fenobarbital, rifampin, rifabutin) vil forventes å øke clearance av efavirenz, noe som resulterer i reduserte plasmakonsentrasjoner [se DOSERING OG ADMINISTRASJON ].
QT-forlengende legemidler
Det er begrenset informasjon tilgjengelig om potensialet for en farmakodynamisk interaksjon mellom SUSTIVA 600 mg og legemidler som forlenger QTc-intervallet. QTc-forlengelse er observert ved bruk av efavirenz [se KLINISK FARMAKOLOGI ]. Vurder alternativer til SUSTIVA 600 mg når det administreres sammen med et legemiddel med kjent risiko for Torsade de Pointes.
Etablerte og andre potensielt signifikante legemiddelinteraksjoner
Legemiddelinteraksjoner med SUSTIVA er oppsummert i tabell 5. For farmakokinetikkdata, [se KLINISK FARMAKOLOGI ] Tabell 7 og 8. Denne tabellen inkluderer potensielt signifikante interaksjoner, men er ikke altomfattende.
Legemidler uten klinisk signifikante interaksjoner med SUSTIVA
Ingen dosejustering anbefales når SUSTIVA 600 mg gis sammen med følgende: antacida av aluminium/magnesiumhydroksid, azitromycin, cetirizin, famotidin, flukonazol, lorazepam, nelfinavir, nukleosid revers transkriptasehemmere (abakabine, stavivudnobin, stavovudnobin, stavovudin, emtricin ), paroksetin og raltegravir.
Cannabinoid testinteraksjon
Efavirenz binder seg ikke til cannabinoidreseptorer. Falsk-positive urin cannabinoid testresultater er rapportert med noen screening analyser hos uinfiserte og HIV-infiserte personer som får efavirenz. Bekreftelse av positive screeningtester for cannabinoider med en mer spesifikk metode anbefales.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Narkotikahandel
Efavirenz plasmakonsentrasjoner kan endres av substrater, inhibitorer eller induktorer av CYP3A. På samme måte kan efavirenz endre plasmakonsentrasjoner av legemidler som metaboliseres av CYP3A eller CYP2B6. Den mest fremtredende effekten av efavirenz ved steady-state er induksjon av CYP3A og CYP2B6 [se DOSERING OG ADMINISTRASJON og NARKOTIKAHANDEL ].
QTc-forlengelse
QTc-forlengelse er observert ved bruk av efavirenz [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ]. Vurder alternativer til SUSTIVA 600mg når det administreres sammen med et legemiddel med kjent risiko for Torsade de Pointes eller når det administreres til pasienter med høyere risiko for Torsade de Pointes.
Motstand
SUSTIVA 200 mg må ikke brukes som enkeltmiddel for å behandle HIV-1-infeksjon eller legges til som eneste middel til et sviktende regime. Resistent virus oppstår raskt når efavirenz administreres som monoterapi. Valget av nye antiretrovirale midler som skal brukes i kombinasjon med efavirenz bør ta hensyn til potensialet for viral kryssresistens.
Samadministrasjon med relaterte produkter
Samtidig administrering av SUSTIVA og ATRIPLA (efavirenz 600 mg/emtricitabin 200 mg/tenofovirdisoproksilfumarat 300 mg) anbefales ikke med mindre det er nødvendig for dosejustering (f.eks. med rifampin), siden efavirenz er en av dens aktive ingredienser.
Psykiatriske symptomer
Alvorlige psykiatriske bivirkninger er rapportert hos pasienter behandlet med SUSTIVA. I kontrollerte studier med 1008 pasienter behandlet med regimer som inneholder SUSTIVA 600 mg i gjennomsnittlig 2,1 år og 635 pasienter behandlet med kontrollregimer i gjennomsnittlig 1,5 år, frekvensen (uavhengig av årsakssammenheng) av spesifikke alvorlige psykiatriske hendelser blant pasienter som fikk SUSTIVA eller kontrollregimer var henholdsvis alvorlig depresjon (2,4 %, 0,9 %), selvmordstanker (0,7 %, 0,3 %), ikke-dødelige selvmordsforsøk (0,5 %, 0), aggressiv oppførsel (0,4 %, 0,5 %), paranoide reaksjoner (0,4 %). %, 0,3 %) og maniske reaksjoner (0,2 %, 0,3 %). Når psykiatriske symptomer tilsvarende de som er nevnt ovenfor ble kombinert og evaluert som en gruppe i en multifaktoriell analyse av data fra studie 006, var behandling med efavirenz assosiert med en økning i forekomsten av disse utvalgte psykiatriske symptomene. Andre faktorer assosiert med en økning i forekomsten av disse psykiatriske symptomene var historie med injeksjonsmiddelbruk, psykiatrisk historie og mottak av psykiatrisk medisin ved studiestart; lignende assosiasjoner ble observert i både SUSTIVA- og kontrollgruppene. I studie 006 oppsto nye alvorlige psykiatriske symptomer gjennom hele studien for både SUSTIVA-behandlede og kontrollbehandlede pasienter. Én prosent av SUSTIVA-behandlede pasienter avbrøt eller avbrøt behandlingen på grunn av ett eller flere av disse utvalgte psykiatriske symptomene. Det har også vært sporadiske rapporter etter markedsføring om dødsfall som følge av selvmord, vrangforestillinger og psykoseliknende atferd, selv om en årsakssammenheng til bruken av SUSTIVA ikke kan fastslås ut fra disse rapportene. Tilfeller av katatoni etter markedsføring er også rapportert og kan være assosiert med økt efavirenzeksponering. Pasienter med alvorlige psykiatriske bivirkninger bør søke umiddelbar medisinsk vurdering for å vurdere muligheten for at symptomene kan være relatert til bruken av SUSTIVA, og i så fall for å avgjøre om risikoen ved fortsatt behandling oppveier fordelene. [se BIVIRKNINGER .]
Symptomer på nervesystemet
Femtitre prosent (531/1008) av pasientene som fikk SUSTIVA 600 mg i kontrollerte studier rapporterte symptomer på sentralnervesystemet (hvilken grad, uavhengig av årsakssammenheng) sammenlignet med 25 % (156/635) av pasientene som fikk kontrollregimer [se BIVIRKNINGER ]. Disse symptomene inkluderte, men var ikke begrenset til, svimmelhet (28,1 % av de 1008 pasientene), søvnløshet (16,3 %), nedsatt konsentrasjon (8,3 %), somnolens (7,0 %), unormale drømmer (6,2 %) og hallusinasjoner (1,2 %). %). Disse symptomene var alvorlige hos 2,0 % av pasientene; og 2,1 % av pasientene avsluttet behandlingen som et resultat. Disse symptomene begynner vanligvis i løpet av den første eller andre dagen av behandlingen og går vanligvis over etter de første 2-4 ukene av behandlingen. Etter 4 ukers behandling varierte prevalensen av nervesystemsymptomer av minst moderat alvorlighetsgrad fra 5 % til 9 % hos pasienter behandlet med regimer som inneholder SUSTIVA og fra 3 % til 5 % hos pasienter behandlet med et kontrollregime. Pasienter bør informeres om at disse vanlige symptomene sannsynligvis ble bedre ved fortsatt behandling og ikke var prediktive for senere utbrudd av de sjeldnere psykiatriske symptomene [se Psykiatriske symptomer ]. Dosering ved sengetid kan forbedre toleransen til disse nervesystemsymptomene [se DOSERING OG ADMINISTRASJON ].
Analyse av langtidsdata fra studie 006 (median oppfølging 180 uker, 102 uker og 76 uker for pasienter behandlet med henholdsvis SUSTIVA + zidovudin + lamivudin, SUSTIVA + indinavir og indinavir + zidovudin + lamivudin) viste at, Etter 24 ukers behandling var forekomsten av nyoppståtte nervesystemsymptomer blant SUSTIVA-behandlede pasienter generelt lik forekomsten i den indinavirholdige kontrollarmen.
Sent innsettende nevrotoksisitet, inkludert ataksi og encefalopati (svekket bevissthet, forvirring, psykomotorisk nedgang, psykose, delirium), kan oppstå måneder til år etter oppstart av efavirenzbehandling. Noen hendelser med sent-debuterende nevrotoksisitet har forekommet hos pasienter med CYP2B6 genetiske polymorfismer som er assosiert med økte efavirenznivåer til tross for standarddosering av SUSTIVA. Pasienter som viser tegn og symptomer på alvorlige nevrologiske bivirkninger bør evalueres umiddelbart for å vurdere muligheten for at disse hendelsene kan være relatert til bruk av efavirenz, og om seponering av SUSTIVA 600 mg er berettiget.
Pasienter som får SUSTIVA 600 mg bør varsles om muligheten for additive effekter på sentralnervesystemet når SUSTIVA 200 mg brukes samtidig med alkohol eller psykoaktive stoffer.
Pasienter som opplever symptomer på sentralnervesystemet som svimmelhet, nedsatt konsentrasjon og/eller døsighet bør unngå potensielt farlige oppgaver som å kjøre bil eller bruke maskiner.
Embryo-føtal toksisitet
Efavirenz kan forårsake fosterskader når det administreres i løpet av første trimester til en gravid kvinne. Rådfør kvinner med reproduksjonspotensial som får SUSTIVA 600 mg for å unngå graviditet. [se Bruk i spesifikke populasjoner .]
Utslett
I kontrollerte kliniske studier fikk 26 % (266/1008) av voksne pasienter behandlet med 600 mg SUSTIVA nyoppståtte hudutslett sammenlignet med 17 % (111/635) av de som ble behandlet i kontrollgruppene [se BIVIRKNINGER ]. Utslett assosiert med blemmer, fuktig deskvamasjon eller sårdannelse forekom hos 0,9 % (9/1008) av pasientene behandlet med SUSTIVA. Forekomsten av grad 4 utslett (f.eks. erythema multiforme, Stevens-Johnson syndrom) hos voksne pasienter behandlet med SUSTIVA i alle studier og utvidet tilgang var 0,1 %. Utslett er vanligvis milde til moderate makulopapulære hudutbrudd som oppstår i løpet av de første 2 ukene etter oppstart av behandling med efavirenz (median tid til utslett debut hos voksne var 11 dager), og hos de fleste pasienter som fortsetter behandlingen med efavirenz, går utslett over innen 1 måned (median varighet, 16 dager). Seponeringsfrekvensen for utslett i kliniske studier for voksne var 1,7 % (17/1008).
Utslett ble rapportert hos 59 av 182 pediatriske pasienter (32 %) behandlet med SUSTIVA [se BIVIRKNINGER ]. To pediatriske pasienter fikk grad 3 utslett (konfluent utslett med feber, generalisert utslett), og fire pasienter hadde grad 4 utslett (erythema multiforme). Median tid før utslett debuterte hos pediatriske pasienter var 28 dager (intervall 3-1642 dager). Profylakse med passende antihistaminer før oppstart av behandling med SUSTIVA hos pediatriske pasienter bør vurderes.
SUSTIVA 600 mg kan vanligvis gjenopptas hos pasienter som avbryter behandlingen på grunn av utslett. SUSTIVA 200 mg bør seponeres hos pasienter som utvikler alvorlig utslett assosiert med blemmer, avskalling, slimhinnepåvirkning eller feber. Egnede antihistaminer og/eller kortikosteroider kan forbedre tolerabiliteten og fremskynde oppløsningen av utslett. For pasienter som har hatt en livstruende hudreaksjon (f.eks. Stevens-Johnsons syndrom), bør alternativ behandling vurderes [se KONTRAINDIKASJONER ].
Hepatotoksisitet
Tilfeller av hepatitt etter markedsføring, inkludert fulminant hepatitt som utvikler seg til leversvikt som krever transplantasjon eller som resulterer i død, er rapportert hos pasienter behandlet med SUSTIVA. Rapporter har inkludert pasienter med underliggende leversykdom, inkludert samtidig infeksjon med hepatitt B eller C, og pasienter uten forhåndseksisterende leversykdom eller andre identifiserbare risikofaktorer.
SUSTIVA 600mg anbefales ikke til pasienter med moderat eller alvorlig nedsatt leverfunksjon. Nøye overvåking anbefales for pasienter med lett nedsatt leverfunksjon som får SUSTIVA. [se BIVIRKNINGER og Bruk i spesifikke populasjoner ].
Overvåking av leverenzymer før og under behandling anbefales for alle pasienter [se DOSERING OG ADMINISTRASJON ].
Vurder å seponere SUSTIVA 600 mg hos pasienter med vedvarende økning av serumtransaminaser til mer enn fem ganger øvre grense for normalområdet.Seponer SUSTIVA 200 mg hvis økning av serumtransaminaser er ledsaget av kliniske tegn eller symptomer på hepatitt eller leverdekompensasjon.
Kramper
Kramper har blitt observert hos voksne og pediatriske pasienter som får efavirenz, vanligvis i nærvær av kjent sykehistorie med anfall [se Ikke-klinisk toksikologi ]. Forsiktighet bør utvises hos enhver pasient med anfallshistorie. Pasienter som samtidig får krampestillende medisiner som primært metaboliseres i leveren, slik som fenytoin og fenobarbital, kan kreve periodisk overvåking av plasmanivåer [se NARKOTIKAHANDEL ].
Lipidforhøyelser
Behandling med SUSTIVA har resultert i økninger i konsentrasjonen av totalkolesterol og triglyserider [se BIVIRKNINGER ]. Kolesterol- og triglyseridtesting bør utføres før oppstart av SUSTIVA 200 mg-behandling og med periodiske intervaller under behandlingen.
Immunrekonstitusjonssyndrom
Immunrekonstitusjonssyndrom er rapportert hos pasienter behandlet med antiretroviral kombinasjonsterapi, inkludert SUSTIVA. Under den innledende fasen av antiretroviral kombinasjonsbehandling kan pasienter hvis immunsystem reagerer utvikle en inflammatorisk respons på indolente eller gjenværende opportunistiske infeksjoner (som Mycobacterium avium-infeksjon, cytomegalovirus, Pneumocystis jiroveci pneumoni [PCP] eller tuberkulose), noe som kan nødvendiggjøre ytterligere evaluering og behandling.
Autoimmune lidelser (som Graves sykdom, polymyositt, Guillain-Barré syndrom og autoimmun hepatitt) har også blitt rapportert å forekomme i forbindelse med immunrekonstitusjon; Tiden til debut er imidlertid mer varierende, og kan forekomme mange måneder etter behandlingsstart.
Omfordeling av fett
Omfordeling/akkumulering av kroppsfett inkludert sentral fedme, dorsocervikal fettforstørrelse (buffalo hump), perifer sløsing, ansiktssvinn, brystforstørrelse og "cushingoid utseende" har blitt observert hos pasienter som får antiretroviral behandling. Mekanismen og de langsiktige konsekvensene av disse hendelsene er foreløpig ukjent. En årsakssammenheng er ikke fastslått.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON og Instruksjoner for bruk ).
Narkotikahandel
En erklæring til pasienter og helsepersonell er inkludert på produktets flaskeetiketter: ADVARSEL: Finn ut om medisiner som IKKE bør tas sammen med SUSTIVA.
SUSTIVA kan interagere med enkelte legemidler; råd derfor pasienter til å rapportere til legen om bruk av andre reseptbelagte eller reseptfrie medisiner.
Generell informasjon for pasienter
Informer pasienter om at SUSTIVA 200 mg ikke er en kur mot HIV-1-infeksjon og pasienter kan fortsette å oppleve sykdommer assosiert med HIV-1-infeksjon, inkludert opportunistiske infeksjoner. Pasienter bør forbli under tilsyn av en lege mens de tar SUSTIVA.
Råd pasienter til å unngå å gjøre ting som kan spre HIV-1-infeksjon til andre.
- . Ikke del eller gjenbruk nåler eller annet injeksjonsutstyr. . Ikke del personlige gjenstander som kan ha blod eller kroppsvæsker på seg, som tannbørster og barberblader. . Ikke ha noen form for sex uten beskyttelse. Utøv alltid tryggere sex ved å bruke lateks- eller polyuretankondom for å redusere sjansen for seksuell kontakt med sæd, vaginale sekreter eller blod. . Ikke amme. Mødre med HIV-1 bør ikke amme fordi HIV-1 kan overføres til barnet i morsmelk.
Doseringsinstruksjoner
Råd pasientene til å ta SUSTIVA hver dag som foreskrevet. Hvis en pasient glemmer å ta SUSTIVA, be pasienten ta den glemte dosen med en gang, med mindre det nesten er tid for neste dose. Råd pasienten om å ikke ta 2 doser på en gang og å ta neste dose til vanlig planlagt tid. Råd pasienten til å spørre en helsepersonell om han/hun trenger hjelp til å planlegge de beste tidspunktene for å ta medisinen hans/hennes.
SUSTIVA 200mg må alltid brukes i kombinasjon med andre antiretrovirale legemidler. Råd pasientene til å ta SUSTIVA 600 mg på tom mage, helst ved sengetid. Inntak av SUSTIVA med mat øker konsentrasjonen av efavirenz og kan øke frekvensen av bivirkninger. Dosering ved sengetid kan forbedre toleransen av symptomer på nervesystemet [se DOSERING OG ADMINISTRASJON og BIVIRKNINGER ]. Helsepersonell bør hjelpe foreldre eller omsorgspersoner med å bestemme den beste doseringsplanen for SUSTIVA for spedbarn og små barn.
For voksne og pediatriske pasienter som ikke kan svelge kapsler eller tabletter, bør pasienter eller deres omsorgspersoner rådes til å lese og nøye følge instruksjonene for administrering av kapselinnholdet i en liten mengde mat eller morsmelkerstatning [se DOSERING OG ADMINISTRASJON og FDA-godkjent pasientmerking ( PASIENTINFORMASJON og INSTRUKSJONER FOR BRUK )]. Pasienter bør ringe helsepersonell eller apotek dersom de har spørsmål.
Symptomer på nervesystemet
Informer pasienter om at symptomer på sentralnervesystemet (NSS) inkludert svimmelhet, søvnløshet, nedsatt konsentrasjon, døsighet og unormale drømmer ofte er rapportert i løpet av de første ukene av behandlingen med SUSTIVA [se ADVARSLER OG FORHOLDSREGLER ]. Dosering ved sengetid kan forbedre toleransen av disse symptomene, som sannsynligvis vil forbedres med fortsatt behandling. Varsle pasienter om potensialet for additive effekter når SUSTIVA brukes samtidig med alkohol eller psykoaktive stoffer. Instruer pasienter om at hvis de opplever NSS, bør de unngå potensielt farlige oppgaver som å kjøre bil eller bruke maskiner.
Informer pasienter om at det er risiko for å utvikle sent-debuterende nevrotoksisitet, inkludert ataksi og encefalopati som kan oppstå måneder til år etter oppstart av SUSTIVA-behandling [se ADVARSLER OG FORHOLDSREGLER ].
Psykiatriske symptomer
Informer pasienter om at alvorlige psykiatriske symptomer, inkludert alvorlig depresjon, selvmordsforsøk, aggressiv atferd, vrangforestillinger, paranoia, psykoselignende symptomer og katatoni er rapportert hos pasienter som får SUSTIVA [se ADVARSLER OG FORHOLDSREGLER ]. Hvis de opplever alvorlige psykiatriske bivirkninger, bør de umiddelbart søke medisinsk vurdering. Råd pasientene til å informere legen om enhver historie med psykisk sykdom eller rusmisbruk.
Utslett
Informer pasientene om at en vanlig bivirkning er utslett [se ADVARSLER OG FORHOLDSREGLER ]. Utslett forsvinner vanligvis uten endring i behandlingen. Men siden utslett kan være alvorlig, råd pasientene til å kontakte legen sin umiddelbart hvis utslett oppstår.
Hepatotoksisitet
Informer pasientene om å se etter tidlige varseltegn på leverbetennelse eller -svikt, som tretthet, svakhet, mangel på appetitt, kvalme og oppkast, samt senere tegn som gulsott, forvirring, hevelse i magen og misfarget avføring, og konsultere deres helsepersonell uten opphold dersom slike symptomer oppstår [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Kvinner av reproduktivt potensial
Informer kvinner med reproduksjonsevne til å bruke effektiv prevensjon samt en barrieremetode under behandling med SUSTIVA 600 mg og i 12 uker etter seponering av SUSTIVA. Råd pasienter til å kontakte helsepersonell dersom de planlegger å bli gravide, bli gravide eller hvis det er mistanke om graviditet under behandling med SUSTIVA [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Eksponeringsregister for graviditet
Gi pasienter beskjed om at det finnes et graviditetseksponeringsregister som overvåker graviditetsutfall hos kvinner eksponert for SUSTIVA under graviditet [se Bruk i spesifikke populasjoner ].
Omfordeling av fett
Informer pasienter om at omfordeling eller akkumulering av kroppsfett kan forekomme hos pasienter som får antiretroviral behandling og at årsaken og langsiktige helseeffekter av disse tilstandene ikke er kjent [se ADVARSLER OG FORHOLDSREGLER ].
SUSTIVA er et registrert varemerke for Bristol-Myers Squibb Pharma Company. ATRIPLA er et varemerke for Bristol-Myers Squibb & Gilead Sciences, LLC.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Langtidskarsinogenitetsstudier på mus og rotter ble utført med efavirenz. Mus ble dosert med 0, 25, 75, 150 eller 300 mg/kg/dag i 2 år. Forekomsten av hepatocellulære adenomer og karsinomer og pulmonale alveolære/bronkiolære adenomer var økt over bakgrunnen hos kvinner. Ingen økning i tumorforekomst over bakgrunn ble sett hos menn. Det var ingen NOAEL hos kvinner etablert for denne studien fordi tumorfunn forekom ved alle doser. AUC ved NOAEL (150 mg/kg) hos menn var omtrent 0,9 ganger høyere enn hos mennesker ved anbefalt klinisk dose. I rottestudien ble det ikke observert noen økning i tumorforekomst ved doser opp til 100 mg/kg/dag, der AUC var 0,1 (hanner) eller 0,2 (hunn) ganger høyere enn hos mennesker ved anbefalt klinisk dose.
Mutagenese
Efavirenz testet negativt i en rekke in vitro og in vivo genotoksisitetsanalyser. Disse inkluderte bakterielle mutasjonsanalyser i S.typhimurium og E. coli, pattedyrmutasjonsanalyser i kinesisk hamsterovarieceller, kromosomavviksanalyser i humane perifere blodlymfocytter eller kinesisk hamsterovarieceller, og en in vivo musebenmargsmikronukleusanalyse.
Nedsatt fruktbarhet
Efavirenz svekket ikke paring eller fertilitet hos hann- eller hunnrotter, og påvirket ikke sædceller fra behandlede hannrotter. Reproduksjonsevnen til avkom født av hunnrotter gitt efavirenz ble ikke påvirket. AUC ved NOAEL-verdiene hos hannrotter (200 mg/kg) og hunnrotter (100 mg/kg) var omtrent ≤ 0,15 ganger høyere enn hos mennesker ved anbefalt klinisk dose.
Bruk i spesifikke populasjoner
Svangerskap
Eksponeringsregister for graviditet
Det finnes et graviditetseksponeringsregister som overvåker graviditetsutfall hos kvinner som er eksponert for SUSTIVA 600 mg under graviditet. Leger oppfordres til å registrere pasienter ved å ringe Antiretroviral Pregnancy Registry på 1-800-258-4263.
Risikosammendrag
Det er retrospektive kasusrapporter av nevralrørsdefekter hos spedbarn hvis mødre ble eksponert for regimer som inneholder efavirenz i første trimester av svangerskapet. Prospektive graviditetsdata fra Antiretroviral Pregnancy Registry er ikke tilstrekkelig til å vurdere denne risikoen tilstrekkelig. Tilgjengelige data fra Antiretroviral Pregnancy Registry viser ingen forskjell i risikoen for generelle store fødselsdefekter sammenlignet med bakgrunnsraten for store fødselsskader på 2,7 % i den amerikanske referansepopulasjonen i Metropolitan Atlanta Congenital Defects Program (MACDP). Selv om det ikke er fastslått en årsakssammenheng mellom eksponering for efavirenz i første trimester og nevralrørsdefekter, har lignende misdannelser blitt observert i studier utført på aper ved doser tilsvarende den humane dosen. I tillegg forekom føtale og embryonale toksisiteter hos rotter, ved en dose som er ti ganger mindre enn den humane eksponeringen ved anbefalt klinisk dose. På grunn av den potensielle risikoen for nevralrørsdefekter, bør efavirenz ikke brukes i første trimester av svangerskapet. Informer gravide kvinner om den potensielle risikoen for et foster.
Data
Menneskelige data
Det er retrospektive postmarkedsføringsrapporter om funn som samsvarer med nevralrørsdefekter, inkludert meningomyelocele, alle hos spedbarn av mødre som ble eksponert for regimer som inneholder efavirenz i første trimester.
Basert på prospektive rapporter fra Antiretroviral Pregnancy Registry (APR) av omtrent 1000 levendefødte etter eksponering for regimer som inneholder efavirenz (inkludert over 800 levendefødte eksponert i første trimester), var det ingen forskjell mellom efavirenz og generelle fødselsdefekter sammenlignet med bakgrunnsrate for fødselsdefekter på 2,7 % i den amerikanske referansepopulasjonen i Metropolitan Atlanta Congenital Defects Program. Fra den foreløpige APR-rapporten utgitt desember 2014 var prevalensen av fødselsskader etter eksponering i første trimester 2,3 % (95 % KI: 1,4 %-3,6 %). En av disse prospektivt rapporterte defektene med eksponering i første trimester var en nevralrørsdefekt. Et enkelt tilfelle av anoftalmi med eksponering for efavirenz i første trimester er også blitt rapportert prospektivt. Denne saken inkluderte også alvorlige skrå ansiktsspalter og fostervannsbånd, som har en kjent sammenheng med anoftalmi.
Dyredata
Effekter av efavirenz på embryo-føtal utvikling er studert hos tre ikke-kliniske arter (cynomolgusaper, rotter og kaniner). Hos aper ble efavirenz 60 mg/kg/dag administrert til gravide kvinner gjennom hele svangerskapet (drektighetsdager 20 til 150). Maternal systemisk legemiddeleksponering (AUC) var 1,3 ganger eksponeringen hos mennesker ved anbefalt klinisk dose (600 mg/dag), med føtale navlestrengsvenøse legemiddelkonsentrasjoner omtrent 0,7 ganger maternelle verdier. Tre av 20 fostre/spedbarn hadde en eller flere misdannelser; det var ingen misdannede fostre eller spedbarn fra placebobehandlede mødre. Misdannelsene som oppsto hos disse tre apefostrene inkluderte anencefali og ensidig anoftalmi hos ett foster, mikroftalmi i det andre, og ganespalte i det tredje. Det var ingen NOAEL (ingen observerbar bivirkningsnivå) etablert for denne studien fordi kun én dose ble evaluert. Hos rotter ble efavirenz administrert enten under organogenese (drektighetsdager 7 til 18) eller fra drektighetsdag 7 til og med diegivningsdag 21 ved 50, 100 eller 200 mg/kg/dag. Administrering av 200 mg/kg/dag hos rotter var assosiert med økning i forekomsten av tidlige resorpsjoner; og doser på 100 mg/kg/dag og mer var assosiert med tidlig neonatal dødelighet. AUC ved NOAEL (50 mg/kg/dag) i denne rottestudien var 0,1 ganger høyere enn hos mennesker ved anbefalt klinisk dose. Legemiddelkonsentrasjoner i melken på ammingsdag 10 var omtrent 8 ganger høyere enn i mors plasma. Hos drektige kaniner var efavirenz verken embryoletalt eller teratogent når det ble administrert i doser på 25, 50 og 75 mg/kg/dag i løpet av organogeneseperioden (drektighetsdager 6 til 18). AUC ved NOAEL (75 mg/kg/dag) hos kaniner var 0,4 ganger høyere enn hos mennesker ved anbefalt klinisk dose.
Amming
Risikosammendrag
Centers for Disease Control and Prevention anbefaler at HIV-infiserte mødre ikke ammer spedbarnene sine for å unngå å risikere postnatal overføring av HIV. På grunn av potensialet for HIV-overføring hos spedbarn som ammes, råd kvinner til ikke å amme.
Kvinner og menn med reproduktivt potensial
På grunn av potensielle teratogene effekter, bør graviditet unngås hos kvinner som får SUSTIVA. [se Svangerskap .]
Graviditetstesting
Kvinner med reproduksjonspotensial bør gjennomgå graviditetstesting før oppstart av SUSTIVA.
Prevensjon
Kvinner med reproduksjonspotensial bør bruke effektiv prevensjon under behandling med SUSTIVA 200 mg og i 12 uker etter seponering av SUSTIVA 200 mg på grunn av den lange halveringstiden til efavirenz. Barriereprevensjon bør alltid brukes i kombinasjon med andre prevensjonsmetoder. Hormonelle metoder som inneholder progesteron kan ha redusert effektivitet [se NARKOTIKAHANDEL ].
Pediatrisk bruk
Sikkerheten, farmakokinetisk profil og virologisk og immunologisk respons til SUSTIVA 600 mg ble evaluert hos antiretroviralt-naive og - erfarne HIV-1-infiserte pediatriske pasienter i alderen 3 måneder til 21 år i tre åpne kliniske studier [se BIVIRKNINGER , KLINISK FARMAKOLOGI , og Kliniske studier ]. Typen og frekvensen av bivirkninger i disse studiene var generelt lik de hos voksne pasienter med unntak av en høyere frekvens av utslett, inkludert en høyere frekvens av grad 3 eller 4 utslett, hos pediatriske pasienter sammenlignet med voksne [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Bruk av SUSTIVA hos pasienter yngre enn 3 måneder ELLER mindre enn 3,5 kg kroppsvekt anbefales ikke fordi sikkerheten, farmakokinetikken og antiviral aktiviteten til SUSTIVA 600 mg ikke er evaluert i denne aldersgruppen og det er en risiko for utvikling av HIV-resistens. hvis SUSTIVA er underdosert. se DOSERING OG ADMINISTRASJON for doseringsanbefalinger for pediatriske pasienter.
Geriatrisk bruk
Kliniske studier av SUSTIVA 200 mg inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Generelt bør dosevalg for en eldre pasient være forsiktig, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon og samtidig sykdom eller annen behandling.
Nedsatt leverfunksjon
SUSTIVA anbefales ikke til pasienter med moderat eller alvorlig nedsatt leverfunksjon fordi det ikke er tilstrekkelige data til å avgjøre om dosejustering er nødvendig. Pasienter med lett nedsatt leverfunksjon kan behandles med efavirenz uten dosejustering. På grunn av den omfattende cytokrom P450-medierte metabolismen av efavirenz og begrenset klinisk erfaring hos pasienter med nedsatt leverfunksjon, bør det utvises forsiktighet ved administrering av SUSTIVA til disse pasientene [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
OVERDOSE
Noen pasienter som ved et uhell tar 600 mg to ganger daglig har rapportert økte symptomer på nervesystemet. En pasient opplevde ufrivillige muskelsammentrekninger.
Behandling av overdose med SUSTIVA 200 mg bør bestå av generelle støttetiltak, inkludert overvåking av vitale tegn og observasjon av pasientens kliniske status. Administrering av aktivt kull kan brukes for å hjelpe til med fjerning av uabsorbert medikament. Det finnes ingen spesifikk motgift mot overdosering med SUSTIVA. Siden efavirenz er sterkt proteinbundet, er det usannsynlig at dialyse vil fjerne legemidlet fra blodet i betydelig grad.
KONTRAINDIKASJONER
- . SUSTIVA er kontraindisert hos pasienter med tidligere påvist klinisk signifikant overfølsomhet (f.eks. Stevens-Johnsons syndrom, erythema multiforme eller toksiske hudutbrudd) overfor noen av komponentene i dette produktet. . Samtidig administrering av efavirenz med elbasvir og grazoprevir er kontraindisert [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Efavirenz er et antiviralt legemiddel [se Mikrobiologi ].
Farmakodynamikk
Hjerteelektrofysiologi
Effekten av SUSTIVA 600 mg på QTc-intervallet ble evaluert i en åpen, positiv og placebokontrollert, fast enkeltsekvens 3-perioders, 3-behandlings crossover QT-studie med 58 friske forsøkspersoner beriket for CYP2B6 polymorfismer. Gjennomsnittlig Cmax for efavirenz hos personer med CYP2B6 *6/*6 genotype etter administrering av 600 mg daglig dose i 14 dager var 2,25 ganger gjennomsnittlig Cmax observert hos personer med CYP2B6 *1/*1 genotype. En positiv sammenheng mellom efavirenzkonsentrasjon og QTc-forlengelse ble observert. Basert på konsentrasjon-QTc-forholdet, er gjennomsnittlig QTc-forlengelse og dens øvre grense 90 % konfidensintervall 8,7 ms og 11,3 ms hos personer med CYP2B6*6/*6 genotype etter administrering av 600 mg daglig dose i 14 dager [se ADVARSLER OG FORHOLDSREGLER ].
Farmakokinetikk
Absorpsjon
Maksimal plasmakonsentrasjon av efavirenz på 1,6-9,1 μM ble oppnådd innen 5 timer etter orale enkeltdoser på 100 mg til 1600 mg administrert til uinfiserte frivillige. Doserelaterte økninger i Cmax og AUC ble sett for doser opp til 1600 mg; økningene var mindre enn proporsjonale, noe som tyder på redusert absorpsjon ved høyere doser.
Hos HIV-1-infiserte pasienter ved steady state var gjennomsnittlig Cmax, gjennomsnittlig Cmin og gjennomsnittlig AUC doseproporsjonale etter 200 mg, 400 mg og 600 mg daglige doser. Tid til topp plasmakonsentrasjoner var ca. 3-5 timer og steady-state plasmakonsentrasjoner ble nådd i løpet av 6-10 dager. Hos 35 pasienter som fikk SUSTIVA 600 mg én gang daglig, var steady-state Cmax 12,9 ± 3,7 μM (gjennomsnittlig ± SD), steadystate Cmin var 5,6 ± 3,2 μM, og AUC var 184 ± 73 μM•t.
Effekt av mat på oral absorpsjon:
Kapsler
Administrering av en enkeltdose på 600 mg efavirenz kapsler sammen med et måltid med høyt fett/høyt kaloriinnhold (894 kcal, 54 g fett, 54 % kalorier fra fett) eller et måltid med redusert fett/normalt kaloriinnhold (440 kcal, 2 g) fett, 4 % kalorier fra fett) var assosiert med en gjennomsnittlig økning på 22 % og 17 % i efavirenz AUC∞ og en gjennomsnittlig økning på henholdsvis 39 % og 51 % i efavirenz Cmax, i forhold til eksponeringene som ble oppnådd når gitt under fastende forhold . [se DOSERING OG ADMINISTRASJON og PASIENTINFORMASJON .]
Nettbrett
Administrering av en enkelt 600 mg efavirenz tablett sammen med et måltid med høyt fett/høyt kaloriinnhold (omtrent 1000 kcal, 500-600 kcal fra fett) var assosiert med en 28 % økning i gjennomsnittlig AUC∞ for efavirenz og en 79 % økning i gjennomsnittlig Cmax for efavirenz i forhold til eksponeringene oppnådd under fastende forhold. [se DOSERING OG ADMINISTRASJON og PASIENTINFORMASJON .]
Biotilgjengelighet av kapselinnhold blandet med matbærere
Hos friske voksne forsøkspersoner oppfylte efavirenz AUC når det ble administrert som innholdet av tre 200 mg kapsler blandet med 2 ts av visse matbærere (eplemos, druegelé eller yoghurt, eller morsmelkerstatning) bioekvivalenskriteriene for AUC for den intakte kapselformuleringen som ble administrert under fastende forhold.
Fordeling
Efavirenz er sterkt bundet (omtrent 99,5-99,75 %) til humane plasmaproteiner, hovedsakelig albumin. Hos HIV-1-infiserte pasienter (n=9) som fikk SUSTIVA 200 til 600 mg én gang daglig i minst én måned, varierte konsentrasjonen av cerebrospinalvæske fra 0,26 til 1,19 % (gjennomsnittlig 0,69 %) av den tilsvarende plasmakonsentrasjonen. Denne andelen er omtrent 3 ganger høyere enn den ikke-proteinbundne (fri) fraksjonen av efavirenz i plasma.
Metabolisme
Studier på mennesker og in vitro-studier med humane levermikrosomer har vist at efavirenz hovedsakelig metaboliseres av cytokrom P450-systemet til hydroksylerte metabolitter med påfølgende glukuronidering av disse hydroksylerte metabolittene. Disse metabolittene er i hovedsak inaktive mot HIV-1. In vitro-studiene tyder på at CYP3A og CYP2B6 er de viktigste isozymene som er ansvarlige for metabolismen av efavirenz.
Efavirenz har vist seg å indusere CYP-enzymer, noe som resulterer i induksjon av sin egen metabolisme. Flere doser på 200-400 mg per dag i 10 dager resulterte i en lavere enn antatt grad av akkumulering (22-42 % lavere) og en kortere terminal halveringstid på 40-55 timer (enkeltdosehalveringstid 52-76 timer) ).
Eliminering
Efavirenz har en terminal halveringstid på 52-76 timer etter enkeltdoser og 40-55 timer etter gjentatte doser. En 1-måneders massebalanse/ekskresjonsstudie ble utført med 400 mg per dag med en C-merket dose administrert på dag 8. Omtrent 14-34 % av radiomerket ble gjenfunnet i urinen og 16-61 % ble gjenfunnet i feces . Nesten all urinutskillelse av det radiomerkede legemidlet var i form av metabolitter. Efavirenz sto for størstedelen av den totale radioaktiviteten målt i feces.
Spesielle populasjoner
Pediatrisk
De farmakokinetiske parameterne for efavirenz ved steady state hos pediatriske pasienter ble forutsagt av en populasjonsfarmakokinetisk modell og er oppsummert i tabell 6 etter vektområder som tilsvarer anbefalte doser.
Kjønn og rase
Farmakokinetikken til efavirenz hos pasienter ser ut til å være lik mellom menn og kvinner og blant de undersøkte rasegruppene.
Nedsatt nyrefunksjon
Farmakokinetikken til efavirenz er ikke studert hos pasienter med nyresvikt; mindre enn 1 % av efavirenz skilles ut uendret i urinen, så innvirkningen av nedsatt nyrefunksjon på efavirenz-eliminasjonen bør være minimal.
Nedsatt leverfunksjon
En flerdosestudie viste ingen signifikant effekt på efavirenz farmakokinetikk hos pasienter med lett nedsatt leverfunksjon (Child-Pugh klasse A) sammenlignet med kontroller. Det var utilstrekkelige data til å bestemme om moderat eller alvorlig nedsatt leverfunksjon (Child-Pugh klasse B eller C) påvirker efavirenz farmakokinetikk.
Legemiddelinteraksjonsstudier
Efavirenz har vist seg in vivo å forårsake leverenzyminduksjon, og dermed øke biotransformasjonen av enkelte legemidler som metaboliseres av CYP3A og CYP2B6. In vitro-studier har vist at efavirenz hemmet CYP-isozymene 2C9 og 2C19 med Ki-verdier (8,5-17 μM) i området for observerte plasmakonsentrasjoner av efavirenz. I in vitro-studier hemmet ikke efavirenz CYP2E1 og hemmet CYP2D6 og CYP1A2 (Ki-verdier 82-160 μM) kun ved konsentrasjoner godt over de klinisk oppnådd. Samtidig administrering av efavirenz med legemidler som primært metaboliseres av CYP2C9, CYP2C19, CYP3A eller CYP2B6 isozymer kan resultere i endrede plasmakonsentrasjoner av det samtidig administrerte legemidlet. Legemidler som induserer CYP3A- og CYP2B6-aktivitet vil forventes å øke clearance av efavirenz, noe som resulterer i reduserte plasmakonsentrasjoner.
Legemiddelinteraksjonsstudier ble utført med efavirenz og andre legemidler som sannsynligvis vil bli administrert samtidig eller legemidler som vanligvis brukes som prober for farmakokinetisk interaksjon. Effektene av samtidig administrering av efavirenz på Cmax, AUC og Cmin er oppsummert i Tabell 7 (effekt av efavirenz på andre legemidler) og Tabell 8 (effekt av andre legemidler på efavirenz). For informasjon om kliniske anbefalinger se NARKOTIKAHANDEL .
Mikrobiologi
Virkningsmekanismen
Efavirenz er en NNRTI av HIV-1. Efavirenz-aktivitet medieres hovedsakelig av ikke-kompetitiv hemming av HIV-1 revers transkriptase. HIV-2 revers transkriptase og humane cellulære DNA-polymeraser α, β, γ og δ hemmes ikke av efavirenz.
Antiviral aktivitet i cellekultur
Konsentrasjonen av efavirenz som hemmer replikasjon av villtype laboratorietilpassede stammer og kliniske isolater i cellekultur med 90-95 % (EC90-95) varierte fra 1,7 til 25 nM i lymfoblastoidcellelinjer, mononukleære celler fra perifert blod (PBMC) og makrofager. /monocyttkulturer. Efavirenz viste antiviral aktivitet mot klasse B og de fleste ikke-klade B-isolater (subtype A, AE, AG, C, D, F, G, J, N), men hadde redusert antiviral aktivitet mot gruppe O-virus. Efavirenz demonstrerte additiv antiviral aktivitet uten cytotoksisitet mot HIV-1 i cellekultur når det ble kombinert med NNRTI-ene delavirdin og nevirapin, NRTI-er (abakavir, didanosin, emtricitabin, lamivudin, stavudin, tenofovir, zalcitabin, zidovrena, PIs, indvira, PIs, PIs nelfinavir, ritonavir, sakinavir), og fusjonshemmeren enfuvirtid. Efavirenz viste additiv til antagonistisk antiviral aktivitet i cellekultur med atazanavir. Efavirenz var ikke antagonistisk med adefovir, brukt til behandling av hepatitt B-virusinfeksjon, eller ribavirin, brukt i kombinasjon med interferon for behandling av hepatitt C-virusinfeksjon.
Motstand
cellekultur
I cellekultur oppstod HIV-1-isolater med redusert følsomhet for efavirenz (>380 ganger økning i EC90-verdi) raskt i nærvær av medikament. Genotypisk karakterisering av disse virusene identifiserte enkle aminosyresubstitusjoner L100I eller V179D, doble substitusjoner L100I/V108I og trippelsubstitusjoner L100I/V179D/Y181C i revers transkriptase.
Kliniske studier
Kliniske isolater med redusert følsomhet i cellekultur for efavirenz er oppnådd. En eller flere substitusjoner i aminosyreposisjonene 98, 100, 101, 103, 106, 108, 188, 190, 225 og 227 i revers transkriptase ble observert hos pasienter som sviktet behandling med efavirenz i kombinasjon med indinavir, eller med zidovudin pluss lamivudin. K103N-substitusjonen var den hyppigst observerte. Langsiktig resistensovervåking (gjennomsnittlig 52 uker, intervall 4-106 uker) analyserte 28 matchende baseline-isolater og virologisk svikt. 61 prosent (17/28) av disse sviktisolatene hadde redusert følsomhet for efavirenz i cellekultur med en median 88 ganger endring i følsomhet for efavirenz (EC50-verdi) fra referansen. Den hyppigste NNRTI-substitusjonen som ble utviklet hos disse pasientisolatene var K103N (54 %). Andre NNRTI-substitusjoner som utviklet seg inkluderte L100I (7%), K101E/Q/R (14%), V108I (11%), G190S/T/A (7%), P225H (18%) og M230I/L (11%) %).
Kryssmotstand
Kryssresistens blant NNRTIer er observert. Kliniske isolater tidligere karakterisert som efavirenz-resistente var også fenotypisk resistente i cellekultur mot delavirdin og nevirapin sammenlignet med baseline. Delavirdin- og/eller nevirapinresistente kliniske virale isolater med NNRTI-resistensassosierte substitusjoner (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, F237a susceptibility) i cellekultur. Mer enn 90 % av NRTI-resistente kliniske isolater testet i cellekultur beholdt følsomheten for efavirenz.
dyretoksikologi
Ikke-vedvarende kramper ble observert hos 6 av 20 aper som fikk efavirenz i doser som ga plasma AUC-verdier 4-13 ganger høyere enn hos mennesker gitt anbefalt dose [se ADVARSLER OG FORHOLDSREGLER ].
Kliniske studier
Voksne
Studie 006 en randomisert, åpen studie, sammenlignet SUSTIVA (600 mg én gang daglig) + zidovudin (ZDV, 300 mg 12h) + lamivudin (LAM, 150 mg 12h) eller SUSTIVA (600 mg én gang daglig) + indinavir (IDV, 1000 mg q8h) med indinavir (800 mg q8h) + zidovudin (300 mg q12h) + lamivudin (150 mg q12h). Tolv hundre sekstiseks pasienter (gjennomsnittsalder 36,5 år [område 18-81], 60 % kaukasiske, 83 % menn) ble registrert. Alle pasientene var efavirenz-, lamivudin-, NNRTI- og PI-naive ved studiestart. Median baseline CD4+ celletall var 320 celler/mm3 og median baseline HIV-1 RNA nivå var 4,8 log kopier/ml. Behandlingsresultater med standardanalyse (analysegrense 400 kopier/ml) gjennom 48 og 168 uker er vist i tabell 9. Plasma HIV RNA-nivåer ble kvantifisert med standard (analysegrense 400 kopier/ml) og ultrasensitiv (analysegrense 50 kopier/ml) versjoner av AMPLICOR HIV-1 MONITOR-analysen. Under studien ble versjon 1.5 av analysen introdusert i Europa for å forbedre deteksjonen av ikke-klade B-virus.
For pasienter behandlet med SUSTIVA + zidovudin + lamivudin, SUSTIVA + indinavir eller indinavir + zidovudin + lamivudin, var prosentandelen av respondere med HIV-1 RNA
ACTG 364 er en randomisert, dobbeltblind, placebokontrollert, 48-ukers studie med NRTI-erfarne pasienter som hadde fullført to tidligere ACTG-studier. Ett hundre og nittiseks pasienter (gjennomsnittsalder 41 år [område 18-76], 74 % kaukasiske, 88 % menn) fikk NRTIs i kombinasjon med SUSTIVA (600 mg én gang daglig), eller nelfinavir (NFV, 750 mg tre ganger daglig). ), eller SUSTIVA (600 mg én gang daglig) + nelfinavir på en randomisert, dobbeltblindet måte. Gjennomsnittlig baseline CD4+ celletall var 389 celler/mm3 og gjennomsnittlig baseline HIV-1 RNA nivå var 8130 kopier/ml. Ved inntreden i studien ble alle pasienter tildelt et nytt åpent NRTI-regime, som var avhengig av deres tidligere NRTI-behandlingserfaring. Det var ingen signifikant forskjell i gjennomsnittlig CD4+-celletall blant behandlingsgruppene; den totale gjennomsnittlige økningen var ca. 100 celler etter 48 uker blant pasienter som fortsatte med studieregimer. Behandlingsresultater er vist i tabell 10. Plasma HIV RNA-nivåer ble kvantifisert med AMPLICOR HIV-1 MONITOR-analysen ved bruk av en nedre grense for kvantifisering på 500 kopier/ml.
En Kaplan-Meier-analyse av tid til behandlingssvikt gjennom 72 uker viser en lengre varighet av virologisk undertrykkelse (HIV RNA
Pediatriske pasienter
Studie AI266922 er en åpen studie for å evaluere farmakokinetikken, sikkerheten, tolerabiliteten og den antivirale aktiviteten til SUSTIVA 200 mg i kombinasjon med didanosin og emtricitabin hos antiretroviral-naive og -erfarne pediatriske pasienter. Trettisju pasienter i alderen 3 måneder til 6 år (median 0,7 år) ble behandlet med SUSTIVA. Ved baseline var median plasma HIV-1 RNA 5,88 log kopier/ml, median CD4+ celletall var 1144 celler/mm3, og median CD4+ prosentandel var 25 %. Mediantiden på studieterapi var 60 uker; 27 % av pasientene avbrøt behandlingen før uke 48. Ved bruk av en ITT-analyse var den totale andelen av pasienter med HIV RNA
Studien PACTG 1021 var en åpen studie for å evaluere farmakokinetikken, sikkerheten, toleransen og den antivirale aktiviteten til SUSTIVA 200 mg i kombinasjon med didanosin og emtricitabin hos pediatriske pasienter som var naive med antiretroviral terapi. Førti-tre pasienter i alderen 3 måneder til 21 år (median 9,6 år) ble doseret med SUSTIVA. Ved baseline var median plasma HIV-1 RNA 4,8 log kopier/ml, median CD4+ celletall var 367 celler/mm3, og median CD4+ prosentandel var 18 %. Mediantiden på studieterapi var 181 uker; 16 % av pasientene avbrøt behandlingen før uke 48. Ved bruk av en ITT-analyse var den totale andelen av pasienter med HIV RNA
Studie PACTG 382 var en åpen studie for å evaluere farmakokinetikken, sikkerheten, toleransen og den antivirale aktiviteten til SUSTIVA i kombinasjon med nelfinavir og en NRTI hos antiretroviral-naive og NRTI-erfarne pediatriske pasienter. Ett hundre to pasienter i alderen 3 måneder til 16 år (median 5,7 år) ble behandlet med SUSTIVA. 87 prosent av pasientene hadde mottatt antiretroviral behandling tidligere. Ved baseline var median plasma HIV-1 RNA 4,57 log kopier/ml, median CD4+ celletall var 755 celler/mm3, og median CD4+ prosentandel var 30 %. Mediantiden på studieterapi var 118 uker; 25 % av pasientene avsluttet behandlingen før uke 48. Ved bruk av en ITT-analyse var den totale andelen av pasienter med HIV RNA
PASIENTINFORMASJON
SUSTIVA® (sus-TEE-vah) (efavirenz) kapsler
SUSTIVA® (sus-TEE-vah) (efavirenz) tabletter
Viktig: Spør legen din eller apoteket om medisiner som ikke bør tas sammen med SUSTIVA. For mer informasjon, se avsnittet "Hva bør jeg fortelle legen min før jeg tar SUSTIVA?"
Les denne pasientinformasjonen før du begynner å ta SUSTIVA og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med legen din om din medisinske tilstand eller behandling.
Hva er SUSTIVA?
SUSTIVA 600mg er et reseptbelagt HIV-1 (Human Immunodeficiency Virus type 1) medisin som brukes sammen med andre antiretrovirale medisiner for å behandle HIV-1 infeksjon hos voksne og barn som er minst 3 måneder gamle og som veier minst 7 pund 12 unser (3,5 gram). kg). HIV er viruset som forårsaker AIDS (Acquired Immune Deficiency Syndrome).
Det er ikke kjent om SUSTIVA er trygt og effektivt hos barn yngre enn 3 måneder eller som veier mindre enn 3,5 kg (7 pund).
Når det brukes sammen med andre antiretrovirale legemidler for å behandle HIV-1-infeksjon, kan SUSTIVA 600 mg hjelpe:
- . redusere mengden av HIV-1 i blodet ditt. Dette kalles viral belastning. . øke antallet CD4+ (T)-celler i blodet ditt som bidrar til å bekjempe andre infeksjoner.
Å redusere mengden av HIV-1 og øke CD4+ (T)-cellene i blodet ditt kan bidra til å forbedre immunforsvaret ditt. Dette kan redusere risikoen for død eller få infeksjoner som kan oppstå når immunsystemet ditt er svakt (opportunistiske infeksjoner).
SUSTIVA 600mg kurerer ikke HIV-1-infeksjon eller AIDS. Du bør fortsette å ta HIV-1-medisiner for å kontrollere HIV-1-infeksjon og redusere HIV-relaterte sykdommer.
Unngå å gjøre ting som kan spre HIV-1-infeksjon til andre:
- . Ikke del eller gjenbruk nåler eller annet injeksjonsutstyr. . Ikke del personlige gjenstander som kan ha blod eller kroppsvæsker på seg, som tannbørster og barberblader. . Ikke ha noen form for sex uten beskyttelse. Utøv alltid tryggere sex ved å bruke lateks- eller polyuretankondom for å redusere sjansen for seksuell kontakt med kroppsvæsker som sæd, vaginale sekreter eller blod.
Spør legen din hvis du har spørsmål om hvordan du kan forhindre overføring av HIV til andre mennesker.
Hvem bør ikke ta SUSTIVA 600mg?
Ikke ta SUSTIVA hvis du er allergisk mot efavirenz eller noen av innholdsstoffene i SUSTIVA. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i SUSTIVA.
Ikke ta SUSTIVA hvis du bruker elbasvir og grazoprevir (ZEPATIER®).
Hva bør jeg fortelle legen min før jeg tar SUSTIVA 200mg?
Før du tar SUSTIVA, fortell legen din dersom du har noen medisinske tilstander og spesielt hvis du:
- . har en hjertesykdom . noen gang har hatt psykiske problemer . noen gang har brukt gatenarkotika eller store mengder alkohol . har leverproblemer, inkludert hepatitt B- eller C-virusinfeksjon . har en historie med anfall . er gravid eller planlegger å bli gravid. SUSTIVA 600mg kan skade det ufødte barnet ditt. Hvis du er i stand til å bli gravid, bør helsepersonell ta en graviditetstest før du starter SUSTIVA. Du bør ikke bli gravid mens du tar SUSTIVA og i 12 uker etter avsluttet behandling med SUSTIVA. Kvinner som er i stand til å bli gravide bør bruke 2 effektive former for prevensjon under behandlingen og i 12 uker etter avsluttet behandling med SUSTIVA. En barriereform for prevensjon bør alltid brukes sammen med en annen type prevensjon. . Barriereformer for prevensjon kan inkludere lateks- eller polyuretankondom, prevensjonssvamp, membran med sæddrepende middel og cervikalhette. . Hormonelle former for prevensjon, som p-piller, injeksjoner, vaginale ringer eller implantater fungerer kanskje ikke under behandling med SUSTIVA. . Snakk med legen din om former for prevensjon som kan brukes under behandling med SUSTIVA. . Svangerskapsregisteret. Det finnes et svangerskapsregister for kvinner som tar antiretrovirale medisiner under svangerskapet. Formålet med dette registeret er å samle informasjon om helsen til deg og babyen din. Snakk med legen din om hvordan du kan ta del i dette registeret. . Ikke amme hvis du tar SUSTIVA. . Du bør ikke amme hvis du har HIV på grunn av risikoen for å overføre HIV til babyen din.
Fortell legen din og apoteket om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
SUSTIVA 600mg kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan SUSTIVA 600mg virker, og kan forårsake alvorlige bivirkninger. Hvis du tar visse medisiner sammen med SUSTIVA, kan mengden SUSTIVA 600 mg i kroppen din være for lav, og det kan hende at det ikke virker for å hjelpe til med å kontrollere HIV-infeksjonen din. HIV-viruset i kroppen din kan bli resistent mot SUSTIVA eller andre HIV-medisiner som ligner det.
Du bør ikke ta SUSTIVA 600 mg hvis du tar ATRIPLA (efavirenz, emtricitabin, tenofovirdisoproksilfumarat) med mindre legen din ber deg om det.
Fortell legen din og apoteket om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Noen legemidler interagerer med SUSTIVA.
Hold en liste over medisinene dine for å vise legen din og apoteket.
- . Du kan spørre legen din eller apoteket om en liste over legemidler som interagerer med SUSTIVA. . Ikke begynn å ta en ny medisin uten å fortelle legen din. Legen din kan fortelle deg om det er trygt å ta SUSTIVA sammen med andre legemidler.
Hvordan skal jeg ta SUSTIVA?
- . Ta SUSTIVA 600 mg nøyaktig slik legen din har fortalt deg. . Ikke endre dosen eller slutt å ta SUSTIVA med mindre legen din ber deg om det. . Hold deg under oppsyn av legen din under behandling med SUSTIVA. . SUSTIVA må brukes sammen med andre antiretrovirale legemidler. . Ta SUSTIVA 1 gang hver dag. . SUSTIVA kommer som tabletter eller kapsler. . SUSTIVA tabletter må ikke brytes. . Svelg SUSTIVA tabletter eller kapsler hele med væske.
Hvordan og når du skal ta SUSTIVA.
- . Du bør ta SUSTIVA 600 mg på tom mage ved sengetid. Å ta SUSTIVA 200 mg sammen med mat øker mengden medisin i kroppen din. Noen bivirkninger kan plage deg mindre hvis du tar SUSTIVA 600 mg på tom mage og ved sengetid. . Barnets lege vil foreskrive riktig dose SUSTIVA 200mg basert på barnets vekt. . Fortell legen din dersom du har problemer med å svelge tabletter eller kapsler. Legen din kan anbefale å åpne SUSTIVA-kapselen og blande innholdet med mat eller morsmelkerstatning. Se den detaljerte "Bruksanvisningen" på slutten av denne pasientinformasjonen for å lære den riktige måten å ta SUSTIVA 600mg ved bruk av kapseldryssmetoden. . Voksne og barn som tar SUSTIVA 600mg ved bruk av kapseldryss-metoden bør ikke spise i 2 timer etter å ha tatt en dose SUSTIVA. . Babyer bør ikke gis morsmelkerstatning før 2 timer etter at de har tatt en dose SUSTIVA ved bruk av kapseldryssmetoden. . Ikke gå glipp av en dose SUSTIVA. Hvis du glemmer å ta SUSTIVA, ta den glemte dosen med en gang, med mindre det nesten er tid for neste dose. Ikke ta 2 doser på en gang. Bare ta din neste dose til ditt faste tidspunkt. Hvis du trenger hjelp til å planlegge de beste tidspunktene for å ta medisinen, spør legen din eller apoteket. . Hvis du tar for mye SUSTIVA, ring legen din eller gå til nærmeste legevakt umiddelbart. . Når SUSTIVA 600 mg-forsyningen begynner å bli tom, få mer fra legen din eller apoteket. Det er viktig å ikke gå tom for SUSTIVA. Mengden av HIV-1 i blodet ditt kan øke hvis medisinen stoppes for en kort stund. Viruset kan bli resistent mot SUSTIVA 600 mg og vanskeligere å behandle.
Hva er de mulige bivirkningene av SUSTIVA?
SUSTIVA 600mg kan forårsake alvorlige bivirkninger, inkludert:
Hvis du har svimmelhet, konsentrasjonsvansker eller døsighet, ikke kjør bil, bruk maskiner eller gjør noe som krever at du er på vakt.
Noen symptomer på nervesystemet (f.eks. forvirring, langsomme tanker og fysiske bevegelser, og vrangforestillinger [falsk tro] eller hallusinasjoner [å se eller høre ting som andre ikke ser eller hører]) kan oppstå måneder til år etter oppstart av SUSTIVA 600 mg-behandling. Kontakt din helsepersonell umiddelbart dersom noen av disse symptomene skulle oppstå.
Fortell legen din umiddelbart hvis du får noen av følgende symptomer:
- . Alvorlige psykiske problemer kan skje hos personer som tar SUSTIVA. Fortell legen din umiddelbart hvis du har noen av følgende symptomer:
- . føl deg trist eller håpløs ikke stol på andre mennesker . føler seg engstelig eller rastløs høre eller se ting som ikke er ekte . har tanker om å skade deg selv (selvmord) eller har forsøkt å skade deg selv eller andre . er ikke i stand til å bevege seg eller snakke normalt . er ikke i stand til å se forskjell på hva som er sant eller ekte og hva som er usant eller uvirkelig
- . svimmelhet . problemer med å konsentrere seg . problemer med å sove . døsighet . uvanlige drømmer . mangel på koordinasjon eller problemer med balanse
- . hudutslett, med eller uten kløe . peeling hud . feber . munnsår . hevelse i ansiktet ditt . røde eller betente øyne, som "rosa øye" (konjunktivitt) . blemmer eller hudlesjoner
- . huden din eller den hvite delen av øynene dine blir gule (gulsott) . du har ikke lyst til å spise mat på flere dager eller lenger . urinen din blir mørk . du føler deg dårlig i magen (kvalme) . din avføring (avføring) blir lys i fargen . du har smerter i nedre del av magen (mage).
De vanligste bivirkningene av SUSTIVA 600mg inkluderer:
- . utslett . unormale drømmer . svimmelhet . tretthet . kvalme . problemer med å sove . hodepine . oppkast . konsentrasjonsvansker
Noen pasienter som tar SUSTIVA har opplevd økte nivåer av lipider (kolesterol og triglyserider) i blodet. Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av SUSTIVA. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare SUSTIVA?
- . Oppbevar SUSTIVA kapsler og tabletter ved romtemperatur mellom 20 °C til 25 °C (68 °F til 77 °F).
Oppbevar SUSTIVA og alle legemidler utilgjengelig for barn.
Generell informasjon om SUSTIVA
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i et pasientinformasjonshefte. Ikke bruk SUSTIVA 600mg for en tilstand det ikke er foreskrevet for. Ikke gi SUSTIVA 600 mg til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre apoteket eller legen om informasjon om SUSTIVA som er skrevet for helsepersonell. For mer informasjon, gå til www.sustiva.com eller ring 1-800-321-1335.
Hva er ingrediensene i SUSTIVA?
Aktiv ingrediens: efavirenz
Inaktive ingredienser:
SUSTIVA 600mg kapsler: laktosemonohydrat, magnesiumstearat, natriumlaurylsulfat og natriumstivelsesglykolat. Kapselskallet inneholder gelatin, natriumlaurylsulfat, titandioksid og/eller gult jernoksid. Kapselskallet kan også inneholde silisiumdioksid. Kapslene er trykt med blekk som inneholder carmine 40 blue, FD&C Blue No. 2 og titandioksid.
SUSTIVA tabletter: kroskarmellosenatrium, hydroksypropylcellulose, laktosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose og natriumlaurylsulfat. Tablettfilmbelegget inneholder Opadry Yellow og Opadry Clear. Tablettene er polert med karnaubavoks og trykket med lilla blekk, Opacode WB.
Denne pasientinformasjonen er godkjent av US Food and Drug Administration.
Instruksjoner for bruk
SUSTIVA® (sus-TEE-vah) (efavirenz) kapsler
Klargjøring av en dose SUSTIVA 600mg ved bruk av kapsel-strømetoden
Les denne bruksanvisningen før du tilbereder din første dose av SUSTIVA blandet med mat eller morsmelkerstatning ved bruk av kapseldryssmetoden, hver gang du får påfyll, og etter behov. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med legen din om din medisinske tilstand eller behandling. Spør legen din eller apoteket hvis du har spørsmål om hvordan du skal blande eller gi en dose SUSTIVA 200 mg ved bruk av kapsel-strømetoden.
Viktig informasjon:
- . For mer informasjon om SUSTIVA 600 mg kapsler, se pasientinformasjonsheftet. . Kapseldryssmetoden for å blande innholdet i SUSTIVA kapsler med myk mat eller morsmelkerstatning kan brukes til voksne eller barn som ikke kan svelge kapsler eller tabletter. . Du bør ta SUSTIVA 600 mg på tom mage ved sengetid. . Du bør ikke spise i 2 timer etter at du har tatt SUSTIVA blandet med mat. . Babyer som er gamle nok til å svelge mat bør gis SUSTIVA ved bruk av kapseldryss-metoden blandet med mat i stedet for med morsmelkerstatning. . Snakk med legen din for å hjelpe deg med å bestemme den beste tidsplanen for å gi babyen din SUSTIVA blandet med morsmelkerstatning ved bruk av kapseldryssmetoden.
Tilberedning av en dose SUSTIVA 600mg blandet med mat ved bruk av kapseldryssmetoden.
Før du tilbereder en dose av SUSTIVA 200 mg blandet med mat ved bruk av kapseldryssmetoden, samle følgende forsyninger:
- . tørkepapir . teskje for måling . liten skje for røring og mating . liten ren beholder (som en liten kopp eller bolle) . myk mat som eplemos, druegelé eller yoghurt
Trinn 1. Velg en ren, flat arbeidsflate. Legg et rent papirhåndkle på arbeidsflaten. Legg deretter de andre forsyningene på papirhåndkleet.
Steg 2. Vask og tørk hendene godt.
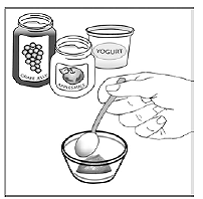
Trinn 3. Legg 1 til 2 teskjeer myk mat som eplemos, druegelé eller yoghurt i den lille beholderen (se Figur A ). Fargen og tykkelsen på maten kan endres når den blandes med medisinen.
Figur A
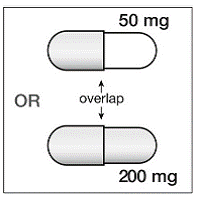
Trinn 4. Det er 2 deler av SUSTIVA 200 mg kapsel. Se på SUSTIVA-kapselen for å se hvilken del av kapselen som overlapper den andre delen (se Figur B ).
Figur B
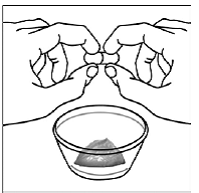
Trinn 5. Hold SUSTIVA-kapselen i sidelengs (horisontal) posisjon rett over beholderen med mat. Hold hver ende av SUSTIVA-kapselen mellom tomlene og pekefingrene (se Figur C ).
Figur C
Trinn 6. Bruk tommelen og pekefingeren til å klype nær enden av den overlappende delen av SUSTIVA 600 mg kapselen (se Figur D ).
Figur D
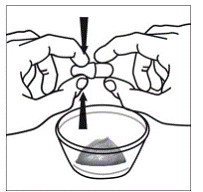
Vri deretter begge endene av SUSTIVA 600 mg kapselen forsiktig i motsatte retninger for å åpne den (se Figur E ). Vær forsiktig så du ikke søler kapselinnholdet eller sprer det i luften.
Figur E

Trinn 7. Dryss innholdet i SUSTIVA-kapselen på maten (se Figur F ).
- . Sjekk kapselskallene for å sikre at de er tomme. . Kast de tomme kapselskallene.
Figur F

Hvis den totale foreskrevet dose er mer enn 1 kapsel, følg trinn 4 til 7 for hver kapsel. Ikke tilsett mer mat.
Trinn 8 til 11 skal fullføres innen 30 minutter å blande medisinen (se Figur G ).
Figur G

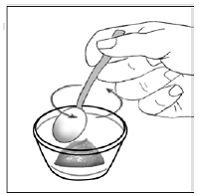
Trinn 8. Bruk den lille skjeen til å blande kapselinnholdet og maten forsiktig sammen (se Figur H ). Sprinkles vil ikke løse seg opp. Blandingen vil se kornete ut, men bør ikke være klumpete.
Figur H
Trinn 9. Bruk den lille skjeen til å gi eller ta blandingen av mat og kapselinnhold. Pass på at all blandingen er svelget.
Trinn 10. Tilsett ca. 2 ts mer av maten i den tomme beholderen og rør forsiktig med den lille skjeen for å blande med eventuelt kapselinnhold som fortsatt kan være i beholderen.
Trinn 11. Bruk den lille skjeen til å gi eller ta blandingen av mat og kapselinnhold. Sørg for at all blandingen er svelget.
Trinn 12. Vask beholderen og skjeene. Kast papirhåndkleet og rengjør arbeidsflaten. Vask hendene.
Forberedelse av en dose SUSTIVA 600 mg blandet med morsmelkerstatning ved bruk av kapseldryssmetoden
For å være sikker på at babyen din får i seg all medisinen, ikke gi SUSTIVA kapselinnholdet til babyen din i en flaske.
Før du tilbereder en dose SUSTIVA blandet med morsmelkerstatning ved bruk av kapseldryssmetoden, samle følgende forsyninger:
- . tørkepapir . teskje for omrøring og måling . liten ren beholder (som en liten kopp eller bolle) (se Figur I ). . 10 mL oral doseringssprøyte (spør apoteket om dette) (se Figur I ). . morsmelkerstatning ved romtemperatur.
Figur I
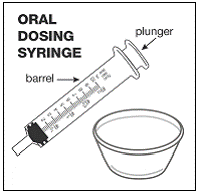
Trinn 1. Tilbered morsmelkerstatningen i henhold til instruksjonene på morsmelkerstatningen. Du vil bruke omtrent 1 unse av formelen for å gi medisinen. Eventuell gjenværende formel bør ikke gis til barnet i 2 timer.
Steg 2. Velg en ren, flat arbeidsflate. Legg et rent papirhåndkle på arbeidsflaten. Plasser forsyningene du trenger på papirhåndkleet.
Trinn 3. Vask og tørk hendene godt.
Trinn 4. Hell 2 ts romtemperatur morsmelkerstatning i beholderen (se Figur J ).
Figur J
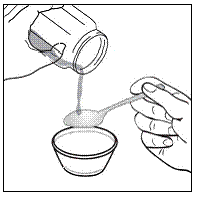
Trinn 5. Det er 2 deler av SUSTIVA-kapselen. Se på SUSTIVA-kapselen for å se hvilken del av kapselen som overlapper den andre delen (se Figur K ).
Figur K
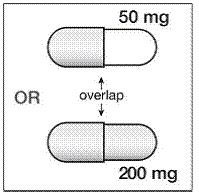
Trinn 6. Hold SUSTIVA-kapselen i sidelengs (horisontal) stilling rett over beholderen med morsmelkerstatningen. Hold hver ende av SUSTIVA 600 mg kapselen mellom tomlene og pekefingrene (se Figur L ).
Figur L
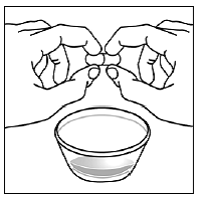
Trinn 7. Bruk tommelen og pekefingeren til å klype nær enden av den overlappende delen av SUSTIVA-kapselen (se Figur M ).
Figur M
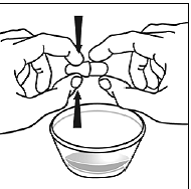
Vri deretter begge endene av SUSTIVA-kapselen forsiktig i motsatte retninger for å åpne den (se Figur N ). Vær forsiktig så du ikke søler kapselinnholdet eller sprer det i luften.
Figur N
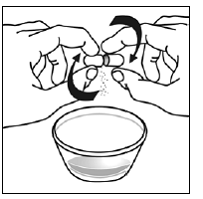
Trinn 8. Dryss innholdet i SUSTIVA 600mg kapselen på morsmelkerstatningen (se Figur O ).
- . Sjekk kapselskallene for å sikre at de er tomme. . Kast de tomme kapselskallene.
Figur O
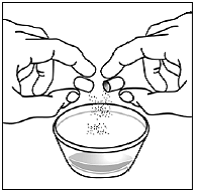
Hvis den totale foreskrevet dose er mer enn 1 kapsel, følg trinn 5 til 8 for hver kapsel. Ikke tilsett mer morsmelkerstatning.
Trinn 9 til 12 skal fullføres innen 30 minutter å blande medisinen (se Figur P ).
Figur P

Trinn 9. Hold beholderen med én hånd. Med den andre hånden, bruk teskjeen til å blande kapselinnholdet og morsmelkerstatningen forsiktig (se Figur Q ). Sprinkles vil ikke løse seg opp. Blandingen vil se kornete ut, men bør ikke være klumpete.
Figur Q
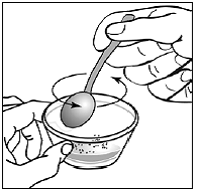
Trinn 10. Slik trekker du opp hele blandingen i den orale doseringssprøyten:
Figur R
Figur S
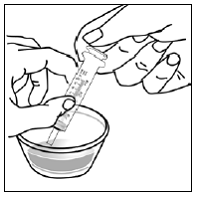
Figur T
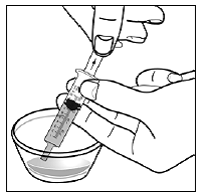
- . Kontroller at stempelet er presset helt inn i sylinderen til sprøyten (se Figur R ). . Plasser spissen av sprøyten i blandingen i beholderen (se Figur S ). . Trekk stempelet sakte tilbake og trekk opp hele blandingen (se Figur T ).
Trinn 11. Plasser spissen av sprøyten i babyens munn langs det indre kinnet (se Figur U ). Trykk sakte på stempelet for å gi babyen hele blandingen.
Figur U
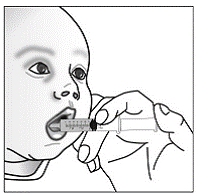
Trinn 12. For å sikre at all medisinen er gitt til babyen din:
- . Gjenta trinn 4 ovenfor. . Rør med en teskje. . Gjenta deretter Trinn 10 og 11 ovenfor (se Figur V ).
Figur V
Trinn 13. Fjern stempelet fra den orale doseringssprøyten. Vask beholderen, teskjeen og oral doseringssprøyte. La stempelet og sprøytehylsen tørke før du setter dem sammen igjen.
Trinn 14. Kast papirhåndkleet og rengjør arbeidsflaten. Vask hendene.
Hvordan bør jeg oppbevare SUSTIVA 600mg kapsler?
- . Oppbevar SUSTIVA kapsler ved romtemperatur mellom 68 °F til 77 °F (20 °C til 25 °C).
Oppbevar SUSTIVA 600 mg kapsler og alle legemidler utilgjengelig for barn.
Denne bruksanvisningen er godkjent av US Food and Drug Administration.
