Arimidex 1mg Anastrozole Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Arimidex og hvordan brukes det?
Arimidex 1mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på brystkreft hos postmenopausale kvinner. Arimidex kan brukes alene eller sammen med andre medisiner.
Arimidex tilhører en klasse legemidler som kalles Antineoplastics, Aromatase Inhibitor.
Det er ikke kjent om Arimidex er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Arimidex?
Arimidex kan forårsake alvorlige bivirkninger inkludert:
- . kortpustethet, . beinbrudd, . hovne kjertler, . kvalme, . smerter i øvre mage, . kløe, . tretthet, . tap av Appetit, . mørk urin, . leirefarget avføring, . gulfarging av hud eller øyne (gulsott), . plutselig nummenhet eller svakhet (spesielt på den ene siden av kroppen), . plutselig kraftig hodepine, . utydelig tale, . problemer med syn eller balanse, . feber, . sår hals, . hevelse i ansiktet eller tungen, . brenner i øynene dine, . hudsmerter, og . rødt eller lilla hudutslett som sprer seg (spesielt i ansiktet eller overkroppen) med blemmer og avskalling
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Arimidex inkluderer:
- . svakhet, . hetetokter, . nummenhet eller prikkende følelse i huden din, . hevelse i anklene eller føttene, . leddsmerter eller stivhet, . problemer med fingrene mens du griper, . sår hals, . hodepine, . ryggsmerte, . beinsmerter, . depresjon, . humørsvingninger, . søvnproblemer (søvnløshet), . høyt blodtrykk, . alvorlig hodepine, . tåkesyn, . dunker i nakken eller ørene, . kvalme, . oppkast, og . mildt utslett
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Arimidex. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
ARIMIDEX (anastrozol) tabletter for oral administrering inneholder 1 mg anastrozol, en ikke-steroid aromatasehemmer. Det er kjemisk beskrevet som 1,3-benzendiacetonitril, a, a, a', a'-tetramethyl-5-(1H-1,2,4-triazol-1-ylmethyl). Dens molekylære formel er C17H19N5 og dens strukturformel er:
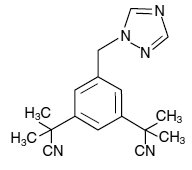
Anastrozol er et off-white pulver med en molekylvekt på 293,4. Anastrozol har moderat vannløselighet (0,5 mg/ml ved 25°C); løseligheten er uavhengig av pH i det fysiologiske området. Anastrozol er fritt løselig i metanol, aceton, etanol og tetrahydrofuran, og svært løselig i acetonitril.
Hver tablett inneholder som inaktive ingredienser: laktose, magnesiumstearat, hydroksypropylmetylcellulose, polyetylenglykol, povidon, natriumstivelsesglykolat og titandioksid.
INDIKASJONER
Adjuvant behandling
ARIMIDEX er indisert for adjuvant behandling av postmenopausale kvinner med hormonreseptorpositiv tidlig brystkreft.
Førstelinjebehandling
ARIMIDEX 1mg er indisert for førstelinjebehandling av postmenopausale kvinner med hormonreseptorpositiv eller hormonreseptor ukjent lokalt avansert eller metastatisk brystkreft.
Andrelinjes behandling
ARIMIDEX 1mg er indisert for behandling av avansert brystkreft hos postmenopausale kvinner med sykdomsprogresjon etter tamoksifenbehandling. Pasienter med ER-negativ sykdom og pasienter som ikke responderte på tidligere tamoksifenbehandling, responderte sjelden på ARIMIDEX.
DOSERING OG ADMINISTRASJON
Anbefalt dose
Dosen av ARIMIDEX er én 1 mg tablett tatt én gang daglig. For pasienter med avansert brystkreft bør ARIMIDEX 1 mg fortsettes til tumorprogresjon. ARIMIDEX kan tas med eller uten mat.
For adjuvant behandling av tidlig brystkreft hos postmenopausale kvinner er den optimale varigheten av behandlingen ukjent. I ATAC-studien ble ARIMIDEX 1 mg administrert i fem år [se Kliniske studier ].
Ingen dosejustering er nødvendig for pasienter med nedsatt nyrefunksjon eller for eldre pasienter [se Bruk i spesifikke populasjoner ].
Pasienter med nedsatt leverfunksjon
Ingen doseendringer anbefales for pasienter med lett til moderat nedsatt leverfunksjon. ARIMIDEX har ikke blitt studert hos pasienter med alvorlig nedsatt leverfunksjon [se Bruk i spesifikke populasjoner ].
HVORDAN LEVERES
Doseringsformer og styrker
Tablettene er hvite, bikonvekse, filmdrasjerte og inneholder 1 mg anastrozol. Tablettene er på den ene siden merket med en logo som består av bokstaven "A" (stor bokstav) med en pilspiss festet til foten av det forlengede høyre benet på "A" og på baksiden med tablettstyrke-merket "Adx 1". ".
Oppbevaring og håndtering
Disse tablettene leveres i flasker med 30 tabletter ( NDC 0310-0201-30).
Oppbevaring
Oppbevares ved kontrollert romtemperatur, 20-25°C (68-77°F) [se USP ].
Distribuert av: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Revidert: mai 2014
BIVIRKNINGER
Alvorlige bivirkninger med ARIMIDEX som forekommer hos mindre enn 1 av 10 000 pasienter, er: 1) hudreaksjoner som lesjoner, sår eller blemmer; 2) allergiske reaksjoner med hevelse i ansikt, lepper, tunge og/eller svelg. Dette kan forårsake problemer med å svelge og/eller puste; og 3) endringer i blodprøver av leverfunksjonen, inkludert betennelse i leveren med symptomer som kan inkludere en generell følelse av å ikke ha det bra, med eller uten gulsott, leversmerter eller leverhevelse.
Vanlige bivirkninger (forekommer med en forekomst på ≥ 10%) hos kvinner som tok ARIMIDEX 1 mg inkludert: hetetokter, asteni, leddgikt, smerte, artralgi, hypertensjon, depresjon, kvalme og oppkast, utslett, osteoporose, brudd, ryggsmerter, søvnløshet, hodepine, beinsmerter, perifert ødem, økt hoste, dyspné, faryngitt og lymfødem.
ATAC-studien var den vanligste rapporterte bivirkningen (> 0,1 %) som førte til seponering av behandlingen for begge behandlingsgruppene hetetokter, selv om det var færre pasienter som avbrøt behandlingen som følge av hetetokter i ARIMIDEX 1 mg-gruppen.
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Erfaring fra kliniske forsøk
Adjuvant terapi
Bivirkningsdata for adjuvant behandling er basert på ATAC-studien [se Kliniske studier ]. Median varighet av adjuvant behandling for sikkerhetsevaluering var 59,8 måneder og 59,6 måneder for pasienter som fikk henholdsvis ARIMIDEX 1 mg og tamoxifen 20 mg.
Bivirkninger som oppstår med en forekomst på minst 5 % i begge behandlingsgruppene under behandling eller innen 14 dager etter avsluttet behandling er presentert i tabell 1.
Visse bivirkninger og kombinasjoner av bivirkninger ble prospektivt spesifisert for analyse, basert på de kjente farmakologiske egenskapene og bivirkningsprofilene til de to legemidlene (se tabell 2).
Iskemiske kardiovaskulære hendelser
Mellom behandlingsarmene i den totale populasjonen på 6186 pasienter var det ingen statistisk forskjell i iskemiske kardiovaskulære hendelser (4 % ARIMIDEX vs. 3 % tamoxifen).
I den totale populasjonen ble angina pectoris rapportert hos 71/3092 (2,3 %) pasienter i ARIMIDEX 1 mg-armen og 51/3094 (1,6 %) pasienter i tamoxifen-armen; hjerteinfarkt ble rapportert hos 37/3092 (1,2 %) pasienter i ARIMIDEX 1 mg-armen og 34/3094 (1,1 %) pasienter i tamoxifen-armen.
Hos kvinner med eksisterende iskemisk hjertesykdom 465/6186 (7,5 %), var forekomsten av iskemiske kardiovaskulære hendelser 17 % hos pasienter på ARIMIDEX og 10 % hos pasienter på tamoxifen. I denne pasientpopulasjonen ble angina pectoris rapportert hos 25/216 (11,6 %) pasienter som fikk ARIMIDEX og 13/249 (5,2 %) pasienter som fikk tamoxifen; hjerteinfarkt ble rapportert hos 2/216 (0,9 %) pasienter som fikk ARIMIDEX og 8/249 (3,2 %) pasienter som fikk tamoxifen.
Funn av benmineraltetthet
Resultater fra ATAC-prøvebeinsubstudien etter 12 og 24 måneder viste at pasienter som fikk ARIMIDEX 1 mg hadde en gjennomsnittlig reduksjon i både korsryggen og total hoftebenmineraltetthet (BMD) sammenlignet med baseline. Pasienter som fikk tamoxifen hadde en gjennomsnittlig økning i både korsryggen og total hofte-BMD sammenlignet med baseline.
Fordi ARIMIDEX senker sirkulerende østrogennivåer, kan det føre til en reduksjon i beinmineraltetthet.
En post-marketing studie vurderte den kombinerte effekten av ARIMIDEX 1mg og bisfosfonatrisedronat på endringer fra baseline i BMD og markører for benresorpsjon og dannelse hos postmenopausale kvinner med hormonreseptorpositiv tidlig brystkreft. Alle pasientene fikk tilskudd av kalsium og vitamin D. Etter 12 måneder ble små reduksjoner i benmineraltetthet i korsryggen observert hos pasienter som ikke fikk bisfosfonater. Bisfosfonatbehandling bevarte bentetthet hos de fleste pasienter med risiko for brudd.
Postmenopausale kvinner med tidlig brystkreft som er planlagt å bli behandlet med ARIMIDEX 1mg, bør ha beinstatus administrert i henhold til behandlingsretningslinjer som allerede er tilgjengelige for postmenopausale kvinner med tilsvarende risiko for skjørhetsbrudd.
Kolesterol
Under ATAC-studien ble flere pasienter som fikk ARIMIDEX 1 mg rapportert å ha forhøyet serumkolesterol sammenlignet med pasienter som fikk tamoxifen (henholdsvis 9 % versus 3,5 %).
En post-marketing studie evaluerte også eventuelle potensielle effekter av ARIMIDEX på lipidprofilen. I den primære analysepopulasjonen for lipider (ARIMIDEX 1 mg alene) var det ingen klinisk signifikant endring i LDL-C fra baseline til 12 måneder og HDL-C fra baseline til 12 måneder.
I den sekundære populasjonen for lipider (ARIMIDEX+risedronat) var det heller ingen klinisk signifikant endring i LDL-C og HDL-C fra baseline til 12 måneder.
begge populasjonene for lipider var det ingen klinisk signifikant forskjell i totalkolesterol (TC) eller serumtriglyserider (TG) etter 12 måneder sammenlignet med baseline.
I denne studien hadde behandling i 12 måneder med ARIMIDEX 1 mg alene en nøytral effekt på lipidprofilen. Kombinasjonsbehandling med ARIMIDEX og risedronat hadde også en nøytral effekt på lipidprofilen.
Studien gir bevis for at postmenopausale kvinner med tidlig brystkreft som er planlagt å bli behandlet med ARIMIDEX 1mg, bør behandles ved å bruke gjeldende retningslinjer for nasjonale kolesterolutdanningsprogram for kardiovaskulær risikobasert behandling av individuelle pasienter med LDL-økninger.
Andre uønskede reaksjoner
Pasienter som fikk ARIMIDEX hadde en økning i leddlidelser (inkludert leddgikt, artrose og artralgi) sammenlignet med pasienter som fikk tamoxifen. Pasienter som fikk ARIMIDEX hadde en økning i forekomsten av alle frakturer (spesielt brudd i ryggraden, hoften og håndleddet) [315 (10 %)] sammenlignet med pasienter som fikk tamoxifen [209 (7 %)].
Pasienter som fikk ARIMIDEX 1 mg hadde en høyere forekomst av karpaltunnelsyndrom [78 (2,5 %)] sammenlignet med pasienter som fikk tamoxifen [22 (0,7 %)].
Vaginal blødning forekom hyppigere hos tamoxifen-behandlede pasienter sammenlignet med ARIMIDEX-behandlede pasienter, henholdsvis 317 (10 %) versus 167 (5 %).
Pasienter som fikk ARIMIDEX hadde en lavere forekomst av hetetokter, vaginal blødning, vaginal utflod, endometriekreft, venøse tromboemboliske hendelser og iskemiske cerebrovaskulære hendelser sammenlignet med pasienter som fikk tamoxifen.
10-års median oppfølgingssikkerhetsresultater fra ATAC-forsøket
Resultatene stemmer overens med de tidligere analysene.
Alvorlige bivirkninger var like mellom ARIMIDEX (50 %) og tamoxifen (51 %).
- . Kardiovaskulære hendelser var i samsvar med de kjente sikkerhetsprofilene til ARIMIDEX og tamoxifen. . Den kumulative forekomsten av alle første frakturer (både alvorlige og ikke-alvorlige, oppstått enten under eller etter behandling) var høyere i ARIMIDEX-gruppen (15 %) sammenlignet med tamoxifen-gruppen (11 %). Denne økte hyppigheten av første brudd under behandling fortsatte ikke i oppfølgingsperioden etter behandling. . Den kumulative forekomsten av nye primære kreftformer var lik i ARIMIDEX 1 mg-gruppen (13,7 %) sammenlignet med tamoxifen-gruppen (13,9 %). I samsvar med de tidligere analysene var endometriekreft høyere i tamoxifen-gruppen (0,8 %) sammenlignet med ARIMIDEX-gruppen (0,2 %). . Det totale antallet dødsfall (under eller utenfor behandling) var likt mellom behandlingsgruppene. Det var flere dødsfall relatert til brystkreft i tamoxifen enn i ARIMIDEX 1 mg-behandlingsgruppen.
Førstelinjeterapi
Bivirkninger som oppstår med en forekomst på minst 5 % i begge behandlingsgruppene av forsøk 0030 og 0027 under eller innen 2 uker etter avsluttet behandling er vist i tabell 3.
Mindre hyppige bivirkninger rapportert hos pasienter som fikk ARIMIDEX 1mg l mg i enten studie 0030 eller studie 0027 var lik de som ble rapportert for andrelinjebehandling.
Basert på resultater fra andrelinjebehandling og den etablerte sikkerhetsprofilen til tamoxifen, ble forekomsten av 9 forhåndsspesifiserte bivirkningskategorier potensielt kausalt relatert til en eller begge behandlingene på grunn av deres farmakologi analysert statistisk. Ingen signifikante forskjeller ble sett mellom behandlingsgruppene.
Andrelinjes terapi
ARIMIDEX 1 mg ble tolerert i to kontrollerte kliniske studier (dvs. forsøk 0004 og 0005), med mindre enn 3,3 % av de ARIMIDEX-behandlede pasientene og 4,0 % av de megestrolacetat-behandlede pasientene som trakk seg på grunn av en bivirkning.
Den viktigste bivirkningen som er mer vanlig med ARIMIDEX enn megestrolacetat, var diaré. Bivirkninger rapportert hos mer enn 5 % av pasientene i noen av behandlingsgruppene i disse to kontrollerte kliniske studiene, uavhengig av årsakssammenheng, er presentert nedenfor:
Kroppen som helhet: Influensa syndrom; feber; nakkesmerter; ubehag; utilsiktet skade; infeksjon
Kardiovaskulær: hypertensjon; tromboflebitt
Hepatisk: Gamma GT økte; SGOT økte; SGPT økt Hematologisk: Anemi; leukopeni
Metabolsk og ernæringsmessig: Alkalisk fosfatase økte; vekttap
Gjennomsnittlig serum totalt kolesterolnivå økte med 0,5 mmol/L blant pasienter som fikk ARIMIDEX. Økning i LDL-kolesterol har vist seg å bidra til disse endringene.
Muskuloskeletal: Myalgi; artralgi; patologisk brudd
Nervøs: Søvnighet; forvirring; søvnløshet; angst; nervøsitet
Luftveiene: bihulebetennelse; bronkitt; rhinitt
Hud og vedheng: Hårtynning (alopecia); kløe
Urogenital: Urinveisinfeksjon; brystsmerter
Forekomsten av følgende bivirkningsgrupper potensielt kausalt relatert til en eller begge terapiene på grunn av deres farmakologi, ble statistisk analysert: vektøkning, ødem, tromboembolisk sykdom, gastrointestinale forstyrrelser, hetetokter og vaginal tørrhet. Disse seks gruppene, og bivirkningene fanget i gruppene, ble prospektivt definert. Resultatene er vist i tabellen nedenfor.
Erfaring etter markedsføring
Disse bivirkningene rapporteres frivillig fra en populasjon av usikker størrelse. Derfor er det ikke alltid mulig å estimere frekvensen på en pålitelig måte eller etablere en årsakssammenheng til legemiddeleksponering. Følgende er rapportert ved bruk av Arimidex etter godkjenning:
- . Lever og galleveier inkludert økning i alkalisk fosfatase, alaninaminotransferase, aspartataminotransferase, gamma-GT og bilirubin; hepatitt . Utslett inkludert tilfeller av mukokutane lidelser som erythema multiforme og Stevens-Johnsons syndrom . Tilfeller av allergiske reaksjoner inkludert angioødem, urticaria og anafylaksi [se KONTRAINDIKASJONER ] . Myalgi, triggerfinger og hyperkalsemi (med eller uten økning i parathyreoideahormon)
NARKOTIKAHANDEL
Tamoxifen
Samtidig administrering av anastrozol og tamoxifen hos brystkreftpasienter reduserte plasmakonsentrasjonen av anastrozol med 27 %. Samtidig administrasjon av anastrozol og tamoxifen påvirket imidlertid ikke farmakokinetikken til tamoxifen eller N-desmetyltamoxifen. Ved en median oppfølging på 33 måneder viste kombinasjonen av ARIMIDEX og tamoxifen ingen effektfordeler sammenlignet med tamoxifen hos alle pasienter så vel som i den hormonreseptor-positive subpopulasjonen. Denne behandlingsarmen ble avbrutt fra forsøket [se Kliniske studier ]. Basert på kliniske og farmakokinetiske resultater fra ATAC-studien, bør tamoksifen ikke administreres sammen med anastrozol.
Østrogen
Østrogenholdige terapier bør ikke brukes sammen med ARIMIDEX 1 mg, da de kan redusere dens farmakologiske virkning.
Warfarin
en studie utført på 16 mannlige frivillige, endret ikke anastrozol eksponeringen (målt ved C max og AUC) og antikoagulerende aktivitet (målt ved protrombintid, aktivert partiell tromboplastintid og trombintid) av både R- og S- warfarin.
Cytokrom P450 Basert på in vitro og in vivo resultater, er det lite sannsynlig at samtidig administrering av ARIMIDEX 1 mg vil påvirke andre legemidler som følge av hemming av cytokrom P450 [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Iskemiske kardiovaskulære hendelser
Hos kvinner med eksisterende iskemisk hjertesykdom ble en økt forekomst av iskemiske kardiovaskulære hendelser observert med ARIMIDEX i ATAC-studien (17 % av pasientene på ARIMIDEX 1 mg og 10 % av pasientene på tamoxifen). Vurder risiko og fordeler ved ARIMIDEX-behandling hos pasienter med eksisterende iskemisk hjertesykdom [se BIVIRKNINGER ]
Beineffekter
Resultater fra ATAC-prøvebeinsubstudien etter 12 og 24 måneder viste at pasienter som fikk ARIMIDEX hadde en gjennomsnittlig reduksjon i både korsryggen og total hoftebenmineraltetthet (BMD) sammenlignet med baseline. Pasienter som fikk tamoxifen hadde en gjennomsnittlig økning i både korsryggen og total hofte-BMD sammenlignet med baseline. Vurder overvåking av bentetthet hos pasienter behandlet med ARIMIDEX [se BIVIRKNINGER ].
Kolesterol
Under ATAC-studien ble flere pasienter som fikk ARIMIDEX 1 mg rapportert å ha forhøyet serumkolesterol sammenlignet med pasienter som fikk tamoxifen (henholdsvis 9 % versus 3,5 %) [se BIVIRKNINGER ].
Informasjon om pasientveiledning
Se FDA godkjent pasientmerking (PASIENTINFORMASJON).
Svangerskap
Pasienter bør informeres om at ARIMIDEX 1mg kan forårsake fosterskader. De bør også informeres om at ARIMIDEX 1mg ikke er til bruk hos premenopausale kvinner; derfor, hvis de blir gravide, bør de slutte å ta ARIMIDEX og umiddelbart kontakte legen.
Allergiske (overfølsomhet) reaksjoner
Pasienter bør informeres om muligheten for alvorlige allergiske reaksjoner med hevelse i ansikt, lepper, tunge og/eller svelg (angioødem) som kan forårsake problemer med å svelge og/eller puste og oppsøke lege umiddelbart.
Iskemiske kardiovaskulære hendelser
Pasienter med eksisterende iskemisk hjertesykdom bør informeres om at økt forekomst av kardiovaskulære hendelser er observert ved bruk av ARIMIDEX 1 mg sammenlignet med bruk av tamoxifen. Hvis pasienter har nye eller forverrede brystsmerter eller kortpustethet, bør de oppsøke lege umiddelbart.
Beineffekter
Pasienter bør informeres om at ARIMIDEX senker nivået av østrogen. Dette kan føre til tap av mineralinnholdet i bein, noe som kan redusere beinstyrken. En mulig konsekvens av redusert mineralinnhold i bein er økt risiko for brudd.
Kolesterol
Pasienter bør informeres om at et økt kolesterolnivå kan sees mens de får ARIMIDEX.
Kiling, prikking eller nummenhet
Pasienter bør informeres om at hvis de opplever kiling, prikking eller nummenhet, bør de varsle helsepersonell.
Tamoxifen
Pasienter bør rådes til ikke å ta ARIMIDEX sammen med Tamoxifen.
Tapte doser
Informer pasienter om at hvis de glemmer en dose, ta den så snart de husker det. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og ta neste regelmessige dose. Pasienter bør ikke ta to doser samtidig.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
En konvensjonell karsinogenesestudie på rotter ved doser på 1,0 til 25 mg/kg/dag (ca. 10 til 243 ganger den daglige maksimale anbefalte dosen for mennesker på mg/m²-basis) administrert ved oral sonde i opptil 2 år, viste en økning i forekomst av hepatocellulært adenom og karsinom og uterine stromale polypper hos kvinner og skjoldbruskkjerteladenom hos menn ved høy dose. En doserelatert økning ble observert i forekomsten av ovarie- og uterinhyperplasi hos kvinner. Ved 25 mg/kg/dag var plasma-AUC0-24 timers nivåer hos rotter 110 til 125 ganger høyere enn nivået som ble vist hos postmenopausale frivillige ved anbefalt dose. En separat karsinogenitetsstudie på mus ved orale doser på 5 til 50 mg/kg/dag (omtrent 24 til 243 ganger den daglige maksimale anbefalte humane dosen på mg/m²-basis) i opptil 2 år ga en økning i forekomsten av benigne ovariestromale, epiteliale og granulosacelletumorer ved alle dosenivåer. En doserelatert økning i forekomsten av ovariehyperplasi ble også observert hos hunnmus. Disse eggstokkendringene anses å være gnagerspesifikke effekter av aromatasehemming og er av tvilsom betydning for mennesker. Forekomsten av lymfosarkom var økt hos menn og kvinner ved høy dose. Ved 50 mg/kg/dag var plasma-AUC-nivåer hos mus 35 til 40 ganger høyere enn nivået som ble vist hos postmenopausale frivillige ved anbefalt dose.
ARIMIDEX 1mg har ikke vist seg å være mutagent i in vitro tester (Ames og E. coli bakterielle tester, CHO-K1 genmutasjonsanalyse) eller klastogene verken in vitro (kromosomavvik i humane lymfocytter) eller in vivo (mikronukleustest i rotter) .
Oral administrering av anastrozol til hunnrotter (fra 2 uker før paring til drektighetsdag 7) ga signifikant insidens av infertilitet og reduserte antall levedyktige drektigheter ved 1 mg/kg/dag (omtrent 10 ganger anbefalt human dose på mg/m²-basis og 9 ganger høyere enn AUC0-24 timer funnet hos postmenopausale frivillige ved anbefalt dose). Pre-implantasjonstap av egg eller foster ble økt ved doser lik eller større enn 0,02 mg/kg/dag (omtrent en femtedel av anbefalt human dose på mg/m²-basis). Gjenoppretting av fertilitet ble observert etter en 5-ukers ikke-doseringsperiode som fulgte etter 3 ukers dosering. Det er ikke kjent om disse effektene observert hos hunnrotter tyder på nedsatt fertilitet hos mennesker.
Flerdosestudier på rotter administrert anastrozol i 6 måneder i doser lik eller større enn 1 mg/kg/dag (som ga plasmaanastrozol Cssmax og AUC 0-24 timer som var 19 og 9 ganger høyere enn de respektive verdiene funnet i postmenopausal frivillige ved anbefalt dose) resulterte i hypertrofi av eggstokkene og tilstedeværelsen av follikulære cyster. I tillegg ble hyperplastisk livmor observert i 6-måneders studier på hunnhunder administrert doser lik eller større enn 1 mg/kg/dag (som ga plasmaanastrozol Cssmax og AUC0-24 timer som var 22 ganger og 16 ganger høyere enn de respektive verdier funnet hos postmenopausale kvinner ved anbefalt dose). Det er ikke kjent om disse effektene på reproduksjonsorganene til dyr er assosiert med nedsatt fertilitet hos premenopausale kvinner.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori X [se KONTRAINDIKASJONER ]
ARIMIDEX kan forårsake fosterskader når det administreres til en gravid kvinne og gir ingen klinisk fordel for premenopausale kvinner med brystkreft. ARIMIDEX er kontraindisert hos kvinner som er eller kan bli gravide. I dyrestudier forårsaket anastrozol svangerskapssvikt, økt svangerskapstap og tegn på forsinket fosterutvikling. Det er ingen studier av bruk av ARIMIDEX 1 mg hos gravide kvinner. Hvis ARIMIDEX 1 mg brukes under graviditet, eller hvis pasienten blir gravid mens han får dette legemidlet, bør pasienten informeres om den potensielle faren for fosteret og potensiell risiko for tap av graviditet.
reproduksjonsstudier på dyr mottok drektige rotter og kaniner anastrozol under organogenese i doser lik eller større enn 1 (rotter) og 1/3 (kaniner) anbefalt human dose på mg/m²-basis. Hos begge arter krysset anastrozol placenta, og det var økt svangerskapstap (økt pre- og/eller post-implantasjonstap, økt resorpsjon og redusert antall levende fostre). Hos rotter var disse effektene doserelaterte, og placentavekten ble betydelig økt. Fostertoksisitet, inkludert forsinket fosterutvikling (dvs. ufullstendig forbening og redusert kroppsvekt hos fosteret), forekom hos rotter ved anastrozoldoser som ga maksimale plasmanivåer 19 ganger høyere enn serumnivåer hos mennesker ved den terapeutiske dosen (AUC 0-24 timer 9 ganger høyere) . Hos kaniner forårsaket anastrozol svangerskapssvikt ved doser lik eller større enn 16 ganger anbefalt human dose på mg/m² basis [se dyretoksikologi og/eller farmakologi ].
Ammende mødre
Det er ikke kjent om anastrozol skilles ut i morsmelk. Fordi mange legemidler skilles ut i morsmelk og på grunn av tumorgenisiteten vist for anastrozol i dyrestudier, eller potensialet for alvorlige bivirkninger hos ammende spedbarn, bør det tas en beslutning om å avbryte ammingen eller å avbryte legemidlet, med tanke på stoffets betydning for moren.
Pediatrisk bruk
Kliniske studier på pediatriske pasienter inkluderte en placebokontrollert studie med gutter i puberteten i ungdomsalder med gynekomasti og en enarmsstudie med jenter med McCune-Albright syndrom og progressiv tidlig pubertet. Effekten av ARIMIDEX 1 mg i behandlingen av pubertal gynekomasti hos unge gutter og i behandlingen av tidlig pubertet hos jenter med McCune-Albright syndrom er ikke påvist.
Gynekomasti studie
En randomisert, dobbeltblind, placebokontrollert, multisenterstudie inkluderte 80 gutter med pubertal gynekomasti i alderen 11 til 18 år. Pasientene ble randomisert til et daglig regime med enten ARIMIDEX 1 mg eller placebo. Etter 6 måneders behandling var det ingen statistisk signifikant forskjell i prosentandelen av pasienter som opplevde en ≥ 50 % reduksjon i gynekomasti (primær effektanalyse). Sekundære effektanalyser (absolutt endring i brystvolum, prosentandelen av pasienter som hadde noen reduksjon i det beregnede volumet av gynekomasti, brystsmerteoppløsning) var i samsvar med den primære effektanalysen. Serum østradiolkonsentrasjoner ved behandlingsmåned 6 ble redusert med 15,4 % i ARIMIDEX-gruppen og 4,5 % i placebogruppen.
Bivirkninger som ble vurdert som behandlingsrelaterte av etterforskerne forekom hos 16,3 % av de ARIMIDEX-behandlede pasientene og 8,1 % av de placebo-behandlede pasientene, og de hyppigste var akne (7 % ARIMIDEX og 2,7 % placebo) og hodepine (7 % ARIMIDEX 1 mg og 0 % placebo); alle andre bivirkninger viste små forskjeller mellom behandlingsgruppene. En pasient behandlet med ARIMIDEX 1mg avbrøt studien på grunn av testikkelforstørrelse. Gjennomsnittlig baseline-subtrahert endring i testikkelvolum etter 6 måneders behandling var + 6,6 ± 7,9 cm³ hos ARIMIDEX-behandlede pasienter og + 5,2 ± 8,0 cm³ i placebogruppen.
McCune-Albright syndrom studie
En multisenter, enarms, åpen studie ble utført på 28 jenter med McCune-Albright syndrom og progressiv tidlig pubertet i alderen 2 til
Fem pasienter (18 %) opplevde bivirkninger som ble ansett som mulig relatert til ARIMIDEX. Disse var kvalme, akne, smerter i en ekstremitet, økt alanintransaminase og aspartattransaminase og allergisk dermatitt.
Farmakokinetikk hos pediatriske pasienter
Etter 1 mg én gang daglig multippel administrering hos pediatriske pasienter, var gjennomsnittlig tid for å nå maksimal anastrozolkonsentrasjon 1 time. De gjennomsnittlige (område) disposisjonsparametrene for anastrozol hos pediatriske pasienter ble beskrevet med en CL/F på 1,54 L/t (0,77-4,53 L/t) og V/F på 98,4 L (50,7-330,0 L). Den terminale eliminasjonshalveringstiden var 46,8 timer, som var lik det som ble observert hos postmenopausale kvinner behandlet med anastrozol for brystkreft. Basert på en populasjonsfarmakokinetisk analyse var farmakokinetikken til anastrozol lik hos gutter med pubertal gynekomasti og jenter med McCune-Albright syndrom.
Geriatrisk bruk
studiene 0030 og 0027 var omtrent 50 % av pasientene 65 år eller eldre. Pasienter ≥ 65 år hadde moderat bedre tumorrespons og tid til tumorprogresjon enn pasienter
I ATAC-studien var 45 % av pasientene 65 år eller eldre. Effekten av ARIMIDEX 1 mg sammenlignet med tamoxifen hos pasienter som var 65 år eller eldre (N=1413 for ARIMIDEX og N=1410 for tamoxifen, fareforholdet for sykdomsfri overlevelse var 0,93 [95 % KI: 0,80, 1,08]) var mindre enn effekt observert hos pasienter som var under 65 år (N=1712 for ARIMIDEX og N=1706 for tamoxifen, hazard ratio for sykdomsfri overlevelse var 0,79 [95 % KI: 0,67, 0,94]).
Farmakokinetikken til anastrozol påvirkes ikke av alder.
Nedsatt nyrefunksjon
Siden bare ca. 10 % av anastrozol skilles ut uendret i urinen, påvirker ikke nedsatt nyrefunksjon den totale kroppsclearance. Dosejustering hos pasienter med nedsatt nyrefunksjon er ikke nødvendig [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Plasmaanastrozolkonsentrasjonene hos pasientene med levercirrhose var innenfor konsentrasjonsområdet som ble sett hos normale forsøkspersoner i alle kliniske studier. Derfor er dosejustering heller ikke nødvendig hos pasienter med stabil levercirrhose. ARIMIDEX har ikke blitt studert hos pasienter med alvorlig nedsatt leverfunksjon [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
OVERDOSE
Kliniske studier er utført med ARIMIDEX, opptil 60 mg i en enkelt dose gitt til friske mannlige frivillige og opptil 10 mg daglig gitt til postmenopausale kvinner med avansert brystkreft; disse dosene ble tolerert. En enkeltdose av ARIMIDEX 1 mg som resulterer i livstruende symptomer er ikke fastslått. Det finnes ingen spesifikk motgift mot overdosering, og behandlingen må være symptomatisk. Ved behandling av en overdose må du vurdere at flere midler kan ha blitt tatt. Oppkast kan fremkalles hvis pasienten er våken. Dialyse kan være nyttig fordi ARIMIDEX ikke er sterkt proteinbundet. Generell støttebehandling, inkludert hyppig overvåking av vitale tegn og nøye observasjon av pasienten, er indisert.
KONTRAINDIKASJONER
Graviditet og premenopausale kvinner
ARIMIDEX 1mg kan forårsake fosterskader når det administreres til en gravid kvinne og gir ingen klinisk fordel for premenopausale kvinner med brystkreft. ARIMIDEX 1mg er kontraindisert hos kvinner som er eller kan bli gravide. Det er ingen tilstrekkelige og godt kontrollerte studier hos gravide kvinner som bruker ARIMIDEX. Hvis ARIMIDEX 1mg brukes under graviditet, eller hvis pasienten blir gravid mens du tar dette legemidlet, bør pasienten informeres om den potensielle faren for et foster eller potensiell risiko for tap av graviditeten [se Bruk i spesifikke populasjoner ].
Overfølsomhet
ARIMIDEX 1mg er kontraindisert hos alle pasienter som har vist en overfølsomhetsreaksjon overfor legemidlet eller overfor noen av hjelpestoffene. Observerte reaksjoner inkluderer anafylaksi, angioødem og urticaria [se BIVIRKNINGER ]
KLINISK FARMAKOLOGI
Virkningsmekanismen
Veksten av mange brystkreft stimuleres eller opprettholdes av østrogener.
Hos postmenopausale kvinner er østrogener hovedsakelig avledet fra virkningen av aromatase-enzymet, som omdanner binyrene androgener (primært androstenedion og testosteron) til østron og østradiol. Undertrykkelsen av østrogenbiosyntesen i perifert vev og i selve kreftvevet kan derfor oppnås ved spesifikt å hemme aromatase-enzymet.
Anastrozol er en selektiv ikke-steroid aromatasehemmer. Det senker serum østradiolkonsentrasjoner betydelig og har ingen påvisbar effekt på dannelsen av binyrekortikosteroider eller aldosteron.
Farmakodynamikk
Effekt på østradiol
Gjennomsnittlige serumkonsentrasjoner av østradiol ble evaluert i flere daglige doseringsforsøk med 0,5, 1, 3, 5 og 10 mg ARIMIDEX hos postmenopausale kvinner med avansert brystkreft. Klinisk signifikant suppresjon av serumøstradiol ble sett med alle doser. Doser på 1 mg og høyere resulterte i suppresjon av gjennomsnittlig serumkonsentrasjon av østradiol til nedre deteksjonsgrense (3,7 pmol/L). Den anbefalte daglige dosen, ARIMIDEX 1 mg, reduserte østradiol med ca. 70 % innen 24 timer og med ca. 80 % etter 14 dagers daglig dosering. Undertrykkelse av serumøstradiol ble opprettholdt i opptil 6 dager etter avsluttet daglig dosering med ARIMIDEX 1 mg.
Effekten av ARIMIDEX 1mg hos premenopausale kvinner med tidlig eller avansert brystkreft er ikke studert. Fordi aromatisering av binyrene androgener ikke er en signifikant kilde til østradiol hos premenopausale kvinner, forventes ikke ARIMIDEX å senke østradiolnivået hos premenopausale kvinner.
Effekt på kortikosteroider
flere daglige doseringsforsøk med 3, 5 og 10 mg ble selektiviteten til anastrozol vurdert ved å undersøke effekter på kortikosteroidsyntese. For alle doser påvirket ikke anastrozol kortisol- eller aldosteronsekresjon ved baseline eller som respons på ACTH. Ingen glukokortikoid- eller mineralkortikoiderstatningsterapi er nødvendig med anastrozol.
Andre endokrine effekter
I flere daglige doseringsforsøk med 5 og 10 mg ble thyroidstimulerende hormon (TSH) målt; det var ingen økning i TSH under administrering av ARIMIDEX. ARIMIDEX har ikke direkte progestogen, androgen eller østrogen aktivitet hos dyr, men forstyrrer de sirkulerende nivåene av progesteron, androgener og østrogener.
Farmakokinetikk
Absorpsjon
Hemming av aromataseaktivitet skyldes først og fremst anastrozol, hovedstoffet. Absorpsjonen av anastrozol er rask og maksimale plasmakonsentrasjoner forekommer vanligvis innen 2 timer etter dosering under fastende forhold. Studier med radiomerket medikament har vist at oralt administrert anastrozol absorberes godt i den systemiske sirkulasjonen. Mat reduserer hastigheten, men ikke den totale graden av absorpsjon av anastrozol. Gjennomsnittlig C max for anastrozol gikk ned med 16 % og median Tmax ble forsinket fra 2 til 5 timer når anastrozol ble administrert 30 minutter etter mat. Farmakokinetikken til anastrozol er lineær over doseområdet 1 til 20 mg, og endres ikke ved gjentatt dosering. Farmakokinetikken til anastrozol var lik hos pasienter og friske frivillige.
Fordeling
Steady-state plasmanivåer er omtrent 3 til 4 ganger høyere enn nivåene observert etter en enkelt dose av ARIMIDEX. Plasmakonsentrasjoner nærmer seg steady-state nivåer ved ca. 7 dager med dosering én gang daglig. Anastrozol er 40 % bundet til plasmaproteiner i det terapeutiske området.
Metabolisme
Metabolisme av anastrozol skjer ved N-dealkylering, hydroksylering og glukuronidering. Tre metabolitter av anastrozol (triazol, et glukuronidkonjugat av hydroksy-anastrozol og et glukuronidkonjugat av anastrozol selv) er identifisert i humant plasma og urin. Den viktigste sirkulerende metabolitten til anastrozol, triazol, mangler farmakologisk aktivitet.
Anastrozol hemmet reaksjoner katalysert av cytokrom P450 1A2, 2C8/9 og 3A4 in vitro med Ki-verdier som var omtrent 30 ganger høyere enn gjennomsnittlig steady-state Cmax-verdier observert etter en daglig dose på 1 mg. Anastrozol hadde ingen hemmende effekt på reaksjoner katalysert av cytokrom P450 2A6 eller 2D6 in vitro. Administrering av en enkelt 30 mg/kg eller flere 10 mg/kg doser av anastrozol til friske forsøkspersoner hadde ingen effekt på clearance av antipyrin eller uringjenvinning av antipyrinmetabolitter.
Utskillelse
Åttifem prosent av radiomerket anastrozol ble gjenfunnet i avføring og urin. Levermetabolismen står for omtrent 85 % av eliminasjonen av anastrozol. Renal eliminasjon utgjør omtrent 10 % av total clearance. Gjennomsnittlig eliminasjonshalveringstid for anastrozol er 50 timer.
Effekt av kjønn og alder
Anastrozols farmakokinetikk har blitt undersøkt hos postmenopausale kvinnelige frivillige og pasienter med brystkreft. Ingen aldersrelaterte effekter ble sett i området 80 år.
Effekt av rase
Serumnivåer av østradiol og østronsulfat var lik mellom japanske og kaukasiske postmenopausale kvinner som fikk 1 mg anastrozol daglig i 16 dager. Anastrozols gjennomsnittlige steady-state minimum plasmakonsentrasjon hos kaukasiske og japanske postmenopausale kvinner var henholdsvis 25,7 og 30,4 ng/ml.
Effekt av nedsatt nyrefunksjon
Anastrozols farmakokinetikk er undersøkt hos personer med nedsatt nyrefunksjon. Anastrozol-nyreclearance sank proporsjonalt med kreatininclearance og var omtrent 50 % lavere hos frivillige med alvorlig nedsatt nyrefunksjon (kreatininclearance DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Effekt av nedsatt leverfunksjon
Anastrozols farmakokinetikk har blitt undersøkt hos personer med levercirrhose relatert til alkoholmisbruk. Den tilsynelatende orale clearance (CL/F) av anastrozol var omtrent 30 % lavere hos personer med stabil levercirrhose enn hos kontrollpersoner med normal leverfunksjon. Imidlertid var disse plasmakonsentrasjonene fortsatt med verdiområdet observert hos normale forsøkspersoner. Effekten av alvorlig nedsatt leverfunksjon ble ikke studert. Ingen dosejustering er nødvendig for stabil levercirrhose [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Dyretoksikologi og/eller farmakologi
Reproduktiv toksikologi
Det er funnet at anastrozol passerer placenta etter oral administrering av 0,1 mg/kg til rotter og kaniner (henholdsvis ca. 1 og 1,9 ganger anbefalt human dose på mg/m²-basis). Studier på både rotter og kaniner ved doser lik eller større enn henholdsvis 0,1 og 0,02 mg/kg/dag (henholdsvis ca. 1 og 1/3, den anbefalte dosen til mennesker på mg/m²-basis), administrert i perioden med organogenese viste at anastrozol økte graviditetstap (økt tap før og/eller etter implantasjon, økt resorpsjon og redusert antall levende fostre); effektene var doserelaterte hos rotter. Placentalvekten var signifikant økt hos rotter ved doser på 0,1 mg/kg/dag eller mer.
Bevis på føtotoksisitet, inkludert forsinket fosterutvikling (dvs. ufullstendig ossifikasjon og redusert kroppsvekt hos fosteret), ble observert hos rotter som ble administrert doser på 1 mg/kg/dag (som ga plasmaanastrozol Cssmax og AUC 0-24 timer som var 19 ganger og 9 ganger høyere enn de respektive verdiene funnet hos postmenopausale frivillige ved anbefalt dose). Det var ingen tegn på teratogenisitet hos rotter som fikk doser på opptil 1,0 mg/kg/dag. Hos kaniner forårsaket anastrozol svangerskapssvikt ved doser lik eller større enn 1,0 mg/kg/dag (ca. 16 ganger anbefalt human dose på mg/m²-basis); det var ingen tegn på teratogenisitet hos kaniner som ble administrert 0,2 mg/kg/dag (ca. 3 ganger anbefalt human dose på mg/m²-basis).
Kliniske studier
Adjuvant behandling av brystkreft hos postmenopausale kvinner
En multisenter, dobbeltblind studie (ATAC) randomiserte 9 366 postmenopausale kvinner med operabel brystkreft til adjuvant behandling med ARIMIDEX 1 mg daglig, tamoxifen 20 mg daglig, eller en kombinasjon av de to behandlingene i fem år eller inntil tilbakefall av sykdommen.
Det primære endepunktet for studien var sykdomsfri overlevelse (dvs. tid til forekomst av fjernt eller lokalt tilbakefall, eller kontralateral brystkreft eller død av en hvilken som helst årsak). Sekundære endepunkter for studien inkluderte fjern sykdomsfri overlevelse, forekomsten av kontralateral brystkreft og total overlevelse. Ved en median oppfølging på 33 måneder viste kombinasjonen av ARIMIDEX og tamoxifen ingen effektfordeler sammenlignet med tamoxifen hos alle pasienter så vel som i den hormonreseptorpositive subpopulasjonen. Denne behandlingsarmen ble avviklet fra forsøket. Basert på kliniske og farmakokinetiske resultater fra ATAC-studien, bør tamoxifen ikke administreres sammen med anastrozol [se NARKOTIKAHANDEL ].
Demografiske og andre grunnlinjekarakteristika var like blant de tre behandlingsgruppene (se tabell 7).
Pasienter i de to monoterapiarmene i ATAC-studien ble behandlet i median 60 måneder (5 år) og fulgt i median 68 måneder. Sykdomsfri overlevelse i intent-to-treat-populasjonen var statistisk signifikant forbedret [Hazard Ratio (HR) = 0,87, 95 % KI: 0,78, 0,97, p=0,0127] i ARIMIDEX-armen sammenlignet med tamoxifen-armen. I den hormonreseptorpositive subpopulasjonen som representerte omtrent 84 % av forsøkspasientene, ble sykdomsfri overlevelse også statistisk signifikant forbedret (HR = 0,83, 95 % KI: 0,73, 0,94, p=0,0049) i ARIMIDEX 1 mg-armen sammenlignet med tamoxifen arm.
Figur 1: Sykdomsfri overlevelse Kaplan Meier overlevelseskurve for alle pasienter randomisert til ARIMIDEX 1mg eller Tamoxifen Monoterapi i ATAC-studien (Intent-to-Treat) 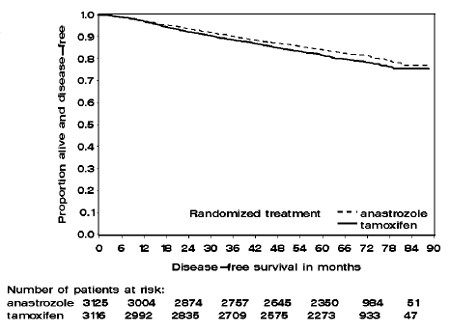
Figur 2: Sykdomsfri overlevelse for hormonreseptor-positiv subpopulasjon av pasienter randomisert til ARIMIDEX eller Tamoxifen monoterapi i ATAC-studien 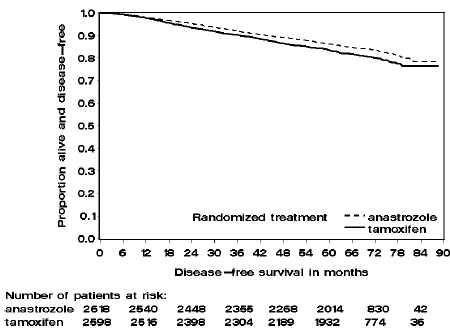
Overlevelsesdataene med 68 måneders oppfølging er presentert i tabell 9.
I gruppen av pasienter som hadde tidligere adjuvant kjemoterapi (N=698 for ARIMIDEX 1mg og N=647 for tamoxifen), var hazard ratio for sykdomsfri overlevelse 0,91 (95 % KI: 0,73 til 1,13) i ARIMIDEX-armen sammenlignet med tamoxifen-armen.
Frekvensen av individuelle hendelser i intent-to-treat-populasjonen og den hormonreseptor-positive subpopulasjonen er beskrevet i tabell 8.
Et sammendrag av resultatene av studiens effekt er gitt i tabell 9.
10-års median oppfølging Effektresultater fra ATAC-studien
I en påfølgende analyse av ATAC-studien ble pasienter i de to monoterapiarmene fulgt i median 120 måneder (10 år). Pasientene fikk studiebehandling i median 60 måneder (5 år) (se tabell 10).
Figur 3: Sykdomsfri overlevelse Kaplan Meier overlevelseskurve for alle pasienter randomisert til ARIMIDEX eller Tamoxifen monoterapi i ATAC-studien (intent-to-treat)a 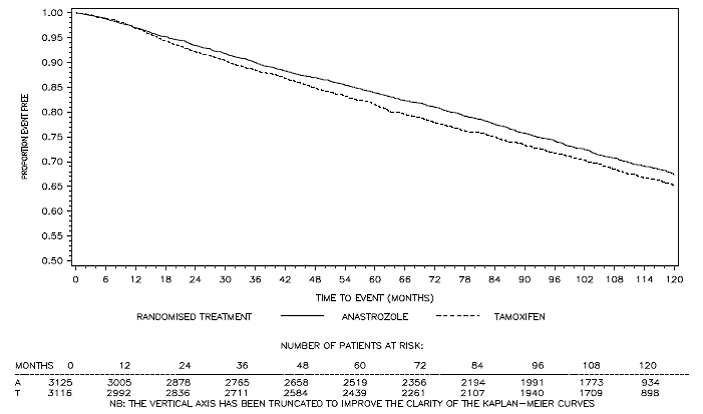
a Andelen pasienter med 120 måneders oppfølging var 29,4 %.
Figur 4: Sykdomsfri overlevelse for hormonreseptor-positiv subpopulasjon av pasienter randomisert til ARIMIDEX 1 mg eller Tamoxifen monoterapi i ATAC-studien 
bAndelen pasienter med 120 måneders oppfølging var 29,8 %.
Førstelinjeterapi hos postmenopausale kvinner med avansert brystkreft
To dobbeltblinde, kontrollerte kliniske studier av lignende design (0030, en nordamerikansk studie og 0027, en overveiende europeisk studie) ble utført for å vurdere effekten av ARIMIDEX 1 mg sammenlignet med tamoxifen som førstelinjebehandling for hormonreseptorpositive eller hormonreseptorer. ukjent lokalt avansert eller metastatisk brystkreft hos postmenopausale kvinner. Totalt 1021 pasienter mellom 30 og 92 år ble randomisert til å få prøvebehandling. Pasientene ble randomisert til å motta 1 mg ARIMIDEX 1 mg én gang daglig eller 20 mg tamoxifen én gang daglig. De primære endepunktene for begge studiene var tid til tumorprogresjon, objektiv tumorresponsrate og sikkerhet.
Demografi og andre grunnlinjekarakteristika, inkludert pasienter som hadde målbar og ingen målbar sykdom, pasienter som fikk tidligere adjuvant terapi, stedet for metastatisk sykdom og etnisk opprinnelse var like for de to behandlingsgruppene for begge studiene. Følgende tabell oppsummerer hormonreseptorstatus ved inngang for alle randomiserte pasienter i forsøk 0030 og 0027.
For de primære endepunktene viste studie 0030 at ARIMIDEX hadde en statistisk signifikant fordel fremfor tamoxifen (p=0,006) for tid til tumorprogresjon; objektive tumorresponsrater var like for ARIMIDEX 1 mg og tamoxifen. Forsøk 0027 viste at ARIMIDEX 1 mg og tamoxifen hadde lignende objektive tumorresponsrater og tid til tumorprogresjon (se tabell 12 og figur 5 og 6).
Tabell 12 nedenfor oppsummerer resultatene fra studie 0030 og studie 0027 for de primære effektendepunktene.
Figur 5: Kaplan-Meier-sannsynlighet for tid til sykdomsprogresjon for alle randomiserte pasienter (intensjon-å-behandle) i forsøk 0030 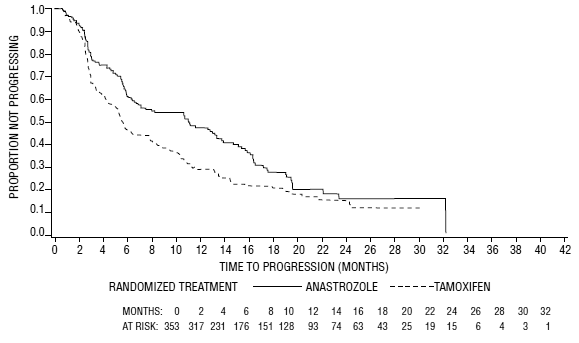
Figur 6: Kaplan-Meier-sannsynlighet for tid til progresjon for alle randomiserte pasienter (intensjon-å-behandle) i forsøk 0027 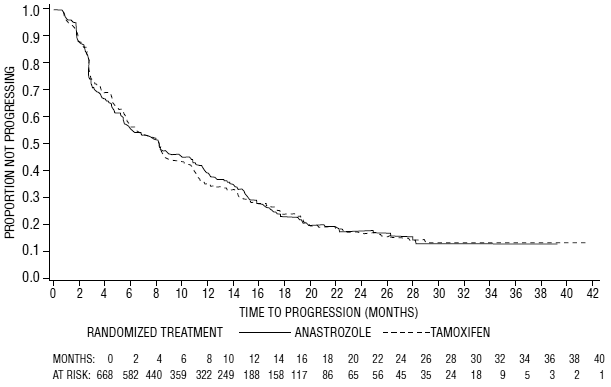
Resultatene fra de sekundære endepunktene støttet resultatene fra de primære effektendepunktene. Det var for få dødsfall på tvers av behandlingsgruppene i begge studiene til å trekke konklusjoner om generelle overlevelsesforskjeller.
Andrelinjebehandling hos postmenopausale kvinner med avansert brystkreft som hadde sykdomsprogresjon etter Tamoxifen-terapi
Anastrozol ble studert i to kontrollerte kliniske studier (0004, en nordamerikansk studie; 0005, en hovedsakelig europeisk studie) hos postmenopausale kvinner med avansert brystkreft som hadde sykdomsprogresjon etter tamoksifenbehandling for enten avansert eller tidlig brystkreft. Noen av pasientene hadde også tidligere fått cellegiftbehandling. De fleste pasientene var ER-positive; en mindre andel var ER-ukjent eller ER-negative; de ER-negative pasientene var kun kvalifisert hvis de hadde hatt en positiv respons på tamoxifen. Kvalifiserte pasienter med målbar og ikke-målbar sykdom ble randomisert til å motta enten en enkelt daglig dose på 1 mg eller 10 mg ARIMIDEX eller megestrolacetat 40 mg fire ganger daglig. Studiene var dobbeltblindede med hensyn til ARIMIDEX. Tid til progresjon og objektiv respons (bare pasienter med målbar sykdom kan betraktes som delvis respondere) var de primære effektvariablene. Objektive svarfrekvenser ble beregnet basert på Union Internationale Contre le Cancer (UICC) kriterier. Frekvensen av langvarig (mer enn 24 uker) stabil sykdom, progresjonshastighet og overlevelse ble også beregnet.
Begge studiene inkluderte over 375 pasienter; demografi og andre grunnlinjekarakteristikker var like for de tre behandlingsgruppene i hver studie. Pasienter i 0005-studien hadde respondert bedre på tidligere tamoksifenbehandling. Av de innmeldte pasientene som hadde tidligere tamoksifenbehandling for avansert sykdom (58 % i forsøk 0004; 57 % i forsøk 0005), ble 18 % av disse pasientene i forsøk 0004 og 42 % i forsøk 0005 rapportert av primærforskeren å ha respondert. I forsøk 0004 var 81 % av pasientene ER-positive, 13 % var ER-ukjente og 6 % var ER-negative. I forsøk 0005 var 58 % av pasientene ER-positive, 37 % var ER-ukjente og 5 % var ER-negative. I forsøk 0004 hadde 62 % av pasientene målbar sykdom sammenlignet med 79 % i forsøk 0005. Stedene for metastatisk sykdom var like blant behandlingsgruppene for hver studie. I gjennomsnitt hadde 40 % av pasientene bløtvevsmetastaser; 60 % hadde benmetastaser; og 40 % hadde viscerale (15 % lever) metastaser.
Effektresultatene fra de to studiene var like som presentert i tabell 13. I begge studiene var det ingen signifikante forskjeller mellom behandlingsarmene med hensyn til noen av effektparametrene oppført i tabellen nedenfor.
Når data fra de to kontrollerte studiene ble samlet, var de objektive responsratene og mediantidene til progresjon og død lik for pasienter randomisert til ARIMIDEX 1 mg og megestrolacetat. Det er i disse dataene ingen indikasjon på at ARIMIDEX 10 mg er bedre enn ARIMIDEX 1 mg.
PASIENTINFORMASJON
ARIMIDEX® A-rim-eh-dex (anastrozol) tabletter for oral administrering
Hva er den viktigste informasjonen jeg bør vite om ARIMIDEX?
ARIMIDEX kan forårsake alvorlige bivirkninger inkludert:
- . hjertesykdom. Kvinner med tidlig brystkreft, som har en historie med blokkering i hjertearteriene (iskemisk hjertesykdom) og som tar ARIMIDEX 1 mg, kan ha en økning i symptomer på redusert blodtilførsel til hjertet sammenlignet med lignende kvinner som tar tamoxifen.
Få medisinsk hjelp umiddelbart hvis du får nye eller forverrede brystsmerter eller kortpustethet under behandling med ARIMIDEX.
Hva er ARIMIDEX?
ARIMIDEX 1mg er et reseptbelagt legemiddel som brukes til kvinner etter overgangsalderen ("livets forandring") for:
- . behandling av tidlig brystkreft
- . etter operasjonen . hos kvinner hvis brystkreft er hormonreseptor-positiv
ARIMIDEX 1mg virker ikke hos kvinner med brystkreft som ikke har gått gjennom overgangsalderen (premenopausale kvinner).
Hvem bør ikke ta ARIMIDEX?
Ikke ta ARIMIDEX 1 mg hvis du:
- . er gravid eller kan bli gravid. ARIMIDEX kan skade det ufødte barnet ditt. Hvis du blir gravid mens du tar ARIMIDEX, fortell legen din umiddelbart. . ikke har gått gjennom overgangsalderen (er premenopausale) . har hatt en alvorlig allergisk reaksjon på anastrozol eller noen av innholdsstoffene i ARIMIDEX. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i ARIMIDEX. Symptomer på en alvorlig allergisk reaksjon på ARIMIDEX inkluderer: hevelse i ansikt, lepper, tunge eller svelg, problemer med å puste eller svelge, elveblest og kløe.
Hva bør jeg fortelle legen min før jeg tar ARIMIDEX 1mg?
Før du tar ARIMIDEX, fortell legen din dersom du:
- . har ikke gått i overgangsalderen. Snakk med legen din hvis du er usikker. . har eller hatt et hjerteproblem . har blitt fortalt at du har beinfortynning eller svakhet (osteoporose) . har høyt kolesterol . har andre medisinske tilstander . er gravid eller planlegger å bli gravid. ARIMIDEX kan skade det ufødte barnet ditt. Se "Hvem bør ikke ta ARIMIDEX?" . ammer eller planlegger å amme. Det er ikke kjent om ARIMIDEX går over i morsmelk. Du og legen din bør bestemme om du vil ta ARIMIDEX 1 mg eller amme. Du bør ikke gjøre begge deler.
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Fortell legen din spesielt hvis du tar:
- . tamoxifen. Du bør ikke ta ARIMIDEX hvis du tar tamoxifen. Å ta ARIMIDEX 1mg med tamoxifen kan redusere mengden ARIMIDEX 1mg i blodet ditt og kan føre til at ARIMIDEX 1mg ikke virker like bra. . Medisiner som inneholder østrogen. ARIMIDEX 1mg virker kanskje ikke hvis det tas sammen med noen av disse legemidlene: . hormonbehandling . P-piller . østrogen kremer . vaginale ringer . vaginale stikkpiller
Kjenn til medisinene du tar. Hold en liste over dem for å vise legen din og apoteket når du får en ny medisin.
Hvordan skal jeg ta ARIMIDEX?
- . Ta ARIMIDEX nøyaktig slik legen din sier at du skal ta det. . Fortsett å ta ARIMIDEX til legen din ber deg slutte. . ARIMIDEX 1mg kan tas med eller uten mat. . Hvis du glemmer en dose, ta den så snart du husker det. Hvis det nesten er tid for neste dose, hopp over den glemte dosen. Ta din neste regelmessige dose. Ikke ta to doser samtidig.
Hvis du tar for mye ARIMIDEX 1mg, ring legen din eller gå til nærmeste legevakt umiddelbart.
Hva er de mulige bivirkningene av ARIMIDEX?
ARIMIDEX kan forårsake alvorlige bivirkninger inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om ARIMIDEX?" . beinfortynning eller svakhet (osteoporose). ARIMIDEX 1mg senker østrogen i kroppen din, noe som kan føre til at beinene dine blir tynnere og svakere. Dette kan øke risikoen for brudd, spesielt i ryggraden, hoften og håndleddet. Legen din kan bestille en beinmineraltetthetstest . før du starter og under behandling med ARIMIDEX for å sjekke deg for beinforandringer. . økt kolesterol i blodet (fett i blodet). Legen din kan ta blodprøver for å sjekke kolesterolet ditt mens du tar ARIMIDEX. . hudreaksjoner. Slutt å ta ARIMIDEX 1mg og ring legen din umiddelbart hvis du får hudlesjoner, sår eller blemmer. . alvorlige allergiske reaksjoner. Få medisinsk hjelp umiddelbart hvis du får: . hevelse i ansiktet, leppene, tungen eller halsen . problemer med å svelge eller puste . leverproblemer. ARIMIDEX 1mg kan forårsake betennelse i leveren og endringer i leverfunksjonsblodprøver. Legen din kan sjekke deg for dette. Slutt å ta ARIMIDEX 1mg og ring legen din umiddelbart hvis du har noen av disse tegnene eller symptomene på et leverproblem:
- . en generell følelse av å ikke ha det bra . gulfarging av huden eller det hvite i øynene . smerte på høyre side av mageområdet (magen)
Vanlige bivirkninger hos kvinner som tar ARIMIDEX 1mg inkluderer:
- . hetetokter . svakhet . leddsmerter . leddsmerter, stivhet eller hevelse (leddgikt) . smerte . sår hals . høyt blodtrykk . depresjon . kvalme og oppkast . utslett . ryggsmerte . søvnproblemer . beinsmerter . hodepine . hevelse i bena, anklene eller føttene . økt hoste . kortpustethet . opphopning av lymfevæske i vevet i den berørte armen (lymfødem)
ARIMIDEX kan også føre til kiling, prikking eller nummenhet i huden.
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av ARIMIDEX. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare ARIMIDEX 1mg?
- . Oppbevar ARIMIDEX 1mg ved romtemperatur mellom 68°F til 77°F (20°C til 25°C).
Oppbevar ARIMIDEX og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av ARIMIDEX.
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i et pasientinformasjonshefte. Ikke ta ARIMIDEX 1 mg for en tilstand det ikke er foreskrevet for. Ikke gi ARIMIDEX til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre apoteket eller legen om informasjon om ARIMIDEX som er skrevet for helsepersonell. For mer informasjon ring 1-866-992-9276 eller gå til www.ARIMIDEX.com.
Hva er ingrediensene i ARIMIDEX?
Aktiv ingrediens: anastrozol
Inaktive ingredienser: laktose, magnesiumstearat, hydroksypropylmetylcellulose, polyetylenglykol, povidon, natriumstivelsesglykolat og titandioksid.
