Parlodel 2.5mg Bromocriptine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Parlodel og hvordan brukes det?
Parlodel 2,5 mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på hyperprolaktinemi-assosierte dysfunksjoner, Parkinsons sykdom, akromegali. Parlodel 2,5 mg kan brukes alene eller sammen med andre medisiner.
Parlodel 2,5 mg tilhører en klasse legemidler som kalles antiparkinsonmidler, dopaminagonister; Hyperprolaktinemi; Metabolske og endokrine, andre.
Det er ikke kjent om Parlodel 2,5 mg er trygt og effektivt hos barn under 10 år.
Hva er de mulige bivirkningene av Parlodel?
Parlodel kan forårsake alvorlige bivirkninger, inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . synsproblemer, . konstant rennende nese, . brystsmerter, . smerte når du puster, . rask puls, . rask pust, . kortpustethet, . ryggsmerte, . hevelse i anklene eller føttene, . urinere mindre eller ikke i det hele tatt, . forvirring, . hallusinasjoner, . svimmelhet, . hodepine, . sult, . svakhet, . svette, . skjelvinger, . irritabilitet, . problemer med å konsentrere seg, . ufrivillige muskelbevegelser, . tap av balanse eller koordinasjon, . blodig eller tjæreaktig avføring, . hoster opp blod, . oppkast som ser ut som kaffegrut, . alvorlig hodepine, . tåkesyn, . surrer i ørene dine, . angst, . forvirring, . brystsmerter, . kortpustethet, . ujevne hjerteslag, og . anfall
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Parlodel 2,5 mg inkluderer:
- . svimmelhet, . spinnende følelse, . mild døsighet, . tretthet, . mild hodepine, . nedstemthet, . søvnproblemer (søvnløshet), . tørr i munnen, . tett nese, . urolig mage, . kvalme, . oppkast, . magesmerter, . tap av Appetit, . diaré, . forstoppelse, og . kald følelse eller nummenhet i fingrene
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Parlodel. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
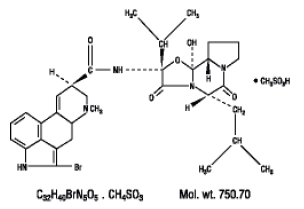
Parlodel® (bromocriptinmesylat) er et ergotderivat med potent dopaminreseptoragonistaktivitet. Hver Parlodel® (bromokriptinmesylat) SnapTabs® tablett for oral administrering inneholder 2½ mg og hver kapsel inneholder 5 mg bromokriptin (som mesylatet). Bromokriptinmesylat er kjemisk betegnet som Ergotaman-3',6',18-trion, 2-brom-12'-hydroxy-2'-(1-methylethyl)-5'-( 2-metylpropyl)-, (5'a)-monometansulfonat (salt).
Strukturformelen er:
2½ mg SnapTabs®
Aktiv ingrediens: bromokriptinmesylat, USP
Inaktive ingredienser: kolloidalt silisiumdioksid, laktose, magnesiumstearat, povidon, stivelse og en annen ingrediens
5 mg kapsler
Aktiv ingrediens: bromokriptinmesylat, USP
Inaktive ingredienser: kolloidalt silisiumdioksid, gelatin, laktose, magnesiumstearat, rødt jernoksid, silisiumdioksid, natriumlaurylsulfat, stivelse, titandioksid, gult jernoksid og en annen ingrediens
INDIKASJONER
Hyperprolaktinemi-assosierte dysfunksjoner
Parlodel (bromokriptinmesylat) er indisert for behandling av dysfunksjoner forbundet med hyperprolaktinemi gjelder også amenoré med eller uten galaktoré, infertilitet eller hypogonadisme . Parlodel 2,5 mg behandling er indisert hos pasienter med prolaktin-utskillende adenomer , som kan være den grunnleggende underliggende endokrinopatien som bidrar til de ovennevnte kliniske presentasjonene. Reduksjon i tumorstørrelse har blitt påvist hos både mannlige og kvinnelige pasienter med makroadenomer. I tilfeller hvor adenektomi velges, kan en behandlingskur med Parlodel 2,5 mg brukes for å redusere tumormassen før operasjonen.
Akromegali
Parlodel 2,5 mg-behandling er indisert for behandling av akromegali. Parlodelterapi, alene eller som tilleggsbehandling med bestråling av hypofysen eller kirurgi, reduserer serumveksthormonet med 50 % eller mer hos omtrent ½ av pasientene som behandles, men vanligvis ikke til normale nivåer.
Siden effekten av ekstern hypofysestråling kanskje ikke blir maksimal på flere år, gir tilleggsbehandling med Parlodel 2,5 mg potensielle fordeler før effekten av bestråling manifesteres.
Parkinsons sykdom
Parlodel 2,5 mg SnapTabs eller kapsler er indisert for behandling av tegn og symptomer på idiopatisk eller postencefalittisk Parkinsons sykdom. Som tilleggsbehandling til levodopa (alene eller med en perifer dekarboksylasehemmer), kan Parlodel-behandling gi ytterligere terapeutiske fordeler hos de pasientene som for tiden opprettholdes på optimale doser av levodopa, de som begynner å forverres (utvikler toleranse) for levodopabehandling, og de som opplever "slutt på dosesvikt" på levodopabehandling. Parlodel 2,5 mg-behandling kan tillate en reduksjon av vedlikeholdsdosen av levodopa og kan dermed lindre forekomsten og/eller alvorlighetsgraden av bivirkninger assosiert med langvarig levodopabehandling som unormale ufrivillige bevegelser (f.eks. dyskinesier) og de markerte svingningene i motorisk funksjon ("på-av"-fenomen). Fortsatt effekt av Parlodel 2,5 mg-behandling under behandling på mer enn 2 år er ikke fastslått.
Dataene er utilstrekkelige til å vurdere potensiell fordel ved å behandle nylig diagnostisert Parkinsons sykdom med Parlodel. Studier har imidlertid vist signifikant flere bivirkninger (spesielt kvalme, hallusinasjoner, forvirring og hypotensjon) hos Parlodel-behandlede pasienter enn hos levodopa/carbidopa-behandlede pasienter. Pasienter som ikke reagerer på levodopa, er dårlige kandidater for Parlodel-behandling.
DOSERING OG ADMINISTRASJON
Generell
Det anbefales at Parlodel (bromokriptinmesylat) tas sammen med mat. Pasienter bør evalueres ofte under doseøkning for å bestemme den laveste dosen som gir en terapeutisk respons.
Hyperprolaktinemiske indikasjoner
Startdosen av Parlodel SnapTabs til voksne er én ½ til én 2½ mg tablett med skåren daglig. En ytterligere 2½ mg tablett kan legges til behandlingsregimet som tolerert hver 2. til 7. dag inntil en optimal terapeutisk respons er oppnådd. Den terapeutiske dosen varierte fra 2,5-15 mg daglig hos voksne studert klinisk.
Basert på begrensede data for barn i alderen 11 til 15, (se Pediatrisk bruk ) startdosen er én ½ til én 2½ mg tablett med skåren daglig. Doseringen må kanskje økes ettersom det tolereres inntil en terapeutisk respons oppnås. Den terapeutiske dosen varierte fra 2,5-10 mg daglig hos barn med prolaktin-utskillende hypofyseadenomer.
For å redusere sannsynligheten for langvarig eksponering for Parlodels, dersom en ikke mistenkt graviditet oppstår, bør et mekanisk prevensjonsmiddel brukes sammen med Parlodel 2,5 mg-behandling inntil normale ovulatoriske menstruasjonssykluser er gjenopprettet. Prevensjon kan deretter seponeres hos pasienter som ønsker å bli gravide.
Deretter, hvis menstruasjon ikke oppstår innen 3 dager etter forventet dato, bør Parlodel 2,5 mg-behandling avbrytes og en graviditetstest utføres.
Akromegali
Nesten alle akromegale pasienter som får terapeutisk fordel av Parlodel 2,5 mg har også reduksjoner i sirkulerende nivåer av veksthormon. Derfor vil periodisk vurdering av sirkulerende nivåer av veksthormon i de fleste tilfeller tjene som en veiledning for å bestemme det terapeutiske potensialet til Parlodel. Hvis det etter en kort utprøving med Parlodel-behandling ikke har funnet sted noen signifikant reduksjon i veksthormonnivået, bør det foretas en nøye vurdering av de kliniske trekk ved sykdommen, og dersom ingen endring har skjedd, bør dosejustering eller seponering av behandlingen vurderes. .
Den initiale anbefalte dosen er én ½ til én 2½ mg Parlodel SnapTabs-tablett ved pensjonering (med mat) i 3 dager. Ytterligere én ½ til 1 SnapTabs-tablett bør legges til behandlingsregimet som tolereres hver 3. til 7. dag inntil pasienten oppnår optimal terapeutisk fordel. Pasienter bør revurderes månedlig og dosen justeres basert på reduksjon av veksthormon eller klinisk respons. Det vanlige optimale terapeutiske doseringsområdet for Parlodel varierer fra 20-30 mg/dag hos de fleste pasienter. Maksimal dose bør ikke overstige 100 mg/dag.
Pasienter som behandles med hypofysebestråling bør seponeres fra Parlodel 2,5 mg-behandling på årsbasis for å vurdere både den kliniske effekten av stråling på sykdomsprosessen så vel som effekten av Parlodel-behandlingen. Vanligvis er en tilbaketrekningsperiode på 4 til 8 uker tilstrekkelig for dette formålet. Tilbakefall av tegn/symptomer eller økning i veksthormon indikerer at sykdomsprosessen fortsatt er aktiv og ytterligere kurer med Parlodel bør vurderes.
Parkinsons sykdom
Det grunnleggende prinsippet for Parlodel 2,5 mg-behandling er å starte behandlingen med en lav dose og, på individuell basis, øke den daglige dosen sakte inntil maksimal terapeutisk respons er oppnådd. Doseringen av levodopa i denne introduksjonsperioden bør opprettholdes, hvis mulig. Startdosen av Parlodel 2,5 mg er en ½ av en 2½ mg SnapTabs-tablett to ganger daglig med måltider. Vurderinger anbefales med 2-ukers intervaller under dosetitrering for å sikre at den laveste dosen som gir en optimal terapeutisk respons ikke overskrides. Om nødvendig kan dosen økes hver 14. til 28. dag med 2½ mg/dag med måltider. Skulle det være tilrådelig å redusere dosen av levodopa på grunn av bivirkninger, bør den daglige dosen av Parlodel, hvis den økes, utføres gradvis i små (2½ mg) trinn.
Sikkerheten til Parlodel er ikke vist i doser over 100 mg/dag.
HVORDAN LEVERES
Parlodel (Bromocriptine Mesylate) SnapTabs
2½ mg
Parlodel er tilgjengelig i flasker som inneholder 30 og 100 tabletter à 2 ½ mg, hver flaske inneholder et tørkemiddel.
SnapTabs med runde, off-white, skråkanter, hver inneholder 2½ mg bromokriptin (som mesylatet). Gravert "PARLODEL 2½" på den ene siden og "017" på den skårede siden. Samsvarer med USP-oppløsningstest 1.
Pakker på 30 - NDC 30698-202-30 Pakker à 100 - NDC 30698-202-01
Parlodel (Bromocriptine Mesylate) Kapsler
5 mg
Karamell og hvite kapsler, som hver inneholder 5 mg bromokriptin (som mesylatet). Påtrykt med rødt blekk "PARLODEL 5 mg" på den ene halvdelen og "102" på den andre halvdelen.
Pakker på 30 - NDC 30698-201-30 Pakker à 100 - NDC 30698-201-01
Lagre og dispensere
Oppbevares ved 68° til 77°F (20° til 25°C); ekskursjoner tillatt til 59° til 86°F (15° til 30°C) [Se USP kontrollert romtemperatur].
Dispenser i en tett, lysbestandig beholder.
Produsert for og distribuert av: Validus Pharmaceuticals LLC Parsippany, NJ 07054. Revidert: juli 2021
BIVIRKNINGER
Bivirkninger fra kliniske studier
Hyperprolaktinemiske indikasjoner
Forekomsten av bivirkninger er ganske høy (69 %), men disse er generelt milde til moderate. Behandlingen ble avbrutt hos omtrent 5 % av pasientene på grunn av bivirkninger. Disse i fallende frekvens er: kvalme (49%), hodepine (19%), svimmelhet (17%), tretthet (7%), svimmelhet (5%), oppkast (5%), magekramper (4%) , tett nese (3 %), forstoppelse (3 %), diaré (3 %) og døsighet (3 %).
En lett hypotensiv effekt kan følge med Parlodel (bromokriptinmesylat) behandling. Forekomsten av bivirkninger kan reduseres ved midlertidig å redusere dosen til ½ SnapTabs-tablett 2 eller 3 ganger daglig. Noen få tilfeller av cerebrospinalvæske rhinoré er rapportert hos pasienter som får Parlodel 2,5 mg for behandling av store prolaktinomer. Dette har forekommet sjelden, vanligvis bare hos pasienter som tidligere har fått transsfenoidal kirurgi, hypofysestråling eller begge deler, og som fikk Parlodel 2,5 mg for residiv av tumor. Det kan også forekomme hos tidligere ubehandlede pasienter hvis svulst strekker seg inn i sphenoid sinus.
Akromegali
De hyppigste bivirkningene hos akromegale pasienter behandlet med Parlodel 2,5 mg var: kvalme (18%), forstoppelse (14%), postural/ortostatisk hypotensjon (6%), anoreksi (4%), munntørrhet/nesetetthet (4 %), fordøyelsesbesvær/dyspepsi (4%), digital vasospasme (3%), døsighet/tretthet (3%) og oppkast (2%).
Mindre hyppige bivirkninger (mindre enn 2 %) var: gastrointestinal blødning, svimmelhet, forverring av Raynauds syndrom, hodepine og synkope. Sjelden (mindre enn 1 %) hårtap, alkoholforsterkning, besvimelse, svimmelhet, arytmi, ventrikkeltakykardi, redusert søvnbehov, visuelle hallusinasjoner, slapphet, kortpustethet, bradykardi, svimmelhet, parestesi, treghet, vasovagalt angrep, vrangforestillingspsykose, , søvnløshet, tung hodehet, redusert toleranse for kulde, prikking i ørene, blekhet i ansiktet og muskelkramper er rapportert.
Parkinsons sykdom
kliniske studier der Parlodel 2,5 mg ble administrert med samtidig reduksjon i dosen av levodopa/karbidopa, var de vanligste nylig oppståtte bivirkningene: kvalme, unormale ufrivillige bevegelser, hallusinasjoner, forvirring, "av-på-fenomen, svimmelhet, døsighet, besvimelse/besvimelse, oppkast, asteni, ubehag i magen, synsforstyrrelser, ataksi, søvnløshet, depresjon, hypotensjon, kortpustethet, forstoppelse og svimmelhet.
Mindre vanlige bivirkninger som kan oppstå inkluderer: anoreksi, angst, blefarospasme, munntørrhet, dysfagi, ødem i føtter og ankler, erytromelalgi, epileptiforme anfall, tretthet, hodepine, sløvhet, flekker i huden, tetthet i nesen, nervøsitet, parestesi, hudutslett, urinfrekvens, urininkontinens, urinretensjon, og i sjeldne tilfeller tegn og symptomer på ergotisme som prikking i fingre, kalde føtter, nummenhet, muskelkramper i føtter og ben eller forverring av Raynauds syndrom.
Unormaliteter i laboratorietester kan omfatte økninger i blod ureanitrogen, SGOT, SGPT, GGPT, CPK, alkalisk fosfatase og urinsyre, som vanligvis er forbigående og ikke av klinisk betydning.
Bivirkninger fra erfaring etter markedsføring
Følgende bivirkninger er rapportert under bruk av Parlodel etter godkjenning (alle indikasjoner kombinert). Fordi bivirkninger fra spontane rapporter rapporteres frivillig fra en populasjon av usikker størrelse, er det vanligvis ikke mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering.
Psykiatriske lidelser: Forvirring, psykomotorisk agitasjon/eksitasjon, hallusinasjoner, psykotiske lidelser, søvnløshet, økt libido, hyperseksualitet og impulskontroll/kompulsiv atferd (inkludert gambling, pengebruk og andre intense drifter).
Forstyrrelser i nervesystemet: Hodepine, døsighet, svimmelhet, dyskinesi, somnolens, parestesi, overdreven somnolens på dagtid, plutselig innsettende søvn.
Øyelidelser: Synsforstyrrelse, uklart syn.
Øre- og labyrintlidelser: Tinnitus.
Hjertesykdommer: Perikardiell effusjon, konstriktiv perikarditt, takykardi, bradykardi, arytmi, hjerteklafffibrose.
Vaskulære lidelser: Hypotensjon, ortostatisk hypotensjon (svært sjelden fører til synkope), reversibel blekhet på fingre og tær indusert av kulde (spesielt hos pasienter med Raynauds fenomen i anamnesen).
Sykdommer i luftveiene, thorax og mediastinum: Nesetetthet, pleural effusjon, pleural fibrose, pleuritt, lungefibrose, dyspné.
Gastrointestinale lidelser: Kvalme, forstoppelse, oppkast, munntørrhet, diaré, magesmerter, retroperitoneal fibrose, magesår, gastrointestinal blødning.
Hud- og subkutane vevssykdommer: Allergiske hudreaksjoner, hårtap.
Muskel- og bindevevslidelser: Kramper i benet.
Generelle lidelser og tilstander på administrasjonsstedet: Tretthet, perifert ødem, et syndrom som ligner malignt nevroleptikasyndrom ved brå seponering av Parlodel, abstinenssymptomer (inkludert apati, angst, depresjon, tretthet, søvnløshet, svetting og smerte) med nedtrapping eller etter seponering (se FORHOLDSREGLER ).
Uønskede hendelser observert under andre forhold
Postpartumpasienter (se ovenfor ADVARSLER )
postpartumstudier med Parlodel 2,5 mg hadde 23 prosent av postpartumpasientene som ble behandlet minst 1 bivirkning, men de var generelt milde til moderate i grad. Behandlingen ble avbrutt hos omtrent 3 % av pasientene. De hyppigst forekommende bivirkningene var: hodepine (10 %), svimmelhet (8 %), kvalme (7 %), oppkast (3 %), tretthet (1,0 %), synkope (0,7 %), diaré (0,4 %) og kramper (0,4%). Blodtrykksreduksjon (≥ 20 mm Hg systolisk og ≥ 10 mm Hg diastolisk) forekom hos 28 % av pasientene minst én gang i løpet av de første 3 dagene etter fødsel; disse var vanligvis av forbigående karakter. Rapporter om besvimelse i barselperioden kan muligens ha sammenheng med denne effekten. Etter markedsføring i USA inkluderer alvorlige bivirkninger rapportert 72 tilfeller av anfall (inkludert 4 tilfeller av status epilepticus), 30 tilfeller av hjerneslag og 9 tilfeller av hjerteinfarkt blant postpartumpasienter. Anfallstilfeller ble ikke nødvendigvis ledsaget av utvikling av hypertensjon. En uopphørlig og ofte progressivt alvorlig hodepine, noen ganger ledsaget av synsforstyrrelser, ofte innledet av timer til dager mange tilfeller av anfall og/eller hjerneslag. De fleste pasientene hadde ikke vist tegn på noen av de hypertensive lidelsene i svangerskapet, inkludert eclampsia, preeklampsi eller svangerskapsindusert hypertensjon. Ett slagtilfelle var assosiert med sagittal sinus trombose, og et annet var assosiert med cerebral og cerebellar vaskulitt. Ett tilfelle av hjerteinfarkt var assosiert med uforklarlig disseminert intravaskulær koagulasjon, og et andre skjedde i forbindelse med bruk av en annen ergotalkaloid. Sammenhengen mellom disse bivirkningene og administrasjonen av Parlodel er ikke fastslått.
sjeldne tilfeller har alvorlige bivirkninger, inkludert hypertensjon, hjerteinfarkt, anfall, hjerneslag eller psykiske lidelser blitt rapportert hos postpartum kvinner behandlet med Parlodel. Hos noen pasienter ble utviklingen av anfall eller hjerneslag forut for alvorlig hodepine og/eller forbigående synsforstyrrelser. Selv om årsakssammenhengen mellom disse hendelsene og stoffet er usikker, er periodisk overvåking av blodtrykket tilrådelig hos kvinner etter fødselen som får Parlodel. Hvis hypertensjon, alvorlig, progressiv eller uavbrutt hodepine (med eller uten synsforstyrrelser), eller tegn på CNS-toksisitet utvikles, bør administreringen av Parlodel 2,5 mg avbrytes og pasienten bør evalueres umiddelbart.
Spesiell forsiktighet er påkrevd hos pasienter som nylig har blitt behandlet eller er på samtidig behandling med legemidler som kan endre blodtrykket, f.eks. vasokonstriktorer som sympatomimetika eller ergotalkaloider inkludert ergometrin eller metylergometrin, og samtidig bruk av disse i barseltiden er ikke anbefalt.
For å rapportere MISTENTE BIVIRKNINGER, kontakt Validus Pharmaceuticals LLC på 1-866-982-5438 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
NARKOTIKAHANDEL
Risikoen ved å bruke Parlodel i kombinasjon med andre legemidler har ikke blitt systematisk evaluert, men alkohol kan potensere bivirkningene av Parlodel. Parlodel 2,5 mg kan interagere med dopaminantagonister, butyrofenoner og visse andre midler. Forbindelser i disse kategoriene resulterer i redusert effekt av Parlodel: fenotiaziner, haloperidol, metoklopramid og pimozid. Bromokriptin er et substrat for CYP3A4. Det bør derfor utvises forsiktighet ved samtidig administrering av legemidler som er sterke hemmere av dette enzymet (som azol-antimykotika, HIV-proteasehemmere). Samtidig bruk av makrolidantibiotika som erytromycin ble vist å øke plasmanivåene av bromokriptin (gjennomsnittlige AUC- og Cmax-verdier økte henholdsvis 3,7 ganger og 4,6 ganger).1 Samtidig behandling av akromegale pasienter med bromokriptin og oktreotid førte til økt plasma nivåer av bromokriptin (bromokriptins AUC økte med ca. 38%).4 Samtidig bruk av Parlodel og andre ergotalkaloider anbefales ikke. Dosejustering kan være nødvendig i de tilfellene hvor høye doser bromokriptin brukes (som f.eks. Parkinsons sykdom).
ADVARSLER
Siden hyperprolaktinemi med amenoré/galaktoré og infertilitet er funnet hos pasienter med hypofysetumorer, er en fullstendig evaluering av hypofysen indisert før behandling med Parlodel (bromokriptinmesylat).
Hvis graviditet oppstår under administrasjon av Parlodel, er nøye observasjon av disse pasientene obligatorisk. Prolaktin-utskillende adenomer kan utvide seg og kompresjon av optikken eller andre kraniale nerver kan oppstå, og akutt hypofysekirurgi blir nødvendig. I de fleste tilfeller løser komprimeringen seg etter levering. Reinitiering av Parlodel 2,5 mg-behandling har blitt rapportert å gi forbedring i synsfeltet hos pasienter hvor nervekompresjon har oppstått under graviditet. Sikkerheten av Parlodel 2,5 mg-behandling under graviditet til mor og foster er ikke fastslått.
Parlodel 2,5 mg har vært assosiert med somnolens og episoder med plutselig innsettende søvn, spesielt hos pasienter med Parkinsons sykdom. Plutselig innsettende søvn under daglige aktiviteter, i noen tilfeller uten bevissthet eller advarselstegn, er rapportert. Pasienter må informeres om dette og rådes til ikke å kjøre bil eller bruke maskiner under behandling med bromokriptin. Pasienter som har opplevd somnolens og/eller en episode med plutselig innsettende søvn, må ikke kjøre bil eller betjene maskiner. Videre kan en reduksjon av dosen eller seponering av behandlingen vurderes.
Symptomatisk hypotensjon kan forekomme hos pasienter behandlet med Parlodel for enhver indikasjon. I postpartumstudier med Parlodel er det observert reduksjoner i liggende systolisk og diastolisk trykk på mer enn henholdsvis 20 mm og 10 mm Hg hos nesten 30 % av pasientene som får Parlodel. Noen ganger var fallet i ryggliggende systolisk trykk så mye som 50-59 mm Hg.
Siden, spesielt i løpet av de første dagene av behandlingen, kan hypotensive reaksjoner av og til oppstå og resultere i redusert årvåkenhet, bør spesiell forsiktighet utvises når du kjører kjøretøy eller bruker maskiner.
Mens hypotensjon under oppstart av behandling med Parlodel 2,5 mg forekommer hos noen pasienter, er det i sjeldne tilfeller rapportert alvorlige bivirkninger, inkludert hypertensjon, hjerteinfarkt, anfall, hjerneslag hos postpartum kvinner behandlet med Parlodel 2,5 mg for hemming av amming. Hypertensjon har blitt rapportert, noen ganger ved behandlingsstart, men ofte utviklet i løpet av den andre uken av behandlingen; anfall har også blitt rapportert både med og uten tidligere utvikling av hypertensjon; hjerneslag har hovedsakelig blitt rapportert hos postpartumpasienter hvis prenatale og obstetriske forløp hadde vært ukompliserte. Mange av disse pasientene som opplevde anfall (inkludert tilfeller av status epilepticus) og/eller slag rapporterte å utvikle en konstant og ofte progressivt alvorlig hodepine timer til dager før den akutte hendelsen. Noen tilfeller av slag og anfall ble også innledet av synsforstyrrelser (tåkesyn og forbigående kortikal blindhet). Tilfeller av akutt hjerteinfarkt er også rapportert.
Selv om en årsakssammenheng mellom administrering av Parlodel og hypertensjon, anfall, hjerneslag og hjerteinfarkt hos postpartum kvinner ikke er fastslått, anbefales ikke bruk av stoffet for forebygging av fysiologisk amming eller hos pasienter med ukontrollert hypertensjon. Hos pasienter som behandles for hyperprolaktinemi, bør Parlodel 2,5 mg seponeres når graviditet er diagnostisert (se FORHOLDSREGLER , Hyperprolaktinemiske tilstander ). I tilfelle Parlodel 2,5 mg gjenopptas for å kontrollere et raskt ekspanderende makroadenom (se FORHOLDSREGLER , Hyperprolaktinemiske tilstander og en pasient opplever en hypertensiv svangerskapsforstyrrelse, må fordelen ved å fortsette med Parlodel veies opp mot den mulige risikoen ved bruk under en hypertensiv svangerskapsforstyrrelse. Når Parlodel brukes til å behandle akromegali eller Parkinsons sykdom hos pasienter som senere blir gravide, bør det tas en beslutning om behandlingen fortsetter å være medisinsk nødvendig eller kan seponeres. Hvis det fortsettes, bør legemidlet seponeres hos de som kan oppleve hypertensive svangerskapsforstyrrelser (inkludert eklampsi, preeklampsi eller svangerskapsindusert hypertensjon) med mindre seponering av Parlodel anses å være medisinsk kontraindisert. På grunn av muligheten for en interaksjon mellom Parlodel og andre ergotalkaloider, anbefales ikke samtidig bruk av disse medisinene. Periodisk overvåking av blodtrykket, spesielt i løpet av de første ukene av behandlingen, er fornuftig. Hvis hypertensjon, alvorlig, progressiv eller uavbrutt hodepine (med eller uten synsforstyrrelser), eller tegn på CNS-toksisitet utvikles, bør medikamentell behandling avbrytes og pasienten evalueres umiddelbart. Spesiell oppmerksomhet bør rettes mot pasienter som nylig har blitt behandlet eller som er på samtidig behandling med legemidler som kan endre blodtrykket. Samtidig bruk i barseltiden anbefales ikke.
Blant pasienter på Parlodel, spesielt på langtids- og høydosebehandling, er det rapportert pleura- og perikardial effusjoner, samt pleural og pulmonal fibrose og konstriktiv perikarditt. Pasienter med uforklarlige pleuropulmonale lidelser bør undersøkes grundig og seponering av Parlodel 2,5 mg-behandling bør vurderes. I de tilfellene der behandlingen med Parlodel 2,5 mg ble avsluttet, gikk endringene sakte tilbake til det normale.
Hos noen få pasienter på Parlodel, spesielt på langtids- og høydosebehandling, har retroperitoneal fibrose blitt rapportert. For å sikre gjenkjennelse av retroperitoneal fibrose på et tidlig reversibelt stadium anbefales det at dens manifestasjoner (f.eks. ryggsmerter, ødem i underekstremitetene, nedsatt nyrefunksjon) overvåkes hos denne pasientkategorien. Parlodel-medisinering bør seponeres dersom fibrotiske forandringer i retroperitoneum er diagnostisert eller mistenkt.
FORHOLDSREGLER
Generell
Det har vært rapporter om pasienter som har opplevd intens trang til å spille, økt seksuell trang, intens trang til å bruke penger ukontrollert og/eller andre intense trang, og manglende evne til å kontrollere disse trangene mens de tar en eller flere av medisinene, inkludert Parlodel 2,5 mg , som øker sentral dopaminerg tone. I noen tilfeller, selv om ikke alle, ble disse trangene rapportert å ha stoppet når dosen ble redusert, eller medisinen ble seponert. Fordi pasienter kanskje ikke gjenkjenner denne atferden som unormal, er det viktig for forskrivere å spesifikt spørre pasienter eller deres omsorgspersoner om utviklingen av nye eller økte spilletrang, seksuelle trang, ukontrollert pengebruk eller andre trang mens de behandles med Parlodel 2,5 mg for Parkinsons sykdom eller hyperprolaktinemi-assosierte dysfunksjoner. Leger bør vurdere dosereduksjon eller stoppe medisinen hvis en pasient utvikler slike trang mens han tar Parlodel.
Sikkerhet og effekt av Parlodel (bromokriptinmesylat) er ikke fastslått hos pasienter med nyre- eller leversykdom. Forsiktighet bør utvises når Parlodel-behandling administreres samtidig med andre medisiner som er kjent for å senke blodtrykket.
Legemidlet bør brukes med forsiktighet hos pasienter med en historie med psykose eller kardiovaskulær sykdom. Hvis akromegale pasienter eller pasienter med prolaktinom eller Parkinsons sykdom behandles med Parlodel 2,5 mg under graviditet, bør de observeres forsiktig, spesielt i postpartumperioden hvis de har en historie med kardiovaskulær sykdom.
Pasienter med sjeldne arvelige problemer med galaktoseintoleranse, alvorlig laktasemangel eller glukose-galaktosemalabsorpsjon bør ikke ta dette legemidlet.
Hyperprolaktinemiske tilstander
Synsfeltsvikt er en kjent komplikasjon av makroprolaktinom. Effektiv behandling med Parlodel 2,5 mg fører til reduksjon i hyperprolaktinemi og ofte til oppløsning av synshemmingen. Hos noen pasienter kan imidlertid en sekundær forverring av synsfelt utvikles til tross for normaliserte prolaktinnivåer og svulstkrymping, som kan være et resultat av trekkraft på den optiske chiasmen som trekkes ned i den nå delvis tomme sella. I disse tilfellene kan synsfeltdefekten forbedres ved reduksjon av bromokriptindosen mens det er en viss økning av prolaktin og en viss svulstforlengelse. Overvåking av synsfelt hos pasienter med makroprolaktinom anbefales derfor for tidlig erkjennelse av sekundært felttap på grunn av chiasmal herniering og tilpasning av legemiddeldosering.
Den relative effekten av Parlodel versus kirurgi for å bevare synsfelt er ikke kjent. Pasienter med raskt progressivt synsfelttap bør evalueres av en nevrokirurg for å hjelpe med å bestemme den mest passende behandlingen.
Siden graviditet ofte er det terapeutiske målet hos mange hyperprolaktinemiske pasienter med amenoré/galaktoré og hypogonadisme (infertilitet), er en nøye vurdering av hypofysen avgjørende for å oppdage tilstedeværelsen av et prolaktin-utskillende adenom. Pasienter som ikke ønsker å bli gravide, eller de som har store adenomer, bør rådes til å bruke andre prevensjonsmidler enn orale prevensjonsmidler under behandling med Parlodel. Siden graviditet kan oppstå før menstruasjonsstart, anbefales en graviditetstest minst hver 4. uke i løpet av amenoréperioden, og, når menstruasjonen er gjenopptatt, hver gang en pasient går glipp av menstruasjon. Behandling med Parlodel SnapTabs eller kapsler bør avbrytes så snart graviditet er etablert. Pasienter må overvåkes nøye gjennom hele svangerskapet for tegn og symptomer som kan signalisere forstørrelse av en tidligere uoppdaget eller eksisterende prolaktin-utskillende svulst. Seponering av Parlodel-behandling hos pasienter med kjente makroadenomer har vært assosiert med rask gjenvekst av tumor og økning i serumprolaktin i de fleste tilfeller.
Cerebrospinalvæske rhinoré har blitt observert hos noen pasienter med prolaktin-utskillende adenomer behandlet med Parlodel.
Akromegali
Kuldefølsom digital vasospasme er observert hos enkelte akromegale pasienter behandlet med Parlodel. Responsen, hvis den skulle oppstå, kan reverseres ved å redusere dosen av Parlodel 2,5 mg og kan forhindres ved å holde fingrene varme. Tilfeller av alvorlig gastrointestinal blødning fra magesår er rapportert, noen dødelige. Selv om det ikke er bevis for at Parlodel 2,5 mg øker forekomsten av magesår hos akromegale pasienter, bør symptomer som tyder på magesår undersøkes grundig og behandles på riktig måte. Pasienter med en historie med magesår eller gastrointestinal blødning bør observeres nøye under behandling med Parlodel.
Mulig tumorutvidelse under behandling med Parlodel er rapportert hos noen få pasienter. Siden den naturlige historien til svulster som utskiller veksthormon er ukjent, bør alle pasienter overvåkes nøye, og hvis det oppstår tegn på tumorekspansjon, seponering av behandling og alternative prosedyrer vurderes.
Parkinsons sykdom
Sikkerhet ved langtidsbruk i mer enn 2 år ved doser som kreves for parkinsonisme er ikke fastslått.
Som med all kronisk behandling, anbefales periodisk evaluering av lever-, hematopoetisk, kardiovaskulær og nyrefunksjon. Symptomatisk hypotensjon kan oppstå, og derfor bør det utvises forsiktighet ved behandling av pasienter som får antihypertensiva.
Høye doser av Parlodel 2,5 mg kan være assosiert med forvirring og mentale forstyrrelser. Siden parkinsonpasienter kan vise mild grad av demens, bør det utvises forsiktighet ved behandling av slike pasienter.
Parlodel administrert alene eller samtidig med levodopa kan forårsake hallusinasjoner (visuelle eller auditive). Hallusinasjoner går vanligvis over med dosereduksjon; noen ganger er det nødvendig med seponering av Parlodel 2,5 mg. I sjeldne tilfeller, etter høye doser, har hallusinasjoner vedvart i flere uker etter seponering av Parlodel.
Som med levodopa, bør det utvises forsiktighet ved administrering av Parlodel til pasienter med hjerteinfarkt i anamnesen som har en gjenværende atriell, nodal eller ventrikulær arytmi.
Retroperitoneal fibrose er rapportert hos noen få pasienter som får langtidsbehandling (2 til 10 år) med Parlodel 2,5 mg i doser fra 30-140 mg daglig.
Epidemiologiske studier har vist at pasienter med Parkinsons sykdom har en høyere risiko (2ca. 6 ganger høyere) for å utvikle melanom enn befolkningen generelt. Hvorvidt den økte risikoen som ble observert skyldtes Parkinsons sykdom eller andre faktorer, for eksempel legemidler som brukes til å behandle Parkinsons sykdom, er uklart. Av grunnene nevnt ovenfor, anbefales pasienter og behandlere å overvåke for melanomer ofte og regelmessig når de bruker Parlodel for enhver indikasjon. Ideelt sett bør periodiske hudundersøkelser utføres av passende kvalifiserte personer (f.eks. hudleger).
Seponering av Parlodel bør foretas gradvis når det er mulig, selv om pasienten skal forbli på levodopa. Et symptomkompleks som ligner det maligne neuroleptikasyndromet (karakterisert av forhøyet temperatur, muskelstivhet, endret bevissthet og autonom ustabilitet), uten annen åpenbar etiologi, er rapportert i forbindelse med rask dosereduksjon, seponering av eller endringer i antiparkinsonbehandling.
Symptomer inkludert apati, angst, depresjon, tretthet, søvnløshet, svetting og smerte er rapportert under nedtrapping eller etter seponering av dopaminagonister, inkludert Parlodel. Disse symptomene reagerer vanligvis ikke på levodopa. Før seponering av Parlodel bør pasienter informeres om potensielle abstinenssymptomer og overvåkes nøye under og etter seponering av Parlodel. Ved alvorlige abstinenssymptomer kan re-administrering av en dopaminagonist med laveste effektive dose vurderes.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
En 74-ukers studie ble utført på mus ved bruk av diettnivåer av bromokriptinmesylat tilsvarende orale doser på 10 og 50 mg/kg/dag. En 100-ukers studie på rotter ble utført ved bruk av diettnivåer tilsvarende orale doser på 1,7, 9,8 og 44 mg/kg/dag. De høyeste dosene testet på mus og rotter var henholdsvis ca. 2,5 og 4,4 ganger den maksimale humane dosen administrert i kontrollerte kliniske studier (100 mg/dag) basert på kroppsoverflate. Ondartede livmorsvulster, endometrial og myometrial, ble funnet hos rotter som følger: 0/50 hunnkontroller, 2/50 hunner gitt 1,7 mg/kg daglig, 7/49 hunner gitt 9,8 mg/kg daglig, og 9/50 hunner gitt 44 mg/kg daglig. Forekomsten av disse neoplasmene kan sannsynligvis tilskrives det høye østrogen/progesteron-forholdet som forekommer hos rotter som et resultat av den prolaktin-hemmende virkningen av bromokriptinmesylat. De endokrine mekanismene som antas å være involvert i rottene er ikke til stede hos mennesker. Det er ingen kjent sammenheng mellom uterine maligniteter som forekommer hos bromokriptinbehandlede rotter og menneskelig risiko. I motsetning til funnene hos rotter, viste ikke livmoren fra mus drept etter 74 ukers behandling tegn på medikamentrelaterte endringer.
Bromokriptinmesylat ble evaluert for mutagent potensial i batteriet av tester som inkluderte Ames bakteriell mutasjonsanalyse, mutagen aktivitet in vitro på V79 kinesiske hamsterfibroblaster, cytogenetisk analyse av benmargsceller fra kinesisk hamster etter in vivo-behandling, og en in vivo mikronukleustest for mutagen. potensial hos mus.
Ingen mutagene effekter ble oppnådd i noen av disse testene.
Fertilitet og reproduksjonsevne hos hunnrotter ble ikke påvirket negativt av behandling med bromokriptin utover den forutsagte reduksjonen i vekten til unger på grunn av undertrykkelse av laktasjon. Hos menn behandlet med 50 mg/kg av dette legemidlet var paring og fruktbarhet innenfor normalområdet. Økt perinatalt tap ble produsert i undergruppene av mødre, avlivet på dag 21 postpartum (pp) etter parring med hanner behandlet med den høyeste dosen (50 mg/kg).
Svangerskap
Kategori B
Administrering av 10-30 mg/kg bromokriptin til 2 rottestammer på dag 6 til 15 postcoitum (pc) samt en enkeltdose på 10 mg/kg på dag 5 pc forstyrret nidasjonen. Tre mg/kg gitt på dag 6 til 15 var uten effekt på nidasjon, og ga ingen anomalier. Hos dyr behandlet fra dag 8-15 pc, dvs. etter implantasjon, ga 30 mg/kg økt prenatal dødelighet i form av økt forekomst av embryonal resorpsjon. En anomali, aplasi av ryggvirvler og ribbeina, ble funnet i gruppen på 262 fostre avledet fra mødre behandlet med 30 mg/kg bromokriptin. Det ble ikke funnet føtotoksiske effekter hos avkom fra mødre behandlet i peri- eller postnatale periode.
To studier ble utført på kaniner (2 stammer) for å bestemme potensialet for å forstyrre nidasjon. Dosenivåer på 100 eller 300 mg/kg/dag fra dag 1 til dag 6 pc påvirket ikke nidasjonen negativt. Den høye dosen var omtrent 63 ganger den maksimale humane dosen administrert i kontrollerte kliniske studier (100 mg/dag), basert på kroppsoverflate. Hos hvite kaniner fra New Zealand forekom en viss embryodødelighet ved 300 mg/kg, noe som var en refleksjon av åpenbar maternell toksisitet. Tre studier ble utført på 2 kaninstammer for å bestemme det teratologiske potensialet til bromokriptin ved dosenivåer på 3, 10, 30, 100 og 300 mg/kg gitt fra dag 6 til dag 18 pc. I 2 studier med Yellow-silver-stammen , ganespalte ble funnet hos 3 og 2 fostre ved maternal toksiske doser på henholdsvis 100 og 300 mg/kg. Ett kontrollfoster viste også denne anomalien. I den tredje studien utført med hvite kaniner fra New Zealand ved bruk av en identisk protokoll, ble det ikke produsert noen ganespalte.
Ingen teratologiske eller embryotoksiske effekter av bromokriptin ble produsert hos noen av 6 avkom fra 6 aper ved et dosenivå på 2 mg/kg.
Informasjon om 1276 graviditeter hos kvinner som tar Parlodel er samlet inn. I de fleste tilfellene ble Parlodel seponert innen 8 uker inn i svangerskapet (gjennomsnittlig 28,7 dager), men 8 pasienter fikk stoffet kontinuerlig gjennom hele svangerskapet. Gjennomsnittlig daglig dose for alle pasienter var 5,8 mg (område 1-40 mg).
Av disse 1276 svangerskapene var det 1088 fulltidsfødsler (4 dødfødte), 145 spontanaborter (11,4%) og 28 induserte aborter (2,2%). Dessuten forårsaket 12 ekstrauterinegraviditeter og 3 hydatidiforme føflekker (to ganger hos samme pasient) tidlig svangerskapsavbrudd. Disse dataene sammenligner gunstig med abortraten (11 % -25 %) som er oppgitt for graviditeter indusert av klomifensitrat, menopausalt gonadotropin og koriongonadotropin.
Selv om spontanaborter ofte ikke blir rapportert, spesielt før 20 ukers svangerskap, har hyppigheten av disse blitt anslått til å være 15 %.
Forekomsten av fødselsskader i befolkningen generelt varierer fra 2 % -4,5 %. Forekomsten i 1109 levendefødte fra pasienter som får bromokriptin er 3,3 %.
Det er ingen antydning om at Parlodel 2,5 mg bidro til typen eller forekomsten av fødselsdefekter hos denne gruppen spedbarn.
Ammende mødre
Parlodel 2,5 mg bør ikke brukes under amming hos kvinner etter fødsel.
Pediatrisk bruk
Sikkerheten og effektiviteten til bromokriptin for behandling av prolaktin-utskillende hypofyseadenomer er etablert hos pasienter i alderen 16 til voksne. Ingen data er tilgjengelig for bruk av bromokriptin hos pediatriske pasienter under 8 år. En enkelt 8 år gammel pasient behandlet med bromokriptin for et prolaktin-utskillende hypofysemakroadenom er rapportert uten terapeutisk respons.
Bruk av bromokriptin til behandling av prolaktin-utskillende adenomer hos pediatriske pasienter i aldersgruppen 11 til under 16 år støttes av bevis fra godt kontrollerte studier hos voksne, med tilleggsdata for et begrenset antall (n=14) barn og ungdom i alderen 11 til 15 år med prolaktin-utskillende hypofyse makro- og mikroadenomer som har blitt behandlet med bromokriptin. Av de 14 rapporterte pasientene hadde 9 vellykkede utfall, 3 delvise responser og 2 responderte ikke på bromokriptinbehandling. Kronisk hypopituitarisme komplisert makroadenombehandling hos 5 av pasientene, både hos pasienter som fikk bromokriptin alene og hos de som fikk bromokriptin i kombinasjon med kirurgisk behandling og/eller bestråling av hypofysen.
Sikkerhet og effektivitet av bromokriptin hos pediatriske pasienter er ikke fastslått for noen annen indikasjon oppført i INDIKASJONER OG BRUK.
Geriatrisk bruk
Kliniske studier for Parlodel 2,5 mg inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om eldre responderer annerledes enn yngre personer. Andre rapporterte kliniske erfaringer, inkludert rapportering etter markedsføring av bivirkninger, har imidlertid ikke identifisert forskjeller i respons eller toleranse mellom eldre og yngre pasienter. Selv om det ikke er observert noen variasjon i effekt eller bivirkningsprofil hos geriatriske pasienter som tar Parlodel 2,5 mg, kan større sensitivitet hos enkelte eldre ikke kategorisk utelukkes. Generelt bør dosevalg for en eldre pasient være forsiktig, med start i den nedre enden av doseområdet, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling i denne populasjonen.
OVERDOSE
De hyppigst rapporterte tegnene og symptomene forbundet med akutt Parlodel (bromocriptinmesylat) overdose er: kvalme, oppkast, forstoppelse, diaforese, svimmelhet, blekhet, alvorlig hypotensjon, ubehag, forvirring, sløvhet, døsighet, vrangforestillinger, hallusinasjoner og gjentatte forvirringer. Den dødelige dosen er ikke fastslått og stoffet har en meget bred sikkerhetsmargin. Imidlertid skjedde ett dødsfall hos en pasient som begikk selvmord med en ukjent mengde Parlodel 2,5 mg og klorokin.
Behandling av overdose består av fjerning av legemidlet ved brekninger (hvis bevisst), mageskylling, aktivt kull eller saltvannskatarsis. Nøye tilsyn og registrering av væskeinntak og -utgang er avgjørende. Hypotensjon bør behandles ved å plassere pasienten i Trendelenburg-stilling og administrere IV-væsker. Hvis tilfredsstillende lindring av hypotensjon ikke kan oppnås ved å bruke de ovennevnte tiltakene i full utstrekning, bør vasopressorer vurderes.
Det har vært isolerte rapporter om barn som ved et uhell har fått i seg Parlodel. Oppkast, somnolens og feber ble rapportert som bivirkninger. Pasientene kom seg enten spontant i løpet av noen få timer eller etter passende behandling.
KONTRAINDIKASJONER
Overfølsomhet overfor bromokriptin eller overfor noen av hjelpestoffene i Parlodel (bromokriptinmesylat), ukontrollert hypertensjon og følsomhet overfor eventuelle ergotalkaloider. Hos pasienter som behandles for hyperprolaktinemi, bør Parlodel 2,5 mg seponeres når graviditet er diagnostisert (se FORHOLDSREGLER , Hyperprolaktinemiske tilstander ). I tilfelle Parlodel 2,5 mg gjenopptas for å kontrollere et raskt ekspanderende makroadenom (se FORHOLDSREGLER , Hyperprolaktinemiske tilstander og en pasient opplever en hypertensiv svangerskapsforstyrrelse, må fordelen ved å fortsette med Parlodel veies opp mot den mulige risikoen ved bruk under en hypertensiv svangerskapsforstyrrelse. Når Parlodel brukes til å behandle akromegali, prolaktinom eller Parkinsons sykdom hos pasienter som senere blir gravide, bør det tas en avgjørelse om behandlingen fortsetter å være medisinsk nødvendig eller kan seponeres. Hvis det fortsettes, bør legemidlet seponeres hos de som kan oppleve hypertensive svangerskapsforstyrrelser (inkludert eklampsi, preeklampsi eller svangerskapsindusert hypertensjon) med mindre seponering av Parlodel anses å være medisinsk kontraindisert.
Legemidlet bør ikke brukes i postpartum perioden hos kvinner med en historie med koronarsykdom og andre alvorlige kardiovaskulære tilstander med mindre abstinens anses som medisinsk kontraindisert. Hvis stoffet brukes i postpartumperioden, bør pasienten observeres med forsiktighet.
KLINISK FARMAKOLOGI
Parlodel (bromokriptinmesylat) er en dopaminreseptoragonist, som aktiverer postsynaptiske dopaminreseptorer. De dopaminerge nevronene i den tuberoinfundibulære prosessen modulerer sekresjonen av prolaktin fra hypofysen ved å skille ut en prolaktinhemmende faktor (som antas å være dopamin); i corpus striatum er de dopaminerge nevronene involvert i kontrollen av motorisk funksjon. Klinisk reduserer Parlodel 2,5 mg plasmanivåer av prolaktin signifikant hos pasienter med fysiologisk forhøyet prolaktin, så vel som hos pasienter med hyperprolaktinemi. Hemming av fysiologisk amming samt galaktoré i patologiske hyperprolaktinemiske tilstander oppnås ved dosenivåer som ikke påvirker utskillelsen av andre tropiske hormoner fra hypofysen fremre. Eksperimenter har vist at bromokriptin induserer langvarig stereotyp oppførsel hos gnagere og snuoppførsel hos rotter med ensidige lesjoner i substantia nigra. Disse virkningene, karakteristiske for de som produseres av dopamin, hemmes av dopaminantagonister og antyder en direkte virkning av bromokriptin på striatale dopaminreseptorer.
Bromokriptinmesylat er et ikke-hormonelt, ikke-østrogent middel som hemmer sekresjonen av prolaktin hos mennesker, med liten eller ingen effekt på andre hypofysehormoner, bortsett fra hos pasienter med akromegali, hvor det senker forhøyede blodnivåer av veksthormon hos de fleste pasienter.
Bromokriptinmesylat produserer sin terapeutiske effekt i behandlingen av Parkinsons sykdom, en klinisk tilstand karakterisert ved en progressiv mangel på dopaminsyntese i substantia nigra, ved direkte å stimulere dopaminreseptorene i corpus striatum. I motsetning til dette, utøver levodopa sin terapeutiske effekt først etter konvertering til dopamin av nevronene til substantia nigra, som er kjent for å være numerisk redusert i denne pasientpopulasjonen.
Farmakokinetikk
Absorpsjon
Etter enkeltdoseadministrasjon av Parlodel 2,5 mg tabletter, 2 x 2,5 mg til 5 friske frivillige under fastende forhold, var gjennomsnittlig maksimal plasmanivå av bromokriptin, tid for å nå maksimal plasmakonsentrasjon og eliminasjonshalveringstid 465 pg/ml ± 226, 2,5 timer ± 2 og 4,85 timer, henholdsvis.1 Lineær sammenheng ble funnet mellom enkeltdoser av Parlodel 2,5 mg og Cmax og AUC i doseområdet 1 til 7,5 mg.2 Farmakokinetikken til bromokriptinmetabolitter er ikke rapportert.
Mat påvirket ikke den systemiske eksponeringen av bromokriptin signifikant etter administrering av Parlodel tabletter, 2,5 mg.3. Det anbefales at Parlodel 2,5 mg tas sammen med mat på grunn av den høye prosentandelen av forsøkspersoner som kaster opp når de får bromokriptin under fastende forhold.
Etter Parlodel 5 mg administrert to ganger daglig i 14 dager, var bromokriptinets Cmax og AUC ved steady-state henholdsvis 628 ± 375 pg/mL og 2377 ± 1186 pg*t/mL.4
Fordeling
In vitro-eksperimenter viste at bromokriptin var 90 % -96 % bundet til serumalbumin.
Metabolisme
Bromokriptin gjennomgår omfattende first-pass biotransformasjon, reflektert av komplekse metabolittprofiler og av nesten fullstendig fravær av moderlegemiddel i urin og avføring.
In vitro-studier med humane levermikrosomer viste at bromokriptin har høy affinitet for CYP3A og hydroksyleringer ved prolinringen av syklopeptiddelen utgjorde en hovedmetabolsk vei.5 Hemmere og/eller potente substrater for CYP3A4 kan derfor hemme clearance av bromokriptin og bly til økte nivåer. (se FORHOLDSREGLER , NARKOTIKAHANDEL seksjon). Deltakelsen av andre store CYP-enzymer som 2D6, 2C8 og 2C19 på metabolismen av bromokriptin har ikke blitt evaluert. Bromokriptin er også en hemmer av CYP3A4 med en beregnet IC50-verdi på 1,69 μM.6 Gitt de lave terapeutiske konsentrasjonene av bromokriptin hos pasienter (Cmax=0,82 nM), bør en signifikant endring av metabolismen til et andre legemiddel hvis clearance er mediert av CYP3A4 ikke vær forventet. Den potensielle effekten av bromokriptin og dets metabolitter for å virke som induktorer av CYP-enzymer er ikke rapportert.
Utskillelse
Omtrent 82 % og 5,6 % av den radioaktive dosen som ble gitt oralt ble gjenfunnet i henholdsvis avføring og urin. Bromolysergic acid og bromoisolysergic acid utgjorde halvparten av radioaktiviteten i urin.5
Spesifikke populasjoner
Effekt av nedsatt nyrefunksjon
Effekten av nyrefunksjon på farmakokinetikken til bromokriptin er ikke evaluert.
Siden det opprinnelige legemidlet og metabolitter nesten utskilles fullstendig via metabolisme, og bare 6 % elimineres via nyrene, kan det hende at nedsatt nyrefunksjon ikke har en signifikant innvirkning på farmakokinetikken til bromokriptin og dets metabolitter (se FORHOLDSREGLER , Generell ).
Effekt av nedsatt leverfunksjon
Effekten av nedsatt leverfunksjon på PK av Parlodel og dets metabolitter har ikke blitt evaluert. Siden Parlodel hovedsakelig elimineres ved metabolisme, kan nedsatt leverfunksjon øke plasmanivåene av bromokriptin, derfor kan det være nødvendig med forsiktighet (se FORHOLDSREGLER , Generell ).
Effekten av alder, rase og kjønn på farmakokinetikken til bromokriptin og dets metabolitter er ikke evaluert.
Kliniske studier
I omtrent 75 % av tilfellene av amenoré og galaktoré, undertrykker Parlodel 2,5 mg-behandling galaktoréen fullstendig eller nesten fullstendig, og gjenoppretter normale eggløsningsmenstruasjonssykluser.
Menstruasjonen gjenopptas vanligvis før fullstendig undertrykkelse av galaktoré; tiden for dette er i gjennomsnitt 6 til 8 uker. Noen pasienter reagerer imidlertid innen få dager, og andre kan ta opptil 8 måneder.
Galaktoré kan ta lengre tid å kontrollere avhengig av graden av stimulering av brystvevet før behandling. Minst 75 % reduksjon i sekresjon observeres vanligvis etter 8 til 12 uker. Noen pasienter kan ikke respondere selv etter 12 måneders behandling.
Hos mange akromegale pasienter gir Parlodel 2,5 mg en rask og vedvarende reduksjon i sirkulerende nivåer av serumveksthormon.
1 Nelson, M. et. al. (1990). Farmakokinetisk evaluering av erytromycin og koffein administrert med bromokriptin. Clin Pharmacol Ther; 47(6):694-7.
Schran, HF, Bhuta, SI, Schwartz, et al. (1980). Farmakokinetikken til bromokriptin hos mennesker. I: Golstein, M. Calne, DB, et. Al (red.). Ergotforbindelse og hjernefunksjon: Nevroendokrine og nevropsykiatriske aspekter, s. 125-139, New York, Rave Press.
3 Kopitar, Z., Vrhovac, B., Povsic, L., Plavsic, F., Francetic, I., Urbancic, J. (1991). Effekten av mat og metoklopramid på farmakokinetikken og bivirkninger av bromokriptin. Eur J Drug Metab Pharmacokinet; 16(3):177-81
4 Flogstad, AK, Halse, J., Grass, P., Abisch, E., Djoseland, O., Kutz, K., Bodd, E., and Jervell, J., (1994). En sammenligning av oktreotid, bromokriptin eller en kombinasjon av begge legemidlene ved akromegali. Journal of Clinical Endocrinology & Metabolism; bind 79, 461-465
5 Peyronneau MA, Delaforge M, Riviere R et al. 1994. Høy affinitet av ergopeptider for CYP P450 3A. Betydningen av peptiddelen deres for P450-gjenkjenning og hydroksylering av bromokriptin. Eur J Biochem 223:947-56.
Wynalda, MA, Wienkers, LC (1997). Vurdering av potensielle interaksjoner mellom dopaminreseptoragonister og forskjellige humane cytokrom P450-enzymer ved bruk av en enkel in vitro-hemmingsskjerm. Drug Metab Dispos; 25:1211-14.
PASIENTINFORMASJON
Under kliniske studier har svimmelhet, døsighet, besvimelse, besvimelse og synkope blitt rapportert tidlig i løpet av behandlingen med Parlodel 2,5 mg. I rapporter etter markedsføring har Parlodel blitt assosiert med somnolens og episoder med plutselig innsettende søvn, spesielt hos pasienter med Parkinsons sykdom. Plutselig innsettende søvn under daglige aktiviteter, i noen tilfeller uten bevissthet eller advarselstegn, har blitt rapportert svært sjelden. Alle pasienter som får Parlodel bør advares med hensyn til å delta i aktiviteter som krever raske og presise reaksjoner, som å kjøre bil eller betjene maskiner. Pasienter som behandles med Parlodel 2,5 mg og som har somnolens og/eller plutselige søvnepisoder, må rådes til ikke å kjøre bil eller delta i aktiviteter der nedsatt årvåkenhet kan sette seg selv eller andre i fare for alvorlig skade eller død (f.eks. betjene maskiner).
Pasienter som får Parlodel 2,5 mg for hyperprolaktinemiske tilstander assosiert med makroadenom eller de som har hatt tidligere transsfenoidal kirurgi, bør informeres om å rapportere vedvarende vannaktig neseutslipp til legen. Pasienter som får Parlodel 2,5 mg for behandling av et makroadenom bør informeres om at seponering av legemidlet kan være assosiert med rask gjenvekst av svulsten og tilbakefall av deres opprinnelige symptomer.
Pasienter og deres omsorgspersoner bør varsles om muligheten for at pasienter kan oppleve intense trang til å bruke penger ukontrollert, intens trang til å spille, økt seksuell trang og andre intense trang og manglende evne til å kontrollere disse trangene mens de tar Parlodel. Råd pasienter og deres omsorgspersoner til å informere helsepersonell dersom de utvikler nye eller økte ukontrollerte utgifter, spilletrang, seksuelle trang eller andre trang mens de behandles med Parlodel [se FORHOLDSREGLER ].
Spesielt i løpet av de første dagene av behandlingen, kan hypotensive reaksjoner av og til oppstå og resultere i redusert årvåkenhet, særlig forsiktighet bør utvises når du kjører bil eller bruker maskiner.
Råd pasienter til å kontakte helsepersonell dersom de ønsker å seponere Parlodel eller redusere dosen av Parlodel. Rådfør pasienter som har fått foreskrevet en lavere dose eller som har blitt trukket tilbake fra legemidlet om å varsle helsepersonell dersom de har abstinenssymptomer som feber, muskelstivhet, endret bevissthet, apati, angst, depresjon, tretthet, søvnløshet, svette eller smerte (se FORHOLDSREGLER ).
