Provera 5mg, 10mg Medroxyprogesterone Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Provera og hvordan brukes det?
Provera 10mg er en reseptbelagt medisin som brukes til å behandle symptomene kraftige menstruasjonsblødninger, fraværende eller uregelmessige menstruasjonsblødninger og som prevensjon. Provera 10mg kan brukes alene eller sammen med andre medisiner.
Provera 5mg tilhører en klasse legemidler som heter antineoplastiske midler, hormoner, gestagener.
Det er ikke kjent om Provera er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Provera 10mg?
Provera 5mg kan forårsake alvorlige bivirkninger, inkludert:
- . vaginal blødning (hvis du allerede har gått gjennom overgangsalderen), . svimmelhet, . brystklump, . depresjon, . søvnproblemer (søvnløshet), . svimmelhet, . humørsvingninger, . hodepine, . feber, . gulfarging av hud eller øyne (gulsott), . hevelse i hender, ankler eller føtter, . brystsmerter eller trykk, . smerte som sprer seg til kjeven eller skulderen, . kvalme, . svette, . plutselig nummenhet eller svakhet, . plutselig kraftig hodepine, . utydelig tale, . synsproblemer, . problemer med balansen din, . plutselig hoste, . hvesing, . rask pust, . hoste opp blod, og . smerter i beinet (eller begge deler) med hevelse, varme og rødhet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Provera 10mg inkluderer:
- . flekker eller gjennombruddsblødninger, . endringer i menstruasjonsperioder, . vaginal kløe eller utflod, . ømhet eller utflod i brystene, . hodepine, . svimmelhet, . føler seg nervøs eller deprimert, . blåmerker eller hevelse i venene dine, . oppblåsthet, . væskeretensjon, . humørsvingninger, . søvnproblemer (søvnløshet), . kløe, . utslett, . kviser, . hårvekst, . tap av hodehår, . ubehag i magen, . oppblåsthet, . kvalme, . vektøkning, og . synsforandringer eller problemer med å bruke kontaktlinser
ADVARSEL
Hjerte- og karlidelser, BRYSTKREFT OG MULIG DEMENS FOR ØTROGEN PLUSS PROGESTINTERAPI
Kardiovaskulære lidelser og sannsynlig demens
Behandling med østrogen pluss gestagen bør ikke brukes til forebygging av kardiovaskulær sykdom eller demens. (Se Kliniske studier og ADVARSLER , Kardiovaskulære lidelser og sannsynlig demens .)
Women's Health Initiative (WHI) østrogen pluss gestagen understudie rapporterte en økt risiko for dyp venetrombose (DVT), lungeemboli (PE), slag og hjerteinfarkt (MI) hos postmenopausale kvinner (50 til 79 år) ) i løpet av 5,6 års behandling med daglige orale konjugerte østrogener (CE) [0,625 mg] kombinert med medroksyprogesteronacetat (MPA) [2,5 mg], i forhold til placebo. (Se Kliniske studier og ADVARSLER , Kardiovaskulære lidelser .)
WHI Memory Study (WHIMS) østrogen pluss progestin hjelpestudie rapporterte en økt risiko for å utvikle sannsynlig demens hos postmenopausale kvinner 65 år eller eldre i løpet av 4 års behandling med daglig CE (0,625 mg) kombinert med MPA (2,5 mg), relativt sett. til placebo. Det er ukjent om dette funnet gjelder yngre postmenopausale kvinner. (Se Kliniske studier og ADVARSLER , Sannsynlig demens og FORHOLDSREGLER , Geriatrisk bruk .)
Brystkreft
WHI østrogen pluss progestin-substudien viste økt risiko for invasiv brystkreft. (Se Kliniske studier og ADVARSLER , Ondartet neoplasma , Brystkreft .)
I mangel av sammenlignbare data, bør disse risikoene antas å være lik for andre doser av CE og MPA, og andre kombinasjoner og doseringsformer av østrogener og progestiner.
Progestiner med østrogener bør foreskrives med de laveste effektive dosene og for den korteste varigheten i samsvar med behandlingsmål og risiko for den enkelte kvinne.
BESKRIVELSE
PROVERA®-tabletter inneholder medroksyprogesteronacetat, som er et derivat av progesteron. Det er et hvitt til off-white, luktfritt krystallinsk pulver, stabilt i luft, smelter mellom 200 og 210°C. Det er fritt løselig i kloroform, løselig i aceton og i dioksan, lite løselig i alkohol og i metanol, lett løselig i eter og uløselig i vann.
Det kjemiske navnet på medroksyprogesteronacetat er pregn-4-en-3, 20-dion, 17-(acetyloksy)-6-metyl-, (6α)-. Strukturformelen er:
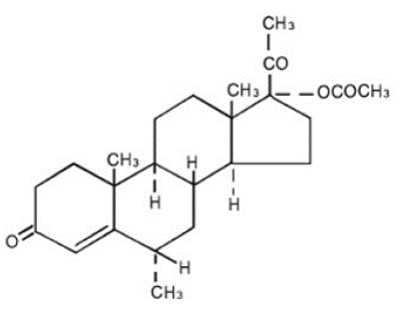
Hver PROVERA 5 mg tablett for oral administrering inneholder 2,5 mg, 5 mg eller 10 mg medroksyprogesteronacetat og følgende inaktive ingredienser: kalsiumstearat, maisstivelse, laktose, mineralolje, sorbinsyre, sukrose og talkum. 2,5 mg tabletten inneholder FD&C Yellow No. 6.
INDIKASJONER
PROVERA 5mg tabletter er indisert for behandling av sekundær amenoré og unormal livmorblødning på grunn av hormonell ubalanse i fravær av organisk patologi, som fibromer eller livmorkreft. De er også indisert for bruk i forebygging av endometriehyperplasi hos ikke-hysterektomiserte postmenopausale kvinner som får daglige orale konjugerte østrogener 0,625 mg tabletter.
DOSERING OG ADMINISTRASJON
Sekundær amenoré
PROVERA 10 mg tabletter kan gis i doser på 5 eller 10 mg daglig i 5 til 10 dager. En dose for å indusere en optimal sekretorisk transformasjon av et endometrium som har blitt tilstrekkelig primet med enten endogent eller eksogent østrogen er 10 mg PROVERA 10 mg daglig i 10 dager. I tilfeller av sekundær amenoré kan behandlingen startes når som helst. Blødning med gestagen seponering oppstår vanligvis innen tre til syv dager etter seponering av PROVERA 10 mg-behandling.
Unormal livmorblødning på grunn av hormonell ubalanse i fravær av organisk patologi
Fra og med den beregnede 16. eller 21. dagen i menstruasjonssyklusen, kan 5 eller 10 mg PROVERA 10 mg gis daglig i 5 til 10 dager. For å produsere en optimal sekretorisk transformasjon av et endometrium som er tilstrekkelig primet med enten endogent eller eksogent østrogen, foreslås 10 mg PROVERA 10 mg daglig i 10 dager med start på den 16. dagen av syklusen. Blødning med gestagen seponering oppstår vanligvis innen tre til syv dager etter avsluttet behandling med PROVERA. Pasienter med en tidligere historie med tilbakevendende episoder med unormal livmorblødning kan ha nytte av planlagt menstruasjonssyklus med PROVERA.
Reduksjon av endometriehyperplasi hos postmenopausale kvinner som daglig får 0,625 mg konjugerte østrogener
Når østrogen foreskrives til en postmenopausal kvinne med livmor, bør en progestin også settes i gang for å redusere risikoen for endometriekreft. En kvinne uten livmor trenger ikke gestagen. Bruk av østrogen, alene eller i kombinasjon med et gestagen, bør være med den laveste effektive dosen og for den korteste varigheten i samsvar med behandlingsmål og risiko for den enkelte kvinne. Pasienter bør revurderes med jevne mellomrom som klinisk hensiktsmessig (for eksempel 3 til 6 måneders intervaller) for å avgjøre om behandling fortsatt er nødvendig (se ADVARSLER ). For kvinner som har en livmor, bør adekvate diagnostiske tiltak, som endometrieprøvetaking, når indisert, utføres for å utelukke malignitet i tilfeller av udiagnostisert vedvarende eller tilbakevendende unormal vaginal blødning.
PROVERA tabletter kan gis i doser på 5 eller 10 mg daglig i 12 til 14 påfølgende dager per måned, til postmenopausale kvinner som får daglig 0,625 mg konjugerte østrogener, enten med start på den første dag av syklusen eller den 16. dag i syklusen.
Pasienter bør startes med laveste dose.
Den laveste effektive dosen av PROVERA er ikke bestemt.
HVORDAN LEVERES
PROVERA 10mg tabletter er tilgjengelig i følgende styrker og pakkestørrelser:
2,5 mg (scoret, rund, oransje)
30 flasker NDC 0009-0064-06 Flasker med 100 stk NDC 0009-0064-04
5 mg (skåren, sekskantet, hvit)
100 flasker NDC 0009-0286-03
10 mg (scoret, rund, hvit)
100 flasker NDC 0009-0050-02 Flasker med 500 stk NDC 0009-0050-11
Oppbevares ved kontrollert romtemperatur 20° til 25°C (68° til 77°F) [se USP ].
"Oppbevares utilgjengelig for barn"
Distribuert av: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Revidert: august 2015
BIVIRKNINGER
Se ADVARSLER I ESKE , ADVARSLER , og FORHOLDSREGLER .
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Følgende bivirkninger er rapportert hos kvinner som tar PROVERA 10 mg tabletter uten samtidig østrogenbehandling:
Genitourinært system
Unormal uterinblødning (uregelmessig, økning, reduksjon), endring i menstruasjonsstrøm, gjennombruddsblødning, spotting, amenoré, endringer i cervikal erosjon og cervical sekret.
Bryster
Ømhet i brystene, mastodyni eller galaktoré er rapportert.
Kardiovaskulær
Tromboemboliske lidelser inkludert tromboflebitt og lungeemboli er rapportert.
Gastrointestinale
Kvalme, kolestatisk gulsott.
Hud
Sensitivitetsreaksjoner bestående av urticaria, pruritus, ødem og generalisert utslett har forekommet. Akne, sensitivitetsreaksjoner bestående av urticaria, pruritus, ødem og generalisert utslett har forekommet. Akne, alopecia og hirsutisme er rapportert.
Øyne
Nevro-okulære lesjoner, for eksempel retinal trombose og optisk neuritt.
Sentralnervesystemet
Psykisk depresjon, søvnløshet, somnolens, svimmelhet, hodepine, nervøsitet.
Diverse
Overfølsomhetsreaksjoner (for eksempel anafylaksi og anafylaktoide reaksjoner, angioødem), utslett (allergisk) med og uten kløe, endring i vekt (økning eller reduksjon), pyreksi, ødem/væskeretensjon, tretthet, redusert glukosetoleranse.
Følgende bivirkninger er rapportert ved behandling med østrogen pluss gestagen.
Genitourinært system
Unormal livmorblødning/flekking eller flyt; gjennombruddsblødning; spotting; dysmenoré/bekkensmerter; økning i størrelsen på livmor leiomyomata; vaginitt, inkludert vaginal candidiasis; endring i mengde livmorhalssekresjon; endringer i cervical ectropion; eggstokkreft; endometrial hyperplasi; livmorkreft.
Bryster
Ømhet, forstørrelse, smerte, utflod fra brystvortene, galaktoré; fibrocystiske brystforandringer; brystkreft.
Kardiovaskulær
Dyp og overfladisk venøs trombose; lungeemboli; tromboflebitt; hjerteinfarkt; slag; økning i blodtrykket.
Gastrointestinale
Kvalme oppkast; magekramper, oppblåsthet; kolestatisk gulsott; økt forekomst av galleblæresykdom; pankreatitt; utvidelse av hepatiske hemangiomer.
Hud
Kloasma eller melasma som kan vedvare når stoffet seponeres; erythema multiforme; erythema nodosum; hemorragisk utbrudd; tap av hodehår; hirsutisme; kløe, utslett.
Øyne
Retinal vaskulær trombose, intoleranse mot kontaktlinser.
Sentralnervesystemet
Hodepine; migrene; svimmelhet; mental depresjon; chorea; nervøsitet; humørforstyrrelser; irritabilitet; forverring av epilepsi, demens.
Diverse
Økning eller reduksjon i vekt; redusert karbohydrattoleranse; forverring av porfyri; ødem; arthalgier; kramper i benet; endringer i libido; urticaria, angioødem, anafylaktoide/anafylaktiske reaksjoner; hypokalsemi; forverring av astma; økte triglyserider.
NARKOTIKAHANDEL
Interaksjoner med legemiddel-laboratorietest
Følgende laboratorieresultater kan endres ved bruk av østrogen pluss gestagenbehandling:
. Akselerert protrombintid, delvis tromboplastintid og blodplateaggregeringstid; økt antall blodplater; økt faktor II, VII antigen, VIII antigen, VIII koagulant aktivitet, IX, X, XII, VIIX kompleks, II-VII-X kompleks og beta-tromboglobulin; reduserte nivåer av anti-faktor Xa og antitrombin III, redusert antitrombin III-aktivitet; økte nivåer av fibrinogen og fibrinogenaktivitet; økt plasminogenantigen og aktivitet. . Økte nivåer av skjoldbruskkjertelbindende globulin (TBG) som fører til økte sirkulerende totale tyreoideahormonnivåer målt ved proteinbundet jod (PBI), T4-nivåer (ved kolonne eller ved radioimmunoassay) eller T3-nivåer ved radioimmunoassay, T3-harpiksopptak er redusert, noe som gjenspeiler den forhøyede TBG. Konsentrasjonene av fritt T4 og fritt T3 er uendret. Kvinner på skjoldbruskkjertelerstatningsterapi kan kreve høyere doser av skjoldbruskkjertelhormon. . Andre bindende proteiner kan være forhøyet i serum, for eksempel kortikosteroidbindende globulin (CBG), kjønnshormonbindende globulin (SHBG) som fører til henholdsvis økt sirkulerende kortikosteroid og kjønnssteroider. Frie hormonkonsentrasjoner, som testosteron og østradiol, kan reduseres. Andre plasmaproteiner kan øke (angiotensinogen/reninsubstrat, alfa-1-antitrypsin, ceruloplasmin). . Økt plasma høydensitet lipoprotein (HDL) og HDL2 kolesterol subfraksjon konsentrasjoner, redusert lav tetthet lipoprotein (LDL) kolesterol konsentrasjon, økte triglyserider nivåer. . Nedsatt glukosetoleranse.ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
Se ADVARSLER I ESKE .
Kardiovaskulære lidelser
Økt risiko for PE, DVT, hjerneslag og MI er rapportert ved behandling med østrogen pluss gestagen. Skulle noen av disse hendelsene oppstå eller mistenkes, bør østrogen pluss gestagenbehandling avbrytes umiddelbart.
Risikofaktorer for arteriell vaskulær sykdom (for eksempel hypertensjon, diabetes mellitus, tobakksbruk, hyperkolesterolemi og fedme) og/eller venøs tromboemboli (VTE) (for eksempel personlig historie eller familiehistorie med VTE, fedme og systemisk lupus erythematosus) bør forvaltes på riktig måte.
Slag
WHI østrogen pluss progestin-substudien ble det rapportert en statistisk signifikant økt risiko for hjerneslag hos kvinner i alderen 50 til 79 år som fikk CE (0,625 mg) pluss MPA (2,5 mg) sammenlignet med kvinner i samme aldersgruppe som fikk placebo (33 versus 25 per 10 000 kvinneår). (Se Kliniske studier .) Økningen i risiko ble påvist etter det første året og vedvarte. Skulle et slag oppstå eller mistenkes, bør østrogen pluss gestagenbehandling avbrytes umiddelbart.
Koronar hjertesykdom
I WHI østrogen pluss progestin-substudien var det en statistisk ikke-signifikant økt risiko for CHD-hendelser rapportert hos kvinner som fikk daglig CE (0,625 mg) pluss MPA (2,5 mg) sammenlignet med kvinner som fikk placebo (41 versus 34 per 10 000 kvinneår) ). En økning i relativ risiko ble påvist i år 1, og en trend mot synkende relativ risiko ble rapportert i år 2 til 5.
Hos postmenopausale kvinner med dokumentert hjertesykdom (n = 2 763, gjennomsnittlig 66,7 år), i en kontrollert klinisk studie av sekundær forebygging av kardiovaskulær sykdom (Heart and Estrogen/Progestin Replacement Study [HERS]), behandling med daglig CE (0,625 mg) ) pluss MPA (2,5 mg) viste ingen kardiovaskulær fordel. I løpet av en gjennomsnittlig oppfølging på 4,1 år, reduserte ikke behandling med CE pluss MPA den totale frekvensen av CHD-hendelser hos postmenopausale kvinner med etablert koronar hjertesykdom. Det var flere CHD-hendelser i CE pluss MPA-behandlet gruppe enn i placebogruppen i år 1, men ikke i løpet av de påfølgende årene. To tusen tre hundre og tjueen (2 321) kvinner fra den opprinnelige HERS-prøven gikk med på å delta i en åpen utvidelse av HERS, HERS II. Gjennomsnittlig oppfølging i HERS II var ytterligere 2,7 år, totalt 6,8 år. Hyppighetene av CHD-hendelser var sammenlignbare blant kvinner i CE pluss MPA-gruppen og placebogruppen i HERS, HERS II og generelt.
Venøs tromboembolisme
WHI østrogen pluss progestin-substudien ble det rapportert en statistisk signifikant 2 ganger høyere rate av VTE (DVT og PE) hos kvinner som fikk daglig CE (0,625 mg) pluss MPA (2,5 mg) sammenlignet med kvinner som fikk placebo (35 versus 17 pr. 10 000 kvinneår). Statistisk signifikant økning i risiko for både DVT (26 versus 13 per 10 000 kvinneår) og PE (18 versus 8 per 10 000 kvinneår) ble også påvist. Økningen i VTE-risiko ble påvist i løpet av det første året og vedvarte. (Se Kliniske studier .) Skulle en VTE oppstå eller mistenkes, bør østrogen pluss gestagenbehandling avbrytes umiddelbart.
Hvis det er mulig, bør østrogener pluss progestiner seponeres minst 4 til 6 uker før operasjon av typen som er forbundet med økt risiko for tromboemboli, eller i perioder med langvarig immobilisering.
Ondartede neoplasmer
Brystkreft
Den viktigste randomiserte kliniske studien som gir informasjon om brystkreft hos brukere av østrogen pluss gestagen er WHI-understudien av daglig CE (0,625 mg) pluss MPA (2,5 mg). Etter en gjennomsnittlig oppfølging på 5,6 år rapporterte østrogen pluss progestin-substudien økt risiko for invasiv brystkreft hos kvinner som tok daglig CE pluss MPA.
denne delstudien ble tidligere bruk av østrogen-alene eller østrogen pluss gestagenbehandling rapportert av 26 prosent av kvinnene. Den relative risikoen for invasiv brystkreft var 1,24, og den absolutte risikoen var 41 versus 33 tilfeller per 10 000 kvinneår, for CE pluss MPA sammenlignet med placebo. Blant kvinner som rapporterte tidligere bruk av hormonbehandling, var den relative risikoen for invasiv brystkreft 1,86, og den absolutte risikoen var 46 versus 25 tilfeller per 10 000 kvinneår, for CE pluss MPA sammenlignet med placebo. Blant kvinner som ikke rapporterte tidligere bruk av hormonbehandling, var den relative risikoen for invasiv brystkreft 1,09, og den absolutte risikoen var 40 versus 36 tilfeller per 10 000 kvinneår, for CE pluss MPA sammenlignet med placebo. I den samme delstudien var invasiv brystkreft større, var mer sannsynlig å være nodepositiv og ble diagnostisert på et mer avansert stadium i CE (0,625 mg) pluss MPA (2,5 mg) gruppen sammenlignet med placebogruppen. Metastatisk sykdom var sjelden uten noen åpenbar forskjell mellom de to gruppene. Andre prognostiske faktorer som histologisk subtype, grad og hormonreseptorstatus skilte seg ikke mellom gruppene. (Se Kliniske studier .)
samsvar med den kliniske studien WHI har observasjonsstudier også rapportert økt risiko for brystkreft for østrogen pluss gestagenbehandling, og en mindre risiko for østrogen-alene behandling, etter flere års bruk. Risikoen økte med varigheten av bruken, og så ut til å gå tilbake til baseline i løpet av ca. 5 år etter avsluttet behandling (bare observasjonsstudiene har betydelige data om risiko etter seponering). Observasjonsstudier tyder også på at risikoen for brystkreft var større, og ble tydelig tidligere, med østrogen pluss gestagenbehandling sammenlignet med østrogen-alene behandling. Imidlertid har disse studiene ikke funnet signifikant variasjon i risikoen for brystkreft mellom forskjellige østrogen pluss gestagen kombinasjoner, eller administreringsveier.
Bruk av østrogen pluss gestagen har blitt rapportert å resultere i en økning i unormale mammografier som krever ytterligere evaluering. Alle kvinner bør få årlige brystundersøkelser av helsepersonell og utføre månedlige bryst selvundersøkelser. I tillegg bør mammografiundersøkelser planlegges basert på pasientens alder, risikofaktorer og tidligere mammografiresultater.
Livmorkreft
En økt risiko for endometriekreft er rapportert ved bruk av uimotsagt østrogenbehandling hos kvinner med livmor. Den rapporterte endometriekreftrisikoen blant østrogenbrukere uten motstand er omtrent 2 til 12 ganger større enn hos ikke-brukere, og ser ut til å være avhengig av behandlingens varighet og østrogendosen. De fleste studier viser ingen signifikant økt risiko forbundet med bruk av østrogener i mindre enn 1 år. Den største risikoen er forbundet med langvarig bruk, med økt risiko på 15 til 24 ganger i 5 til 10 år eller mer. Denne risikoen har vist seg å vedvare i minst 8 til 15 år etter at østrogenbehandlingen er avsluttet.
Klinisk overvåking av alle kvinner som bruker østrogen pluss gestagenbehandling er viktig. Adekvate diagnostiske tiltak, inkludert endometrieprøvetaking når indisert, bør iverksettes for å utelukke malignitet i alle tilfeller av udiagnostisert vedvarende eller tilbakevendende unormal genital blødning. Det er ingen bevis for at bruk av naturlige østrogener resulterer i en annen endometrial risikoprofil enn syntetiske østrogener med tilsvarende østrogendose. Å legge til et gestagen til østrogenbehandling har vist seg å redusere risikoen for endometriehyperplasi, som kan være en forløper til endometriekreft.
Eggstokkreft
WHI østrogen pluss progestin-substudie rapporterte en statistisk ikke-signifikant økt risiko for eggstokkreft. Etter en gjennomsnittlig oppfølging på 5,6 år var den relative risikoen for eggstokkreft for CE pluss MPA versus placebo 1,58 (95 prosent KI, 0,77–3,24). Den absolutte risikoen for CE pluss MPA var 4 versus 3 tilfeller per 10 000 kvinneår. I noen epidemiologiske studier har bruk av østrogen pluss gestagen og kun østrogenprodukter, spesielt i 5 eller flere år, vært assosiert med økt risiko for eggstokkreft. Varigheten av eksponering assosiert med økt risiko er imidlertid ikke konsistent på tvers av alle epidemiologiske studier, og noen rapporterer ingen sammenheng.
Sannsynlig demens
WHIMS estrogen pluss progestin hjelpestudie av WHI, ble en populasjon på 4532 postmenopausale kvinner i alderen 65 til 79 år randomisert til daglig CE (0,625 mg) pluss MPA (2,5 mg) eller placebo. Etter en gjennomsnittlig oppfølging på 4 år ble 40 kvinner i CE pluss MPA-gruppen og 21 kvinner i placebogruppen diagnostisert med sannsynlig demens. Den relative risikoen for sannsynlig demens for CE pluss MPA versus placebo var 2,05 (95 prosent KI, 1,21–3,48). Den absolutte risikoen for sannsynlig demens for CE pluss MPA versus placebo var 45 versus 22 tilfeller per 10 000 kvinneår. Det er ukjent om disse funnene gjelder for yngre postmenopausale kvinner. (Se Kliniske studier og FORHOLDSREGLER , Geriatrisk bruk .)
Visuelle abnormiteter
Avbryt østrogen pluss gestagenbehandling i påvente av undersøkelse hvis det er plutselig delvis eller fullstendig synstap, eller en plutselig innsettende proptose, diplopi eller migrene. Hvis undersøkelse avslører papilleødem eller retinale vaskulære lesjoner, bør behandling med østrogen pluss gestagen seponeres permanent.
FORHOLDSREGLER
Generell
Tillegg av et gestagen når en kvinne ikke har hatt en hysterektomi
Studier av tilsetning av et progestin i 10 eller flere dager av en syklus med østrogenadministrasjon, eller daglig med østrogen i et kontinuerlig regime, har rapportert en redusert forekomst av endometriehyperplasi enn det som ville bli indusert av østrogenbehandling alene. Endometriehyperplasi kan være en forløper til endometriekreft.
Det er imidlertid mulige risikoer som kan være forbundet med bruk av progestiner med østrogener sammenlignet med østrogen-alene regimer. Disse inkluderer økt risiko for brystkreft.
Uventet unormal vaginal blødning
I tilfeller av uventet unormal vaginal blødning, er adekvate diagnostiske tiltak indisert.

Forhøyet blodtrykk
Blodtrykket bør overvåkes med jevne mellomrom med østrogen pluss gestagenbehandling.
Hypertriglyseridemi
Hos kvinner med allerede eksisterende hypertriglyseridemi, kan østrogen pluss gestagenbehandling være assosiert med forhøyede plasmatriglyserider som fører til pankreatitt. Vurder å seponere behandlingen hvis pankreatitt oppstår.
Nedsatt leverfunksjon og/eller tidligere historie med kolestatisk gulsott
Østrogener pluss gestagen kan være dårlig metabolisert hos kvinner med nedsatt leverfunksjon. For kvinner med en historie med kolestatisk gulsott assosiert med tidligere østrogenbruk eller med graviditet, bør det utvises forsiktighet, og i tilfelle av tilbakefall bør medisinering seponeres.
Væskeretensjon
Progestiner kan forårsake en viss grad av væskeretensjon. Kvinner som har tilstander som kan påvirkes av denne faktoren, som hjerte- eller nyresvikt, krever nøye observasjon når østrogen pluss gestagen foreskrives.
Hypokalsemi
Behandling med østrogen pluss gestagen bør brukes med forsiktighet hos kvinner med hypoparatyreoidisme, da østrogenindusert hypokalsemi kan forekomme.
Forverring av andre tilstander
Behandling med østrogen pluss gestagen kan forårsake en forverring av astma, diabetes mellitus, epilepsi, migrene, porfyri, systemisk lupus erythematosus og hepatiske hemangiomer og bør brukes med forsiktighet hos kvinner med disse tilstandene.
Pasientinformasjon
Leger anbefales å diskutere PASIENTINFORMASJON brosjyre med kvinner som de foreskriver PROVERA til.
Det kan være økt risiko for mindre fødselsskader hos barn hvis mødre er eksponert for gestagen i første trimester av svangerskapet. Den mulige risikoen for den mannlige babyen er hypospadi, en tilstand der åpningen av penis er på undersiden i stedet for på tuppen av penis. Denne tilstanden forekommer naturlig i omtrent 5 til 8 per 1000 mannlige fødsler. Risikoen kan øke ved eksponering for PROVERA. Forstørrelse av klitoris og fusjon av kjønnsleppene kan forekomme hos kvinnelige babyer. En klar sammenheng mellom hypospadi, klitorisforstørrelse og labial fusjon ved bruk av PROVERA er imidlertid ikke fastslått.
Informer pasienten om viktigheten av å rapportere eksponering for PROVERA 5mg tidlig i svangerskapet.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Kreftfremkallende egenskaper
Langtids intramuskulær administrering av medroksyprogesteronacetat har vist seg å gi brystsvulster hos beaglehunder. Det var ingen bevis for en karsinogen effekt assosiert med oral administrering av medroksyprogesteronacetat til rotter og mus.
Langvarig kontinuerlig administrering av østrogen pluss gestagenbehandling har vist økt risiko for brystkreft og eggstokkreft. (Se ADVARSLER og FORHOLDSREGLER .)
Genotoksisitet
Medroksyprogesteronacetat var ikke mutagent i en rekke in vitro eller in vivo genetiske toksisitetsanalyser.
Fertilitet
Medroksyprogesteronacetat i høye doser er et antifertilitetsmedisin og høye doser vil forventes å svekke fertiliteten inntil behandlingen avsluttes.
Svangerskap
Graviditetskategori X
PROVERA skal ikke brukes under graviditet. (Se KONTRAINDIKASJONER .)
Det kan være økt risiko for hypospadi, klitorisforstørrelse og labial fusjon hos barn hvis mødre er eksponert for PROVERA 10 mg i løpet av første trimester av svangerskapet. En klar sammenheng mellom disse tilstandene med bruk av PROVERA er imidlertid ikke etablert.
Ammende mødre
PROVERA skal ikke brukes under amming. Detekterbare mengder gestagen er identifisert i morsmelk til ammende mødre som får gestagen.
Pediatrisk bruk
PROVERA 10 mg tabletter er ikke indisert til barn. Kliniske studier er ikke utført i den pediatriske populasjonen.
Geriatrisk bruk
Det har ikke vært tilstrekkelig antall geriatriske kvinner involvert i kliniske studier med PROVERA alene til å avgjøre om de over 65 år skiller seg fra yngre forsøkspersoner når det gjelder respons på PROVERA alene.
The Women's Health Initiative Studies
I WHI østrogen pluss progestin-substudien (daglig CE [0,625 mg] pluss MPA [2,5 mg] versus placebo), var det en høyere relativ risiko for ikke-dødelig hjerneslag og invasiv brystkreft hos kvinner over 65 år. (Se Kliniske studier .)
The Women's Health Initiative Memory Study
I WHIMS tilleggsstudier av postmenopausale kvinner i alderen 65 til 79 år, var det en økt risiko for å utvikle sannsynlig demens hos kvinner som fikk østrogen alene eller østrogen pluss gestagen sammenlignet med placebo. (Se ADVARSLER , Sannsynlig demens .)
Siden begge tilleggsstudiene ble utført på kvinner i alderen 65 til 79 år, er det ukjent om disse funnene gjelder for yngre postmenopausale kvinner. (Se ADVARSLER , Sannsynlig demens .)
OVERDOSE
Overdosering av østrogen pluss gestagenbehandling kan forårsake kvalme og oppkast, ømhet i brystene, svimmelhet, magesmerter, døsighet/tretthet og abstinensblødninger kan forekomme hos kvinner. Behandling av overdose består av seponering av CE pluss MPA sammen med institusjon av passende symptomatisk behandling.
KONTRAINDIKASJONER
PROVERA 10mg er kontraindisert hos kvinner med noen av følgende tilstander:
. Udiagnostisert unormal genital blødning. . Kjent, mistenkt eller historie med brystkreft. . Kjent eller mistenkt østrogen- eller progesteronavhengig neoplasi. . Aktiv DVT, PE eller en historie med disse tilstandene . Aktiv arteriell tromboembolisk sykdom (for eksempel slag og MI), eller en historie med disse tilstandene. . Kjent anafylaktisk reaksjon eller angioødem på PROVERA. . Kjent leversvikt eller sykdom. . Kjent eller mistenkt graviditet.KLINISK FARMAKOLOGI
Medroksyprogesteronacetat (MPA) administrert oralt eller parenteralt i anbefalte doser til kvinner med tilstrekkelig endogent østrogen, transformerer proliferativt til sekretorisk endometrium. Androgene og anabole effekter har blitt notert, men stoffet er tilsynelatende blottet for betydelig østrogen aktivitet. Mens parenteralt administrert MPA hemmer gonadotropinproduksjonen, som igjen forhindrer follikulær modning og eggløsning, indikerer tilgjengelige data at dette ikke skjer når den vanligvis anbefalte orale dosen gis som enkeltdoser daglig.
Farmakokinetikk
Farmakokinetikken til MPA ble bestemt hos 20 postmenopausale kvinner etter en enkeltdoseadministrasjon av åtte PROVERA 2,5 mg tabletter eller en enkelt administrering av to PROVERA 10 mg tabletter under fastende forhold. I en annen studie ble steady-state farmakokinetikken til MPA bestemt under fastende forhold hos 30 postmenopausale kvinner etter daglig administrering av én PROVERA 10 mg tablett i 7 dager. I begge studiene ble MPA kvantifisert i serum ved bruk av en validert gasskromatografi-massespektrometri (GC-MS) metode. Estimater av de farmakokinetiske parametrene til MPA etter enkelt- og multiple doser av PROVERA-tabletter var svært varierende og er oppsummert i tabell 1.
Absorpsjon
Ingen spesifikk undersøkelse av den absolutte biotilgjengeligheten av MPA hos mennesker er utført. MPA absorberes raskt fra mage-tarmkanalen, og maksimale MPA-konsentrasjoner oppnås mellom 2 til 4 timer etter oral administrering.
Administrering av PROVERA med mat øker biotilgjengeligheten av MPA. En dose på 10 mg PROVERA 10 mg, tatt rett før eller etter et måltid, økte MPA Cmax (50 til 70 %) og AUC (18 til 33 %). Halveringstiden til MPA ble ikke endret med mat.
Fordeling
MPA er omtrent 90 % proteinbundet, primært til albumin; ingen MPA-binding oppstår med kjønnshormonbindende globulin.
Metabolisme
Etter oral dosering metaboliseres MPA omfattende i leveren via hydroksylering, med påfølgende konjugering og eliminering i urinen.
Utskillelse
De fleste MPA-metabolitter skilles ut i urinen som glukuronidkonjugater med bare mindre mengder utskilt som sulfater.
Spesifikke populasjoner
Leverinsuffisiens
MPA elimineres nesten utelukkende via levermetabolisme. Hos 14 pasienter med avansert leversykdom var MPA-disponeringen signifikant endret (redusert eliminasjon). Hos pasienter med fettlever var gjennomsnittlig prosentdose utskilt i 24-timers urinen som intakt MPA etter en dose på 10 mg eller 100 mg henholdsvis 7,3 % og 6,4 %.
Nyreinsuffisiens
Effekten av nedsatt nyrefunksjon på farmakokinetikken til PROVERA 5mg er ikke studert.
Narkotikahandel
Medroksyprogesteronacetat (MPA) metaboliseres in vitro primært ved hydroksylering via CYP3A4. Spesifikke legemiddelinteraksjonsstudier som evaluerer de kliniske effektene med CYP3A4-induktorer eller -hemmere på MPA er ikke utført. Induktorer og/eller hemmere av CYP3A4 kan påvirke metabolismen av MPA.
Kliniske studier
Effekter på endometrium
I en 3-årig, dobbeltblind, placebokontrollert studie av 356 ikke-hysterektomiserte, postmenopausale kvinner mellom 45 og 64 år randomisert til å motta placebo (n=119), kun 0,625 mg konjugert østrogen (n=119), eller 0,625 mg konjugert østrogen pluss syklisk PROVERA (n=118), resultatene viste en redusert risiko for endometriehyperplasi i behandlingsgruppen som fikk 10 mg PROVERA 5 mg pluss 0,625 mg konjugerte østrogener sammenlignet med gruppen som kun fikk 0,625 mg konjugerte østrogener. Se tabell 2.
en andre 1-års studie ble 832 postmenopausale kvinner mellom 45 og 65 år behandlet med daglig 0,625 mg konjugert østrogen (dag 1–28), pluss enten 5 mg syklisk PROVERA eller 10 mg syklisk PROVERA (dag 15–28), eller daglig kun 0,625 mg konjugert østrogen. Behandlingsgruppene som mottok 5 eller 10 mg syklisk PROVERA (dager 15–28) pluss daglige konjugerte østrogener, viste en signifikant lavere forekomst av hyperplasi sammenlignet med gruppen med kun konjugerte østrogener. Se tabell 3.
Women's Health Initiative Studies
WHI registrerte omtrent 27 000 overveiende friske postmenopausale kvinner i to delstudier for å vurdere risikoen og fordelene ved daglig oral CE (0,625 mg) alene eller i kombinasjon med MPA (2,5 mg) sammenlignet med placebo i forebygging av visse kroniske sykdommer. Det primære endepunktet var forekomsten av koronar hjertesykdom (definert som ikke-dødelig hjerteinfarkt, stille hjerteinfarkt og død), med invasiv brystkreft som det primære uønskede utfallet. En "global indeks" inkluderte den tidligste forekomsten av CHD, invasiv brystkreft, hjerneslag, PE, endometriekreft (bare i CE pluss MPA-substudien), kolorektal kreft, hoftebrudd eller død på grunn av annen årsak. Disse delstudiene evaluerte ikke effekten av CE-alene eller CE pluss MPA på menopausale symptomer.
WHI Estrogen Plus Progestin Substudie
WHI østrogen pluss progestin-substudien ble stoppet tidlig. I henhold til den forhåndsdefinerte stoppregelen, etter en gjennomsnittlig oppfølging av 5,6 års behandling, oversteg den økte risikoen for invasiv brystkreft og kardiovaskulære hendelser de spesifiserte fordelene inkludert i den "globale indeksen." Den absolutte overrisikoen for hendelser inkludert i den "globale indeksen" var 19 per 10 000 kvinneår.
For de resultatene inkludert i WHI "global index" som nådde statistisk signifikans etter 5,6 års oppfølging, var den absolutte overrisikoen per 10 000 kvinneår i gruppen behandlet med CE pluss MPA 7 flere CHD-hendelser, 8 flere slag, 10 flere PE-er og 8 flere invasive brystkrefttilfeller, mens den absolutte risikoreduksjonen per 10 000 kvinneår var 6 færre tykktarmskreft og 5 færre hoftebrudd.
Resultatene fra CE pluss MPA-understudien, som inkluderte 16 608 kvinner (gjennomsnittlig alder 63 år, fra 50 til 79 år; 83,9 prosent hvite, 6,8 prosent svarte, 5,4 prosent latinamerikanske, 3,9 prosent andre) er presentert i tabell 4. Disse resultatene gjenspeiler sentralt. bedømte data etter en gjennomsnittlig oppfølging på 5,6 år.
Tidspunkt for initiering av østrogen pluss gestagenbehandling i forhold til starten av menopause kan påvirke den samlede risiko-nytte-profilen. WHI østrogen pluss progestin-substudien stratifisert etter alder viste hos kvinner 50 til 59 år en ikke-signifikant trend mot redusert risiko i total dødelighet [farerasjon (HR) 0,69 (95 prosent KI, 0,44–1,07)].
Minnestudie for kvinnehelseinitiativet
WHIMS østrogen pluss progestin hjelpestudie av WHI registrerte 4532 overveiende friske postmenopausale kvinner 65 år og eldre (47 prosent var i alderen 65 til 69 år, 35 prosent var 70 til 74 år og 18 prosent var 75 år gamle alder og eldre) for å evaluere effekten av daglig CE (0,625 mg) pluss MPA (2,5 mg) på forekomsten av sannsynlig demens (primært utfall) sammenlignet med placebo.
Etter en gjennomsnittlig oppfølging på 4 år var den relative risikoen for sannsynlig demens for CE pluss MPA versus placebo 2,05 (95 prosent KI, 1,21–3,48). Den absolutte risikoen for sannsynlig demens for CE pluss MPA versus placebo var 45 mot 33 per 10 000 kvinneår. Sannsynlig demens som definert i denne studien inkluderte Alzheimers sykdom (AD), vaskulær demens (VaD) og blandet type (med trekk av både AD og VaD). Den vanligste klassifiseringen av sannsynlig demens i behandlingsgruppen og placebogruppen var AD. Siden tilleggsstudien ble utført på kvinner i alderen 65 til 79 år, er det ukjent om disse funnene gjelder for yngre postmenopausale kvinner. (Se ADVARSLER , Sannsynlig demens og FORHOLDSREGLER , Geriatrisk bruk ).
PASIENTINFORMASJON
PROVERA (pro-VE-rah) (medroxyprogesteronacetat) tabletter , USP
Les denne pasientinformasjonen før du begynner å ta PROVERA og les hva du får hver gang du fyller på PROVERA-resepten. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller din behandling.
Hva er den viktigste informasjonen jeg bør vite om PROVERA (et gestagenhormon)?
- . Ikke bruk østrogener med progestiner for å forhindre hjertesykdom, hjerteinfarkt, slag eller demens (nedgang i hjernefunksjon). . Bruk av østrogener med gestagen kan øke sjansen for å få hjerteinfarkt, slag, brystkreft og blodpropp. . Bruk av østrogener med gestagener kan øke sjansen for å få demens, basert på en studie av kvinner i alderen 65 år eller eldre. . Du og helsepersonell bør snakke regelmessig om hvorvidt du fortsatt trenger behandling med PROVERA.
Hva er PROVERA 10mg?
PROVERA er et legemiddel som inneholder medroksyprogesteronacetat, et progestinhormon.
Hva brukes PROVERA 5mg til?
PROVERA brukes til:
- . Behandle menstruasjonsperioder som har stoppet eller for å behandle unormal livmorblødning. Kvinner med livmor som ikke er gravide, som slutter å ha regelmessige menstruasjoner eller som begynner å få uregelmessige menstruasjoner, kan få et fall i progesteronnivået. Snakk med helsepersonell om PROVERA 10mg er riktig for deg. . Reduser sjansene for å få kreft i livmoren (livmoren). Hos postmenopausale kvinner med livmor som bruker østrogener, vil det å ta gestagen i kombinasjon med østrogen redusere sjansen for å få livmorkreft (livmor).
Hvem bør ikke ta PROVERA?
Ikke begynn å ta PROVERA hvis du:
- . har uvanlige vaginale blødninger . har eller har hatt visse kreftformer Østrogen pluss gestagen kan øke sjansen for å få visse typer kreft, inkludert brystkreft. Hvis du har eller har hatt kreft, snakk med helsepersonell om du bør bruke PROVERA. . hatt hjerneslag eller hjerteinfarkt . har eller har hatt blodpropp . har eller har hatt leverproblemer . er allergisk mot PROVERA 10mg eller noen av ingrediensene Se listen over ingredienser i PROVERA på slutten av dette pakningsvedlegget. . tror du kan være gravid PROVERA er ikke for gravide. Hvis du tror du kan være gravid, bør du ta en graviditetstest og vite resultatene. Ikke bruk PROVERA hvis testen er positiv og snakk med helsepersonell. Det kan være økt risiko for mindre fødselsskader hos barn hvis mødre tar PROVERA i løpet av de første 4 månedene av svangerskapet. PROVERA skal ikke brukes som test for graviditet.
Hva bør jeg fortelle helsepersonell før jeg tar PROVERA 10mg? Før du tar PROVERA 5mg, fortell helsepersonell dersom du:
- . har andre medisinske problemer Din helsepersonell må kanskje sjekke deg mer nøye hvis du har visse tilstander som astma (hvising), epilepsi (anfall), diabetes, migrene, endometriose (alvorlige bekkensmerter), lupus eller problemer med hjertet, leveren, skjoldbruskkjertelen, nyrer, eller har høyt kalsium i blodet. . skal opereres eller ligge i seng Helsepersonell vil gi deg beskjed hvis du må slutte å ta PROVERA. . ammer Hormonet i PROVERA kan gå over i morsmelk.
Fortell helsepersonell om alle medisinene du tar inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Noen legemidler kan påvirke hvordan PROVERA virker. PROVERA kan også påvirke hvordan andre legemidler virker.
Hvordan skal jeg ta PROVERA 10mg?
Start med den laveste dosen og snakk med helsepersonell om hvor godt den dosen virker for deg. Den laveste effektive dosen av PROVERA er ikke bestemt. Du og helsepersonell bør snakke regelmessig (hver 3. til 6. måned) om dosen du tar og om du fortsatt trenger behandling med PROVERA.
. Fravær av menstruasjon: PROVERA kan gis i doser fra 5 til 10 mg daglig i 5 til 10 dager. . Unormal livmorblødning: PROVERA kan gis i doser fra 5 til 10 mg daglig i 5 til 10 dager. . Overvekst av slimhinnen i livmoren: Når det brukes i kombinasjon med orale konjugerte østrogener hos postmenopausale kvinner med livmor, kan PROVERA gis i doser som varierer fra 5 eller 10 mg daglig i 12 til 14 strake dager per måned.Hva er de mulige bivirkningene av PROVERA?
Følgende bivirkninger er rapportert ved bruk av PROVERA 10 mg alene:
- . ømhet i brystene . morsmelksekresjon . gjennombruddsblødning . spotting (mindre vaginal blødning) . uregelmessige menstruasjoner . amenoré (fravær av menstruasjon) . vaginale sekreter . hodepine . nervøsitet . svimmelhet . depresjon . søvnløshet, søvnighet, tretthet . premenstruelt syndrom-lignende symptomer . tromboflebitt (betente årer) . blodpropp . kløe, elveblest, hudutslett . kviser . hårtap, hårvekst . ubehag i magen . kvalme . oppblåsthet . feber . økning i vekt . opphovning . endringer i syn og følsomhet for kontaktlinser
Ring helsepersonell med en gang hvis du får elveblest, pusteproblemer, hevelse i ansikt, munn, tunge eller nakke
Følgende bivirkninger er rapportert ved bruk av PROVERA 5mg med østrogen.
Bivirkninger er gruppert etter hvor alvorlige de er og hvor ofte de oppstår når du blir behandlet.
Alvorlige, men mindre vanlige bivirkninger inkluderer:
- . hjerteinfarkt . slag . blodpropp . demens . brystkreft . kreft i livmoren . kreft i eggstokken . høyt blodtrykk . høyt blodsukker . galleblæren sykdom . leverproblemer . endringer i skjoldbruskhormonnivået . forstørrelser av godartede svulster ("fibroider")
Ring helsepersonell med en gang hvis du får noen av følgende advarselstegn eller andre uvanlige symptomer som angår deg:
- . nye brystklumper . uvanlig vaginal blødning . endringer i syn og tale . plutselig ny kraftig hodepine . sterke smerter i brystet eller bena med eller uten kortpustethet, svakhet og tretthet . hukommelsestap eller forvirring
Mindre alvorlige, men vanlige bivirkninger inkluderer:
- . hodepine . brystsmerter . uregelmessige vaginale blødninger eller flekker . mage- eller magekramper, oppblåsthet . kvalme og oppkast . hårtap . væskeretensjon . vaginal soppinfeksjon
Dette er ikke alle mulige bivirkninger av PROVERA med eller uten østrogen. For mer informasjon, spør helsepersonell eller apotek om råd om bivirkninger. Fortell helsepersonell dersom du har bivirkninger som plager deg eller ikke forsvinner. Du kan rapportere bivirkninger til Pfizer på 1-800-438-1985 eller FDA på 1-800-FDA-1088.
Hva kan jeg gjøre for å redusere sjansene mine for en alvorlig bivirkning med PROVERA 10mg?
- . Snakk med helsepersonell regelmessig om du bør fortsette å ta PROVERA. Tilsetning av gestagen anbefales generelt for kvinner med livmor for å redusere sjansen for å få livmorkreft (livmor). . Kontakt helsepersonell med en gang hvis du får vaginal blødning mens du tar PROVERA. . Ta en bekkenundersøkelse, brystundersøkelse og mammografi (brystrøntgen) hvert år med mindre helsepersonell forteller deg noe annet. Hvis medlemmer av familien din har hatt brystkreft eller hvis du noen gang har hatt brystklumper eller et unormalt mammografi, kan det hende du må ha brystundersøkelser oftere. . Hvis du har høyt blodtrykk, høyt kolesterol (fett i blodet), diabetes, er overvektig, eller hvis du bruker tobakk, kan du ha større sjanse for å få hjertesykdom. Spør helsepersonell om måter å redusere sjansen for å få hjertesykdom.
Generell informasjon om sikker og effektiv bruk av PROVERA
- . Medisiner er noen ganger foreskrevet for tilstander som ikke er nevnt i pasientopplysninger. . Ikke ta PROVERA for tilstander som det ikke er foreskrevet for. . Ikke gi PROVERA til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Oppbevar PROVERA 10mg utilgjengelig for barn.
Dette pakningsvedlegget gir et sammendrag av den viktigste informasjonen om PROVERA. Hvis du vil ha mer informasjon, snakk med helsepersonell eller apotek. Du kan be om informasjon om PROVERA 10mg som er skrevet for helsepersonell. Du kan få mer informasjon ved å ringe gratisnummeret, 1-800-438-1985.
Hva er ingrediensene i PROVERA?
Hver PROVERA 5 mg tablett for oral administrering inneholder 2,5 mg, 5 mg eller 10 mg medroksyprogesteronacetat.
Inaktive ingredienser: kalsiumstearat, maisstivelse, laktose, mineralolje, sorbinsyre, sukrose, talkum. 2,5 mg tabletten inneholder FD&C Yellow No. 6.
Dette produktets etikett kan ha blitt oppdatert. For gjeldende full forskrivningsinformasjon, vennligst besøk www.pfizer.com
