Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Diflucan og hvordan brukes det?
Diflucan er et reseptbelagt legemiddel som brukes til å behandle symptomene på soppinfeksjoner. Diflucan 50mg kan brukes alene eller sammen med andre medisiner.
Diflucan 100mg tilhører en klasse med medisiner som kalles soppdrepende midler.
Hva er bivirkningene av Diflucan 150mg?
Diflucan 100mg kan forårsake alvorlige bivirkninger inkludert:
- . rask eller bankende hjerterytme, . flagre i brystet, . kortpustethet, . plutselig svimmelhet, . feber, . frysninger, . Smerter i kroppen, . influensasymptomer, . lett blåmerker eller blødninger, . uvanlig svakhet, . anfall (kramper), . hudutslett eller lesjoner, . tap av Appetit, . smerter i øvre mage, . mørk urin, . leirefarget krakk, og . gulfarging av øyne eller hud (gulsott)
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Diflucan inkluderer:
- . kvalme, . magesmerter, . diaré, . urolig mage, . hodepine, . svimmelhet, og . endringer i smakssansen din
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Diflucan. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
DIFLUCAN® (flukonazol), den første av en ny underklasse av syntetiske triazol-antifungale midler, er tilgjengelig som tabletter for oral administrering, som pulver til oral suspensjon.
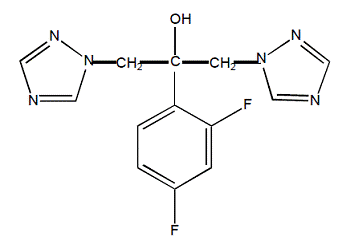
Flukonazol er kjemisk betegnet som 2,4-difluor-a,α1-bis(1H-1,2,4-triazol-1-ylmetyl)benzylalkohol med en empirisk formel på C13H12F2N6O og molekylvekt på 306,3. Strukturformelen er:
Flukonazol er et hvitt krystallinsk fast stoff som er lett løselig i vann og saltvann.
DIFLUCAN tabletter inneholder 50, 100, 150 eller 200 mg flukonazol og følgende inaktive ingredienser: mikrokrystallinsk cellulose, vannfri dibasisk kalsiumfosfat, povidon, kroskarmellosenatrium, FD&C Red No. 40 aluminiums-stearat og magnesium.
DIFLUCAN for oral suspensjon inneholder 350 mg eller 1400 mg flukonazol og følgende inaktive ingredienser: sukrose, natriumsitratdihydrat, vannfri sitronsyre, natriumbenzoat, titandioksid, kolloidalt silisiumdioksid, xantangummi og naturlig appelsinsmak. Etter rekonstituering med 24 ml destillert vann eller renset vann (USP), inneholder hver ml rekonstituert suspensjon 10 mg eller 40 mg flukonazol.
INDIKASJONER
DIFLUCAN (flukonazol) er indisert for behandling av:
- . Vaginal candidiasis (vaginale soppinfeksjoner på grunn av Candida). . Orofaryngeal og esophageal candidiasis. I åpne, ikke-komparative studier av relativt lite antall pasienter, var DIFLUCAN også effektiv for behandling av Candida urinveisinfeksjoner, peritonitt og systemiske Candida-infeksjoner inkludert candidemi, disseminert candidiasis og lungebetennelse. . Kryptokok meningitt. Før du foreskriver DIFLUCAN (flukonazol) til AIDS-pasienter med kryptokokkmeningitt, vennligst se Kliniske studier seksjon. Studier som sammenligner DIFLUCAN 150 mg med amfotericin B hos ikke-hiv-infiserte pasienter er ikke utført.
Profylakse
DIFLUCAN er også indisert for å redusere forekomsten av candidiasis hos pasienter som gjennomgår benmargstransplantasjon som får cytotoksisk kjemoterapi og/eller strålebehandling.
Prøver for soppkultur og andre relevante laboratoriestudier (serologi, histopatologi) bør innhentes før behandling for å isolere og identifisere forårsakende organismer. Terapi kan iverksettes før resultatene av kulturene og andre laboratoriestudier er kjent; Men når disse resultatene blir tilgjengelige, bør anti-infeksjonsterapi justeres tilsvarende.
DOSERING OG ADMINISTRASJON
Dosering og administrasjon hos voksne
Enkeltdose
Vaginal candidiasis
Den anbefalte dosen av DIFLUCAN for vaginal candidiasis er 150 mg som en enkelt oral dose.
Multippel dose
SIDEN ORAL ABSORPTION ER RASK OG NESTEN FULLSTENDIG, ER DEN DAGLIGE DOSEN AV DIFLUCAN (FLUCONAZOL) DEN SAMME FOR ORAL (TABLETTER OG SUSPENSJON) OG INTRAVENØS ADMINISTRASJON. Generelt anbefales en startdose på to ganger den daglige dosen den første behandlingsdagen for å gi plasmakonsentrasjoner nær steady-state innen den andre behandlingsdagen.
Den daglige dosen av DIFLUCAN 100 mg for behandling av andre infeksjoner enn vaginal candidiasis bør være basert på den infiserte organismen og pasientens respons på behandlingen. Behandlingen bør fortsettes til kliniske parametere eller laboratorietester indikerer at aktiv soppinfeksjon har avtatt. En utilstrekkelig behandlingsperiode kan føre til tilbakefall av aktiv infeksjon. Pasienter med AIDS og kryptokokkmeningitt eller tilbakevendende orofaryngeal candidiasis krever vanligvis vedlikeholdsbehandling for å forhindre tilbakefall.
Orofaryngeal Candidiasis
Den anbefalte dosen av DIFLUCAN for orofaryngeal candidiasis er 200 mg den første dagen, etterfulgt av 100 mg en gang daglig. Kliniske tegn på orofaryngeal candidiasis går vanligvis over i løpet av flere dager, men behandlingen bør fortsette i minst 2 uker for å redusere sannsynligheten for tilbakefall.
Esophageal Candidiasis
Den anbefalte dosen av DIFLUCAN 200 mg for esophageal candidiasis er 200 mg den første dagen, etterfulgt av 100 mg en gang daglig. Doser opptil 400 mg/dag kan brukes, basert på medisinsk vurdering av pasientens respons på behandlingen. Pasienter med esophageal candidiasis bør behandles i minst tre uker og i minst to uker etter at symptomene har løst seg.
Systemiske Candida-infeksjoner
For systemiske Candida-infeksjoner inkludert candidemi, disseminert candidiasis og lungebetennelse, er optimal terapeutisk dosering og behandlingsvarighet ikke fastslått. I åpne, ikke-komparative studier av et lite antall pasienter, har doser på opptil 400 mg daglig blitt brukt.
Urinveisinfeksjoner og peritonitt
For behandling av Candida urinveisinfeksjoner og peritonitt har daglige doser på 50 til 200 mg blitt brukt i åpne, ikke-komparative studier av et lite antall pasienter.
Kryptokok meningitt
Anbefalt dosering for behandling av akutt kryptokokkmeningitt er 400 mg den første dagen, etterfulgt av 200 mg én gang daglig. En dose på 400 mg én gang daglig kan brukes, basert på medisinsk vurdering av pasientens respons på behandlingen. Anbefalt behandlingsvarighet for initial behandling av kryptokokkmeningitt er 10 til 12 uker etter at cerebrospinalvæsken blir kulturnegativ. Den anbefalte dosen av DIFLUCAN 150 mg for undertrykkelse av tilbakefall av kryptokokkmeningitt hos pasienter med AIDS er 200 mg én gang daglig.
Profylakse hos pasienter som gjennomgår benmargstransplantasjon
Den anbefalte daglige dosen av DIFLUCAN for forebygging av candidiasis hos pasienter som gjennomgår benmargstransplantasjon er 400 mg én gang daglig. Pasienter som forventes å ha alvorlig granulocytopeni (mindre enn 500 nøytrofile celler/mm³) bør starte DIFLUCAN-profylakse flere dager før forventet begynnelse av nøytropeni, og fortsette i 7 dager etter at nøytrofiltallet stiger til over 1000 celler/mm³.
Dosering og administrasjon hos barn
Følgende doseekvivalensskjema skal generelt gi tilsvarende eksponering hos pediatriske og voksne pasienter:
Erfaring med DIFLUCAN hos nyfødte er begrenset til farmakokinetiske studier hos premature nyfødte. (Se KLINISK FARMAKOLOGI .) Basert på den forlengede halveringstiden sett hos premature nyfødte (svangerskapsalder 26 til 29 uker), bør disse barna, i de to første leveukene, få samme dose (mg/kg) som hos eldre barn, men administrert hver 72. time. Etter de to første ukene bør disse barna doseres én gang daglig. Ingen informasjon om DIFLUCANs farmakokinetikk hos fullbårne nyfødte er tilgjengelig.
Orofaryngeal Candidiasis
Den anbefalte dosen av DIFLUCAN 150 mg for orofaryngeal candidiasis hos barn er 6 mg/kg den første dagen, etterfulgt av 3 mg/kg én gang daglig. Behandling bør gis i minst 2 uker for å redusere sannsynligheten for tilbakefall.
Esophageal Candidiasis
For behandling av esophageal candidiasis er den anbefalte dosen av DIFLUCAN til barn 6 mg/kg den første dagen, etterfulgt av 3 mg/kg én gang daglig. Doser på opptil 12 mg/kg/dag kan brukes, basert på medisinsk vurdering av pasientens respons på behandlingen. Pasienter med esophageal candidiasis bør behandles i minst tre uker og i minst 2 uker etter at symptomene er opphørt.
Systemiske Candida-infeksjoner
For behandling av candidemia og disseminerte Candida-infeksjoner har daglige doser på 6 til 12 mg/kg/dag blitt brukt i en åpen, ikke-komparativ studie av et lite antall barn.
Kryptokok meningitt
For behandling av akutt kryptokokkmeningitt er den anbefalte dosen 12 mg/kg den første dagen, etterfulgt av 6 mg/kg én gang daglig. En dose på 12 mg/kg én gang daglig kan brukes, basert på medisinsk vurdering av pasientens respons på behandlingen. Anbefalt behandlingsvarighet for initial behandling av kryptokokkmeningitt er 10 til 12 uker etter at cerebrospinalvæsken blir kulturnegativ. For undertrykkelse av tilbakefall av kryptokokkmeningitt hos barn med AIDS er den anbefalte dosen av DIFLUCAN 6 mg/kg én gang daglig.
Dosering hos pasienter med nedsatt nyrefunksjon
Flukonazol elimineres primært ved nyreutskillelse som uendret legemiddel. Det er ikke nødvendig å justere enkeltdosebehandling for vaginal candidiasis på grunn av nedsatt nyrefunksjon. Hos pasienter med nedsatt nyrefunksjon som vil få flere doser DIFLUCAN, bør en startdose på 50 mg til 400 mg gis. Etter startdosen bør den daglige dosen (i henhold til indikasjon) baseres på følgende tabell:
Pasienter på hemodialyse bør få 100 % av anbefalt dose etter hver hemodialyse; på dager uten dialyse bør pasienter få en redusert dose i henhold til kreatininclearance.
Dette er foreslåtte dosejusteringer basert på farmakokinetikk etter administrering av flere doser. Ytterligere justering kan være nødvendig avhengig av klinisk tilstand.
Når serumkreatinin er det eneste tilgjengelige målet for nyrefunksjon, bør følgende formel (basert på kjønn, vekt og alder på pasienten) brukes for å estimere kreatininclearance hos voksne:
Menn: Vekt (kg) × (140 – alder)/ 72 × serumkreatinin (mg/100 ml)
Kvinner: 0,85 × over verdi
Selv om farmakokinetikken til flukonazol ikke er studert hos barn med nyreinsuffisiens, bør dosereduksjon hos barn med nyreinsuffisiens være parallell med det som anbefales for voksne. Følgende formel kan brukes til å beregne kreatininclearance hos barn:
× lineær lengde eller høyde (cm)/ serumkreatinin (mg/100 mL)
(Hvor K=0,55 for barn eldre enn 1 år og 0,45 for spedbarn.)
Administrasjon
DIFLUCAN 100 mg administreres oralt. DIFLUCAN kan tas med eller uten mat.
Instruksjoner for blanding av oral suspensjon
Forbered en suspensjon ved dispensering som følger: trykk på flasken til alt pulveret flyter fritt. For å rekonstituere, tilsett 24 ml destillert vann eller renset vann (USP) til flukonazol-flasken og rist kraftig for å suspendere pulveret. Hver flaske vil levere 35 ml suspensjon. Konsentrasjonene av de rekonstituerte suspensjonene er som følger:
Merk: Rist oral suspensjon godt før bruk. Oppbevar rekonstituert suspensjon mellom 86°F (30°C) og 41°F (5°C) og kast ubrukt porsjon etter 2 uker. Beskytt mot frysing.
HVORDAN LEVERES
DIFLUCAN 100mg tabletter Rosa trapesformede tabletter som inneholder 50, 100 eller 200 mg flukonazol er pakket i flasker eller enhetsdoseblister. 150 mg flukonazoltablettene er rosa og ovale, pakket i en enkeltdose blisterpakning.
DIFLUCAN tabletter leveres som følger:
DIFLUCAN 50 mg tabletter : Gravert med "DIFLUCAN" og "50" foran og "ROERIG" på baksiden.
NDC 0049-3410-30 Flasker à 30 stk
DIFLUCAN 100 mg tabletter : Gravert med "DIFLUCAN" og "100" foran og "ROERIG" på baksiden.
NDC 0049-3420-30 Flasker à 30 stk NDC 0049-3420-41 Enhetsdosepakke med 100 stk
DIFLUCAN 150 mg tabletter : Gravert med "DIFLUCAN" og "150" foran og "ROERIG" på baksiden.
NDC 0049-3500-79 Enhetsdosepakke med 1
DIFLUCAN 200 mg tabletter : Gravert med "DIFLUCAN" og "200" foran og "ROERIG" på baksiden.
NDC 0049-3430-30 Flasker à 30 stk NDC 0049-3430-41 Enhetsdosepakke med 100 stk
Oppbevaring
Oppbevar tabletter under 86 °F (30 °C).
DIFLUCAN 100mg for oral suspensjon : DIFLUCAN for oral suspensjon leveres som et pulver med appelsinsmak for å gi 35 ml per flaske som følger:
NDC 0049-3440-19 Flukonazol 350 mg per flaske NDC 0049-3450-19 Flukonazol 1400 mg per flaske
Oppbevaring
Oppbevar tørt pulver under 86 °F (30 °C). Oppbevar rekonstituert suspensjon mellom 86°F (30°C) og 41°F (5°C) og kast ubrukt porsjon etter 2 uker. Beskytt mot frysing.
Distribuert av: Roerig Division of Pfizer Inc., NY, NY 10017. Revidert: okt 2021
BIVIRKNINGER
DIFLUCAN tolereres generelt godt.
Hos noen pasienter, spesielt de med alvorlige underliggende sykdommer som AIDS og kreft, har endringer i nyre- og hematologiske funksjonstestresultater og leveravvik blitt observert under behandling med flukonazol og komparative midler, men den kliniske betydningen og forholdet til behandlingen er usikker.
Hos pasienter som får en enkelt dose for vaginal candidiasis
Under sammenlignende kliniske studier utført i USA ble 448 pasienter med vaginal candidiasis behandlet med DIFLUCAN, 150 mg enkeltdose. Den totale forekomsten av bivirkninger muligens relatert til DIFLUCAN var 26 %. Hos 422 pasienter som fikk aktive komparative midler var forekomsten 16 %. De vanligste behandlingsrelaterte bivirkningene rapportert hos pasientene som fikk 150 mg enkeltdose flukonazol for vaginitt var hodepine (13 %), kvalme (7 %) og magesmerter (6 %). Andre bivirkninger rapportert med en forekomst lik eller større enn 1 % inkluderte diaré (3 %), dyspepsi (1 %), svimmelhet (1 %) og smaksforstyrrelser (1 %). De fleste av de rapporterte bivirkningene var milde til moderate i alvorlighetsgrad. I sjeldne tilfeller er angioødem og anafylaktiske reaksjoner rapportert i markedsføringserfaring.
Hos pasienter som mottar flere doser for andre infeksjoner
Seksten prosent av over 4000 pasienter behandlet med DIFLUCAN (flukonazol) i kliniske studier på 7 dager eller mer opplevde bivirkninger. Behandlingen ble avbrutt hos 1,5 % av pasientene på grunn av uønskede kliniske hendelser og hos 1,3 % av pasientene på grunn av unormale laboratorieprøver.
Kliniske bivirkninger ble rapportert hyppigere hos HIV-infiserte pasienter (21 %) enn hos ikke-HIV-infiserte pasienter (13 %); Imidlertid var mønstrene hos HIV-infiserte og ikke-HIV-infiserte pasienter like. Andelene av pasienter som avbrøt behandlingen på grunn av kliniske bivirkninger var lik i de to gruppene (1,5 %).
Følgende behandlingsrelaterte kliniske bivirkninger forekom med en insidens på 1 % eller mer hos 4048 pasienter som fikk DIFLUCAN 50 mg i 7 eller flere dager i kliniske studier: kvalme 3,7 %, hodepine 1,9 %, hudutslett 1,8 %, oppkast 1,7 %, abdominal smerte 1,7 %, og diaré 1,5 %.
Hepato-Galleveis
kombinerte kliniske studier og markedsføringserfaring har det vært sjeldne tilfeller av alvorlige leverreaksjoner under behandling med DIFLUCAN. (Se ADVARSLER .) Spekteret av disse leverreaksjonene har variert fra milde forbigående økninger i transaminaser til klinisk hepatitt, kolestase og fulminant leversvikt, inkludert dødsfall. Forekomster av fatale leverreaksjoner ble registrert primært hos pasienter med alvorlige underliggende medisinske tilstander (hovedsakelig AIDS eller malignitet) og ofte mens de tok flere samtidige medisiner. Forbigående leverreaksjoner, inkludert hepatitt og gulsott, har forekommet hos pasienter uten andre identifiserbare risikofaktorer. I hvert av disse tilfellene gikk leverfunksjonen tilbake til baseline ved seponering av DIFLUCAN.
to sammenlignende studier som evaluerte effekten av DIFLUCAN for undertrykkelse av tilbakefall av kryptokokkmeningitt, ble det observert en statistisk signifikant økning i median AST (SGOT)-nivåer fra en baseline-verdi på 30 IE/l til 41 IE/l i en studie og 34 IU/L til 66 IU/L i den andre. Den totale frekvensen av serumtransaminaseøkninger på mer enn 8 ganger øvre normalgrense var ca. 1 % hos flukonazolbehandlede pasienter i kliniske studier. Disse økningene forekom hos pasienter med alvorlig underliggende sykdom, hovedsakelig AIDS eller maligniteter, hvorav de fleste fikk flere samtidige medisiner, inkludert mange kjent for å være hepatotoksiske. Forekomsten av unormalt forhøyede serumtransaminaser var høyere hos pasienter som tok DIFLUCAN samtidig med en eller flere av følgende medisiner: rifampin, fenytoin, isoniazid, valproinsyre eller orale sulfonylurea hypoglykemiske midler.
Erfaring etter markedsføring
I tillegg har følgende bivirkninger oppstått etter markedsføring.
Immunologisk: I sjeldne tilfeller har anafylaksi (inkludert angioødem, ansiktsødem og pruritus) blitt rapportert.
Kroppen som helhet: Asteni, tretthet, feber, ubehag.
Kardiovaskulær: QT-forlengelse, torsade de pointes. (Se FORHOLDSREGLER .)
Sentralnervesystemet: Kramper, svimmelhet.
Hematopoetisk og lymfatisk: Leukopeni, inkludert nøytropeni og agranulocytose, trombocytopeni.
Metabolsk: Hyperkolesterolemi, hypertriglyseridemi, hypokalemi.
Gastrointestinale: Kolestase, munntørrhet, hepatocellulær skade, dyspepsi, oppkast.
Andre sanser: Smaksperversjon.
Muskel- og skjelettsystemet: myalgi.
Nervesystemet: Søvnløshet, parestesi, somnolens, skjelving, svimmelhet.
Hud og vedheng: Akutt generalisert eksantematøs pustulose, legemiddelutbrudd inkludert fast legemiddelutbrudd, økt svette, eksfoliative hudsykdommer inkludert Stevens-Johnsons syndrom og toksisk epidermal nekrolyse, legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) (se ADVARSLER ), alopecia.
Bivirkninger hos barn
Mønsteret og forekomsten av uønskede hendelser og laboratorieavvik registrert under pediatriske kliniske studier er sammenlignbare med de som er sett hos voksne.
I kliniske fase II/III-studier utført i USA og i Europa ble 577 pediatriske pasienter i alderen 1 dag til 17 år behandlet med DIFLUCAN i doser opptil 15 mg/kg/dag i opptil 1616 dager. Tretten prosent av barna opplevde behandlingsrelaterte bivirkninger. De hyppigst rapporterte hendelsene var oppkast (5 %), magesmerter (3 %), kvalme (2 %) og diaré (2 %). Behandlingen ble avbrutt hos 2,3 % av pasientene på grunn av uønskede kliniske hendelser og hos 1,4 % av pasientene på grunn av unormale laboratorieprøver. De fleste behandlingsrelaterte laboratorieavvik var forhøyede transaminaser eller alkalisk fosfatase.
Andel av pasienter med behandlingsrelaterte bivirkninger
NARKOTIKAHANDEL
(Se KONTRAINDIKASJONER .) Flukonazol er en moderat CYP2C9- og CYP3A4-hemmer. Flukonazol er også en sterk hemmer av CYP2C19. Pasienter behandlet med DIFLUCAN, som også behandles samtidig med legemidler med et smalt terapeutisk vindu metabolisert gjennom CYP2C9 og CYP3A4, bør overvåkes for bivirkninger forbundet med de samtidig administrerte legemidlene. I tillegg til de observerte/dokumenterte interaksjonene nevnt nedenfor, er det en risiko for økt plasmakonsentrasjon av andre forbindelser metabolisert av CYP2C9, CYP2C19 og CYP3A4 samtidig administrert med flukonazol. Derfor bør det utvises forsiktighet ved bruk av disse kombinasjonene, og pasientene bør overvåkes nøye. Den enzymhemmende effekten av flukonazol vedvarer 4 til 5 dager etter seponering av flukonazolbehandling på grunn av den lange halveringstiden til flukonazol. Klinisk eller potensielt signifikante legemiddelinteraksjoner mellom DIFLUCAN 200mg og følgende midler/klasser er observert og er beskrevet mer detaljert nedenfor:
Alfentanil
En studie observerte en reduksjon i clearance og distribusjonsvolum samt forlengelse av t½ av alfentanil etter samtidig behandling med flukonazol. En mulig virkningsmekanisme er flukonazols hemming av CYP3A4. Dosejustering av alfentanil kan være nødvendig.
Amiodaron
Samtidig administrering av flukonazol og amiodaron kan øke QT-forlengelsen. Forsiktighet må utvises dersom samtidig bruk av flukonazol og amiodaron er nødvendig, spesielt med høydose flukonazol (800 mg).
Amitriptylin, Nortriptylin
Flukonazol øker effekten av amitriptylin og nortriptylin. 5-Nortriptylin og/eller S-amitriptylin kan måles ved oppstart av kombinasjonsbehandlingen og etter 1 uke. Dosering av amitriptylin/nortriptylin bør justeres om nødvendig.
Amfotericin B
Samtidig administrering av flukonazol og amfotericin B i infiserte normale og immunsupprimerte mus viste følgende resultater: en liten additiv antifungal effekt ved systemisk infeksjon med Candida albicans, ingen interaksjon ved intrakraniell infeksjon med Cryptococcus neoformans, og antagonisme av de to legemidlene ved systemisk infeksjon med A fumigatus. Den kliniske betydningen av resultater oppnådd i disse studiene er ukjent.
Azitromycin
En åpen, randomisert, treveis crossover-studie med 18 friske forsøkspersoner vurderte effekten av en enkelt 1200 mg oral dose azitromycin på farmakokinetikken til en enkelt 800 mg oral dose flukonazol, samt effekten av flukonazol på farmakokinetikken. av azitromycin. Det var ingen signifikant farmakokinetisk interaksjon mellom flukonazol og azitromycin.
Kalsiumkanalblokkere
Visse kalsiumkanalantagonister (nifedipin, isradipin, amlodipin, verapamil og felodipin) metaboliseres av CYP3A4. Flukonazol har potensial til å øke den systemiske eksponeringen av kalsiumkanalantagonistene. Hyppig overvåking for uønskede hendelser anbefales.
Karbamazepin
Flukonazol hemmer metabolismen av karbamazepin og en økning i serumkarbamazepin på 30 % er observert. Det er en risiko for å utvikle karbamazepin-toksisitet. Dosejustering av karbamazepin kan være nødvendig avhengig av konsentrasjonsmålinger/effekt.
Celecoxib
Ved samtidig behandling med flukonazol (200 mg daglig) og celekoksib (200 mg), økte Cmax og AUC for celekoksib med henholdsvis 68 % og 134 %. Halvparten av celecoxib-dosen kan være nødvendig når det kombineres med flukonazol.
Antikoagulanter av kumarin-type
Protrombintiden kan økes hos pasienter som samtidig får DIFLUCAN 150 mg og antikoagulantia av kumarintype. Etter markedsføring, som med andre antifungale azoler, er blødningshendelser (blåmerker, neseblødning, gastrointestinal blødning, hematuri og melena) rapportert i forbindelse med økt protrombintid hos pasienter som får flukonazol samtidig med warfarin. Nøye overvåking av protrombintid hos pasienter som får DIFLUCAN 50 mg og antikoagulantia av kumarintype anbefales. Dosejustering av warfarin kan være nødvendig. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Cyklofosfamid
Kombinasjonsbehandling med cyklofosfamid og flukonazol resulterer i en økning i serumbilirubin og serumkreatinin. Kombinasjonen kan brukes mens man tar økt hensyn til risikoen for økt serumbilirubin og serumkreatinin.
Syklosporin
DIFLUCAN 100 mg øker ciklosporinnivået signifikant hos nyretransplanterte pasienter med eller uten nedsatt nyrefunksjon. Nøye overvåking av ciklosporinkonsentrasjoner og serumkreatinin anbefales hos pasienter som får DIFLUCAN og ciklosporin. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .) Denne kombinasjonen kan brukes ved å redusere dosen av ciklosporin avhengig av ciklosporinkonsentrasjonen.
Fentanyl
Ett fatalt tilfelle av mulig fentanyl-flukonazol-interaksjon ble rapportert. Forfatteren vurderte at pasienten døde av fentanylforgiftning. Videre, i en randomisert crossover-studie med 12 friske frivillige, ble det vist at flukonazol forsinket eliminasjonen av fentanyl betydelig. Forhøyet fentanylkonsentrasjon kan føre til respirasjonsdepresjon.
HMG-CoA-reduktasehemmere
Risikoen for myopati og rabdomyolyse øker når flukonazol administreres samtidig med HMG-CoA-reduktasehemmere metabolisert gjennom CYP3A4, som atorvastatin og simvastatin, eller gjennom CYP2C9, som fluvastatin. Hvis samtidig behandling er nødvendig, bør pasienten observeres for symptomer på myopati og rabdomyolyse, og kreatininkinase bør overvåkes. HMG-CoA-reduktasehemmere bør seponeres hvis en markert økning i kreatininkinase observeres eller myopati/rabdomyolyse er diagnostisert eller mistenkt.
Hydroklortiazid
I en farmakokinetisk interaksjonsstudie økte samtidig administrering av flerdoser hydroklortiazid til friske frivillige som fikk flukonazol plasmakonsentrasjonen av flukonazol med 40 %. En effekt av denne størrelsesorden bør ikke nødvendiggjøre en endring i flukonazoldoseregimet hos personer som samtidig får diuretika.
Ibrutinib
Moderate hemmere av CYP3A4 som flukonazol kan øke plasmakonsentrasjonen av ibrutinib og øke risikoen for bivirkninger forbundet med ibrutinib. Hvis ibrutinib og flukonazol administreres samtidig, reduser dosen av ibrutinib som instruert i forskrivningsinformasjonen for ibrutinib, og pasienten bør overvåkes ofte for eventuelle bivirkninger forbundet med ibrutinib.
Lemborexant
Samtidig administrering av flukonazol økte lemborexant Cmax og AUC med henholdsvis ca. 1,6 og 4,2 ganger, noe som forventes å øke risikoen for bivirkninger, som somnolens. Unngå samtidig bruk av DIFLUCAN og lemborexant.
Losartan
Flukonazol hemmer metabolismen av losartan til dens aktive metabolitt (E-31 74) som er ansvarlig for det meste av angiotensin Il-reseptorantagonismen som oppstår under behandling med losartan. Pasienter bør ha blodtrykket overvåket kontinuerlig.
Metadon
Flukonazol kan øke serumkonsentrasjonen av metadon. Dosejustering av metadon kan være nødvendig.
Ikke-steroide antiinflammatoriske legemidler
Cmax og AUC for flurbiprofen økte med henholdsvis 23 % og 81 % ved samtidig administrering med flukonazol sammenlignet med administrering av flurbiprofen alene. Tilsvarende ble Cmax og AUC for den farmakologisk aktive isomeren [S-(+)-ibuprofen] økt med henholdsvis 15 % og 82 % når flukonazol ble administrert samtidig med racemisk ibuprofen (400 mg) sammenlignet med administrering av racemisk ibuprofen alene.
Selv om det ikke er spesifikt studert, har flukonazol potensial til å øke den systemiske eksponeringen av andre ikke-steroide antiinflammatoriske legemidler (NSAIDs) som metaboliseres av CYP2C9 (f.eks. naproksen, lornoxicam, meloksikam, diklofenak). Hyppig overvåking for uønskede hendelser og toksisitet relatert til NSAIDs anbefales. Justering av dosen av NSAIDs kan være nødvendig.
Olaparib
Moderate hemmere av CYP3A4 som flukonazol øker plasmakonsentrasjonen av olaparib; samtidig bruk anbefales ikke. Hvis kombinasjonen ikke kan unngås, reduser dosen av olaparib som instruert i LYNPARZA® (Olaparib) forskrivningsinformasjon.
Orale prevensjonsmidler
To farmakokinetiske studier med et kombinert oralt prevensjonsmiddel er utført ved bruk av flere doser flukonazol. Det var ingen relevante effekter på hormonnivået i 50 mg flukonazol-studien, mens ved 200 mg daglig økte AUC for etinyløstradiol og levonorgestrel med henholdsvis 40 % og 24 %. Det er derfor lite sannsynlig at bruk av flere doser av flukonazol i disse dosene vil ha en effekt på effekten av det kombinerte orale prevensjonsmidlet.
Orale hypoglykemiske midler
Klinisk signifikant hypoglykemi kan utløses ved bruk av DIFLUCAN med orale hypoglykemiske midler; en dødsfall er rapportert fra hypoglykemi i forbindelse med kombinert bruk av DIFLUCAN 150 mg og glyburid. DIFLUCAN reduserer metabolismen av tolbutamid, glyburid og glipizid og øker plasmakonsentrasjonen av disse midlene. Når DIFLUCAN 100 mg brukes samtidig med disse eller andre orale hypoglykemiske sulfonylureamidler, bør blodsukkerkonsentrasjonen overvåkes nøye og dosen av sulfonylurea justeres etter behov. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Fenytoin
DIFLUCAN øker plasmakonsentrasjonen av fenytoin. Nøye overvåking av fenytoinkonsentrasjoner hos pasienter som får DIFLUCAN 50 mg og fenytoin anbefales. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Pimozide
Selv om det ikke er studert in vitro eller in vivo, kan samtidig administrering av flukonazol med pimozid føre til hemming av pimozidmetabolismen. Økte plasmakonsentrasjoner av pimozid kan føre til QT-forlengelse og sjeldne forekomster av torsade de pointes. Samtidig administrering av flukonazol og pimozid er kontraindisert.
Prednison
Det var en kasusrapport om at en levertransplantert pasient behandlet med prednison utviklet akutt binyrebarksvikt når en 3 måneders behandling med flukonazol ble avbrutt. Seponering av flukonazol forårsaket antagelig økt CYP3A4-aktivitet som førte til økt metabolisme av prednison. Pasienter på langtidsbehandling med flukonazol og prednison bør overvåkes nøye for binyrebarkinsuffisiens når flukonazol seponeres.
Kinidin
Selv om det ikke er studert in vitro eller in vivo, kan samtidig administrering av flukonazol og kinidin resultere i hemming av kinidinmetabolismen. Bruk av kinidin har vært assosiert med QT-forlengelse og sjeldne forekomster av torsade de pointes. Samtidig administrering av flukonazol og kinidin er kontraindisert. (Se KONTRAINDIKASJONER .)
Rifabutin
Det har vært rapporter om at en interaksjon eksisterer når flukonazol administreres samtidig med rifabutin, noe som fører til økte serumnivåer av rifabutin med opptil 80 %. Det har vært rapporter om uveitt hos pasienter som flukonazol og rifabutin ble administrert samtidig. Pasienter som får rifabutin og flukonazol samtidig bør overvåkes nøye. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Rifampin
Rifampin øker metabolismen av samtidig administrert DIFLUCAN. Avhengig av kliniske omstendigheter bør det vurderes å øke dosen av DIFLUCAN 200 mg når det administreres sammen med rifampin. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Saquinavir
Flukonazol øker AUC for sakinavir med ca. 50 %, Cmax med ca. 55 %, og reduserer clearance av sakinavir med ca. 50 % på grunn av hemming av sakinavirs levermetabolisme av CYP3A4 og hemming av P-glykoprotein. Dosejustering av saquinavir kan være nødvendig.
Korttidsvirkende benzodiazepiner
Etter oral administrering av midazolam resulterte flukonazol i betydelige økninger i midazolamkonsentrasjoner og psykomotoriske effekter. Denne effekten på midazolam ser ut til å være mer uttalt etter oral administrering av flukonazol enn med flukonazol administrert intravenøst. Hvis korttidsvirkende benzodiazepiner, som metaboliseres av cytokrom P450-systemet, administreres samtidig med flukonazol, bør det vurderes å redusere benzodiazepindosen, og pasientene bør overvåkes på passende måte. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Sirolimus
Flukonazol øker plasmakonsentrasjonen av sirolimus antagelig ved å hemme metabolismen av sirolimus via CYP3A4 og P-glykoprotein. Denne kombinasjonen kan brukes med en dosejustering av sirolimus avhengig av effekt/konsentrasjonsmålinger.
Takrolimus
Flukonazol kan øke serumkonsentrasjonen av oralt administrert takrolimus opptil 5 ganger på grunn av hemming av takrolimusmetabolismen gjennom CYP3A4 i tarmen. Ingen signifikante farmakokinetiske endringer er observert når takrolimus gis intravenøst. Økte takrolimusnivåer har vært assosiert med nefrotoksisitet. Dosering av oralt administrert takrolimus bør reduseres avhengig av takrolimuskonsentrasjon. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Teofyllin
DIFLUCAN 50mg øker serumkonsentrasjonen av teofyllin. Nøye overvåking av serum teofyllinkonsentrasjoner hos pasienter som får DIFLUCAN 100 mg og teofyllin anbefales. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Tofacitinib
Systemisk eksponering for tofacitinib øker når tofacitinib gis samtidig med flukonazol. Reduser dosen av tofacitinib når det gis samtidig med flukonazol (dvs. fra 5 mg to ganger daglig til 5 mg en gang daglig som instruert i XELJANZ [tofacitinib]-etiketten). (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Tolvaptan
Plasmaeksponering for tolvaptan er signifikant økt (200 % i AUC; 80 % i Cmax) når tolvaptan, et CYP3A4-substrat, administreres samtidig med flukonazol, en moderat CYP3A4-hemmer. Denne interaksjonen kan resultere i risiko for en betydelig økning i bivirkninger forbundet med tolvaptan, spesielt signifikant diurese, dehydrering og akutt nyresvikt. Hvis tolvaptan og flukonazol administreres samtidig, bør tolvaptan-dosen reduseres som instruert i forskrivningsinformasjonen for tolvaptan, og pasienten bør overvåkes ofte for eventuelle bivirkninger forbundet med tolvaptan.
Triazolam
Flukonazol øker AUC for triazolam (enkeltdose) med ca. 50 %, Cmax med 20 % til 32 %, og øker t½ med 25 % til 50 % på grunn av hemming av metabolismen av triazolam. Dosejusteringer av triazolam kan være nødvendig.
Vinca Alkaloider
Selv om det ikke er studert, kan flukonazol øke plasmanivåene av vinca-alkaloidene (f.eks. vincristin og vinblastin) og føre til nevrotoksisitet, som muligens skyldes en hemmende effekt på CYP3A4.
Vitamin A
Basert på en kasusrapport hos en pasient som fikk kombinasjonsbehandling med all-trans-retinoid syre (en syreform av vitamin A) og flukonazol, har sentralnervesystem (CNS) relaterte bivirkninger utviklet seg i form av pseudotumor cerebri, som forsvant etter seponering av flukonazolbehandling. Denne kombinasjonen kan brukes, men forekomsten av CNS-relaterte bivirkninger bør tas i betraktning.
Vorikonazol
Unngå samtidig administrering av vorikonazol og flukonazol. Overvåking for uønskede hendelser og toksisitet relatert til vorikonazol anbefales; spesielt hvis vorikonazol startes innen 24 timer etter siste dose med flukonazol. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier .)
Zidovudin
Flukonazol øker Cmax og AUC for zidovudin med henholdsvis 84 % og 74 % på grunn av en ca. 45 % reduksjon i oral zidovudinclearance. Halveringstiden til zidovudin ble likeledes forlenget med ca. 128 % etter kombinasjonsbehandling med flukonazol. Pasienter som får denne kombinasjonen bør overvåkes for utvikling av zidovudin-relaterte bivirkninger. Dosereduksjon av zidovudin kan vurderes.

Leger bør være oppmerksomme på at interaksjonsstudier med andre medisiner enn de som er oppført i avsnittet KLINISK FARMAKOLOGI ikke er utført, men slike interaksjoner kan forekomme.
ADVARSLER
. Leverskade: DIFLUCAN bør administreres med forsiktighet til pasienter med nedsatt leverfunksjon. DIFLUCAN har vært assosiert med sjeldne tilfeller av alvorlig levertoksisitet, inkludert dødsfall primært hos pasienter med alvorlige underliggende medisinske tilstander. I tilfeller av DIFLUCAN-assosiert levertoksisitet er det ikke observert noen åpenbar sammenheng med total daglig dose, behandlingsvarighet, kjønn eller alder på pasienten. DIFLUCAN 150 mg levertoksisitet har vanligvis, men ikke alltid, vært reversibel ved seponering av behandlingen. Pasienter som utvikler unormale leverfunksjonstester under behandling med DIFLUCAN bør overvåkes for utvikling av mer alvorlig leverskade. DIFLUCAN bør seponeres hvis det oppstår kliniske tegn og symptomer forenlig med leversykdom som kan tilskrives DIFLUCAN. . Anafylaksi: I sjeldne tilfeller har anafylaksi blitt rapportert. . Dermatologisk: Eksfoliative hudsykdommer under behandling med DIFLUCAN 200 mg er rapportert. Dødelige utfall er rapportert hos pasienter med alvorlige underliggende sykdommer. Pasienter med dyptsittende soppinfeksjoner som utvikler utslett under behandling med DIFLUCAN 200 mg bør overvåkes nøye og legemidlet seponeres dersom lesjonene utvikler seg. Flukonazol bør seponeres hos pasienter som behandles for overfladisk soppinfeksjon som utvikler utslett som kan tilskrives flukonazol. . Potensial for fosterskade: Det finnes ingen tilstrekkelige og velkontrollerte kliniske studier av DIFLUCAN hos gravide kvinner. Kasusrapporter beskriver et mønster av distinkte medfødte anomalier hos spedbarn som ble eksponert in utero for høydose flukonazol hos mor (400 til 800 mg/dag) i det meste av eller hele første trimester. Disse rapporterte anomaliene ligner de som er sett i dyrestudier. Hvis DIFLUCAN 150mg brukes under graviditet eller hvis pasienten blir gravid mens du tar legemidlet, bør pasienten informeres om den potensielle faren for fosteret. Effektive prevensjonstiltak bør vurderes hos kvinner i fertil alder som behandles med DIFLUCAN 400 til 800 mg/dag og bør fortsette gjennom hele behandlingsperioden og i ca. 1 uke (5 til 6 halveringstider) etter siste dose. Epidemiologiske studier tyder på en potensiell risiko for spontanabort og medfødte abnormiteter hos spedbarn hvis mødre ble behandlet med 150 mg flukonazol som en enkelt eller gjentatt dose i første trimester, men disse epidemiologiske studiene har begrensninger og disse funnene er ikke bekreftet i kontrollerte kliniske studier. prøvelser. (Se FORHOLDSREGLER : Svangerskap .)FORHOLDSREGLER
Generell
Noen azoler, inkludert flukonazol, har blitt assosiert med forlengelse av QT-intervallet på elektrokardiogrammet. Flukonazol forårsaker QT-forlengelse via hemming av Rectifier Potassium Channel-strøm (Ikr). QT-forlengelsen forårsaket av andre legemidler (som amiodaron) kan forsterkes via hemming av cytokrom P450 (CYP) 3A4. (Se FORHOLDSREGLER : Narkotikahandel .) Under overvåking etter markedsføring har det vært sjeldne tilfeller av QT-forlengelse og torsade de pointes hos pasienter som tar flukonazol. De fleste av disse rapportene involverte alvorlig syke pasienter med flere forvirrende risikofaktorer, som strukturell hjertesykdom, elektrolyttavvik og samtidige medisiner som kan ha vært medvirkende. Pasienter med hypokalemi og avansert hjertesvikt har økt risiko for forekomst av livstruende ventrikulære arytmier og torsade de pointes.
Flukonazol bør administreres med forsiktighet til pasienter med disse potensielt proarytmiske tilstandene.
Samtidig bruk av flukonazol og erytromycin har potensial til å øke risikoen for kardiotoksisitet (forlenget QT-intervall, torsade de pointes) og følgelig plutselig hjertedød. Denne kombinasjonen bør unngås.
Flukonazol bør administreres med forsiktighet til pasienter med nedsatt nyrefunksjon.
Binyrebarksvikt er rapportert hos pasienter som får azoler, inkludert flukonazol. Reversible tilfeller av binyrebarksvikt er rapportert hos pasienter som får flukonazol.
DIFLUCAN 100 mg pulver til oral suspensjon inneholder sukrose og skal ikke brukes til pasienter med arvelig fruktose, glukose/galaktosemalabsorpsjon og sukrase-isomaltase-mangel.
Når du kjører kjøretøy eller betjener maskiner, bør det tas i betraktning at det av og til kan forekomme svimmelhet eller anfall.
Enkeltdose
Bekvemmeligheten og effekten av den orale enkeltdose-tabletten av flukonazol for behandling av vaginale gjærinfeksjoner bør veies opp mot akseptabiliteten av en høyere forekomst av legemiddelrelaterte bivirkninger med DIFLUCAN (26 %) versus intravaginale midler (16 %) i USA sammenlignende kliniske studier. (Se BIVIRKNINGER og Kliniske studier .)
Ikke-klinisk toksikologi
Karsinogenese, mutagenese og svekkelse av fruktbarhet
Flukonazol viste ingen tegn på kreftfremkallende potensial hos mus og rotter behandlet oralt i 24 måneder med doser på 2,5 mg/kg/dag, 5 mg/kg/dag eller 10 mg/kg/dag (omtrent 2 til 7 ganger anbefalt human dose ). Hannrotter behandlet med 5 mg/kg/dag og 10 mg/kg/dag hadde økt forekomst av hepatocellulære adenomer.
Flukonazol, med eller uten metabolsk aktivering, var negativ i tester for mutagenitet i fire stammer av S. typhimurium, og i muselymfom L5178Y-systemet. Cytogenetiske studier in vivo (murine benmargsceller, etter oral administrering av flukonazol) og in vitro (humane lymfocytter eksponert for flukonazol ved 1000 mcg/ml) viste ingen tegn på kromosomale mutasjoner.
Flukonazol påvirket ikke fertiliteten til hann- eller hunnrotter behandlet oralt med daglige doser på 5 mg/kg, 10 mg/kg eller 20 mg/kg eller med parenterale doser på 5 mg/kg, 25 mg/kg eller 75 mg /kg, selv om starten på fødselen ble litt forsinket ved 20 mg/kg PO. I en intravenøs perinatal studie på rotter med 5 mg/kg, 20 mg/kg og 40 mg/kg ble dystoki og forlengelse av fødsel observert hos noen få mødre ved 20 mg/kg (omtrent 5 til 15 ganger anbefalt human dose ) og 40 mg/kg, men ikke ved 5 mg/kg. Forstyrrelsene i fødsel ble reflektert av en svak økning i antall dødfødte unger og reduksjon i neonatal overlevelse ved disse dosenivåene. Effektene på fødsel hos rotter er i samsvar med den artsspesifikke østrogen-senkende egenskapen som produseres av høye doser flukonazol. En slik hormonforandring har ikke blitt observert hos kvinner behandlet med flukonazol. (Se KLINISK FARMAKOLOGI .)
Svangerskap
Teratogene effekter
Potensial for fosterskade
Bruk under graviditet bør unngås unntatt hos pasienter med alvorlige eller potensielt livstruende soppinfeksjoner hvor flukonazol kan brukes dersom den forventede fordelen oppveier den mulige risikoen for fosteret. Noen få publiserte kasusrapporter beskriver et mønster av tydelige medfødte anomalier hos spedbarn som ble eksponert in utero for høydose flukonazol hos mor (400 til 800 mg/dag) i det meste av eller hele første trimester. Disse rapporterte anomaliene ligner de som er sett i dyrestudier. Effektive prevensjonstiltak bør vurderes hos kvinner i fertil alder som behandles med DIFLUCAN 400 til 800 mg/dag og bør fortsette gjennom hele behandlingsperioden og i ca. 1 uke (5 til 6 halveringstider) etter siste dose. Hvis DIFLUCAN brukes under graviditet, eller hvis pasienten blir gravid mens du tar legemidlet, bør pasienten informeres om den potensielle faren for fosteret. Spontane aborter og medfødte abnormiteter har blitt foreslått som potensielle risikoer forbundet med 150 mg flukonazol som en enkelt eller gjentatt dose i første trimester av svangerskapet basert på retrospektive epidemiologiske studier. Det er ingen tilstrekkelige og godt kontrollerte studier av DIFLUCAN 150 mg hos gravide kvinner. (Se ADVARSLER : Potensial for fosterskade .)
Menneskelige data
Kasusrapporter beskriver et særegent og sjeldent mønster av fødselsdefekter blant spedbarn hvis mødre fikk høydose (400 til 800 mg/dag) flukonazol under det meste av eller hele første trimester av svangerskapet. Funksjonene som sees hos disse spedbarnene inkluderer brachycephaly, unormale ansikter, unormal calvarial utvikling, ganespalte, lårbensbuing, tynne ribben og lange bein, arthrogryposis og medfødt hjertesykdom. Disse effektene ligner de som er sett i dyrestudier.
Epidemiologiske studier tyder på en potensiell risiko for spontanabort og medfødte abnormiteter hos spedbarn hvis mødre ble behandlet med 150 mg flukonazol som en enkelt eller gjentatt dose i første trimester, men disse epidemiologiske studiene har begrensninger og disse funnene er ikke bekreftet i kontrollerte kliniske studier. prøvelser.
Dyredata
Flukonazol ble administrert oralt til drektige kaniner under organogenese i to studier i doser på henholdsvis 5 mg/kg, 10 mg/kg og 20 mg/kg og ved 5 mg/kg, 25 mg/kg og 75 mg/kg. Mors vektøkning ble svekket ved alle dosenivåer (omtrent 0,25 til 4 ganger 400 mg klinisk dose basert på kroppsoverflate [BSA] sammenligning), og aborter skjedde ved 75 mg/kg (ca. 4 ganger 400 mg klinisk dose basert på BSA); ingen uønskede fostereffekter ble observert.
flere studier der gravide rotter fikk flukonazol oralt under organogenese, ble mors vektøkning svekket og placentavekten økt med 25 mg/kg. Det var ingen fostereffekter ved 5 mg/kg eller 10 mg/kg; økning i føtale anatomiske varianter (supernumerære ribben, utvidelse av nyrebekkenet) og forsinkelser i ossifikasjon ble observert ved 25 mg/kg og 50 mg/kg og høyere doser. Ved doser fra 80 til 320 mg/kg (omtrent 2 til 8 ganger den kliniske dosen på 400 mg basert på BSA), var embryodødelighet hos rotter økt og fosterabnormiteter inkluderte bølgete ribben, ganespalte og unormal kraniofacial ossifikasjon. Disse effektene stemmer overens med hemming av østrogensyntese hos rotter og kan være et resultat av kjente effekter av redusert østrogen på graviditet, organogenese og fødsel.
Ammende mødre
Flukonazol var tilstede i lave nivåer i morsmelk etter administrering av en enkeltdose på 150 mg, basert på data fra en studie med 10 ammende kvinner som midlertidig eller permanent avbrøt ammingen 5 dager til 19 måneder etter fødselen. Den estimerte daglige spedbarnsdosen av flukonazol fra morsmelk (forutsatt gjennomsnittlig melkeforbruk på 150 ml/kg/dag) basert på gjennomsnittlig maksimal melkekonsentrasjon (2,61 mcg/ml [område: 1,57 til 3,65 mcg/ml] 5,2 timer etter dose) var 0,39 mg/kg/dag, som er omtrent 13 % av anbefalt pediatrisk dose for orofaryngeal candidiasis. (Merket pediatrisk dose er 6 mg/kg/dag den første dagen etterfulgt av 3 mg/kg/dag; estimert spedbarnsdose er 13 % av 3 mg/kg/dag vedlikeholdsdose). Det er ingen data om flukonazolnivåer i melk etter gjentatt bruk eller etter høydose flukonazol. En publisert undersøkelse av 96 ammende kvinner som ble behandlet med flukonazol 150 mg annenhver dag (gjennomsnittlig 7,3 kapsler [område 1 til 29 kapsler]) for ammingsassosiert candida i brystene rapporterte ingen alvorlige bivirkninger hos spedbarn. Forsiktighet bør utvises når DIFLUCAN administreres til en ammende kvinne.
Pediatrisk bruk
En åpen, randomisert, kontrollert studie har vist at DIFLUCAN 100 mg er effektiv i behandlingen av orofaryngeal candidiasis hos barn i alderen 6 måneder til 13 år. (Se Kliniske studier .)
Bruken av DIFLUCAN 200 mg hos barn med kryptokokkmeningitt, Candida-øsofagitt eller systemiske Candida-infeksjoner støttes av effekten vist for disse indikasjonene hos voksne og av resultatene fra flere små ikke-komparative pediatriske kliniske studier. I tillegg farmakokinetiske studier hos barn (se KLINISK FARMAKOLOGI ) har etablert en doseproporsjonalitet mellom barn og voksne. (Se DOSERING OG ADMINISTRASJON .)
en ikke-komparativ studie av barn med alvorlige systemiske soppinfeksjoner, hvorav de fleste var candidemia, var effekten av DIFLUCAN lik den som ble rapportert for behandling av candidemia hos voksne. Av 17 personer med kulturbekreftet candidemia, hadde 11 av 14 (79 %) med grunnlinjesymptomer (3 var asymptomatiske) en klinisk kur; 13/15 (87 %) av evaluerbare pasienter hadde en mykologisk kur ved slutten av behandlingen, men to av disse pasientene fikk tilbakefall ved henholdsvis 10 og 18 dager etter avsluttet behandling.
Effekten av DIFLUCAN for undertrykkelse av kryptokokkmeningitt var vellykket hos 4 av 5 barn som ble behandlet i en studie med flukonazol for bruk av flukonazol for behandling av livstruende eller alvorlig mykose. Det er ingen informasjon om effekten av flukonazol for primærbehandling av kryptokokkmeningitt hos barn.
Sikkerhetsprofilen til DIFLUCAN 200 mg hos barn er studert hos 577 barn i alderen 1 dag til 17 år som fikk doser fra 1 til 15 mg/kg/dag i 1 til 1 616 dager. (Se BIVIRKNINGER .)
Effekten av DIFLUCAN er ikke fastslått hos spedbarn under 6 måneder. (Se KLINISK FARMAKOLOGI .) Et lite antall pasienter (29) i alder fra 1 dag til 6 måneder har blitt behandlet trygt med DIFLUCAN.
Geriatrisk bruk
Hos ikke-AIDS-pasienter ble bivirkninger mulig relatert til flukonazolbehandling rapportert hos færre pasienter i alderen 65 år og eldre (9 %, n =339) enn for yngre pasienter (14 %, n=2240). Det var imidlertid ingen konsistent forskjell mellom de eldre og yngre pasientene med hensyn til individuelle bivirkninger. Av de hyppigst rapporterte (>1 %) bivirkningene forekom utslett, oppkast og diaré hos større andeler av eldre pasienter. Lignende andeler av eldre pasienter (2,4 %) og yngre pasienter (1,5 %) avbrøt behandlingen med flukonazol på grunn av bivirkninger. Etter markedsføring var spontane rapporter om anemi og akutt nyresvikt hyppigere blant pasienter 65 år eller eldre enn hos pasienter mellom 12 og 65 år. På grunn av rapportenes frivillige natur og den naturlige økningen i forekomsten av anemi og nyresvikt hos eldre, er det imidlertid ikke mulig å fastslå en årsakssammenheng til legemiddeleksponering.
Kontrollerte kliniske studier med flukonazol inkluderte ikke tilstrekkelig antall pasienter i alderen 65 år og eldre til å vurdere om de responderer annerledes enn yngre pasienter på hver indikasjon. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter.
Flukonazol utskilles primært ved nyreutskillelse som uendret legemiddel. Fordi det er mer sannsynlig at eldre pasienter har nedsatt nyrefunksjon, bør det utvises forsiktighet for å justere dosen basert på kreatininclearance. Det kan være nyttig å overvåke nyrefunksjonen. (Se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRASJON .)
OVERDOSE
Det har vært rapporter om overdosering med flukonazol ledsaget av hallusinasjoner og paranoid oppførsel.
Ved overdosering bør symptomatisk behandling (med støttende tiltak og mageskylling hvis det er klinisk indisert) settes i gang.
Flukonazol skilles i stor grad ut i urinen. En 3-timers hemodialysesesjon reduserer plasmanivåene med omtrent 50 %.
Hos mus og rotter som fikk svært høye doser av flukonazol, inkluderte kliniske effekter hos begge arter redusert motilitet og respirasjon, ptosis, tåreflåd, spyttutskillelse, urininkontinens, tap av opprettingsrefleks og cyanose; døden ble noen ganger innledet av kloniske kramper.
KONTRAINDIKASJONER
DIFLUCAN (flukonazol) er kontraindisert hos pasienter som har vist overfølsomhet overfor flukonazol eller noen av dets hjelpestoffer. Det er ingen informasjon om kryss-hypersensitivitet mellom flukonazol og andre azol-antifungale midler. Forsiktighet bør utvises ved forskrivning av DIFLUCAN til pasienter med overfølsomhet overfor andre azoler. Samtidig administrering av andre legemidler som er kjent for å forlenge QT-intervallet og som metaboliseres via enzymet CYP3A4 som erytromycin, pimozid og kinidin er kontraindisert hos pasienter som får flukonazol. (Se KLINISK FARMAKOLOGI : Legemiddelinteraksjonsstudier og FORHOLDSREGLER .)
KLINISK FARMAKOLOGI
Farmakokinetikk og metabolisme
De farmakokinetiske egenskapene til flukonazol er like etter administrering intravenøst eller oralt. Hos normale frivillige er biotilgjengeligheten av oralt administrert flukonazol over 90 % sammenlignet med intravenøs administrering. Bioekvivalens ble etablert mellom 100 mg tabletten og begge suspensjonsstyrkene når de ble administrert som en enkelt 200 mg dose.
Maksimal plasmakonsentrasjon (Cmax) hos fastende normale frivillige forekommer mellom 1 og 2 timer med en terminal plasmaeliminasjonshalveringstid på ca. 30 timer (område: 20 til 50 timer) etter oral administrering.
Hos fastende, normale frivillige fører administrering av en enkelt oral 400 mg dose DIFLUCAN (flukonazol) til en gjennomsnittlig Cmax på 6,72 mcg/ml (område: 4,12 til 8,08 mcg/ml) og etter orale enkeltdoser på 50 til 400 mg, flukonazol plasmakonsentrasjoner og areal under plasmakonsentrasjon-tid-kurven (AUC) er doseproporsjonale.
Cmax- og AUC-data fra en mateffektstudie som involverte administrering av DIFLUCAN (flukonazol)-tabletter til friske frivillige under fastende forhold og med et fettrikt måltid, indikerte at eksponering for legemidlet ikke påvirkes av mat. Derfor kan DIFLUCAN tas uten hensyn til måltider. (Se DOSERING OG ADMINISTRASJON .)
Steady-state-konsentrasjoner nås innen 5 til 10 dager etter orale doser på 50 til 400 mg gitt én gang daglig. Administrering av en startdose (på dag 1) på to ganger den vanlige daglige dosen resulterer i plasmakonsentrasjoner nær steady-state innen den andre dagen. Det tilsynelatende distribusjonsvolumet av flukonazol tilnærmer seg det for totalt kroppsvann. Plasmaproteinbindingen er lav (11 til 12%). Etter enten enkelt- eller flere orale doser i opptil 14 dager, trenger flukonazol inn i alle kroppsvæsker som er undersøkt (se tabellen nedenfor ). Hos normale frivillige var spyttkonsentrasjoner av flukonazol lik eller litt høyere enn plasmakonsentrasjoner uavhengig av dose, vei eller varighet av dosering. Hos pasienter med bronkiektasi var sputumkonsentrasjonen av flukonazol etter en enkelt 150 mg oral dose lik plasmakonsentrasjonen både 4 og 24 timer etter dose. Hos pasienter med soppmeningitt er flukonazolkonsentrasjonen i cerebrospinalvæsken (CSF) omtrent 80 % av de tilsvarende plasmakonsentrasjonene.
En enkelt oral dose på 150 mg flukonazol administrert til 27 pasienter penetrerte vaginalt vev, noe som resulterte i vev: plasmaforhold fra 0,94 til 1,14 i løpet av de første 48 timene etter dosering.
En enkelt oral dose på 150 mg flukonazol administrert til 14 pasienter penetrerte vaginalvæske, noe som resulterte i væske: plasmaforhold fra 0,36 til 0,71 i løpet av de første 72 timene etter dosering.
Hos normale frivillige elimineres flukonazol primært ved renal utskillelse, med omtrent 80 % av den administrerte dosen som vises i urinen som uendret legemiddel. Omtrent 11 % av dosen skilles ut i urinen som metabolitter.
Farmakokinetikken til flukonazol påvirkes markant av reduksjon i nyrefunksjonen. Det er et omvendt forhold mellom eliminasjonshalveringstiden og kreatininclearance. Dosen av DIFLUCAN må kanskje reduseres hos pasienter med nedsatt nyrefunksjon. (Se DOSERING OG ADMINISTRASJON .) En 3-timers hemodialyseøkt reduserer plasmakonsentrasjonene med omtrent 50 %.
Hos normale frivillige var DIFLUCAN-administrasjon (doser fra 200 mg til 400 mg én gang daglig i opptil 14 dager) assosiert med små og inkonsekvente effekter på testosteronkonsentrasjoner, endogene kortikosteroidkonsentrasjoner og det adrenokortikotropiske hormonet (ACTH)-stimulerte kortisolresponsen.
Farmakokinetikk hos barn
Hos barn er følgende farmakokinetiske data {Mean (%cv)} rapportert:
Clearance korrigert for kroppsvekt ble ikke påvirket av alder i disse studiene. Gjennomsnittlig kroppsclearance hos voksne er rapportert å være 0,23 (17 %) ml/min/kg.
Hos premature nyfødte (gestasjonsalder 26 til 29 uker), var gjennomsnittlig (%cv) clearance innen 36 timer etter fødselen 0,180 (35 %, N=7) ml/min/kg, som økte med tiden til et gjennomsnitt på 0,218 ( 31 %, N=9) mL/min/kg seks dager senere og 0,333 (56 %, N=4) mL/min/kg 12 dager senere. Tilsvarende var halveringstiden 73,6 timer, som sank med tiden til gjennomsnittlig 53,2 timer seks dager senere og 46,6 timer 12 dager senere.
Farmakokinetikk hos eldre
En farmakokinetisk studie ble utført på 22 personer, 65 år eller eldre, som fikk en enkelt 50 mg oral dose flukonazol. Ti av disse pasientene fikk samtidig diuretika. Cmax var 1,54 mcg/ml og inntraff 1,3 timer etter dose. Gjennomsnittlig AUC var 76,4 ± 20,3 mcg•t/ml, og gjennomsnittlig terminal halveringstid var 46,2 timer. Disse farmakokinetiske parameterverdiene er høyere enn analoge verdier rapportert for normale unge mannlige frivillige. Samtidig administrering av diuretika endret ikke signifikant AUC eller Cmax. I tillegg var kreatininclearance (74 ml/min), prosentandelen av medikamentet gjenvunnet uendret i urinen (0 til 24 timer, 22%), og flukonazol-nyreclearance-estimatene (0,124 ml/min/kg) for eldre var generelt lavere enn yngre frivillige. Endringen i flukonazoldisponeringen hos eldre ser derfor ut til å være relatert til redusert nyrefunksjon som er karakteristisk for denne gruppen. Et plott av hver enkelt pasients terminale eliminasjonshalveringstid versus kreatininclearance sammenlignet med den anslåtte halveringstiden – kreatininclearance-kurve avledet fra normale forsøkspersoner og forsøkspersoner med varierende grader av nyresvikt, indikerte at 21 av 22 individer falt innenfor 95 % konfidensgrensen for de predikerte halveringstiden-kreatininclearance-kurvene. Disse resultatene stemmer overens med hypotesen om at høyere verdier for farmakokinetiske parametere observert hos eldre forsøkspersoner sammenlignet med normale unge mannlige frivillige skyldes nedsatt nyrefunksjon som forventes hos eldre.
Legemiddelinteraksjonsstudier
(Se NARKOTIKAHANDEL )
Orale prevensjonsmidler
Orale prevensjonsmidler ble administrert som en enkeltdose både før og etter oral administrering av DIFLUCAN 50 mg én gang daglig i 10 dager hos 10 friske kvinner. Det var ingen signifikant forskjell i etinyløstradiol eller levonorgestrel AUC etter administrering av 50 mg DIFLUCAN. Gjennomsnittlig økning i etinyløstradiol AUC var 6 % (område: –47 til 108 %) og levonorgestrel AUC økte 17 % (område: –33 til 141 %).
en andre studie fikk tjuefem normale kvinner daglige doser av både 200 mg DIFLUCAN 150 mg tabletter eller placebo i to, ti-dagers perioder. Behandlingssyklusene var en måneds mellomrom med alle forsøkspersoner som fikk DIFLUCAN i løpet av en syklus og placebo under den andre. Rekkefølgen på studiebehandlingen var tilfeldig. Enkeltdoser av en p-pille som inneholdt levonorgestrel og etinyløstradiol ble administrert på den siste behandlingsdagen (dag 10) i begge sykluser. Etter administrering av 200 mg DIFLUCAN var gjennomsnittlig prosentvis økning av AUC for levonorgestrel sammenlignet med placebo 25 % (område: – 12 til 82 %) og gjennomsnittlig prosentvis økning for etinyløstradiol sammenlignet med placebo var 38 % (område: –11 til 101 %). Begge disse økningene var statistisk signifikant forskjellige fra placebo.
En tredje studie evaluerte den potensielle interaksjonen av en ukentlig dosering av flukonazol 300 mg til 21 normale kvinner som tok et oralt prevensjonsmiddel som inneholder etinyløstradiol og noretindron. I denne placebokontrollerte, dobbeltblinde, randomiserte, toveis crossover-studien utført over tre sykluser med oral prevensjonsbehandling, resulterte flukonazoldosering i små økninger i gjennomsnittlig AUC for etinyløstradiol og noretindron sammenlignet med tilsvarende placebodosering. Gjennomsnittlig AUC for etinyløstradiol og noretindron økte med henholdsvis 24 % (95 % KI-område: 18 til 31 %) og 13 % (95 % KI-område: 8 til 18 %), i forhold til placebo. Flukonazolbehandling forårsaket ikke en reduksjon i etinyløstradiol AUC for noen individuelle individer i denne studien sammenlignet med placebodosering. De individuelle AUC-verdiene for noretindron sank svært svakt (
Cimetidin
DIFLUCAN 100 mg ble administrert som en enkelt oral dose alene og to timer etter en enkelt dose cimetidin 400 mg til seks friske mannlige frivillige. Etter administrering av cimetidin var det en signifikant reduksjon i flukonazols AUC og Cmax. Det var en gjennomsnittlig ± SD-reduksjon i flukonazol AUC på 13 % ± 11 % (område: –3,4 til –31 %) og Cmax redusert med 19 % ± 14 % (område: –5 til –40) %). Administrering av cimetidin 600 mg til 900 mg intravenøst over en fire-timers periode (fra én time før til 3 timer etter en enkelt oral dose av DIFLUCAN 200 mg) påvirket imidlertid ikke biotilgjengeligheten eller farmakokinetikken til flukonazol hos 24 friske mannlige frivillige. .
Antacida
Administrering av Maalox® (20 ml) til 14 normale mannlige frivillige rett før en enkelt dose DIFLUCAN 100 mg hadde ingen effekt på absorpsjon eller eliminering av flukonazol.
Hydroklortiazid
Samtidig oral administrering av 100 mg DIFLUCAN og 50 mg hydroklortiazid i 10 dager hos 13 normale frivillige resulterte i en signifikant økning i flukonazol AUC og Cmax sammenlignet med DIFLUCAN gitt alene. Det var en gjennomsnittlig ± SD økning i flukonazol AUC og Cmax på henholdsvis 45 % ± 31 % (område: 19 til 114 %) og 43 % ± 31 % (område: 19 til 122 %). Disse endringene tilskrives en gjennomsnittlig ± SD-reduksjon i renal clearance på 30 % ± 12 % (område: -10 til -50%).
Rifampin
Administrering av en enkelt oral 200 mg dose av DIFLUCAN 200 mg etter 15 dager med rifampin administrert som 600 mg daglig hos åtte friske mannlige frivillige, resulterte i en signifikant reduksjon i flukonazol AUC og en signifikant økning i tilsynelatende oral clearance av flukonazol. Det var en gjennomsnittlig ± SD-reduksjon i flukonazol AUC på 23 % ± 9 % (område: -13 til -42%). Tilsynelatende oral clearance av flukonazol økte med 32 % ± 17 % (område: 16 til 72 %). Flukonazols halveringstid gikk ned fra 33,4 ± 4,4 timer til 26,8 ± 3,9 timer. (Se FORHOLDSREGLER .)
Warfarin
Det var en signifikant økning i protrombintidsrespons (areal under protrombintid-tid-kurven) etter en enkeltdose warfarin (15 mg) administrert til 13 normale mannlige frivillige etter oral DIFLUCAN 200 mg administrert daglig i 14 dager sammenlignet med administrering av warfarin alene. Det var en gjennomsnittlig ± SD-økning i protrombintidsresponsen (arealet under protrombintids-tid-kurven) på 7 % ± 4 % (område: – 2 til 13 %). (Se FORHOLDSREGLER .) Gjennomsnittet er basert på data fra 12 forsøkspersoner, da en av 13 forsøkspersoner opplevde en 2 ganger økning i protrombintidsresponsen.
Fenytoin
AUC for fenytoin ble bestemt etter 4 dager med fenytoindosering (200 mg daglig, oralt i 3 dager etterfulgt av 250 mg intravenøst for én dose) både med og uten administrering av flukonazol (oral DIFLUCAN 200 mg daglig i 16 dager) hos 10 normale menn frivillige. Det var en signifikant økning i fenytoin AUC. Gjennomsnittlig ± SD økning i fenytoin AUC var 88 % ± 68 % (område: 16 til 247 %). Den absolutte størrelsen på denne interaksjonen er ukjent på grunn av den iboende ikke-lineære disposisjonen av fenytoin. (Se FORHOLDSREGLER .)
Syklosporin
Cyklosporin AUC og Cmax ble bestemt før og etter administrering av flukonazol 200 mg daglig i 14 dager hos åtte nyretransplanterte pasienter som hadde vært på ciklosporinbehandling i minst 6 måneder og på en stabil ciklosporindose i minst 6 uker. Det var en signifikant økning i ciklosporin AUC, Cmax, Cmin (24-timers konsentrasjon) og en signifikant reduksjon i tilsynelatende oral clearance etter administrering av flukonazol. Gjennomsnittlig ± SD-økning i AUC var 92 % ± 43 % (område: 18 til 147 %). Cmax økte med 60 % ± 48 % (område: – 5 til 133 %). C økte 157 % ± 96 % (område: 33 til 360 %). Den tilsynelatende orale clearance ble redusert med 45 % ± 15 % (område: -15 til -60%). (Se FORHOLDSREGLER .)
Zidovudin
Plasma zidovudinkonsentrasjoner ble bestemt ved to anledninger (før og etter flukonazol 200 mg daglig i 15 dager) hos 13 frivillige med AIDS eller ARC som var på en stabil zidovudindose i minst to uker. Det var en signifikant økning i zidovudin AUC etter administrering av flukonazol. Gjennomsnittlig ± SD-økning i AUC var 20 % ± 32 % (område: – 27 til 104 %). Forholdet mellom metabolitten, GZDV, og modermedikamentet ble signifikant redusert etter administrering av flukonazol, fra 7,6 ± 3,6 til 5,7 ± 2,2.
Teofyllin
Farmakokinetikken til teofyllin ble bestemt fra en enkelt intravenøs dose aminofyllin (6 mg/kg) før og etter oral administrering av flukonazol 200 mg daglig i 14 dager hos 16 normale mannlige frivillige. Det var signifikante økninger i teofyllin AUC, Cmax og halveringstid med en tilsvarende reduksjon i clearance. Gjennomsnittlig ± SD teofyllin AUC økte 21 % ± 16 % (område: – 5 til 48 %). Cmax økte 13 % ± 17 % (område: -13 til 40 %). Teofyllinclearance ble redusert med 16 % ± 11 % (område: – 32 til 5 %). Halveringstiden til teofyllin økte fra 6,6 ± 1,7 timer til 7,9 ± 1,5 timer. (Se FORHOLDSREGLER .)
Kinidin
Selv om det ikke er studert in vitro eller in vivo, kan samtidig administrering av flukonazol og kinidin resultere i hemming av kinidinmetabolismen. Bruk av kinidin har vært assosiert med QT-forlengelse og sjeldne forekomster av torsade de pointes. Samtidig administrering av flukonazol og kinidin er kontraindisert. (Se KONTRAINDIKASJONER og FORHOLDSREGLER .)
Orale hypoglykemiske midler
Effekten av flukonazol på farmakokinetikken til de orale hypoglykemiske sulfonylureamidlene tolbutamid, glipizid og glyburid ble evaluert i tre placebokontrollerte studier med normale frivillige. Alle forsøkspersoner fikk sulfonylurea alene som en enkeltdose og igjen som en enkeltdose etter administrering av DIFLUCAN 100 mg daglig i 7 dager. I disse tre studiene opplevde 22/46 (47,8 %) av DIFLUCAN-behandlede pasienter og 9/22 (40,1 %) av placebo-behandlede pasienter symptomer i samsvar med hypoglykemi. (Se FORHOLDSREGLER .)
Tolbutamid
Hos 13 normale mannlige frivillige var det signifikant økning i tolbutamid (500 mg enkeltdose) AUC og Cmax etter administrering av flukonazol. Det var en gjennomsnittlig ± SD økning i tolbutamid AUC på 26 % ± 9 % (område: 12 til 39 %). Tolbutamid Cmax økte 11 % ± 9 % (område: -6 til 27 %). (Se FORHOLDSREGLER .)
Glipizid
AUC og Cmax for glipizid (2,5 mg enkeltdose) ble signifikant økt etter administrering av flukonazol hos 13 normale mannlige frivillige. Det var en gjennomsnittlig ± SD økning i AUC på 49 % ± 13 % (område: 27 til 73 %) og en økning i Cmax på 19 % ± 23 % (område: – 11 til 79 %). (Se FORHOLDSREGLER .)
Glyburide
AUC og Cmax for glyburid (5 mg enkeltdose) var signifikant økt etter administrering av flukonazol hos 20 normale mannlige frivillige. Det var en gjennomsnittlig ± SD økning i AUC på 44 % ± 29 % (område: –13 til 115 %) og Cmax økte 19 % ± 19 % (område: –23 til 62%). Fem forsøkspersoner trengte oral glukose etter inntak av glyburid etter 7 dager med flukonazoladministrasjon. (Se FORHOLDSREGLER .)
Rifabutin
Det er publisert rapporter om at det eksisterer en interaksjon når flukonazol administreres samtidig med rifabutin, noe som fører til økte serumnivåer av rifabutin. (Se FORHOLDSREGLER .)
Takrolimus
Det er publisert rapporter om at det eksisterer en interaksjon når flukonazol administreres samtidig med takrolimus, noe som fører til økte serumnivåer av takrolimus. (Se FORHOLDSREGLER .)
Midazolam
Effekten av flukonazol på farmakokinetikken og farmakodynamikken til midazolam ble undersøkt i en randomisert, cross-over-studie med 12 frivillige. I studien inntok forsøkspersoner placebo eller 400 mg flukonazol på dag 1 etterfulgt av 200 mg daglig fra dag 2 til dag 6. I tillegg ble en dose på 7,5 mg midazolam oralt inntatt den første dagen, 0,05 mg/kg ble administrert intravenøst. på den fjerde dagen, og 7,5 mg oralt på den sjette dagen. Flukonazol reduserte clearance av IV midazolam med 51 %. På den første doseringsdagen økte flukonazol midazolam AUC og C med henholdsvis 259 % og 150 %. På den sjette doseringsdagen økte flukonazol midazolams AUC og C med henholdsvis 259 % og 74 %. De psykomotoriske effektene av midazolam var signifikant økt etter oral administrering av midazolam, men ble ikke signifikant påvirket etter intravenøs midazolam.
En andre randomisert, dobbel-dummy, placebokontrollert, cross-over-studie i tre faser ble utført for å bestemme effekten av administreringsveien for flukonazol på interaksjonen mellom flukonazol og midazolam. I hver fase ble forsøkspersonene gitt oral flukonazol 400 mg og intravenøs saltvann; oral placebo og intravenøs flukonazol 400 mg; og oral placebo og IV saltvann. En oral dose på 7,5 mg midazolam ble inntatt etter flukonazol/placebo. AUC og Cmax for midazolam var signifikant høyere etter oral enn IV administrering av flukonazol. Oralt flukonazol økte midazolams AUC og Cmax med henholdsvis 272 % og 129 %. IV flukonazol økte midazolam AUC og Cmax med henholdsvis 244 % og 79 %. Både oral og IV flukonazol økte de farmakodynamiske effektene av midazolam. (Se FORHOLDSREGLER .)
Azitromycin
En åpen, randomisert, treveis crossover-studie med 18 friske forsøkspersoner vurderte effekten av en enkelt 800 mg oral dose flukonazol på farmakokinetikken til en enkelt 1200 mg oral dose azitromycin, så vel som effekten av azitromycin på farmakokinetikken. av flukonazol. Det var ingen signifikant farmakokinetisk interaksjon mellom flukonazol og azitromycin.
Vorikonazol
Vorikonazol er et substrat for både CYP2C9 og CYP3A4 isoenzymer. Samtidig administrering av oral voriconazol (400 mg Q12h i 1 dag, deretter 200 mg Q12h i 2,5 dager) og oral flukonazol (400 mg på dag 1, deretter 200 mg Q24h i 4 dager) til 6 friske mannlige forsøkspersoner resulterte i en økning i Cmax og AUCτ for vorikonazol med et gjennomsnitt på henholdsvis 57 % (90 % KI: 20 % til 107 %) og 79 % (90 % KI: 40 % til 128 %). I en oppfølgende klinisk studie med 8 friske mannlige forsøkspersoner, eliminerte eller reduserte ikke redusert dosering og/eller frekvens av vorikonazol og flukonazol denne effekten. Samtidig administrering av vorikonazol og flukonazol i alle doser anbefales ikke. Tett overvåking for bivirkninger relatert til vorikonazol anbefales hvis vorikonazol brukes sekvensielt etter flukonazol, spesielt innen 24 timer etter siste dose flukonazol. (Se FORHOLDSREGLER .)
Tofacitinib
Samtidig administrering av flukonazol (400 mg på dag 1 og 200 mg én gang daglig i 6 dager [dager 2–7]) og tofacitinib (30 mg enkeltdose på dag 5) hos friske forsøkspersoner resulterte i økte gjennomsnittlige AUC- og Cmax-verdier for tofacitinib på ca. 79 % (90 % KI: 64 % til 96 %) og 27 % (90 % KI: 12 % til 44 %), sammenlignet med administrering av tofacitinib alene. (Se FORHOLDSREGLER .)
Mikrobiologi
Virkningsmekanismen
Flukonazol er en svært selektiv hemmer av soppcytokrom P450-avhengig enzym lanosterol 14-α-demetylase. Dette enzymet fungerer for å omdanne lanosterol til ergosterol. Det påfølgende tapet av normale steroler korrelerer med akkumulering av 14-α-metylsteroler i sopp og kan være ansvarlig for den fungistatiske aktiviteten til flukonazol. Demetylering av pattedyrceller er mye mindre følsom for flukonazol-hemming.
Motstand
Et potensial for utvikling av resistens mot flukonazol er velkjent. Soppisolater som viser redusert følsomhet for andre azoler kan også vise redusert følsomhet for flukonazol. Hyppigheten av utvikling av medikamentresistens for de ulike soppene som dette legemidlet er indisert for, er ikke kjent.
Flukonazolresistens kan oppstå fra en modifikasjon i kvaliteten eller kvantiteten til målenzymet (lanosterol 14-α-demetylase), redusert tilgang til medikamentmålet eller en kombinasjon av disse mekanismene.
Punktmutasjoner i genet (ERG11) som koder for målenzymet fører til et endret mål med redusert affinitet for azoler. Overekspresjon av ERG11 resulterer i produksjon av høye konsentrasjoner av målenzymet, noe som skaper behov for høyere intracellulære medikamentkonsentrasjoner for å hemme alle enzymmolekylene i cellen.
Den andre hovedmekanismen for medikamentresistens involverer aktiv utstrømning av flukonazol ut av cellen gjennom aktivering av to typer multimedikamentutstrømningstransportører; de viktigste fasilitatorene (kodet av MDR-gener) og de fra den ATP-bindende kassett-superfamilien (kodet av CDR-gener). Oppregulering av MDR-genet fører til flukonazolresistens, mens oppregulering av CDR-gener kan føre til resistens mot flere azoler.
Resistens i Candida glabrata inkluderer vanligvis oppregulering av CDR-gener som resulterer i resistens mot flere azoler. For et isolat der minimum hemmende konsentrasjon (MIC) er kategorisert som mellomprodukt (16 til 32 mcg/ml), anbefales den høyeste flukonazoldosen.
Candida krusei bør anses å være resistent mot flukonazol. Resistens hos C. krusei ser ut til å være mediert av redusert følsomhet av målenzymet for inhibering av midlet.
Det har vært rapporter om tilfeller av superinfeksjon med andre Candida-arter enn C. albicans, som ofte i seg selv ikke er mottakelige for DIFLUCAN (f.eks. Candida krusei). Slike tilfeller kan kreve alternativ antifungal behandling.
Antimikrobiell aktivitet
Flukonazol har vist seg å være aktiv mot de fleste isolater av følgende mikroorganismer både in vitro og ved kliniske infeksjoner.
Candida albicans Candida glabrata (Mange isolater er middels følsomme) Candida parapsilose Candida tropicalis Cryptococcus neoformans
Følgende in vitro-data er tilgjengelige, men deres kliniske betydning er ukjent. Minst 90 % av de følgende soppene viser en in vitro MIC mindre enn eller lik det følsomme bruddpunktet for flukonazol (https://www.fda.gov/STIC) mot isolater av lignende slekt eller organismegruppe. Effektiviteten av flukonazol ved behandling av kliniske infeksjoner på grunn av disse soppene har imidlertid ikke blitt fastslått i tilstrekkelige og godt kontrollerte kliniske studier.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusei bør anses å være resistent mot flukonazol. Resistens hos C. krusei ser ut til å være mediert av redusert følsomhet av målenzymet for inhibering av midlet.
Det har vært rapporter om tilfeller av superinfeksjon med andre Candida-arter enn C. albicans, som ofte i seg selv ikke er mottakelige for DIFLUCAN (f.eks. Candida krusei). Slike tilfeller kan kreve alternativ antifungal behandling.
Resistenstesting
For spesifikk informasjon om tolkningskriterier for mottakelighetstest og tilhørende testmetoder og kvalitetskontrollstandarder anerkjent av FDA for dette legemidlet, se: https://www.fda.gov/STIC.
Kliniske studier
Kryptokok meningitt
I en multisenterstudie som sammenlignet DIFLUCAN (200 mg/dag) med amfotericin B (0,3 mg/kg/dag) for behandling av kryptokokkmeningitt hos pasienter med AIDS, avslørte en multivariat analyse tre forbehandlingsfaktorer som spådde død i løpet av behandlingen: unormalt mental status, cerebrospinalvæske kryptokokkantigentiter større enn 1:1024, og cerebrospinalvæske antall hvite blodlegemer på mindre enn 20 celler/mm³. Dødeligheten blant høyrisikopasienter var henholdsvis 33 % og 40 % for amfotericin B- og DIFLUCAN-pasienter (p=0,58), med totale dødsfall 14 % (9 av 63 forsøkspersoner) og 18 % (24 av 131 forsøkspersoner) for de 2 armene til studien (p=0,48). Optimale doser og regimer for pasienter med akutt kryptokokkmeningitt og med høy risiko for behandlingssvikt gjenstår å fastsette. (Saag, et al. N Engl J Med 1992; 326:83-9.)
Vaginal candidiasis
To tilstrekkelige og godt kontrollerte studier ble utført i USA med 150 mg tabletten. I begge var resultatene av flukonazolregimet sammenlignbare med kontrollregimet (klotrimazol eller mikonazol intravaginalt i 7 dager) både klinisk og statistisk ved en måneds evaluering etter behandling.
Den terapeutiske helbredelsesraten, definert som en fullstendig oppløsning av tegn og symptomer på vaginal candidiasis (klinisk kur), sammen med en negativ KOH-undersøkelse og negativ kultur for Candida (mikrobiologisk utryddelse), var 55 % i både flukonazolgruppen og de vaginale produktene gruppe.
Omtrent tre fjerdedeler av de registrerte pasientene hadde akutt vaginitt (
Vesentlig flere gastrointestinale hendelser ble rapportert i flukonazolgruppen sammenlignet med den vaginale produktgruppen. De fleste hendelsene var milde til moderate. Fordi flukonazol ble gitt som en enkeltdose, skjedde det ingen seponeringer.
Pediatriske studier
Orofaryngeal Candidiasis
En åpen, komparativ studie av effekten og sikkerheten til DIFLUCAN (2 til 3 mg/kg/dag) og oralt nystatin (400 000 IE 4 ganger daglig) hos immunkompromitterte barn med orofaryngeal candidiasis ble utført. Kliniske og mykologiske responsrater var høyere hos barna behandlet med flukonazol.
Klinisk helbredelse ved slutten av behandlingen ble rapportert for 86 % av flukonazolbehandlede pasienter sammenlignet med 46 % av nystatinbehandlede pasienter. Mykologisk hadde 76 % av flukonazolbehandlede pasienter den smittende organismen utryddet sammenlignet med 11 % for nystatinbehandlede pasienter.
Andelen pasienter med klinisk tilbakefall 2 uker etter avsluttet behandling var 14 % for personer som fikk DIFLUCAN og 16 % for personer som fikk nystatin. 4 uker etter avsluttet behandling var prosentandelen av pasienter med klinisk tilbakefall 22 % for DIFLUCAN 150 mg og 23 % for nystatin.
PASIENTINFORMASJON
DIFLUCAN® (fargestoff-FLEW-kan) (flukonazol) Tabletter
Dette pakningsvedlegget inneholder viktig informasjon om DIFLUCAN. Det er ikke ment å erstatte instruksjonene fra helsepersonell. Les denne informasjonen nøye før du tar DIFLUCAN. Spør helsepersonell hvis du ikke forstår noe av denne informasjonen eller hvis du vil vite mer om DIFLUCAN.
Hva er DIFLUCAN 100mg?
DIFLUCAN er et reseptbelagt legemiddel som brukes til å behandle vaginale soppinfeksjoner forårsaket av en gjær kalt Candida. DIFLUCAN 150mg hjelper til med å stoppe for mye gjær i å vokse i skjeden slik at gjærinfeksjonen forsvinner.
DIFLUCAN 150mg er forskjellig fra andre behandlinger for vaginale soppinfeksjoner fordi det er en tablett som tas gjennom munnen. DIFLUCAN brukes også ved andre tilstander. Dette pakningsvedlegget handler imidlertid kun om bruk av DIFLUCAN 50 mg for vaginale soppinfeksjoner. For informasjon om bruk av DIFLUCAN 200mg av andre grunner, spør helsepersonell. Se delen av dette pakningsvedlegget for informasjon om vaginale soppinfeksjoner.
Hva er en vaginal soppinfeksjon?
Det er normalt at en viss mengde gjær finnes i skjeden. Noen ganger begynner for mye gjær å vokse i skjeden, og dette kan forårsake en soppinfeksjon. Vaginale soppinfeksjoner er vanlige. Omtrent tre av fire voksne kvinner vil ha minst én vaginal soppinfeksjon i løpet av livet.
Noen medisiner og medisinske tilstander kan øke sjansen for å få en soppinfeksjon. Hvis du er gravid, har diabetes, bruker p-piller eller tar antibiotika kan du få soppinfeksjoner oftere enn andre kvinner. Personlig hygiene og visse typer klær kan øke sjansene dine for å få en soppinfeksjon. Spør helsepersonell om tips om hva du kan gjøre for å forhindre vaginale soppinfeksjoner. Hvis du får en vaginal soppinfeksjon, kan du ha noen av følgende symptomer:
- . kløe . en brennende følelse når du tisser . rødhet . sårhet . en tykk hvit utflod fra skjeden som ser ut som cottage cheese
Ikke ta DIFLUCAN hvis du.
- . ta følgende medisiner:
- . kinidin . erytromycin . pimozid . er allergisk mot flukonazol, den aktive ingrediensen i DIFLUCAN 50mg, eller noen av ingrediensene i DIFLUCAN. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i DIFLUCAN.
Før du tar DIFLUCAN, fortell helsepersonell om alle dine medisinske tilstander hvis du:
- . har leverproblemer . har nyreproblemer . har hjerteproblemer inkludert hjertearytmier . har hypokalemi (lavt kalium) . er gravid eller planlegger å bli gravid. Fortell legen din med en gang hvis du blir gravid mens du tar DIFLUCAN. Du og helsepersonell vil avgjøre om DIFLUCAN 100mg er riktig for deg. Hvis du kan bli gravid, bør du bruke en prevensjonsmetode mens du tar DIFLUCAN og i 1 uke etter den siste dosen. . ammer eller planlegger å amme. DIFLUCAN kan gå over i morsmelken din. Snakk med helsepersonell om den beste måten å mate babyen din mens du tar DIFLUCAN.
Før du begynner å ta DIFLUCAN, fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Fortell spesielt helsepersonell hvis du tar:
- . diabetesmedisiner som glyburid, tolbutamid, glipizid . blodtrykksmedisiner som hydroklortiazid, losartan, amlodipin, verapamilnifedipin eller felodipin . blodfortynnende midler som warfarin . ciklosporin, takrolimus eller sirolimus (brukes for å forhindre avstøting av organtransplantasjoner) . rifampin eller rifabutin for tuberkulose . fenytoin eller karbamazepin for å kontrollere anfall . teofyllin for å kontrollere astma . kinidin (brukes til å korrigere forstyrrelser i hjerterytmen) . amiodaron (brukes for å behandle ujevne hjerteslag 'arytmier') . amitriptylin eller nortriptylin for depresjon . pimozid for psykiatrisk sykdom . amfotericin B eller voriconazol for soppinfeksjoner . erytromycin for bakterielle infeksjoner . olaparib, cyklofosfamid eller vinca alkaloider som vinkristin eller vinblastin for behandling av kreft . fentanyl, alfentanil eller metadon for kroniske smerter . ibrutinib brukes til å behandle blodkreft . lemborexant, brukt til behandling av søvnløshet . lipidsenkende legemidler som atorvastatin, simvastatin og fluvastatin . ikke-steroide antiinflammatoriske legemidler inkludert celecoxib, ibuprofen og naproxen . prednison, et steroid som brukes til å behandle hud-, gastrointestinale, hematologiske eller respiratoriske lidelser . antivirale medisiner som brukes til å behandle HIV som saquinavir eller zidovudin . tofacitinib for revmatoid artritt . vitamin A kosttilskudd . tolvaptan brukes til å behandle hyponatremi (lave nivåer av natrium i blodet) eller for å bremse nedsatt nyrefunksjon
Siden det er mange merkenavn for disse medisinene, sjekk med helsepersonell eller apotek hvis du har spørsmål.
Hvordan skal jeg ta DIFLUCAN?
- . Ta DIFLUCAN nøyaktig slik helsepersonell forteller deg. . Ta DIFLUCAN 100 mg gjennom munnen med eller uten mat. . Hvis du tar for mye DIFLUCAN 50mg, ring legen din eller gå til nærmeste legevakt med en gang.
Hva bør jeg unngå mens jeg tar DIFLUCAN 150mg?
DIFLUCAN kan forårsake svimmelhet og anfall. Ikke kjør bil eller bruk maskiner før du vet hvordan DIFLUCAN påvirker deg.
Hva er de mulige bivirkningene av DIFLUCAN 150mg?
DIFLUCAN 50mg kan forårsake alvorlige bivirkninger inkludert:
- . alvorlige leverproblemer. Noen personer med alvorlige medisinske problemer har utviklet alvorlige leverproblemer som ble livstruende eller forårsaket død mens de tok DIFLUCAN. Noen ganger kan disse leverproblemene reverseres når du slutter å ta DIFLUCAN. Fortell helsepersonell med en gang hvis du har symptomer på alvorlige leverproblemer, inkludert:
- . mørk farget urin . alvorlig hudkløe . gulfarging av hud og øyne (gulsott) . lyse avføring . tretthet . oppkast . tap av Appetit
- . kortpustethet . feber . hevelse av øyelokkene . hoste . hudutslett, elveblest, blemmer eller hudavskalling . ansikt, munn, nakke eller andre deler av kroppen . hvesing . banking i hjertet eller ørene . frysninger
De vanligste bivirkningene av DIFLUCAN 200mg inkluderer:
- . hodepine . svimmelhet . diaré . magesmerter . kvalme eller urolig mage . endringer i måten maten smaker på
Andre bivirkninger inkluderer:
- . binyrebarksvikt: Noen personer som har tatt DIFLUCAN utviklet binyrebarksvikt som var reversibel. Fortell helsepersonell med en gang hvis du har symptomer på binyrebarksvikt, inkludert:
- . langvarig tretthet . muskel svakhet . tap av Appetit . vekttap . magesmerter . svimmelhet . kvalme . oppkast
Dette er ikke alle mulige bivirkninger av DIFLUCAN.
Ring helsepersonell for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg oppbevare DIFLUCAN?
Oppbevar DIFLUCAN tabletter under 86 °F (30 °C).
Oppbevar DIFLUCAN 50mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av DIFLUCAN.
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i et pasientinformasjonshefte. Ikke bruk DIFLUCAN 50 mg for en tilstand det ikke er foreskrevet for. Ikke gi DIFLUCAN til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem. Du kan spørre helsepersonell om informasjon om DIFLUCAN 200mg som er skrevet for helsepersonell.
Hva er ingrediensene i DIFLUCAN 150mg?
Aktiv ingrediens: flukonazol
Inaktive ingredienser: mikrokrystallinsk cellulose, vannfri dibasisk kalsiumfosfat, povidon, kroskarmellosenatrium, FD&C Red No. 40 aluminiumsfargestoff og magnesiumstearat.
Denne pasientinformasjonen er godkjent av US Food and Drug Administration
